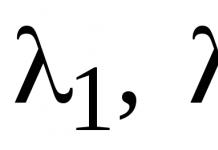4.D, L -Система обозначения стереоизомеров.
В ряде случаев предпочитают пользоваться не R,S -системой обозначения абсолютной конфигурации, а другой, D,L -системой. Выбор D или L обоpyачения изомера основан на определенном расположении регерной группы в проекции Фишера. D , L -Номенклатура широко используется в названиях -амино, -гидроксикислот и углеводов.
По этой системе L -конфигурация приписывается стереозомеру, у которого в проекций Фишера реперная группа находится слева от вертикальной линии (от лат. "laevus" -левый). Соответственно, если реперная группа расположена в проекции Фишера справа, стереоизомер имеет D - конфигурацию (от лат. "dexter" - правый):

Конечно, надо помнить, что в проекции Фишера вверху располагает наиболее окисленный атом углерода (то есть, группу СООН в амино- и гидроксилкслотах и группу СН=О в углеводах).
Амино и гидроксикислоты
В -амино- и -гидроксикислотах реперными группами служат, соответственно, группы NH 2 и ОН:

Если в амино- или гидроксикислоте есть несколько амино- или гидрокси-групп, то указывают их взаимное расположение, пользуясь приставками "эритро", "трео" и.п. Отнесение кислоты к D- или L-ряду при этом определяет NH 2 или ОН-группа, находящаяся в - положении к СООН-группе, расположенной вверху в проекции Фишера:

В этом случае буквы D и L, указывающие положение реперной группы, снабжены индексом "S". Это делается во избежание путаницы. Индекс "S" подчеркивает, что указана конфигурация именно верхнего хирального центра, находящегося относительно карбоксильной группы в - положении, как и в аминокислоте серине ("S" - от слова "serine").

Для гидроксикислот с несколькими ОН-группами, а также аминогидроксикислот используют и альтернативный вариант обозначения конфигурации, в котором реперной группой является самая нижняя в проекции Фишера НО- группа. При этом конфигурационные дескрипторы D и L снабжаются подстрочным индексом "g" (от "glyceric aldehyde"). В этом случае изображенные на рис.123 и 124 аминокислоты получают названия: D g -треонин ( L s - треонин) и L g -треонин ( D s -треонин).
Углеводы .
В углеводах реперной группой является самая нижняя в проекции Фишера гидроксильная группа, связанная с аиммтрическим атомом углерода


Очевидно, что в случае молекул с одним асимметрическим атомом D,L -номенклатура, как и R,S -номенклатура однозначно говорит об абсолютной конфигурации центра хиральности. То же самое относится к применению D,L -наименования стереоизомеров с несколькими асимметрическими атомами, поскольку в этом случае конфигурация остальных центров хиральности задается приставками эритро-, трео-, рибо-, ликсо- и т.п. Так, если мы скажем "треоза", то зададим только относительную конфигурацию асимметрических атомов в молекуле. Тогда будет неясно, о каком именно энантиомере идет речь: (26) или (27), Если же мы скажем "D-треоза", то однозначно укажем, что имеется в виду изомер (26), поскольку в нем реперная группа ОН расположена справа в проекции Фишера:

Таким образом, название "D-треоза" (как и
"L-треоза") говорит об абсолютной
конфигурации обоих асимметрических атомов в
молекуле.
Как и R,S -номенклатура, D,L-система обозначения
стереоизомеров не связана со знаком оптического
вращения.
Следует отметить, что ранее для обозначения
направления вращения плоскости поляризации
света использовались строчные буквы d
(вправо)
и l
(влево). Не следует путать применение
этих букв с использованием прописных букв D
и
L для обозначения конфигурации молекул. В
настоящее время направление вращения плоскости
поляризации света принято обозначать
символами (+) и (-).
5.Хиральные молекулы без асимметрических атомов
В предыдущих разделах были рассмотрены молекулы, хиральность которых обусловлена определенным npocтранственным расположением четырех разных атомов или групп атомов относительно некоторого центра, называемого центром хиральности.
Возможны случаи, когда подобных центров в
молекуле нет, но тем не менее молекула хиральна,
поскольку в ней отсутствуют элементы симметрии
группы S n . В таких случаях энантиомеры
различаются расположением атомов
относительно
некоторой оси или плоскости, которые называют
осью хиральности или плоскостью хиральностию.
Ось хиральности встречается, например, в
молекулах кумуленов.
Строение молекулы простейшего кумулена - аллена -
такого, что два его фрагмента СН 2
находятся в двух взаимно перлендикулярных
плоскостях:

Молекула аллена ахиральна: в ней есть две плоскости симметрии (показаны на рисунке). Ахиральны также молекулы бутадиена-1,2 и 3-метил-бутадиена-1,2

Если же мы рассмотрим молекулу пентадиена-2,3, то увидим, что в ней нет плоскостей симметрии (как нет и других элементов симметрии группы Sn). Этот диен существует в виде пары энантиомеров:

Хиральность молекул (28) и (29) обусловлена определенным простарственным расположением заместителей относительно оси (показана на рисунке), проходящей через атомы углерода, связанные двойными связями. Эту ось называют осью хиральности . О молекулах, подобных (28) и (29) говорят, что они обладают осевой хиральностью.
Оси хиральности имеются и в молекулах некоторых других соединений, например, спиросоединениях (спиранах):

Упомянутые антропоизомеры орто-дизамещенных бифенилов также представляют собой молекулы с осевой хиральностью.Примерами молекул с плоскостью хиральности могут служить молекулы пара-циклофанов:

Изображенные здесь энантиомеры не могут превратиться друг в друга за счет поворота вокруг -связей в силу пространственых требованй входящих в состав этих молекул фрагментов.
Для обозначения конфигурации молекул с осевой и плоскостной хиральностью можно использовать R,S-номенклатуру. Интересующиеся могут найти описание принципов отнесения конфигурации к R или S для таких молекул в издании ВИНИТИ: Hoмeнклатурные правила ИЮПАК по химии, т.3, полутом2, М., 1983.
6.К правилу последовательности в R,S - номенклатуре.
В ряде случаев при определении порядка старшинства заместителей встречаются осложнения.Рассмотрим некоторые из них.
Пример 1.

Очевидно, что в данном случае младшими заместителями при асимметрическом атоме углерода, отмеченном звездочкой, являются Н (d) и СН 3 (с). Рассмотрим два оставшихся сложных заместителя, расположив в них атомы по слоям.

В первом слое обоих заместителей атомы одинаковы. Во втором слое набор атомов также одинаков. (Н,С,О). Поэтому нам необходимо обратиться к третьему слою атомов. При этом в левом и правом заместителях следует в первую очередь сравнивать атомы Ш слоя, связанные со старшими атомами II- слоя (то есть рассматривать "старшие ветви " обоих заместителей). В данном случае речь идет об атома, связанных с атомом кислорода П слоя. Поскольку в правом заместителе с атомом кислорода связан атом С, а в левом - атом Н, правый заместитель получает преимущество в сташинстве:

Соединению следует приписать R-конфигурацию:

Если бы атомы "старшей ветви" в третьем слое оказались одинаковы, например, оба С, то надо было бы сравнивать атомы того же III слоя, но уже в младшей ветви. Тогда подучил бы преимущество левый заместитель. Однако, мы не достигаем этого пункта в наших сравнениях, так как можем сделать выбор уже на основании различия атомов Ш слоя старшей ветви.
Совершенно аналогично выбор порядка старшинства осуществляется, например, между такими заместителями:

Может встретиться ситуация, когда для выбора старшего заместителя необходимо "пройди" через кратную связь. В таком случае прибегают к помощи так называемых фантомных атомов, имеющих нулевой атомный номер (то есть априорно самых младших) и валентность, равную 1.

В этом примере примере надр сделать выбор между левым и правим углеродсодержащими заместителями. Рассмотрим их, предварительно "раскрыв" двойную С=С связь первого заместителя. При этом появятся дублированнве атомы (выделены кружками). К дубликатам атомов присоединим фантомные атосмы (обозначим их буквой ф) так, чтобы довести валентность каждого до 4:

Теперь мы можем провести сравнение левого и правого заместителей:

Различие в третьем слое атомов позволяет отдать предпочтение в старшинстве правому заместителю:

Следовательно, соединение имеет R-конфигурацию.
Пример 3. В ряде случаев два заместителя при асимметрическом атоме структурно одинаковы, но различаются лишь абсолютной конфигурацией хиральных центров. Тогда принимают, что-R-конфигурация старше S-конфигурации . В соответствии с этим, центральному атому углерода в приведенном ниже примере следует приписать S-конфигурацию:

Пример 4 . Изложенные выше принципы применимы также для описания абсолютной конфигурации асимметрических атомов с тремя заместителями (атомы азота, фосфора, серы). При этом в качестве четвертого заместителя используют фантомный атом, который всегда является самым младшим (в роли фантомного атома можно рассматривать неподеленную пapy электронов):

Пример 5. Иногда для выбора старшинства заместителей приходится "раскрывать" цикл, подобно тому, как производят "раскрытие" кратной связи.

В данном случае легко определить самый старший (О) и самый младший (Н) заместители при атоме углерода, отмеченном звездочкой. Для того, чтобы сделать выбор между атомами углерода 1 Си 2 С, следует "раскрыть" цикл по связи 2 С- О согласно следующей схеме (дубликаты атомов выделены кружками):

В этом случае, в отличие от "раскрытия" кратных связей, дублированные атомы уже не представляют собой "тупиковые" ветви, а находят продолжение в повторении атома, отмеченного звездочкой. То есть, процедура "раскрытия" цикла заканчивается тогда, когда на концах обеих ветвей оказывается один и тот же атом (вернее, его дубликат). Теперь мы можем сравнить атомы 1 Си 2 С, рассмотрев соответствующие слои атомов:

Различие в третьем слое позволяет отдать преимущество в старшинстве - атому углерода 2 С. Следовательно, рассматриваемый центр хиралъноети имеет S-конфигурацию:

1.Э.Илиел, Основы стереохимии. М.: Мир, 1971, 107 с,
2.В.М.Потапов, Стереохимия. М.: Химия, 1988, 463 с.
3.В.И.Соколов, Введение в теоретическую стереохимию, М., Наука, 1979, 243 с.
Как обозначить конфигурацию соединения, чтобы по названию можно было изобразить пространственное расположение групп у хирального атома углерода? Для этого используют R,S -систему, предложенную К. Ингольдом, Р. Каном, З. Прелогом. R,S -система основана на определении старшинства заместителей вокруг хирального центра. Старшинство групп определяется следующим образом:
1). Атом с большим атомным номером является старшим относительно атома с меньшим атомным номером.
2). Если непосредственно соединенные с углеродом С* атомы одинаковы, то необходимо рассмотреть старшинство последующих атомов.
Например, как определить старшую из групп: -C 2 Н 5 и СН(СН 3) 2 в соединении

В этильной группе за атомом, соединённым с хиральным центром, следуют Н, Н и С, а в изопропильной группе - Н, С и С. Сравнивая эти группы между собой, устанавливаем, что изопропильная группа старше, чем этильная.

3). Если хиральный углерод С* соединён с атомом, имеющим кратную связь, то связи этого атома следует представить как простые связи.

4). Для того, чтобы установить конфигурацию молекулы, её располагают так, чтобы связь хирального центра с младшей группой под номером 4 была направлена от наблюдателя, и определяют расположение оставшихся групп (рис. 2.6).

Рис. 2.6. Определение R,S -конфигураций
Если старшинство групп убывает (1®2®3) по часовой стрелке, то конфигурация хирального центра определяется как R (от латинского слова “rectus” - правый). Если старшинство заместителей убывает против часовой стрелки, то конфигурация хирального центра - S (от латинского “sinister” - левый).
Знак оптического вращения (+) или (-) определяется экспериментально и не связан с обозначением конфигурации (R ) или (S ). Например, правовращающий 2-бутанол имеет (S )-конфигурацию.
Для того, чтобы определить конфигурацию соединения, изображённого проекционной формулой Фишера поступают следующим образом.

1). Выполняют чётное число перестановок заместителей у хирального центра (нечётное число перестановок приведёт к энантиомеру) так, чтобы младший заместитель под номером 4 оказался вверху или внизу.

2). Определяют расположение оставшихся групп, обходя их в порядке убывания старшинства. Если старшинство заместителей убывает по часовой стрелке, то исходную конфигурацию определяют как R -конфигурацию, если против часовой стрелки, то конфигурацию определяют как S -конфигурацию.
Если преобразовать проекционную формулу непросто, можно установить порядок уменьшения старшинства, отбросив младший заместитель, стоящий сбоку, но выбрать для обозначения конфигурации «обратный» символ. Например, в исходном соединении

отбросив младший заместитель (H), устанавливаем порядок уменьшения старшинства: 1→2→3. Получаем обозначение (S ), меняем его на (R ) и получаем правильное название: (R )-2-хлорэтансульфоновая кислота.
6801 0
s-Элементами называют элементы I и II групп (+ Не , находящийся в группе 0 (VIII) периодической таблицы). Все они, кроме H и Не , металлы. Металлы I группы называют щелочными , так как реагируют с водой с образованием щелочей. Металлы II группы, кроме Be , называют щелочноземельными . Термин «щелочная земля» обозначает оксиды этих металлов. Эти оксиды реагируют с водой с образованием щелочей.
Для s-элементов характерна конфигурация валентных электронов ns 1 (1 группа) или ns 2 (2 группа). Важнейшее химическое свойство металлов 1 группы — способность к образованию положительных однозарядных катионов. Высокие значения окислительно-восстановительных потенциалов металлов I и II групп свидетельствуют об их значительной реакционной способности, поэтому в обычных условиях они встречаются только в виде ионов. Эти ионы, в зависимости от рН, могут находиться в свободном виде или в виде комплексов, чаще всего с водой, углекислотой, ионами галогенов.
С водой щелочные металлы реагируют, выделяя большое количество теплоты (экзотермическая реакция). По мере увеличения атомного номера реакционная способность повышается настолько, что, начиная с К , образующийся в реакции Н 2 возгорается, часто со взрывом. Значительная восстановительная способность щелочных металлов объясняется легкостью отдачи ими электрона.
Таблица 1. Металлы с электронной конфигурацией s
|
1(главная) |
2 (главная) |
|
|
Н |
|
|
|
Li |
Вe |
|
|
Na |
Mg |
|
|
К |
Ca |
|
|
Rb |
Sr |
|
|
Cs |
Ba |
|
|
Fr |
Ra |
|
Во внешней оболочке атомов всех s-металлов содержатся один (у элементов I группы — Li, Na, К, Rb, Cs, Fr ) или два (у элементов II группы — Be, Mg, Са, Sr, Ва, Ra ) электрона, очень легко отделяемых с образованием ионов, которые по конфигурации электронных оболочек аналогичны благородным газам. Изотопы всех щелочных металлов содержат некомпенсированный ядерный спин, то есть парамагнитны. В цельной крови эти изотопы распределяются согласно следующему правилу: чем больше радиус иона, тем выше его содержание в клетках крови (табл. 6).
Таблица 2. Соотношение коэффициента распределения К р и радиуса ионов щелочных металлов
|
Атомный Номер | |||
Поскольку ионы металлов I группы крупные, но не содержат d-электронов, комплексные соединения они образуют слабо, причем их способность к комплексообразованию с увеличением атомного номера уменьшается. Если хелатные комплексы все же образуются, их лиганды чаще всего оказываются кислородсодержащими.
Металлы II группы образуют комплексные соединения легче. Как правило, лигандами в этом случае оказываются сильные комплексообразователи с кислородными и азотными электроннодопорными атомами. Например, хелатный лиганд ЭДТА (рис. 1) часто используют для титриметрического определения концентрации ионов Са 2+ и Mg 2+ при анализе жесткости воды.
Рис. 1. Комплекс этилендиаминтетрауксусной кислоты (ЭДТА, "трилон Б") с Са 2+
Завершая описание s-металлов, отметим особенности свойств Li и Be , объясняемую расположением этих элементов в верхней части I и II групп, соответственно, Периодической системы:
1) высокие по сравнению с другими членами групп энергии ионизации. Это объясняет ковалентный, а не ионный характер образуемых этими элементами соединений;
2) меньшие, чем у других членов групп, радиусы ионов, обусловливающие:
а) высокую плотность заряда, следовательно, повышенную поляризующую способность, что проявляется в увеличенной ковалентности их соединений;
б) повышенные энергии решетки соединений этих элементов, объясняющие их пониженную растворимость;
3) меньшую электроположительность по сравнению с другими членами групп. Однако Li обладает высоким окислительно-восстановительным потенциалом, обусловленным большей энергией гидратации.
Для биохимии и медицины существенно, что свойства Li и его соединений во многом сходны со свойствами Mg и его соединений. Известно, что Mg 2+ играет в обмене веществ в живом организме очень большую роль, активируя АТФ и многие важные ферменты.
Подобное диагональное соотношение между элементами в периодической таблице отмечено также для пары Be и Al с их соединениями, хотя Be (II группа) по электронной конфигурации относится к s-элементам, а Аl (III группа) — к р-элементам. Кроме того, диагональное соотношение описано для пары В — Si и для ионов Na + — Са 2+ — Y 3+ .
Биологическая роль s-элементов очень велика. Ионы Na + , К + , Са 2+ , Mg 2+ , Cl - и НС О 3 - содержатся во всех биологических жидкостях. В частности, Na + и Сl - в большом количестве содержатся в плазме крови и обеспечивают ее осмотическое давление. В нервных клетках резкие изменения концентрации ионов Na + и К + вызывают электрические импульсы, обеспечивающие передачу сигналов в нервной системе.
В плазмалемме нервных клеток действует натриевый насос, обеспечивающий высокую концентрацию ионов К + внутри нервных клеток, и ионов Na + — в межклеточной жидкости. Когда ионы К + диффундируют за пределы клетки, на ее плазмалемме возникает разность потенциалов, обусловленная избытком внутри клетки ионов Сl - , имеющих отрицательный заряд. После стимулирования клетки через плазмалемму начинают проходить ионы Na + , в результате чего знак разности потенциалов изменяется на противоположный. После этого начинает распространяться электрический импульс.
Одним из проявлений гомеостаза считается также то, что хлорид натрия входит в состав потовой жидкости, выделение которой помогает охлаждать организм.
Медицинская бионеорганика. Г.К. Барашков
Термин «абсолютная конфигурация» используют для обозначения известного расположения лигандов относительно элемента хиральности в трехмерном пространстве . После 1951 г. стало возможным определять абсолютную стереохимию хиральной молекулы с помощью метода, основанного на флуоресценции рентгеновских лучей . Абсолютная конфигурация молекулы может быть изображена в плоскости бумаги с помощью хорошо знакомых «клиньев» и «штрихов» или с помощью построенных по определенному принципу проекционных формул, например проекционных формул Фишера.
Однако и в этом случае, как и при описаний строения, возникает необходимость обозначать абсолютную конфигурацию с помощью специальных символов, которые добавлялись бы к названию соединений. В последние годы RS-система стереохимической номенклатуры, предложенная Каном, Ингольдом и Прелогом в 1951 г и модифицированная в 1956 г. и в 1966 г. , во многих областях органической химии постепенно вытесняет старую DL-систему.
RS-Система обозначений.
Система Кана - Ингольда - Прелога для обозначения абсолютной конфигурации заключается в том, что в конфигурационно-хиральной молекуле хиральность каждого элемента хиральности (центра или оси) уточняется в соответствии со «старшинством» лигандов .В наиболее знакомой форме эта система была использована для описания хирального () атома углерода (47), хотя ее с равным успехом можно распространить и на другие атомы , окруженные четырьмя различными лигандами (abed); в качестве лиганда можно рассматривать даже свободную пару электронов! На основании правила старшинства (см. ниже) лиганды а, b, с и d размещают в последовательности . Затем рассматривают хиральный центр со стороны, противоположной лиганду d, обладающему наименьшим старшинством:

Если лиганды а, b и с окажутся расположенными по направлению движения часовой стрелки, то используют символ R, а если они расположены против движения часовой стрелки - символ 5 [обозначения R и S производятся от латинских слов rectus (правый) и sinister (левый)]. Для того чтобы определить старшинство применяют следующее правило. Прежде всего, лиганды располагают в порядке убывания атомных номеров, так что в бромиодхлорметане (63) последовательность имеет вид , и, следовательно, указанному расположению лигандов в пространстве соответствует -конфигурация.

Если атомы, непосредственно связанные с хиральным центром, у нескольких лигандов одинаковы, то их старшинство устанавливается последовательным рассмотрением второго слоя лигандов, окружающих эти одинаковые атомы. Если и после этого старшинство установить не удается, то рассматривается третий слой лигандов, и так до тех пор, пока не обнаружится различие. Эту процедуру можно пояснить на примере установления старшинства для лигандов в соединении (64), где и, следовательно, хиральный центр имеет здесь -конфигурацию.
Следует обратить внимание на то, что как только в одном из сравниваемых лигандов мы доходим до атома с наибольшим атомным номером, в данном случае до иода, он сразу же обеспечивает старшинство этого лиганда по сравнению с другим лигандом, в котором содержатся атомы с меньшими атомными номерами, в данном случае бром и кислород. Многократно связанные атомы (в двойных и тройных связях) формально рассматривают как соответственно два или три атома. Ниже показано, как можно обозначить двойные и тройные связи с помощью дополнительных простых связей и атомов (в скобках):

В -глицериновом альдегиде, , старшинство соответствует последовательности и поэтому ему приписывается -конфигурация:

Наконец, если в состав лиганда входят изотопы, то старшинство присуждается атому с большим массовым числом, например (см. разд. 1.1.5.2). Разумеется, в соединении может быть несколько хиральных центров. В таких случаях символы R и S приводятся вместе с указателем положения хирального центра по номенклатуре IUPAC. Например, энантиомерные обозначаются как и .
Соответствующим образом замещенные аллены (48) обладают конфигурационной хиральностью: элементом хиральности у них является ось, относящаяся к точечной группе (38). Сравнение формул (47) и (48) показывает, что для возникновения хиральности относительно оси требуется меньшее различие между лигандами, чем для образования хирального центра. Хиральный аллен можно рассматривать с любого конца оси хиральности. При установлении старшинства сначала определяют старшинство лигандов, лежащих ближе к наблюдателю. Так, применяя правило старшинства к диметилаллену (66) нетрудно убедиться, что независимо от выбора точки наблюдения ему следует приписать -конфигурацию:

Другие примеры осевой хиральности встречаются среди алкилиденциклоалканов, спиросоединений и систем, подобных адамантану. Кроме того, алленовый фрагмент может входить в состав циклической системы, как, например, в случае (+)- (см. разд. 2.2.1); этот углеводород имеет -конфигурацию.
D,L -система обозначений.
Эта гораздо более старая система обозначений все еще широко используется в химии -аминокислот , циклитолов и углеводов . Она применима для молекул типа RCHXR, которые можнп ориентировать на проекционной формуле Фишера таким образом, чтобы наиболее окисленный углеродсодержащий лиганд оказался сверху. Если при этом заместитель X находится справа, то молекула имеет -конфигурацию, а если слева - -конфигурацию. Так, (+)-глицериновый альдегид ) относится к -ряду, а (-) -глицериновый альдегид - к -ряду. В случае соединений с несколькими хиральными центрами применение D, L-системы может вызвать затруднения. В подобных случаях атомы углерода на проекции Фишера нумеруют сверху вниз и по абсолютной конфигурации хирального атома углерода с наибольшим порядковым номером устанавливают символ абсолютной конфигурации для молекулы в целом. На основании этого принципа (-)-треоза относится к -ряду, а (-арабиноза к -ряду:
Относительные конфигурации при остальных хиральных центрах в L- (67) и D- (68) определяются соответственно приставками трео- и арабиноотносящимися к группам родственных соединений. Пожалуй, целесообразно, чтобы эти «локальные» системы номенклатуры были сохранены , так как переход на RS-систему был бы здесь и сложен, и чреват путаницей. В то же время нет никаких препятствий к тому, чтобы для тех соединений, где это удобно, RS-система применялась наряду с системой DL.
a,b-Система обозначений.
Одна из широко распространенных сегодня систем обозначения абсолютной конфигурации - это - система, используемая в сочетании с тривиальным названием в химии стероидов и родственных им соединений . Если рассматривать кольца стероидной молекулы как проекцию на плоскость бумаги, то формула располагается так, как, например, в случае холестерина (8) (см. с. 21). Заместитель, связанный с кольцом, обозначается символом а, если он расположен ниже плоскости проекции (например, атом Н при ), символом р, если он выше нее (например, метильная группа при ).