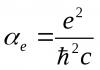Большая советская энциклопедия:
Менделеев Дмитрий Иванович , русский химик, открывший периодический закон химических элементов, разносторонний ученый, педагог и общественный деятель.
М. - сын И.П. Менделеева (1783-1847), директора Тобольской гимназии. Высшее образование М. получил на отделении естественных наук физико-математического факультета Главного педагогического института в Петербурге, курс которого окончил в 1855 с золотой медалью. В 1856 защитил в Петербургском университете магистерскую диссертацию; с 1857 в качестве доцента читал там же курс органической химии. В 1859-61 М. был в научной командировке в Гейдельберге, где подружился со многими находившимися там учеными, в том числе с А.П. Бородиным и И.М. Сеченовым. Работал в своей небольшой домашней лаборатории, а также в лаборатории Р. Бунзена в Гейдельбергском университете. В 1861 опубликовал учебник «Органическая химия», удостоенный Петербургской АН Демидовской премия. В 1864-66 профессор Петербургского технологического института. В 1865 защитил докторскую диссертацию «О соединении спирта с водой» и тогда же был утвержден профессор Петербургского университета. В 1876 избран член-корреспондентом Петербургской АН, но кандидатура М. в академики была в 1880 отвергнута «...противодействием темных сил, которые ревниво закрывают двери Академии пред русскими талантами» (из письма профессоров Московского университета, цитата по книге: Бутлеров А.М., Соч., т.3, 1958, с.128). Забаллотирование М. Петербургской АН вызвало резкий протест общественности в России и за рубежом.
Во время происходивших в 1890 студенческих волнений М. передал министру народного просвещения И.Д. Делянову петицию студенческой сходки с пожеланиями дать автономию университету и отменить полицейские функции инспекции. Делянов вернул М. петицию, в ответ М. тотчас же подал прошение об отставке. В 1890-1895 состоял консультантом Научно-технической лаборатории Морского министерства. В 1890 изобрел новый вид бездымного пороха («пироколлодий») и в 1892 организовал его производство. В 1892 М. назначен ученым хранителем Депо образцовых гирь и весов, преобразованного по его инициативе в Главную палату мер и весов (1893; ныне Всесоюзный научно-исследовательский институт метрологии им. Д.И. Менделеева). Ее управляющим (директором) М. оставался до конца жизни.
Научную деятельность М. чрезвычайно обширна и многогранна. Среди его печатных трудов (более 500) - фундаментальные работы по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, по вопросам экономики, народного просвещения и многим др. «Сам удивляюсь, чего только я не делывал на своей научной жизни. И сделано, думаю, недурно», - писал в 1899 М. (Соч., т.25, 1952, с.714).
В студенческие годы М. получил подготовку по химии у А.А. Воскресенского, по высшей математике - у М.В. Остроградского и по физике - у Э.Х. Ленца. Прекрасное владение методами математики и физики, применение их к разрешению химических проблем существенно отличает М. от большинства выдающихся химиков его времени.
Уже на первых порах научной работы главное внимание М. привлекают соотношения между составом, физическими свойствами и формами химических соединений. В выпускной диссертации «Изоморфизм в связи с другими отношениями кристаллической формы к составу» (1856; Соч., т.1, 1937) он делает попытку классифицировать химические элементы по кристаллическим формам их соединений, а в магистерской диссертации «Удельные объемы» (1856; Соч., т.1, 1937, т.25, 1952) пользуется с той же целью понятием удельного объема (частное от деления атомного или молекулярного веса на плотность простого или сложного вещества).
В те годы под влиянием работ Ш. Жерара происходило становление понятия молекулы, изменение системы атомных весов. М. в работе «Удельные объемы» всецело становится на сторону воззрений Жерара, применяет его систему атомных весов. Там же М. дает вывод зависимости, которая в современных обозначениях выражается уравнением М = 2,016d (М - молекулярный вес газа или пара, d - его плотность по отношению к водороду). Отклонения от этой зависимости (которую М. назвал законом Авогадро - Жерара) он объяснил термической диссоциацией, что позже подтвердилось на опыте.
В 1860 М. и 6 русских химиков (среди них Н.Н. Зинин, А.П. Бородин) участвовали в Международном конгрессе химиков в Карлсруэ. По докладу С. Канниццаро съезд строго разграничил понятия атом, молекула, эквивалент, которые до того времени не различались, что приводило к путанице. М. последовательно проводил новые воззрения в лекциях и печатных работах («Органическая химия», 1861; «Основы химии», ч.1-2, 1869-1871).
Приступив к чтению курса неорганической химии в Петербургском университете, М., не найдя ни одного пособия, которое мог бы рекомендовать студентам, начал писать свой классический труд «Основы химии». По словам М., «тут много самостоятельного..., а главное - периодичность элементов, найденная именно при обработке «Основ химии»» (Соч., т.25, 1952, с.699). Открытие М. периодического закона датируется 17 февраля (1 марта) 1869, когда он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Оно явилось результатом долголетних поисков. Однажды на вопрос, как он открыл периодическую систему, М. ответил: «Я над ней может быть двадцать лет думал, а вы думаете: сидел и вдруг... готово» (Д.И. Менделеев по воспоминаниям О.Э. Озаровской, М., 1929, с.110). М. составил несколько вариантов периодической системы и на ее основе исправил атомные веса некоторых известных элементов, предсказал существование и свойства еще неизвестных элементов. На первых порах сама система, внесенные исправления и прогнозы М. были встречены сдержанно. Но после открытия предсказанных М. элементов (галлий, германий, скандий) периодический закон стал получать признание. Периодическая система М. явилась своего рода путеводной картой при изучении неорганической химии и исследовательской работе в этой области.
Сделанные в конце 19 - начале 20 вв. открытия инертных газов и радиоактивных элементов не поколебали периодического закона, как сначала считалось, а укрепили его. Открытие изотопов устранило некоторые нарушения данной М. последовательности расположения элементов в порядке возрастания атомных весов (Аг - K, Со - Ni, Te - I). Теория строения атома показала, что М. совершенно правильно расположил элементы в порядке возрастания их атомных номеров, и разрешила все сомнения о месте лантаноидов в периодической системе (подробнее см. Периодическая система элементов Д.И. Менделеева и Периодический закон Менделеева). Так сбылось предвидение М.: «...периодическому закону - будущее не грозит разрушением, а только надстройки и развитие обещает...» (Архив Д.И. Менделеева, т.1, 1951, с.34). Периодический закон давно получил всеобщее признание как один из основных законов химии.
Периодический закон явился фундаментом, на котором М. создал свою книгу «Основы химии». По словам А. Ле Шателье, все учебники химии 2-й половины 19 в. построены по одному образцу, «...но заслуживает быть отмеченной лишь единственная попытка действительно отойти от классических традиций - это попытка Менделеева; его руководство по химии задумано но совершенно особому плану» (Le Chatelier Н., Lecons sur ie carbone, la combustion, les lois chimiques, P., 1926, р. Vll). По богатству и смелости научной мысли, оригинальности освещения материала, влиянию на развитие и преподавание химии этот труд М. не имел равного в мировой химической литературе. При жизни М. «Основы химии» издавались в России 8 раз (8 издание, 1906), а также вышли в переводах на английский (1891, 1897, 1905), немецкий (1891) и французский (1895) языки. В СССР они переиздавались 5 раз (в 1927-28, 1931, 1932, 1934, 1947).
Свои взгляды на природу растворов М. изложил в монографии «Исследование водных растворов по удельному весу» (1887), содержащей огромный экспериментальный материал. По воззрениям М., растворы - это находящиеся в состоянии диссоциации жидкие системы, образованные молекулами растворителя, растворенного вещества и продуктов их взаимодействия - нестойких определенных химических соединений. На диаграммах зависимости между составом и производной от плотности по составу (т.е. пределом отношения приращения плотности к приращению состава) М. обнаружил изломы, которые он считал отвечающими образованию химических соединений. Значительно позже (начиная с 1912) Н.С. Курнаков, исходя из идей М., создал учение о сингулярных точках химических диаграмм (см. также Физико-химический анализ). В своих взглядах на растворы М. предвосхитил теории гидратации (и вообще сольватации) ионов. Представления М. о химическом взаимодействии между компонентами растворов имели большое значение для разработки современного учения о растворах.
Из исследований М. по физике особенно важны указание на существование «температуры абсолютного кипения» жидкостей (1860-61), позднее названной критической температурой; вывод уравнения состояния для одного моля идеального газа (1874; см. Клапейрона уравнение); изучение отклонений реальных газов от закона Бойля - Мариотта при малых давлениях, для чего он разработал специальную аппаратуру. В 1887 М. совершил (без пилота) подъем на воздушном шаре для наблюдения солнечного затмения и изучения верхних слоев атмосферы.
М. - автор ряда работ по метрологии. Им создана точная теория весов, разработаны наилучшие конструкции коромысла и арретира, предложены точнейшие приемы взвешивания. При участии и под руководством М. в Главной палате мер и весов были возобновлены прототипы фунта и аршина, произведено сравнение русских эталонов мер с английскими и метрическими (1893-98). М. считал необходимым введение в России метрической системы мер. По настоянию М. в 1899 она была допущена факультативно и только в 1918 стала обязательной.
В научной деятельности М. был стихийным материалистом, признавал объективность и познаваемость законов природы, возможность использования их в интересах человека. М. писал: «...границ научному познанию и предсказанию предвидеть невозможно» (Соч., т.24, 1954, с.458, прим.). Он отмечал также: «...без самобытного движения немыслима ни одна малейшая доля вещества...» («Основы химии», т.1, 1947, с.473).
Важнейшей чертой деятельности М. была неразрывная связь научных исследований с потребностями экономического развития страны. Особое внимание М. уделял нефтяной, угольной, металлургической и химической промышленности. С 1860-х гг. он не раз приезжал для консультаций на Бакинские нефтепромыслы; был инициатором устройства нефтепроводов и разностороннего использования нефти как химического сырья. М. предложил принцип непрерывной дробной перегонки нефти, высказал (1877) гипотезу ее образования в результате взаимодействия карбидов железа с глубинными водами при высоких температурах. В отчете о командировке в Донецкую область (1888) он указал мероприятия для быстрейшего освоения природных богатств Донбасса (каменного угля, железных руд, каменной соли и др.), предсказал краю великую промышленную будущность, впервые высказал идею подземной газификации углей. Расширение разработки угольных месторождений России М. связывал с развитием производства чугуна, стали и меди; отмечал необходимость добычи хромовых и марганцевых руд на Урале и Кавказе. М. считал первоочередными задачами увеличение производства соды, серной кислоты, искусственных минеральных удобрений на базе отечественного сырья; на много лет вперед он наметил программу освоения огромных природных богатств страны.
В работах по вопросам сельского хозяйства М. возражал против распространенной тогда «теории убывающего плодородия почвы» и считал возможным многократное повышение плодородия земли удобрениями. Основываясь на результатах полевых опытов (1867-69), М. указывал на необходимость известкования кислых почв, применения размолотых фосфоритов, суперфосфата, азотных и калийных удобрений, совместного внесения минеральных и органических удобрений. Он поддерживал начинания В.В. Докучаева (проведение почвенных обследований, организацию кафедр почвоведения и др.).
М. уделял большое внимание орошению земель Нижнего Поволжья, улучшению судоходства на реках России, постройке новых железных дорог, освоению Северного морского пути и др. крупным проблемам. Интересуясь развитием промышленности и научными исследованиями, он ездил не только по стране, но и в Западную Европу и США, знакомясь с заводами и промышленными выставками.
Передовой общественный деятель, М. ратовал за промышленное развитие и экономическую независимость России. Это отразилось и в его работе в Совете торговли и мануфактур, где он занимался разработкой нового таможенного тарифа (1889-92). Процветание страны М. связывал не только с широким и рациональным использованием ее природных богатств, но и с развитием творческих сил народа, с распространением просвещения и науки. Направление русского народного образования, по М., должно быть жизненным и реальным (а не т.н. классическим), доступным для всех сословий. Особое значение М. придавал подготовке учителей и профессоров; сам был талантливым лектором и воспитателем научной смены. Учениками или последователями М. были А.А. Байков, В.И. Вернадский, Т.Т. Густавсон, В.А. Кистяковский, В.Л. Комаров, Д.П. Коновалов, Н.С. Курнаков, А.Л. Потылицын, К.А. Тимирязев, В.Е. Тищенко, И.Ф. Шредер и др. Все рус. химики конца 19 - начала 20 вв. учились по его «Основам химии».
М. вместе с А.А. Воскресенским, Н.Н. Зининым и Н.А. Меншуткиным был инициатором основания Русского химического общества (1868; в 1878 объединено с Русским физическим обществом в Русское физико-химическое общество; его отделение химии преобразовано в 1932 во Всесоюзное химическое общество им. Д.И. Менделеева; см. Химическое общество им. Д.И. Менделеева).
М. еще при жизни был известен во многих странах, получил свыше 130 дипломов и почетных званий от русских и зарубежных академий, ученых обществ и учебных заведений (см. «Материалы по истории отечественной химии», М.-Л., 1950, с. 116-21).
В СССР учреждены менделеевские премии за выдающиеся работы по физике и химии, присуждаемые Академией наук. Имя М. (кроме упомянутых выше Всесоюзного химического общества и Всесоюзного института метрологии) носят Московский химико-технологический институт и Тобольский государственный педагогический институт. В честь М. названы: подводный хребет в Северном Ледовитом океане, действующий вулкан на о. Кунашир (Курильские острова), кратер на Луне, минерал менделеевит, научно-исследовательское судно АН СССР для океанографических исследований и др. В СССР укрепилась традиция проведения Менделеевских съездов по общей и прикладной химии (с 1907 по 1969 состоялось 10 съездов). В Ленинграде проводятся (с 1939) ежегодные Менделеевские чтения. В здании ЛГУ (в бывшей квартире М.) находится основанный в 1911 Музей и научный архив Д.И. Менделеева.
Американские ученые (Г. Сиборг и др.), синтезировавшие в 1955 элемент 101, дали ему название менделевий (Md) «...в знак признания приоритета великого русского химика Дмитрия Менделеева, который первым использовал периодическую систему элементов для предсказания химических свойств тогда еще не открытых элементов. Этот принцип явился ключом при открытии почти всех трансурановых элементов» (Сиборг Г., Искусственные трансурановые элементы, М., 1965, с. 49). В 1964 имя М. занесено на Доску почета науки Бриджпортского университета (штат Коннектикут, США) в числе имен величайших ученых мира.
Основы химии Д. Менделеева, профессора Императорского Спб. Университета. Ч.1-2. Спб., типография тов-ва «Общественная Польза», 1869-71.
Часть первая: 4[н.н.], III, 1[н.н.], 816 стр., 151 политипаж. Спб., 1869. Господин Никитин стенографически записал со слов автора почти всю первую часть сочинения. Большинство рисунков резал господин Удгоф. Корректуру держали г-да Дитлов, Богданович и Пестреченко. В первой части приведена так называемая малая таблица «Опыта системы элементов, основанной на их атомном весе и химическом сходстве» с 66 элементами!
Часть вторая: 4[н.н.], 1[н.н.], 951 с., 1[н.н.], 28 политипажей. Спб., 1871. Г-да Вериго, Маркузе, Кикин и Леонтьев стенографировали вторую часть сочинения. Рисунки резал г. Угдоф. Корректуру почти всего тома держал г. Демин. Во второй части приведены раскладная Естественная система элементов Д. Менделеева и Указатель элементов. Правда, количество элементов возросло до 96, 36 из которых вакантны (их будут находить и получать потом). В черных п/к переплетах того времени с тиснением золотом на корешках. Внизу тиснено владельческие А.Ш. Состояние хорошее. Формат: 18х12 см. На второй половинке первого форзаца автограф Д.И. Менделеева: «Уважаемому другу…автор».

 Все знают о существовании Периодической системы и Периодического закона химических элементов, автором которых является великий русский ученый-химик Д.И. Менделеев. В 1867 году Менделеев занял кафедру неорганической(общей) химии Императорского Спб. университета в должности ординарного профессора.В 1868 году Менделеев приступил к работе над «Основами химии». Работая над этим курсом, он открыл периодический закон химических элементов. По преданию, 17 февраля 1869 года он после долгого чтения неожиданно заснул на своём диване в кабинете и ему приснилась переодическая система элементов... Первый вариант таблицы химических элементов, выражавшей периодический закон, Дмитрий Иванович опубликовал в виде отдельного листка под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» и разослал этот листок в марте 1869 многим русским и иностранным химикам. Сообщение об открытом Менделеевым соотношении между свойствами элементов и их атомными весами было сделано 6(18) марта 1869 года на заседании Русского химического общества (Н.А. Меншуткиным от имени Менделеева) и опубликовано в «Журнале Русского химического общества» («Соотношение свойств с атомным весом элементов»), 1869. Летом 1871 года Дмитрий Иванович подытожил свои исследования, связанные с установлением периодического закона, в труде «Периодическая законность для химических элементов». В 1869 году ни один человек в мире не думал о классификации химических элементов больше, чем Менделеев, и, пожалуй, ни один химик не знал о химических элементах больше, чем он. Он знал, что сходство кристаллических форм, проявляющееся при изоморфизме, не всегда достаточное основание для суждения о сходстве элементов. Он знал, что и удельные объемы тоже не дают ясного руководящего принципа для классификации. Он знал, что вообще изучение сцеплений, теплоемкостей, плотностей, показателей преломления, спектральных явлений еще не достигло уровня, который позволил бы положить эти свойства в основу научной классификации элементов. Но он знал и другое - то, что такая классификация, такая система обязательно должна существовать. Ее угадывали, ее пытались расшифровать многие ученые, и Дмитрий Иванович, пристально следивший за работами в интересующей его области, не мог не знать об этих попытках. То, что некоторые элементы проявляют черты совершенно явного сходства, ни для одного химика тех лет не было секретом. Сходство между литием, натрием и калием, между хлором, бромом и йодом или между кальцием, стронцием и барием бросалось в глаза любому. И от внимания Дюма не ускользнули интересные соотношения атомных весов таких сходственных элементов. Так, атомный вес натрия равен полусумме весов соседствующих с ним лития и калия. То же самое можно сказать о стронции и его соседях кальции и барии. Больше того, Дюма обнаружил такие странные цифровые аналогии у сходственных элементов, которые воскрешали в памяти попытки пифагорейцев найти сущность мира в числах и их комбинациях. В самом деле, атомный вес лития равен 7, натрия - 7 + (1 х16) = 23, калия - 7 + (2 х 16) = 39! В 1853 году английский химик Дж. Гладстон обратил внимание на то, что элементы с близкими атомными весами сходны по химическим свойствам: таковы платина, родий, иридий, осмий, палладий и рутений или железо, кобальт, никель. Спустя четыре года швед Ленсеп объедииил по химическому сходству несколько «триад»: рутений - родий - палладий; осмий - платина - иридий; марганец - железо - кобальт. Немец М. Петтенкофер отметил особое значение чисел 8 и 18, так как разности между атомными весами сходственных элементов оказывались нередко близкими 8 и 18 либо кратными им. Были сделаны даже попытки составить таблицы элементов. В библиотеке Менделеева сохранилась книга германского, химика Л. Гмелина, в которой в 1843 году была опубликована такая таблица. В 1857 году английский химик В. Одлинг предложил свой вариант. Но... «Все замеченные отношения в атомных весах аналогов, - писал Дмитрий Иванович, - не привели, однако, по сих пор ни к одному логическому следствию, не получили даже и права гражданства в науке по причине многих недостатков. Во-первых, не явилось сколько то мне известно, ни одного обобщения, связывающего все известные естественные группы в одно целое, и оттого выводы, сделанные для некоторых групп, страдали отрывочностью и не вели к каким-либо дальнейшим логическим заключениям, представлялись необходимым и неожиданным явлением... Во-вторых, замечены были такие факты... где сходные элементы имели близкие атомные веса. В итоге, поэтому можно было только сказать, что сходство элементов связано иногда с близостью атомных весов, а иногда с правильным возрастанием их величины. В-третьих, между несходными элементами и не искали даже каких-либо точных и простых соотношений в атомных весах...» В библиотеке Менделеева до сих пор хранится книга германского химика А. Штреккера «Теории и эксперименты для определения атомных весов элементов», которую Дмитрий Иванович привез из первой заграничной командировки. И читал он ее внимательно. Об этом свидетельствуют многочисленные пометки на полях, об этом свидетельствует отмеченная Дмитрием Ивановичем фраза: «Вышевыставленные отношения между атомными весами... химически сходственных элементов, конечно, едва ли могут быть приписаны случайности, но ныне мы должны предоставить будущему отыскание закономерности, проглядывающей
между указанными числами». Слова эти были написаны в 1859 году, а ровно десять лет спустя настало время открытия этой закономерности. «Меня неоднократно спрашивали,- вспоминает Менделеев, - на основании чего, исходя из какой мысли, найден был мною и упорно защищаем периодический закон?.. Моя личная мысль во все времена... останавливалась на том, что вещество, силу и дух мы бессильны понимать в их существе или в раздельности, что мы можем их изучать в проявлениях, где они неизбежно сочетаны, и что в них, кроме присущей им вечности, есть свои - постижимые - общие самобытные признаки или свойства, которые и следует изучать на все лады. Посвятив свои силы изучению вещества, я вижу в нем два таких признака или свойства: массу,
занимающую пространство и проявляющуюся... яснее или реальнее всего в весе, и индивидуальность,
выраженную в химических превращениях, а яснее всего в представлении о химических элементах. Когда думаешь о веществе... нельзя, для меня, избежать двух вопросов: сколько и какого дано вещества, чему и соответствуют понятия массы и химических элементов... Поэтому невольно зарождается мысль о том, что между массою и химическими элементами необходимо должна быть связь, а так как масса вещества... выражается окончательно в виде атомов, то надо искать функционального соответствия между индивидуальными свойствами элементов и их атомными весами... Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и коренными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства элементов стоят в периодической зависимости от их атомного веса...» В этом описании все выглядит очень просто, но чтобы хоть отдаленно представить себе всю неимоверную трудность содеянного, надо уяснить, что кроется за несколько расплывчатым понятием «индивидуальность, выраженная в химических превращениях». В самом деле, атомный вес - понятная и легковыразимая в цифрах величина. Но как, в каких цифрах можно выразить способность элемента к химическим реакциям? Сейчас человек, знакомый с химией хотя бы в объеме средней школы, легко ответит на этот вопрос: способность элемента давать те или иные типы химических соединений определяется его валентностью. Но в наши дни сказать это только потому легко, что именно периодическая система способствовала выработке современного представления о валентности. Как мы уже говорили, понятие о валентности (Менделеев называл его атомностью) ввел в химию Франкланд, заметивший, что атом того или иного элемента может связать определенное число атомов других элементов. Скажем, атом хлора может связать один атом водорода, поэтому оба эти элемента одновалентные. Кислород в молекуле воды связывает два атома одновалентного водорода, следовательно, кислород двухвалентен. В аммиаке на атом азота приходится три атома водорода, поэтому в этом соединении азот трехвалентен. Наконец, в молекуле метана одни атом углерода удерживает четыре атома водорода. Четырехвалентность углерода подтверждается еще и тем, что в углекислом газе в полном соответствии с теорией валентности углеродный атом удерживает два двухвалентных атома кислорода. Установление четырехвалентности углерода сыграло такую важную роль в становлении органической химии, разъяснило в этой науке такое множество запутанных вопросов, что германский химик Кекуле (тот самый, который придумал бензольное кольцо) заявлял: валентность элемента так же постоянна, как и его атомный вес. Если бы это убеждение соответствовало действительности, задача, стоящая перед Менделеевым, упростилась бы до крайности: ему нужно было бы просто сопоставить валентность элементов с их атомным весом. Но в том-то и заключалась вся сложность, что Кекуле хватил через край. Перехват этот, необходимый и важный для органической химии, был очевиден всякому химику. Даже углерод и тот в молекуле угарного газа связывал лишь один атом кислорода и был, следовательно, не четырех-, а двухвалентным. Азот же давал целую гамму соединений: М 2 О, N0, М 2 О 3 , МО 2 , N2O5, в которых он пребывал в одно-, двух-, трех-, четырех- и пятивалентном состояниях. Кроме того, было и еще одно странное обстоятельство: хлор, соединяющийся с одним атомом водорода, следует считать одновалентным элементом. Натрий, два атома которого соединяются с одним атомом двухвалентного кислорода, тоже следует считать одновалентным. Выходит, в группу одновалентных, попадают элементы, не только не имеющие между собой ничего общего, но являющиеся прямо-таки химическими антиподами. Чтобы как-то отличать такие одинакововалентные, но малопохожие элементы, химики были вынуждены в каждом случае делать оговорку: одновалентный по водороду или одновалентный по кислороду. Менделеев ясно понижал всю «шаткость учения об атомности элементов», но так же ясно он понимал и то, что атомность (то есть валентность) - ключ к классификации. «Для характеристики элемента, кроме прочих данных, требуются два путем наблюдений опыта и сличений добываемых данных: знание атомного веса и знание атомности». Вот когда пригодился Менделееву опыт работы над «Органической химией», вот когда пригодилась ему идея о ненасыщенных и насыщенных, предельных
органических соединениях. По сути дела, прямая аналогия подсказала ему, что из всех значений валентности, которые может иметь данный элемент, характеристическим, тем, который надо класть в основу классификации, следует считать наивысшую предельную валентность. Что же касается вопроса о том, какой валентностью - по водороду или по кислороду - руководствоваться, то ответ на него Менделеев нашел довольно легко. В то время как с водородом соединяются сравнительно немногие элементы, с кислородом соединяются практически все, поэтому формой именно кислородных соединений - окислов - должно руководствоваться при построении системы. Эти соображения отнюдь не беспочвенные догадки. Недавно в архиве ученого была обнаружена интереснейшая таблица, составленная Дмитрием Ивановичем в 1862 году, вскоре после издания «Органической химии». В этой таблице приведены все известные Менделееву кислородные соединения 25 элементов. И когда спустя семь лет Дмитрий Иванович приступил к завершающему этапу, эта таблица, несомненно, сослужила ему отличную службу. Раскладывая карточки, переставляя их, меняя местами, Дмитрий Иванович пристально всматривается в скупые сокращенные записки и цифры. Вот щелочные металлы - литий, натрий, калий, рубидий, цезий. Как ярко выражена в них «металличность»! Не та «металличность», под которой любой человек понимает характерный блеск, ковкость, высокую прочность и теплопроводность, но «Металличность» химическая. «Металличность», заставляющая эти мягкие легкоплавкие металлы быстро окисляться и даже гореть в воздухе, давая при этом прочные окислы. Соединяясь с водой, эти окислы образуют едкие щелочи, окрашивающие лакмус в синий цвет. Все они одновалентны по кислороду и дают удивительно правильные изменения плотности, температуры плавления и кипения в зависимости от нарастания атомного веса. А вот антиподы щелочных металлов - галогены - фтор, хлор, бром, йод. Дмитрий Иванович может Аннь догадываться, что самый легкий из них - фтор, - по всей видимости, газ. Ибо в 1869 году еще никому не удалось выделить из соединений фтор - типичнейший и самый энергичный из всех неметаллов. За ним следует более тяжелый, хорошо изученный газ хлор, затем темно-бурая жидкость с резким запахом - бром, и кристаллический с металлическим отблеском йод. Галогены тоже одновалентны, но одновалентны по водороду. С кислородом же они дают ряд неустойчивых окислов, из которых предельный имеет формулу R2O7. Это значит: максимальная валентность галогенов по кислороду - 7. Раствор С1 2 О7 в воде дает сильную хлорную кислоту, окрашивающую лакмусовую бумагу в красный цвет. Наметанный глаз Менделеева выделяет еще некоторые группы элементов, не столь, правда, яркие, как щелочные металлы и галогены. Щелочноземельные металлы - кальций, стронций и барий, дающие окислы типа RО; сера, селен, теллур, образующие высший окисел типа RO3; азот и фосфор с выcшим окислом R2О5. Прослеживается, хотя и не явное, химическое сходство между углеродом и кремнием, дающими окислы типа RO2 и между алюминием и бором, высший окисел которых R2Оз. Но дальше все спутывается, различия смазываются, индивидуальности утрачиваются. И хотя существование отдельных групп, отдельных семейств можно было считать установленным фактом, «связь групп была совершенно неясна: тут галоиды, тут щелочные металлы, тут металлы, подобные цинку, - друг в друга они точно так же не превращаются, как одна семья в другую. Другими словами, неизвестно было, как эти семьи между собой связаны». В наши дни легко оказать: смысл периодического закона - установление зависимости между наивысшей валентностью по кислороду и атомным весом элемента. Но тогда, сто с лишним лет назад, из нынешних 104 элементов Менделееву были известны лишь 63; атомные веса десяти из них оказались заниженными в 1,5-2 раза; из 63 элементов лишь 17 соединялись с водородом, а высшие солеобразующие окислы многих элементов разлагались с такой быстротой, что были неизвестны, поэтому высшая валентность по кислороду у них оказывалась заниженной. Но самую большую трудность представляли элементы с промежуточными свойствами. Взять, к примеру, алюминий. По физическим свойствам - это металл, а по химическим - не поймешь что. Соединение его окисла с водой - странное вещество, не то слабая щелочь, не то слабая кислота. Все зависит от того, с чем оно реагирует. С сильной кислотой оно ведет себя как щелочь, а с сильной щелочью - как кислота. Глубокий знаток менделеевских работ по периодическому закону академик Б. Кедров считает, что Дмитрий Иванович в своих изысканиях шел от хорошо известного к неизвестному, от явного к неявному. Сначала он выстроил горизонтальный ряд щелочных металлов, так напоминающий ему гомологические ряды органической химии.
Все знают о существовании Периодической системы и Периодического закона химических элементов, автором которых является великий русский ученый-химик Д.И. Менделеев. В 1867 году Менделеев занял кафедру неорганической(общей) химии Императорского Спб. университета в должности ординарного профессора.В 1868 году Менделеев приступил к работе над «Основами химии». Работая над этим курсом, он открыл периодический закон химических элементов. По преданию, 17 февраля 1869 года он после долгого чтения неожиданно заснул на своём диване в кабинете и ему приснилась переодическая система элементов... Первый вариант таблицы химических элементов, выражавшей периодический закон, Дмитрий Иванович опубликовал в виде отдельного листка под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» и разослал этот листок в марте 1869 многим русским и иностранным химикам. Сообщение об открытом Менделеевым соотношении между свойствами элементов и их атомными весами было сделано 6(18) марта 1869 года на заседании Русского химического общества (Н.А. Меншуткиным от имени Менделеева) и опубликовано в «Журнале Русского химического общества» («Соотношение свойств с атомным весом элементов»), 1869. Летом 1871 года Дмитрий Иванович подытожил свои исследования, связанные с установлением периодического закона, в труде «Периодическая законность для химических элементов». В 1869 году ни один человек в мире не думал о классификации химических элементов больше, чем Менделеев, и, пожалуй, ни один химик не знал о химических элементах больше, чем он. Он знал, что сходство кристаллических форм, проявляющееся при изоморфизме, не всегда достаточное основание для суждения о сходстве элементов. Он знал, что и удельные объемы тоже не дают ясного руководящего принципа для классификации. Он знал, что вообще изучение сцеплений, теплоемкостей, плотностей, показателей преломления, спектральных явлений еще не достигло уровня, который позволил бы положить эти свойства в основу научной классификации элементов. Но он знал и другое - то, что такая классификация, такая система обязательно должна существовать. Ее угадывали, ее пытались расшифровать многие ученые, и Дмитрий Иванович, пристально следивший за работами в интересующей его области, не мог не знать об этих попытках. То, что некоторые элементы проявляют черты совершенно явного сходства, ни для одного химика тех лет не было секретом. Сходство между литием, натрием и калием, между хлором, бромом и йодом или между кальцием, стронцием и барием бросалось в глаза любому. И от внимания Дюма не ускользнули интересные соотношения атомных весов таких сходственных элементов. Так, атомный вес натрия равен полусумме весов соседствующих с ним лития и калия. То же самое можно сказать о стронции и его соседях кальции и барии. Больше того, Дюма обнаружил такие странные цифровые аналогии у сходственных элементов, которые воскрешали в памяти попытки пифагорейцев найти сущность мира в числах и их комбинациях. В самом деле, атомный вес лития равен 7, натрия - 7 + (1 х16) = 23, калия - 7 + (2 х 16) = 39! В 1853 году английский химик Дж. Гладстон обратил внимание на то, что элементы с близкими атомными весами сходны по химическим свойствам: таковы платина, родий, иридий, осмий, палладий и рутений или железо, кобальт, никель. Спустя четыре года швед Ленсеп объедииил по химическому сходству несколько «триад»: рутений - родий - палладий; осмий - платина - иридий; марганец - железо - кобальт. Немец М. Петтенкофер отметил особое значение чисел 8 и 18, так как разности между атомными весами сходственных элементов оказывались нередко близкими 8 и 18 либо кратными им. Были сделаны даже попытки составить таблицы элементов. В библиотеке Менделеева сохранилась книга германского, химика Л. Гмелина, в которой в 1843 году была опубликована такая таблица. В 1857 году английский химик В. Одлинг предложил свой вариант. Но... «Все замеченные отношения в атомных весах аналогов, - писал Дмитрий Иванович, - не привели, однако, по сих пор ни к одному логическому следствию, не получили даже и права гражданства в науке по причине многих недостатков. Во-первых, не явилось сколько то мне известно, ни одного обобщения, связывающего все известные естественные группы в одно целое, и оттого выводы, сделанные для некоторых групп, страдали отрывочностью и не вели к каким-либо дальнейшим логическим заключениям, представлялись необходимым и неожиданным явлением... Во-вторых, замечены были такие факты... где сходные элементы имели близкие атомные веса. В итоге, поэтому можно было только сказать, что сходство элементов связано иногда с близостью атомных весов, а иногда с правильным возрастанием их величины. В-третьих, между несходными элементами и не искали даже каких-либо точных и простых соотношений в атомных весах...» В библиотеке Менделеева до сих пор хранится книга германского химика А. Штреккера «Теории и эксперименты для определения атомных весов элементов», которую Дмитрий Иванович привез из первой заграничной командировки. И читал он ее внимательно. Об этом свидетельствуют многочисленные пометки на полях, об этом свидетельствует отмеченная Дмитрием Ивановичем фраза: «Вышевыставленные отношения между атомными весами... химически сходственных элементов, конечно, едва ли могут быть приписаны случайности, но ныне мы должны предоставить будущему отыскание закономерности, проглядывающей
между указанными числами». Слова эти были написаны в 1859 году, а ровно десять лет спустя настало время открытия этой закономерности. «Меня неоднократно спрашивали,- вспоминает Менделеев, - на основании чего, исходя из какой мысли, найден был мною и упорно защищаем периодический закон?.. Моя личная мысль во все времена... останавливалась на том, что вещество, силу и дух мы бессильны понимать в их существе или в раздельности, что мы можем их изучать в проявлениях, где они неизбежно сочетаны, и что в них, кроме присущей им вечности, есть свои - постижимые - общие самобытные признаки или свойства, которые и следует изучать на все лады. Посвятив свои силы изучению вещества, я вижу в нем два таких признака или свойства: массу,
занимающую пространство и проявляющуюся... яснее или реальнее всего в весе, и индивидуальность,
выраженную в химических превращениях, а яснее всего в представлении о химических элементах. Когда думаешь о веществе... нельзя, для меня, избежать двух вопросов: сколько и какого дано вещества, чему и соответствуют понятия массы и химических элементов... Поэтому невольно зарождается мысль о том, что между массою и химическими элементами необходимо должна быть связь, а так как масса вещества... выражается окончательно в виде атомов, то надо искать функционального соответствия между индивидуальными свойствами элементов и их атомными весами... Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и коренными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства элементов стоят в периодической зависимости от их атомного веса...» В этом описании все выглядит очень просто, но чтобы хоть отдаленно представить себе всю неимоверную трудность содеянного, надо уяснить, что кроется за несколько расплывчатым понятием «индивидуальность, выраженная в химических превращениях». В самом деле, атомный вес - понятная и легковыразимая в цифрах величина. Но как, в каких цифрах можно выразить способность элемента к химическим реакциям? Сейчас человек, знакомый с химией хотя бы в объеме средней школы, легко ответит на этот вопрос: способность элемента давать те или иные типы химических соединений определяется его валентностью. Но в наши дни сказать это только потому легко, что именно периодическая система способствовала выработке современного представления о валентности. Как мы уже говорили, понятие о валентности (Менделеев называл его атомностью) ввел в химию Франкланд, заметивший, что атом того или иного элемента может связать определенное число атомов других элементов. Скажем, атом хлора может связать один атом водорода, поэтому оба эти элемента одновалентные. Кислород в молекуле воды связывает два атома одновалентного водорода, следовательно, кислород двухвалентен. В аммиаке на атом азота приходится три атома водорода, поэтому в этом соединении азот трехвалентен. Наконец, в молекуле метана одни атом углерода удерживает четыре атома водорода. Четырехвалентность углерода подтверждается еще и тем, что в углекислом газе в полном соответствии с теорией валентности углеродный атом удерживает два двухвалентных атома кислорода. Установление четырехвалентности углерода сыграло такую важную роль в становлении органической химии, разъяснило в этой науке такое множество запутанных вопросов, что германский химик Кекуле (тот самый, который придумал бензольное кольцо) заявлял: валентность элемента так же постоянна, как и его атомный вес. Если бы это убеждение соответствовало действительности, задача, стоящая перед Менделеевым, упростилась бы до крайности: ему нужно было бы просто сопоставить валентность элементов с их атомным весом. Но в том-то и заключалась вся сложность, что Кекуле хватил через край. Перехват этот, необходимый и важный для органической химии, был очевиден всякому химику. Даже углерод и тот в молекуле угарного газа связывал лишь один атом кислорода и был, следовательно, не четырех-, а двухвалентным. Азот же давал целую гамму соединений: М 2 О, N0, М 2 О 3 , МО 2 , N2O5, в которых он пребывал в одно-, двух-, трех-, четырех- и пятивалентном состояниях. Кроме того, было и еще одно странное обстоятельство: хлор, соединяющийся с одним атомом водорода, следует считать одновалентным элементом. Натрий, два атома которого соединяются с одним атомом двухвалентного кислорода, тоже следует считать одновалентным. Выходит, в группу одновалентных, попадают элементы, не только не имеющие между собой ничего общего, но являющиеся прямо-таки химическими антиподами. Чтобы как-то отличать такие одинакововалентные, но малопохожие элементы, химики были вынуждены в каждом случае делать оговорку: одновалентный по водороду или одновалентный по кислороду. Менделеев ясно понижал всю «шаткость учения об атомности элементов», но так же ясно он понимал и то, что атомность (то есть валентность) - ключ к классификации. «Для характеристики элемента, кроме прочих данных, требуются два путем наблюдений опыта и сличений добываемых данных: знание атомного веса и знание атомности». Вот когда пригодился Менделееву опыт работы над «Органической химией», вот когда пригодилась ему идея о ненасыщенных и насыщенных, предельных
органических соединениях. По сути дела, прямая аналогия подсказала ему, что из всех значений валентности, которые может иметь данный элемент, характеристическим, тем, который надо класть в основу классификации, следует считать наивысшую предельную валентность. Что же касается вопроса о том, какой валентностью - по водороду или по кислороду - руководствоваться, то ответ на него Менделеев нашел довольно легко. В то время как с водородом соединяются сравнительно немногие элементы, с кислородом соединяются практически все, поэтому формой именно кислородных соединений - окислов - должно руководствоваться при построении системы. Эти соображения отнюдь не беспочвенные догадки. Недавно в архиве ученого была обнаружена интереснейшая таблица, составленная Дмитрием Ивановичем в 1862 году, вскоре после издания «Органической химии». В этой таблице приведены все известные Менделееву кислородные соединения 25 элементов. И когда спустя семь лет Дмитрий Иванович приступил к завершающему этапу, эта таблица, несомненно, сослужила ему отличную службу. Раскладывая карточки, переставляя их, меняя местами, Дмитрий Иванович пристально всматривается в скупые сокращенные записки и цифры. Вот щелочные металлы - литий, натрий, калий, рубидий, цезий. Как ярко выражена в них «металличность»! Не та «металличность», под которой любой человек понимает характерный блеск, ковкость, высокую прочность и теплопроводность, но «Металличность» химическая. «Металличность», заставляющая эти мягкие легкоплавкие металлы быстро окисляться и даже гореть в воздухе, давая при этом прочные окислы. Соединяясь с водой, эти окислы образуют едкие щелочи, окрашивающие лакмус в синий цвет. Все они одновалентны по кислороду и дают удивительно правильные изменения плотности, температуры плавления и кипения в зависимости от нарастания атомного веса. А вот антиподы щелочных металлов - галогены - фтор, хлор, бром, йод. Дмитрий Иванович может Аннь догадываться, что самый легкий из них - фтор, - по всей видимости, газ. Ибо в 1869 году еще никому не удалось выделить из соединений фтор - типичнейший и самый энергичный из всех неметаллов. За ним следует более тяжелый, хорошо изученный газ хлор, затем темно-бурая жидкость с резким запахом - бром, и кристаллический с металлическим отблеском йод. Галогены тоже одновалентны, но одновалентны по водороду. С кислородом же они дают ряд неустойчивых окислов, из которых предельный имеет формулу R2O7. Это значит: максимальная валентность галогенов по кислороду - 7. Раствор С1 2 О7 в воде дает сильную хлорную кислоту, окрашивающую лакмусовую бумагу в красный цвет. Наметанный глаз Менделеева выделяет еще некоторые группы элементов, не столь, правда, яркие, как щелочные металлы и галогены. Щелочноземельные металлы - кальций, стронций и барий, дающие окислы типа RО; сера, селен, теллур, образующие высший окисел типа RO3; азот и фосфор с выcшим окислом R2О5. Прослеживается, хотя и не явное, химическое сходство между углеродом и кремнием, дающими окислы типа RO2 и между алюминием и бором, высший окисел которых R2Оз. Но дальше все спутывается, различия смазываются, индивидуальности утрачиваются. И хотя существование отдельных групп, отдельных семейств можно было считать установленным фактом, «связь групп была совершенно неясна: тут галоиды, тут щелочные металлы, тут металлы, подобные цинку, - друг в друга они точно так же не превращаются, как одна семья в другую. Другими словами, неизвестно было, как эти семьи между собой связаны». В наши дни легко оказать: смысл периодического закона - установление зависимости между наивысшей валентностью по кислороду и атомным весом элемента. Но тогда, сто с лишним лет назад, из нынешних 104 элементов Менделееву были известны лишь 63; атомные веса десяти из них оказались заниженными в 1,5-2 раза; из 63 элементов лишь 17 соединялись с водородом, а высшие солеобразующие окислы многих элементов разлагались с такой быстротой, что были неизвестны, поэтому высшая валентность по кислороду у них оказывалась заниженной. Но самую большую трудность представляли элементы с промежуточными свойствами. Взять, к примеру, алюминий. По физическим свойствам - это металл, а по химическим - не поймешь что. Соединение его окисла с водой - странное вещество, не то слабая щелочь, не то слабая кислота. Все зависит от того, с чем оно реагирует. С сильной кислотой оно ведет себя как щелочь, а с сильной щелочью - как кислота. Глубокий знаток менделеевских работ по периодическому закону академик Б. Кедров считает, что Дмитрий Иванович в своих изысканиях шел от хорошо известного к неизвестному, от явного к неявному. Сначала он выстроил горизонтальный ряд щелочных металлов, так напоминающий ему гомологические ряды органической химии.
Lf = 7; Na = 23; К = 39; Rb = 85,4; Cs=133.
Всматриваясь во второй ярко выраженный ряд - галогены, - он обнаружил удивительную закономерность; каждый галоген легче близкого к нему по атомному весу щелочного металла на 4-6 единиц. Значит, ряд галогенов можно поставить над рядом щелочных металлов:
F Cl Br J
Li Ns К Rb Cs
Р С1 Вг J
Li Na К Rb Cs
Cs Sr Ва
Атомный вес фтора - 19, ближе всего к нему примыкает кислород - 16. Не ясно ли, что над галогенами надо поставить семейство аналогов кислорода - серу, селен, теллур? Еще выше - семейство азота: фосфор, мышьяк, сурьму, висмут. Атомный вес каждого члена этого семейства на 1-2 единицы меньше, чем атомный вес элементов из семейства кислорода. По мере того как укладывается ряд за рядом, Менделеев все более и более, укрепляется в мысли, что он на правильном пути. Валентность по кислороду от 7 у галогенов последовательно уменьшается при перемещении вверх. Для элементов из семейства кислорода она равна 6, азота - 5, углерода - 4. Следовательно, дальше должен идти трехвалентный бор. И точно: атомный вес бора на единицу меньше атомного веса предшествующего ему углерода... В феврале 1869 года Менделеев разослал многим химикам отпечатанный на отдельном листке «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». А 6 марта делопроизводитель Русского химического общества Н. Меншуткин вместо отсутствовавшего Менделеева зачитал на заседании общества сообщение о предложенной Дмитрием Ивановичем классификации. Изучая этот непривычный для современного взгляда вертикальный вариант менделеевской таблицы, нетрудно убедиться в том, что он, если так можно выразиться, разомкнут, что к его жесткому костяку - поставленным рядом щелочным металлам и галогенам - сверху и снизу, примыкают ряды элементов с менее ярко выраженными переходными свойствами. Было в этом первом варианте и несколько неправильно расположенных элементов: так, ртуть попала в группу меди, уран и золото - в группу алюминия, таллий - в группу щелочных металлов, марганец - в одну группу с родием и платиной, а кобальт и никель заняли одно место. Вопросительные знаки, поставленные около символов некоторых элементов, свидетедьствуют о том, что сам Менделеев сомневался в правильности определения атомных весов тория, теллура и золота и считал спорным положение в таблице эрбия, иттрия и индия. Но все эти неточности отнюдь не должны умалить важности самого вывода: именно этот первый, несовершенный еще вариант привел Дмитрия Ивановича к открытию великого закона, побудившего его поставить четыре вопросительных знака там, где должны были стоять символы четырех элементов... Сопоставление элементов, расположенных в вертикальных столбцах, навело Менделеева на мысль, что свойства их изменяются периодически по мере нарастания атомного веса. Это был принципиально новый и неожиданный вывод, так как от предшественников Менделеева, увлекавшихся созерцанием линейного изменения свойств сходственных элементов в группах, ускользала эта периодичность, позволившая связать воедино все казавшиеся разрозненными группы. В «Основах химии», изданных в 1903 году, есть таблица, с помощью которой Дмитрий Иванович сделал периодичность свойств химических элементов необычайно наглядной. В длинный столбец он выписал все известные к тому времени элементы, а справа и слева поместил цифры, показывающие удельные объемы и температуры плавления, и формулы высших окислов и гидратов, причём, чем выше валентность, тем дальше от символа отстоит соответствующая формула. При беглом взгляде на эту таблицу сразу видишь, как периодически нарастают и убывают цифры, отражающие свойства элементов, по мере неуклонного увеличения атомного веса. В 1869 году неожиданные перерывы в этом плавном нарастании и убывании чисел доставили Менделееву немало затруднений. Укладывая один ряд за другим, Дмитрий Иванович обнаружил, что в столбце, идущем вверх от рубидия, вслед за пятивалентным мышьяком идет двухвалентный цинк. Резкий перепад атомного веса - 10 единиц вместо 3-5, и полное отсутствие сходства между. свойствами цинка и углерода, стоящего во главе этой группы, навели Дмитрия Ивановича на мысль: в перекрестии пятого горизонтального ряда и третьего вертикального столбца должен находиться не открытый еще четырехвалентный элемент, напоминающий по свойствам углерод и кремний. А поскольку цинк ничего общего не имел и с идущей далее группой бора и алюминия, Менделеев предположил, что науке еще неизвестен и один трехвалентный элемент - аналог бора. Такие же соображения побудили его предположить существование еще двух элементов с атомными весами 45 и 180. Понадобилась поистине изумительная химическая интуиция Менделеева, чтобы сделать столь смелые предположения, и понадобилась его поистине необъятная химическая эрудиция, чтобы предсказать свойства не открытых еще элементов и исправить многие заблуждения, касающиеся элементов малоизученных. Дмитрий Иванович не случайно назвал свою первую таблицу «опытом», этим он как бы подчеркивал ее незавершенность; но в ближайший же год он придал периодической системе элементов ту совершенную форму, которая, почти не изменившись, сохранилась до наших дней. «Разомкнутость» вертикального варианта, по-видимому, не соответствовала представлениям Менделеева о гармонии. Он чувствовал, что из хаотической кучи деталей ему удалось сложить машину, но он ясно видел, как далека эта машина от совершенства. И он решил переконструировать таблицу, разорвать тот двойной ряд, который был ее костяком, и поместить щелочные металлы и галогены на противоположных концах таблицы. Тогда все остальные элементы окажутся как бы внутри конструкции и будут служить постепенным естественным переходом от одной крайности к другой. И как часто бывает с гениальными творениями, формальная, казалось бы, перестройка вдруг открыла новые, ранее не подозреваемые и не угадываемые связи и сопоставления. К августу 1869 года Дмитрий Иванович составляет четыре новых наброска системы. Работая над ними, он выявил так называемые двойные сходственные отношения между элементами, которые вначале он помещал в различные группы. Так вторая группа - группа щелочноземельных металлов - оказалась состоящей из двух подгрупп: первой - бериллий, магний, кальций, стронций и барий и второй - цинк, кадмий, ртуть. Далее, уяснение периодической зависимости позволило Менделееву исправить атомные веса 11 элементов и изменить местоположение в системе 20 элементов! В итоге этой неистовой работы в 1871 году появилась знаменитая статья «Периодическая законность для химических элементов» и тот классический вариант периодической системы, который ныне украшает химические и физические лаборатории во всем мире. Сам Дмитрий Иванович очень гордился этой статьей. В старости он писал: «Это лучший свод моих взглядов и соображений о периодичности элементов и оригинал, по которому писалось потом так много про эту систему. Это причина главная моей научной известности - потому что многое оправдалось гораздо позднее». И действительно, позднее многое оправдалось, но все это было позднее, а тогда... Сейчас с изумлением узнаешь, что большинство химиков восприняло периодическую систему лишь как удобное учебное пособие для студентов. В цитированном письме Зинину Дмитрий Иванович писал: «Если немцы не знают моих работ... я позабочусь о том, чтобы они знали». Выполняя это обещание, он попросил своего товарища химика Ф. Вредена перевести на немецкий язык его фундаментальную работу по периодическому закону, и, получив 15 ноября 1871 года типографские оттиски, он разослал их многим иностранным химикам. Но, увы, не только компетентного суждения, но вообще никакого ответа не получил на свои письма Дмитрий Иванович. Ни от Ж. Дюма, ни от А. Вюрца, ни от С, Канниццаро, Ж. Мариньяка, В. Одлинга, Г. Роско, X. Бломстранда, А. Байера и других химиков. Дмитрий Иванович не мог понять, в чем дело. Он снова и снова перелистывал свою статью и снова и снова убеждался в том, что она полна захватывающего интереса. Разве не удивительно, что он, не производя никаких экспериментов и измерений и основываясь только на периодическом законе, доказал, что считавшийся ранее трехвалентным бериллий в действительности двухвалентен? Разве не доказана правильность периодического закона тем, что, исходя из Него, Менделеев установил трехвалентность таллия, который раньше считался щелочным металлом? Разве не убедительно то, что Менделеев, исходя из периодического закона, приписал малоисследованному индию валентность, равную трем, что спустя несколько месяцев было подтверждено измерениями теплоемкости индия, сделанными Бунзеном? И тем не менее это ни в чем не убедило «папашу Бунзена». Когда один из молодых учеников попытался привлечь его внимание к менделеевской таблице, он только досадливо отмахнулся: «Да уйдите вы от меня с этими догадками. Такие правильности вы найдете и между числами биржевого листка». А нравящееся самому Дмитрию Ивановичу исправление атомных весов урана и ряда других элементов, продиктованное периодической законностью, вызвало лишь упрек со стороны германского физика Лотара Мейера, которому, по странной иронии судьбы, впоследствии пытались приписать приоритет в создании периодической системы. «Было бы поспешно, - писал он в «Либиховских анналах» о статьях Менделеева, - изменять доныне принятые атомные веса на основании столь непрочного исходного пункта». У Менделеева начинало создаваться впечатление, что эти люди слушают - и не слышат, смотрят - и не видят. Не видят черным по белому написанных слов: «Система элементов имеет значение не только педагогическое, не только облегчает изучение разнообразных фактов, приводя их в порядок и связь, но имеет и чисто научное значение, открывая аналогии и указывая чрез то новые пути для изучения элементов». Не видят, что «по сих пор мы не имели никаких поводов предсказывать свойства неизвестных элементов, даже не могли судить о недостатке или отсутствии тех или других из них... Только слепой случай и особая прозорливость и наблюдательность вели к открытию новых элементов. Теоретического интереса в открытии новых элементов вовсе почти не было, и оттого важнейшая область химии, а именно изучение элементов, до сих пор привлекала к себе только немногих химиков. Закон периодичности открывает в этом последнем отношении новый путь, придавая особый, самостоятельный интерес даже таким элементам, как иттрий и эрбий, которыми до сих пор, должно сознаться, интересовались только весьма немногие». Но больше всего поражало Менделеева равнодушие к тому, о чем сам он на склоне лет с гордостью писал: «Это был риск, но правильный и успешный». Убежденный в истинности периодического закона, он в разосланной многим химикам мира статье не только смело предсказал существование трех еще не открытых элементов, но и описал самым подробнейшим образом их свойства. Увидев, что это изумительное открытие тоже не заинтересовало химиков, Дмитрий Иванович предпринял было попытку сделать все эти открытия сам. Он съездил за границу для закупки минералов, содержащих, как ему казалось, искомые элементы. Он затеял исследование редкоземельных элементов. Он поручил студенту Н. Бауэру изготовить металлический уран и измерить его теплоемкость. Но масса других научных тем и организационных дел нахлынула на него и легко отвлекла от работы, несвойственной складу его души. В начале 1870-х годов Дмитрий Иванович занялся изучением упругости газов и предоставил времени и событиям испытывать и проверять периодическую систему элементов, в истинности которой сам он был совершенно уверен. «Писавши в 1871 году статью о приложении периодического закона к определению свойств еще не открытых элементов, я не думал, что доживу до оправдания этого следствия периодического закона, - вспоминал в одном из последних изданий «Основ химии» Менделеев, - но действительность ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и экасилиций, и не прошло еще 20 лет, как я имел величайшую радость видеть все три открытыми...» И первым из трех был эка-алюминий - галлий. Потом открытия элементов посыпались, как из рога изобилия! В классическом труде «Основы химии», выдержавшем при жизни автора 8 изданий на русском языке и несколько изданий на многих иностранных языках, Менделеев впервые изложил неорганическую химию на основе периодического закона. Поэтому, естественно, первое издание «Основ химии» 1869-71 г.г. является желанным предметом для многих коллекционеров и библиофилов мира, собирающих научно-техническую и приоритетную тематику. Естественно, «Основы химии» вошли в знаменитые PMM, № 407 и DSB, volume IX, p.p. 286-295. Естественно, они присутствуют на аукционах Sotheby’s и Christie’s. Экземпляры с автографом автора крайне редки!
«Наука только тогда благотворна,
когда мы принимаем её не только разумом, но и сердцем»
Д. И. Менделеев
Д. И. Менделеев родился 27 января (8 февраля) 1834 года в Тобольске в семье директора Тобольской гимназии Ивана Павловича Менделеева и его жены Марии Дмитриевны.
Здание Тобольской губернской гимназии
В 1849 г. Дмитрий Менделеев окончил Тобольскую гимназию и в конце лета 1850 года, после вступительных экзаменов, был зачислен на физико-математический факультет Главного педагогического института. В 1855 году с золотой медалью он окончил отделение естественных наук.
В 1857 г. Менделеев блестяще защитил диссертацию на тему: «Удельные объемы» , после чего сразу получил должность приват-доцента на физико-математическом факультете Петербургского университета. После переезда в Петербург он читает лекции по теоретической и органической химии в Петербургском университете и ведет практические занятия со студентами. Ученый проводит также исследования в области физической и органической химии. К этому времени относятся и его первые работы технологического характера.
 В январе 1859 года Дмитрий Иванович получил разрешение на заграничную командировку «для усовершенствования в науках». Он отправился в Германию, в город Гейдельберг с собственной хорошо разработанной оригинальной программой научных исследований связи физических и химических свойств веществ. Особенно ученого занимал в это время вопрос о силах сцепления частиц. Изучал Менделеев это явление путем измерения поверхностного натяжения жидкостей при различных температурах. При этом ему удалось установить, что жидкость переходит в пар при определенной температуре, которую он назвал «абсолютной температурой кипения». Это было первое крупное научное открытие Менделеева. Позже, после исследований других ученых, для этого явления был установлен термин «критическая температура», но приоритет Менделеева в данном случае остается несомненным и общепризнанным и сегодня.
В январе 1859 года Дмитрий Иванович получил разрешение на заграничную командировку «для усовершенствования в науках». Он отправился в Германию, в город Гейдельберг с собственной хорошо разработанной оригинальной программой научных исследований связи физических и химических свойств веществ. Особенно ученого занимал в это время вопрос о силах сцепления частиц. Изучал Менделеев это явление путем измерения поверхностного натяжения жидкостей при различных температурах. При этом ему удалось установить, что жидкость переходит в пар при определенной температуре, которую он назвал «абсолютной температурой кипения». Это было первое крупное научное открытие Менделеева. Позже, после исследований других ученых, для этого явления был установлен термин «критическая температура», но приоритет Менделеева в данном случае остается несомненным и общепризнанным и сегодня.
Вместе с Д. И. Менделеевым в Гейдельберге работала группа молодых русских ученых, среди которых  были будущий великий физиолог И. М. Сеченов, химик и композитор А. П. Бородин.
были будущий великий физиолог И. М. Сеченов, химик и композитор А. П. Бородин.
Вернувшись в Петербург, Менделеев погрузился в активную педагогическую, исследовательскую и литературную работу. По предложению издательства «Общественная польза», он написал учебник по органической химии, ставший первым русским пособием по этой дисциплине.
В ходе работы над учебником Менделеев сформулировал важнейшую теоретическую закономерность в области органической химии - учение о пределе. На основе понятия о рядах соединений разной предельности ученому удалось систематизировать большое число органических соединений различных классов. Учебник был отмечен 1-й премией Академии наук. В 1862 году Дмитрию Менделееву за него присудили Демидовскую премию,
считавшуюся в ученом мире весьма почетной.
Молодые ученые. В середине А. П. Бородин и Д. И. Менделеев
Медаль Демидовской премии
«Органическая химия» - первый отечественный учебник, в котором идеей, объединяющей всю совокупность органических соединений, является теория пределов , оригинально и всесторонне развитая. Первое издание быстро разошлось, и в следующем году учебник был переиздан.
В 1864-1866 годах Менделеев в качестве профессора преподавал в Петербургском технологическом институте, а в 1865 году защитил докторскую диссертацию «О соединении спирта с водой» . В 1867 году он возглавил кафедру общей химии в университете. Готовясь к изложению своего предмета, ему было необходимо создать не курс химии, а настоящую, цельную науку химию с общей теорией и согласованностью всех частей этой науки. Эту задачу он с блеском выполнил в своем капитальном труде учебнике «Основы химии».
Работать над учебником Менделеев начал в 1867 г., а закончил - в 1871 г. Книга выходила отдельными выпусками, первый появился в конце мая - начале июня 1868 г. В процессе работы над 2-й частью «Основ химии», Менделеев постепенно переходил от группировки элементов по валентности к их расположению по сходству свойств и атомному весу.
В середине февраля 1869 года Менделеев, продолжая обдумывать структуру последующих разделов книги, вплотную подошел к проблеме создания рациональной системы химических элементов. Периодический закон и «Основы химии» открыли новую эпоху не только в химии, но и во всём естествознании. Сегодня этот закон имеет значение глубочайшего закона природы. Сам ученый впоследствии вспоминал: «Писать начал, когда стал после Воскресенского читать неорганическую химию в университете и когда, перебрав все книги, не нашел, что следует рекомендовать студентам». Данное 6-е прижизненное 780-страничное издание включает оглавление на 16-ти страницах, авторское предисловие, украшено портретом Лавуазье и 14-ти других великих химиков. Формат 17х25 см, издательский полукожаный переплет с тиснением. Выпущена книга была в С.-Петербургской типографии В. Демакова в 1895 году.
 Свои «Основы Химии», периодический закон, исследование упругости газов, понимание растворов как ассоциации Д. И. Менделеев считал тем богатством, которое составило его имя. По мнению авторитетных исследователей за всю печатную историю человечества менделеевские «Основы Химии» вошли в число 100 великих книг всех времен и народов.
К прижизненным изданиям Д. И. Менделеева интерес не ослабевает и в настоящее время. В 2002 году первое издание труда «Основы Химии» было продано на аукционе «Сотбис» за 47000 долларов. Издание не подлежит вывозу за пределы Российской Федерации.
При жизни Менделеева «Основы химии» издавались в России 8 раз, еще пять изданий вышли в переводах на английском, французском и немецком языках.
Свои «Основы Химии», периодический закон, исследование упругости газов, понимание растворов как ассоциации Д. И. Менделеев считал тем богатством, которое составило его имя. По мнению авторитетных исследователей за всю печатную историю человечества менделеевские «Основы Химии» вошли в число 100 великих книг всех времен и народов.
К прижизненным изданиям Д. И. Менделеева интерес не ослабевает и в настоящее время. В 2002 году первое издание труда «Основы Химии» было продано на аукционе «Сотбис» за 47000 долларов. Издание не подлежит вывозу за пределы Российской Федерации.
При жизни Менделеева «Основы химии» издавались в России 8 раз, еще пять изданий вышли в переводах на английском, французском и немецком языках.
 В историю мировой науки имя Менделеева вошло благодаря открытому им периодическому закону
, когда 17 февраля (1 марта) 1869 года он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»
. Советский минералог и геохимик и академик PAH Aлександр Eвгеньевич Ферсман писал: «Будут появляться и умирать новые теории, блестящие обобщения будут сменять наши устаревшие понятия, величайшие открытия будут сводить на нет прошлые и открывать новые, невиданные по широте горизонты - всё это будет приходить и уходить, но Периодический закон Д. И. Менделеева всегда будет жить, развиваться и совершенствоваться.» Научная деятельность Д. И. Менделеева чрезвычайно обширна и многогранна: среди его печатных трудов (более 500) - фундаментальные работы по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, по вопросам экономики, народного просвещения и др. Зная об обширных познаниях Менделеева во многих областях науки, видные государственные деятели нередко обращались к нему за советом и помощью. В 1892 году министр финансов Витте предложил Дмитрию Ивановичу должность ученого хранителя Палаты мер и весов
, и Менделеев согласился. Несмотря на преклонный возраст, он начал активную и разностороннюю работу в этой новой области. Здесь ученый также сделал несколько открытий. В частности, он разработал точнейшие эталоны веса. Дмитрий Иванович работал до последнего дня. Он скончался утром 20 января 1907 года.
В историю мировой науки имя Менделеева вошло благодаря открытому им периодическому закону
, когда 17 февраля (1 марта) 1869 года он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»
. Советский минералог и геохимик и академик PAH Aлександр Eвгеньевич Ферсман писал: «Будут появляться и умирать новые теории, блестящие обобщения будут сменять наши устаревшие понятия, величайшие открытия будут сводить на нет прошлые и открывать новые, невиданные по широте горизонты - всё это будет приходить и уходить, но Периодический закон Д. И. Менделеева всегда будет жить, развиваться и совершенствоваться.» Научная деятельность Д. И. Менделеева чрезвычайно обширна и многогранна: среди его печатных трудов (более 500) - фундаментальные работы по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, по вопросам экономики, народного просвещения и др. Зная об обширных познаниях Менделеева во многих областях науки, видные государственные деятели нередко обращались к нему за советом и помощью. В 1892 году министр финансов Витте предложил Дмитрию Ивановичу должность ученого хранителя Палаты мер и весов
, и Менделеев согласился. Несмотря на преклонный возраст, он начал активную и разностороннюю работу в этой новой области. Здесь ученый также сделал несколько открытий. В частности, он разработал точнейшие эталоны веса. Дмитрий Иванович работал до последнего дня. Он скончался утром 20 января 1907 года.
После смерти Менделеева его имя было присвоено Русскому химическому обществу
, и ежегодно 27 января, в день рождения ученого, в Петербурге происходит торжественное заседание, на котором представляют авторов лучших работ по химии и награждают их медалью имени Д. И. Менделеева. Эта награда считается одной из самых престижных в мировой химии.
Биография великого русского ученого подтверждает, что Д. И. Менделеев всю свою жизнь был великим тружеником. Его упорная деятельность привела к множеству блестящих научных открытий в области химии, физики и даже таможенного дела. Но всегда следует помнить, что триумфальный периодический закон Менделеева - это результат огромного труда, глубоких раздумий и постоянного поиска. Наша библиотека гордится тем, что в её фондах имеются прижизненные издания Д. И. Менделеева
, хранящие память о Великом учёном.
Менделееву посвящается
В простых и сложных веществах
Все элементы изучались,
Их сочетания в телах
Веками лишь распознавались.
В разнообразиях они
Черты подобий проявляли,
И люди не одной страны
Меж ними сходство все искали.
Никто, однако, не открыл
Того, что обнаружил гений.
Провидец мир весь поразил,
Проникнув в сущность изменений.
Закон периодов нашел
Наш русский химик Менделеев,
Чем, безусловно, превзошел
Он сей науки корифеев.
Своей системой показал
В различье элементов - сходства
И этим миру доказал
Науки Русской превосходство.
С. Щипачев
зав. сектором отдела организации и сохранности фондов Марина Комарова
Многие слышали о Дмитрии Ивановиче Менделееве и об открытом им в 19-м веке (1869г.) “Периодическом законе изменения свойств химических элементов по группам и рядам” (авторское название таблицы — “Периодическая система элементов по группам и рядам”).
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор - на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства. В дальнейшем расчеты химика полностью подтвердились - галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Но не всё так просто и кое-что мы не знаем.
Мало тех, кто знает, что Д. И. Менделеев был одним из первых всемирно известных русских учёных конца 19-го века, кто отстаивал в мировой науке идею эфира как всемирной субстанциональной сущности, кто придавал ей фундаментальное научное и прикладное значение в раскрытии тайн Бытия и для улучшения народнохозяйственной жизни людей.
Бытует мнение что официально преподаваемая в школах и ВУЗах таблица химических элементов Менделеева- фальсификат. Сам Менделеев в работе под названием "Попытка химического понимания мирового эфира" привёл несколько иную таблицу.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание).
Отличия видны: нулевая группа перенесена в 8-ю, а элемент легче водорода, с которой должна начинаться таблица и который условно назван Ньютонием (эфир),- вообще исключён.
Эта же таблица увековечена "КРОВАВЫМ ТИРАНОМ" тов. Сталиным в Санкт-Петербурге, Московский просп. 19. ВНИИМ им. Д. И. Менделеева (Всероссийский научно-исследовательский институт метрологии)
Памятник-таблица Периодическая система химических элементов Д. И. Менделеева выполнен мозаикой под руководством профессора Академии художеств В. А. Фролова (архитектурное оформление Кричевского) . В основу памятника положена таблица из последнего прижизненного 8-го издания (1906 г.) Основ химии Д. И. Менделеева. Элементы, открытые при жизни Д. И. Менделеева обозначены красным цветом. Элементы, открытые с 1907 по 1934 гг. , обозначены синим цветом.
Почему и как случилось, что нам столь нагло и открыто лгут?
Место и роль мирового эфира в истинной таблице Д. И. Менделеева
Многие слышали о Дмитрии Ивановиче Менделееве и об открытом им в 19-м веке (1869 г.) “Периодическом законе изменения свойств химических элементов по группам и рядам” (авторское название таблицы — “Периодическая система элементов по группам и рядам”).
Многие слышали также, что Д.И. Менделеев был организатором и безсменным руководителем (1869—1905 гг.) российского общественного научного объединения под названием “Русское Химическое Общество” (с 1872 года — “Русское Физико-Химическое Общество”), издававшее во всё время своего существования всемирно известный журнал ЖРФХО, вплоть до момента ликвидации Академией Наук СССР в 1930 году — и Общества, и его журнала.
Но мало тех, кто знает, что Д. И. Менделеев был одним из последних всемирно известных русских учёных конца 19-го века, кто отстаивал в мировой науке идею эфира как всемирной субстанциональной сущности, кто придавал ей фундаментальное научное и прикладное значение в раскрытии тайн Бытия и для улучшения народнохозяйственной жизни людей.
Ещё меньше тех, кто знает, что после скоропостижной (!!?) смерти Д. И. Менделеева (27.01.1907), признанного тогда выдающимся учёным всеми научными сообществами во всём мире кроме одной только Петербургской Академии Наук, его главное открытие — “Периодический закон” — было умышленно и повсеместно фальсифицировано мировой академической наукой.
И уж совсем мало тех, кто знает, что всё выше перечисленное связано воедино нитью жертвенного служения лучших представителей и носителей бессмертной Русской Физической Мысли благу народов, общественной пользе, вопреки нараставшей волне безответственности в высших слоях общества того времени.
В сущности, всестороннему развитию последнего тезиса и посвящена настоящая диссертация, ибо в подлинной науке любое пренебрежение существенными факторами всегда приводит к ложным результатам.
Элементы нулевой группы начинают каждый ряд других элементов, располагаясь в левой части Таблицы, “...что составляет строго логическое следствие понимания периодического закона” — Менделеев.
Особо важное и даже исключительное по смыслу периодического закона место принадлежит элементу “х”,— “Ньютонию”, — мировому эфиру. И располагаться этот особый элемент должен в самом начале всей Таблицы, в так называемой “нулевой группе нулевого ряда”. Более того, — являясь системообразующим элементом (точнее — системообразующей сущностью) всех элементов Таблицы Менделеева, мировой эфир — это субстанциональный аргумент всего многообразия элементов Таблицы Менделеева. Сама же Таблица, в этой связи, выступает в роли закрытого функционала этого самого аргумента.
Источники:
""Основы химии" и периодический закон неотделимы один от другого, и правильное понимание периодического закона без "Основ химии" является совершенно невозможным". *
* (А. А. Байков, Труды Юбилейного Менделеевского съезда, т. I, Изд. АН СССР, 1936, стр. 28. )
Открытие Д. И. Менделеевым периодического закона совпало по времени и неразрывно связано с его работой над книгой "Основы химии", изданной (в двух томах) в 1869-1871 г. При жизни Дмитрия Ивановича она издавалась восемь раз с его исправлениями, замечаниями и большим количеством дополнений (8-е издание вышло в 1906 г.). В течение многих лет книга "Основы химии" служила настольным руководством и пособием для русских химиков; она была переведена на ряд иностранных языков, причем троекратно издавалась в переводе на английский (1891, 1897 и 1905 г.). За годы Советский власти книга Д. И. Менделеева издавалась с соответствующими дополнениями еще пять раз (5-е советское издание в 1947 г.), она интересна и в настоящее время.
Во втором томе первого издания "Основ химии" изложены основные идеи периодичности и помещена естественная система элементов. Принципиально она мало отличается от предыдущего варианта; в ней также введены координаты "ряд" - "группа", а места пересечений линий ряда и группы отвечают определенному элементу. Под символами элементов помещены формулы наиболее типичных соединений, что загромождало таблицу (в последующих вариантах формулы были исключены).
Последним элементом в системе стал уран, для которого Д. И. Менделеев, основываясь на периодическом законе, изменил атомный вес со 116 на 240. В отношении урана он писал:
"Интерес дальнейшего изучения возрастает при изменении атомного веса еще и потому, что его атом оказывается тяжелейшим из всех известных элементов...Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет предметов для новых исследований, особо тщательно заниматься урановыми соединениями"...
За ураном Д. И. Менделеев поставил пять черточек, отвечающих пяти еще неизвестным элементам с атомными весами 245-250, что было указанием на возможность открытия трансурановых элементов, подтвердившимся впоследствии (после 1940 г. искусственно получено 12 элементов, стоящих за ураном).
Исходя из того, что свойства любого элемента X находятся в закономерной связи со свойствами соседних элементов (рис. 1) по горизонтали (D, Е), вертикали (В, F) и диагоналям (А, Н и С, G), Д. И. Менделеев использует эту "звездность", или атоманалогию * , для предсказания 11 еще неизвестных элементов: экацезия, экабария, экабора, экаалюминия, экалантана, экасилиция, экатантала, экателлура, экамарганца, двимарганца и экаиода ** . В отношении трех из них - экабора, экаалюминия и экасилиция (условные символы которых Eb, Ea, Es) - у Менделеева была особенно твердая уверенность в возможности их открытия.
* (Свойства элемента должны быть среднеарифметическими из свойств окружающих его элементов. )
** (Приставка эка означает - еще один, а два - второй. )
В период между выходом в свет второго (1872 г.) и третьего (1877 г.) изданий книги "Основы химии" предсказание Д. И. Менделеева подтвердилось. Французский химик Лекок де Буабодран в 1875 г. открыл новый элемент - галлий, свойства которого, установленные экспериментально, поразительно совпали со свойствами предсказанного экаалюминия (табл. 7).


Первоначально де Буабодран определил плотность галлия - 4,7. Менделеев в письме к нему указал, что это значение ошибочно и является результатом работы с нечистым образцом, а в действительности плотность галлия должна быть равной 5,9-6,0. При вторичном определении плотности очищенного от примесей галлия была получена величина 5,904.
Работы Менделеева не были известны де Буабодрану и его открытие не связано с периодическим законом. Тем не менее он позднее писал:
"Я думаю нет необходимости настаивать на огромном значении подтверждения теоретических выводов г. Менделеева относительно плотности нового элемента".
Гениальность предвидения Д. И. Менделеева восторгает К. А. Тимирязева:
"Менделеев объявляет всему миру, что где-то во вселенной... должен найтись элемент, которого не видел еще человеческий глаз, и этот элемент находится, и тот, кто его находит при помощи своих чувств, видит его на первый раз хуже, чем видел его умственным взором Менделеев". *
* (К. А. Тимирязев, "Научные задачи современного естествознания", Изд. 3-е, Москва, 1908, стр. 14. )
Открытие галлия дало Д. И. Менделееву уверенность в истинности периодического закона и в третьем издании "Основ химии" он вводит новую главу - "Сходство элементов и их система (изоморфизм), форма соединений, периодический закон, удельные объемы". В другой главе приведены все известные данные о свойствах галлия. Этот элемент впервые был введен в вариант системы, названной "Периодическая система химических элементов, основанная на их атомном весе и химическом сходстве".

В конце 1879 г. шведский ученый Нильсон открыл предсказанный Д. И. Менделеевым экабор и назвал новый элемент скандием (табл. 8). Нильсон писал о совпадении предсказанных и экспериментально найденных свойств нового элемента:
"... не остается никакого сомнения, что в скандии открыт экабор...; так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование названного простого тела, но и наперед дать его важнейшие свойства".

В четвертом издании "Основ химии" (1882 г.) новый элемент включен в систему элементов и приведены данные о его свойствах. Перед значением атомного веса 72 Менделеев, ожидая открытия этого элемента, поставил знаки вопроса (табл. 9).

Вверху таблицы элементы четных, внизу - нечетных рядов.
("Основы химии", изд. 4-е, ч. I, СПб, 1881, стр. XVI. )
Решающую победу периодический закон одержал в 1886 г., когда немецкий химик Винклер открыл новый элемент - германий. Свойства, установленные для этого элемента опытным путем, полностью совпали со свойствами, указанными Менделеевым для экасилиция (табл. 10).

По поводу открытия германия Винклер отмечал:
"... исследование его свойств составляет необыкновенно привлекательную задачу еще и в том отношении, что задача эта является как бы пробным камнем человеческой проницательности. Вряд ли может существовать более ясное доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического "экасилиция"; оно составляет, конечно, более чем простое подтверждение смелой теории, оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания".
Отвечая Винклеру, в 1886 г. Менделеев писал:
"В наше время (действий) едва ли кого-нибудь будут интересовать одни только утверждения, потому мы должны рассматривать как делающие эпоху утверждения, получившие свое реальное осуществление". (Подчеркнуто нами - В. С.)

В пятом издании книги "Основы химии" (1889 г.) германий был включен в систему элементов на заранее предназначенное ему место и описаны его свойства.
После открытия германия периодический закон Д. И. Менделеева получил всемирное признание, а периодическая система стала необходимым пособием при изучении курса химии. Однако дальнейшее развитие химии, открытие новых элементов и изучение их свойств вызывали необходимость в дополнениях и изменениях периодической системы, определении в ней места новых элементов и разрешения возникавших спорных вопросов, что не проходило без сомнений и затруднений. Примером этому служит открытие инертных газов.
В 1894 г. английские ученые Рэлей и Рамзай обнаружили, что при нормальных условиях литр азота, выделенного из воздуха (после удаления из него паров воды, двуокиси углерода и кислорода), весит 1,2572 г, а литр азота, полученного разложением азотсодержащих веществ, весит меньше - 1,2505 г. Эта разница не могла быть объяснена ошибкой опыта, в связи с чем было сделано предположение, что в азоте, полученном из воздуха, содержится неизвестный более тяжелый газ. Пропуская азот через накаленный магний (при этом получается нитрид магния), ученые химически связали азот и изолировали неизвестный газ. Было установлено, что молекула этого газа одноатомна, атомный вес равен 40 и атомы газа не соединяются между собой и с атомами других элементов. Газ оказался химически недеятельным, а потому был назван аргоном ("ленивый") и обозначен символом А (впоследствии Аr).

В первое время Д. И. Менделеев не считал аргон элементом * и принимал его за полимеризованный азот N 3 с атомным весом в 1,5 раза большим, чем у N 2 , подобно озону O 3 , являющемуся аллотропическим видоизменением кислорода О 2 , но в дополнении к V главе шестого издания (1896 г.) "Основ химии" он все же дал описание нового элемента - аргона.
* (Клетка, отвечающая атомному весу 40 в периодической системе, была занята кальцием. )
Дальнейшие исследования Рамзая подтвердили элементарную природу аргона, и на основании периодической системы он высказал мысль о существовании группы таких элементов:
"По образцу нашего учителя Менделеева, я описал, поскольку возможно было, ожидаемые свойства и предполагаемые отношения". Пользуясь менделеевским методом, Ю. Томсен предсказывает атомные веса предполагаемых элементов.
Вскоре Рамзай и Траверс открыли еще четыре инертных газа: гелий, неон, криптон и ксенон. Эррера предложил ввести для этих элементов нулевую группу в системе, другие же считали возможным включение их в VIII группу (как принято это и в настоящее время).
Открытие инертных газов явилось неожиданным событием (если не считать предвидения Н. А. Морозова, см. стр. 51) и их место в периодической системе Менделеевым не было предусмотрено. Тем не менее он пришел к следующему выводу:
"...Я более, чем прежде, стал склоняться к тому, что аргон и его аналоги суть элементарные вещества с особой совокупностью свойств, стоящие отнюдь не в VIII группе (как думают некоторые), а образующие особую (нулевую) группу".
В седьмом издании "Основ химии" инертные газы в периодической системе помещены в нулевую группу. Эта группа в одном варианте (с вертикальными периодами) поставлена после группы галогенов, а в другом (с горизонтальными периодами) - перед щелочными металлами (табл. 11). В систему включен также радий, открытый М. Кюри-Склодовской и П. Кюри в 1898 г. Всего в системе 71 элемент. Так как аргон стоит в системе до калия, атомный вес которого 39,15, Менделеев принимает атомный вес для аргона равным 38, хотя опытные данные приводили к значению 39,9.


Этот вариант системы без изменений был воспроизведен и в восьмом, последнем издании "Основ химии" (1906 г.), вышедшем при жизни Д. И. Менделеева, в которое он включил ряд примечаний: "Об аргоновых элементах", "Как найден был периодический закон", "О первичной материи", "Об атомных весах никеля и кобальта, теллура и иода и о редкоземельных элементах", "О формах изображения периодического закона", "Законы природы не терпят исключений", "Периодичность принадлежит элементам, а не соединениям". Все эти вопросы имели немаловажное значение для проблемы периодического закона. Объективная оценка истории открытия периодического закона дана самим Менделеевым:
"Таким образом, периодическая законность прямо вытекала из запаса сближений и проверенных сведений, существовавших к концу 60-х годов, она есть свод их в одно более или менее систематическое, цельное выражение..."

Важнейшими событиями в развитии и утверждении периодического закона Д. И. Менделеев считал открытие галлия, скандия, германия и инертных газов:
"Писавши в 1871 г. статью о приложении периодического закона к определению свойств еще не открытых элементов, я не думал, что доживу до оправдания этого следствия периодического закона, но действительность ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и экасилиций, и не прошло 20 лет, как я имел уже величайшую радость видеть все три открытыми и получившими имена от тех стран, где найдены редкие минералы, их содержащие, и где сделано их открытие: галлия, скандия и германия. Л. де Буабодрана, Вильсона и Винклера, их открывших, я, со своей стороны, считаю истинными укрепителями периодического закона. Без них он не был бы признан в такой мере, как это случилось ныне. В такой же мере я считаю Рамзая утвердителем справедливости периодического закона, так как он открыл Не, Ne, Ar, Кr и Хе, определил их атомные веса, и эти числа вполне подходят к требованиям периодической системы элементов". ("Основы химии", изд. 13, т. II, 389-390).
К "укрепителям" периодического закона Менделеев относит также чешского ученого Браунера, экспериментальные работы которого были связаны с периодической системой, с разработкой методов определения атомных весов и изучения свойств редкоземельных элементов. Д. И. Менделеев упоминает и о работах Л. В. Писаржевского в области изучения строения и свойств перекисей и надкислот, имевших немаловажное значение для периодического закона.
"Основы химии" Д. И. Менделеева - это не только учебник, излагающий в логической и исторической последовательности процесс развития химии как науки, но и замечательный основополагающий труд, вносящий в эту науку принципиально новое содержание, систему и средство познания всего накопленного" ею материала.