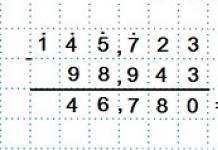
Лекция № 1765
АМИНОКИСЛОТЫ. ПЕПТИДЫ
Лекция № 16
АМИНОКИСЛОТЫ. ПЕПТИДЫ
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащие
карбоксильную и аминогруппы. По взаимному расположению функциональных групп
различают a
-,b
-, g
— и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу на конце цепи, называют
w
-аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.

a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при
взаимодействии альдегида с HCN и NH
3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH
4 Cl.

Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминирование
оксокислот

4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам.

Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов
перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. Химические
свойства
Аминокислоты дают реакции, характерные для карбоксильной
и аминогрупп, и, кроме того, проявляют специфические свойства, которые
определяются наличием двух функциональных групп и их взаимным
расположением.
2.1. Кислотно-основные
свойства
Аминокислоты содержат кислотный и основный
центры и являются амфотерными соединениями. В кристаллическом состоянии они
существуют в виде внутренних солей (биполярных ионов), которые образуются в
результате внутримолекулярного переноса протона от более слабого основного
центра (СОО
— ) к более сильному
основному центру (NH
2).

Ионное строение аминокислот подтверждается их
физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с
высокими температурами плавления. Они нерастворимы в неполярных органических
растворителях и растворимы в воде. Их молекулы обладают большими дипольными
моментами.
Форма существования аминокислот в водных
растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и
существуют преимущественно в виде катионов. В щелочной среде биполярный ион
отдает протон и превращается в анион.

При некотором значении рН, строго определенном
для каждой аминокислоты, она существует преимущественно в виде биполярного иона.
Это значение рН называют изоэлектрической точкой
(рI
).
В
изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей
растворимостью в воде. Катионная форма аминокислоты содержит два кислотных
центра (COOH и NH
3 + ) и
характеризуется двумя константами диссоциации рК а1 и рК а2 .
Значение рI определяется по уравнению:
![]()
2.2. Реакции по
аминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам
взаимодействуют с азотистой кислотой с выделением азота. При этом происходит
замещение аминогруппы на гидроксильную.
RCH(NH 2)COOH + HNO 2 ® RCH(OH)COOH + N 2 + H 2 O
Реакция используется для количественного
определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и
арилирование
При взаимодействии аминокислот с избытком
алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются
внутренние соли.

Аминокислоты арилируются 2,4-динитрофторбензолом
(ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в
активированном ароматическом кольце.
Реакция используется для установления
аминокислотной последовательности в пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами и
хлорангидридами с образованием N-ацильных производных.

Реакция используется для защиты аминогруппы в
синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно,
гидролизуются в жестких условиях. При разработке методов синтеза пептидов были
найдены защитные группы, которые легко удаляются путем гидролиза или
гидрогенолиза.
Карбобензоксизащита:

трет
-Бутоксикарбонильная защита
(БОК-защита).

Легкость снятия защиты обусловлена устойчивостью
бензил- и трет
-бутил-катионов, которые образуются в качестве
интермедиатов.
2.3. Реакции по карбоксильной
группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида
бария аминокислоты декарбоксилируются с образованием аминов.

Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как
катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры
– легко летучие соединения и могут быть разделены путем перегонки или
газожидкостной хроматографии, что используется для анализа и разделения смесей
аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и
ангидридов
При действии на защищенные по аминогруппе
аминокислоты галогенидов фосфора или серы образуются хлорангидриды.

Реакция используется для активации карбоксильной
группы при нуклеофильном замещении. Чаще для этой цели получают смешанные
ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в
синтезе пептидов.
2.4. Специфические реакции
аминокислот
Реакции с одновременным участием карбоксильной и
аминогрупп идут, как правило, с образованием продуктов, содержащих
термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование
a
-Аминокислоты
образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr
и др.).

Отношение аминокислот к
нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения
карбоксильной и аминогруппы и определяются возможностью образования
термодинамически стабильных 5-ти- 6-тичленных циклов
a
-Аминокислоты
вступают в реакцию межмолекулярного самоацилирования. При этом образуются
циклические амиды – дикетопиперазины.

b
-Аминокислоты при
нагревании переходят
a
,b
-непредельные кислоты.

g
— и
d
-Аминокислот претерпевают
внутримолекулярное ацилирование с образованием циклических амидов – лактамов
.

Нингидриновая реакция
При взаимодействии a
-аминокислот с трикетоном – нингидрином происходит одновременное окислительное
дезаминирование и декарбоксилирование с образованием альдегида и окрашенного
продукта конденсации.

Реакция используется для количественного анализа
аминокислот методом фотометрии.
- a
-Аминокислоты,
входящие в состав белков
3.1. Строение и
классификация
Природные аминокислоты отвечают общей формуле RCH(NH 2 )COOH и отличаются строением радикала R. Формулы и
тривиальные названия важнейших аминокислот приведены в таблице. Для
биологического функционирования аминокислот в составе белков определяющим
является полярность радикала R. По этому признаку аминокислоты разделяют на
следующие основные группы (см. таблицу).
Таблица. Важнейшие
a
-аминокислоты
RCH(NH 2)COOH
| Формула |
Название |
Обозначение |
pI |
| Аминокислоты, содержащие неполярный радикал R |
|||
 |
Глицин |
Gly |
5,97 |
 |
Аланин |
Ala |
6,0 |
 |
Валин |
Val |
5,96 |
 |
Лейцин |
Leu |
5,98 |
 |
Изолейцин |
Ile |
6,02 |
 |
Фенилаланин |
Phe |
5,48 |
 |
Триптофан |
Trp |
5,89 |
 |
Пролин |
Pro |
6,30 |
 |
Метионин |
Met |
5,74 |
 |
Цистин |
(Cys) 2 |
5,0 |
| неионогенный радикал R |
|||
 |
Серин |
Ser |
5,68 |
 |
Треонин |
|
5,60 |
 |
Гидроксипролин |
Hyp |
5,8 |
 |
Аспаргин |
Asn |
5,41 |
 |
Глутамин |
Gln |
5,65 |
| Аминокислоты, содержащие полярный положительно заряженный радикал R |
|||
 |
Лизин |
Lys |
9,74 |
 |
5-Гидроксилизин |
9,15 |
|
 |
Аргинин |
Arg |
10,76 |
 |
Гистидин |
His |
7,59 |
| Аминокислоты, содержащие полярный отрицательно заряженный радикал R |
|||
 |
Аспаргиновая кислота |
Asp |
2,77 |
 |
Глутаминовая кислота |
Gly |
3,22 |
 |
Тирозин |
Tyr |
5,66 |
 |
Цистеин |
Cys |
5,07 |
Аминокислоты, содержащие неполярный радикал
R.
Такие группы
располагаются внутри
молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный
неионогенный радикал R.
Аминокислоты этого типа
имеют в составе бокового радикала полярные группы, не
способные к ионизации в водной среде (спиртовый гидроксил, амидная группа).
Такие группы могут располагаться как внутри, так и на поверхности молекулы
белка. Они участвуют в образовании водородных связей с другими полярными
группами.
Аминокислоты, содержащие радикал R, способный
к ионизации в водной среде с образованием положительно или отрицательно
заряженных групп.
Такие аминокислоты содержат в боковом радикале
дополнительный основный или кислотный центр, который в водном растворе может
соответственно присоединять или отдавать протон.

В белках ионогенные группы этих аминокислот
располагаются, как правило, на поверхности молекулы и обуславливают
электростатические взаимодействия.
3.2.
Стереоизомерия.
Все природные
a
-аминокислоты (кроме глицина)
являются хиральными соединениями. По конфигурации хирального центра в положении
2 аминокислоты относят D- или L-ряду.

Природные аминокислоты относятся к
L-ряду.
Большинство аминокислот содержат один хиральный
центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин,
гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют
(кроме цистина) 4 стереоизомера, из которых только один встречается в составе
белков.
Так, из 4-х стереоизомеров треонина в
природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.

Использование для построения белков только
одного вида стереоизомеров имеет важное значение для формирования их
пространственной структуры и обеспечения биологической активности.
a
-Аминокислоты,
полученные синтетическим путем, представляют рацемические смеси, которые
необходимо разделять. Наиболее предпочтительным является ферментативный способ
разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные
производные только L-
a
-аминокислот. Ферментативное расщепление проводят по
следующей схеме.
Сначала рацемическую аминокислоту ацилируют
уксусным ангидридом:
Затем рацемическую смесь ацетильных производных
подвергают ферментативной обработке. При этом гидролизуется ацетильное
производное только L-аминокислоты:
Полученная после ферментативного смесь легко
разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в
щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные
свойства.
По кислотно-основным свойствам аминокислоты
разделяют на три группы.
Нейтральные аминокислоты
не содержат в
радикале R дополнительных кислотных или основных центров, способных к ионизации
в водной среде. В кислой среде они существуют в виде однозарядного катиона и
являются двухосновными кислотами по Бренстеду. Как видно на примере аланина,
изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале
5,5 – 6,3.

pI=1/2(2,34+9,69)=6,01
Основные аминокислоты
содержат в
радикале R дополнительный основный центр. К ним относятся лизин, гистидин и
аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными
кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере
лизина, лежит в области рН выше 7.

pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты
содержат в
радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и
глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются
трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области
рН много ниже 7.

pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах
слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при
физиологическом значении рН (~7) ни одна аминокислота не находится в
изоэлектрической точке. В организме все аминокислоты ионизированы, что
обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах
используется для разделения аминокислот методом электрофореза и ионообменной
хроматографии. При данном значении рН разные аминокислоты могут иметь разный по
величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и
движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а
аланин находится в изоэлектрической точке и не перемещается в
электрическом поле. Таким образом при рН6 они могут быть
разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной
хроматографии используют катионообменные смолы (сульфированный полистирол).
Процесс ведут в кислой среде, когда аминокислоты находятся катионной
форме.
Скорость продвижения аминокислот по
хроматографической колонке зависит от силы их электростатических и гидрофобных
взаимодействий со смолой. Наиболее прочно связываются со смолой основные
аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые
аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты
с неполярными боковыми радикалами, особенно ароматическими. Таким образом,
порядок элюирования аминокислот следующий. Легче других элюируются кислые
аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные
неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются
аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в
последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
3.4. Реакции аминокислот in
vivo
Восстановительное аминирование
– метод
синтеза
a
-аминокислот из
a
-оксокислот при участии кофермента НАД
Н в качестве
восстанавливающего реагента.

Трасаминирование
–
основной
путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух
функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой.
При этом нужная для организма аминокислота 1 синтезируется из аминокислоты 2,
имеющейся в клетках в избыточном коичестве. Реакция осуществляется при участии
ферментов трансаминаз и кофермента пиридоксальфосфата.

Декарбоксилирование
Аминокислоты декарбоксилируются под действием
ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом
образуются биогенные амины.

Биогенные амины обладают ярко выраженной
биологической активностью. Важнейшими из них являются — коламин (предшественник
в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает
аллергические реакции организма),
g
-аминомасляная кислота (нейромедиатор), адреналин
(гормон надпочечников, нейромедиатор)
Дезаминирование
Неокислительное дезаминирование происходит путем
отщепления аммиака под действием ферментов с образованием
a
,b
-непредельных кислот.

Окислительное дезаминирование
происходит
при участии ферментов оксидаз и кофермента НАД + , который выступает в качестве окислителя. В результате
выделяется аммиак и образуется соответствующая кетокислота.

С помощью реакций дезаминирования снижается
избыток аминокислот в организме.
4. Пептиды
Петиды – это полиамиды, построенные из a
-аминокислот. По числу аминокислотных остатков в
молекуле пептида различают дипептиды, трипептиды, тетрапептиды
и т.д.
Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами
, более 10 аминокислотных остатков – полипептидами
.
Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками
.
4.1. Строение
пептидов
Формально пептиды можно рассматривать как продукты поликонденсации
аминокислот.

Аминокислотные остатки в пептиде связаны
амидными (пептидными
) связями. Один конец цепи, на котором находится
аминокислота со свободной аминогруппой, называют N-концом
. Другой конец,
на котором находится аминокислота со свободной карбоксильной группой, называют С-концом
. Пептиды принято записывать и называть, начиная с
N-конца.
Название пептида строят на основе тривиальных
названий, входящих в его состав аминокислотных остатков, которые перечисляют,
начиная с N-конца. При этом в названиях всех аминокислот за исключением
С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения
пептидов используют трехбуквенные обозначения входящих в его состав
аминокислот.

Пептид характеризуется аминокислотным
составом
и аминокислотной последовательностью
.
Аминокислотный состав пептида может быть
установлен путем полного гидролиза пептида (расщепления до аминокислот) с
последующим качественным и количественным анализом образовавшихся аминокислот
методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот.
Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н.
HCl.
Одному и тому же аминокислотному составу
отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено
2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот
n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают
следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val
Ala-Val-Glu
Таким образом, для полной характеристики пептида
необходимо знать его аминокислотный состав и аминокислотную
последовательность.
4.2. Определение аминокислотной
последовательности
Для определения аминокислотной
последовательности используют комбинацию двух методов: определение концевых
аминокислот и частичный гидролиз
.
Определение N-концевых
аминокислот.
Метод Сегнера
. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а
затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют
ДНФ-производное N-концевой аминокислоты.

Метод Эдмана
состоит во
взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде.
При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от
цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ)
производного.

Преимущество этого метода состоит в том, что при
отщеплении N-концевой аминокислоты пептид не разрушается и операцию по
отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе –
секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления,
идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной
хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с
образованием более коротких цепей. Частичный гидролиз проводят с помощью
ферментов, которые гидролизуют пептидные связи избирательно, например, только с
N-конца (аминопептидазы
) или только с С-конца (карбоксипептидазы
).
Существуют ферменты, расщепляющие пептидные связи только между определенными
аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные
фрагменты, которые перекрываются по составляющим их аминокислотным остаткам.
Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного
пептида. Рассмотрим простейший пример установления структуры трипептида.
Частичный гидролиз по двум разным направлениям трипептида неизвестного строения
дает продукты представленные на схеме.
Единственный трипептид, структура которого не
противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности
пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная
задача, которая требует комбинации различных методов.
4.3. Синтез
петидов
Синтез пептида с заданной аминокислотной
последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза
дипептида из 2-х разных аминокислот возможно образование 4-х разных
продуктов.
В настоящее время разработана стратегия синтеза
пептидов, основанная на использовании методов активации
и защиты
функциональных групп на соответствующих этапах синтеза. Процесс синтеза
дипептида включает следующие стадии:
- защита аминогруппы N-концевой
аминокислоты; - активация карбоксильной группы N-концевой
аминокислоты; - конденсация модифицированных
аминокислот - снятие защитных групп

Таким образом, последовательно присоединяя
аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень
длителен, трудоемок и дает низкий выход конечного продукта. Основные потери
связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее
время твердофазный синтез пептидов
. На первой стадии защищенная по
аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе
(полистироле, модифицированном введением групп –CH
2 Cl). После снятия защиты проводят ацилирование
аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая
содержит активированную карбоксильную и защищенную аминогруппу. После снятия
защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей
проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с
носителя действием бромистоводородной кислоты. Твердофазный синтез
автоматизирован и проводится с помощью приборов – автоматических
синтезаторов.
;
Методом твердофазного синтеза получено большое
количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе
инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных
остатка).
Химическое поведение аминокислот определяется двумя функциональными группами -NН 2 и -СООН. Аминокислотам характерны реакции по аминогруппе, карбоксильной группе и по радикальной части, при этом в зависимости от реагента взаимодействие веществ может идти по одному или нескольким реакционным центрам.
Амфотерный характер аминокислот. Имея в молекуле одновременно кислотную и основную группу, аминокислоты в водных растворах ведут себя как типичные амфотерные соединения. В кислых растворах они проявляют основные свойства, реагируя как основания, в щелочных - как кислоты, образуя соответственно две группы солей:
Благодаря своей амфотерности в живом организме, аминокислоты играют роль буферных веществ, поддерживающих определенную концентрацию водородных ионов. Буферные растворы, полученные при взаимодействии аминокислот с сильными основаниями, широко применяются в биоорганической и химической практике. Соли аминокислот с минеральными кислотами лучше растворимы в воде, чем свободные аминокислоты. Соли с органическими кислотами труднорастворимые в воде и используются для идентификации и разделения аминокислот.
Реакции, обусловленные аминогруппой. С участием аминогруппы аминокислоты образуют аммониевые соли с кислотами, ацилируются, алкилируются, реагируют с азотистой кислотой и альдегидами в соответствии со следующей схемой:
Алкилирование проводится при участии R-На1 или Аr-Наl:
В процессе реакции ацилирования используются хлорангидриды или ангидриды кислот (ацетилхлорид, уксусный ангидрид, бензилоксикарбонилхлорид):
Реакции ацилирования и алкилировнаия применяется для защиты NН 2 -группы аминокислот в процессе синтеза пептидов.
Реакции, обусловленные карбоксильной группой . При участиикарбоксильной группы аминокислоты образуют cоли, сложные эфиры, амиды, хлорангидриды в соответствии со схемой, представленной ниже:
Если при a-углеродном атоме в углеводородном радикале имеется электроноакцепторный заместитель (-NO 2 , -СС1 3 , -СООН, -COR и т.д.), поляризующий связь С®СООН, то у карбоновых кислот легко протекают реакции декарбоксилирования . Декарбоксилирование a-аминокислот, содержащих в качестве заместителя + NH 3 -группу, приводит к образованию биогенных аминов. В живом орга-низме данный процесс протекает под действием фермента декарбоксилазы и витамина пиридоксальфосфата.
В лабораторных условиях реакцию осуществляется при на-гревании a-аминокислоты в присутствии поглотителей СО 2 , например, Ва(ОН) 2 .
При декарбоксилировании b-фенил-a-аланина, лизина, серина и гистидина образуются, соответственно, фенамин, 1,5-диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и триптамин.
Реакции аминокислот с участием боковой группы. При нитровании аминокислоты тирозин азотной кислотой происходитобразованиединитропроизводного соединения, окрашенного в оранжевый цвет (ксантопротеиновая проба):
Окислительно-восстановительные переходы имеют место в системе цистеин - цистин:
2НS CH 2 CH(NH 2)COOH ¾¾¾® HOOCCH(NH 2)CH 2 S-S CH 2 CH(NH 2)COOH
HOOCCH(NH 2)CH 2 S-S CH 2 CH(NH 2)COOH ¾¾¾® 2 НS CH 2 CH(NH 2)COOH
В некоторых реакциях аминокислоты реагируют по обеим функциональным группам одновременно.
Образование комплексов с металлами. Почти все a-аминокислоты образуют комплексы с ионами двухвалентных металлов. Наиболее устойчивыми являются комплексные внутренние соли меди (хелатные соединения), образующиеся в результате взаимодействия с гидроксидом меди (II) и окрашенные в синий цвет:
Действие азотистой кислоты на алифатические аминокислоты приводит кобразованию гидроксикислот, на ароматические - диазосоединений.
Образование гидроксикислот:
Реакция диазотирования:
(диазосоединение)
1. с выделением молекулярного азота N 2:
2. без выделения молекулярного азота N 2:
Хромофорная группа азобензола -N=N в азосоединениях обуславливает желтую, желтую, оранжевую или другого цвета окраску веществ при поглощении в видимой области света (400-800 нм). Ауксохромная группа
СООН изменяет и усиливает окраску за счет π, π - сопряжения с π - электронной системой основной группы хромофора.
Отношение аминокислот к нагреванию. При нагревании аминокислоты разлагаются с образованием различных продуктов в зависимости от их типа. При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды - дикетопиперазины:
валин (Val) диизопропильное производное
дикетопиперазина
При нагревании b-аминокислот от них отщепляется аммиак с образованием α, β-непредельных кислот с сопряженной системой двойных связей:
β-аминовалериановая кислота пентен-2-овая кислота
(3-аминопентановая кислота)
Нагревание g- и d-аминокислот сопровождается внутримолекулярной дегидратацией и образованием внутренних циклических амидов - лактамов:
γ-аминоизовалериановая кислота лактам γ-аминоизовалериановой
(4-амино-3-метилбутановая кислота) кислоты
Аминокислоты - главный строительный материал любого живого организма. По своей природе они являются первичными азотистыми веществами растений, которые синтезируются из почвы. Строение и и аминокислот зависят от их состава.
Структура аминокислоты
Каждая ее молекула имеет карбоксильные и аминные группы, которые соединены с радикалом. Если аминокислота содержит 1 карбоксильную и 1 амино-группу, строение ее можно обозначить формулой, представленной ниже.

Аминокислоты, которые имеют 1 кислотную и 1 щелочную группу, называют моноаминомонокарбоновыми. В организмах также синтезируются и функции которых обусловливают 2 карбоксильных группы или 2 аминных группы. Аминокислоты, содержащие 2 карбоксильные и 1 аминную группы, называют моноаминодикарбоновыми, а имеющие 2 аминные и 1 карбоксильную - диаминомонокарбоновыми.
Также они различны по строению органического радикала R. У каждой из них имеется свое наименование и структура. Отсюда и различные функции аминокислот. Именно наличие кислотной и щелочной групп обеспечивает ее высокую реактивность. Эти группы соединяют аминокислоты и образуют полимер - белок. Белки еще именуются полипептидами из-за своего строения.
Аминокислоты как строительный материал
Молекула белка - это цепочка из десятков или сотен аминокислот. Белки отличаются по составу, количеству и порядку расположения аминокислот, ведь число сочетаний из 20 составляющих практически бесконечно. Одни из них имеют весь состав незаменимых аминокислот, иные обходятся без одной или нескольких. Отдельные аминокислоты, структура, функции которых подобны белкам человеческого тела, не применяются в качестве пищевых, так как малорастворимы и не расщепляются ЖКТ. К таким принадлежат белки ногтей, волос, шерсти или перьев.
Функции аминокислот трудно переоценить. Эти вещества выступают главной пищей в рационе людей. Какую функцию выполняют аминокислоты? Они увеличивают рост мышечной массы, помогают укреплению суставов и связок, восстанавливают поврежденные ткани организма и участвуют во всех процессах, происходящих в теле человека.

Незаменимые аминокислоты
Только из добавок или пищевых продуктов можно получить Функции в процессе формирования здоровых суставов, крепких мышц, красивых волос очень значимы. К таким аминокислотам относятся:
- фенилаланин;
- лизин;
- треонин;
- метионин;
- валин;
- лейцин;
- триптофан;
- гистидин;
- изолейцин.
Функции аминокислот незаменимых
Эти кирпичики выполняют важнейшие функции в работе каждой клетки человеческого организма. Они незаметны, пока поступают в организм в достаточном количестве, но их недостаток существенно ухудшает работу всего организма.
- Валин возобновляет мышцы, служит отличным источником энергии.
- Гистидин улучшает состав крови, способствует восстановлению и росту мышц, улучшает работу суставов.
- Изолейцин помогает выработке гемоглобина. Контролирует количество сахара в крови, повышает энергичность человека, выносливость.
- Лейцин укрепляет иммунитет, следит за уровнем сахара и лейкоцитов в крови. Если уровень лейкоцитов завышен: он их понижает и подключает резервы организма для ликвидации воспаления.
- Лизин помогает усвоению кальция, что формирует и укрепляет кости. Помогает выработке коллагена, улучшает структуру волос. Для мужчин это отличный анаболик, так как он наращивает мышцы и увеличивает мужскую силу.
- Метионин нормализует работу пищеварительной системы и печени. Участвует в расщеплении жиров, убирает токсикоз у беременных, благотворно влияет на волосы.
- Треонин улучшает работу ЖКТ. Повышает иммунитет, участвует в создании эластина и коллагена. Треонин препятствует отложению жира в печени.
- Триптофан отвечает за эмоции человека. Вырабатывает серотонин - гормон счастья, тем самым нормализует сон, поднимает настроение. Укрощает аппетит, благотворительно влияет на сердечную мышцу и артерии.
- Фенилаланин служит передатчиком сигналов от нервных клеток в мозг головы. Улучшает настроение, подавляет нездоровый аппетит, улучшает память, повышает восприимчивость, снижает боль.
Дефицит незаменимых аминокислот приводит к остановке роста, нарушению обмена веществ, снижению мышечной массы.

Заменимые аминокислоты
Это такие аминокислоты, строение и функции которых вырабатываются в организме:
- аргинин;
- аланин;
- аспарагин;
- глицин;
- пролин;
- таурин;
- тирозин;
- глутамат;
- серин;
- глутамин;
- орнитин;
- цистеин;
- карнитин.
Функции аминокислот заменимых
- Цистеин ликвидирует токсические вещества, участвует в создании тканей кожи и мышц, представляет собой естественный антиоксидант.
- Тирозин снижает физическую усталость, ускоряет метаболизм, ликвидирует стресс и депрессию.
- Аланин служит для роста мускулатуры, является источником энергии.
- увеличивает метаболизм и снижает образование аммиака при больших нагрузках.
- Цистин устраняет боль при травмировании связок и суставов.
- отвечает за мозговую активность, во время длительных физических нагрузок переходит в глюкозу, вырабатывая энергию.
- Глутамин восстанавливает мышцы, повышает иммунитет, ускоряет метаболизм, усиливает работу мозга и создает гормон роста.
- Глицин необходим для работы мышц, расщепления жира, стабилизации артериального давления и сахара в крови.
- Карнитин перемещает жировые кислоты в клетки, где совершается их расщепление с выделением энергии, в результате чего сжигается лишний жир и генерируется энергия.
- Орнитин производит гормон роста, участвует в процессе мочеобразования, расщепляет жирные кислоты, помогает выработке инсулина.
- Пролин обеспечивает производство коллагена, он необходим для связок и суставов.
- Серин повышает иммунитет и вырабатывает энергию, нужен для быстрого метаболизма жирных кислот и роста мышц.
- Таурин расщепляет жир, поднимает сопротивляемость организма, синтезирует желчные соли.
Белок и его свойства
Белки, или протеины - высокомолекулярные соединения с содержанием азота. Понятие "протеин", впервые обозначенное Берцелиусом в 1838 г., происходит от греческого слова и означает "первичный", что отображает лидирующее значение протеинов в природе. Разновидность белков дает возможность для существования огромного количества живых существ: от бактерий до человеческого организма. Их существенно больше, чем других макромолекул, ведь белки - это фундамент живой клетки. Составляют приблизительно 20% от массы человеческого тела, больше 50% сухой массы клетки. Такое количество разнообразных белков объясняется свойствами двадцати различных аминокислот, которые взаимодействуют друг с другом и создают полимерные молекулы.

Выдающееся свойство белков - способность к самостоятельному созданию определенной, свойственной конкретному белку пространственной структуры. По белки - это биополимеры с пептидными связями. Для химического состава белков свойственно постоянное среднее содержание азота - приблизительно 16%.
Жизнь, а также рост и развитие организма невозможны без функции белковых аминокислот строить новые клетки. Белки нельзя заменить прочими элементами, их роль в человеческом организме является чрезвычайно важной.
Функции белков
Необходимость белков заключается в таких функциях:
- он необходим для роста и развития, так как выступает главным строительным материалом для создания новых клеток;
- управляет метаболизмом, во время которого освобождается энергия. После принятия пищи скорость метаболизма увеличивается, например, если еда состоит из углеводов, метаболизм ускоряется на 4%, если из белков - на 30%;
- регулируют в организме, благодаря своей гидрофильности - способности притягивать воду;
- усиливают работу иммунной системы, синтезируя антитела, которые защищают от инфекции и ликвидируют угрозу заболевания.

Продукты - источники белков
Мышцы и скелет человека состоят из живых тканей, которые на протяжении жизни не только функционируют, но и обновляются. Восстанавливаются после повреждений, сохраняют свою силу и прочность. Для этого им требуются вполне определенные питательные вещества. Пища обеспечивает организм энергией, необходимой для всех процессов, включая работу мышц, рост и восстановление тканей. А белок в организме используется и как источник энергии, и как стройматериал.

Поэтому очень важно соблюдать его ежедневное использование в пищу. Богатые белком продукты: курица, индейка, постная ветчина, свинина, говядина, рыба, креветки, фасоль, чечевица, бекон, яйца, орех. Все эти продукты обеспечивают организм белком и дают энергию, необходимую для жизни.
ОПРЕДЕЛЕНИЕ
Аминокислоты - это сложные органические соединения, которые в своей молекуле одновременно содержат аминогруппу и карбоксильную группу.
Аминокислоты представляют собой твердые кристаллические вещества, характеризующиеся высокими температурами плавления и разлагающиеся при нагревании. Они хорошо растворяются в воде. Данные свойства объясняются возможностью существование аминокислот в виде внутренних солей (рис. 1).
Рис. 1. Внутренняя соль аминоуксусной кислоты.
Получение аминокислот
Исходными соединениями для получения аминокислот часто служат карбоновые кислоты, в молекулу которых вводится аминогруппа. Например, получение их из галогензамещенных кислот
CH 3 -C(Br)H-COOH + 2NH 3 →CH 3 -C(NH 2)H-COOH + NH 4 Br.
Кроме этого исходным сырьем для получения аминокислот могут служить альдегиды (1), непредельные кислоты (2) и нитросоединения (3):
CH 3 -C(O)H + NH 3 + HCN → CH 3 -C(NH 2)H-C≡H + H 2 O;
CH 3 -C(NH 2)H-C≡H + H 2 O (H +) → CH 3 -C(NH 2)H-COOH + NH 3 (1).
CH 2 =CH-COOH + NH 3 → H 2 N-CH 2 -CH 2 -COOH (2);
O 2 N-C 6 H 4 -COOH + [H] →H 2 N-C 6 H 4 -COOH (3).
Химические свойства аминокислот
Аминокислота как гетерофункциональные соединения вступают в большинство реакций, характерных для карбоновых кислот и аминов. Наличие в молекулах аминокислот двух различных функциональных групп приводит к появлению ряда специфических свойств.
Аминокислоты - амфотерные соединения. Они реагируют как с кислотами, так и с основаниями:
NH 2 -CH 2 -COOH + HCl→ Cl
NH 2 -CH 2 -COOH + NaOH→ NH 2 -CH 2 -COONa + H 2 O
Водные растворы аминокислот имеют нейтральную, щелочную и кислотную среду в зависимости от количества функциональных групп. Например, глутаминовая кислота образует кислый раствор, поскольку в её составе две карбоксильные группы и одна аминогруппа, а лизин - щелочной раствор, т.к. в её составе одна карбоксильная группа и две аминогруппы.
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:

Полученное соединение называют дипептидом. Вещества, построенные из многих остатков аминокислот, называются полипептидами. Пептиды гидролизуются под действием кислот и оснований.
Применение аминокислот
Аминокислоты, необходимые для построения организма, как человек, так и животные получают из белков пищи.
γ-Аминомасляная кислота используется в медицине (аминалон / гаммалон) при психических заболеваниях; на её основе создан целый ряд ноотропных препаратов, т.е. оказывающих влияние на процессы мышления.
ε-Аминокапроновая кислота также используется в медицине (кровоостанавливающее средство), а кроме того представляет собой крупнотоннажный промышленный продукт, использующийся для получения синтетического полиамидного волокна - капрона.
Антраниловая кислота используется для синтеза красителей, например синего индиго, а также участвует в биосинтезе гетероциклических соединений.
Примеры решения задач
ПРИМЕР 1
| Задание | Напишите уравнения реакций аланина с: а) гидроксидом натрия; б) гидроксидом аммония; в) соляной кислотой. За счет каких групп внутренняя соль проявляет кислотные и основные свойства? |
| Ответ | Аминокислоты часто изображают как соединения, содержащие аминогруппу и карбоксильную группу, однако с такой структурой не согласуются некоторые их физические и химические свойства. Строение аминокислот соответствует биполярному иону:
H 3 N + -CH(R)-COO — . Запишем формулу аланина как внутренней соли: H 3 N + -CH(CH 3)-COO — . Исходя из этой структурной формулы, напишем уравнения реакций: а) H 3 N + -CH(CH 3)-COO — + NaOH = H 2 N-CH(CH 3)-COONa + H 2 O; б) H 3 N + -CH(CH 3)-COO — + NH 3 ×H 2 O = H 2 N-CH(CH 3)-COONH 4 + H 2 O; в) H 3 N + -CH(CH 3)-COO — + HCl = Cl — . Внутренняя соль аминокислоты реагирует с основаниями как кислота, с кислотами - как основание. Кислотная группа - N + H 3 , основная - COO — . |
ПРИМЕР 2
| Задание | При действии на раствор 9,63 г неизвестной моноаминокарбоновой кислоты избытком азотистой кислоты было получено 2,01 л азота при 748 мм. рт. ст. и 20 o С. Определите молекулярную формулу этого соединения. Может ли эта кислоты быть одной из природных аминокислот? Если да, то какая это кислота? В состав молекулы этой кислоты не входит бензольное кольцо. |
| Решение | Напишем уравнение реакции:
H 2 NC x H 2 x COOH + HONO = HO-C x H 2 x -COOH + N 2 + H 2 O. Найдем количество вещества азота при н.у., применяя уравнение Клапейрона-Менделеева. Для этого температуру и давление выражаем в единицах СИ: T = 273 + 20 = 293 K; P = 101,325 × 748 / 760 = 99,7 кПа; n(N 2) = 99,7 × 2,01 / 8,31 × 293 = 0,082 моль. По уравнению реакции находим количество вещества аминокислоты и её молярную массу. По уравнению n(H 2 NC x H 2 x COOH) = n(N 2) = 0,082 моль. M(H 2 NC x H 2 x COOH) = 9,63 / 0,082 = 117 г/моль. Определим аминокислоту. Составим уравнение и найдем x: 14x + 16 + 45 = 117; H 2 NC 4 H 8 COOH. Из природных кислот такому составу может отвечать валин. |
| Ответ | Эта аминокислота — валин. |
Аминокислоты представляют собой структурные химические единицы или "строительные кирпичики", образующие белки. Аминокислоты на 16% состоят из азота, это является их основным химическим отличием от двух других важнейших элементов питания - углеводов и жиров. Важность аминокислот для организма определяется той огромной ролью, которую играют белки во всех процессах жизнедеятельности.
Любой живой организм от самых крупных животных до крошечных микробов состоит из белков. Разнообразные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти. Белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит этих элементов питания в организме может привести к нарушению водного баланса, что вызывает отеки.
Каждый белок в организме уникален и существует для специальных целей. Белки не являются взаимозаменяемыми. Они синтезируются в организме из аминокислот, которые образуются в результате расщепления белков, находящихся в пищевых продуктах. Таким образом, именно аминокислоты, а не сами белки являются наиболее ценными элементами питания. Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них выполняют роль нейромедиаторов (нейротрансмиттеров) или являются их предшественниками.
Нейромедиаторы - это химические вещества, передающие нервный импульс от одной нервной клетки другой. Таким образом, некоторые аминокислоты необходимы для нормальной работы головного мозга. Аминокислоты способствуют тому, что витамины и минералы адекватно выполняют свои функции. Некоторые аминокислоты непосредственно снабжают энергией мышечную ткань.
В организме человека многие аминокислоты синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. К таким незаменимым аминокислотам относятся - гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печен: аланин, аргинин, аспарагин, аспарагиновая кислота, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамин и глютаминовая кислота, глицин, орнитин, пролин, серин, таурин, тирозин.
Процесс синтеза белков идет в организме постоянно. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам - от нарушения пищеварения до депрессии и замедления роста.
Как возникает такая ситуация? Легче, чем это можно себе представить. Многие факторы приводят к этому, даже, если ваше питание сбалансировано и вы потребляете достаточное количество белка. Нарушение всасывания в желудочно-кишечном тракте, инфекция, травма, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме - все это может привести к дефициту незаменимых аминокислот.
Следует иметь в виду, что все вышесказанное вовсе не означает, что потребление большого количества белков поможет решить любые проблемы. В действительности, это не способствует сохранению здоровья.
Избыток белков создает дополнительный стресс для почек и печени, которым надо перерабатывать продукты метаболизма белков, основным из них является аммиак. Он очень токсичен для организма, поэтому печень немедленно перерабатывает его в мочевину, которая затем поступает с током крови в почки, где отфильтровывается и выводится наружу.
До тех пор, пока количество белка не слишком велико, а печень работает хорошо, аммиак нейтрализуется сразу же и не причиняет никакого вреда. Но если его слишком много и печень не справляется с его обезвреживанием (в результате неправильного питания, нарушения пищеварения и/или заболеваний печени) - в крови создается токсический уровень аммиака. При этом может возникнуть масса серьезных проблем со здоровьем, вплоть до печеночной энцефалопатии и комы.
Слишком высокая концентрация мочевины также вызывает повреждение почек и боли в спине. Следовательно, важным является не количество, а качество потребляемых с пищей белков. В настоящее время можно получать незаменимые и заменимые аминокислоты в виде биологически активных пищевых добавок.
Это особенно важно при различных заболеваниях и при применении редукционных диет. Вегетарианцам необходимы такие добавки, содержащие незаменимые аминокислоты, чтобы организм получал все необходимое для нормального синтеза белков.
 Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты . Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Имеются разные виды добавок, содержащих аминокислоты. Аминокислоты входят в состав некоторых поливитаминов, белковых смесей. Есть в продаже формулы, содержащие комплексы аминокислот или содержащие одну или две аминокислоты . Они представлены в различных формах: в капсулах, таблетках, жидкостях и порошках.
Большинство аминокислот существует в виде двух форм, химическая структура одной является зеркальным отображением другой. Они называются D- и L-формами, например D-цистин и L-цистин.
D означает dextra (правая на латыни), а L - levo (соответственно, левая). Эти термины обозначают направление вращения спирали, являющейся химической структурой данной молекулы. Белки животных и растительных организмов созданы в основном L-формами аминокислот (за исключением фенилаланина, который представлен D, L формами).
Пищевые добавки, содержащие L-аминокислоты, считаются более подходящими для биохимических процессов человеческого организма.
Свободные, или несвязанные, аминокислоты представляют собой наиболее чистую форму. Поэтому при выборе добавки, содержащей аминокислоты, предпочтение следует отдавать продуктам, содержащим L-кристаллические аминокислоты, стандартизированные по Американской Фармакопее (USP). Они не нуждаются в переваривании и абсорбируются непосредственно в кровоток. После приема внутрь всасываются очень быстро и, как правило, не вызывают аллергических реакций.
Отдельные аминокислоты принимают натощак, лучше всего утром или между приемами пищи с небольшим количеством витаминов В6 и С. Если вы принимаете комплекс аминокислот, включающий все незаменимые, это лучше делать через 30 минут после или за 30 минут до еды. Лучше всего принимать и отдельные нужные аминокислоты, и комплекс аминокислот, но в разное время. Отдельно аминокислоты не следует принимать в течение длительного времени, особенно в высоких дозах. Рекомендуют прием в течение 2 месяцев с 2-месячным перерывом.
Аланин
Аланин способствует нормализации метаболизма глюкозы. Установлена взаимосвязь между избытком аланина и инфицированием вирусом Эпштейна-Барра, а также синдромом хронической усталости. Одна из форм аланина - бета-аланин является составной частью пантотеновой кислоты и коэнзима А - одного из самых важных катализаторов в организме.
Аргинин
Аргинин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты. В связи с этим аргинин полезен людям, страдающим ВИЧ-инфекцией и злокачественными новообразованиями.
Его также применяют при заболеваниях печени (циррозе и жировой дистрофии), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Семенная жидкость содержит аргинин, поэтому его иногда применяют в комплексной терапии бесплодия у мужчин. В соединительной ткани и в коже также находится большое количество аргинина, поэтому его прием эффективен при различных травмах. Аргинин - важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аргинин помогает снизить вес, так как вызывает некоторое уменьшение запасов жира в организме.
 Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Аргинин входит в состав многих энзимов и гормонов. Он оказывает стимулирующее действие на выработку инсулина поджелудочной железой в качестве компонента вазопрессина (гормона гипофиза) и помогает синтезу гормона роста. Хотя аргинин синтезируется в организме, его образование может быть снижено у новорожденных. Источниками аргинина являются шоколад, кокосовые орехи, молочные продукты, желатин, мясо, овес, арахис, соевые бобы, грецкие орехи, белая мука, пшеница и пшеничные зародыши.
Люди, имеющие вирусные инфекции, в том числе Herpes simplex, не должны принимать аргинин в виде пищевых добавок и должны избегать потребления продуктов, богатых аргинином. Беременным и кормящим грудью матерям не следует употреблять пищевые добавки с аргинином. Прием небольших доз аргинина рекомендуется при заболеваниях суставов и соединительной ткани, при нарушениях толерантности к глюкозе, заболеваниях печени и травмах. Длительный прием не рекомендован.
Аспарагин
Аспарагин необходим для поддержания баланса в процессах, происходящих в центральной нервной системе: препятствует как чрезмерному возбуждению, так и излишнему торможению. Он участвует в процессах синтеза аминокислот в печени.
Так как эта аминокислота повышает жизненную силу, добавку на ее основе применяют при усталости. Она играет также важную роль в процессах метаболизма. Аспартовую кислоту часто назначают при заболеваниях нервной системы. Она полезна спортсменам, а также при нарушениях функции печени. Кроме того, он стимулирует иммунитет за счет повышения продукции иммуноглобулинов и антител.
Аспартовая кислота в больших количествах содержится в белках растительного происхождения, полученных из пророщенных семян и в мясных продуктах.
Карнитин
Строго говоря, карнитин не является аминокислотой, но его химическая структура сходна со структурой аминокислот, и поэтому их обычно рассматривают вместе. Карнитин не участвует в синтезе белков и не является нейромедиатором. Его основная функция в организме - это транспорт длинноцепочечных жирных кислот, в процессе окисления которых выделяется энергия. Это один из основных источников энергии для мышечной ткани. Таким образом, карнитин увеличивает переработку жира в энергию и предотвращает отложение жира в организме, прежде всего в сердце, печени, скелетной мускулатуре.
Карнитин снижает вероятность развития осложнений сахарного диабета, связанных с нарушениями жирового обмена, замедляет жировое перерождение печени при хроническом алкоголизме и риск возникновения заболеваний сердца. Он обладает способностью снижать уровень триглицеридов в крови, способствует снижению массы тела и повышает силу мышц у больных с нервно-мышечными заболеваниями и усиливает антиоксидантное действие витаминов С и Е.
Считается, что некоторые варианты мышечных дистрофий связаны с дефицитом карнитина. При таких заболеваниях люди должны получать большее количество этого вещества, чем это положено по нормам.
Он может синтезироваться в организме при наличии железа, тиамина, пиридоксина и аминокислот лизина и метионина. Синтез карнитина осуществляется в присутствии также достаточного количества витамина С. Недостаточное количество любого из этих питательных веществ в организме приводит к дефициту карнитина. Карнитин поступает в организм с пищей, прежде всего с мясом и другими продуктами животного происхождения.
 Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Большинство случаев дефицита карнитина связано с генетически обусловленным дефектом в процессе его синтеза. К возможным проявлениям недостаточности карнитина относятся нарушения сознания, боли в сердце, слабость в мышцах, ожирение.
Мужчинам вследствие большей мышечной массы требуется большее количество карнитина, чем женщинам. У вегетарианцев более вероятно возникновение дефицита этого питательного вещества, чем у невегетарианцев, в связи с тем, что карнитин не встречается в белках растительного происхождения.
Более того, метионин и лизин (аминокислоты, необходимые для синтеза карнитина) также не содержатся в растительных продуктах в достаточных количествах.
Для получения необходимого количества карнитина вегетарианцы должны принимать пищевые добавки или есть обогащенные лизином продукты, такие как кукурузные хлопья.
Карнитин представлен в биологически активных пищевых добавках в различных формах: в виде D, L-карнитина, D-карнитина, L-карнитина, ацетил-L-карнитина.
Предпочтительнее принимать L-карнитин.
Цитруллин
Цитруллин преимущественно находится в печени. Он повышает энергообеспечение, стимулирует иммунную систему, в процессе обмена веществ превращается в L-аргинин. Он обезвреживает аммиак, повреждающий клетки печени.
Цистеин и цистин
Эти две аминокислоты тесно связаны между собой, каждая молекула цистина состоит из двух молекул цистеина, соединенных друг с другом. Цистеин очень нестабилен и легко переходит в L-цистин, и, таким образом, одна аминокислота легко переходит в другую при необходимости.
Обе аминокислоты относятся к серосодержащим и играют важную роль в процессах формирования тканей кожи, имеют значение для дезинтоксикационных процессов. Цистеин входит в состав альфа-кератина - основного белка ногтей, кожи и волос. Он способствует формированию коллагена и улучшает эластичность и текстуру кожи. Цистеин входит в состав и других белков организма, в том числе некоторых пищеварительных ферментов.
Цистеин помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации. Он представляет собой один из самых мощных антиоксидантов, при этом его антиоксидантное действие усиливается при одновременном приеме с витамином С и селеном.
Цистеин является предшественником глютатиона - вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме. Цистеин растворяется лучше, чем цистин, и быстрее утилизируется в организме, поэтому его чаще используют в комплексном лечении различных заболеваний. Это аминокислота образуется в организме из L-метионина, при обязательном присутствии витамина В6.
Дополнительный прием цистеина необходим при ревматоидном артрите, заболеваниях артерий, раке. Он ускоряет выздоровление после операций, ожогов, связывает тяжелые металлы и растворимое железо. Эта аминокислота также ускоряет сжигание жиров и образование мышечной ткани.
L-цистеин обладает способностью разрушать слизь в дыхательных путях, благодаря этому его часто применяют при бронхитах и эмфиземе легких. Он ускоряет процессы выздоровления при заболеваниях органов дыхания и играет важную роль в активизации лейкоцитов и лимфоцитов.
Так как это вещество увеличивает количество глютатиона в легких, почках, печени и красном костном мозге, оно замедляет процессы старения, например, уменьшая количество старческих пигментных пятен. N-ацетилцистеин более эффективно повышает уровень глютатиона в организме, чем цистин или даже сам глютатион.
Люди с сахарным диабетом должны быть осторожны при приеме добавок с цистеином, так как он обладает способностью инактивировать инсулин. При цистинурии, редком генетическом состоянии, приводящем к образованию цистиновых камней, принимать цистеин нельзя.
Диметилглицин
Диметилглицин - это производная глицина - самой простой аминокислоты. Он является составным элементом многих важных веществ, таких как аминокислоты метионин и холин, некоторых гормонов, нейромедиаторов и ДНК.
 В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
В небольших количествах диметилглицин встречается в мясных продуктах, семенах и зернах. Хотя с дефицитом диметилглицина не связано никаких симптомов, прием пищевых добавок с диметилглицином оказывает целый ряд положительных эффектов, включая улучшение энергообеспечения и умственной деятельности.
Диметилглицин также стимулирует иммунитет, уменьшает содержание холестерина и триглицеридов в крови, помогает нормализации артериального давления и уровня глюкозы, а также способствует нормализации функции многих органов. Его также применяют при эпилептических припадках.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота (GABA) выполняет в организме функцию нейромедиатора центральной нервной системы и незаменима для обмена веществ в головном мозге. Образуется она из другой аминокислоты - глютаминовой. Она уменьшает активность нейронов и предотвращает перевозбуждение нервных клеток.
Гамма-аминомасляная кислота снимает возбуждение и оказывает успокаивающее действие, ее можно принимать также как транквилизаторы, но без риска развития привыкания. Эту аминокислоту используют в комплексном лечении эпилепсии и артериальной гипертензии. Так как она оказывает релаксирующее действие, ее применяют при лечении нарушений половых функций. Кроме того, GABA назначают при синдроме дефицита внимания. Избыток гамма-аминомасляной кислоты, однако, может увеличить беспокойство, вызывает одышку, дрожание конечностей.
Глютаминовая кислота
Глютаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер.
Эта аминокислота может использоваться клетками головного мозга в качестве источника энергии. Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты - глютамина. Этот процесс - единственный способ обезвреживания аммиака в головном мозге.
Глютаминовую кислоту применяют при коррекции расстройств поведения у детей, а также при лечении эпилепсии, мышечной дистрофии, язв, гипогликемических состояний, осложнений инсулинотерапии сахарного диабета и нарушений умственного развития.
Глютамин
Глютамин - это аминокислота, наиболее часто встречающаяся в мышцах в свободном виде. Он очень легко проникает через гематоэнцефалический барьер и в клетках головного мозга переходит в глютаминовую кислоту и обратно, кроме того увеличивает количество гамма-аминомасляной кислоты, которая необходима для поддержания нормальной работы головного мозга.
Эта аминокислота также поддерживает нормальное кислотно-щелочное равновесие в организме и здоровое состояние желудочно-кишечного тракта, необходим для синтеза ДНК и РНК.
Глютамин - активный участник азотного обмена. Его молекула содержит два атома азота и образуется из глютаминовой кислоты путем присоединения одного атома азота. Таким образом, синтез глютамина помогает удалить избыток аммиака из тканей, прежде всего из головного мозга и переносить азот внутри организма.
Глютамин находится в больших количествах в мышцах и используется для синтеза белков клеток скелетной мускулатуры. Поэтому пищевые добавки с глютамином применяются культуристами и при различных диетах, а также для профилактики потери мышечной массы при таких заболеваниях, как злокачественные новообразования и СПИД, после операций и при длительном постельном режиме.
Дополнительно глютамин применяют также при лечении артритов, аутоиммунных заболеваниях, фиброзах, заболеваниях желудочно-кишечного тракта, пептических язвах, заболеваниях соединительной ткани.
 Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Эта аминокислота улучшает деятельность мозга и поэтому применяется при эпилепсии, синдроме хронической усталости, импотенции, шизофрении и сенильной деменции. L-глютамин уменьшает патологическую тягу к алкоголю, поэтому применяется при лечении хронического алкоголизма.
Глютамин содержится во многих продуктах как растительного, так и животного происхождения, но он легко уничтожается при нагревании. Шпинат и петрушка являются хорошими источниками глютамина, но при условии, что их потребляют в сыром виде.
Пищевые добавки, содержащие глютамин, следует хранить только в сухом месте, иначе глютамин переходит в аммиак и пироглютаминовую кислоту. Не принимают глютамин при циррозе печени, заболеваниях почек, синдроме Рейе.
Глютатион
Глютатион, так же как и карнитин, не является аминокислотой. По химической структуре это трипептид, получаемый в организме из цистеина, глютаминовой кислоты и глицина.
Глютатион является антиоксидантом. Больше всего глютатиона находится в печени (некоторое его количество высвобождается прямо в кровоток), а также в легких и желудочно-кишечном тракте.
Он необходим для углеводного обмена, а также замедляет старение за счет влияния на липидный обмен и предотвращает возникновения атеросклероза. Дефицит глютатиона сказывается прежде всего на нервной системе, вызывая нарушения координации, мыслительных процессов, тремор.
Количество глютатиона в организме уменьшается с возрастом. В связи с этим пожилые люди должны получать его дополнительно. Однако предпочтительнее употреблять пищевые добавки, содержащие цистеин, глютаминовую кислоту и глицин - то есть вещества, синтезирующие глютатион. Наиболее эффективным считается прием N-ацетилцистеина.
Глицин
Глицин замедляет дегенерацию мышечной ткани, так как является источником креатина - вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК. Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме.
Он входит в состав многих антацидных препаратов, применяемых при заболеваниях желудка, полезен для восстановления поврежденных тканей, так как в больших количествах содержится в коже и соединительной ткани.
Эта аминокислота необходима для нормального функицонирования центральной нервной системы и поддержки хорошего состояния предстательной железы. Он выполняет функцию тормозного нейромедиатора и, таким образом, может предотвратить эпилептические судороги.
Глицин применяют в лечении маниакально-депрессивного психоза, он также может быть эффективен при гиперактивности. Избыток глицина в организме вызывает чувство усталости, но адекватное количество обеспечивает организм энергией. При необходимости глицин в организме может превращаться в серин.
Гистидин
Гистидин - это незаменимая аминокислота, способствующая росту и восстановлению тканей, которая входит в состав миелиновых оболочек, защищающих нервные клетки, а также необходима для образования красных и белых клеток крови. Гистидин защищает организм от повреждающего действия радиации, способствует выведению тяжелых металлов из организма и помогает при СПИДе.
Слишком высокое содержание гистидина может привести к возникновению стресса и даже психических нарушений (возбуждения и психозов).
Неадекватное содержание гистидина в организме ухудшает состояние при ревматоидном артрите и при глухоте, связанной с поражением слухового нерва. Метионин способствует понижению уровня гистидина в организме.
 Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Гистамин, очень важный компонент многих иммунологических реакций, синтезируется из гистидина. Он также способствует возникновению полового возбуждения. В связи с этим одновременный прием биологически активных пищевых добавок, содержащих гистидин, ниацин и пиридоксин (необходимых для синтеза гистамина), может оказаться эффективным при половых расстройствах.
Так как гистамин стимулирует секрецию желудочного сока, применение гистидина помогает при нарушениях пищеварения, связанных с пониженной кислотностью желудочного сока.
Люди, страдающие маниакально-депрессивным психозом, не должны принимать гистидин, за исключением случаев, когда дефицит этой аминокислоты точно установлен. Гистидин находится в рисе, пшенице и ржи.
Изолейцин
Изолейцин - одна из аминокислот BCAA и незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.Метаболизм изолейцина происходит в мышечной ткани.
Совместный прием с изолейцином и валином (BCAA) увеличиваtт выносливость и способствуют восстановлению мышечной ткани, что особенно важно для спортсменов.
 Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Изолейцин необходим при многих психических заболеваниях. Дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
К пищевым источниками изолейцина относятся миндаль, кешью, куриное мясо, турецкий горох, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Имеются биологически активные пищевые добавки, содержащие изолейцин. При этом необходимо соблюдать правильный баланс между изолейцином и двумя другими разветвленными аминокислотами BCAA - лейцином и валином.
Лейцин
Лейцин - незаменимая аминокислота, вместе с изолейцином и валином относящаяся к трем разветвленным аминокислотам BCAA . Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций.
Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. К пищевым источникам лейцина относятся бурый рис, бобы, мясо, орехи, соевая и пшеничная мука.
Биологически активные пищевые добавки, содержащие лейцин, применяются в комплексе с валином и изолейцином. Их следует принимать с осторожностью, чтобы не вызвать гипогликемии. Избыток лейцина может увеличить количество аммиака в организме.
Лизин
Лизин - незаменимая аминокислота, входящая в состав практически любых белков. Он необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых.
Эта аминокислота участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Лизин применяют в восстановительный период после операций и спортивных травм. Он также понижает уровень триглицеридов в сыворотке крови.
Лизин оказывает противовирусное действие, особенно в отношении вирусов, вызывающих герпес и острые респираторные инфекции. Прием добавок, содержащих лизин в комбинации с витамином С и биофлавоноидами, рекомендуется при вирусных заболеваниях.
Дефицит этой незаменимой аминокислоты может привести к анемии, кровоизлияниям в глазное яболко, ферментным нарушениям, раздражительности, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела, а также к нарушениям репродуктивной системы.
Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Метионин
 Метионин - незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Метионин - незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и на стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает дезинтоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Эту аминокислоту применяют в комплексной терапии ревматоидного артрита и токсикоза беременности. Метионин оказывает выраженное антиоксидантное действие, так как является хорошим источником серы, инактивирующей свободные радикалы. Его применяют при синдроме Жильбера, нарушениях функции печени. Метионин также необходим для синтеза нуклеиновых кислот, коллагена и многих других белков. Его полезно принимать женщинам, получающим оральные гормональные контрацептивы. Метионин понижает уровень гистамина в организме, что может быть полезно при шизофрении, когда количество гистамина повышено.
Метионин в организме переходит в цистеин, который является предшественником глютатиона. Это очень важно при отравлениях, когда требуется большое количество глютатиона для обезвреживания токсинов и защиты печени.
Пищевые источники метионина: бобовые, яйца, чеснок, чечевица, мясо, лук, соевые бобы, семена и йогурт.
Орнитин
Орнитин помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в дезинтоксикационных процессах и восстановлении печеночных клеток.
Орнитин в организме синтезируется из аргинина и, в свою очередь, служит предшественником для цитруллина, пролина, глютаминовой кислоты. Высокие концентрации орнитина обнаруживаются в коже и соединительной ткани, поэтому эта аминокислота способствует восстановлению поврежденных тканей.
Нельзя давать биологически активные пищевые добавки, содержащие орнитин, детям, беременным и кормящим матерям, а также лицам с шизофренией в анамнезе.
Фенилаланин
Фенилаланин - это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту - тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Его используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона и шизофрении.
Фенилаланин встречается в трех формах: L-фенилаланин (естественная форма и именно она входит в состав большинства белков человеческого тела), D-фенилаланин (синтетическая зеркальная форма, обладает анальгирующим действием), DL-фенилаланин (объединяет полезные свойства двух предыдущих форм, ее обычно применяют при предменструальном синдроме.
Биологически активные пищевые добавки, содержащие фенилаланин, не дают беременным женщинам, лицам с приступами беспокойства, диабетом, высоким артериальным давлением, фенилкетонурией, пигментной меланомой.
Пролин
Пролин улучшает состояние кожи, за счет увеличения продукции коллагена и уменьшения его потери с возрастом. Помогает в восстановлении хрящевых поверхностей суставов, укрепляет связки и сердечную мышцу. Для укрепления соединительной ткани пролин лучше применять в комбинации с витамином С.
Пролин поступает в организм преимущественно из мясных продуктов.
Серин
Серин необходим для нормального обмена жиров и жирных кислот, роста мышечной ткани и поддержания нормального состояния иммунной системы.
Серин синтезируется в организме из глицина. В качестве увлажняющего вещества входит в состав многих косметических продуктов и дерматологических препаратов.
Таурин
Таурин в высокой концентрации содержится в сердечной мышце, белых клетках крови, скелетной мускулатуре, центральной нервной системе. Он участвует в синтезе многих других аминокислот, а также входит в состав основного компонента желчи, которая необходима для переваривания жиров, абсорбции жирорастворимых витаминов и для поддержания нормального уровня холестерина в крови.
Поэтому таурин полезен при атеросклерозе, отеках, заболеваниях сердца, артериальной гипертонии и гипогликемии. Таурин необходим для нормального обмена натрия, калия, кальция и магния. Он предотвращает выведение калия из сердечной мышцы и потому способствует профилактике некоторых нарушений сердечного ритма. Таурин оказывает защитное действие на головной мозг, особенно при дегидратации. Его применяют при лечении беспокойства и возбуждения, эпилепсии, гиперактивности, судорог.
Биологически активные пищевые добавки с таурином дают детям с синдромом Дауна и мышечной дистрофией. В некоторых клиниках эту аминокислоту включают в комплексную терапию рака молочной железы. Избыточное выведение таурина из организма встречается при различных состояниях и нарушениях обмена.
 Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
Аритмии, нарушения процессов образования тромбоцитов, кандидозы, физический или эмоциональный стресс, заболевания кишечника, дефицит цинка и злоупотребление алкоголем приводят к дефициту таурина в организме. Злоупотребление алкоголем к тому же нарушает способность организма усваивать таурин.
При диабете увеличивается потребность организма в таурине, и наоборот, прием БАД, содержащих таурин и цистин, уменьшает потребность в инсулине. Таурин находится в яйцах, рыбе, мясе, молоке, но не встречается в белках растительного происхождения.
Он синтезируется в печени из цистеина и из метионина в других органах и тканях организма, при условии достаточного количества витамина В6. При генетических или метаболических нарушениях, мешающих синтезу таурина, необходим прием БАД с этой аминокислотой.
Треонин
Треонин - это незаменимая аминокислота, способствующая поддержанию нормального белкового обмена в организме. Она важна для синтеза коллагена и эластина, помогает работе печени и участвует в обмене жиров в комбинации с аспартовой кислотой и метионином.
Треонин находится в сердце, центральной нервной системе, скелетной мускулатуре и препятствует отложенную жиров в печени. Эта аминокислота стимулирует иммунитет, так как способствует продукции антител. Треонин очень в незначительных количествах содержится в зернах, поэтому у вегетарианцев чаще возникает дефицит этой аминокислоты.
Триптофан
Триптофан - это незаменимая аминокислота, необходимая для продукции ниацина. Он используется для синтеза в головном мозге серотонина, одного из важнейших нейромедиаторов. Триптофан применяют при бессоннице, депрессии и для стабилизации настроения.
Он помогает при синдроме гиперактивности у детей, используется при заболеваниях сердца, для контроля за массой тела, уменьшения аппетита, а также для увеличения выброса гормона роста. Помогает при мигренозных приступах, способствует уменьшению вредного воздействия никотина. Дефицит триптофана и магния может усиливать спазмы коронарных артерий.
К наиболее богатым пищевым источникам триптофана относятся бурый рис, деревенский сыр, мясо, арахис и соевый белок.
Тирозин
Тирозин является предшественником нейромедиаторов норэпинефрина и допамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза.
Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Поэтому неудивительно, что низкое содержание тирозина в плазме связано с гипотиреозом.
Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног.
 Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина - миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Биологически активные пищевые добавки с тирозином используют для снятия стресса, полагают, что они могут помочь при синдроме хронической усталости и нарколепсии. Их используют при тревоге, депрессии, аллергиях и головной боли, а также при отвыкании от лекарств. Тирозин может быть полезен при болезни Паркинсона. Естественные источники тирозина - миндаль, авокадо, бананы, молочные продукты, семечки тыквы и кунжут.
Тирозин может синтезироваться из фенилаланина в организме человека. БАД с фенилаланином лучше принимать перед сном или вместе с продуктами питания, содержащими большое количество углеводов.
На фоне лечения ингибиторами моноаминоксидазы (обычно их назначают при депрессии) следует практически полностью отказаться от продуктов, содержащих тирозин, и не принимать БАД с тирозином, так как это может привести к неожиданному и резкому подъему артериального давления.
Валин
Валин - незаменимая аминокислота, оказывающая стимулирующее действие, одна из аминокислот BCAA, поэтому может быть использована мышцами в качестве источника энергии. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме.
Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Его чрезмерно высокий уровень в организме может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Валин содержится в следующих пищевых продуктах: зерновые, мясо, грибы, молочные продукты, арахис, соевый белок.
Прием валина в виде пищевых добавок следует сбалансировать с приемом других разветвленных аминокислот BCAA - L-лейцина и L-изолейцина.