В зависимости от того, в каком состоянии соединения находятся в природе, они делятся на молекулярные и немолекулярные. В молекулярных веществах мельчайшими структурными частицами являются молекулы. Эти вещества имеют молекулярную кристаллическую решетку. В немолекулярных веществах мельчайшими структурными частицами являются атомы или ионы. Кристаллическая решетка у них атомная, ионная или металлическая.
Тип кристаллической решетки во многом определяет свойства веществ. Например, металлы, имеющие металлический тип кристаллической решетки , отличаются от всех остальных элементов высокой пластичностью, электро- и теплопроводностью . Эти свойства, а также и многие другие - ковкость, металлический блеск и т.п. обусловлены особым видом связи между атомами металла -- металлической связью. Необходимо отметить, что свойства, присущие металлам, проявляются только в конденсированном состоянии. Например, серебро в газообразном состоянии не обладает физическими свойствами металлов.
Особый тип связи в металлах - металлическая - обусловлен дефицитом валентных электронов, поэтому они общие для всей структуры металла. Наиболее простая модель строения металлов предполагала, что кристаллическая решетка металлов состоит из положительных ионов, окруженных свободными электронами, движение электронов происходит хаотически, подобно молекулам газа. Однако такая модель, качественно объясняя многие свойства металлов, при количественной проверке оказывается недостаточной. Дальнейшая разработка теории металлического состояния привела к созданию зонной теории металлов , которая основывается на представлениях квантовой механики.
В узлах кристаллической решетки находятся катионы и атомы металла, а электроны свободно перемещаются по кристаллической решетке .
Характерным механическим свойством металлов является пластичность , обусловленная особенностями внутреннего строения их кристаллов. Под пластичностью понимают способность тел под действием внешних сил подвергаться деформации, которая остается и после прекращения внешнего воздействия. Это свойство металлов позволяет придавать им различную форму при ковке, прокатывать металл в листы или вытягивать в проволоку.
Пластичность металлов обусловлена тем, что при внешнем воздействии слои ионов, образующих кристаллическую решетку, сдвигаются относительно друг друга без разрыва. Это происходит в результате того, что переместившиеся электроны благодаря свободному перераспределению продолжают осуществлять связь межу ионными слоями. При механическом воздействии на твердое вещество с атомной решеткой смещаются отдельные ее слои и сцепление между ними нарушается из-за разрыва ковалентных связей.
Если в узлах кристаллической решетки находятся ионы , то эти вещества образуют ионный тип кристаллической решетки .

Это соли, а также оксиды и гидроксиды типичных металлов. Это твердые, хрупкие вещества, но основное их качество: растворы и расплавы этих соединений проводят электрический ток .
Под химическим строением (структурой) понимается порядок взаимного расположения в пространстве атомов, составляющих молекулу, и типов химических связей между ними. Создатель теории строения органических соединений A.M. Бутлеров (1828–1886 гг.). Кратко главные положения теории Бутлерова можно сформулировать так:
1) химические свойства органических соединений определяются не столько составом, сколько их структурой;
2) различные атомы и группы атомов в органической молекуле оказывают взаимное влияние друг на друга;
3) химическая структура молекулы может быть представлена только одной формулой, которая выражает все химические свойства данного вещества.
1.4. Изомеры. Виды изомерии
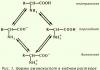
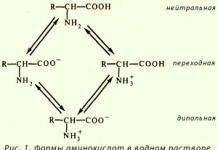
Изомерия – явление существования нескольких веществ одинакового элементного состава и молекулярной массы.
Изомеры – молекулы одинакового состава, но различной структуры и, соответственно, с различными свойствами.
Пример зависимости свойств веществ от их химического строения приведен в табл. 2.
Т а б л и ц а 2
Зависимость свойств от химического строения
У этих двух веществ-изомеров также резко различное биологическое действие на организмы.
Понятие «структура» включает три аспекта:
(А) Химическое строение – вид и порядок чередования атомов в молекуле;
(Б) Электронное строение – тип химических связей между атомами (–; =; );
(В) Пространственное строение – характер взаимного расположения атомов друг относительно друга в пространстве.
Соответственно, – три группы источников изомерии.
А) Различие химического строения:
Изомерия С-скелета
(а)
(б)


н -бутан

 изобутан
цикло–пентан метил-ц-бутан
изобутан
цикло–пентан метил-ц-бутан
Различное положение функциональных групп


OH [пропанол-1] OH [пропанол-2]
Различный вид функциональных групп (метамерия)
изомеры




кислота] аминоэтановой кислоты]
См. также пример из табл. 2.
Б) Различие электронного строения:
Различный вид и положение кратных связей
(изомеры


[бутадиен-1,3] [бутин-1] [бутин-2]
Обычные структурные формулы отражают только эти два (А и Б) аспекта структуры молекул.
В) ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (или стереоизомерия):
Такие изомеры имеют одинаковый порядок связи между атомами, но различаются по пространственному расположению входящих в их состав атомов или групп атомов. Для показа пространственной структуры используют спецприемы.
Сюда относятся:
(5) Цис-транс-Изомерия – различное расположение атомов относительно двойной связи (а) или плоскости цикла (б):
Пример (а) – стереоизомеры бутен-2:


[цис-Бутен-2] [транс-Бутен-2]
Пример (б) – стереоизомеры :

цис-форма транс-форма
(6) Оптическая (зеркальная) изомерия
Это явление обусловлено наличием в молекулах асимметрических атомов углерода; рассматривается в разделах «Оксикислоты» и «Углеводы».
(7) Конформационная изомерия
Для большинства веществ характерна способность в зависимости от условий находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном.
Например, вода при нормальном давлении в интервале температур 0-100 o C является жидкостью, при температуре выше 100 о С способна существовать только в газообразном состоянии, а при температуре менее 0 о С представляет собой твердое вещество.
Вещества в твердом состоянии различают аморфные и кристаллические.
Характерными признаками аморфных веществ является отсутствие четкой температуры плавления: их текучесть плавно увеличивается с ростом температуры. К аморфным веществам относятся такие соединения, как воск, парафин, большинство пластмасс, стекло и т.д.
Все же кристаллические вещества обладают конкретной температурой плавления, т.е. вещество с кристаллическим строением переходит из твердого состоянии в жидкое не постепенно, а резко, при достижении конкретной температуры. В качестве примера кристаллических веществ можно привести поваренную соль, сахар, лед.
Разница в физических свойствах аморфных и кристаллических твердых веществ обусловлена прежде всего особенностями строения таких веществ. В чем заключается разница между веществом в аморфном и кристаллическом состоянии, проще всего понять из следующей иллюстрации:
Как можно заметить, в аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкорасположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки .
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки .
В узлах молекулярной кристаллической решетки
Кристаллическая решетка льда как пример молекулярной решеткинаходятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях. Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H 2 , O 2 , Cl 2 , ромбическая сера S 8 , белый фосфор P 4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
Кристаллическая решетка алмаза как пример атомной решеткиВ узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO 2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой
в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток.
К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH 4 +), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
 Кристаллическая решетка хлорида натрия как пример ионной решетки
Кристаллическая решетка хлорида натрия как пример ионной решетки
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Такие особенности строения приводят к тому, что металлы хорошо проводят тепло и электрический ток, часто обладают высокой пластичностью (ковкостью).
Разброс значений температур плавления металлов очень велик. Так, например, температура плавления ртути составляет примерно минус 39 о С (жидкая в обычных условиях), а вольфрама — 3422 °C. Следует отметить, что в обычных условиях все металлы, кроме ртути, являются твердыми веществами.
Тест А6 Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения. 1. Кристаллическая решетка хлорида кальция 1) ионная 2)молекулярная 3) металлическая 4) атомная 2. Молекулярное строение имеет 1) ртуть 2) бром 3) гидроксид натрия 4) сульфат калия 3. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 4. Вещества, обладающие твёрдостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку: 1) молекулярную 2) атомную 3) ионную 4) металлическую 5. Молекулярную кристаллическую решетку имеет 1) НВr 2) K2О 3) ВаО 4) КСl 6. Вещества с атомной кристаллической решеткой 1) очень твёрдые и тугоплавкие 2) хрупкие и легкоплавкие 3) проводят электрический ток в растворах 4) проводят электрический ток в расплавах. 7. Молекулярную кристаллическую решетку имеет 1) Са3Р2 2) СО2 3) SO2 4) АlF3 8. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V) 9. Кристаллическая решетка графита 1) ионная 2) молекулярная 3) атомная 4) металлическая 10. Вещества, обладающие твердостью, тугоплавкостью, хорошей растворимостью в воде, как правило, имеют кристаллическую решетку 1) молекулярную 2) ионную 3) атомную 4) металлическую 11. Молекулярную кристаллическую решетку имеет 1) кремний 2) оксид углерода(IV) 3) диоксид кремния 4) нитрат аммония 12. Кристаллическая решетка галогенов 1) атомная 2) ионная 3) молекулярная 4) металлическая 13. К веществам с атомной кристаллической решеткой относятся 1) натрий, фтор, оксид серы (IV) 2) свинец, азотная кислота, оксид магния 3) бор, алмаз, карбид кремния 4) хлорид калия, белый фосфор, йод 14. Молекулярное строение имеет 1) цинк 2) нитрат бария 3) гидроксид калия 4) бромоводород 15. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную 16. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия 17. Немолекулярное строение имеют все неметаллы группы 1) углерод, бор, кремний 3) кислород, сера, азот 2) фтор, бром, иод 4) хлор, фосфор, селен 18. Кристаллическую структуру, подобную структуре алмаза, имеет 1) кремнезем 2) оксид натрия 3) оксид углерода (II) 4) белый фосфор Р4 19. Атом является структурной частицей в кристаллической решетке 1) метана 2) водорода 3) кислорода 4) кремния 20. Молекулярную кристаллическую решетку имеет каждое из двух веществ 1) графит и алмаз 2) кремний и йод 3) хлор и оксид углерода(IV) 4) хлорид бария и оксид бария 21. Атомную кристаллическую решетку имеет каждое из двух веществ 1) оксид кремния (IV) и оксид углерода (IV) 2) графит и кремний 3) хлорид калия и фторид натрия 4) хлор и йод 22. Молекулярное строение имеет 1) натрий 2) фруктоза 3) фосфат натрия 4) оксид натрия 23. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду 1) хлорид калия, азот, метан 2) иод, диоксид углерода, озон 3) алюминий, бром, алмаз 4) водород, сульфат магния, оксид железа (III) 24. Оксид кремния тугоплавок, нерастворим в воде. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 25. В зависимости от характера частиц, образующих кристалл, и от природы сил взаимодействия между ними различают четыре типа кристаллических решеток: 1) ионные, атомные, молекулярные и металлические 2) ионные, ковалентные, атомные и молекулярные 3) металлические, ковалентные, атомные и молекулярные 4) ионные, кубические, треугольные и слоистые 26. Кристаллическая решетка льда: 1) атомная 2) молекулярная 3) ионная 4) металлическая 27. Укажите вещество, которое в твердом состоянии имеет молекулярную кристаллическую решетку. 1) графит 2) натрий 3) гидроксид натрия 4) водород 28. Укажите вещество, которое в твердом состоянии имеет атомную кристаллическую решетку: 1) хлороводород 2) хлор 3) оксид кремния (IV) 4) оксид кальция 29. Для твердых веществ с металлической кристаллической решеткой характерна высокая... 1) растворимость в воде 2) электроотрицательность атомов 3) летучесть 4) электропроводность 30. Кристаллическое вещество образовано частицами Na+ и ОН-. К какому типу принадлежит кристаллическая решетка этого вещества? 1) атомная 2) молекулярная 3) ионная 4) металлическая 31. Немолекулярное строение имеет каждое из двух веществ: 1) S8 и O2 2) Fe и NaCl 3) CO и Mg 4) Na2CO3 и I2 32. Веществом молекулярного строения является 1) озон 2) оксид бария 3) графит 4) сульфид калия 33. Атомная кристаллическая решетка у простого вещества: 1) алмаз 2) медь 3) фтор 4) олово 34. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для 1) алмаза 2) поваренной соли 3) кремния 4) азота 35. Ионную кристаллическую решетку имеет 1) вода 2) фторид натрия 3) серебро 4) бром 36. Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами 1) малых периодов 3) побочных подгрупп 2) главных подгрупп 4) больших периодов 37. Кристаллическую структуру, подобную структуре алмаза, имеет: 1) кремнезем SiO2 2) оксид натрия Na2O 3) оксид углерода(II) CO 4) белый фосфор Р4 38. Фосфин РН3 - это газ. Его кристаллическая решётка 1) атомная 2) молекулярная 3) ионная 4) металлическая 39. Из молекул состоят кристаллы. 1) сахара 2) соли 3) алмаза 4) серебра 40. Из разноимённо заряженных ионов состоят кристаллы 1) сахара 2) гидроксида натрия 3) алмаза 4) серебра 41. Какие частицы образуют кристалл нитрата натрия? 1) атомы Nа, N и О 3) ионы Nа+, NO3+ 5+ 22) ионы Nа, N ,О 4) молекулы NаNО3 42. Оцените правильность суждений о связи между строением и свойствами вещества. А. Среди веществ молекулярного строения есть газообразные, жидкие и твёрдые при обычных условиях. Б. Вещества с атомной кристаллической решеткой при обычных условиях твёрдые. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 43. Оцените правильность суждений о связи между строением и свойствами вещества: А. Если между частицами в кристалле прочная химическая связь, то вещество тугоплавко. Б. Все твёрдые вещества имеют немолекулярное строение 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 44. Какие из приведенных утверждений верны: А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность. Б. Вещества с атомной решеткой пластичны и обладают высокой электропроводностью. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 45. Установите соответствие между веществом и типом его кристаллической решетки. ВЕЩЕСТВО ТИП КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ 1) поваренная соль А) молекулярная 2) серебро Б) ионная 3) углекислый газ В) атомная 4) графит Г) металлическая 5) глюкоза 46. Установите соответствие между типом кристаллической решетки и свойствами веществ. ТИП КРИСТАЛЛИЧЕСКОЙ СВОЙСТВА ВЕЩЕСТВ РЕШЕТКИ A) ионная 1) твердые, тугоплавкие, не растворяются в воде Б) металлическая 2) хрупкие, легкоплавкие, не проводят электрический ток В) атомная 3) пластичные, имеют различные температуры плавления, проводят электрический ток Г) молекулярная 4) твердые, тугоплавкие, хорошо растворяются в воде 47. Укажите ряд, характеризующийся уменьшением длины химической связи 1) SiCl4, MgCl2, AlCl3, NaCl 2) NaCl, MgCl2, SiCl4, AlCl3 3) NaCl, SiCl4, MgCl2, AlCl3 4) NaCl, MgCl2, AlCl3, SiCl4 48. Оцените правильность суждений о связи между строением и свойствами вещества. А. Если между частицами в кристалле прочная химическая связь, то вещество легко испаряется. Б. Все газы имеют молекулярное строение. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Лекция 7Зависимость свойств веществ от их
строения. Химическая связь. Основные
виды химической связи.
Рассматриваемые вопросы:
1. Уровни организации вещества. Иерархия структуры.
2. Вещества молекулярного и немолекулярного строения.
3.
4. Причины возникновения химической связи.
5. Ковалентная связь: механизмы образования, способы
перекрывания атомных орбиталей, полярность, дипольный момент
молекулы.
6. Ионная связь.
7. Сравнение ковалентной полярной и ионной связи.
8. Сравнение свойств веществ с ковалентными полярными и
ионными связями.
9. Металлическая связь.
10. Межмолекулярные взаимодействия.Вещество (более 70 млн.)
Что надо знать о каждом веществе?
Формула (из чего состоит)
Структура (как устроено)
Физические свойства
Химические свойства
Способы получения
(лаб. и промышл.)
6. Практическое применение
1.
2.
3.
4.
5.Иерархия структуры вещества
Все вещества
состоят из
атомов, но не
все – из
молекул.
Атом
Молекула
У всех веществ
Только у веществ
молекулярного
строения
Наноуровень
У всех веществ
Объемный (макро)
уровень
У всех веществ
Все 4 уровня – объект изучения химииВещества молекулярного
и немолекулярного строенияВещества
Молекулярного
строения
Немолекулярного
строения
Состоят из молекул
Состоят из атомов
или ионов
H2O, CO2, HNO3, C60,
почти все орг. вещества
Алмаз, графит, SiO2,
металлы, соли
Формула отражает
состав молекулы
Формула отражает состав
формульной единицыВещества
Хлорид натрия
Формульная единица NaClВещества
Диоксид кремния
Формульная единица SiO2
Минералогический музей имени Ферсмана находится возле входа в Нескучный сад.
Адрес: Москва, Ленинский проспект, дом 18, корпус 2.Разнообразие химических структур.
пропеллан
C5H6
коронен
(супербензол)
C24H12
кавитанд
C36H32O8Разнообразие химических структур.
катенанРазнообразие химических структур.
катенанРазнообразие химических структур.
лист МебиусаМолекула
Молекула – устойчивая система, состоящая из нескольких
атомных ядер и электронов.
Атомы объединяются в молекулы путем образования
химических связей.
Главная движущая сила образования молекулы из
атомов – уменьшение общей энергии.
Молекулы имеют геометрическую форму, характеризующуюся
расстояниями между ядрами и углами между связями.Главная движущая сила
образования химической связи
между частицами вещества –
уменьшение общей энергии
системы.Основные типы химической
связи:
1.Ионная
2.Ковалентная
3.Металлическая
Основные межмолекулярные
взаимодействия:
1.Водородные связи
2.Ван-дер-Ваальсовы связиИонная связь
Если связь образуют атомы с резко различающимися
значениями электроотрицательности (ΔОЭО ≥ 1,7),
общая электронная пара практически полностью
смещается в сторону более электроотрицательного
атома.
Na Cl
ОЭО 0,9 3,16
∆ 2,26
+Na
Анион
:ClКатион
Химическая связь между ионами, возникающая за
счет их электростатического притяжения,
называется ионной.Ионная связь
Кулоновский потенциал сферически
симметричен, направлен во все стороны,
поэтому ионная связь ненаправлена.
Кулоновский потенциал не имеет
ограничений на количество
присоединяемых противоионов -
следовательно, ионная связь
ненасыщаема.Ионная связь
Соединения с ионным типом связи
твердые, хорошо растворимые в
полярных растворителях, имеют высокие
температуры плавления и кипения.Ионная связь
Кривая I: притяжение ионов, если
бы они представляли собой
точечные заряды.
Кривая II: отталкивание ядер в
случае сильного сближения ионов.
Кривая III: минимум энергии Е0 на
кривой соответствует
равновесному состоянию ионной
пары, при котором силы
притяжения электронов к ядрам
скомпенсированы силами
отталкивания ядер между собой на
расстоянии r0,Химическая связь в молекулах
Химическую связь в молекулах можно описать с
позиций двух методов:
- метода валентных связей, МВС
- метода молекулярных орбиталей, ММОМетод валентных связей
Теория Гейтлера-Лондона
Основные положения метода ВС:
1. Связь образуют два электрона с противоположными
спинами, при этом происходит перекрывание волновых
функций и увеличивается электронная плотность между
ядрами.
2. Связь локализована в направлении максимального
перекрывания Ψ-функций электронов. Чем сильнее
перекрывание, тем прочнее связь.
dсв - длина
связи;
Есв - энергия
связи.Образование молекулы водорода:
Н· + ·Н → Н:Н
При сближении двух атомов
возникают силы притяжения и
отталкивания:
1) притяжения: «электрон-ядро»
соседних атомов;
2) отталкивания: «ядро-ядро»,
«электрон-электрон» соседних
атомов.Образование молекулы водорода:
Молекулярное
двухэлектронное облако,
обладающее максимальной
электронной плотностью.Химическая связь, осуществляемая общими
электронными парами, называется ковалентной.
Общая электронная пара может образоваться двумя
способами:
1) в результате объединения двух непарных электронов:
2) в результате обобществления неподеленной
электронной пары одного атома (донора) и пустой
орбитали другого (акцептора).
Два механизма образования ковалентной связи:
обменный и донорно-акцепторный.
плотности связи происходит по линии,
соединяющей центры атомов (ядра), то такое
перекрывание называется σ-связью:Способы перекрывания атомных орбиталей при
образовании ковалентной связи
Если образование максимальной электронной
плотности связи происходит по обе стороны
линии, соединяющей центры атомов (ядра), то
такое перекрывание называется π-связью:Полярная и неполярная ковалентная связь
1) Если связь образуют одинаковые атомы,
двухэлектронное облако связи распределяется в
пространстве симметрично между их ядрами - такая
связь называется неполярной: H2, Cl2, N2.
2) если связь образуют разные атомы, облако связи
смещено в сторону более электроотрицательного атома
- такая связь называется полярной: HCl, NH3, CO2.Полярная ковалентная связь
Дипольный момент связи
Диполь
H+δCl-δ или H+0,18Cl-0,18
Где ±δ - эффективный
заряд атома, доля
абсолютного заряда
электрона.
+δ
-δ
Не путать со степенью окисления!
l
Произведение эффективного заряда на длину диполя
называется электрическим моментом диполя: μ = δl
Это векторная величина: направлен от положительного
заряда к отрицательному.Полярная ковалентная связь
Дипольный момент молекулы
Дипольный момент молекулы равен сумме
векторов дипольных моментов связей с учетом
неподеленных электронных пар.
Единицей измерения дипольного момента
является Дебай: 1D = 3,3·10-30 Кл·м.Полярная ковалентная связь
Дипольный момент молекулы
В произведении μ = δl обе величины разнонаправлены.
Поэтому надо внимательно отслеживать причину
изменения μ.
Например,
CsF
CsCl
24
31
δ «проиграл» l
CsI
HF
HCl
HBr
HI
37
5,73
3,24
2,97
1,14
наоборотПолярная ковалентная связь
Дипольный момент молекулы
Может ли молекула быть неполярной, если
все связи в ней полярные?
Молекулы типа АВ всегда полярны.
Молекулы типа АВ2 могут быть и полярными, и
неполярными...
Н2О
О
Н
СО2
μ>0
Н
О
С
μ=0
ОПолярная ковалентная связь
Молекулы, состоящие из трех атомов и более
(АВ2, АВ3, АВ4, АВ5, АВ6) ,
могут быть неполярными, если они симметричны.
На что влияет наличие дипольного момента
молекулы?
Имеются межмолекулярные взаимодействия, а,
следовательно, увеличиваются плотность вещества,
t°плавления и t°кипения.Сравнение ионной и ковалентной полярной связей
Общее: образование общей
электронной пары.
Отличие: степень
смещения общей
электронной пары
(поляризация связи).
Ионную связь следует рассматривать как крайний
случай ковалентной полярной связи.
полярной связей
Ковалентная связь: насыщена и направлена
Насыщаемость (максимальная валентность) -
определяется способностью атома образовывать
ограниченное количество связей (с учетом обоих
механизмов образования).
Направление связи задает валентный угол, зависящий от
типа гибридизации орбиталей центрального атома.
Ионная связь: ненасыщена и ненаправлена.Сравнение характеристик ионной и ковалентной
полярной связей
Направленность связи задают валентные углы.
Валентные углы определяют экспериментально или
предсказывают на основе теории гибридизации
атомных орбиталей Л. Поллинга либо теории
Гиллеспи.
Подробно об этом на семинарах.
ковалентными связями
Ковалентные связи
Атомные кристаллы
Между атомами
в самом кристалле
Высокая твердость
высокие tºплав, tºкип
плохие тепло- и
электропроводность
Молекулярные кристаллы
Между атомами
в молекуле
Умеренная мягкость
достаточно низкие
tºплав, tºкип
плохие тепло- и
Электропроводность
Нерастворимы в водеСравнение свойств веществ с ионными и
ковалентными связями
Молекулярный кристалл
Температура плавления 112,85 °ССравнение свойств веществ с ионными и
ковалентными связями
Атомный ковалентный кристалл
Температура плавления ≈ 3700 °ССравнение свойств веществ с ионными и
ковалентными связями
Ионные связи
между ионами
в кристалле
твердость и хрупкость
высокая температура плавления
плохие тепло- и электропроводность
Растворимы в водеСравнение свойств веществ с ионными и
ковалентными связями
Ионный кристалл
Температура плавления ≈ 800 °СМеталлическая связь
Металлическая связь осуществляется электронами,
принадлежащими всем атомам одновременно.
Электронная плотность
делокализована «электронный газ».
Характерный
металлический блеск
Пластичность
Ковкость
Высокие тепло- и
электропроводность
Температуры плавления
очень разные.Межмолекулярные связи.
1. Водородная связь
Притяжение между атомом водорода (+) одной
молекулы и атомом F, O, N (–) другой молекулы
F
F
H
H
H
H
F
F
O
H3C
H
F
C
H
Полимер
(HF)n
O
C
O
H
CH3
Димер
уксусной кислоты
O
Водородные связи слабы индивидуально,
но сильны коллективноМежмолекулярные связи.
2. Водородная связь в ДНКМежмолекулярные связи.
3. Водородные связи в воде
жидкая вода
ледМежмолекулярные связи.
4. Образование водородных связей в
воде
жидкая вода
превращение
воды в ледМежмолекулярные связи.
5. Ван-дер-ваальсовы связи
Даже если между молекулами нет водородных связей,
молекулы всегда притягиваются друг к другу.
Притяжение между молекулярными диполями называют вандер-ваальсовой связью.
В-д-в притяжение тем сильнее, чем больше:
1) полярность; 2) размер молекул.
Пример: метан (CH4) – газ, бензол (C6H6) – жидкость
Одна из самых слабых в-д-в связей – между молекулами
H2 (т. пл. –259 оС, т. кип. –253 оС).
Взаимодействие между молекулами во много раз слабее связи между атомами:
Eков(Cl–Cl) = 244 кДж/моль, Eвдв(Cl2–Cl2) = 25 кДж/моль
но именно оно обеспечивает существование жидкого и твердого состояния веществаВ лекции использованы материалы профессора
химического факультета МГУ им. Ломоносова
Еремина Вадима Владимировича
Спасибо
за внимание!