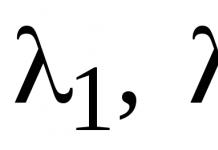Которые в своем составе содержат одну или несколько гидроксильных группу. В зависимости от количества групп ОН эти делятся на одноатомные спирты, трехатомные и т.д. Чаще всего эти сложные вещества рассматривают как производные углеводородов, молекулы которых претерпели изменения, т.к. один или несколько атомов водорода заместились на гидроксильную группу.
Наиболее простыми представителями данного класса являются одноатомные спирты, общая формула которых выглядит так: R-OH или

Cn+ H 2n+1OH.
- Спирты, содержащие до 15 атомов углерода - жидкости, 15 и более - твердые вещества.
- Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней.
- Температура кипения также возрастает с увеличением атомной массы, например, t кип. СН3ОН= 65 °С, а t кип. С2Н5ОН =78 °С.
- Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется.
Данные физические свойства насыщенных спиртов с одной гидроксильной группой можно объяснить возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды.
Одноатомные спирты способны вступать в такие химические реакции:

Рассмотрев химические свойства алкоголей, можно сделать вывод, что одноатомные спирты - это амфотерные соединения, т.к. они могут реагировать с щелочными металлами, проявляя слабые и с галогенводородами, проявляя основные свойства. Все химические реакции идут с разрывом связи О-Н или С-О.
Таким образом, предельные одноатомные спирты - это сложные соединения с одной группой ОН, не имеющие свободных валентностей после образования связи С-С и проявляющие слабо свойства и кислот, и оснований. За счет своих физических и химических свойств они нашли широкое применение в органическом синтезе, в производстве растворителей, добавок к топливу, а также в пищевой промышленности, медицине, косметологии (этанол).
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп -ОН), соединенных с углеводородным радикалом.
Классификация спиртов
По числу гидроксильных групп (атомности) спирты делятся на:
Одноатомные
, например:![]()
Двухатомные
(гликоли), например:
Трехатомные
, например:
По характеру углеводородного радикала выделяют следующие спирты:
Предельные
, содержащие в молекуле лишь предельные углеводородные радикалы, например:

Непредельные , содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
![]()
Ароматические , т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:

Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
Например:

Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)

Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:


В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:

Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:

Давайте дадим название спирту, формула которого указана ниже:

Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов-метанол,имея относительную молекулярную массу 32, в обычных условиях-жидкость.

Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C 12 H 25 OH) при комнатной температуре-твердые вещества. Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами.
Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)

- Взаимодействие спиртов с галогеноводородами.
Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима. - Межмолекулярная дегидратация
спиртов-
отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир. - Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров(реакция этерификации)
Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов
происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
- Окисление спиртов
обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
 При окислении вторичных спиртов образуются кетоны:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. - Дегидрирование спиртов.
При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные - в кетоны:


- Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.

Получение спиртов:

Применение спиртов
Метанол (метиловый спирт СН 3 ОН) - бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола - древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy - вино, опьянеть; hule - вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С 2 Н 5 ОН) - бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды. Для получения безводного этанола - «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт - важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме - ацетальдегид - крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью - циррозу печени.
Этандиол-1,2 (этиленгликоль) - бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей - антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) - вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
ОПРЕДЕЛЕНИЕ
Спирты – соединения, содержащие одну или несколько гидроксильных групп –ОН, связанных с углеводородным радикалом.
Общая формула гомологического ряда предельных одноатомных спиртов C n H 2 n +1 OH . В названии спиртов присутствует суффикс – ол.
В зависимости от числа гидроксильных групп спирты делят на одно- (CH 3 OH — метанол, C 2 H 5 OH — этанол), двух- (CH 2 (OH)-CH 2 -OH — этиленгликоль) и трехатомные (CH 2 (OH)-CH(OH)-CH 2 -OH — глицерин). В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают первичные (R-CH 2 -OH), вторичные (R 2 CH-OH) и третичные спирты (R 3 C-OH).
Для предельных одноатомных спиртов характерна изомерия углеродного скелета (начиная с бутанола), а также изомерия положения гидроксильной группы (начиная с пропанола) и межклассовая изомерия с простыми эфирами.
СН 3 -СН 2 -СН 2 -СН 2 -ОН (бутанол – 1)
СН 3 -СН(СН 3)- СН 2 -ОН (2-метилпропанол – 1)
СН 3 -СН(ОН)-СН 2 -СН 3 (бутанол – 2)
СН 3 -СН 2 -О-СН 2 -СН 3 (диэтиловый эфир)
Химические свойства спиртов
1. Реакция, протекающие с разрывом связи О-Н:
— кислотные свойства спиртов выражены очень слабо. Спирты реагируют с щелочными металлами
2C 2 H 5 OH + 2K → 2C 2 H 5 OK + H 2
но не реагируют с щелочами. В присутствии воды алкоголяты полностью гидролизуются:
C 2 H 5 OK + Н 2 О → C 2 H 5 OH + KOH
Это означает, что спирты – более слабые кислоты, чем вода
— образование сложных эфиров под действием минеральных и органических кислот:
CH 3 -CO-OH + H-OCH 3 ↔ CH 3 COOCH 3 + H 2 O
— окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты.
R-CH 2 -OH + [O] → R-CH = O + [O] → R-COOH
Вторичные спирты окисляются в кетоны:
R-CH(OH)-R’ + [O] → R-C(R’) = O
Третичные спирты более устойчивы к окислению.
2. Реакция с разрывом связи С-О.
— внутримолекулярная дегидратация с образованием алкенов (происходит при сильном нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
CH 3 -CH 2 -CH 2 -OH → CH 3 -CH = CH 2 + H 2 O
— межмолекулярная дегидратация спиртов с образованием простых эфиров (происходит при слабом нагревании спиртов с водоотнимающими веществами (концентрированная серная кислота)):
2C 2 H 5 OH → C 2 H 5 -O-C 2 H 5 + H 2 O
— слабые основные свойства спиртов проявляются в обратимых реакциях с галогеноводородами:
C 2 H 5 OH + HBr →C 2 H 5 Br + H 2 O
Физические свойства спиртов
Низшие спирты (до С 15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в оде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.
Получение спиртов
Получение спиртов возможно с помощью биотехнологического (брожение) способа из древесины или сахара.
К лабораторным способам получения спиртов относятся:
— гидратация алкенов (реакция протекает при нагревании и в присутствии концентрированной серной кислоты)
СН 2 = СН 2 + Н 2 О → СН 3 ОН
— гидролиз алкилгалогенидов под действием водных растворов щелочей
СН 3 Br + NaOH → CH 3 OH + NaBr
СН 3 Br + Н 2 О → CH 3 OH + HBr
— восстановление карбонильных соединений
CH 3 -CH-O + 2[H] → CH 3 – CH 2 -OH
Примеры решения задач
ПРИМЕР 1
| Задание | Массовые доли углерода, водорода и кислорода в молекуле предельного одноатомного спирта 51,18, 13,04 и 31, 18%, соответственно. Выведите формулу спирта. |
| Решение |
Обозначим количество элементов, входящих в молекулу спирта индексами x, y, z. Тогда, формула спирта в общем виде будет выглядеть — С x H y O z .
Запишем соотношение: x:y:z = ω(С)/Ar(C): ω(Н)/Ar(Н) : ω(О)/Ar(О); x:y:z = 51,18/12: 13,04/1: 31,18/16; x:y:z = 4,208: 13,04: 1,949. Разделим получившиеся значения на наименьшее, т.е. на 1,949. Получим: x:y:z = 2: 6: 1. Следовательно, формула спирта – С 2 H 6 O 1 . Или C 2 H 5 OH – это этанол. |
| Ответ | Формула предельного одноатомного спирта — C 2 H 5 OH. |