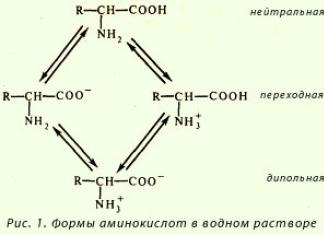
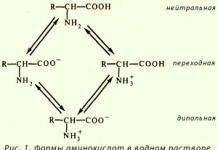
К p-элементам III-A группы относятся бор В алюминий Al и элементы семейства галлия – галлий Ga, индий In, таллий Tl.
К p-элементам III-A группы относятся бор В алюминий Al и элементы семейства галлия – галлий Ga, индий In, таллий Tl.
 С увеличением порядкового номера энергия ионизации атомов уменьшается, а металлические свойства элементов III-A группы, как и в других главных подгруппах заметно усиливаются. Так, оксид бора имеет кислотный характер, оксиды Al, галлия и индия амфотерны, причем их основные свойства постепенно усиливаются, а оксид таллия имеет основной характер.
С увеличением порядкового номера энергия ионизации атомов уменьшается, а металлические свойства элементов III-A группы, как и в других главных подгруппах заметно усиливаются. Так, оксид бора имеет кислотный характер, оксиды Al, галлия и индия амфотерны, причем их основные свойства постепенно усиливаются, а оксид таллия имеет основной характер.
 Бор – неметалл, таллий – типичный элемент металл. Металлические свойства этих элементов выражены слабее, чем соответствующих главных подгрупп (IIA и особенно IA групп). Неметалличность бора отвечает его положению в периодической системе между бериллием и углеродом и по диагонали рядом с кремнием, поэтому у бора проявляются сходства не только с Al, но и с кремнием.
Бор – неметалл, таллий – типичный элемент металл. Металлические свойства этих элементов выражены слабее, чем соответствующих главных подгрупп (IIA и особенно IA групп). Неметалличность бора отвечает его положению в периодической системе между бериллием и углеродом и по диагонали рядом с кремнием, поэтому у бора проявляются сходства не только с Al, но и с кремнием.
 Степени окисления: +3, -3, +1, -1. Для таллия наиболее устойчивы соединения, где степень окисления равна +1. Электронные формулы B, Al, Ga, In, и Tl В – 2 s 22 p 1 Al – 3 s 23 p 1 Ga – 4 s 23 d 104 p 1 In – 5 s 24 d 105 p 1 Tl – 6 s 24 f 145 d 106 p 1
Степени окисления: +3, -3, +1, -1. Для таллия наиболее устойчивы соединения, где степень окисления равна +1. Электронные формулы B, Al, Ga, In, и Tl В – 2 s 22 p 1 Al – 3 s 23 p 1 Ga – 4 s 23 d 104 p 1 In – 5 s 24 d 105 p 1 Tl – 6 s 24 f 145 d 106 p 1
 История открытия и получения бора. Название элемента появилось за тысячу лет до его открытия, во времена алхимии так называли буру. Первое сообщение о получении бора было сделано в 1808 г. сразу двумя учеными в двух страна: Гей-Люссаком во Франции и Гемфри Дэви в Англии. Полученные продукты были так непохожи, что казались различными веществами.
История открытия и получения бора. Название элемента появилось за тысячу лет до его открытия, во времена алхимии так называли буру. Первое сообщение о получении бора было сделано в 1808 г. сразу двумя учеными в двух страна: Гей-Люссаком во Франции и Гемфри Дэви в Англии. Полученные продукты были так непохожи, что казались различными веществами.
 Позже в 1856 году химики А. Девиль и Ф. Велер выяснили, что бор может существовать в двух различных модификациях: кристаллической и аморфной. И та, и другая модификации могут быть получены действием активных металлов на соединения бора: t B 2 O 3 + 2 Al → Al 2 O 3 + 2 Bкристаллический H 3 BO 3 + 3 Na → 3 Na. OH + Bаморфный
Позже в 1856 году химики А. Девиль и Ф. Велер выяснили, что бор может существовать в двух различных модификациях: кристаллической и аморфной. И та, и другая модификации могут быть получены действием активных металлов на соединения бора: t B 2 O 3 + 2 Al → Al 2 O 3 + 2 Bкристаллический H 3 BO 3 + 3 Na → 3 Na. OH + Bаморфный
 Споры о свойствах бора в чистом состоянии не затихали примерно 100 лет после первого его выделения. В 1892 г. французский ученый Анри Муассон, проверяя работы Гей. Люссака, Деви, Велера, установил, что полученные ими вещества содержали лишь 70% бора. Чистый бор был получен в 1908 г. восстановлением хлорида бора в электрической дуге: t 2 BCl 3 + 3 H 2 → 2 B + 6 HCl
Споры о свойствах бора в чистом состоянии не затихали примерно 100 лет после первого его выделения. В 1892 г. французский ученый Анри Муассон, проверяя работы Гей. Люссака, Деви, Велера, установил, что полученные ими вещества содержали лишь 70% бора. Чистый бор был получен в 1908 г. восстановлением хлорида бора в электрической дуге: t 2 BCl 3 + 3 H 2 → 2 B + 6 HCl
 В настоящее время Bкристаллический получают аналогично восстановлением галогенидов водородом: t 2 BBr 3 + 3 H 2 → 2 B + 6 HBr
В настоящее время Bкристаллический получают аналогично восстановлением галогенидов водородом: t 2 BBr 3 + 3 H 2 → 2 B + 6 HBr
 Технический Bаморфный получают Mgтермическим восстановлением борного ангидрида, образующегося при термическом разложении борной кислоты. Методика была предложена А. Муассоном: t 2 H 3 BO 3 → B 2 O 3 + 3 H 2 O t 3 Mg + B 2 O 3 → 3 Mg. O + 2 B
Технический Bаморфный получают Mgтермическим восстановлением борного ангидрида, образующегося при термическом разложении борной кислоты. Методика была предложена А. Муассоном: t 2 H 3 BO 3 → B 2 O 3 + 3 H 2 O t 3 Mg + B 2 O 3 → 3 Mg. O + 2 B
 БОР. Содержание в земной коре составляет 3· 10 -4%. В свободном состоянии не встречается. Основные минералы: Na 2 B 4 O 7 · 10 H 2 O – бура H 3 BO 3 –борная кислота Аморфная форма бора – коричневая, кристаллическая – черная. Кристаллическая решетка бора прочна, по твердости уступает только алмазу.
БОР. Содержание в земной коре составляет 3· 10 -4%. В свободном состоянии не встречается. Основные минералы: Na 2 B 4 O 7 · 10 H 2 O – бура H 3 BO 3 –борная кислота Аморфная форма бора – коричневая, кристаллическая – черная. Кристаллическая решетка бора прочна, по твердости уступает только алмазу.
 Бор – первый p-элемент в периодической системе элементов. Строение электронной оболочки атома в невозбужденном состоянии: 2 p 2 s 1 s В возбужденном состоянии: 2 p 2 s 1 s
Бор – первый p-элемент в периодической системе элементов. Строение электронной оболочки атома в невозбужденном состоянии: 2 p 2 s 1 s В возбужденном состоянии: 2 p 2 s 1 s
 При комнатной температуре бор инертен и непосредственно взаимодействует со фтором, образуя BF 3, где имеет место sp 2 -гибридизация, орбитали расположены под углом 120º. При нагревании (400 -700 ºС) окисляется O 2, S, хлором и даже азотом (свыше 1200 ºС). С водородом бор не взаимодействует.
При комнатной температуре бор инертен и непосредственно взаимодействует со фтором, образуя BF 3, где имеет место sp 2 -гибридизация, орбитали расположены под углом 120º. При нагревании (400 -700 ºС) окисляется O 2, S, хлором и даже азотом (свыше 1200 ºС). С водородом бор не взаимодействует.
 В кислотах, не являющихся окислителями, бор не растворяется. Он взаимодействует при нагревании с конц. H 2 SO 4, HNO 3, с царской водкой. 2 B + 3 H 2 SO 4 (к) → 2 H 3 BO 3 + 3 SO 2 B + 3 HNO 3 (к) → H 3 BO 3 + 3 NO 2 Bкрист не реагирует с растворами щелочей. Bаморфн взаимодействует с их конц. растворами. 550° 2 B + 3 H 2 O B 2 O 3 + 3 H 2
В кислотах, не являющихся окислителями, бор не растворяется. Он взаимодействует при нагревании с конц. H 2 SO 4, HNO 3, с царской водкой. 2 B + 3 H 2 SO 4 (к) → 2 H 3 BO 3 + 3 SO 2 B + 3 HNO 3 (к) → H 3 BO 3 + 3 NO 2 Bкрист не реагирует с растворами щелочей. Bаморфн взаимодействует с их конц. растворами. 550° 2 B + 3 H 2 O B 2 O 3 + 3 H 2
 При нагревании бора с галогенами получаются галогениды: BF 3, BCl 3: газы BBr 3: жидкость BI 3: кристаллическое вещество Галогениды бора активно взаимодействуют с водой: BBr 3 + 3 HOH → H 3 BO 3 + 3 HBr
При нагревании бора с галогенами получаются галогениды: BF 3, BCl 3: газы BBr 3: жидкость BI 3: кристаллическое вещество Галогениды бора активно взаимодействуют с водой: BBr 3 + 3 HOH → H 3 BO 3 + 3 HBr
 Вещества, реагирующие необратимо с водой с образованием двух кислот, одна из которых галогеноводородная, называются галогеноангидридами. Таким образом, галогениды бора – это галогеноангидриды борной кислоты. При гидролизе стеклообразного сульфида бора: B 2 S 3 + 6 H 2 O → 2 H 3 BO 3 + 3 H 2 S
Вещества, реагирующие необратимо с водой с образованием двух кислот, одна из которых галогеноводородная, называются галогеноангидридами. Таким образом, галогениды бора – это галогеноангидриды борной кислоты. При гидролизе стеклообразного сульфида бора: B 2 S 3 + 6 H 2 O → 2 H 3 BO 3 + 3 H 2 S
 При нагревании бор взаимодействует со многими металлами, образуя бориды. Это кристаллические тугоплавкие вещества. Почти все бориды d-элементов характеризуются очень большими твердостью и тугоплавкостью, химической инертностью. Бориды s -элементов (Mg. B 2, Mg 3 B 2) реакционно способны: t 2 B + 3 Mg → Mg 3 B 2
При нагревании бор взаимодействует со многими металлами, образуя бориды. Это кристаллические тугоплавкие вещества. Почти все бориды d-элементов характеризуются очень большими твердостью и тугоплавкостью, химической инертностью. Бориды s -элементов (Mg. B 2, Mg 3 B 2) реакционно способны: t 2 B + 3 Mg → Mg 3 B 2
 Большинство металлов в зависимости от условий синтеза образуют бориды различного состава. При действии разбавленной HCl на борид Mg получают гидрид бора (бороводород или боран): 6 Mg. B 2 + 12 HCl → H 2 + B 4 H 10 + 6 Mg. Cl 2 + 8 B Mg 3 B 2 + 6 H 2 O → B 2 H 6 + 3 Mg(OH)2
Большинство металлов в зависимости от условий синтеза образуют бориды различного состава. При действии разбавленной HCl на борид Mg получают гидрид бора (бороводород или боран): 6 Mg. B 2 + 12 HCl → H 2 + B 4 H 10 + 6 Mg. Cl 2 + 8 B Mg 3 B 2 + 6 H 2 O → B 2 H 6 + 3 Mg(OH)2
 Простейшие водородные соединения бора – BH 3 в обычных условиях не существует. Из выделенных в свободном состоянии гидридов бора состава Bn. Hn+4 и Bn. Hn+6 простейшими являются: B 2 H 6, B 4 H 10 – газы B 6 H 12 – жидкость B 10 H 14 – твердое вещество Имеют отвратительный запах и ядовиты.
Простейшие водородные соединения бора – BH 3 в обычных условиях не существует. Из выделенных в свободном состоянии гидридов бора состава Bn. Hn+4 и Bn. Hn+6 простейшими являются: B 2 H 6, B 4 H 10 – газы B 6 H 12 – жидкость B 10 H 14 – твердое вещество Имеют отвратительный запах и ядовиты.
 H H Бороводороды – соединения с дефицитом электронов. Например: H H в B 2 H 6 общее число валентных электронов B B H H равно 12, т. е. их не хватает для образования восьми обычных двух электронных двухцентровых связей.
H H Бороводороды – соединения с дефицитом электронов. Например: H H в B 2 H 6 общее число валентных электронов B B H H равно 12, т. е. их не хватает для образования восьми обычных двух электронных двухцентровых связей.
 В диборане имеют место двухцентровые и трехцентровые связи. Две концевые BH 2 лежат в одной плоскости, а атомы водорода и бора связаны двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровой двухэлектронной связью.
В диборане имеют место двухцентровые и трехцентровые связи. Две концевые BH 2 лежат в одной плоскости, а атомы водорода и бора связаны двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровой двухэлектронной связью.
 Она возникает в результате перекрывания двух sp 2 -гибридных орбиталей бора и 1 s-орбитали атома H, что и обеспечивает прочность молекулы B 2 H 6. Диборан B 2 H 6 – энергичный восстановитель, на воздухе он самовоспламеняется: B 2 H 6 + 3 O 2 → B 2 O 3 + 3 H 2 O
Она возникает в результате перекрывания двух sp 2 -гибридных орбиталей бора и 1 s-орбитали атома H, что и обеспечивает прочность молекулы B 2 H 6. Диборан B 2 H 6 – энергичный восстановитель, на воздухе он самовоспламеняется: B 2 H 6 + 3 O 2 → B 2 O 3 + 3 H 2 O
 Гидриды бора разлагаются водой, спиртами, щелочами с выделением водорода B 2 H 6 + 6 H 2 O → 2 H 3 BO 3 + 3 H 2 В среде эфира B 2 H 6 взаимодействует с Li. H, образуя анионные комплексы B 2 H 6 + 2 Li. H → 2 Li тетрагидридоборат(III) лития или боронат лития
Гидриды бора разлагаются водой, спиртами, щелочами с выделением водорода B 2 H 6 + 6 H 2 O → 2 H 3 BO 3 + 3 H 2 В среде эфира B 2 H 6 взаимодействует с Li. H, образуя анионные комплексы B 2 H 6 + 2 Li. H → 2 Li тетрагидридоборат(III) лития или боронат лития
 Борогидриды лития и натрия используют в органических синтезах как сильные восстановители. Чаще используют Na – белое кристаллическое вещество, получают: 4 Na. H + B(OCH 3)3 → Na + 3 CH 3 ONa B(OCH 3)3 – метиловый эфир ортоборной кислоты Na – боронат натрия
Борогидриды лития и натрия используют в органических синтезах как сильные восстановители. Чаще используют Na – белое кристаллическое вещество, получают: 4 Na. H + B(OCH 3)3 → Na + 3 CH 3 ONa B(OCH 3)3 – метиловый эфир ортоборной кислоты Na – боронат натрия
 Тетрафторобораты очень разнообразны, хорошо растворимы в воде, мало растворимы - K, Rb, Cs. Все эти комплексы соответствуют sp 3 -гибридному состоянию атома бора и имеют форму тетраэдра.
Тетрафторобораты очень разнообразны, хорошо растворимы в воде, мало растворимы - K, Rb, Cs. Все эти комплексы соответствуют sp 3 -гибридному состоянию атома бора и имеют форму тетраэдра.
 С кислородом бор образует борный ангидрид B 2 O 3 – кристаллическое вещество. В газообразном состоянии молекула B 2 O 3 имеет строение: B 2 O 3 необходимая составная часть O эмалей, глазурей, а также B 95° B термостойкого стекла. Борный ангидрид O O гидроскопичен.
С кислородом бор образует борный ангидрид B 2 O 3 – кристаллическое вещество. В газообразном состоянии молекула B 2 O 3 имеет строение: B 2 O 3 необходимая составная часть O эмалей, глазурей, а также B 95° B термостойкого стекла. Борный ангидрид O O гидроскопичен.
 При взаимодействии с водой вначале образуются метаборная кислота, а дальнейшее обводнение приводит к образованию ортоборной кислоты: B 2 O 3 + H 2 O → 2 HBO 2 метаборная кислота B 2 O 3 + 3 H 2 O → 2 H 3 BO 3 ортоборная кислота В разбавленном водном растворе существует только одна кислота H 3 BO 3 – кристаллическое вещество, имеет слоистую структуру, в которой молекулы прочно объединены водородными связями. Плохо растворяется в воде, хорошо - в горячей.
При взаимодействии с водой вначале образуются метаборная кислота, а дальнейшее обводнение приводит к образованию ортоборной кислоты: B 2 O 3 + H 2 O → 2 HBO 2 метаборная кислота B 2 O 3 + 3 H 2 O → 2 H 3 BO 3 ортоборная кислота В разбавленном водном растворе существует только одна кислота H 3 BO 3 – кристаллическое вещество, имеет слоистую структуру, в которой молекулы прочно объединены водородными связями. Плохо растворяется в воде, хорошо - в горячей.
 Ортоборная кислота или ортоборат водорода при нагревании теряет воду, переходя в полимерные метабораты водорода HBO 2 и далее в B 2 O 3: 2 H 3 BO 3 2 HBO 2 B 2 O 3 -2 H 2 O -H 2 O В ортоборной кислоте субъединицы B(OH)3 связаны друг с другом водородными связями и образуют бесконечные слои с симметрией, близкой к гексагональной.
Ортоборная кислота или ортоборат водорода при нагревании теряет воду, переходя в полимерные метабораты водорода HBO 2 и далее в B 2 O 3: 2 H 3 BO 3 2 HBO 2 B 2 O 3 -2 H 2 O -H 2 O В ортоборной кислоте субъединицы B(OH)3 связаны друг с другом водородными связями и образуют бесконечные слои с симметрией, близкой к гексагональной.
 H 3 BO 3 и бораты образуют устойчивые комплексы с глицерином, при этом кислотные свойства ее усиливаются: CH 2 2 CH CH 2 OH OH + H 3 BO 3 OH CH 2 H + -2 H 2 O OH CH HO O CH 2 B CH 2 O
H 3 BO 3 и бораты образуют устойчивые комплексы с глицерином, при этом кислотные свойства ее усиливаются: CH 2 2 CH CH 2 OH OH + H 3 BO 3 OH CH 2 H + -2 H 2 O OH CH HO O CH 2 B CH 2 O
 Соли борных кислот в своем большинстве полимеры. Так, в кристаллах Na. BO 2 присутствует циклический метаборатный анион, а в Сa(BO 2)2 полиметаборатный анион, образующий бесконечные цепи в виде зигзагов: O O B O O O B
Соли борных кислот в своем большинстве полимеры. Так, в кристаллах Na. BO 2 присутствует циклический метаборатный анион, а в Сa(BO 2)2 полиметаборатный анион, образующий бесконечные цепи в виде зигзагов: O O B O O O B
 Эти анионы состоят из плоских треугольных структурных единиц BO 3 4 H 3 BO 3 → H 2 B 4 O 7 + 5 H 2 O H 3 BO 3 – слабая кислота. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединением OH-ионов. H 3 BO 3 + HOH → - + H+
Эти анионы состоят из плоских треугольных структурных единиц BO 3 4 H 3 BO 3 → H 2 B 4 O 7 + 5 H 2 O H 3 BO 3 – слабая кислота. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединением OH-ионов. H 3 BO 3 + HOH → - + H+
 Качественной реакцией на H 3 BO 3 и соли борных кислот является взаимодействие с H 2 SO 4 (к) и метанолом (этанолом) при нагревании. Образуется борнометиловый эфир, который при поджигании горит очень красивым зеленым пламенем. Na 2 B 4 O 7 + H 2 SO 4 (к) + 5 H 2 O → 4 H 3 BO 3 + Na 2 SO 4 H 3 BO 3 + 3 CH 3 OH → (CH 3 O)3 B + 3 H 2 O
Качественной реакцией на H 3 BO 3 и соли борных кислот является взаимодействие с H 2 SO 4 (к) и метанолом (этанолом) при нагревании. Образуется борнометиловый эфир, который при поджигании горит очень красивым зеленым пламенем. Na 2 B 4 O 7 + H 2 SO 4 (к) + 5 H 2 O → 4 H 3 BO 3 + Na 2 SO 4 H 3 BO 3 + 3 CH 3 OH → (CH 3 O)3 B + 3 H 2 O
 При нейтрализации H 3 BO 3 не образуются ортобораты, содержащие ион BO 33 -, а получаются тетрабораты, метабораты: 4 H 3 BO 3 + 2 Na. OH → Na 2 B 4 O 7 + 7 H 2 O H 3 BO 3 + Na. OH → Na. BO 2 + 2 H 2 O
При нейтрализации H 3 BO 3 не образуются ортобораты, содержащие ион BO 33 -, а получаются тетрабораты, метабораты: 4 H 3 BO 3 + 2 Na. OH → Na 2 B 4 O 7 + 7 H 2 O H 3 BO 3 + Na. OH → Na. BO 2 + 2 H 2 O
 Невозможность получения ортоборатов объясняется малой диссоциацией H 3 BO 3, приводящей к практически полному гидролизу ее солей: Na 2 B 4 O 7 + 7 H 2 O → 4 H 3 BO 3 + 2 Na. OH Как и B 2 O 3, так и бораты легко образуют стекловидные фазы, что обуславливает их полимерное строение.
Невозможность получения ортоборатов объясняется малой диссоциацией H 3 BO 3, приводящей к практически полному гидролизу ее солей: Na 2 B 4 O 7 + 7 H 2 O → 4 H 3 BO 3 + 2 Na. OH Как и B 2 O 3, так и бораты легко образуют стекловидные фазы, что обуславливает их полимерное строение.
 Применение в фармации. Кислота борная, натрия тетраборат применяются наружно в качестве антисептических средств. Алюминия гидроксид применяется в качестве адсорбирующего и обволакивающего средства: наружно – для присыпок, внутрь – для лечения язвенной болезни, гастритов, входит в состав препарата “Алмагель”. В фарманализе в методе кислотноосновного титрования применяют тетраборат натрия как установочное вещество.
Применение в фармации. Кислота борная, натрия тетраборат применяются наружно в качестве антисептических средств. Алюминия гидроксид применяется в качестве адсорбирующего и обволакивающего средства: наружно – для присыпок, внутрь – для лечения язвенной болезни, гастритов, входит в состав препарата “Алмагель”. В фарманализе в методе кислотноосновного титрования применяют тетраборат натрия как установочное вещество.

 Основным сырьем для получения алюминия являются бокситы, содержащие до 60% глинозема Al 2 O 3. Перспективным является выделение его из алюминиевой руды нефелина - Na 2 O Al 2 O 3 2 Si. O 2. Встречается минерал криолит – Na 3. Встречается чистый Al 2 O 3 – минерал корунд. Драгоценные камни рубин и сапфир – это кристаллы корунда, окрашенные примесью оксида хрома (рубин) и оксидов титана и железа (сапфир).
Основным сырьем для получения алюминия являются бокситы, содержащие до 60% глинозема Al 2 O 3. Перспективным является выделение его из алюминиевой руды нефелина - Na 2 O Al 2 O 3 2 Si. O 2. Встречается минерал криолит – Na 3. Встречается чистый Al 2 O 3 – минерал корунд. Драгоценные камни рубин и сапфир – это кристаллы корунда, окрашенные примесью оксида хрома (рубин) и оксидов титана и железа (сапфир).

 На воздухе алюминий покрывается тончайшей пленкой Al 2 O 3, отличающейся большой прочностью. Это объясняет его устойчивость при комнатной температуре к действию кислорода и воды. Конфигурация внешних электронных оболочек - 3 s 23 p 1. 3 d 3 p Al* 3 s c v
На воздухе алюминий покрывается тончайшей пленкой Al 2 O 3, отличающейся большой прочностью. Это объясняет его устойчивость при комнатной температуре к действию кислорода и воды. Конфигурация внешних электронных оболочек - 3 s 23 p 1. 3 d 3 p Al* 3 s c v
 Наличие в валентном слое незаполненных p- и d-орбиталей дает возможности для донорноакцепторного взаимодействия. Ион Al 3+ проявляет склонность к комплексообразованию. Как вообще для s- и p-элементов, для Al 3+ характерно образование комплексов с H 2 O, OH-, F-, менее устойчивые с Cl-, Br-, I-.
Наличие в валентном слое незаполненных p- и d-орбиталей дает возможности для донорноакцепторного взаимодействия. Ион Al 3+ проявляет склонность к комплексообразованию. Как вообще для s- и p-элементов, для Al 3+ характерно образование комплексов с H 2 O, OH-, F-, менее устойчивые с Cl-, Br-, I-.
 При комплексообразовании в химическую связь могут вносить вклад свободные d-орбитали. Поэтому существуют комплексы с КЧ=6. Например: 3 - - sp 3 d 2 гибридизация. В водных растворах солей Al содержатся октаэдрические комплексы 3+. С ионами H- и Al 3+ образует тетраэдрический комплекс -.
При комплексообразовании в химическую связь могут вносить вклад свободные d-орбитали. Поэтому существуют комплексы с КЧ=6. Например: 3 - - sp 3 d 2 гибридизация. В водных растворах солей Al содержатся октаэдрические комплексы 3+. С ионами H- и Al 3+ образует тетраэдрический комплекс -.
 Металлический алюминий, поверхность которого покрыта защитной пленкой Al 2 O 3 не реагирует с водой, но если ее разрушить, то происходит бурное взаимодействие с водой с образованием Al(OH)3 и H 2: 2 Al + 6 H 2 O → 2 Al(OH)3 + 3 H 2
Металлический алюминий, поверхность которого покрыта защитной пленкой Al 2 O 3 не реагирует с водой, но если ее разрушить, то происходит бурное взаимодействие с водой с образованием Al(OH)3 и H 2: 2 Al + 6 H 2 O → 2 Al(OH)3 + 3 H 2
 При нагревании Al энергично взаимодействует с O 2, S, N 2, но не реагирует с H 2. 4 Al + 3 O 2 → 2 Al 2 O 3 С кислотами Al активно взаимодействует с выделением водорода: 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2 2 Al + 6 H+ + 12 H 2 O → 23+ + 3 H 2
При нагревании Al энергично взаимодействует с O 2, S, N 2, но не реагирует с H 2. 4 Al + 3 O 2 → 2 Al 2 O 3 С кислотами Al активно взаимодействует с выделением водорода: 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2 2 Al + 6 H+ + 12 H 2 O → 23+ + 3 H 2
 Однако очень разбавленные и очень концентрированные растворы HNO 3 и H 2 SO 4 на Al практически не действуют – происходит пассивация. В умеренной концентрации растворов этих кислот Al растворяется.
Однако очень разбавленные и очень концентрированные растворы HNO 3 и H 2 SO 4 на Al практически не действуют – происходит пассивация. В умеренной концентрации растворов этих кислот Al растворяется.
 С растворами щелочей алюминий взаимодействует энергично, поскольку они растворяют оксидную защитную пленку: 2 Al + 6 Na. OH + 6 H 2 O → 2 Na 3 + 3 H 2 гексагидроксоалюминат (III) натрия 3 Cu 2+ +2 Al → 3 Cu + 2 Al 3+ Cu – красная губчатая масса
С растворами щелочей алюминий взаимодействует энергично, поскольку они растворяют оксидную защитную пленку: 2 Al + 6 Na. OH + 6 H 2 O → 2 Na 3 + 3 H 2 гексагидроксоалюминат (III) натрия 3 Cu 2+ +2 Al → 3 Cu + 2 Al 3+ Cu – красная губчатая масса
 Al не вступает в реакцию с водородом H 2. Гидрид Al (алан) получают косвенным путем, действуя Li. H в эфирном растворе на Al. Cl 3: Al. Cl 3 + 3 Li. H → Al. H 3 + 3 Li. Cl Al. H 3 – белый порошок, имеет полимерное строение, это соединение с дефицитом электронов. Если взять большое количество Li. H, то получается гидридоалюминат или аланат лития: Al. Cl 3 + 4 Li. H → Li + 3 Li. Cl Это устойчивое соединение, сильный восстановитель.
Al не вступает в реакцию с водородом H 2. Гидрид Al (алан) получают косвенным путем, действуя Li. H в эфирном растворе на Al. Cl 3: Al. Cl 3 + 3 Li. H → Al. H 3 + 3 Li. Cl Al. H 3 – белый порошок, имеет полимерное строение, это соединение с дефицитом электронов. Если взять большое количество Li. H, то получается гидридоалюминат или аланат лития: Al. Cl 3 + 4 Li. H → Li + 3 Li. Cl Это устойчивое соединение, сильный восстановитель.
 Оксид Al - Al 2 O 3 – очень твердое тугоплавкое соединение, известно его 3 модификации – . Al 2 O 3 – корунд, по твердости он уступает только алмазу. Обладает амфотерными свойствами, но не взаимодействует с водой, кислотами и щелочами.
Оксид Al - Al 2 O 3 – очень твердое тугоплавкое соединение, известно его 3 модификации – . Al 2 O 3 – корунд, по твердости он уступает только алмазу. Обладает амфотерными свойствами, но не взаимодействует с водой, кислотами и щелочами.
 Гидроксид алюминия - Al(OH)3 Получают: Al 2(SO 4)3 + 6 Na. OH → 2 Al(OH)3 студ. белый осадок + 3 Na 2 SO 4 Al(OH)3 – полимерное соединение, формула условна Al(OH)3 H 2 O. Это типичное амфотерное соединение: t 2 Al(OH)3 → 3 H 2 O + Al 2 O 3 Al(OH)3 + 3 H+ + 3 H 2 O → 3+ Al(OH)3 + 3 OH- → 3 -
Гидроксид алюминия - Al(OH)3 Получают: Al 2(SO 4)3 + 6 Na. OH → 2 Al(OH)3 студ. белый осадок + 3 Na 2 SO 4 Al(OH)3 – полимерное соединение, формула условна Al(OH)3 H 2 O. Это типичное амфотерное соединение: t 2 Al(OH)3 → 3 H 2 O + Al 2 O 3 Al(OH)3 + 3 H+ + 3 H 2 O → 3+ Al(OH)3 + 3 OH- → 3 -
 В отличие от многих гидроксидов dэлементов Al(OH)3 не растворяется в NH 3 Галиды алюминия (галогениды) получают прямым взаимодействием простых веществ. Это бесцветные кристаллические вещества.
В отличие от многих гидроксидов dэлементов Al(OH)3 не растворяется в NH 3 Галиды алюминия (галогениды) получают прямым взаимодействием простых веществ. Это бесцветные кристаллические вещества.
 Al. Cl 3 – малорастворимое и тугоплавкое вещество, остальные хорошо растворимы, причем при растворении их в воде выделяется большое количество теплоты. Соли сильно гидролизуются: 2 Al. Cl 3 + 3 Na 2 CO 3 + 6 H 2 O → 2 Al(OH)3 + 6 Na. Cl + 3 H 2 CO 3 Гидролиз необратимый, первой стадией которой является отщепление H+ 3+ 2+ + H+
Al. Cl 3 – малорастворимое и тугоплавкое вещество, остальные хорошо растворимы, причем при растворении их в воде выделяется большое количество теплоты. Соли сильно гидролизуются: 2 Al. Cl 3 + 3 Na 2 CO 3 + 6 H 2 O → 2 Al(OH)3 + 6 Na. Cl + 3 H 2 CO 3 Гидролиз необратимый, первой стадией которой является отщепление H+ 3+ 2+ + H+
 Далее образуются различные полиядерные комплексы 4+, которые остаются в растворе, поэтому не наблюдается образование осадка гидроксида, хотя протекание гидролиза можно легко заметить по изменению раствора. С фторидами щелочных металлов Al. F 3 образует фтороалюминаты, наиболее устойчивый из них криолит Na 3.
Далее образуются различные полиядерные комплексы 4+, которые остаются в растворе, поэтому не наблюдается образование осадка гидроксида, хотя протекание гидролиза можно легко заметить по изменению раствора. С фторидами щелочных металлов Al. F 3 образует фтороалюминаты, наиболее устойчивый из них криолит Na 3.
 Биологическая роль Алюминий и бор относятся к примесным микроэлементам. Концентрируются в сыворотке крови, легких, мозге, печени, почках. Избыток алюминия тормозит синтез гемоглобина, блокируя активные центры ферментов, участвующих в кроветворении.
Биологическая роль Алюминий и бор относятся к примесным микроэлементам. Концентрируются в сыворотке крови, легких, мозге, печени, почках. Избыток алюминия тормозит синтез гемоглобина, блокируя активные центры ферментов, участвующих в кроветворении.
 Избыток бора вреден для организма, так как он угнетает амилазы, протеиназы, уменьшает активность адреналина, нарушает в организме обмен углеводов и белков, что приводит к кишечным заболеваниям – энтеритам.
Избыток бора вреден для организма, так как он угнетает амилазы, протеиназы, уменьшает активность адреналина, нарушает в организме обмен углеводов и белков, что приводит к кишечным заболеваниям – энтеритам.

Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента и каким уровнем заканчивается заполнение оболочки электронами.
К s-элементам относят элементы IA-группы – щелочные металлы . Электронная формула валентной оболочки атомов щелочных металлов ns1 . Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки. При увеличении радиуса в группе Li-Fr связь валентного электрона с ядром слабеет и уменьшается энергия ионизации. Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители.
Восстановительные свойства усиливаются с возрастанием порядкового номера.
К p-элементам относятся 30 элементов IIIA-VIIIA-групп периодической системы; p-элементы расположены во втором и третьем малых периодах, а также в четвертом-шестом больших периодах. Элементы IIIА-группы имеют один электрон на p-орбитали. В IVА-VIIIА -группах наблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов ns2np6 . В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2p-элементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства p-элемента в группе с увеличением порядкового номера.
К d-элементам относятся 32 элемента периодической системы IV–VII больших периодов . В IIIБ-группе у атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки (n-1)dansb, где a=1?10, b=1?2 . С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-эле-ментов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
8. Ковалентная связь. Метод валентных связей
Химическая связь, осуществляемая общими электронными парами, возникающих в оболочках связываемых атомов, имеющих антипараллельные спины, называется атомной, или ковалентной связью. Ковалентная связь двухэлектронная и двуцентровая (удерживает ядра). Она образуется атомами одного вида – ковалентная неполярная – новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора; и атомами разного вида, сходных по химическому характеру – ковалентная полярная. Элементы с большей электроотрицательностью (Cl) будут оттягивать общие электроны от элементов с меньшей электроотрицательностью (Н). Атомы с непарными электронами, имеющими параллельные спины, отталкиваются – химическая связь не возникает. Способ образования ковалентной связи называется обменным механизмом .
Свойства ковалентной связи. Длина связи – межъядерное расстояние. Чем это расстояние короче, чем прочнее химическая связь. Энергия связи – количество энергии, требующееся для разрыва связи. Величина кратности связи прямо пропорциональна энергии связи и обратно пропорциональна длине связи. Направленность связи – определенное расположение электронных облаков в молекуле. Насыщаемость – способность атома образовывать определенное количество ковалентных связей. Химическая связь, образованная перекрыванием электронных облаков вдоль оси, соединяющей центры атомов, называется ?-связью. Связь, образованная перекрыванием электронных облаков перпендикулярно оси, соединяющей центры атомов, называется ?-связью . Пространственная направленность ковалентной связи характеризуется углами между связями. Эти углы называются валентными углами. Гибридизация – процесс перестройки неравноценных по форме и энергии электронных облаков, ведущих к образованию одинаковых по тем же параметрам гибридных облаков. Валентность – число химических связей (ковалентных ), посредством которых атом соединен с другими. Электроны, участвующие в образовании химических связей, называются валентными . Число связей между атомами равно числу его неспаренных электронов, участвующих в образовании общих электронных пар, поэтому валентность не учитывает полярность и не имеет знака. В соединениях, в которых отсутствует ковалентная связь, имеет место степень окисления – условный заряд атома, исходный из предположения, что оно состоит из положительно или отрицательно заряженных ионов. К большинству неорганических соединений применимо понятие степень окисления.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Общая характеристика р-элементов III группы
Электронная конфигурация основного состояния у этих элементов ns 1 np 2 характеризуется наличием одного неспаренного электрона. В возбужденном состоянии они содержат три неспаренных электрона, которые, находясь в sр 2 -гибридизации, участвуют в образовании трех ковалентных связей. При этом у атомов элементов IIIА группы остается одна незанятая орбиталь, а число валентных электронов остается меньше числа доступных по энергии орбиталей. Поэтому многие ковалентные соединения элементов IIIА группы являются кислотами Льюиса - акцепторами электронной пары, приобретая которую, они не только повышают координационное число до четырех, но и изменяют геометрию своего окружения - одна из плоскостей становится тетраэдрической (состояние sр 2 -гибридизации).
Бор отличается по свойствам от других элементов этой подгруппы. Бор - единственный неметалл, химически инертен и образует ковалентные связи B?F, B?N, B?C и т.д., кратность которых часто повышена за счет рр?рр - связывания. Химии бора близка химия кремния, в этом проявляется диагональное сходство. У атомов алюминия появляются вакантные d-орбитали, возрастает радиус атома, поэтому увеличиваетсякординационное число до шести. Галлий, индий, таллий располагаются сразу за металлами d-блока; заполнение d-оболочки сопровождается последовательным сжатием атомов. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше. При переходе от Al к Ga рост эффективного заряда ядра оказывается более значительным, чем изменение радиуса атома, поэтому энергия ионизации повышается. Рост энергий ионизации при переходе от Iп к Tl является результатом d- и f-сжатия, приводящего к усилению взаимодействия валентных электронов с ядром атома. Увеличение энергии связи 6s 2 -электронов таллия с ядром затрудняет их участие в образовании связей и приводит к понижению стабильности их соединений в высшей степени окисления. Так для талля, свинца, висмута и полония устойчивы соединения со степенью окисления +1, +2, +3, +
К р-элементам III группы относятся типические элементы - бор и аллюминий и элементы подгруппы галлия - галлий, индий, таллий. Все перечисленные элементы, кроме бора, являются металлами. Все элементы редкие, за исключением алюминия, на долю которого приходится 8,8% массы земной коры. На внешнем электронном уровне они имеют три электрона ns 2 np 1 , а в возбужденном состоянии - ns 1 np 2 электроны. Высшая степень окисления элементов подгруппы бора равна +3. Из-за того, что в атомах Ga, In, T1 предпоследний уровень содержит 18 электронов, нарушаются закономерные различия некоторых свойств при переходе от А1 к Ga. Некоторые физические константы элементов подгруппы IIIА приведены в табл. 7.
2. Элементы IIIА группы (подгруппа бора)
2.1 Бор
Природные ресурсы . В свободном состоянии бор не встречается, а только в связанном состоянии. Основные минералы - бораты: Na 2 B 4 0 7 10Н 2 О - бура, Н 3 ВО 3 - борная кислота, нитрид бора BN.
Получение. Технический (аморфный) бор получают магнийтермическим восстановлением его оксида:
3Mg + B 2 О 3 3MgO + 2B; Н<0.
MgO удаляют растворением в HCl. Кристаллический бор получают восстановлением галогенидов водородом:
2ВВr 3 + ЗН 2 6HBr + 2B.
Свойства. Бор известен в аморфной (коричневой) и кристаллической (черной) формах. Кристаллическая решетка бора очень прочна (икосаэдры), это проявляется в высокой твердости, малой энтропии S 0 (в) =7 э.е. и высокой температуре плавления. Бор - полупроводник, ширина запрещенной зоны составляет 1,42 эВ.
Бор - первый р - элемент в периодической системе элементов. Строение внешней электронной оболочки 2s 2 2p l . Возбуждение переводит атом в sp 2 - гибридное валентное состояние, в котором орбитали расположены под 120 0 (ВFз, ВС1з). Благодаря наличию свободной р-орбитали и малому размеру атома, бор - один из сильнейших акцепторов неподеленных электронных пар, образует комплексные ионы типа:
BF 3 (г) + HF = H (p),
BF 3 (г) + F - (p) = -1 (p).
Комплексный ион [ВF 4 ] -1 имеет тетраэдрическое строение, которое характерно и для других соединений бора.
Свойства элементов подгруппы III А
|
Свойства элементов |
||||||
|
Атомный радиус, нм |
||||||
|
Ионный радиус Э 3+ , нм |
||||||
|
Энергия ионизации, Э 0 Э + , эВ |
||||||
|
Температура плавления,°С |
||||||
|
Температура кипения,°С |
||||||
|
Плотность, г/см 3 |
||||||
|
Е 0 (Э 3+ / Э 0), В |
||||||
|
Электроотрицательность |
||||||
|
Степень окисления |
С донорно-акцепторным взаимодействием связано наличие большого числа неорганических боросодержищих полимеров. По значению электроотрицательности бор находится почти в середине шкалы электроотрицательности, поэтому он может быть как окислителем в соединениях со степенью окисления +3 (ВF 3 , В 2 О 3), так и восстановителем в соединениях со степенью окисления -3 (Mg 3 B 2 , В 3 Н 6). Связи, образуемые бором, - ковалентные. Для бора типичны соединения, в которых он входит состав комплексного аниона (В 4 O 7 2- , BF 4 -).
Бор обнаруживает диагональную аналогию с кремнием. Для бора и кремния наиболее характерны производные, в которых эти элементы поляризованы положительно. Для обоих элементов их низшие гидриды малоустойчивы и газообразны. Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, стеклообразование оксидов, способность образовать многочисленные полимерные структуры и т.д. При обычных условиях бор химически инертен. Вода не действует на бор; концентрированная азотная и серная кислоты окисляют его до борной кислоты:
2В + ЗН 2 S0 4 = 2Н 3 ВО 3 + 3SO 2,
В + 3HNO 3 = Н 3 ВО 3 + ЗN0 2.
Кипящие соляная и плавиковая кислота на него не действуют. Аморфный бор растворяется в концентрированных растворах щелочей с образованием метаборатов:
2В + 2КОН + 2Н 2 О 2КВО 2 + ЗН 2.
Во всех случаях кристаллический бор химически менее активен, чем аморфный. В химических реакциях бор чаще выступает как восстановитель.
Водородные соединения бора. С водородом бор не реагирует; бороводороды или бораны получают искусственным путем. Это газы или легколетучие жидкости с неприятным запахом, очень ядовиты! Их можно разделить на две группы: B n H n +4 (B 2 H 6) и B n H n +6 (B 4 H 10). Боран ВНз существует как промежуточный продукт в химических реакциях, частицы которого, взаимодействуя друг с другом образуя димер (диборан):
2BH 3 (г) = B 2 H 6 (г), G 0 = -126кДж
Дибораны получают:
1) ЗNа[ВН 4 ] + 4ВF 3 газовая фаза 2В 2 Н 6 + ЗNа[ВF 4 ];
2) 2ВС?з+6H 2 (г) газовая фаза В 2 Н 6 + 6НС1;
Эти реакции протекают в газовой фазе или в неводных средах.
Диборан является энергичным восстановителем; воспламеняется на воздухе:
В 2 Н 6 + 3О 2 3Н 2 О + В 2 О 3 ;
энергично взаимодействует с водой с выделением водорода:
В 2 Н б + 6Н 2 0 2В(ОН) 3 + 6Н 2.
В среде эфира В 2 Н б реагирует с гидридом лития, образуя тетрагидроборат лития:
В 2 Н 6 + 2LiН 2Li.
С кислородом бор образует оксид В 2 О 3 - белый гигроскопичный порошок или хрупкую стекловидную массу. B 2 O 3 энергично присоединяет воду, образуя кислоты:
B 2 O 3 + H 2 O = 2HBO 2 (метаборная кислота),
HBO 2 + H 2 O = H 3 BO 3 (ортоборная кислота).
Ортоборная (или просто борная) кислота - белое кристаллическое вещество, легко расслаивается на очень тонкие перламутровые чешуйки. Молекулы Н 3 ВО 3 , расположенные в плоских параллельных слоях, связаны между собой водородными связями, а связь между слоями осуществляется слабыми силами Ван-дер-Ваальса. Борная кислота хорошо растворима в воде, а также в некоторых растворах органических растворителей. В водных растворах она проявляет себя как одноосновная кислота, вследствие образования гидроксокомплекса:
В(ОН) 3 + Н 2 0 = Н [В(ОН) 4 ].
Тетрагидроксоборат водорода представляет собой слабую кислоту, близкую по силе к угольной кислоте. Ортоборная кислота Н 3 ВО 3 при 100°С с отщеплением молекулы воды переходит в метаборную кислоту НВO 2 . И ортобораты, и метабораты активных металлов подвергаются гидролизу:
Na 2 B 4 0 7 + ЗH 2 O2NaB0 2 +2H 3 BO 3.
Тeтpaбopнaя кислота Н 2 B 4 О 7 в свободном состоянии неизвестна, ее соли тетрабораты встречаются в природе; тетраборат натрия образуется при нейтрализации H 3 BO 3 водными растворами щелочей:
4Н 3 ВО 3 + 2NаОН = Nа 2 В 4 О 7 + 7Н 2 О.
Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными элементами (нитриды, галогениды).
Кислотная природа галогенидов проявляется при их гидролизе:
ВС1 3 + ЗН 2 О = Н 3 ВО 3 + ЗНС1.
С азотом бор образует соединение BN - нитрид бора. Синтез осуществляется при температуре выше 1200°С по реакции:
B 2 O 3 + 2NH 3 = 2BN + 3H 2 O.
Полученный таким образом нитрид бора представляет собой белый, похожий на тальк, порошок; его часто называют «белым графитом». Его кристаллическая структура аналогична графиту. Атомы бора и азота связаны между собой sp 2 - гибридными связями. В плоскости слоев осуществляется дополнительное - связывание за счет пустой р - орбитали атома бора и неподеленной электронной пары атома азота. Отдельные слои связаны силами Ван-дер-Ваальса. «Белый графит» обладает высокой огнеупорностью, химически инертен и расслаивается на чешуйки, как графит.
Другая модификация нитрида бора имеет кубическую алмазоподобную структуру. В ней атомы бора и азота находятся в sp 3 - гибридном состоянии. При КЧ=4 три связи образованы по обменному механизму, а одна по донорно-акцепторному, причем атом бора является акцептором электронной пары, а атом азота - донором. Эта модификация BN - называется боразоном или эльбором. При высоких температурах эльбор можно получить из «белого графита», подобно тому как алмаз получается из черного графита:
BN (гекс) BN (куб).
При нагревании с углеродом бор образует карбид В 4 С:
7С + 2В 2 O 3 6СО + В 4 С.
Карбид бора уступает по твердости лишь алмазу и боразону.
При нагревании бор взаимодействует со многими металлами, образуя бориды различного состава, например: Сг 4 В, Сг 3 В, СгВ, СгВ 2 . Это кристаллические вещества. Все бориды d-элементов характеризуются большой твердостью, тугоплавки и химически инертны. Бориды s - элементов, например, MgB 2 , реакционноспособны.
Применение. Бор применяют как добавку к сплавам, увеличивающую их жаропрочность и износостойкость. Поскольку ядро бора имеет высокое сечение захвата нейтронов, бор используют для защиты от нейтронов и в регулирующих устройствах атомных реакторов.
Бораты входят в состав многих моющих средств. В 2 О 3 - необходимая часть ряда эмалей, глазурей и специальных сортов стекла. В микроэлектронике бор используется в качестве полупроводника, применяется для легирования полупроводниковых материалов. Белый графит служит изолятором и твердой высокотемпературной смазкой. Боразон применяют как сверхтвердый материал в буровых работах, при обработке металлов. Бориды применяют для изготовления высокоогнеупорных деталей.
Борная кислота применяется в медицине. Тетраборат натрия Nа 2 В 4 0 7 (бура) используется в качестве флюса при пайке, т.к. в расплаве этой соли хорошо растворяются оксиды металлов с образованием метаборатов:
Na 2 B 4 O 7 + CuO2NaBO2 Cu(BO 2) 2.
2.2 Алюминий
Второй типический элемент III группы периодической системы. Алюминий является первым и самым легким р-металлом. У алюминия по сравнению с бором атомный радиус больше, а потенциал ионизации меньше; следовательно, возрастают его металлические свойства. В отличие от неметалла бора алюминий является амфотерным элементом. Алюминий и его гидроксид растворяются в кислотах и щелочах. Для химии алюминия исключительно важное значение имеет его большое сродство к кислороду, в таблице 8 приведены значения энтальпий и энергий Гиббса образования оксидов алюминия и его аналогов.
Термодинамические параметры оксидов IIIА группы
И энтальпия, и энергия Гиббса образования алюминия резко отличаются от таковых для галлия и его аналогов, что указывает на его высокую устойчивость. И, наконец, для алюминия наблюдается горизонтальная аналогия с кремнием. Отчетливо проявляется она в алюмосиликатах, наиболее распространенных в земной коре химических соединений.
Природные ресурсы . Алюминий - один из самых распространенных на земле элементов, занимает третье место по распространенности после кислорода и кремния. Алюминий входит в состав 250 минералов, главным образом алюмосиликатов, из которых образована земная кора; продуктом их разрушения является глина А1 2 О 3 2SiO 2 2Н 2 O (каолинит). Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Иногда встречается белая глина, без примесей железа. Техническое название А1 2 O 3 - глинозем. Для добычи алюминия используют минералы: боксит А1 2 O 3 Н 2 O, а также нефелин Na 2 OAl 2 O 3 2SiO 2 , криолит Na 3 . Встречается чистый А1 2 O 3 - корунд. В зависимости от содержания примесей корунд имеет различную окраску и названия. Драгоценные камни рубин и сапфир - это кристаллы корунда, окрашенные примесью оксида хрома (рубин) и оксидов титана и железа (сапфир).
Алюминий получают электролизом расплава смеси глинозёма с криолитом. Расплав A? 2 O 3 в криолите Na 3 подвергают электролизу при 950 о С и напряжении 6-7 B. Протекаемые процессы:
Al 2 O 3 = 2A? 3+ + 3O 2 - (диссоциация на ионы);
на катоде: A? 3+ +3e = A?;
на аноде: 2O 2- - 4e =O 2 .
Особо чистый алюминий, необходимый, например, в электронной технике, получают специальными методами: вакуумной дистилляцией или зонной плавкой.
Физические и химические свойства алюминия . Алюминий - серебристо-белый металл. Очень мягок, легко вытягивается в фольгу. Кристаллизуется в ГЦК - структуре. По электрической проводимости занимает четвертое место после серебра, золота и меди. На воздухе покрывается тончайшей пленкой (10 -5 мм) Al 2 O 3 , отличающейся большой прочностью. Защитная пленка надежно предохраняет металл от дальнейшего окисления. Почти все реакции с участием алюминия идут с латентным (скрытым) периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее.
С пниктогенами и халькогенами алюминий взаимодействует при высокой температуре. С галогенами, за исключением йода, алюминий непосредственно не реагирует. Концентрированные серная и азотная кислоты пассивируют его, поэтому он в них не растворяется. Алюминий растворяется в соляной кислоте и в растворах щелочей:
2А? + 6НС? = 2А?С1 3 + ЗН 2,
2A? + 2NaOH + 6H 2 O = 2Na + 3H 2. .
Алюминий, лишенный защитной пленки, энергично взаимодействует с водой:
2А? + 6Н 2 O = 2А? (ОН) 3 + 3H 2 .
Химическая связь в соединениях алюминия обладает большей долей ионности, чем в соединениях бора. Так, ВF 3 -газ, А?F 3 -твердое соединение с высокой температурой плавления, его вполне можно назвать солью; галогениды А?С1 3 , А?Вг 3 , А?I 3 обнаруживают свойства, промежуточные между свойствами галогенидов неметаллов и солей.
Ион A? 3+ , имеющий малый радиус и большой заряд, проявляет склонность к комплексообразованию, причем у алюминия она больше, чем у магния, и меньше, чем у бора. Алюминий образует прочные комплексы с H 2 O, OH - , F - ; как все s- и р - элементы не дает прочных комплексов с аммиаком и его производными. При комплексообразовании в химическую связь могут вносить вклад свободные d - орбитали атома алюминия. Этим объясняется возможность образования комплексов с К.Ч.=6, например, [А?(Н 2 O) 6 ] 3+ (sp 3 d 2 - гибридизация).
Соединения. Алюминий не вступает в реакцию с водородом. Гидрид алюминия получают косвенным путем, действуя гидридом лития в эфирном растворе на А1С1 3:
A?C? 3 + 3LiH A?H 3 + 3LiC?.
Гидрид алюминия АlН 3 - белый порошок; это полимерное соединение (А1Н 3) n . Если предыдущую реакцию провести с избытком LiH, то получаем тетрагидроалюминат лития:
A?C? 3 + 4LiHLi + 3HC?.
Li сильный восстановитель, бурно реагирует с водой с выделением водорода:
Li + 4H 2 OLiOH + A? (OH) 3 + 4H 2 .
При нагревании алюминий энергично взаимодействует с кислородом:
4А? (г) + 3O 2 (г) = 2А? 2 O 3 (к); G° = -3164 кДж.
Оксид алюминия Аl 2 О 3 - очень твердое, тугоплавкое, химически стойкое соединение (T пл =2072 о C, Т кип = З500 о С), разрушается лишь при длительном нагревании с кислотами или щелочами:
А? 2 O 3 + 6НС? = 2А?С? 3 + ЗН 2 O,
A? 2 O 3 + 2NaOH = 2NaA1O 2 + H 2 O.
В щелочных растворах образуются гидроксоалюминаты:
A? 2 O 3 + 2NaOH + 7H 2 O = 2Na .
Гидроксид алюминия А? (ОН) 3 амфотерное соединение, ему соответствуют два типа солей: соли алюминия (III), например, A? 2 (SO 4) 3 , А?С? 3 , и алюминаты - соли алюминиевых кислот. В водных растворах алюминаты существуют в виде гидроксокомплексов, например, К [А?(ОН) 4 ], в расплавах в виде cолей несуществующей в свободном состоянии метаалюминиевой кислоты, например, КА?O 2 . Схему равновесия в насыщенном водном растворе А1 (ОН) 3 можно представить следующим образом:
A? 3+ +3ОH?A? (OH) 3 H H + + -
раствор осадок раствор
Добавление кислоты (Н +) приводит к смещению равновесия в сторону образования катиона Al 3+ (солей алюминия катионного типа):
А? (ОH) 3 + ЗН + = A? 3+ + ЗH 2 O.
Добавление щелочи (ОН -) - в сторону образования анионов (солей алюминия анионного типа):
А? (ОН) 3 + ОН - = - .
Соли алюминия в водных растворах сильно гидролизованы. Реакция среды зависит от типа растворенной соли:
A? 3+ + H 2 OA?OH 2+ + Н + рН < 7.
Соли А? 3+ и слабых кислот гидролизуются полностью с образованием осадков гидроксида алюминия или гидроксосолей алюминия:
A? (СН 3 СОО) 3 +2Н 2 OA?OН(СН 3 СОО) 2 ++А? (ОН) 2 СН 3 СОО + СН 3 СООН.
Вследствие сильного гидролиза многие соли алюминия не удается выделить из водных растворов (например, сульфид, карбонат, цианид и др.):
А? 2 S 3 + 6H 2 O = 2А?(OH) 3 v + 3H 2 S^
Соли алюминия и кислородосодержащих кислот растворимы в воде. Исключение составляет фосфат алюминия А?РО Образование малорастворимого фосфата играет важную роль в жизнедеятельности организмов. Усвоение фосфора организмом уменьшается в присутствии катионов А? 3+ вследствие образования в кишечнике малорастворимого фосфаталюминия. Это обстоятельство необходимо учитывать при назначении препаратов алюминия, например средства против повышенной кислотности желудка А?(ОН) 3 .
В желудке гидроксид алюминия образует гель, который нейтрализует ионы гидроксония желудочного сока:
A?(ОН) 3 + 3Н 3 О + = A? 3+ + 6Н 2 О
Перешедшие в раствор ионы алюминия в кишечнике переходят в малорастворимую форму - фосфат алюминия:
A? 3+ (р) +РО 4 3- (р) = A?РО 4 (т)
В живых организмах с биолигандами (оксикислотами, полифенолами, углеводами, липидами) алюминий образует хелатные комплексные соединения. Как правило, связи с органическими лигандами он образует через атомы кислорода.
В стоматологической практике находят широкое применение соединения алюминия, например, белая глина (каолин) A? 2 О 3 SiO 2 2H 2 O. Каолин входит в состав цементов, которые используют как временный пломбировочный материал, а также для штамповки коронок.
С сульфатами металлов в степени окисления +1 сульфат алюминия образует двойные соли типа Ме 2 SO 4 А? 2 (SO 4) 3 12Н 2 O. Эти соединения получили название алюминиевых квасцов. Квасцы в твердом состоянии устойчивы, а в растворах диссоцированы на составляющие ионы. Квасцы хорошо растворимы в воде и кристаллизуются из растворов, образуя большие октаэдрические кристаллы.
Гидроксид алюминия получается в виде аморфных осадков. Кристаллический A?(ОН) 3 можно получить, пропуская СО 2 через щелочные растворы алюмината натрия:
2 Na + 2CO 2 = 2A?(OH) 3 v + 2naHCo 3 + 4H 2 O
Применение. Алюминий - второй (после железа) металл по объему производства и применения в технике. Используют как чистый алюминий, так и его сплавы. Сплав - дюралюминий, содержащий 4%(масс.) Сu, 1,5% Mg, 0,5% Mn - основной конструкционный материал в самолетостроении. Большое количество алюминия идет на изготовление проводов. Из алюминиевых сплавов был изготовлен первый искусственный спутник Земли. Благодаря высокому сродству с кислородом алюминия, возможен процесс алюмотермии - выделение металлов из их оксидов при действии алюминия. Алюмотермию используют для лабораторного получения многих металов (Mn, Cr, V, W, и др.), в ряде случаев в промышленности (получение Sr, Ba, и др.)
Из оксида алюминия изготовляют огнеупорную и химически стойкую керамику. В больших количествах выращивают монокристаллы чистого А? 2 О 3 с добавками примесей (искусственные рубины и сапфиры). Из них изготавливают лазеры и подшипники для точных механизмов.
Соединения алюминия входят в состав многих продуктов силикатной промышленности (цемент, фарфор, керамика). Квасцы применяют в кожевенной и в текстильной промышленности. Сульфат алюминия применяют для очистки воды. В основе первого этапа водоочистки используется реакция:
А? 2 (SO 4) 3 + ЗСа(НСО 3) 2 ЗСаSO 4 + 2А? (ОН) 3 + 6СO 2 .
Образующиеся хлопья гидроксида алюминия увлекают в осадок различные примеси. Хлорид алюминия и гидроалюминат лития используют в органических синтезах.
Из кристаллогидратов солей алюминия в медицинской практике находят применение алюмокалиевые квасцы КA?(SO 4) 2 12H 2 O и жженые квасцы КA?(SO 4) 2 которые получают нагреванием алюмокалиевых квасцов при температуре не выше 433 К.
Жженые квасцы используют в виде присыпок как вяжущее и высушивающее средство. Осушающее действие связано с тем, что жженые квасцы медленно поглощают воду:
КA?(SO 4) 2 + xH 2 O = KA?(SO 4) 2 xH 2 O
Фармакологическое действие солей алюминия основано на том, что ионы A? 3+ образуют с белками (протеинами Pr) комплексы, выпадающие в виде гелей:
A? 3+ + Pr >A?Pr
Это приводит к гибели микробных клеток и снижает воспалительную реакцию.
Квасцы применяют для полосканий, промываний и примочек при воспалительных заболеваниях слизистых оболочек и кожи. Кроме того, этот препарат применяют как кровоостанавливающее средство при порезах (свертывающее действие).
2.3 Подгруппа галлия
Несмотря на то, что элементы подгруппы галлия - типовые аналоги, наблюдаются особенности в свойствах отдельных ее представителей. Галлий непосредственно следует за первой десяткой переходных 3d-металлов, для которых особенно сильна d-контракция, поэтому атомный радиус галлия не только меньше его более тяжелых аналогов, но и алюминия, вследствие этого другие энергетические характеристики отличаются от его аналогов.
Природные соединения. Галлий, индий, таллий, в отличие от алюминия, - редкие и рассеянные элементы. Они входят в качестве примеси в различные руды. Практически существует один минерал галлия - галлит CuGaS 2 , редко встречающийся. Галлий сопутствует алюминию и цинку. Индиевые руды рокезит CuInS 2 и индит FeInS 2 встречаются тоже очень редко. Основным сырьем для получения таллия являются полиметаллические руды.
Получение. Соли и оксиды Ga, In, T? выделяют путем переработки отходов производства алюминия и извлечения соединений этих металлов из полиметаллических руд. Свободные металлы получают электролизом подкисленных водных растворов из солей или восстановлением их оксидов углем или водородом. Выделенные металлы очищают зонной плавкой или методами амальгамной металлургии.
Свойства. Существование галлия - экаалюминия было предсказано Д.И. Менделеевым в 1870 г., а также «вычислены» основные свойства этого элемента. В 1875 г. французский химик Лекок де Буабодран открыл и выделил этот элемент. В свободном состоянии галлий, индий, таллий - серебристо-белые металлы. Галлий хрупкий, а индий и таллий очень мягкие металлы. Галлий и индий на воздухе устойчивы, в отличие от таллия, который во влажной атмосфере покрывается слоем гидроксида и быстро разрушается. Уникальная среди металлов кристаллическая решетка галлия, состоящая из атомных пар Ga 2 , обуславливает необычные свойства металлического галлия. Для него характерна низкая температура плавления, меньшая плотность кристаллов по сравнению с жидкостью, большая склонность к переохлаждению. Галлий - вещество с очень большим температурным интервалом существования жидкой фазы. В парах галлий одноатомен.
Галлий, индий, таллий - химически активны. По отношению к различным окислителям они проявляют индивидуальные особенности. Галлий напоминает алюминий (особенно по отношению к щелочам); в HNO 3 растворяется медленно, хорошо растворяется в НС1 и H 2 SO 4 ; таллий хорошо растворяется в HNO 3:
T? + 4HNO 3 = T? (NO 3) 3 + NO + 2H 2 O,
а в НС1 и Н 2 SO 4 медленно из-за пассивирующих пленок Т?С? и T? 2 SO При растворении в кислотах галлий и индий ведут себя как трехвалентные металлы, а таллий образует соли ТI + ; т.к. ион Tl 3+ неустойчив:
2Ga + 6HC? = 2GaC? 3 + 3H 2, ^
2Т? + 2НС?= 2Т?С?+ Н 2 ^
Галлий и индий взаимодействует со щелочами с образованием галлатов и индатов с выделением водорода, причем галлий реагирует быстро, а индий - медленно.
2Ga + 6NaOH + 6H 2 O = 2Na 3 + ЗH 2 .
С водородом галлий, индий и таллий не реагируют. Косвенным путем можно получить легко разлагающиеся гидриды: Ga 2 H 6 (жидкость) и GaН 3 , InН 3 (полимеры, аналогичные АIН 3). При нагревании галлий, индий и таллий образуют оксиды типа Ме 2 O 3 и соответствующие гидроксиды Ме(ОН) 3 (табл. 9).
Повышение устойчивости низких степеней окисления в ряду Ga-In-TI показывает следующая закономерность: Gа 2 O 3 плавится без разложения, Iп 2 O 3 разлагается при нагревании выше 850°С, Т? 2 О 3 начинает отщеплять кислород при 90°С, превращаясь в ТI 2 О.
С увеличением атомного номера возрастает интенсивность окраски: Ga 2 O 3 - белый, In 2 O 3 -светло-желтый, T? 2 O 3 - коричневый. Этот факт указывает на усиление доли ионности в оксидах с ростом атомной массы элемента. Ga 2 O 3 - изоструктурен корунду, а In 2 O 3 и T? 2 O 3 кристализируются в решетке типа О.Ц.К. Взаимодействие со щелочами в указанном ряду ослабевает: Ga 2 O 3 растворяется в растворах щелочей хорошо, образуя гидроксогаллаты, T? 2 O 3 практически не растворяется:
Ga 2 O 3 + 2NaOH +3H 2 O = 2Na .
В расплавах щелочей образуются безводные галлаты:
Ga 2 O 3 + 2NaOH = 2NaGaO 2 + H 2 O.
Гидроксоиндаты Na 3 образуются только при большем избытке щелочи. При действии воды галлаты и индаты полностью гидролизуются:
NaGaO 2 + 2HOH = NaOH + Ga(OH) 3 .
Гидроксиды Ga(OH) 3 , In(OH) 3 , T?(OH) 3 получают действуя растворами щелочей на растворы соответствующих солей. Гидроксид галлия растворяется в сильных кислотах и основаниях. Он является редким примером идеального амфолита, для которого кислотные и основные свойства выражены практически в равной мере. Для обезвоживания Ga(OH) 3 требуется нагревание, а TI(OH) 3 самопроизвольно теряет воду при комнатной температуре, о чем свидетельствуют значения G 0 298:
2Ga(OH) 3 (k) = Ga 2 O 3 (k) + 3H 2 O(r); G 0 298 = - 8 кДж,
2T? (OH) 3 (k) = T? 2 O 3 (k) + 3H 2 O(r); G 0 298 = -117 кДж.
Оксид T? 2 O 3 в отличие от своих аналогов разлагается при 100 о С: и окисляет НС? до С? 2: T? 2 O 3 + 6НС? = 2Т?С?+3Н 2 О +2С? 2.
T? 2 O получают прямым окислением металла на воздухе при небольшом нагревании. TI 2 O - порошок черного цвета; в расплавленном состояниии - желтый, легко растворяется в воде с образованием щелочи, то есть ведет себя как оксид щелочного металла. Расплав TI 2 O разрушает силикаты - стекло, фарфор. Такое же действие оказывает и растворT?OH (сильная щелочь). Гидроксид Т?ОН получают по реакции обмена: гидроксид таллия (I) поглащает угдлекислый газ:
2T?OH + СО 2 = T? 2 СО 3 + Н 2 О
T? 2 СO 3 + СО 2 + Н 2 О = 2T?НСО 3
При комнатной температуре Ga, In, T? реагируют с галогенами F 2 , C? 2 , Br 2 , а при нагревании с I 2 . В результате образуются галогениды ЭГ 3 . По свойствам GaГ 3 ближе к галогенидам неметеллов, а InГ 3 и T?Г 3 к солям.
Известно много солей Ga +3 , In +3 , T? +3 , большинство из них хорошо растворимы в воде. Ионы Ga 3+ , In 3+ бесцветны, T? 3+ имеет светло-желтую окраску. Все соли рассматриваемых металлов Э 3+ подвержены гидролизу. Халькогениды известны для галлия и индия. Для таллия известен сульфид T? 2 S 3 , который может быть получен сухим путем. Гидроксид T?OH получают по реакции обмена:
T?SO 4 + Ba(OH) 2 = BaSO 4 v + 2T?OH
Применение. Металлический галлий и индий используются в вакуумной технике: галлий для жидкометаллических затворов (заменяющих ртутные), в качестве уплотняющих прокладок в аппаратах, где создается высокий вакуум. Галлий можно использовать для изготовления оптических зеркал, отличающихся высокой отражающей способностью.
Разнообразные применения имеют полупроводниковые материалы элементов подгруппы галлия (GaAs, GaSb, InAs, InSb, Т1 2 S 3 и др.). Эти полупроводники работают в фотоэлементах и в фотосопротивлениях, воспринимающих инфракрасное излучение.
3 . Биологическая роль р-элементов III А-группы
Бор. Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10 -5 %. Бор концентрируется главным образом в легких (0,34 мг), щитовидной железе (0,30 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце (0,21 мг). Биологическое действие еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, в виде труднорастворимых солей борной кислоты с катионами металлов.
Избыток бора вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, уменьшает активность адреналина. Предполагается, что снижение активности адреналина, являющегося производным полифенола, связано с его взаимодействием с отоборной кислотой.
Давно известно, что бор необходим высшим растениям, однако данные о его биологической роли противоречивы.
Исследования, проведенные в последние годы, показали, что бор является необходимым для некоторых животных. Установлено, что бор участвует в углеродно-фосфатном обмене, взаимодействует с рядом биологически активных соединений (углеводами, ферментами, витаминами, гормонами). Вместе с тем употребление пищевых продуктов с большим содержанием бора нарушает в организме обмен углеводов и белков, что приводит к возникновению эндемических кишечных заболеваний - энтеритов.
Алюминий. По содержанию в организме человека (10 -5 %) алюминий относится к примесным микроэлемен6там. Алюминий концентрируется главным образом в сыворотке крови, легких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека.
Суточное потребление алюминия человеком составляет 47 мг. Алюминий влияет на развитие эпителиальной и соединительной тканей, на регенерацию костных тканей, влияет на обмен фосфора.
Алюминий оказывает действие на ферментативные процессы. В большинстве случаев катион A? 3+ замещает ионы Э 2+ - активаторы ферментов Е, например, ионы Mg 2+ , Са 2+ :
Э 2+ Е + A? 3+ = Э 2+ + A? 3+ Е
Такая взаимозамещаемость возможна вследствие сходства ряда свойств ионов A? 3+ и Mg 2+ , Са 2+ . Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветворении. Имеются данные, что алюминий может катализировать реакцию трансаминирования (перенос NH 2 -группы.)
Галлий. Галлий - примесный микроэлемент (содержание в организме человека 10- 6 - 10- 5 %). Биологическая роль галлия в живых организмах почти не выяснена.
Индий. В настоящее время биологическое действие индия неизвестно, не имеется достоверных сведений о его наличии в живых организмах. Учитывая близость атомного строения и физико-химических свойств индия и галлия, можно прогнозировать сходство их биологического действия. Очевидно индий, как и алюминий, попадая в организм должен накапливаться в костной и других тканях в виде малорастворимого фосфата.
Таллий. Таллий относится к весьма токсичным элементам. Ион Tl + склонен, подобно Ag + , образовывать прочные соединения с серосодержащими лигандами:
Tl + + R - SH > R - S - Tl + H +
Вследствие этого он токсичен, так как подавляет активность ферментов, содержащих тиогруппы - SH. Даже весьма незначительные количества соединений Tl + при попадании в организм вызывают выпадение волос.
Вследствие близости радиусов К + и Tl + (?r = 11 пм) они обладают сходными свойствами и способны замещать друг друга в ферментах. Ионы Tl + и К + являются синергистами. Этим объясняется тот факт, что ферменты пируваткиназа и диолдегидратаза активируются не только ионами К + , но ионами Tl + (ион Tl + замещает К + в каталитическом центре ферментов). Синергизм таллия и калия проявляется и в том, что подобно ионам К + , ионы Tl + накапливаются в эритроцитах.
В качестве противоядия при отравлениях ионами Tl + используют серосодержащий лиганд - аминокислоту цистин HS-CH 2 CH(NH 2) COOH.
В заключение необходимо отметить, что биологическая роль р-элементов IIIА-группы изучена недостаточно. В настоящее время известно, что бор и галлий взаимодействуют в растениях с ингибиторами их развития полифенолами, уменьшая токсичность последних. Установлена также несомненная роль алюминия в построении эпителиальной и соединительной тканей, а кроме того его участие в ферментативных процессах как в качестве активатора, так и в качестве ингибитора. Свойством ингибировать многие серосодержащие ферменты обладает ион Tl + .
Биологическая активность р-элементов IIIА-группы связана главным образом с их способностью к образованию комплексных соединений с кислородосодержащими лигандами и нерастворимых фосфатов.
4. Элементы IVА группы (подгруппа углерода)
4 .1 Общая характеристика элементов IVА группы
Четвертая главная группа периодической системы включает два типических элемента углерод и кремний, и элементы: германий, олово свинец (подгруппа германия). Углерод является основой органической химии, главным органогенным элементом, необходимым компонентом организма всех живых существ. Второй типический элемент - кремний - основной элемент неорганической химии и всей неживой природы. Кремний и германий - доминирующие полупроводниковые материалы. Интегральные схемы на основе кремния и германия являются основой компьютеров, микропроцессоров и т.д.
Все элементы этой подгруппы содержат по четыре валентных электрона - это ns 2 np 2 электроны. Это число валентных электронов является оптимальным для возникновения тетраэдрических связей по обменному механизму. Некоторые физико-химические константы данных элементов подгруппы приведенные в табл. 10.
В пределах IVА - группы наблюдается зависимость свойств от положения элемента. Так, ОЭО германия больше, чем кремния, хотя первый потенциал ионизации германия меньше. Это объясняется существованием у атома германия в отличие от кремния, заполненного внутреннего 3d 10 - уровня, который служит экраном для р-электронов. В ряду C - Si - Ge - Sn - Pb энергия ионизации уменьшается и увеличивается атомный радиус, то есть усиливаются металлические свойства. Первые два элемента - типичные неметаллы, кремний и германий - полуметаллы. Свинец типичный - металл. Все элементы проявляют степень окисления: +4, +2, причем, сверху вниз устойчивость высокой степени окисления уменьшается, а низкой возрастает. У соединений элементов со степенью окисления (+4) в ряду от углерода к свинцу усиливаются окислительные свойства, а у соединений со степенью окисления (+2) ослабляются восстановительные свойства. Например, германий и олово в степени окисления (+2) являются сильными восстановителями, у соединений Ge (+2) восстановительные свойства настолько сильны, что в отсутствие окислителя они диспропорционируют. Для свинца степень окисления (+2) является наиболее устойчивой, а соединения Pb (+4) - сильные окислители.
Свойства элементов подгруппы углерода
|
Свойства |
||||||
|
Атомный радиус, нм |
||||||
|
Ионный радиус Э -4 , нм |
||||||
|
Ионный радиус Э +4 , нм |
||||||
Потенциал ионизации I, В |
||||||
|
Ширина запрещенной зоны, ЭВ |
5,2 (алмаз) |
|||||
|
Температура плавления, 0 С |
||||||
|
Температура кипения, 0 С |
||||||
|
Плотность, г/см 3 |
3,51 |
|||||
|
Е (Э 3+ р-р /Э), В |
||||||
|
Степень окисления |
4.2 Углерод и его соединения
Природные ресурсы. Содержание углеродав земной коре составляет 0,1%.Встречается как в свободном виде (алмаз, графит), так в связанном состоянии (диоксид углерода, карбонаты, нефть, природный газ, сланцевое масло, битумы).
В зависимости от числа у-связей координационное число углерода равно четырем (sp 3 - гибридизация), трем (sp 2 - гибридизация), или двум (sp - гибридизация) валентных орбиталей:
В соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединятся в полимерные образования координационной (sp 3), слоистой (sp 2) и линейной (sp) структуры.
Этому соответствует три простых типа веществ: алмаз, графит, карбин. В продуктах конденсации паров графита выделена новая модификация углерода - фуллерен.
Алмаз (sp 3) - кристаллическое вещество с атомной координационной решеткой, обладающее большой твердостью и значительной плотностью. Он тверже всех веществ. Его широко используют для резки стекол, бурения горных пород, шлифования особо твердых материалов. Образцы его в чистом виде сильно преломляют свет (светятся). При специальной огранке прозрачных кристаллов получают бриллианты. Это самый дорогой из драгоценных камней. Массу алмаза выражают в каратах (1 карат соответствует 0,2 грамма). Стоимость алмаза растет пропорционально квадрату его массы.
При sp 2 гибридизации образуется плоская структура графита . Графит - черно-серое кристаллическое вещество со слабым металлическим блеском. Расстояние между слоями очень велико (0,335 нм), а межмолекулярные силы между слоями в графите очень малы. Графит расщепляется на тонкие чешуйки, которые сами по себе очень прочны и легко прилипают к бумаге. Графит тугоплавок, из него готовят тигли для металлургии. В ядерных реакторах графит используют в качестве замедлителя нейтронов. Встречается в виде залежей (Алтай), получается из кокса. Переход графита в алмаз осуществляется при температуре 1800°С и давлении 6 ГПа в присутствии растворителей (расплавленный FeS, Та, Ni и др.).
При sp гибридизации образуется карбин , открытый в 1963 году, позднее обнаруженный в природе. Карбин получают путем каталитического окисления ацетилена. Карбин - мелкокристаллический порошок черного цвета. Кристаллы карбина состоят из линейных цепочек углеродных атомов, соединенных чередующимися одинарными и тройными связями:
- С С - С С - … (- С С -) n
По твердости карбин превосходит графит, но уступает алмазу. Обладает полупроводниковыми свойствами. При нагревании (Т=2880°C) без доступа воздуха превращается в графит.
К разновидностям графита относят сажу и древесный уголь. Уголь получается при термическом разложении углеродистых соединений. Уголь представляет собой тонко измельченный графит. Древесный уголь получается при обугливании древесины. Уголь (особенно древесный) содержит большое количество пор, поэтому обладает большой адсорбционной способностью. Адсорбцией называется свойство угля и других твердых тел удерживать на своей поверхности пары, газы и растворенные вещества. Вещества, на поверхности которых происходит адсорбция, называются адсорбентами. Если пропустить через растертый уголь чернила (уголь - адсорбент, чернила - адсорбат), то они обесцвечиваются. В технике в качестве адсорбентов применяются алюмосиликаты. В медицине таблетки из активированного угля используют для удаления вредных веществ.
Химические свойства. При обычной температуре углерод весьма инертен, при определенных условиях проявляет окислительные и восстановительные свойства. Окислительные свойства проявляются в реакциях:
4А1 + 3 = Al 4 +3 С 3 -4 (карбид А?);
СаО + 3С = С +2 О + СаС 2 (карбид Са);
С + 2Н 2 = С -4 H 4 (метан).
Восстановительные свойства для угля более характерны:
С° + О 2 = СО 2 .
Уголь восстанавливает Fe, Cu, Zn, Pb и другие металлы из их оксидов, например:
2ZnO + С° = 2Zn + С +4 О 2 .
При высоких температурах углерод взаимодействует с кислородом, азотом, галогенами и многими другими металлами.
Оксид углерода (II) СО образуется в процессе сгорания угля при недостатке кислорода:
2С + O 2 = 2СО.
В молекуле монооксида тройная химическая связь, поэтому СО характеризуется низкой температурой плавления и малой растворимостью в воде. В промышленности СО получают пропусканием диоксида углерода над раскалённым углём при высокой температуре:
СО 2 + С = 2СО.
Вследствие протекания этой реакции выхлопные газы автомобилей содержат СО, также содержат СО, отходящие газы печей при плохой тяге.
В лаборатории оксид углерода СО получают, добавляя по каплям муравьиную кислоту к концентрированной серной кислоте, которая отнимает от неё воду:
НСООН СО + Н 2 О.
Щавелевая кислота при нагревании с серной кислотой даёт смесь двух оксидов:
Н 2 С 2 0 4 = СО + С0 2 + Н 2 О.
Смесь полученных газов пропускают через раствор гидроксида бария, который поглощает только CO 2 .
Физиологическое действие . Монооксид углерода очень ядовит, смертельная доза СО в воздухе 0,2%. С гемоглобином крови СО связывается прочнее, чем кислород, тем самым блокируя перенос кислорода в организме. Признаки отравления малыми дозами: кровь необычно яркой окраски, сильная головная боль, иногда потеря сознания.
Свойства. Оксид углерода (СО) - бесцветный газ, тяжелее воздуха, мало растворим в воде. Поглощается активированным углём, а также фильтрующим слоем, содержащим I 2 O 5 . Оксид углерода при обычных температурах химически инертен, однако при участии катализаторов реагирует с водородом с образованием углеводородов. Из-за наличия неподеленных пар у углерода и кислорода монооксид углерода является лигандом и образует прочные комплексы с переходными металлами, например, , , . При высоких температурах СО восстанавливает многие металлы из их оксидов:
CO + CuO = Cu + CO 2.
Это свойство оксида углерода (II) используется при выплавке металлов из руд. Соединяясь с серой, образует тиооксид:
Соединяясь с хлором, образует фосген:
СО + C? 2 = СОС? 2 .
Фосген (СОС? 2) - бесцветный газ со слабым сенным запахом. Очень ядовит , в первую мировую войну его использовали как удушающее и отравляющее средство. Фосген медленно гидролизуется водой с образованием соляной и угольной кислот:
СОС? 2 + 2НОН = Н 2 СО 3 + 2НС?.
Диоксид углерода СO 2 - образуется в природе при сгорании и гниении органических веществ. В воздухе его концентрация составляет 0,03%, содержится он также во многих минеральных источниках (нарзан, боржоми). Атмосфера Венеры на 95% состоит из СО 2 . Диоксид углерода ассимилируется в процессе фотосинтеза зелеными растениями с помощью имеющегося у них хлорофилла; при поглощении солнечной энергии в растениях образуются органические вещества (в первую очередь глюкоза), а кислород освобождается и выделяется в атмосферу. Поглощенная энергия при диссимиляции в живых организмах животных и растений снова высвобождается. Диссимиляция органических веществ в организмах - это процесс их окисления в присутствии ферментов с образованием диоксида углерода и воды:
Подобные документы
Физические свойства элементов главной подгруппы III группы. Общая характеристика алюминия, бора. Природные неорганические соединения углерода. Химические свойства кремния. Взаимодействие углерода с металлами, неметаллами и водой. Свойства оксидов.
презентация , добавлен 09.04.2017
Основные классы неорганических соединений. Распространенность химических элементов. Общие закономерности химии s-элементов I, II и III групп периодической системы Д.И. Менделеева: физические, химические свойства, способы получения, биологическая роль.
учебное пособие , добавлен 03.02.2011
Общая характеристика элементов VIA подгруппы, их получение, физические и химические свойства, распространение в природе. Водородные и кислородные соединения халькогенов. Обоснование степеней окисления +IV, +VI. Основные области применения серной кислоты.
презентация , добавлен 11.08.2013
Кальций как один из самых распространенных элементов на Земле, его главные физические и химические свойства, история открытия и исследований. Нахождение элемента в природе, сферы его практического применения. Существующие соединения и биологическая роль.
контрольная работа , добавлен 26.01.2014
Атомные, физические и химические свойства элементов подгруппы меди и их соединений. Содержание элементов подгруппы меди в земной коре. Использование пиро- и гидрометаллургическиех процессов для получения меди. Свойства соединений меди, серебра и золота.
реферат , добавлен 26.06.2014
Общая характеристика химических элементов IV группы таблицы Менделеева, их нахождение в природе и соединения с другими неметаллами. Получение германия, олова и свинца. Физико-химические свойства металлов подгруппы титана. Сферы применения циркония.
презентация , добавлен 23.04.2014
Общая характеристика элементов І группы, их химические и физические свойства, история открытия и особенности способов получения. Литий и его соединения. Закономерности в строении атомов щелочных металлов. Правила хранения некоторых элементов этой группы.
презентация , добавлен 30.11.2012
Характеристика и групповое значение р-элементов. Степени их окисления. Состояние атомов халькогенов. Свойства галогенов. Подгруппа алюминия, азота и углерода. Основные минеральные формы бора. Распространенность в земной коре различных видов минералов.
презентация , добавлен 22.04.2016
Металлы. Методы получения металлов. Химические свойства металлов. Характеристика металлов главной подгруппы I группы. Характеристика элементов главной подгруппы II группы. Характеристика элементов главной подгруппы III группы. Алюминий. Переходные металлы
реферат , добавлен 18.05.2006
Элемент главной подгруппы второй группы, четвертого периода периодической системы химических элементов Д. И. Менделеева. История и происхождение названия. Нахождение кальция в природе. Физические и химические свойства. Применение металлического кальция.
р - ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
1. Общая характеристика р-элементов (р-блок).
Кр-блоку относят 30 элементовIIIА-VIIIА-групп периодической системы. р-Элементы входят во второй и третий малые периоды, а также в четвертый - шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА-VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы).
Строение внешних электронных оболочек атомов элементов р-блока (общая формула п s 2 np a , где а = 1-6).
В периодах слева направо атомные и ионные
радиусы р-элементов по мере увеличения
заряда ядра уменьшаются, энергия
ионизации и сродство к электрону в целом
возрастают, электроотрицательность
увеличивается, окислительная активность
элементных веществ и неметаллические
свойства усиливаются.
периодах слева направо атомные и ионные
радиусы р-элементов по мере увеличения
заряда ядра уменьшаются, энергия
ионизации и сродство к электрону в целом
возрастают, электроотрицательность
увеличивается, окислительная активность
элементных веществ и неметаллические
свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
На свойства р-элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение подуровней внутренних электронных оболочек. р-Элементы второго периода - В, С, N, О, F - резко отличаются от элементов нижеследуюших периодов Так, начиная с р-элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переводить электроны с р-подуровня при возбуждении атомов Полностью заполненный 3d-полуронень у d-элементов четвертого периода - Gа, Gе, Аs, Sе, Вr - обусловливает отличие их свойств от элементов третьего периода Максимальное заполнение 4f-подуровня в шестом периоде аналогично сказывается на различии свойств р-элементов шестого и пятого периода.
Вдоль периода у р-элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. Наоборот, способность к образованию отрицательных ионов с зарядом, равным разности (8 - № группы), возрастает при движении вдоль периода.
р -Элементы
образуют двухатомные молекулы Э 2 ,
различающиеся по устойчивости. Наиболее
устойчивы молекулы Э 2
элементов
второго периода - N 2 ,
О 2
и F 2 .
При переходе от IIIА-
к IVА-
и VА-группам
устойчивость молекул возрастает, а
затем при переходе к VIIIА-группе
понижается. В группах при движении вниз
прочность связи Э-Э уменьшается.
-Элементы
образуют двухатомные молекулы Э 2 ,
различающиеся по устойчивости. Наиболее
устойчивы молекулы Э 2
элементов
второго периода - N 2 ,
О 2
и F 2 .
При переходе от IIIА-
к IVА-
и VА-группам
устойчивость молекул возрастает, а
затем при переходе к VIIIА-группе
понижается. В группах при движении вниз
прочность связи Э-Э уменьшается.
р-Элементы второго периода - азот, кислород и фтор - обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют.
Сходство р-элементов второго периода с р-элементами последующих периодов заключается в основном только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d- и f-подуровней).
При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. В этом направлении увеличивается склонность элементов образовывать комплексные соединения и повышаются координационные числа.
Т ак,
если р-элементы второго периода имеют
в соединениях координационные числа
2, 3, 4, то р-элементы последующих периодов
могут иметь координационные числа 5, 6,
7, 8 и даже 12.
ак,
если р-элементы второго периода имеют
в соединениях координационные числа
2, 3, 4, то р-элементы последующих периодов
могут иметь координационные числа 5, 6,
7, 8 и даже 12.
При переходе вниз по группе устойчивость максимальной положительной степени окисления у р-элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1.
Физические свойства простых веществ р-элементов сильно различаются. Одни вещества - кислород, азот (газы) - кипят и плавятся при очень низких температурах, другие - бор, углерод - при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек атомов, типом химической связи, координационным числом атома.
Таким образом, у p-элементов различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s-элементов.
Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N. Р, О, S, Si, Сl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений - это соединения р-элементов.
Таким образом, изучение р-элементов особенно важно для медиков, так как пять из них - С, N. Р, О и S - являются органогенами и составляют основу живых систем, а ряд других - Р, Сl, I - незаменимые микроэлементы.