تشمل السوائل الموصلة ذوبان ومحاليل الإلكتروليتات، أي. الأملاح والأحماض والقلويات.
عندما تذوب الإلكتروليتات في الماء، تتفكك جزيئاتها إلى أيونات - التفكك الإلكتروليتي. درجة التفكك، أي. تعتمد نسبة الجزيئات الموجودة في المادة المذابة والتي تتفكك إلى أيونات على درجة الحرارة وتركيز المحلول والخواص الكهربائية للمذيب. مع زيادة درجة الحرارة، تزداد درجة التفكك، وبالتالي، يزداد تركيز الأيونات الموجبة والسالبة. عندما تلتقي الأيونات ذات العلامات المختلفة، يمكنها أن تتحد مرة أخرى لتشكل جزيئات محايدة. وتسمى هذه العملية إعادة التركيب. في ظل ظروف ثابتة، يتم إنشاء توازن ديناميكي في المحلول، حيث يكون عدد الجزيئات التي تتفكك إلى أيونات في الثانية مساويًا لعدد أزواج الأيونات التي تتحد في نفس الوقت لتشكل جزيئات محايدة.
وبالتالي، فإن حاملات الشحنة الحرة في توصيل السوائل هي الأيونات الموجبة والسالبة. إذا تم وضع أقطاب كهربائية متصلة بمصدر تيار في السائل، فستبدأ هذه الأيونات في التحرك. يتم توصيل أحد القطبين بالقطب السالب لمصدر التيار - ويسمى الكاثود - والآخر متصل بالقطب الموجب - الأنود. عند توصيلها بمصدر تيار، تبدأ الأيونات الموجودة في محلول الإلكتروليت بتحريك الأيونات السالبة نحو القطب الموجب (الأنود)، والأيونات الموجبة، على التوالي، نحو القطب السالب (الكاثود). أي أنه سيتم إنشاء تيار كهربائي. وتسمى هذه الموصلية في السوائل بالأيونية، لأن حاملات الشحنة هي أيونات.
عندما يمر التيار عبر محلول إلكتروليت، يتم إطلاق مادة عند الأقطاب الكهربائية المرتبطة بتفاعلات الأكسدة والاختزال. عند القطب الموجب، تتخلى الأيونات السالبة عن إلكتروناتها الإضافية (تفاعل الأكسدة)، وعند الكاثود، تستقبل الأيونات الموجبة الإلكترونات المفقودة ( رد فعل الانتعاش). وتسمى هذه العملية التحليل الكهربائي.
أثناء التحليل الكهربائي، يتم إطلاق مادة في الأقطاب الكهربائية. إن اعتماد كتلة المادة المنطلقة m على القوة الحالية ووقت مرور التيار والمادة نفسها تم تأسيسه بواسطة M. Faraday. يمكن الحصول على هذا القانون من الناحية النظرية. لذا فإن كتلة المادة المنطلقة تساوي حاصل ضرب كتلة أيون واحد mi بعدد الأيونات N i التي وصلت إلى القطب خلال الزمن Dt. كتلة الأيون وفقا لصيغة كمية المادة تساوي m i =M/N a، حيث M هو الكتلة الموليةالمواد N a – ثابت أفوجادرو. عدد الأيونات التي وصلت إلى القطب يساوي N i = Dq/q i، حيث Dq هي الشحنة التي مرت عبر المنحل بالكهرباء خلال الزمن Dt (Dq = I*Dt)، q i هي شحنة الأيون، وهو يتحدد بتكافؤ الذرة (q i = n*e، حيث n – تكافؤ الذرة، e – تهمة الابتدائية). عند استبدال هذه الصيغ، نحصل على أن m=M/(neN a)*IDt. إذا أشرنا بـ k (معامل التناسب) =M/(neN a)، فلدينا m=kIDt. هذا تمثيل رياضي لقانون فاراداي الأول - أحد قوانين التحليل الكهربائي. تتناسب كتلة المادة المنطلقة على القطب خلال الزمن Dt أثناء مرور تيار كهربائي مع قوة التيار وهذه الفترة الزمنية. تسمى القيمة k المكافئ الكهروكيميائي لمادة معينة، وهي تساوي عدديًا كتلة المادة المنطلقة على الأقطاب الكهربائية عند نقلها بواسطة أيونات بشحنة تساوي 1 درجة مئوية. [ك]= 1 كجم/Cl. k = M/(neN a) = 1/F*M/n، حيث F هو ثابت فاراداي. F=eN a =9.65*10 4 C/mol. الصيغة المشتقة k=(1/F)*(M/n) هي قانون فاراداي الثاني.
يستخدم التحليل الكهربائي على نطاق واسع في التكنولوجيا لأغراض مختلفة، على سبيل المثال، تغطية سطح معدن واحد بطبقة رقيقة من معدن آخر (طلاء النيكل، طلاء الكروم، طلاء النحاس، إلخ). إذا تأكدت من تقشير الطلاء الإلكتروليتي جيدًا من السطح، فيمكنك الحصول على نسخة من تضاريس السطح. وتسمى هذه العملية بالطلاء الكهربائي. يستخدم التحليل الكهربائي أيضًا لتنقية المعادن من الشوائب، على سبيل المثال، يتم وضع صفائح سميكة من النحاس الخام المستخرج من الخام في الحمام كقطب موجب. أثناء عملية التحليل الكهربائي، يذوب النحاس، وتهبط الشوائب إلى القاع، ويستقر النحاس النقي على الكاثود. يتم أيضًا إنتاج لوحات الدوائر الإلكترونية باستخدام التحليل الكهربائي. يتم لصق نمط معقد رفيع من أسلاك التوصيل على العازل الكهربائي، ثم يتم وضع اللوحة في محلول كهربائي، حيث يتم حفر مناطق الطبقة النحاسية غير المغطاة بالطلاء. بعد ذلك، يتم غسل الطلاء وتظهر تفاصيل الدائرة الدقيقة على السبورة.
تقرير عن الموضوع:
في السوائل
(الشوارد)
التحليل الكهربائي
قوانين فاراداي
الشحنة الكهربائية الأولية
طلاب 8 ذ فصل « ب »
ل أوجينوفا م ألحان أ ندريفني
موسكو 2003
المدرسة رقم 91
مقدمة
يرتبط الكثير في حياتنا بالتوصيل الكهربائي لمحاليل الأملاح في الماء (الشوارد). من أول نبضة للقلب (الكهرباء "الحية" في جسم الإنسان وهي 80٪ ماء) إلى السيارات في الشارع واللاعبين والهواتف المحمولة (جزء لا يتجزأ من هذه الأجهزة هي "البطاريات" - البطاريات الكهروكيميائية والبطاريات المختلفة - من حمض الرصاص في السيارات إلى بوليمر الليثيوم في أغلى الهواتف المحمولة). وفي أحواض ضخمة تتصاعد منها أبخرة سامة، يتم إنتاج الألومنيوم عن طريق التحليل الكهربائي من البوكسيت المنصهر في درجات حرارة عالية - المعدن "المجنح" للطائرات والعلب في فانتا. كل شيء حولنا - من شبكة المبرد المطلية بالكروم لسيارة أجنبية إلى القرط المطلي بالفضة في الأذن - واجه في وقت ما محلولاً أو أملاحًا منصهرة، وبالتالي تيارًا كهربائيًا في السوائل. ليس من قبيل الصدفة أن تتم دراسة هذه الظاهرة من خلال علم كامل - الكيمياء الكهربائية. لكننا الآن مهتمون أكثر الأساس الماديهذه الظاهرة.
تيار كهربائي في المحلول الشوارد
نعلم من دروس الفيزياء للصف الثامن أن الشحنة في الموصلات (المعادن) تحملها إلكترونات سالبة الشحنة.
تسمى الحركة المنظمة للجسيمات المشحونة بالتيار الكهربائي.
لكن إذا قمنا بتجميع جهاز (مع أقطاب الجرافيت):
ثم نتأكد من انحراف إبرة مقياس التيار الكهربائي - يتدفق التيار عبر المحلول! ما هي الجسيمات المشحونة الموجودة في المحلول؟
في عام 1877، قام العالم السويدي سفانتي أرينيوس بدراسة التوصيل الكهربائي للمحاليل مواد مختلفةوتوصل إلى أن سببها هو الأيونات التي تتكون عندما يذوب الملح في الماء. عند ذوبانه في الماء، يتفكك جزيء CuSO 4 (ينفصل) إلى أيونين مشحونين بشكل مختلف - Cu 2+ وSO 4 2-. يمكن أن تنعكس العمليات المبسطة بالصيغة التالية:
CuSO 4ÞCu 2+ +SO 4 2-
تقوم محاليل الأملاح والقلويات والأحماض بتوصيل التيار الكهربائي.
تسمى المواد التي تقوم محاليلها بتوصيل التيار الكهربائي بالكهرباء.
محاليل السكر والكحول والجلوكوز وبعض المواد الأخرى لا توصل الكهرباء.
المواد التي لا توصل محاليلها التيار الكهربائي تسمى غير إلكتروليتات.
التفكك الكهربائي
تسمى عملية تحلل الإلكتروليت إلى أيونات التفكك الكهربائي.
S. ارهينيوس الذي التزم به النظرية الفيزيائيةالمحاليل، لم تأخذ بعين الاعتبار تفاعل المنحل بالكهرباء مع الماء، واعتقدت وجود أيونات حرة في المحاليل. في المقابل، قام الكيميائيان الروسيان أ.أ.كابلوكوف وف.أ. كيستياكوفسكي بتطبيق تفسير التفكك الإلكتروليتي النظرية الكيميائية D.I. Mendeleev وأثبت أنه عندما يذوب المنحل بالكهرباء، تفاعل كيميائيتذوب المادة مع الماء، مما يؤدي إلى تكوين الهيدرات، ثم تتفكك إلى أيونات. لقد اعتقدوا أن المحاليل لا تحتوي على أيونات حرة وليست "عارية"، بل تحتوي على أيونات رطبة، أي "مغطاة بطبقة" من جزيئات الماء. ونتيجة لذلك، يحدث تفكك جزيئات الإلكتروليت بالتسلسل التالي:
أ) اتجاه جزيئات الماء حول أقطاب جزيء المنحل بالكهرباء
ب) ترطيب جزيء المنحل بالكهرباء
ج) التأين
د) تحللها إلى أيونات رطبة
بالنسبة لدرجة التفكك الإلكتروليتي، تنقسم الإلكتروليتات إلى قوية وضعيفة.
- إلكتروليتات قوية- تلك التي تنفصل بشكل شبه كامل عند ذوبانها.
درجة تفككهم تميل إلى الوحدة.
- إلكتروليتات ضعيفة- تلك التي لا تنفصل تقريبًا عند ذوبانها. درجة تفككهم تميل إلى الصفر.
ومن هذا نستنتج أن حاملات الشحنة الكهربائية (حاملات التيار الكهربائي) في المحاليل الإلكتروليتية ليست إلكترونات، بل هي موجبة وسالبة الشحنة الأيونات المائية .
الاعتماد على درجة الحرارة لمقاومة المنحل بالكهرباء
كما ترتفع درجة الحرارةيتم تسهيل عملية التفكك، وزيادة حركة الأيونات و تنخفض مقاومة المنحل بالكهرباء .
الكاثود والأنود. الكاتيونات والأنيونات
ماذا يحدث للأيونات تحت تأثير التيار الكهربائي؟
دعنا نعود إلى أجهزتنا:

في المحلول، يتفكك CuSO 4 إلى أيونات – Cu 2+ وSO 4 2-. أيون موجب الشحنةالنحاس 2+ (الموجبة)ينجذب إلى قطب كهربائي سالب الشحنة - الكاثودحيث يستقبل الإلكترونات المفقودة ويتحول إلى معدن النحاس - مادة بسيطة. إذا قمت بإزالة الكاثود من الجهاز بعد تمرير التيار عبر المحلول، فمن السهل ملاحظة طلاء أحمر-بني - وهو نحاس معدني.
قانون فاراداي الأول
هل يمكننا معرفة كمية النحاس التي تم إطلاقها؟ ومن خلال وزن الكاثود قبل وبعد التجربة، يمكن تحديد كتلة المعدن المترسب بدقة. تظهر القياسات أن كتلة المادة المنطلقة على الأقطاب الكهربائية تعتمد على القوة الحالية ووقت التحليل الكهربائي:
حيث K هو معامل التناسب، ويسمى أيضًا المعادل الكهروكيميائي .
وبالتالي، فإن كتلة المادة المنطلقة تتناسب طرديا مع القوة الحالية ووقت التحليل الكهربائي. ولكن الحالية مع مرور الوقت (وفقا للصيغة):
هناك تهمة.
لذا، تتناسب كتلة المادة المنطلقة على القطب مع الشحنة، أو كمية الكهرباء التي تمر عبر المنحل بالكهرباء.
م = ك ق
تم اكتشاف هذا القانون تجريبياً عام 1843 على يد العالم الإنجليزي مايكل فاراداي ويسمى قانون فاراداي الأول .
قانون فاراداي الثاني
ما هو المعادل الكهروكيميائي وعلى ماذا يعتمد؟ أجاب مايكل فاراداي أيضًا على هذا السؤال.
وبناء على العديد من التجارب، توصل إلى استنتاج مفاده أن هذه القيمة مميزة لكل مادة. لذلك، على سبيل المثال، أثناء التحليل الكهربائي لمحلول اللازورد (نترات الفضة AgNO 3)، تطلق قلادة واحدة 1.1180 ملجم من الفضة؛ يتم إطلاق نفس الكمية تمامًا من الفضة أثناء التحليل الكهربائي بشحنة قلادة واحدة من أي ملح فضي. عند التحليل الكهربائي لملح معدن آخر، تطلق قلادة واحدة كمية أخرى من هذا المعدن. هكذا , المعادل الكهروكيميائي للمادة هو كتلة هذه المادة المنطلقة أثناء التحليل الكهربي بمقدار 1 كولوم من الكهرباء المتدفقة خلال المحلول . وهنا قيمها لبعض المواد:
| مادة |
ك في ملغم / ك |
|
| حج (فضية) |
||
| ح (الهيدروجين) |
||
من الجدول نرى أن المعادلات الكهروكيميائية للمواد المختلفة تختلف اختلافًا كبيرًا عن بعضها البعض. على أي خصائص المادة تعتمد قيمة مكافئها الكهروكيميائي؟ الجواب على هذا السؤال مقدم من قانون فاراداي الثاني :

تتناسب المعادلات الكهروكيميائية لمختلف المواد مع أوزانها الذرية وتتناسب عكسيا مع الأرقام التي تعبر عن تكافؤها الكيميائي.
ن – التكافؤ
أ- الوزن الذري
- يسمى المعادل الكيميائي لمادة معينة
– معامل التناسب، وهو بالفعل ثابت عالمي، أي أن له نفس القيمة لجميع المواد. إذا قمنا بقياس المكافئ الكهروكيميائي بـ g/k، نجد أنه يساوي 1.037´10 -5 g/k.
وبدمج قانون فاراداي الأول والثاني نحصل على:

هذه الصيغة لها معنى فيزيائي بسيط: F تساوي عدديًا الشحنة التي يجب تمريرها عبر أي إلكتروليت من أجل إطلاق مادة على الأقطاب الكهربائية بكمية تساوي مكافئًا كيميائيًا واحدًا. F يسمى عدد فاراداي ويساوي 96400 ك/جم.
المول وعدد الجزيئات الموجودة فيه. رقم أفوجادرو
نعلم من مقرر الكيمياء للصف الثامن أنه يتم قياس كميات المواد الموجودة فيه التفاعلات الكيميائية، تم اختيار وحدة خاصة - الشامة. لقياس مول واحد من مادة ما، عليك أن تأخذ عددًا من الجرامات منها مثل قريبها الوزن الجزيئيله.
على سبيل المثال، 1 مول من الماء (H 2 O) يساوي 18 جرامًا (1 + 1 + 16 = 18)، ومول من الأكسجين (O 2) يساوي 32 جرامًا، ومول من الحديد (Fe) يساوي 56 جرامًا. ولكن ما هو مهم بشكل خاص بالنسبة لنا هو أن 1 مول من أي مادة موجود دائمًا يتضمن نفس عدد الجزيئات .
المول هو كمية من المادة تحتوي على 6 ´ 10 23 جزيء من هذه المادة.
تكريما للعالم الإيطالي أ.أفوجادرو هذا الرقم ( ن) يسمى ثابت أفوجادروأو رقم أفوجادرو .
من الصيغة  ويترتب على ذلك أنه إذا س=و، الذي - التي . وهذا يعني أنه عندما تمر شحنة تساوي 96400 كولوم عبر المنحل بالكهرباء، سيتم إطلاق جرامات من أي مادة. وبعبارة أخرى، لتحرير مول واحد من مادة أحادية التكافؤ، يجب أن تتدفق الشحنة عبر المنحل بالكهرباء س=والمعلقات. لكننا نعلم أن أي مول من المادة يحتوي على نفس العدد من الجزيئات - ن=6×1023. يتيح لنا ذلك حساب شحنة أيون واحد من مادة أحادية التكافؤ - الشحنة الكهربائية الأولية - شحنة إلكترون واحد (!):
ويترتب على ذلك أنه إذا س=و، الذي - التي . وهذا يعني أنه عندما تمر شحنة تساوي 96400 كولوم عبر المنحل بالكهرباء، سيتم إطلاق جرامات من أي مادة. وبعبارة أخرى، لتحرير مول واحد من مادة أحادية التكافؤ، يجب أن تتدفق الشحنة عبر المنحل بالكهرباء س=والمعلقات. لكننا نعلم أن أي مول من المادة يحتوي على نفس العدد من الجزيئات - ن=6×1023. يتيح لنا ذلك حساب شحنة أيون واحد من مادة أحادية التكافؤ - الشحنة الكهربائية الأولية - شحنة إلكترون واحد (!):
تطبيقات التحليل الكهربائي
طريقة التحليل الكهربائي للحصول على المعادن النقية (التكرير والتكرير). التحليل الكهربائي يرافقه حل الأنود
وخير مثال على ذلك هو تنقية (تكرير) النحاس كهربائيا. يتم صب النحاس الذي يتم الحصول عليه مباشرة من الخام في ألواح ويوضع كأنود في محلول CuSO 4. من خلال تحديد الجهد على أقطاب الحمام (0.20-0.25 فولت)، من الممكن التأكد من إطلاق النحاس المعدني فقط عند الكاثود. في هذه الحالة، تدخل الشوائب الأجنبية إما إلى المحلول (دون إطلاقها عند الكاثود) أو تسقط في قاع الحمام على شكل رواسب ("حمأة الأنود"). تتحد كاتيونات مادة الأنود مع أنيون SO 4 2، وعند هذا الجهد يتم إطلاق النحاس المعدني فقط عند الكاثود. يبدو أن الأنود "يذوب". يتيح لنا هذا التنقية تحقيق نقاء بنسبة 99.99% ("التسعات الأربع"). كما يتم أيضًا تنقية المعادن الثمينة (الذهب Au، والفضة Ag) بالمثل (التكرير).
حاليًا، يتم استخراج كل الألومنيوم (Al) كهربائيًا (من ذوبان البوكسيت).
الطلاء الكهربائي
الطلاء الكهربائي – مجال الكيمياء الكهربائية التطبيقية الذي يتعامل مع عمليات تطبيق الطلاءات المعدنية على سطح المنتجات المعدنية وغير المعدنية عندما يمر تيار كهربائي مباشر عبر محاليل أملاحها. وتنقسم تكنولوجيا الطلاء الكهربائي إلى الطلاء الكهربائي و رأب الجلفانوبلاستي .
يمكن استخدام التحليل الكهربائي لتغليف الأجسام المعدنية بطبقة من معدن آخر. هذه العملية تسمى الطلاء الكهربائي. من الأمور ذات الأهمية التقنية الخاصة الطلاءات التي تحتوي على معادن يصعب أكسدةها، وخاصة طلاء النيكل والكروم، بالإضافة إلى طلاء الفضة والذهب، والتي غالبًا ما تستخدم لحماية المعادن من التآكل. للحصول على الطلاء المطلوب، يتم تنظيف الجسم جيدًا وإزالة الشحوم منه ووضعه ككاثود في حمام إلكتروليتي يحتوي على ملح المعدن الذي ترغب في طلاء الجسم به. للحصول على طلاء أكثر تجانسًا، من المفيد استخدام لوحتين كأنود، مع وضع الجسم بينهما.

أيضًا، من خلال التحليل الكهربائي، لا يمكنك طلاء الأشياء بطبقة من معدن أو آخر فحسب، بل يمكنك أيضًا عمل نسخ معدنية بارزة (على سبيل المثال، العملات المعدنية والميداليات). تم اختراع هذه العملية من قبل عضو فيزيائي ومهندس كهربائي روسي الأكاديمية الروسيةعلوم بوريس سيمينوفيتش جاكوبي (1801-1874) في الأربعينيات من القرن التاسع عشر ويسمى الطلاء الكهربائي . لعمل نسخة بارزة من جسم ما، يتم أولاً صنع قالب من بعض المواد البلاستيكية، مثل الشمع. يتم فرك هذا القالب بالجرافيت ويتم غمره في حمام التحليل الكهربائي ككاثود، حيث يتم ترسيب طبقة من المعدن عليه. ويستخدم هذا في الطباعة في إنتاج النماذج المطبوعة.

بالإضافة إلى ما ذكر أعلاه، وجد التحليل الكهربائي تطبيقًا في مجالات أخرى:
الحصول على أفلام واقية من الأكسيد على المعادن (الأنودة)؛
المعالجة السطحية الكهروكيميائية للمنتجات المعدنية (تلميع)؛
الطلاء الكهروكيميائي للمعادن (مثل النحاس والنحاس والزنك والكروم وما إلى ذلك)؛
تنقية الماء هي إزالة الشوائب القابلة للذوبان منه. والنتيجة هي ما يسمى بالماء العذب (خصائصه تشبه الماء المقطر)؛
الشحذ الكهروكيميائي لأدوات القطع (مثل السكاكين الجراحية وشفرات الحلاقة وما إلى ذلك).
قائمة الأدبيات المستخدمة:
1. جورفيتش أ. "الفيزياء. الظواهر الكهرومغناطيسية. الصف الثامن" موسكو، دار نشر"حبارى". 1999
2. غابرييليان أو إس "الكيمياء. الصف الثامن" موسكو، دار النشر "دروفا". 1997
3. "كتاب الفيزياء الابتدائي الذي حرره الأكاديمي جي إس لاندسبيرج - المجلد الثاني - الكهرباء والمغناطيسية." موسكو، "العلم" 1972.
4. إريك إم روجرز. “الفيزياء للعقل المستفسر (أساليب وطبيعة وفلسفة العلوم الفيزيائية)”. "مطبعة جامعة برينستون" 1966. المجلد الثالث - الكهرباء والمغناطيسية. ترجمة موسكو، "العالم" 1971.
5. A. N. Remizov "دورة في الفيزياء والإلكترونيات وعلم التحكم الآلي لـ المعاهد الطبية" موسكو " تخرج من المدرسه» 1982.
يعرف كل شخص تقريبًا تعريف التيار الكهربائي، لكن بيت القصيد هو أن أصله وحركته بيئات مختلفةمختلفة تماما عن بعضها البعض. على وجه الخصوص، التيار الكهربائي في السوائل له خصائص مختلفة قليلا عن إنه على وشكحول نفس الموصلات المعدنية.
والفرق الرئيسي هو أن التيار في السوائل هو حركة الأيونات المشحونة، أي الذرات أو حتى الجزيئات التي فقدت أو اكتسبت إلكترونات لسبب ما. علاوة على ذلك فإن من مؤشرات هذه الحركة التغير في خصائص المادة التي تمر من خلالها هذه الأيونات. استنادا إلى تعريف التيار الكهربائي، يمكننا أن نفترض أنه أثناء التحلل، ستتحرك الأيونات السالبة نحو الموجب والموجب، على العكس من ذلك، نحو السالب.
تسمى عملية تحلل جزيئات المحلول إلى أيونات موجبة وسالبة الشحنة بالتفكك الكهربائي في العلوم. وبالتالي، فإن التيار الكهربائي في السوائل ينشأ بسبب حقيقة أنه على عكس نفس الموصل المعدني، فإن التركيب و الخصائص الكيميائيةهذه السوائل، مما يؤدي إلى حركة الأيونات المشحونة.
التيار الكهربائي في السوائل أصله وكميته خصائص الجودةكانت إحدى المشاكل الرئيسية التي درسها الفيزيائي الشهير إم فاراداي لفترة طويلة. على وجه الخصوص، بمساعدة العديد من التجارب، تمكن من إثبات أن كتلة المادة المنبعثة أثناء التحليل الكهربائي تعتمد بشكل مباشر على كمية الكهرباء والوقت الذي تم فيه إجراء هذا التحليل الكهربائي. ولا تعتمد هذه الكتلة على أي أسباب أخرى، باستثناء نوع المادة.
بالإضافة إلى ذلك، من خلال دراسة التيار في السوائل، وجد فاراداي تجريبيًا أنه لتحرير كيلوغرام واحد من أي مادة أثناء التحليل الكهربائي، يلزم نفس الكمية، التي تساوي 9.65.10 7 ك، تسمى رقم فاراداي.
وعلى عكس الموصلات المعدنية، فإن التيار الكهربائي في السوائل محاط، مما يعيق بشكل كبير حركة أيونات المادة. في هذا الصدد، يمكن توليد تيار جهد صغير فقط في أي إلكتروليت. وفي الوقت نفسه، إذا زادت درجة حرارة المحلول، تزداد موصليته ويزداد المجال.
التحليل الكهربائي له خاصية أخرى مثيرة للاهتمام. بيت القصيد هو أنه كلما زاد عدد جزيئات المادة نفسها والمذيب، زاد احتمال تفكك جزيء معين إلى أيونات موجبة وسالبة الشحنة. في الوقت نفسه، في لحظة معينة، يصبح المحلول مشبعًا بالأيونات، وبعد ذلك تبدأ موصلية المحلول في الانخفاض. وبالتالي، فإن الأقوى سيحدث في المحلول الذي يكون فيه تركيز الأيونات منخفضًا للغاية، ولكن شدة التيار الكهربائي في مثل هذه المحاليل ستكون منخفضة للغاية.
لقد وجدت عملية التحليل الكهربائي تطبيقًا واسعًا في العمليات الصناعية المختلفة المرتبطة بالتفاعلات الكهروكيميائية. وأهمها إنتاج المعادن باستخدام الإلكتروليتات، والتحليل الكهربائي للأملاح التي تحتوي على الكلور ومشتقاته، وتفاعلات الأكسدة والاختزال، وإنتاج مادة ضرورية مثل الهيدروجين، وتلميع الأسطح، والطلاء الكهربائي. على سبيل المثال، في العديد من المؤسسات الميكانيكية وصناعة الأدوات، تكون طريقة التكرير شائعة جدًا، وهي إنتاج المعدن دون أي شوائب غير ضرورية.
التيار الكهربائي في الغازات
حاملات الشحنة: الإلكترونات، الأيونات الموجبة، الأيونات السالبة.
تظهر حاملات الشحنة في الغاز نتيجة التأين: بسبب تشعيع الغاز، أو تصادم جزيئات الغاز الساخنة مع بعضها البعض.
التأين بالتأثير الإلكتروني.
A_(الحقول)=eEl
ه=1.6\cdot 10^(19)Cl ؛
E - اتجاه المجال؛
l هو متوسط المسار الحر بين تصادمين متتاليين للإلكترون مع ذرات الغاز.
A_(الحقول)=eEl\geq W - حالة التأين
W هي طاقة التأين، أي. الطاقة اللازمة لإزالة الإلكترون من الذرة

يزداد عدد الإلكترونات في التقدم الهندسيونتيجة لذلك يحدث انهيار إلكترونى، وبالتالى تفريغ للغاز.
التيار الكهربائي في السائل
السوائل كذلك المواد الصلبةيمكن أن تكون عوازل وموصلات وأشباه الموصلات. تشتمل المواد العازلة على الماء المقطر، وتشمل الموصلات محاليل الإلكتروليتات: الأحماض والقلويات والأملاح والمعادن المنصهرة. أشباه الموصلات السائلة هي ذوبان السيلينيوم والكبريتيد المنصهر.
التفكك الكهربائي
عند إذابة الشوارد تحت التأثير المجال الكهربائيتفكك جزيئات الماء القطبي جزيئات الإلكتروليت إلى أيونات. على سبيل المثال، CuSO_(4)\سهم يمين Cu^(2+)+SO^(2-)_(4).
جنبا إلى جنب مع التفكك، تحدث العملية العكسية - إعادة التركيب ، أي. دمج الأيونات ذات العلامات المعاكسة في جزيئات محايدة.
ناقلات الكهرباء في محاليل الإلكتروليت هي الأيونات. وتسمى هذه الموصلية أيوني .
التحليل الكهربائي
إذا تم وضع الأقطاب الكهربائية في حوض استحمام بمحلول إلكتروليت وتم تطبيق تيار، فستنتقل الأيونات السالبة إلى القطب الموجب، والأيونات الموجبة إلى السالب.
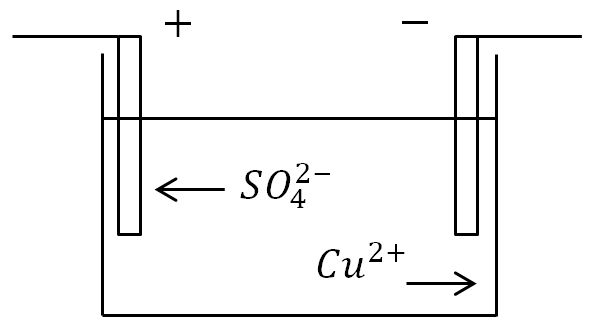
عند القطب الموجب (القطب الموجب)، تتخلى الأيونات السالبة عن الإلكترونات الإضافية (تفاعل الأكسدة)، وعند الكاثود (القطب السالب)، تتلقى الأيونات الموجبة الإلكترونات المفقودة (تفاعل الاختزال).
تعريف.تسمى عملية إطلاق المواد على الأقطاب الكهربائية المرتبطة بتفاعلات الأكسدة والاختزال التحليل الكهربائي.
قوانين فاراداي
أنا. تتناسب كتلة المادة التي يتم إطلاقها على القطب بشكل مباشر مع الشحنة المتدفقة عبر المنحل بالكهرباء:
م=كف
ك هو المعادل الكهروكيميائي للمادة.
س=I\دلتا تي، إذن
م = كي \ دلتا ر
ك=\فارك(1)(F)\فارك(\مو)(ن)
\frac(\mu)(n) - المعادل الكيميائي للمادة؛
\mu - الكتلة المولية؛
ن - التكافؤ
تتناسب المعادلات الكهروكيميائية للمواد مع المكافئات الكيميائية.
F - ثابت فاراداي.
الماء كمذيب عالمي.. المحاليل المائية.. التفكك الإلكتروليتي.. الإلكتروليت.. الإلكتروليتات الضعيفة والقوية.. الناقلات الشحنات الكهربائيةفي السائل.. الأيونات الموجبة والسالبة.. التحليل الكهربائي.. يذوب.. طبيعة التيار الكهربائي في المصهورات..
من شروط حدوث التيار الكهربائي وجود شحنات حرة قادرة على التحرك تحت تأثير المجال الكهربائي. وتحدثنا أيضًا عن طبيعة التيار الكهربائي في المعادن.
في هذا الدرس سنحاول معرفة ذلك ما هي الجزيئات التي تحمل شحنة كهربائية في السوائل وتذوب.
الماء كمذيب عالمي
وكما نعلم فإن الماء المقطر لا يحتوي على حاملات شحنة وبالتالي لا يوصل التيار الكهربائي، أي أنه عازل. ومع ذلك، فإن وجود أي شوائب يجعل الماء موصلًا جيدًا إلى حد ما.
يتمتع الماء بقدرة هائلة على إذابة كل شيء تقريبًا العناصر الكيميائية. عندما تذوب مواد مختلفة (الأحماض والقلويات والقواعد والأملاح وغيرها) في الماء، يصبح المحلول موصلاً بسبب تحلل جزيئات المادة إلى أيونات. وتسمى هذه الظاهرة بالتفكك الإلكتروليتي، والمحلول نفسه عبارة عن إلكتروليت قادر على توصيل التيار الكهربائي. جميع المسطحات المائية على الأرض هي، إلى حد أكبر أو أقل، إلكتروليتات طبيعية.
المحيط العالمي عبارة عن محلول لأيونات جميع عناصر الجدول الدوري تقريبًا.
عصير المعدة والدم واللمف وجميع السوائل في جسم الإنسان هي إلكتروليتات. تتكون جميع الحيوانات والنباتات أيضًا بشكل أساسي من إلكتروليتات.
وفقا لدرجة التفكك، هناك إلكتروليتات ضعيفة وقوية. الماء إلكتروليت ضعيف، ومعظم الأحماض غير العضوية كذلك إلكتروليتات قوية. تسمى الإلكتروليتات أيضًا بالموصلات من النوع الثاني.
ناقلات الشحنة الكهربائية في السوائل
 عندما تذوب مواد مختلفة في الماء (أو سائل آخر)، فإنها تتحلل إلى أيونات.
عندما تذوب مواد مختلفة في الماء (أو سائل آخر)، فإنها تتحلل إلى أيونات.
على سبيل المثال، ينفصل ملح الطعام الشائع NaCl (كلوريد الصوديوم) الموجود في الماء إلى أيونات الصوديوم الموجبة (Na +) وأيونات الكلور السالبة (Cl -). إذا كان القطبان في المنحل بالكهرباء الناتج في إمكانات مختلفة، فإن الأيونات السالبة تنجرف نحو القطب الموجب بينما تنجرف الأيونات الموجبة نحو القطب السالب.
وبالتالي، فإن التيار الكهربائي في السائل يتكون من تدفقات من الأيونات الموجبة والسالبة الموجهة نحو بعضها البعض.
في حين أن الماء النقي تمامًا هو مادة عازلة، فإن الماء الذي يحتوي حتى على شوائب صغيرة (طبيعية أو مدخلة من الخارج) من المادة المتأينة هو موصل للتيار الكهربائي.
التحليل الكهربائي

نظرًا لأن الأيونات الموجبة والسالبة للمذاب تنجرف إلى الداخل تحت تأثير المجال الكهربائي جوانب مختلفة، تنقسم المادة تدريجياً إلى قسمين.
يسمى هذا الفصل للمادة إلى العناصر المكونة لها بالتحليل الكهربائي.
تستخدم الإلكتروليتات في الكيمياء الكهربائية المصادر الكيميائيةالتيار (الخلايا الفولتية والبطاريات)، في عمليات إنتاج الطلاء الكهربائي وغيرها من التقنيات القائمة على حركة الشحنات الكهربائية في السوائل تحت تأثير المجال الكهربائي.
يذوب
من الممكن تفكك المادة دون مشاركة الماء. يكفي لإذابة البلورات التركيب الكيميائيالمواد والحصول على ذوبان. إن ذوبان المادة، تمامًا مثل الإلكتروليتات المائية، هي موصلات من النوع الثاني، وبالتالي يمكن تسميتها بالكهرباء. التيار الكهربائي في المواد المصهورة له نفس طبيعة التيار في الشوارد المائية - وهي عبارة عن تدفقات مضادة للأيونات الموجبة والسالبة.

باستخدام المصهورات، تنتج المعادن الألومنيوم باستخدام طريقة التحليل الكهربائي من الألومينا. يتم تمرير تيار كهربائي عبر أكسيد الألومنيوم وأثناء عملية التحليل الكهربائي، يتراكم الألومنيوم النقي في أحد الأقطاب الكهربائية (الكاثود). هذه عملية كثيفة الاستهلاك للطاقة، والتي من حيث استهلاك الطاقة تذكرنا بتحلل الماء إلى هيدروجين وأكسجين باستخدام التيار الكهربائي.
في ورشة التحليل الكهربائي للألمنيوم


























