U tečnosti koje su provodnici spadaju taline i rastvori elektrolita, tj. soli, kiseline i alkalije.
Kada se elektroliti otapaju u vodi, njihovi molekuli se raspadaju u ione - elektrolitička disocijacija. Stepen disocijacije, tj. Udio molekula u otopljenoj tvari koji su se razbili na ione ovisi o temperaturi, koncentraciji otopine i električnim svojstvima rastvarača. Sa povećanjem temperature, stepen disocijacije raste i, posljedično, koncentracija pozitivno i negativno nabijenih jona raste. Kada se sretnu joni različitih znakova, oni se ponovo mogu ujediniti u neutralne molekule. Ovaj proces se naziva rekombinacija. Pod stalnim uslovima, u rastvoru se uspostavlja dinamička ravnoteža u kojoj je broj molekula koji se u sekundi raspadaju na ione jednak broju parova jona koji se istovremeno rekombinuju u neutralne molekule.
Dakle, slobodni nosioci naboja u provodnim tečnostima su pozitivni i negativni joni. Ako se elektrode spojene na izvor struje stave u tekućinu, ti ioni će se početi kretati. Jedna od elektroda je spojena na negativni pol izvora struje - zove se katoda - druga je povezana s pozitivnim polom - anodom. Kada su spojeni na izvor struje, ioni u otopini elektrolita počinju pomicati negativne ione prema pozitivnoj elektrodi (anodi), odnosno pozitivni ioni prema negativnoj elektrodi (katodi). Odnosno, uspostaviće se električna struja. Takva provodljivost u tečnostima naziva se jonska, jer su nosioci naboja joni.
Kada struja prolazi kroz otopinu elektrolita, na elektrodama se oslobađa supstanca povezana s redoks reakcijama. Na anodi negativni ioni daju svoje dodatne elektrone (oksidaciona reakcija), a na katodi pozitivni ioni prihvataju elektrone koji nedostaju ( reakcija oporavka). Ovaj proces se naziva elektroliza.
Tokom elektrolize, na elektrodama se oslobađa supstanca. Zavisnost mase oslobođene supstance m o jačini struje, vremenu prolaska struje i same supstance ustanovio je M. Faraday. Ovaj zakon se može dobiti teoretski. Dakle, masa oslobođene supstance jednaka je proizvodu mase jednog jona m i sa brojem jona N i koji su stigli do elektrode za vreme Dt. Masa jona prema formuli za količinu supstance jednaka je m i =M/N a, gdje je M molarna masa supstance, N a – Avogadrova konstanta. Broj jona koji stignu do elektrode jednak je N i =Dq/qi, gdje je Dq naboj koji je prošao kroz elektrolit za vrijeme Dt (Dq=I*Dt), qi je naboj jona koji se određuje valencijom atoma (q i = n*e, gdje je n – valencija atoma, e – elementarnog naboja). Prilikom zamjene ovih formula dobijamo da je m=M/(neN a)*IDt. Ako označimo sa k (koeficijent proporcionalnosti) =M/(neN a), onda imamo m=kIDt. Ovo je matematički prikaz prvog Faradejevog zakona - jednog od zakona elektrolize. Masa supstance koja se oslobađa na elektrodi tokom vremena Dt tokom prolaska električne struje proporcionalna je jačini struje i ovom vremenskom periodu. Vrijednost k naziva se elektrohemijski ekvivalent date supstance, koja je numerički jednaka masi supstance koja se oslobađa na elektrodama kada je prenose joni naelektrisanja jednakog 1 C. [k]= 1 kg/Cl. k = M/(neN a) = 1/F*M/n, gdje je F Faradejeva konstanta. F=eN a =9,65*10 4 C/mol. Izvedena formula k=(1/F)*(M/n) je drugi Faradejev zakon.
Elektroliza se široko koristi u tehnologiji u različite svrhe, na primjer, pokrivanje površine jednog metala tankim slojem drugog (niklovanje, kromiranje, bakreno prevlačenje itd.). Ako osigurate dobro ljuštenje elektrolitskog premaza s površine, možete dobiti kopiju topografije površine. Ovaj proces se naziva galvanizacija. Elektroliza se također koristi za pročišćavanje metala od nečistoća, na primjer, debeli listovi sirovog bakra dobivenog iz rude stavljaju se u kadu kao anoda. Tokom procesa elektrolize, bakar se otapa, nečistoće padaju na dno, a čisti bakar se taloži na katodi. Elektronske ploče se također proizvode elektrolizom. Tanka složena šara spojnih žica zalijepi se na dielektrik, zatim se ploča stavlja u elektrolit, gdje se urezuju područja bakrenog sloja koja nisu prekrivena bojom. Nakon toga, boja se ispere i na ploči se pojavljuju detalji mikrokola.
Izvještaj na temu:
u tečnostima
(elektroliti)
Elektroliza
Faradejevi zakoni
Elementarni električni naboj
Studenti 8 th klasa « B »
L Oginova M arije A ndreevny
Moskva 2003
Škola br. 91
Uvod
Mnogo toga u našim životima je povezano sa električnom provodljivošću rastvora soli u vodi (elektroliti). Od prvog otkucaja srca („živi“ elektricitet u ljudskom tijelu, koji je 80% vode) do automobila na ulici, igrača i mobilnih telefona (sastavni dio ovih uređaja su „baterije“ – elektrohemijske baterije i razne baterije - od olovne kiseline u automobilima do litijum polimera u najskupljim mobilnim telefonima). U ogromnim bačvama koje puše otrovnim isparenjima, aluminij se proizvodi elektrolizom iz boksita otopljenog na visokim temperaturama - "krilati" metal za avione i limenke za Fantu. Sve oko sebe – od hromirane rešetke hladnjaka stranog automobila do posrebrene minđuše u uhu – u nekom trenutku je naišlo na rastvor ili rastopljene soli, a samim tim i na električnu struju u tečnostima. Nije uzalud što ovaj fenomen proučava čitava nauka - elektrohemija. Ali sada smo više zainteresovani fizičku osnovu ovaj fenomen.
Električna struja u rastvoru. Elektroliti
Iz nastave fizike u 8. razredu znamo da naelektrisanje u provodnicima (metalima) nose negativno nabijeni elektroni.
Uređeno kretanje nabijenih čestica naziva se električna struja.
Ali ako sastavimo uređaj (sa grafitnim elektrodama):
tada ćemo se pobrinuti da se igla ampermetra skrene - struja teče kroz rješenje! Koje naelektrisane čestice ima u rastvoru?
Davne 1877. godine, švedski naučnik Svante Arrhenius, proučavajući električnu provodljivost rastvora razne supstance, došao do zaključka da su njen uzrok joni koji nastaju kada se sol otopi u vodi. Kada se rastvori u vodi, molekul CuSO 4 se raspada (disocira) na dva različito nabijena jona - Cu 2+ i SO 4 2-. Pojednostavljeni procesi se mogu prikazati sljedećom formulom:
CuSO 4 ÞCu 2+ +SO 4 2-
Otopine soli, alkalija i kiselina provode električnu struju.
Supstance čiji rastvori provode električnu struju nazivaju se elektroliti.
Otopine šećera, alkohola, glukoze i nekih drugih supstanci ne provode struju.
Tvari čije otopine ne provode električnu struju nazivaju se neelektroliti.
Elektrolitička disocijacija
Proces razgradnje elektrolita na jone naziva se elektrolitička disocijacija.
S. Arrhenius, koji se pridržavao fizička teorija otopine, nisu uzimali u obzir interakciju elektrolita s vodom i vjerovali su da u otopinama ima slobodnih jona. Nasuprot tome, ruski hemičari I.A.Kablukov i V.A.Kistjakovski su primenili na objašnjenje elektrolitičke disocijacije hemijska teorija D.I.Mendeljejev i dokazao da kada se elektrolit otapa, hemijska reakcija otopljenu supstancu s vodom, što dovodi do stvaranja hidrata, a zatim se oni disociraju na ione. Vjerovali su da otopine sadrže ne slobodne, ne "gole" ione, već hidratizirane, odnosno "obučene u kaput" od molekula vode. Posljedično, disocijacija molekula elektrolita se događa u sljedećem redoslijedu:
a) orijentacija molekula vode oko polova molekula elektrolita
b) hidratacija molekula elektrolita
c) njegovu jonizaciju
d) njegovu razgradnju na hidratizirane jone
U odnosu na stepen elektrolitičke disocijacije, elektroliti se dele na jake i slabe.
- Jaki elektroliti- one koje se rastvaraju skoro potpuno.
Njihov stepen disocijacije teži jedinstvu.
- Slabi elektroliti- one koje se skoro ne raspadaju kada se rastvore. Njihov stepen disocijacije teži nuli.
Iz ovoga zaključujemo da nosioci električnog naboja (nosioci električne struje) u otopinama elektrolita nisu elektroni, već pozitivno i negativno nabijeni hidratisani joni .
Temperaturna ovisnost otpora elektrolita
Kako temperatura raste olakšava se proces disocijacije, povećava se pokretljivost jona i otpor elektrolita pada .
Katoda i anoda. Kationi i anioni
Šta se dešava sa jonima pod uticajem električne struje?
Vratimo se na naš uređaj:

U rastvoru se CuSO 4 disocira na jone – Cu 2+ i SO 4 2-. Pozitivno nabijeni ion Cu 2+ (kation) privlači negativno nabijenu elektrodu – katoda, gdje prima elektrone koji nedostaju i svodi se na metal bakra – jednostavna supstanca. Ako uklonite katodu iz uređaja nakon prolaska struje kroz otopinu, lako je primijetiti crveno-smeđi premaz - to je metalni bakar.
Faradejev prvi zakon
Možemo li saznati koliko je bakra oslobođeno? Vaganjem katode prije i poslije eksperimenta, može se precizno odrediti masa deponovanog metala. Mjerenja pokazuju da masa tvari koja se oslobađa na elektrodama ovisi o jačini struje i vremenu elektrolize:
gdje je K koeficijent proporcionalnosti, koji se također naziva elektrohemijski ekvivalent .
Posljedično, masa oslobođene tvari je direktno proporcionalna jačini struje i vremenu elektrolize. Ali aktuelno tokom vremena (prema formuli):
postoji naknada.
dakle, masa tvari koja se oslobađa na elektrodi proporcionalna je naboju, odnosno količini električne energije koja prolazi kroz elektrolit.
M=K´q
Ovaj zakon je eksperimentalno otkrio 1843. godine engleski naučnik Michael Faraday i zove se Prvi Faradejev zakon .
Faradejev drugi zakon
Šta je elektrohemijski ekvivalent i od čega zavisi? Michael Faraday je također odgovorio na ovo pitanje.
Na osnovu brojnih eksperimenata došao je do zaključka da je ova vrijednost karakteristična za svaku supstancu. Tako, na primjer, tokom elektrolize otopine lapisa (srebrni nitrat AgNO 3), 1 privjesak oslobađa 1,1180 mg srebra; potpuno ista količina srebra se oslobađa tokom elektrolize sa punjenjem od 1 privjeska bilo koje srebrne soli. Prilikom elektrolize soli drugog metala, 1 privjesak oslobađa drugu količinu tog metala. Dakle , Elektrohemijski ekvivalent supstance je masa ove supstance koja se oslobađa tokom elektrolize od strane 1 kulona električne energije koji teče kroz rastvor . Evo njegovih vrijednosti za neke supstance:
| Supstanca |
K u mg/k |
|
| Ag (srebro) |
||
| H (vodik) |
||
Iz tabele vidimo da se elektrohemijski ekvivalenti različitih supstanci značajno razlikuju jedni od drugih. Od kojih svojstava supstance zavisi vrednost njenog elektrohemijskog ekvivalenta? Odgovor na ovo pitanje daje Faradejev drugi zakon :

Elektrohemijski ekvivalenti različitih supstanci su proporcionalni njihovoj atomskoj težini i obrnuto proporcionalni brojevima koji izražavaju njihovu hemijsku valenciju.
n – valencija
A – atomska težina
- naziva se hemijski ekvivalent date supstance
– koeficijent proporcionalnosti, koji je već univerzalna konstanta, odnosno ima istu vrijednost za sve supstance. Ako izmjerimo elektrohemijski ekvivalent u g/k, nalazimo da je jednak 1,037´10 -5 g/k.
Kombinacijom Faradejevog prvog i drugog zakona dobijamo:

Ova formula ima jednostavno fizičko značenje: F je numerički jednak naboju koji se mora proći kroz bilo koji elektrolit da bi se oslobodila supstanca na elektrodama u količini jednakoj jednom hemijskom ekvivalentu. F se zove Faradejev broj i jednak je 96400 k/g.
Mol i broj molekula u njemu. Avogadrov broj
Iz kursa hemije u 8. razredu znamo da se mjere količine supstanci uključene u hemijske reakcije, izabrana je posebna jedinica - krtica. Da biste izmjerili jedan mol tvari, potrebno je uzeti onoliko grama koliko je relativna molekularne težine njegov.
Na primjer, 1 mol vode (H 2 O) je jednak 18 grama (1 + 1 + 16 = 18), mol kisika (O 2) je 32 grama, a mol željeza (Fe) je 56 grama. Ali ono što je za nas posebno važno je da je 1 mol bilo koje supstance uvek sadrži isti broj molekula .
Mol je količina supstance koja sadrži 6 ´ 10 23 molekula ove supstance.
U čast italijanskog naučnika A. Avogadra, ovaj broj ( N) se zove Avogadrova konstanta ili Avogadrov broj .
Iz formule  slijedi da ako q=F, To . To znači da kada naelektrisanje od 96.400 kulona prođe kroz elektrolit, oslobađa se grama bilo koje supstance. Drugim riječima, da bi se oslobodio jedan mol jednovalentne tvari, naboj mora protjecati kroz elektrolit q=F privesci. Ali znamo da svaki mol supstance sadrži isti broj molekula - N=6x10 23. To nam omogućava da izračunamo naboj jednog jona monovalentne tvari - elementarni električni naboj - naboj jednog (!) elektrona:
slijedi da ako q=F, To . To znači da kada naelektrisanje od 96.400 kulona prođe kroz elektrolit, oslobađa se grama bilo koje supstance. Drugim riječima, da bi se oslobodio jedan mol jednovalentne tvari, naboj mora protjecati kroz elektrolit q=F privesci. Ali znamo da svaki mol supstance sadrži isti broj molekula - N=6x10 23. To nam omogućava da izračunamo naboj jednog jona monovalentne tvari - elementarni električni naboj - naboj jednog (!) elektrona:
Primjena elektrolize
Elektrolitička metoda za dobijanje čistih metala (rafinacija, rafinacija). Elektroliza praćena otapanjem anode
Dobar primjer je elektrolitičko pročišćavanje (rafiniranje) bakra. Bakar dobijen direktno iz rude se lijeva u ploče i stavlja kao anoda u otopinu CuSO 4. Odabirom napona na elektrodama kupke (0,20-0,25 V), moguće je osigurati da se na katodi oslobađa samo metalni bakar. U tom slučaju strane nečistoće ili odlaze u otopinu (bez oslobađanja na katodi) ili padaju na dno kupke u obliku sedimenta („anodni mulj“). Kationi anodne supstance se kombinuju sa anjonom SO 4 2- i pri tom naponu se na katodi oslobađa samo metalni bakar. Čini se da se anoda „rastvara“. Ovo pročišćavanje nam omogućava da postignemo čistoću od 99,99% („četiri devetke“). Slično se prečišćavaju i plemeniti metali (zlato Au, srebro Ag) (rafiniranje).
Trenutno se sav aluminijum (Al) vadi elektrolitički (iz taline boksita).
Galvanizacija
Galvanizacija je oblast primijenjene elektrohemije koja se bavi procesima nanošenja metalnih premaza na površinu metalnih i nemetalnih proizvoda kada jednosmjerna električna struja prolazi kroz otopine njihovih soli. Tehnologija galvanizacije se dijeli na galvanizacija I galvanizacija .
Elektroliza se može koristiti za premazivanje metalnih predmeta slojem drugog metala. Ovaj proces se zove galvanizacija. Od posebnog tehničkog značaja su premazi sa teško oksidirajućim metalima, posebno niklom i hromiranjem, kao i srebrom i pozlatom, koji se često koriste za zaštitu metala od korozije. Da bi se dobili željeni premazi, predmet se temeljito očisti, dobro odmasti i stavi kao katoda u elektrolitičku kupku koja sadrži sol metala kojom se predmet želi premazati. Za ravnomjerniji premaz, korisno je koristiti dvije ploče kao anodu, postavljajući predmet između njih.

Također, putem elektrolize, ne možete samo premazati predmete slojem jednog ili drugog metala, već i napraviti njihove reljefne metalne kopije (na primjer, kovanice, medalje). Ovaj proces je izmislio ruski fizičar i elektroinženjer, član Ruska akademija nauke Boris Semenovič Jakobi (1801-1874) četrdesetih godina 19. veka i tzv. galvanizacija . Da bi se napravila reljefna kopija predmeta, prvo se pravi odljevak od nekog plastičnog materijala, poput voska. Ovaj odljevak se utrlja grafitom i uroni u elektrolitičku kupku kao katoda, gdje se na nju nanosi sloj metala. Ovo se koristi u štampi u proizvodnji štampanih formi.

Osim gore navedenih, elektroliza je našla primjenu u drugim područjima:
Dobivanje oksidnih zaštitnih filmova na metalima (eloksiranje);
Elektrokemijska obrada metalnih proizvoda (poliranje);
Elektrohemijsko farbanje metala (na primjer, bakra, mesinga, cinka, kroma, itd.);
Prečišćavanje vode je uklanjanje rastvorljivih nečistoća iz nje. Rezultat je takozvana meka voda (njena svojstva su slična destilovanoj vodi);
Elektrohemijsko oštrenje reznih instrumenata (na primjer, hirurški noževi, brijači, itd.).
Spisak korišćene literature:
1. Gurevich A. E. “Fizika. Elektromagnetne pojave. 8. razred" Moskva, Izdavačka kuća"Drofa". 1999
2. Gabrielyan O. S. “Hemija. 8. razred" Moskva, Izdavačka kuća "Drofa". 1997
3. “Elementarni udžbenik fizike priredio akademik G. S. Landsberg – tom II – elektricitet i magnetizam.” Moskva, "Nauka" 1972.
4. Eric M. Rogers. "Fizika za istražni um (metode, priroda i filozofija fizičke nauke)". "Princeton University Press" 1966. Tom III - elektricitet i magnetizam. Prevod Moskva, „Svet“ 1971.
5. A. N. Remizov „Kurs fizike, elektronike i kibernetike za medicinskih instituta" Moskva, " postdiplomske škole» 1982.
Gotovo svaka osoba zna definiciju električne struje kao Međutim, cijela poenta je u tome što je njeno nastanak i kretanje različitim okruženjima prilično različite jedna od druge. Konkretno, električna struja u tekućinama ima nešto drugačija svojstva od Radi se o otprilike iste metalne provodnike.
Glavna razlika je u tome što je struja u tekućinama kretanje nabijenih jona, odnosno atoma ili čak molekula koji su iz nekog razloga izgubili ili dobili elektrone. Štoviše, jedan od pokazatelja ovog kretanja je promjena u svojstvima tvari kroz koju ti ioni prolaze. Na osnovu definicije električne struje, možemo pretpostaviti da će se tokom raspadanja negativno nabijeni joni kretati prema pozitivnim, a pozitivnim, naprotiv, prema negativnim.
Proces razgradnje molekula otopine na pozitivno i negativno nabijene ione u nauci se naziva elektrolitička disocijacija. Dakle, električna struja u tekućinama nastaje zbog činjenice da, za razliku od istog metalnog provodnika, sastav i hemijska svojstva ove tečnosti, što rezultira kretanjem naelektrisanih jona.
Električna struja u tečnostima, njeno poreklo, kvantitativno i karakteristike kvaliteta bili su jedan od glavnih problema koje je dugo proučavao poznati fizičar M. Faraday. Konkretno, uz pomoć brojnih eksperimenata, uspio je dokazati da masa tvari koja se oslobađa tijekom elektrolize direktno ovisi o količini električne energije i vremenu tijekom kojeg je ta elektroliza provedena. Ova masa ne zavisi od drugih razloga, osim od vrste supstance.
Osim toga, proučavajući struju u tekućinama, Faraday je eksperimentalno otkrio da je za oslobađanje jednog kilograma bilo koje tvari tijekom elektrolize potrebna ista količina, jednaka 9,65,10 7 k., nazvana je Faradayev broj.
Za razliku od metalnih vodiča, električna struja u tekućinama je okružena, što značajno otežava kretanje iona tvari. S tim u vezi, u bilo kojem elektrolitu može se generirati samo mala struja napona. Istovremeno, ako se temperatura otopine povećava, povećava se njegova vodljivost i povećava se polje.
Elektroliza ima još jedno zanimljivo svojstvo. Stvar je u tome da što je veći broj molekula same supstance i rastvarača, veća je verovatnoća da se određeni molekul raspadne na pozitivno i negativno naelektrisane ione. Istovremeno, u određenom trenutku otopina postaje prezasićena ionima, nakon čega provodljivost otopine počinje opadati. Tako će se najjače javiti u otopini u kojoj je koncentracija iona izuzetno niska, ali će intenzitet električne struje u takvim otopinama biti izuzetno nizak.
Proces elektrolize našao je široku primjenu u različitim industrijskim procesima povezanim s elektrohemijskim reakcijama. Najvažnije od njih uključuju proizvodnju metala pomoću elektrolita, elektrolizu soli koje sadrže klor i njegove derivate, redoks reakcije, proizvodnju tako potrebne tvari kao što je vodik, poliranje površine i galvanizaciju. Na primjer, u mnogim preduzećima za proizvodnju mašina i instrumenata vrlo je uobičajena metoda rafiniranja, a to je proizvodnja metala bez ikakvih nepotrebnih nečistoća.
Električna struja u plinovima
Nosioci naboja: elektroni, pozitivni ioni, negativni ioni.
Nosači naboja se pojavljuju u plinu kao rezultat ionizacije: zbog zračenja plina, ili sudara zagrijanih čestica plina međusobno.
Ionizacija elektronskim udarom.
A_(polja)=eEl
e=1.6\cdot 10^(19)Cl ;
E - smjer polja;
l je srednji slobodni put između dva uzastopna sudara elektrona sa atomima gasa.
A_(polja)=eEl\geq W - stanje jonizacije
W je energija jonizacije, tj. energija potrebna za uklanjanje elektrona iz atoma

Broj elektrona se povećava u geometrijska progresija, kao rezultat toga, dolazi do lavine elektrona, a posljedično i do pražnjenja u plinu.
Električna struja u tečnosti
Tečnosti kao i čvrste materije mogu biti dielektrici, provodnici i poluprovodnici. Dielektrici uključuju destilovanu vodu, provodnici uključuju otopine elektrolita: kiselina, lužina, soli i rastopljenih metala. Tečni poluprovodnici su rastopljeni selen i sulfidna talina.
Elektrolitička disocijacija
Prilikom rastvaranja elektrolita pod utjecajem električno polje Polarne molekule vode razlažu molekule elektrolita u ione. na primjer, CuSO_(4)\rightarrow Cu^(2+)+SO^(2-)_(4).
Zajedno sa disocijacijom, dešava se i obrnuti proces - rekombinacija , tj. spajanje jona suprotnih predznaka u neutralne molekule.
Nosioci električne energije u otopinama elektrolita su joni. Ova provodljivost se zove jonski .
Elektroliza
Ako se elektrode stave u kadu s otopinom elektrolita i dovede se struja, tada će se negativni ioni premjestiti na pozitivnu elektrodu, a pozitivni ioni na negativnu.
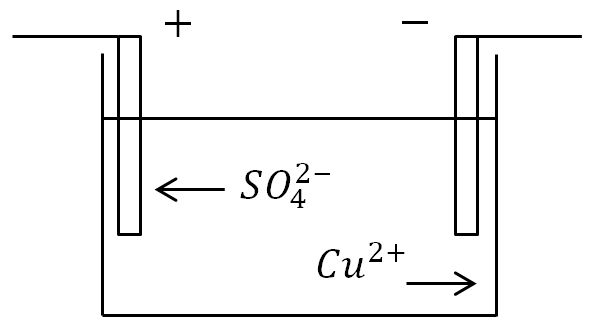
Na anodi (pozitivna elektroda), negativno nabijeni ioni daju dodatne elektrone (reakcija oksidacije), a na katodi (negativna elektroda), pozitivni ioni primaju elektrone koji nedostaju (reakcija redukcije).
Definicija. Proces oslobađanja tvari na elektrodama povezan s redoks reakcijama naziva se elektroliza.
Faradejevi zakoni
I. Masa supstance koja se oslobađa na elektrodi direktno je proporcionalna naelektrisanju koje teče kroz elektrolit:
m=kq
k je elektrohemijski ekvivalent supstance.
q=I\Delta t, dakle
m=kI\Delta t
k=\frac(1)(F)\frac(\mu)(n)
\frac(\mu)(n) - hemijski ekvivalent supstance;
\mu - molarna masa;
n - valencija
Elektrohemijski ekvivalenti supstanci su proporcionalni hemijskim.
F - Faradejeva konstanta;
Voda kao univerzalni rastvarač.. Vodeni rastvori.. Elektrolitička disocijacija.. Elektrolit.. Slabi i jaki elektroliti.. Nosioci električnih naboja u tečnosti.. Pozitivni i negativni joni.. Elektroliza.. Taline.. Priroda električne struje u topi..
Jedan od uslova za nastanak električne struje je prisustvo slobodnih naelektrisanja koji se mogu kretati pod uticajem električnog polja. Razgovarali smo i o prirodi električne struje u metalima.
U ovoj lekciji pokušaćemo da shvatimo koje čestice nose električni naboj u tečnostima i topi se.
Voda kao univerzalni rastvarač
Kao što znamo, destilovana voda ne sadrži nosioce naboja i samim tim ne provodi električnu struju, odnosno ona je dielektrik. Međutim, prisustvo bilo kakvih nečistoća već čini vodu prilično dobrim provodnikom.
Voda ima fenomenalnu sposobnost da rastvori skoro sve hemijski elementi. Kada se razne tvari (kiseline, lužine, baze, soli itd.) otopi u vodi, otopina postaje provodnik zbog razlaganja molekula tvari na ione. Ova pojava se naziva elektrolitička disocijacija, a sama otopina je elektrolit sposoban da provodi električnu struju. Sva vodena tijela na Zemlji su, u većoj ili manjoj mjeri, prirodni elektroliti.
Svjetski okean je otopina jona gotovo svih elemenata periodnog sistema.
Želudačni sok, krv, limfa, sve tečnosti u ljudskom tijelu su elektroliti. Sve životinje i biljke se također prvenstveno sastoje od elektrolita.
Prema stepenu disocijacije razlikuju se slabi i jaki elektroliti. Voda je slab elektrolit, a većina neorganskih kiselina je jaki elektroliti. Elektroliti se nazivaju i provodnici druge vrste.
Električni nosioci naboja u tečnostima
 Kada se različite supstance rastvore u vodi (ili nekoj drugoj tečnosti), one se razlažu na jone.
Kada se različite supstance rastvore u vodi (ili nekoj drugoj tečnosti), one se razlažu na jone.
Na primjer, kuhinjska sol NaCl (natrijum hlorid) u vodi se razdvaja na pozitivne ione natrija (Na+) i negativne ione hlora (Cl-). Ako su dva pola u rezultirajućem elektrolitu na različitim potencijalima, tada negativni ioni pomjeraju se prema pozitivnom polu, dok pozitivni ioni pomiču prema negativnom polu.
Dakle, električna struja u tekućini sastoji se od tokova pozitivnih i negativnih jona usmjerenih jedan prema drugom.
Dok je apsolutno čista voda izolator, voda koja sadrži čak i male nečistoće (prirodne ili unesene izvana) jonizirane tvari je provodnik električne struje.
Elektroliza

Budući da pozitivni i negativni ioni otopljene tvari pod utjecajem električnog polja uvlače različite strane, supstanca se postepeno razdvaja na dva dela.
Ovo razdvajanje supstance na njene sastavne elemente naziva se elektroliza.
Elektroliti se koriste u elektrohemiji, u hemijski izvori struja (naponske ćelije i baterije), u procesima proizvodnje galvanizacije i drugim tehnologijama zasnovanim na kretanju električnih naboja u tečnostima pod uticajem električnog polja.
Topi se
Disocijacija tvari je moguća bez sudjelovanja vode. Dovoljno da rastopi kristale hemijski sastav supstance i dobije se talina. Taline materije, baš kao i vodeni elektroliti, su provodnici druge vrste, pa se stoga mogu nazvati elektrolitima. Električna struja u talinama ima istu prirodu kao i struja u vodenim elektrolitima - to su protivtokovi pozitivnih i negativnih jona.

Koristeći taline, metalurgija proizvodi aluminij elektrolitičkom metodom iz glinice. Električna struja prolazi kroz aluminijum oksid i tokom procesa elektrolize, čisti aluminijum se akumulira na jednoj od elektroda (katodi). Ovo je energetski vrlo intenzivan proces, koji po potrošnji energije podsjeća na razgradnju vode na vodik i kisik uz pomoć električne struje.
U radionici za elektrolizu aluminijuma


























