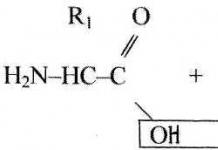
생물유기화학 생물의 가장 중요한 구성요소인 바이오폴리머와 저분자량 바이오레귤레이터의 구조와 생물학적 기능을 연구하는 기초과학으로, 화합물의 구조와 생물학적 작용 사이의 관계 패턴을 규명하는 데 중점을 두고 있습니다.
생물유기화학은 화학과 생물학의 교차점에 있는 과학으로, 생명체의 기능 원리를 밝히는 데 기여합니다. 생물유기화학은 의약, 농업, 화학, 식품 및 미생물 산업을 위한 새로운 가치 있는 화합물을 얻기 위한 이론적 기초가 되는 뚜렷한 실용적인 방향을 가지고 있습니다. 생물 유기 화학의 관심 범위는 유난히 넓습니다. 이것은 야생 동물에서 분리되어 생명에 중요한 역할을하는 물질의 세계이며 인공적으로 얻은 세계입니다. 유기 화합물생물학적 활동으로. 생물유기화학은 살아 있는 세포의 모든 물질, 수만, 수십만 가지 화합물의 화학을 다룹니다.
생물유기화학의 연구대상, 연구방법 및 주요과제
연구 대상생물 유기 화학은 단백질 및 펩티드, 탄수화물, 지질, 혼합형 생체 고분자 - 당단백질, 핵단백질, 지단백질, 당지질 등, 알칼로이드, 테르페노이드, 비타민, 항생제, 호르몬, 프로스타글란딘, 페로몬, 독소 및 생물학적 합성 조절제입니다. 공정 : 약물, 살충제 등
연구 방법의 주요 무기고생물유기화학 메이크업 방법; 물리적, 물리 화학적, 수학적 및 생물학적 방법은 구조적 문제를 해결하는 데 사용됩니다.
주요 작업생물유기화학은 다음과 같습니다.
- 결정화, 증류, 다양한 종류크로마토그래피, 전기영동, 한외여과, 초원심분리 등 이 경우 연구 물질의 특정 생물학적 기능이 종종 사용됩니다(예를 들어 항생제의 순도는 항균 활성에 의해 제어되고 호르몬은 특정 생리학적 프로세스 등);
- 유기화학 접근법을 기반으로 공간 구조를 포함한 구조 확립(가수분해, 산화적 절단, 특정 단편에서의 절단, 예를 들어 펩타이드 및 단백질의 구조 확립 시 메티오닌 잔기에서, 1,2-디올 그룹에서의 절단 탄수화물 등) 및 물리 화학질량분석법, 각종 광분광법(IR, UV, laser 등), X-선 회절분석법, 핵자기공명법, 전자상자성공명법, 선광분산법, 원편광이색법, 고속 동역학법 등을 복합적으로 이용 컴퓨터에 대한 계산. 많은 바이오폴리머의 구조를 확립하는 것과 관련된 표준 문제를 신속하게 해결하기 위해 자동 장치가 만들어지고 널리 사용되며 작동 원리는 표준 반응과 천연 및 생물학적 활성 화합물의 특성을 기반으로 합니다. 이들은 펩타이드의 정량적 아미노산 조성을 결정하기 위한 분석기, 펩타이드의 아미노산 잔기의 서열 및 핵산의 뉴클레오티드 서열을 확인하거나 확립하기 위한 시퀀서 등입니다. 결합은 복잡한 바이오폴리머의 구조를 연구하는 데 중요합니다. 이러한 효소는 단백질(트립신, 글루탐산, 프롤린 및 기타 아미노산 잔기에서 펩티드 결합을 절단하는 프로테이나제), 핵산 및 폴리뉴클레오티드(뉴클레아제, 제한 효소), 탄수화물 함유 중합체(글리코시다제, 특정 것을 포함 - 갈락토시다아제 , 글루쿠로니다아제 등). 연구의 효율성을 높이기 위해 천연 화합물뿐만 아니라 특성을 포함하는 파생물, 특별히 도입된 그룹 및 표지된 원자도 분석됩니다. 이러한 유도체는 예를 들어 표지된 아미노산 또는 삼중수소, 방사성 탄소 또는 인을 포함하는 다른 방사성 전구체를 포함하는 배지에서 생산자를 성장시켜 얻습니다. 복합 단백질 연구에서 얻은 데이터의 신뢰성은 이 연구가 해당 유전자의 구조 연구와 함께 수행되는 경우 크게 증가합니다.
- 전체 합성, 유사체 및 파생물의 합성을 포함하여 연구 화합물의 화학적 합성 및 화학적 변형. 저분자량 화합물의 경우 확립된 구조의 정확성에 대한 중요한 기준은 여전히 카운터 합성입니다. 천연 및 생물학적 활성 화합물의 합성 방법의 개발은 생물 유기 화학의 다음 중요한 문제인 구조와 생물학적 기능 사이의 관계를 밝히기 위해 필요합니다.
- 바이오폴리머와 저분자량 바이오레귤레이터의 구조와 생물학적 기능 사이의 관계 규명; 연구 화학적 메커니즘그들의 생물학적 작용. 생물유기화학의 이러한 측면은 점점 더 실용적인 가치. 비교적 단순한 생물 조절제 합성을 위한 계속 개선되는 기술과 함께 복잡한 생체 고분자(활성 기능 유전자를 포함하는 생물학적 활성 펩티드, 단백질, 폴리뉴클레오티드, 핵산)의 화학 및 화학 효소 합성 방법의 개선 , 뿐만 아니라 바이오폴리머의 선택적 분해 방법을 통해 화합물 구조에 대한 생물학적 작용의 의존성을 더 깊이 이해할 수 있습니다. 고도로 효율적인 컴퓨터 기술을 사용하면 서로 다른 연구자의 수많은 데이터를 객관적으로 비교하고 공통 패턴을 찾을 수 있습니다. 발견된 특수하고 일반적인 패턴은 새로운 화합물의 합성을 자극하고 촉진하며, 일부 경우(예를 들어, 뇌 활동에 영향을 미치는 펩타이드 연구에서) 그들의 자연 대응물에 대한 생물학적 활동. 생물학적 작용의 화학적 메커니즘에 대한 연구는 미리 결정된 특성을 가진 생물학적 활성 화합물을 생성할 수 있는 가능성을 열어줍니다.
- 실질적으로 귀중한 약을 얻습니다.
- 얻어진 화합물의 생물학적 시험.
생물 유기 화학의 형성. 역사 참조
세계에서 생물 유기 화학의 형성은이 분야의 주요 연구 대상이 세포와 유기체의 생명에 중요한 역할을하는 네 가지 종류의 유기 화합물 인 단백질, 다당류 인 50 년대 후반에서 60 년대 초반에 발생했습니다. 및 지질. 놀라운 업적 L. Pauling이 단백질의 폴리펩타이드 사슬의 공간 구조의 주요 요소 중 하나로 α-나선을 발견하고 A. Todd가 뉴클레오타이드의 화학 구조를 확립한 것과 같은 천연 화합물의 전통적인 화학 디뉴클레오타이드의 최초 합성, F. Sanger가 단백질의 아미노산 서열을 결정하고 그 도움으로 해독하는 방법, 인슐린 구조, R. Woodward가 레세르핀, 엽록소 및 비타민 B12는 최초의 펩타이드 호르몬인 옥시토신의 합성으로, 본질적으로 천연 화합물의 화학이 현대의 생물유기 화학으로 전환되었음을 의미합니다.
그러나 우리나라에서는 훨씬 일찍 단백질과 핵산에 대한 관심이 생겼습니다. 단백질과 핵산의 화학적 성질에 대한 최초의 연구는 1920년대 중반에 시작되었습니다. 모스크바 대학의 벽 안에 최초의 과학 학교가 형성되어 오늘날까지 자연 과학의 중요한 분야에서 성공적으로 일하고 있습니다. 그래서 20대에. N.D. Zelinsky는 단백질 분자 구조의 일반 원리를 밝히는 것이 주된 임무인 단백질 화학에 대한 체계적인 연구를 시작했습니다. N.D. Zelinsky는 아미노산과 펩타이드의 합성 및 구조 분석에 대한 중요한 작업이 수행되는 우리나라 최초의 단백질 화학 실험실을 만들었습니다. 이 작품의 개발에서 뛰어난 역할은 M.M. Botvinnik과 그녀의 학생들은 세포에서 인 대사의 핵심 효소인 무기 피로포스파타아제의 구조와 작용 메커니즘을 연구하여 인상적인 결과를 얻었습니다. 유전 과정에서 핵산의 주도적인 역할이 나타나기 시작한 1940년대 말, M.A. 프로코피예프와 Z.A. Shabarova는 핵산 성분과 그 유도체의 합성 작업을 시작하여 우리나라 핵산 화학의 토대를 마련했습니다. 뉴클레오사이드, 뉴클레오타이드 및 올리고뉴클레오타이드의 최초 합성이 이루어졌으며 국내 자동 핵산 합성기의 탄생에 큰 공헌을 했습니다.
60년대. 우리나라의 이러한 추세는 일관되고 빠르게 발전했으며 종종 해외의 유사한 단계와 추세보다 앞서 있습니다. A.N. 고등 식물에서 DNA의 존재를 증명하고 핵산의 화학적 조성을 체계적으로 연구한 Belozersky는 V.A. Engelhardt와 V.A. A.E.에 대한 세계적으로 유명한 연구 인산화의 산화 메커니즘에 대한 Belitser. Arbuzov는 생리 활성 유기인 화합물의 화학과 I.N. Nazarova와 N.A. 다양한 천연 물질과 그 유사체의 합성 및 기타 작업에 대한 Preobrazhensky. 소련에서 생물 유기 화학의 생성 및 개발에서 가장 큰 업적은 Academician M.M. Shemyakin. 특히 그는 비정형 펩타이드(depsipeptides)에 대한 연구를 시작했으며, 이후 이오노포어(ionophores)로서의 기능과 관련하여 광범위한 개발을 받았습니다. 이 과학자와 다른 과학자들의 재능, 통찰력 및 활발한 활동은 소비에트 생물 유기 화학의 국제적 명성의 급속한 성장, 가장 관련성 높은 분야에서의 통합 및 우리나라의 조직 강화에 기여했습니다.
60년대 후반~70년대 초반. 복잡한 구조의 생물학적 활성 화합물의 합성에서 효소가 촉매로 사용되기 시작했습니다 (소위 화학 효소 결합 합성). 이 접근법은 G. Korana가 최초의 유전자 합성에 사용했습니다. 효소를 사용함으로써 많은 천연 화합물을 엄밀하게 선택적으로 변형시키고 높은 수율로 펩타이드, 올리고당 및 핵산의 새로운 생물학적 활성 유도체를 얻을 수 있었습니다. 70년대에. 올리고뉴클레오티드 및 유전자의 합성, 세포막 및 다당류 연구, 단백질의 1차 및 공간 구조 분석과 같은 생물유기화학 분야가 가장 집중적으로 발전했습니다. 중요한 효소(transaminase, β-galactosidase, DNA-dependent RNA polymerase), 보호 단백질(γ-글로불린, 인터페론), 막 단백질(adenosine triphosphatases, bacteriorhodopsin)의 구조를 연구했습니다. 큰 중요성신경 활동 조절제(소위 신경펩티드)인 펩타이드의 구조 및 작용 메커니즘 연구에 대한 연구를 획득했습니다.
현대국내 생물유기화학
현재 국내 생물유기화학은 여러 핵심 분야에서 세계 최고의 위치를 차지하고 있다. 호르몬, 항생제 및 신경독을 포함하는 생물학적 활성 펩타이드 및 복합 단백질의 구조와 기능에 대한 연구에서 주요한 발전이 이루어졌습니다. 막 활성 펩타이드의 화학에서 중요한 결과가 얻어졌습니다. dyspepside ionophores의 독특한 선택성과 효과에 대한 이유가 조사되었고 살아있는 시스템에서 기능하는 메커니즘이 해명되었습니다. 원하는 특성을 가진 이온 운반체의 합성 유사체를 얻었으며 이는 천연 샘플보다 몇 배 더 효율적입니다(V.T. Ivanov, Yu.A. Ovchinnikov). ionophores의 고유한 특성은 이를 기반으로 하는 이온 선택적 센서를 만드는 데 사용되며 기술에서 널리 사용됩니다. 다른 그룹의 조절제 연구에서 달성된 성공 - 신경 자극 전달의 억제제인 신경독은 막 수용체 및 세포막의 다른 특정 구조를 연구하기 위한 도구로 널리 사용되었습니다(EV Grishin). 펩타이드 호르몬의 합성 및 연구에 대한 연구 개발로 인해 평활근 수축 및 혈압 조절을 담당하는 호르몬 옥시토신, 안지오텐신 II 및 브래디키닌의 매우 효과적인 유사체가 만들어졌습니다. 큰 성공은 완전한 화학 합성인간 인슐린 (N.A. Yudaev, Yu.P. Shvachkin 등)을 포함한 인슐린 제제. gramicidin S, polymyxin M, actinoxanthin(G.F. Gause, A.S. Khokhlov 등)을 포함한 많은 단백질 항생제가 발견되고 연구되었습니다. 수용체 및 수송 기능을 수행하는 막 단백질의 구조 및 기능을 연구하기 위한 연구가 활발히 진행되고 있다. 광수용체 단백질인 로돕신과 박테리오로돕신을 얻었고 광의존성 이온 펌프로서의 기능에 대한 물리화학적 기초를 연구했습니다(V.P. Skulachev, Yu.A. Ovchinnikov, M.A. Ostrovsky). 세포에서 단백질 생합성의 주요 시스템인 리보솜의 구조와 기능 메커니즘이 널리 연구되었습니다(A.S. Spirin, A.A. Bogdanov). 대규모 연구 주기는 효소 연구, 1차 구조 및 공간 구조 결정, 촉매 기능 연구(아스파르트산 아미노전이효소, 펩신, 키모트립신, 리보뉴클레아제, 인 대사 효소, 글리코시다아제, 콜린에스테라아제 등)와 관련이 있습니다. 핵산 및 그 구성 요소의 합성 및 화학적 변형 방법이 개발되었으며(D.G. Knorre, M.N. Kolosov, Z.A. Shabarova) 바이러스, 종양 및 자가면역 질환의 치료를 위해 이를 기반으로 하는 차세대 약물을 만들기 위한 접근 방식이 개발되고 있습니다. 핵산의 고유한 특성을 사용하고 이를 기반으로 진단 준비 및 바이오 센서, 여러 생물학적 활성 화합물 분석기가 생성됩니다(V.A. Vlasov, Yu.M. Evdokimov 등).
탄수화물의 합성 화학(세균 항원 합성 및 인공 백신 생성, 세포 표면에 바이러스 흡착의 특정 억제제 합성, 박테리아 독소의 특정 억제제 합성(N.K. Kochetkov, A .Ya. Khorlin)). 지질, 리포아미노산, 리포펩티드 및 리포단백질 연구에서 상당한 진전이 있었습니다(LD Bergelson, NM Sisakyan). 많은 생물학적 활성 지방산, 지질 및 인지질의 합성 방법이 개발되었습니다. 다양한 유형의 리포좀, 박테리아 막 및 간 마이크로솜에서 지질의 막관통 분포를 연구했습니다.
생물 유기 화학의 중요한 영역은 살아있는 세포에서 발생하는 다양한 과정을 조절할 수 있는 다양한 천연 및 합성 물질에 대한 연구입니다. 이들은 구충제, 항생제, 페로몬, 신호 물질, 효소, 호르몬, 비타민 및 기타 (소위 저 분자량 조절제)입니다. 스테로이드 호르몬과 항생제의 중요한 부분인 거의 모든 알려진 비타민의 합성 및 생산을 위한 방법이 개발되었습니다. 치료약으로 사용되는 많은 코엔자임(코엔자임 Q, 피리독살 포스페이트, 티아민 피로포스페이트 등)을 얻기 위한 산업적 방법이 개발되었습니다. 알려진 외국 약물(I.V. Torgov, S.N. Ananchenko)보다 작용이 우수한 새로운 강력한 단백 동화제가 제안되었습니다. 천연 및 변형된 스테로이드의 생물 발생 및 작용 메커니즘이 연구되었습니다. 알칼로이드, 스테로이드, 트리테르펜 배당체, 쿠마린 연구에서 상당한 진전이 있었습니다. 독창적인 연구살충제 화학 분야에서 수행되어 많은 귀중한 약물 (I.N. Kabachnik, N.N. Melnikov 등)이 출시되었습니다. 다양한 질병의 치료에 필요한 신약에 대한 적극적인 탐색이 이루어지고 있습니다. 다수의 종양학적 질병(도판, 사르콜리신, 프토라푸르 등)의 치료에 효과가 입증된 제제가 입수되었습니다.
생물유기화학 발전의 우선방향과 전망
생물유기화학 분야에서 과학 연구의 우선순위 영역은 다음과 같습니다.
- 생물학적 활성 화합물의 구조적 및 기능적 의존성 연구;
- 의약품 및 식물 보호 제품의 생성을 포함하여 새로운 생물학적 활성 의약품의 설계 및 합성;
- 고효율 생명 공학 공정 연구;
- 살아있는 유기체에서 발생하는 과정의 분자 메커니즘에 대한 연구.
생물 유기 화학 분야의 기본 연구는 단백질, 핵산, 탄수화물, 지질, 알칼로이드, 프로스타글란딘 및 기타 화합물을 포함하여 가장 중요한 생체 고분자 및 저분자량 생물 조절제의 구조와 기능을 연구하는 것을 목표로 합니다. 생물유기화학은 의학 및 농업(비타민, 호르몬, 항생제 및 기타 의약품, 식물 성장 촉진제 및 동물 및 곤충 행동 조절제 확보), 화학, 식품 및 미생물 산업의 실제 문제와 밀접한 관련이 있습니다. 과학적 연구 결과는 현대 의료 면역 진단 기술, 의료 유전 연구용 시약 및 생화학 분석, 종양학, 바이러스학, 내분비학, 위장병학, 화학 식물 보호 제품 및 농업에 사용하기 위한 기술에 사용하기 위한 약물 합성 기술.
생물 유기 화학의 주요 문제에 대한 해결책은 생물학, 화학 및 여러 기술 과학의 발전에 중요합니다. 가장 중요한 바이오폴리머와 바이오레귤레이터의 구조와 특성을 해명하지 않고는 생명과정의 본질을 알 수 없으며, 유전 형질의 번식과 전달, 정상 및 악성 세포의 성장과 같은 복잡한 현상을 제어하는 방법을 찾는 것은 더욱 불가능하다. , 면역, 기억, 신경 자극 전달 등. 동시에 고도로 전문화 된 생물학적 활성 물질과 그 참여로 발생하는 과정에 대한 연구는 화학 발전을위한 근본적으로 새로운 기회를 열 수 있습니다. 화학 기술그리고 기술. 그 해결책은 생물 유기 화학 분야의 연구와 관련되어 있으며 엄격하게 특정한 고 활성 촉매 (효소의 구조 및 작용 메커니즘에 대한 연구를 기반으로 함)의 생성, 화학 에너지를 기계적 에너지(근육 수축 연구 기반) 및 기술에서의 사용 화학 원리생물학적 시스템에서 수행되는 정보의 저장 및 전송, 다성분 세포 시스템의 자기 조절 원칙, 주로 생물학적 막의 선택적 투과성 등 이미 분자 생물학 분야와 관련된 생화학 연구 개발의 거점 . 해결해야 할 문제의 폭과 중요성, 방법의 다양성, 타인과의 긴밀한 관계 과학 분야제공하다 빠른 개발 bioorganic chemistry.Moscow University Bulletin, series 2, Chemistry. 1999. V. 40. No. 5. S. 327-329.
Bender M, Bergeron R, Komiyama M. 효소 촉매의 생물 유기 화학. 당. 영어로부터. M.: 미르, 1987. 352 S.
야코비신 L.A. Bioorganic Chemistry에서 선택된 장. 세바스토폴: Strizhak-press, 2006. 196쪽.
Nikolaev A.Ya. 생화학. M.: 의료 정보 기관, 2001. 496 p.
생물유기화학. Tyukavkina N.A., Baukov Yu.I.

3판, 개정. 추가 - M.: 2004 - 544p.
이 교과서의 주요 특징은 의대생에게 필요한 이 화학 과정의 의학 오리엔테이션과 높은 기초 과학 수준을 결합한 것입니다. 세포의 구조적 구성요소인 바이오폴리머를 비롯한 유기화합물의 구조와 반응성, 주요 대사물질, 저분자량 바이오레귤레이터 등의 기초적인 내용을 담고 있다. 제3판(2nd - 1991)에서는 살아있는 유기체에서 유사한 화합물과 반응에 특별한 주의를 기울이고, 중요한 화합물 부류의 생물학적 역할을 강조하고, 생태학적 및 독성학적 특성이 확장됩니다. 전문 분야에서 공부하는 대학생의 경우 040100 일반 의학, 040200 소아과, 040300 의료 및 예방 작업, 040400 치과.
체재: pdf
크기: 15MB
감상, 다운로드:드라이브.구글
콘텐츠
머리말........................... 7
소개.................................. 9
1부
유기 화합물의 구조 및 반응성의 기초
제1장 유기화합물의 일반특성 16
1.1. 분류. "................ 16
1.2. .명칭........................... 20
1.2.1. 대체 명명법 .................. 23
1.2.2. 급진적 기능 명명법 ........ 28
제2장 유기물에서 원자의 화학적 결합과 상호 영향
연결 .................. 29
2.1. 유기원소의 전자구조 ...... 29
2.1.1. 원자 오비탈 .................................. 29
2.1.2. 오비탈의 혼성화 ........................... 30
2.2. 공유 결합 ........................... 33
2.2.1. a- 및 l-연결........................... 34
2.2.2. 기증자-수용자 채권 ........................... 38
2.2.3. 수소 결합 ............. 39
2.3. 컨쥬게이션 및 방향족성 ............. 40
2.3.1. 개방 회로 시스템... ,..... 41
2.3.2. 폐쇄 루프 시스템 .................................. 45
2.3.3. 일렉트로닉 이펙트 ..................49
제3장 유기화합물 구조의 기초........51
3.1. 화학 구조 및 구조 이성질체 ...... 52
3.2. 공간 구조와 입체이성질체 ...... 54
3.2.1. 구성........................... 55
3.2.2. 형태........................... 57
3.2.3. 분자의 대칭 요소 ........................... 68
3.2.4. 탄성체 .................... 72
3.2.5. 부분입체이성질체 ....................
3.2.6. 레이스메이트...........80
3.3. 에난티오토피아, 디아스테레오토피아. . .........82
제4장 유기화합물 반응의 일반적 특성 88
4.1. 반응 메커니즘의 개념..... 88
3
11.2. 펩티드와 단백질의 1차 구조 ........................ 344
11.2.1. 구성 및 아미노산 서열 ...... 345
11.2.2. 펩타이드의 구조와 합성 ...........................351
11.3. 폴리펩타이드와 단백질의 공간 구조.... 361
12장
12.1. 단당류 ................ 378
12.1.1. 구조와 입체이성질체 ................... 378
12.1.2. 호변이성..........." 388
12.1.3. 형태...........................389
12.1.4. 단당류의 유도체 ........................... 391
12.1.5. 화학적 특성 .................. 395
12.2. 이당류 ............................... 407
12.3. 다당류.................................. 413
12.3.1. 호모다당류 ........................... 414
12.3.2. 이종다당류 .............420
13장
13.1. 뉴클레오시드 및 뉴클레오타이드 ...........................431
13.2. 핵산의 구조 ..................441
13.3 뉴클레오사이드 폴리포스페이트 니코틴 아민 및 뉴클레오타이드.....448
14장
14.1. 비누화 지질 ........................... 458
14.1.1. 고급 지방산 - 구조적 구성 요소비누화 지질 458
14.1.2. 단순지질 .................461
14.1.3. 복합지질 .............462
14.1.4. 비누화 지질과 그 구조적 성분의 일부 특성 467
14.2. 불검화물 지질 472
14.2.1. 테르펜........... ...... 473
14.2.2. 저분자량 지질 생물 조절제. . . 477
14.2.3. 스테로이드..................483
14.2.4. 테르펜과 스테로이드의 생합성 ..................492
15장
15.1. 크로마토그래피...........................496
15.2. 유기 화합물 분석. . .......500
15.3. 분광법 .............501
15.3.1. 전자 분광기 .............501
15.3.2. 적외선 분광법 ..................504
15.3.3. 핵 자기 공명 분광법 ...... 506
15.3.4. 전자 상자성 공명 .............509
15.3.5. 질량분석법 .............510
머리말
수세기에 걸친 자연 과학 발전의 역사를 통틀어 의학과 화학 사이에는 긴밀한 관계가 확립되었습니다. 이러한 과학의 지속적인 깊은 상호 침투는 개별 생리적 과정의 분자적 특성, 질병 병인의 분자적 기초, 약리학의 분자적 측면 등을 연구하는 새로운 과학적 방향의 출현으로 이어집니다. 살아있는 세포- 지속적으로 상호 작용하고 일어나고 사라지는 크고 작은 분자의 실제 영역.
생물유기화학은 생물학적으로 중요한 물질을 연구하고 세포 성분에 대한 포괄적인 연구를 위한 "분자 도구" 역할을 할 수 있습니다.
생물유기화학은 현대 의학 분야의 발전에 중요한 역할을 하며 의사의 자연과학 교육의 필수적인 부분입니다.
의학의 발전과 공중 보건의 향상은 전문의의 심도 있는 기본 교육과 관련이 있습니다. 이 접근 방식의 관련성은 주로 생태학, 독성학, 생명 공학 등의 문제가 시야에 들어오는 사회 영역의 큰 부분으로 의학을 전환함으로써 결정됩니다.
의대 커리큘럼 부재로 인해 일반 과정이 교재의 유기화학은 생물유기화학의 동화작용에 필요한 유기화학의 기초에 일정한 자리를 부여하고 있다. 제3판(2nd - 1992)을 준비하는 동안 교과서의 내용이 개정되었으며 의학 지식을 인식하는 작업에 더욱 가까워졌습니다. 살아있는 유기체에서 유추되는 화합물과 반응의 범위가 확장되었습니다. 생태학적 및 독성학적 정보에 더 많은 관심을 기울입니다. 의학 교육에 근본적으로 중요하지 않은 순전히 화학적 성질의 요소, 특히 유기 화합물을 얻는 방법, 여러 개별 대표자의 특성 등이 일부 감소되었습니다. 유기 물질의 구조와 약물 작용의 분자 기반으로서의 생물학적 작용 사이의 관계에 대한 자료를 포함하여 확장되었습니다. 교과서의 구조가 개선되었고 특별한 생의학적 중요성을 지닌 화학 물질이 별도의 제목으로 배치되었습니다.
저자는 S. E. Zurabyan, I. Yu. Belavin, I. A. Selivanova 교수 및 모든 동료들에게 진심으로 감사를 표합니다. 유용한 팁들재인쇄를 위한 원고 준비 지원.
Grodno" href="/text/category/grodno/" rel="bookmark">그로드노 주 의과 대학”, 화학 과학 후보자, 부교수;
교육 시설 "Grodno State Medical University"의 일반 및 생물 유기 화학과 부교수, 생물 과학 후보, 부교수
검토자:
교육 시설 "Gomel State Medical University"의 일반 및 생물 유기 화학과;
– 머리 생물 유기 화학과, 교육 기관 "벨로루시 주립 의과 대학", 의학 후보, 부교수.
일반 및 생물 유기 화학 교육 기관 "Grodno State Medical University"학과
(01.01.01 날짜의 의사록)
교육 기관 "Grodno State Medical University"의 중앙 과학 및 방법론 협의회
(01.01.01 날짜의 의사록)
전문 섹션 1의학 교육을 위한 벨로루시 공화국 대학의 교육 및 방법론 협회의 의료 및 심리 사업
(01.01.01 날짜의 의사록)
릴리스 책임:
교육 기관 "Grodno State Medical University"의 초대 부총장, 교수, 의학 박사
주석
학문 분야 공부의 관련성
"유기화학"
생물유기화학은 기본적인 자연과학 분야입니다. 생물유기화학은 유기화학과 생화학의 교차점에서 20세기 후반에 독립적인 과학으로 형성되었다. 생물유기화학 연구의 타당성은 의약과 농업(비타민, 호르몬, 항생물질, 식물생장촉진제, 동물 및 곤충 행동조절제, 기타 의약품을 얻는 것)이 직면하고 있는 실제적인 문제에 기인하며, 이를 사용하지 않고는 해결이 불가능하다. 생물유기화학의 이론적이고 실제적인 잠재력에 대해
생물유기화학은 천연 화합물의 분리 및 정제를 위한 새로운 방법, 천연 화합물 및 그 유사체의 합성 방법, 화합물의 구조와 생물학적 활성 사이의 관계에 대한 지식 등으로 지속적으로 풍부해지고 있습니다.
교육의 재생산 스타일을 극복하고 학생들의 인지 및 연구 활동을 보장하는 것과 관련된 의학 교육에 대한 최신 접근 방식은 개인과 팀 모두의 잠재력을 실현할 수 있는 새로운 전망을 열어줍니다.
규율의 목적과 목표
표적:생물 의학 및 임상 분야의 후속 연구를 보장하는 의학 교육 시스템의 화학적 능력 수준 형성.
작업:
구조 및 생물학적 활동과 관련하여 유기 분자의 화학적 변형에 대한 이론적 기초를 학생들이 마스터합니다.
형성: 생명 과정의 분자적 기초에 대한 지식;
의약품으로 작용하는 유기 화합물의 분류, 구조 및 특성을 탐색하는 기술 개발
화학적 사고의 논리 형성;
질적 분석 방법을 사용하는 기술 개발
유기 화합물;
화학역량의 근간이 되는 화학지식과 기술은 대학원생의 전문역량 형성에 기여할 것이다.
학문 분야를 마스터하기위한 요구 사항
"생물 유기 화학" 분야의 내용을 마스터하는 수준에 대한 요구 사항은 역량 요구 사항을 고려하여 개발된 일반 전문 및 특수 분야 주기의 첫 번째 단계 고등 교육 교육 표준에 의해 결정됩니다. 일반화 된 형식으로 분야의 최소 콘텐츠를 나타내는 기반 접근 방식 화학 지식대학 졸업자의 생물유기적 역량을 구성하는 기술:
a) 일반화된 지식:
- 과학으로서의 주제의 본질과 다른 학문과의 관계를 이해합니다.
신진대사 과정 이해의 중요성;
유기 분자의 구조와 반응성의 통일성 개념;
살아있는 유기체에서 일어나는 과정을 설명하는 데 필요한 화학의 기본 법칙
유기 화합물의 주요 부류의 화학적 특성 및 생물학적 중요성.
b) 일반화된 기술:
유기 분자의 구조와 화학 결합을 끊는 방법에 대한 지식을 바탕으로 반응 메커니즘을 예측합니다.
살아있는 시스템의 기능에 대한 반응의 중요성을 설명하십시오.
생화학, 약리학 및 기타 분야 연구에서 습득한 지식을 사용합니다.
학문의 구조와 내용
이 프로그램에서 "생물유기화학" 분야의 내용 구조는 분야에 대한 소개와 유기 분자의 반응성에 대한 일반적인 문제를 다루는 두 개의 섹션으로 구성되어 있습니다. 삶의 과정. 각 섹션은 프로그램 자료의 최적 학습 및 동화를 보장하는 순서로 배열된 주제로 나뉩니다. 각 주제에 대해 학생들의 생체 유기 능력의 본질을 구성하는 일반화된 지식과 기술이 제시됩니다. 각 주제의 내용에 따라 테스트를 개발할 수 있는 구성 및 진단을 위해 역량에 대한 요구 사항이 정의됩니다(일반화된 지식 및 기술 시스템의 형태로).
교수법
이 분야를 공부하는 목표를 적절하게 충족시키는 주요 교육 방법은 다음과 같습니다.
설명 및 상담
실험실 수업;
집단 문제 학습(학생의 교육 및 연구 작업);
생물유기화학개론
유기 물질의 구조와 생물학적 기능과 관련된 변형을 연구하는 과학으로서의 생물 유기 화학. 생물 유기 화학 연구 대상. 현대 분자 수준에서 생물학적 및 의학 지식의 인식을 위한 과학적 기반을 형성하는 데 있어 생물유기화학의 역할.
유기 화합물의 구조 이론과 현재 단계에서의 개발. 유기 화합물의 다양성의 기초가 되는 유기 화합물의 이성질체. 유기 화합물의 이성질체 유형.
생의학 분석에 중요한 유기 화합물의 분리 및 연구를 위한 물리화학적 방법.
유기 화합물에 대한 IUPAC 체계적 명명법의 기본 규칙: 치환 및 라디칼 기능 명명법.
유기 분자의 공간 구조, 탄소 원자의 혼성화 유형(sp3-, sp2- 및 sp-혼성화)과의 관계. 입체화학 공식. 구성 및 구성. 열린 사슬의 형태(차폐, 방해, 베벨). 형태의 에너지 특성. Newman의 투영 공식. 형태적 평형의 결과로서 그리고 5원 및 6원 고리의 우세한 형성에 대한 이유 중 하나로 사슬의 특정 부분의 공간적 수렴. 고리형 화합물(시클로헥산, 테트라히드로피란)의 형태. 의자 및 목욕 형태의 에너지 특성. 축 및 적도 연결. 생물학적 활동과 공간 구조의 관계.
역량 요구 사항:
연구 대상과 생물 유기 화학의 주요 작업을 알고,
탄소 골격의 구조와 성질에 따라 유기화합물을 분류할 수 있다. 작용기, 체계적인 화학 명명법의 규칙을 사용하십시오.
· 유기 화합물의 주요 이성질체 유형을 알고 화합물의 구조식으로 가능한 이성질체 유형을 결정할 수 있습니다.
· 탄소 원자 오비탈의 다양한 혼성화 유형, 원자 결합의 공간적 방향, 혼성화 유형에 따른 유형 및 수를 파악합니다.
· 고리형(의자, 욕조 형태) 및 비고리형(억제, 왜곡, 가려진 형태) 분자 구조의 에너지 특성을 알고 Newman 투영 공식을 사용하여 나타낼 수 있습니다.
· 다양한 분자에서 발생하는 응력 유형(비틀림, 각도, 반 데르 발스), 구조 및 분자 전체의 안정성에 미치는 영향을 파악합니다.
섹션 1. 원자, 흐름 메커니즘의 상호 영향으로 인한 유기 분자의 반응성 유기 반응
주제 1. 공액계, 방향족성, 치환기의 전자적 효과
공액 시스템 및 방향성. 접합(p, p- 및 p, p-접합). 공액 개방 사슬 시스템: 1,3-디엔(부타디엔, 이소프렌), 폴리엔(카로티노이드, 비타민 A). 폐쇄 회로가 있는 공액 시스템. 방향성: 방향성 기준, Hückel의 방향성 규칙. 벤조이드(벤젠, 나프탈렌, 페난트렌) 화합물의 방향족성. 컨쥬게이션 에너지. 탄소 및 헤테로 고리 방향족 화합물의 열역학적 안정성의 구조와 원인. 헤테로사이클릭(피롤, 이미다졸, 피리딘, 피리미딘, 퓨린) 화합물의 방향족성. 피롤 및 피리딘 질소 원자, p-과잉 및 p-결핍 방향족 시스템.
원자의 상호 영향과 유기 분자에서의 전달 방법. 분자 및 이온의 안정성을 증가시키는 요인 중 하나인 전자 비편재화는 생물학적으로 중요한 분자(포르핀, 헴, 헤모글로빈 등)에서 광범위하게 발생합니다. 채권의 양극화. 전자 밀도의 불균일한 분포와 분자 내 반응 중심의 출현에 대한 원인으로서 치환체(유도성 및 중간체)의 전자적 효과. 유도 및 중간체 효과(긍정적 및 부정적), 유기 화합물의 구조식에서 그래픽 지정. 전자 공여체 및 전자 수용체 치환기.
역량 요구 사항:
· 켤레의 종류를 알고 연결의 구조식으로 켤레의 종류를 결정할 수 있다.
· 방향족성의 기준을 알고, 구조식에 의해 탄소 및 헤테로 고리 분자의 방향족 화합물에 속하는 것을 결정할 수 있습니다.
· 피리딘 및 피롤 질소 원자의 전자 구조를 알기 위해 단일 공액 시스템 생성에 대한 원자의 전자적 기여도를 평가할 수 있습니다.
· 치환체의 전자적 효과와 그 원인을 알고 그 작용을 그래픽으로 묘사할 수 있습니다.
· 유도 효과와 중간 효과에 따라 치환기를 전자 공여 또는 전자 끄는 치환기로 분류할 수 있습니다.
· 분자의 반응성에 대한 치환기의 영향을 예측할 수 있습니다.
주제 2. 탄화수소의 반응성. 라디칼 치환, 친전자성 첨가 및 치환 반응
생물학적 기능을 위한 화학적 기초로서 유기 화합물의 일반적인 반응성 패턴. 과정으로서의 화학 반응. 개념: 기질, 시약, 반응 센터, 전이 상태, 반응 생성물, 활성화 에너지, 반응 속도, 메커니즘.
결과(추가, 치환, 제거, 산화환원) 및 메커니즘에 따른 유기 반응의 분류 - 라디칼, 이온성(친전자성, 친핵성), 일관성. 시약 유형: 라디칼, 산성, 염기성, 친전자성, 친핵성. Homolytic 및 heterolytic 갭 공유 결합유기 화합물 및 생성된 입자: 자유 라디칼, 탄소 양이온 및 탄소 음이온. 이러한 입자의 전자 및 공간 구조와 상대적 안정성을 결정하는 요소.
탄화수소의 반응성. 라디칼 치환 반응: sp3 혼성화된 탄소 원자의 CH 결합을 포함하는 균일 반응. 알칸과 시클로 알칸의 할로겐화 반응의 예에 대한 라디칼 치환 메커니즘. 체인 프로세스의 개념. 위치 선택성의 개념.
자유 라디칼 형성 방법: 광분해, 열분해, 산화환원 반응.
친전자성 첨가 반응( 애) 행에서 불포화 탄화수소: sp2-혼성화 탄소 원자 사이의 p-결합을 포함하는 이종 분해 반응. 수화 및 수소화 할로겐화 반응의 메커니즘. 산성 촉매. Markovnikov의 규칙. 친전자성 첨가 반응의 위치 선택성에 대한 정적 및 동적 요인의 영향. 디엔 탄화수소 및 작은 주기(시클로프로판, 시클로부탄)에 대한 친전자성 첨가 반응의 특징.
친전자성 치환 반응( 남동): 방향족 시스템의 p-전자 구름을 포함하는 이종 분해 반응. 할로겐화, 질화, 방향족 화합물의 알킬화 반응 메커니즘: p - 및 에스- 단지. 친전자성 입자 형성에서 촉매(루이스 산)의 역할.
친전자성 치환 반응에서 화합물의 반응성에 대한 방향족 핵의 치환기의 영향. 치환체의 방향성 영향(I 및 II 종류의 방향체).
역량 요구 사항:
· 기질, 시약, 반응 중심, 반응 생성물, 활성화 에너지, 반응 속도, 반응 메커니즘의 개념을 안다.
· 다양한 기준(최종 결과, 결합 파괴 방법, 메커니즘) 및 시약 유형(라디칼, 친전자성, 친핵성)에 따른 반응 분류를 알 수 있습니다.
· 시약의 전자 및 공간 구조와 상대적 안정성을 결정하는 요소를 알고 유사한 시약의 상대적 안정성을 비교할 수 있습니다.
· 알칸과 시클로알칸의 할로겐화 반응의 예를 통해 자유 라디칼의 형성 방식과 라디칼 치환(SR) 반응의 메커니즘을 안다.
· 라디칼 치환 반응에서 가능한 생성물 형성의 통계적 확률 및 위치선택적 과정의 가능성을 결정할 수 있다.
· 할로겐화, 수소화할로겐화 및 알켄의 수화 반응에서 친전자성 첨가(AE) 반응의 메커니즘을 알고, 치환기의 전자적 효과를 기반으로 기질의 반응성을 정성적으로 평가할 수 있습니다.
· Markovnikov의 규칙을 알고 정적 및 동적 요인의 영향을 기반으로 수화 및 수소화 할로겐화 반응의 위치 선택성을 결정할 수 있습니다.
· 공액 디엔 탄화수소 및 작은 순환(시클로프로판, 시클로부탄)에 대한 친전자성 첨가 반응의 특징을 알고 있습니다.
· 방향족 화합물의 할로겐화, 니트로화, 알킬화, 아실화 반응에서 친전자성 치환 반응(SE)의 메커니즘을 안다.
· 치환체의 전자적 효과를 기반으로 방향족 핵의 반응성과 배향 작용에 대한 치환체의 영향을 결정할 수 있습니다.
주제 3. 유기화합물의 산-염기 특성
유기 화합물의 산도와 염기도: 브뢴스테드와 루이스의 이론. 산성 음이온의 안정성은 산성 특성의 정성적 지표입니다. 산성 또는 염기성 중심에 있는 원자의 특성, 이러한 중심에 있는 치환기의 전자적 효과와 관련하여 산성 또는 염기성 특성 변화의 일반적인 패턴. 수소 함유 작용기(알코올, 페놀, 티올, 카르복실산, 아민, 분자의 CH-산성 및 카브리케이션)를 갖는 유기 화합물의 산성 특성. p-베이스 및 N- 기지. 고독한 전자쌍(알코올, 티올, 황화물, 아민) 및 음이온(수산화물, 알콕사이드 이온, 유기산 음이온)을 갖는 헤테로원자를 포함하는 중성 분자의 주요 특성. 질소 함유 헤테로사이클(피롤, 이미다졸, 피리딘)의 산-염기 특성. 산-염기 특성의 특정 표현으로서의 수소 결합.
수산기를 포함하는 화합물(1가 및 다가 알코올, 페놀, 카르복실산)의 산 특성 비교 특성. 지방족 및 방향족 아민의 주요 특성의 비교 특성. 유기 분자의 산-염기 특성에 대한 치환기의 전자 특성의 영향.
역량 요구 사항:
· Bronsted protolytic 이론과 Lewis 전자 이론에 따라 산과 염기의 정의를 알 수 있습니다.
· 산성 또는 염기성 중심의 원자 특성에 따라 산과 염기의 브뢴스테드 분류를 알 수 있습니다.
· 산의 강도와 짝염기의 안정성에 영향을 미치는 요인을 알고 해당 음이온의 안정성을 기반으로 산의 강도를 비교 평가할 수 있습니다.
· 브뢴스테드 기지의 강도에 영향을 미치는 요소를 파악하고 이러한 요소를 고려하여 기지의 강도를 비교 평가할 수 있습니다.
· 수소 결합의 원인을 알고 수소 결합의 형성을 물질의 산-염기 특성의 특정 징후로 해석할 수 있습니다.
· 유기 분자에서 케토-에놀 호변이성질체의 원인을 알고 생물학적 활성과 관련하여 화합물의 산-염기 특성의 관점에서 설명할 수 있습니다.
· 알고 할 수 있다 질적 반응, 다가 알코올, 페놀, 티올을 구별할 수 있습니다.
주제 4. 반응 친핵성 치환정방정계 탄소 원자와 경쟁적 제거 반응에서
sp3 혼성화된 탄소 원자에서의 친핵성 치환 반응: 탄소-헤테로원자 결합의 분극화로 인한 이종 분해 반응(할로겐 유도체, 알코올). 쉽고 어려운 그룹 탈퇴: 그룹 탈퇴의 용이성과 그룹 구조 사이의 연결. 단분자 및 이분자 친핵 치환(SN1 및 SN2) 반응에서 화합물의 반응성에 대한 용매, 전자 및 공간 요인의 영향. 친핵성 치환 반응의 입체화학.
할로겐 유도체의 가수분해 반응. 알코올, 페놀, 티올, 황화물, 암모니아, 아민의 알킬화 반응. 수산기의 친핵성 치환에서 산 촉매 작용의 역할. 알킬화제로서의 할로겐 유도체, 알코올, 황산 에스테르 및 인산. 알킬화 반응의 생물학적 역할.
단분자 및 이분자 제거 반응(E1 및 E2): (탈수, 탈할로겐화수소화). sp3 혼성화된 탄소 원자에서 친핵성 치환을 수반하는 제거 반응의 원인으로서 증가된 CH-산성.
역량 요구 사항:
· 가장 중요한 친핵성 입자의 구조인 시약의 친핵성을 결정하는 요인을 알 수 있습니다.
· 포화 탄소 원자에서의 친핵성 치환 반응의 일반적인 패턴, 친핵성 치환 반응에서 물질의 반응성에 대한 정적 및 동적 요인의 영향을 파악합니다.
· 단분자 및 2분자 친핵성 치환의 메커니즘을 알고 입체적 요인의 영향, 용매의 영향, 메커니즘 중 하나에 의한 반응에 대한 정적 및 동적 요인의 영향을 평가할 수 있습니다.
· 친핵성 치환 반응과 제거 반응 사이의 경쟁에 대한 이유인 단분자 및 이분자 제거의 메커니즘을 알 수 있습니다.
· Zaitsev의 법칙을 알고 비대칭 알코올과 할로알케인의 탈수 반응과 탈할로겐화 반응의 주요 생성물을 결정할 수 있습니다.
주제 5. 삼방 탄소 원자에서 친핵성 첨가 및 치환 반응
친핵성 첨가 반응: 탄소-산소 p-결합(알데히드, 케톤)을 포함하는 이종 분해 반응. 카르보닐 화합물과 친핵성 시약(물, 알코올, 티올, 아민)의 상호 작용 메커니즘. 전자 및 공간 요인의 영향, 산 촉매 작용의 역할, 친핵성 첨가 반응의 가역성. 헤미아세탈 및 아세탈, 이들의 제조 및 가수분해. 아세탈화 반응의 생물학적 역할. 알돌 첨가 반응. 주요 촉매. enolate 이온의 구조.
일련의 카르복실산에서 친핵성 치환 반응. 카르복실기의 전자 및 공간 구조. sp2 혼성화된 탄소 원자에서 친핵성 치환 반응(카르복실산 및 그 기능성 유도체). 아실화제(산 할로겐화물, 무수물, 카르복실산, 에스테르, 아미드), 반응성의 비교 특성. 아실화 반응 - 무수물, 에스테르, 티오에테르, 아미드의 형성 및 역가수분해 반응. Acetyl coenzyme A는 천연 macroergic acylating agent입니다. 아실화 반응의 생물학적 역할. 인 원자에서의 친핵성 치환의 개념, 인산화 반응.
유기 화합물의 산화 및 환원 반응. 유기 화합물의 산화 환원 반응의 특이성. 1전자이동, 수소이온이동의 개념과 NAD+↔NADH계의 작용. 알코올, 페놀, 황화물, 카르보닐 화합물, 아민, 티올의 산화 반응. 카르보닐 화합물, 이황화물의 회수 반응. 생명 과정에서 산화 환원 반응의 역할.
역량 요구 사항:
· 카보닐 그룹의 전자 및 공간 구조, 알데하이드 및 케톤에서 옥소 그룹의 반응성에 대한 전자 및 입체 요인의 영향을 알 수 있습니다.
· 촉매의 역할인 물, 알코올, 아민, 티올을 알데히드 및 케톤에 친핵성 첨가하는 반응 메커니즘을 안다.
· 이 반응에서 화합물의 참여를 결정하는 요인인 알돌 축합 반응의 메커니즘을 알 수 있습니다.
· 옥소화합물과 금속수소화물의 환원반응 메커니즘을 안다.
· 알다 반응 센터카복실산 분자에 존재. 라디칼의 구조에 따라 카르복실산의 강도를 비교 평가할 수 있습니다.
· 카르복실기의 전자 및 공간 구조를 알고, 카르복실산 및 그 기능적 유도체(산 할로겐화물, 무수물, 에스테르, 아미드, 염)에서 옥소기의 탄소 원자 능력에 대한 비교 평가를 수행할 수 있습니다. 친핵성 공격을 받는다.
· 아실화, 에스테르화, 에스테르의 가수분해, 무수물, 산 할로겐화물, 아미드의 예를 사용하여 친핵성 치환 반응의 메커니즘을 알 수 있습니다.
주제 6. 지질, 분류, 구조, 특성
지질은 비누화 가능하고 비비누화 가능합니다. 중성 지질. 트리아실글리세롤의 혼합물로서의 천연 지방. 지질을 구성하는 주요 천연 고급 지방산은 팔미트산, 스테아르산, 올레산, 리놀레산, 리놀렌산입니다. 아라키돈산. 불포화 지방산의 특징, w-명칭법.
세포막에서 불포화 지방산 조각의 과산화물 산화. 신체에 저선량의 방사선이 작용하는 막의 지질 과산화의 역할. 항산화 방어 시스템.
인지질. 인산. 포스파티딜콜라민 및 포스파티딜세린(세팔린), 포스파티딜콜린(레시틴)은 세포막의 구조적 구성 요소입니다. 지질 이중층. 스핑고지질, 세라마이드, 스핑고미엘린. 뇌 당지질(cerebrosides, gangliosides).
역량 요구 사항:
지질의 분류와 그 구조를 안다.
· 비누화 지질(알코올 및 고급 지방산)의 구조적 구성 요소 구조를 안다.
· 단순 지질과 복합 지질의 생성 및 가수분해 반응 메커니즘을 안다.
· 불포화 지방산 및 오일에 대한 정성적 반응을 알고 수행할 수 있습니다.
· 불검화물 지질의 분류를 알고, 테르펜과 스테로이드의 분류 원리, 생물학적 역할에 대한 아이디어를 가지고 있습니다.
· 지질의 생물학적 역할과 주요 기능을 알고, 지질 과산화의 주요 단계와 이 과정이 세포에 미치는 영향에 대해 알고 있습니다.
섹션 2. 유기 분자의 입체이성질체. 중요 프로세스에 관여하는 폴리 및 이종 기능성 화합물
주제 7. 유기분자의 입체이성질체
이중 결합이 있는 일련의 화합물의 입체이성질체(p-부분입체이성질체). 불포화 화합물의 시스 - 및 트랜스-이성질체. E, Z는 p-부분입체이성질체에 대한 표기법입니다. p-부분입체이성질체의 비교 안정성.
키랄 분자. 키랄성의 중심으로서의 비대칭 탄소 원자. 하나의 키랄성 중심을 갖는 분자의 입체이성질체(거울상이성질체). 광학 활동. 피셔 프로젝션 공식. 구성 표준, 절대 및 상대 구성으로서의 글리세르알데히드. D, 입체화학적 명명법의 L-시스템. 입체화학적 명명법의 R, S-시스템. 라세믹 혼합물 및 이들의 분리 방법.
2개 이상의 키랄성 중심을 갖는 분자의 입체이성질체. 거울상이성질체, 부분입체이성질체, 중간형.
역량 요구 사항:
· 일련의 알켄 및 디엔 탄화수소에서 입체이성질체의 원인을 알 수 있습니다.
·불포화 화합물의 약식 구조식으로 p-부분입체이성질체의 존재 가능성을 판단할 수 있고, 시스-트랜스-이성질체를 구별할 수 있으며, 이들의 비교 안정성을 평가할 수 있다.
· 분자의 대칭 요소, 유기 분자에서 키랄성이 발생하는 데 필요한 조건을 알 수 있습니다.
· Fisher 프로젝션 공식을 사용하여 거울상이성질체를 알고 묘사할 수 있고, 분자 내 키랄 중심의 수를 기준으로 예상되는 입체이성질체의 수를 계산할 수 있으며, 절대 및 상대 구성을 결정하는 원리, D - , 입체화학적 명명법의 L-시스템.
· 입체화학적 명명법의 R, S-시스템의 기본 원리인 라세미체를 분리하는 방법을 안다.
주제 8. 지방족, 방향족 및 헤테로사이클릭 계열의 생리학적 활성 다관능성 및 이종관능성 화합물
중요한 과정에 관여하고 가장 중요한 약물 그룹의 창시자가 되는 유기 화합물의 특징 중 하나인 다중 및 이종 기능. 기능 그룹의 상대적 위치에 따른 상호 영향의 특징.
다가 알코올: 에틸렌 글리콜, 글리세린. 다가 알코올과 무기산의 에스테르(니트로글리세린, 글리세롤 인산염). 2가 페놀: 하이드로퀴논. 이원자 페놀의 산화. 하이드로퀴논-퀴논 시스템. 항산화제로서의 페놀(유리기 제거제). 토코페롤.
이염기 카르복실산: 옥살산, 말론산, 숙신산, 글루타르산, 푸마르산. 생물학적으로 중요한 탈수소화 반응의 예로서 숙신산에서 푸마르산으로의 전환. 탈카르복실화 반응, 생물학적 역할.
아미노 알코올: 아미노에탄올(콜라민), 콜린, 아세틸콜린. 시냅스에서 신경 임펄스의 화학적 전달에서 아세틸콜린의 역할. 아미노페놀: 도파민, 노르에피네프린, 에피네프린. 이들 화합물 및 그 유도체의 생물학적 역할에 대한 개념. 6-하이드록시도파민과 암페타민의 신경독성 효과.
하이드록시 및 아미노산. 고리화 반응: 고리 형성 과정에 대한 다양한 요인의 영향(해당 형태의 구현, 결과 고리의 크기, 엔트로피 인자). 락톤. 락탐. 락톤 및 락탐의 가수분해. b-하이드록시 및 아미노산의 제거 반응.
Aldegido - 및 케토산: 피루브산, 아세토아세트산, 옥살로아세트산, α-케토글루타르산. 산성 특성 및 반응성. b-케토산의 탈카르복실화 반응과 α-케토산의 산화적 탈카르복실화 반응. 아세토아세트산 에스테르, 케토-에놀 호변이성질체. "케톤체"의 대표자 - b-하이드록시부티르산, b-케토부티르산, 아세톤, 생물학적 및 진단적 중요성.
약물로서의 벤젠 계열의 이종 기능성 유도체. 살리실산 및 그 유도체(아세틸살리실산).
파라아미노벤조산 및 그 유도체(마취제, 노보카인). p-아미노벤조산의 생물학적 역할. 설파닐산 및 그 아미드(스트렙토사이드).
여러 헤테로원자를 가진 헤테로사이클. 피라졸, 이미다졸, 피리미딘, 퓨린. Pyrazolone-5는 비마약성 진통제의 기초입니다. 바르비투르산 및 그 유도체. 하이드록시퓨린(하이포잔틴, 크산틴, 요산), 생물학적 역할. 헤테로원자가 하나인 헤테로사이클. 피롤, 인돌, 피리딘. 생물학적으로 중요한 피리딘 유도체는 니코틴아미드, 피리독살, 이소니코틴산 유도체입니다. Nicotinamide는 NAD+ 코엔자임의 구조적 구성 요소로 OVR 참여를 결정합니다.
역량 요구 사항:
· 구성 및 상호 배열에 따라 이종 작용기 화합물을 분류할 수 있습니다.
· 알다 특정 반응 a, b, g가 있는 아미노 및 하이드록시산 - 작용기 배열.
· 콜린, 아세틸콜린, 아드레날린과 같은 생물학적 활성 화합물의 형성으로 이어지는 반응을 알 수 있습니다.
· 케토산(피루브산, 옥살로아세트산, 아세토아세트산) 및 헤테로사이클릭 화합물(피라졸, 바르비투르산, 퓨린)의 생물학적 활성을 나타내는 케토-에놀 호변이성질체의 역할을 알 수 있습니다.
· 유기 화합물의 산화환원 변환 방법, 이원자 페놀, 니코틴아미드, 케톤체 형성의 생물학적 활성 발현에서 산화환원 반응의 생물학적 역할을 알고 있습니다.
주제9 . 탄수화물, 분류, 구조, 특성, 생물학적 역할
탄수화물, 가수분해와 관련된 분류. 단당류의 분류. 알도스, 케토스: 트리오즈, 테트로스, 오탄당, 육탄당. 단당류의 입체이성질체. 입체화학적 명명법의 D- 및 L-시리즈. 개방형 및 순환형. Fisher 공식과 Haworth 공식. 퓨라노스 및 피라노스, a- 및 b-아노머. 사이클로 옥소 호변 이성질체. 피라노스 형태의 단당류 형태. 오탄당(리보오스, 자일로스)의 가장 중요한 대표 구조; 육탄당(글루코스, 만노스, 갈락토스, 과당); 데옥시당(2-데옥시리보스); 아미노당(글루코사민, 만노사민, 갈락토사민).
단당류의 화학적 성질. 아노머 중심을 포함하는 친핵성 치환 반응. O - 및 N-배당체. 배당체의 가수분해. 단당류의 인산염. 단당류의 산화 및 환원. 알도스의 특성 감소. 글리코닉, 글리카릭, 글리쿠론산.
올리고당. 이당류: 맥아당, 셀로비오스, 유당, 자당. 구조, 사이클로옥소호변이성질체. 가수 분해.
다당류. 다당류의 일반적인 특성 및 분류. 동종 및 이종 다당류. 동종다당류: 전분, 글리코겐, 덱스트란, 셀룰로오스. 1차 구조, 가수분해. 2차 구조(전분, 셀룰로오스)의 개념.
역량 요구 사항:
단당류의 분류(탄소 원자의 수, 작용기의 구성에 따라), 가장 중요한 단당류의 개방 및 고리 형태(푸라노스, 피라노스)의 구조, D-와 L-계열의 입체화학적 비율을 알 수 있습니다. 명명법, 가능한 부분입체이성질체의 수를 결정할 수 있음, 입체이성질체를 부분입체이성질체, 에피머, 아노머로 지칭.
· 단당류 용액의 돌연변이화 원인인 단당류 고리화 반응의 메커니즘을 안다.
· 산화환원 반응, O- 및 N-배당체의 형성 및 가수분해 반응, 에스테르화 반응, 인산화 등 단당류의 화학적 특성을 알 수 있습니다.
· 디올 단편과 단당류의 환원 특성의 존재에 대해 정성적 반응을 수행할 수 있습니다.
· 이당류의 분류와 그 구조, 글리코시드 결합을 형성하는 아노머 탄소 원자의 배열, 이당류의 호변이성질체 변형, 화학적 특성, 생물학적 역할을 안다.
· 다당류의 분류(단당류 조성에 따른 가수분해 관련), 호모다당류의 가장 중요한 대표 구조, 글리코시드 결합을 형성하는 아노머 탄소 원자의 배열, 이들의 물리적, 화학적 특성 및 생물학적 역할을 안다. . 헤테로다당류의 생물학적 역할을 이해합니다.
주제 10.ㅏ- 아미노산, 펩타이드, 단백질. 구조, 특성, 생물학적 역할
단백질과 펩타이드를 구성하는 α-아미노산의 구조, 명명법, 분류. α-아미노산의 입체이성질체.
옥소산으로부터 α-아미노산 형성을 위한 생합성 경로: 환원적 아미노화 및 아미노전이 반응. 필수 아미노산.
이종 작용기 화합물로서의 α-아미노산의 화학적 성질. a-아미노산의 산-염기 특성. 등전점, α-아미노산의 분리 방법. 착물 내 염의 형성. 에스테르화, 아실화, 알킬화 반응. 아질산 및 포름알데히드와의 상호 작용, 아미노산 분석을 위한 이러한 반응의 중요성.
g-아미노부티르산은 CNS의 억제성 신경전달물질입니다. 수면신경전달물질인 L-트립토판, 세로토닌의 항우울 작용. 글리신, 히스타민, 아스파르트산 및 글루탐산의 매개체 특성.
α-아미노산의 생물학적으로 중요한 반응. 탈아미노화 및 수산화 반응. α-아미노산의 탈카르복실화 - 생체 아민 및 생체 조절제(콜라민, 히스타민, 트립타민, 세로토닌)의 형성 방법 펩티드. 펩티드 결합의 전자 구조. 펩타이드의 산성 및 알칼리성 가수분해. 현대 물리 화학적 방법(Sanger 및 Edman 방법)을 사용하여 아미노산 조성을 확립합니다. 신경펩티드의 개념.
단백질의 기본 구조. 부분 및 완전 가수분해. 2차, 3차 및 4차 구조의 개념.
역량 요구 사항:
· 천연아미노산, 필수아미노산의 D-, L-입체화학적 계열에 속하는 α-아미노산의 구조, 입체화학적 분류를 안다.
· in vivo 및 in vitro에서 a-아미노산의 합성 방법을 알고, 산-염기 특성 및 a-아미노산을 등전 상태로 전환하는 방법을 알고 있습니다.
· α-아미노산의 화학적 특성(아미노 및 카르복실 그룹에 대한 반응)을 알고 정성적 반응(xantoprotein, Сu(OH)2, 닌히드린 포함)을 수행할 수 있습니다.
펩타이드 결합의 전자 구조, 단백질과 펩타이드의 1차, 2차, 3차, 4차 구조를 알고, 아미노산 조성 및 아미노산 서열(Sanger 방법, Edman 방법)을 결정하는 방법을 알고, 뷰렛을 수행할 수 있다. 펩타이드와 단백질의 반응.
· 작용기의 보호와 활성화를 이용한 펩타이드 합성방법의 원리를 안다.
주제 11. 뉴클레오티드 및 핵산
핵산을 구성하는 핵염기. 피리미딘(우라실, 티민, 시토신) 및 퓨린(아데닌, 구아닌) 염기, 이들의 방향성, 호변이성질체 변형.
뉴클레오시드, 그들의 형성 반응. 핵산 염기와 탄수화물 잔기의 연결 특성; 글리코시드 센터의 구성. 뉴클레오시드의 가수분해.
뉴클레오티드. 핵산을 형성하는 모노뉴클레오티드의 구조. 명명법. 뉴클레오티드의 가수분해.
핵산의 기본 구조. 포스포다이에스터 결합. 리보핵산과 디옥시리보핵산. RNA와 DNA의 뉴클레오티드 구성. 핵산의 가수분해.
DNA의 2차 구조에 대한 개념. 역할 수소 결합이차 구조의 형성에서. 핵산 염기의 상보성.
변형된 핵산 염기(5-플루오로우라실, 6-메르캅토퓨린) 기반 약물. 화학적 유사성의 원리. 화학 물질 및 방사선의 영향으로 핵산 구조의 변화. 아질산의 돌연변이 유발 작용.
뉴클레오사이드 폴리포스페이트(ADP, ATP), 그 구조의 특징으로 거시성 화합물 및 세포내 생물 조절제의 기능을 수행할 수 있습니다. 호르몬의 세포내 "중개자"인 cAMP의 구조.
역량 요구 사항:
· 피리미딘과 퓨린 질소 염기의 구조, 호변이성질체 변형을 안다.
· N-글리코사이드(뉴클레오사이드) 형성 및 가수분해 반응 메커니즘, 뉴클레오사이드의 명명법을 알기 위해.
· DNA 및 RNA의 일부인 뉴클레오시드와 비교하여 천연 및 합성 뉴클레오시드-항생제 사이의 근본적인 유사점과 차이점을 파악합니다.
· 뉴클레오타이드 형성 반응, 핵산을 구성하는 모노뉴클레오타이드의 구조, 명명법을 안다.
· 뉴클레오사이드 사이클로- 및 폴리포스페이트의 구조, 생물학적 역할을 안다.
· DNA와 RNA의 뉴클레오티드 구성, 핵산의 기본 구조를 생성하는 포스포다이에스터 결합의 역할을 알 수 있습니다.
· DNA의 2차 구조 형성에서 수소 결합의 역할, 질소 염기의 상보성, DNA의 생물학적 기능에서 상보적 상호작용의 역할을 안다.
돌연변이를 일으키는 요인과 그 작용 원리를 알아라.
안내 부분
서지
기본:
1. Romanovsky, 생물 유기 화학 : 2 부분으로 된 교과서 /. - 민스크: BSMU, 20대.
2. Romanovsky, 생물유기화학 워크숍: 지도 시간/에 의해 편집. - 민스크: BSMU, 1999. - 132p.
3. Tyukavkina, N. A., Bioorganic chemistry: 교과서 /,. - 모스크바: 의학, 1991. - 528p.
추가의:
4. Ovchinnikov, 화학: 모노그래프 / .
- 모스크바: 교육, 1987. - 815p.
5. Potapov, : 교과서 /. - 모스크바:
화학, 1988. - 464쪽.
6. Riles, A. Fundamentals of organic chemistry: 교과서 / A. Rice, K. Smith,
R. 워드. - 모스크바: Mir, 1989. - 352p.
7. Taylor, G. 유기화학 기초: 교과서 / G. Taylor. -
모스크바: 미르스.
8. Terney, A. Modern organic chemistry: 교과서 2권 /
A. 터니. - 모스크바: Mir, 1981. - 1310 p.
9. Tyukavkina, 생물 유기물에 대한 실험실 연구용
화학: 교과서 / [및 기타]; N.A에 의해 편집됨
Tyukavkina. - 모스크바: 의학, 1985. - 256p.
10. Tyukavkina, N. A., Bioorganic chemistry: 학생을 위한 교과서
의료기관 / , . - 모스크바.
현대 생물유기화학은 분지된 지식 분야로, 많은 생물의학 분야의 기초이며, 무엇보다도 먼저 생화학, 분자생물학, 유전체학, 단백질체학 및
생물 정보학, 면역학, 약리학.
이 프로그램은 시스템 접근하나의 이론에 전체 과정을 구축
유기물의 전자적, 공간적 구조에 대한 아이디어를 바탕으로
화학적 변형의 화합물 및 메커니즘. 이 자료는 5개 섹션의 형태로 제공되며 가장 중요한 섹션은 "유기 화합물 구조의 이론적 기초 및 반응성을 결정하는 요인", "생물학적으로 중요한 수업유기 화합물” 및 “바이오폴리머 및 그 구조적 구성 요소. 지질"
이 프로그램은 의과대학에서 생물유기화학을 전문적으로 가르치는 것을 목표로 하며, 이와 관련하여 "의학에서의 생물유기화학"이라고 합니다. 생물유기화학의 가르침을 프로파일링하는 것은 생물학적으로 중요한 유기 화합물(이형기능성 화합물, 헤테로사이클, 탄수화물, 아미노산 및 단백질, 핵산, 지질 ) 뿐만 아니라 이러한 종류의 화합물의 생물학적으로 중요한 반응 ). 프로그램의 별도 섹션은 특정 종류의 유기 화합물의 약리학적 특성과 특정 종류의 약물의 화학적 특성을 고려하는 데 전념합니다.
이환율 구조에서 "산화 스트레스 질환"의 중요한 역할 고려 현대인이 프로그램은 자유 라디칼 산화 반응, 실험실 진단에서 자유 라디칼 지질 산화의 최종 생성물 검출, 천연 항산화제 및 항산화 약물에 중점을 둡니다. 이 프로그램은 환경 문제, 즉 제노바이오틱스의 특성과 살아있는 유기체에 대한 독성 영향의 메커니즘에 대한 고려를 제공합니다.
1. 교육의 목적 및 목적.
1.1. 의학에서 생물유기화학 교과목을 가르치는 목적 : 현대생물학의 기초가 되는 생물유기화학의 역할에 대한 이해를 형성하고, 생물유기화합물의 생물학적 작용과 약물의 작용기전 및 생성을 설명하기 위한 이론적 기초를 형성한다. 신약의. 생물 유기 화합물의 가장 중요한 부류의 구조, 화학적 특성 및 생물학적 활성 사이의 관계에 대한 지식을 제공하고 습득한 지식을 후속 학문 연구 및 전문 활동에 적용하는 방법을 가르칩니다.
1.2 생물유기화학 교육 과제:
1. 의학적 및 생물학적 중요성을 결정하는 가장 중요한 생물 유기 화합물 부류의 구조, 특성 및 반응 메커니즘에 대한 지식 형성.
2. 화학적 성질과 생물학적 활성을 설명하기 위한 기초로서 유기 화합물의 전자적 및 공간적 구조에 대한 개념 형성.
3. 기술 및 실무 기술의 형성:
탄소 골격과 작용기의 구조에 따라 생물유기 화합물을 분류한다.
화학 명명법의 규칙을 사용하여 대사 산물, 약물, 생체이물의 이름을 지정합니다.
분자의 반응 중심을 결정합니다.
임상 및 검사실에서 중요한 정성적 반응을 수행할 수 있어야 합니다.
2. OOP 구조에서 규율의 위치:
"생물유기화학" 분야는 "화학" 분야의 필수적인 부분으로, 수학, 자연과학 분야의 순환을 의미합니다.
학문을 연구하는 데 필요한 기본 지식은 수학, 자연 과학 분야의 순환에서 형성됩니다. 물리학, 수학; 의료 정보학; 화학; 생물학; 해부학, 조직학, 배아학, 세포학; 정상적인 생리; 미생물학, 바이러스학.
학문 연구의 선구자입니다.
생화학;
약리학;
미생물학, 바이러스학;
면역학;
전문 분야.
기본 부분의 틀 내에서 학제 간 연결을 제공하는 학문을 병렬로 연구했습니다. 과정:
화학, 물리학, 생물학, 3. 학생들이 생물 유기 화학 연구에 필요한 동화가 필요한 분야 및 주제 목록.
일반 화학. 원자의 구조, 화학 결합의 성질, 결합의 종류, 화학 물질의 종류, 반응의 종류, 촉매 작용, 수용액에서의 매질의 반응.
유기화학. 유기 물질의 분류, 유기 화합물의 명명법, 탄소 원자의 구성, 원자 오비탈의 분극화, 시그마 결합 및 파이 결합. 유기 화합물 종류의 유전적 연결. 다양한 종류의 유기 화합물의 반응성.
물리학. 원자의 구조. 광학 - 스펙트럼의 자외선, 가시광선 및 적외선 영역.
물질과 빛의 상호 작용 - 전송, 흡수, 반사, 산란. 편광.
생물학. 유전자 코드. 유전과 변이의 화학적 기초.
라틴어. 용어 마스터하기.
외국어. 외국 문학 작업 능력.
4. 제공된 (후속)과의 분야 및 학제 간 연결 섹션분야 제공된 항목을 공부하는 데 필요한 이 분야의 섹션 수 번호 제공된 p/n 이름(후속) 분야(후속) 분야 1 2 3 4 5 1 화학 + + + + + 생물학 + - - + + 생화학 + + + + + + 4 미생물학, 바이러스학 + + - + + + 5 면역학 + - - - + 약리학 + + - + + + 7 위생학 + - + + + 전문 분야 + - - + + + 5. 학문의 내용을 숙달하는 수준 연구 학문의 목적 달성 "생물유기화학"은 학생들이 특정 역량, 지식, 기술 및 특정 실용적인 기술을 갖추어야 하는 여러 가지 문제가 있는 과제의 구현을 제공합니다. 나타나야 합니다.
5.1. 학생은 다음을 갖추어야 합니다.
5.1.1. 일반적인 문화적 역량:
다양한 유형의 직업 및 사회 활동에서 인문학, 자연 과학, 생물 의학 및 임상 과학의 방법을 실제로 사용하기 위해 사회적으로 중요한 문제 및 프로세스를 분석하는 능력 및 준비성(OK-1);
5.1.2. 전문 역량(PC):
과학적 및 전문적 정보를 획득, 저장, 처리하는 주요 방법, 방법 및 수단을 적용할 수 있는 능력 및 준비성; 현대 사용을 포함하여 다양한 출처에서 정보를 얻습니다. 컴퓨터 시설, 네트워크 기술, 데이터베이스 및 과학 문헌 작업, 정보 분석, 검색, 읽은 내용을 전문적인 문제 해결 도구로 전환하는 능력 및 의지 (주요 조항, 결과 및 제안 강조);
과학적 문제의 공식화 및 실험적 구현에 참여하는 능력과 의지(PC-2, PC-3, PC-5, PC-7).
5.2. 학생은 다음을 알아야 합니다.
유기 화합물의 분류, 명명법 및 이성질체의 원리.
유기화합물의 구조와 반응성을 연구하기 위한 기초가 되는 이론적 유기화학의 기본 토대.
유기 분자의 공간 및 전자 구조와 생명 과정에 참여하는 물질의 화학적 변형 생물학적 구조, 생물학적으로 중요한 유기 화합물의 주요 부류의 화학적 특성 및 생물학적 역할.
5.3. 학생은 다음을 할 수 있어야 합니다.
탄소 골격의 구조와 작용기의 성질에 따라 유기화합물을 분류한다.
구조식에 따라 생물학적으로 중요한 물질 및 약물의 전형적인 대표 이름과 이름으로 공식을 작성하십시오.
유기 화합물의 화학적 거동을 결정하기 위해 분자에서 작용기, 산성 및 염기성 중심, 공액 및 방향족 조각을 분리합니다.
유기 화합물의 화학적 변형의 방향과 결과를 예측합니다.
5.4. 학생은 다음을 갖추어야 합니다.
기술 독립적 인 일교육, 과학 및 참고 문헌; 연구를 수행하고 결론을 도출합니다.
화학물질 취급에 능숙해야 합니다.
화학 실험실에서 안전하게 작업할 수 있는 기술과 부식성, 유독성, 휘발성 유기 화합물을 취급하고 버너, 스피릿 램프 및 전기 가열 장치로 작업할 수 있는 능력이 있어야 합니다.
5.5. 지식 통제의 형태 5.5.1. 전류 제어:
재료 마스터링의 진단 제어. 주로 공식 자료에 대한 지식을 제어하기 위해 주기적으로 수행됩니다.
각 수업에서 교육용 컴퓨터 제어.
테스트 작업, 분석 및 일반화 능력이 필요합니다(부록 참조).
프로그램의 많은 부분에 대한 연구 완료 시 계획된 구어체 대화(부록 참조).
5.5.2 최종 관리:
테스트(두 단계로 수행):
C.2 - 수학, 자연 과학 및 생의학
2 유기 현대 물리적 화합물의 분류, 명명법 및 분류 및 분류 기능: 탄소 골격의 구조 및 작용기의 특성.
화학적 방법 작용기, 유기 라디칼. 알코올, 페놀, 티올, 에테르, 황화물, 알데히드 화합물, 케톤, 카르복실산 및 그 유도체, 술폰산과 같은 유기 화합물의 생물유기 부류에 대한 생물학적으로 중요한 연구.
IUPAC 명명법. 다양한 국제 명명법 - 대체 및 급진적 기능 명명법. 지식의 가치 3 유기 화합물 구조의 이론적 기초 및 유기 화합물 구조 이론 A.M. Butlerova. 위치를 결정하는 주요 요인. 구조식. 반응성 위치에 따른 탄소 원자의 성질. 쇠사슬. 유기 화학의 특정 현상으로서의 이성질체. 유형 입체이성질체.
광학 이성질체의 원인으로서 유기 화합물 분자의 키랄성. 하나의 키랄성 중심을 갖는 분자의 입체이성질체(거울상이성질체). 광학 활동. 구성 표준으로서의 글리세르알데히드. 피셔 프로젝션 공식. 입체화학적 명명법의 D 및 L-시스템. R,S-명명법에 대한 아이디어.
2개 이상의 키랄성 중심을 갖는 분자의 입체이성질체: 거울상이성질체 및 부분입체이성질체.
이중 결합이 있는 일련의 화합물의 입체이성질체(Pidstereomerism). 시스 및 트랜스 이성질체. 유기 화합물의 입체 이성질체 및 생물학적 활성.
원자의 상호 영향: 유기 화합물 분자에서 전달되는 원인, 유형 및 방법.
편성. 개방 회로에서의 활용(Pi-Pi). 공액 결합. 생물학적으로 중요한 화합물의 디엔 구조: 1,3-디엔(부타디엔), 폴리엔, 알파, 베타-불포화 카르보닐 화합물, 카르복실기. 시스템 안정화 요인으로서의 결합. 컨쥬게이션 에너지. 아레나(Pi-Pi) 및 헤테로사이클(p-Pi)에서의 컨쥬게이션.
방향성. 방향족 기준. 벤조이드(벤젠, 나프탈렌, 안트라센, 페난트렌) 및 헤테로사이클릭(푸란, 티오펜, 피롤, 이미다졸, 피리딘, 피리미딘, 퓨린) 화합물의 방향족성. 생물학적으로 중요한 분자(포르핀, 헴 등)에서 공액 구조의 광범위한 발생.
분자 내 전자 밀도의 불균일한 분포의 원인으로 본드 분극 및 전자 효과(유도성 및 중간체). 치환체는 전자 공여체와 전자 수용체입니다.
가장 중요한 치환기와 그 전자적 효과. 치환기의 전자적 효과와 분자의 반응성. 벤젠 고리의 방향 규칙, I 및 II 종류의 치환기.
유기 화합물의 산도 및 염기도.
수소 함유 작용기(아민, 알코올, 티올, 페놀, 카르복실산)를 가진 유기 화합물의 중성 분자의 산도 및 염기도. Bronsted Lowry와 Lewis에 따른 산과 염기. 산과 염기의 공액 쌍. 음이온의 산도 및 안정성. Ka 및 pKa 값으로 유기 화합물의 산도를 정량적으로 평가합니다.
다양한 종류의 유기 화합물의 산도. 유기 화합물의 산도를 결정하는 요인: 비금속 원자(С-Н, N-H, O-H 산); 비금속 원자의 분극성(알코올 및 티올, 티올 독); 라디칼의 특성(알코올, 페놀, 카르복실산).
유기 화합물의 염기성. n-염기(헤테로사이클) 및 Pi-염기(알켄, 알칸디엔, 아렌). 유기 화합물의 염기도를 결정하는 요인: 헤테로 원자(O- 및 N 염기)의 전기음성도; 비금속 원자의 분극화 가능성(O- 및 S-염기); 라디칼의 특성(지방족 및 방향족 아민).
반응성 및 생물학적 활성에 대한 중성 유기 분자의 산-염기 특성의 중요성.
산-염기 특성의 특정 표현으로서의 수소 결합. 생물학적 기능을 위한 화학적 기초로서 유기 화합물의 일반적인 반응성 패턴.
유기 화합물의 반응 메커니즘.
치환, 첨가, 제거, 재배열, 산화환원 반응의 결과 및 메커니즘에 따른 유기 화합물의 반응 분류 - 라디칼, 이온성(친전자성, 친핵성). 유기 화합물의 공유 결합 절단 유형 및 생성된 입자: 동질 분해(유리기) 및 이종 분해(탄소 양이온 및 탄소음이온).
이러한 입자의 전자 및 공간 구조와 상대적 안정성을 결정하는 요소.
C-H 결합을 포함하는 알칸에서 라디칼 치환의 호몰리틱 반응 sp 3-혼성화된 탄소 원자. 살아있는 세포에서 자유 라디칼 산화 반응. 반응성(라디칼) 형태의 산소. 산화 방지제. 생물학적 중요성.
친전자성 첨가 반응(Ae): Pi-결합을 포함하는 이종 분해 반응. 에틸렌 할로겐화 및 수화 반응의 메커니즘. 산성 촉매. 반응의 위치 선택성에 대한 정적 및 동적 요인의 영향. 비대칭 알켄에서 파이 결합에 대한 수소 함유 물질의 첨가 반응의 특성. Markovnikov의 규칙. 공액계에 대한 친전자성 첨가의 특징.
친전자성 치환 반응(Se): 방향족 시스템을 포함하는 이종 분해 반응. 아렌에서 친전자성 치환 반응의 메커니즘. 시그마 콤플렉스. 아렌의 알킬화, 아실화, 니트로화, 술폰화, 할로겐화 반응. 오리엔테이션 규칙.
1종 및 2종의 치환기. 헤테로사이클에서 친전자성 치환 반응의 특징. 이종 원자의 배향 영향.
sp3 혼성화된 탄소 원자에서의 친핵성 치환(Sn) 반응: 탄소-헤테로원자 시그마 결합(할로겐 유도체, 알코올)의 분극화로 인한 이종 분해 반응. 친핵성 치환 반응에서 화합물의 반응성에 대한 전자적 및 공간적 요인의 영향.
할로겐 유도체의 가수분해 반응. 알코올, 페놀, 티올, 황화물, 암모니아 및 아민의 알킬화 반응. 수산기의 친핵성 치환에서 산 촉매 작용의 역할.
1차 아미노기를 가진 화합물의 탈아미노화. 알킬화 반응의 생물학적 역할.
제거 반응(탈수소할로겐화, 탈수).
sp3 혼성화된 탄소 원자에서 친핵성 치환을 수반하는 제거 반응의 원인으로서 증가된 CH-산성.
친핵성 첨가 반응(An): 탄소-산소 파이 결합(알데하이드, 케톤)을 포함하는 이종 분해 반응. 카르보닐 화합물의 부류. 대표자. 알데하이드, 케톤, 카르복실산 얻기. 카르보닐기의 구조와 반응성. 전자 및 공간 요인의 영향. An 반응의 메커니즘: 카르보닐의 반응성을 증가시키는 양성자화의 역할. 알데히드 및 케톤의 생물학적으로 중요한 반응 수소화, 알데히드의 산화-환원(dismutation 반응), 알데히드의 산화, 시아노히드린의 형성, 수화, 헤미아세탈의 형성, 이민. 알돌 첨가 반응. 생물학적 중요성.
sp2 혼성화된 탄소 원자에서 친핵성 치환 반응(카르복실산 및 그 기능성 유도체).
sp2 혼성화 탄소 원자에서 친핵성 치환(Sn) 반응의 메커니즘. 아실화 반응 - 무수물, 에스테르, 티오에테르, 아미드의 형성 및 역가수분해 반응. 아실화 반응의 생물학적 역할. O-H 그룹에 따른 카르복실산의 산 특성.
유기 화합물의 산화 및 환원 반응.
산화 환원 반응, 전자 메커니즘.
유기 화합물에서 탄소 원자의 산화 정도. 1차, 2차 및 3차 탄소 원자의 산화. 다양한 종류의 유기 화합물의 산화성. 세포에서 산소를 이용하는 방법.
에너지 산화. 산화 효소 반응. 유기 물질의 산화는 케모트로프의 주요 에너지원입니다. 플라스틱 산화.
4 유기 화합물의 생물학적으로 중요한 부류 다가 알코올: 에틸렌 글리콜, 글리세롤, 이노시톨. 하이드록시산 형성: 분류, 명명법, 락트산, 베타하이드록시부티르산, 감마하이드록시부티르산, 말산, 타르타르산, 시트르산, 환원성 아민화, 트랜스아민화 및 탈카르복실화의 대표.
아미노산: 분류, 베타 및 감마 이성질체 아미노프로판, 감마아미노부티르산, 엡실론아미노카프로산 대표. 반응 살리실산 및 그 유도체(아세틸살리실산 해열제, 항염증제 및 항류마티스제, 엔테로셉톨 및 5-NOC. 아편 알칼로이드, 진경제(파파베린) 및 진통제(모르핀)의 기초가 되는 이소퀴놀린의 핵심. 아크리딘 유도체는 소독제입니다.
잔틴 유도체 - 카페인, 테오브로민 및 테오필린, 인돌 유도체 레세르핀, 스트리키닌, 필로카르핀, 퀴놀린 유도체 - 퀴닌, 이소퀴놀린 모르핀 및 파파베린.
cephalosproins - cephalosporanic acid의 유도체, tetracyclines - naphthacene의 유도체, streptomycins - amyloglycosides. 반합성 5 바이오폴리머 및 그 구조적 구성 요소. 지질. 정의. 분류. 기능.
사이클로-옥소토머리즘. 돌연변이. 단당류 데옥시당(데옥시리보스) 및 아미노당(글루코사민, 갈락토사민)의 유도체.
올리고당. 이당류: 맥아당, 유당, 자당. 구조. 배당체 결합. 회복 속성. 가수 분해. 생물학적(아미노산 분해 경로); 라디칼 반응 - 하이드록실화(아미노산의 옥시 유도체 형성). 펩티드 결합의 형성.
펩티드. 정의. 펩타이드 그룹의 구조. 기능.
생물학적 활성 펩티드: 글루타티온, 옥시토신, 바소프레신, 글루카곤, 신경펩티드, 키닌 펩티드, 면역활성 펩티드(티모신), 염증 펩티드(디펙신). 사이토카인의 개념. 항생제 펩티드(그라미시딘, 악티노마이신 D, 사이클로스포린 A). 펩티드 독소. 특정 아미노산 잔기와 펩티드의 생물학적 효과의 연관성.
다람쥐. 정의. 기능. 단백질 구조 수준. 1차 구조는 아미노산의 서열입니다. 연구 방법. 단백질의 부분 및 완전 가수분해. 단백질의 1차 구조를 결정하는 가치.
단백질의 기능적 활성과 1차 구조 사이의 관계를 연구하기 위한 방법으로서 부위 지정 돌연변이유발. 단백질의 기본 구조의 선천성 장애 - 점 돌연변이. 2차 구조 및 유형(알파 나선, 베타 구조). 3차 구조.
변성. 활성 센터의 개념입니다. 올리고머 단백질의 4차 구조. 협동 속성. 단순 및 복합 단백질, 당단백질, 지단백질, 핵단백질, 인단백질, 금속단백질, 색소단백질.
질소 염기, 뉴클레오사이드, 뉴클레오타이드 및 핵산.
개념 질소 염기, 뉴클레오사이드, 뉴클레오타이드 및 핵산의 정의. 퓨린(아데닌 및 구아닌) 및 피리미딘(우라실, 티민, 시토신) 질소 함유 염기. 방향족 속성. 생물학적 역할을 수행하기 위한 기초로서 산화 분해에 대한 내성.
락팀 - 락탐 호변 이성질체. 미량의 질소 함유 염기(하이포잔틴, 3-N-메틸우라실 등). 질소 염기의 유도체 - 항대사물질(5-플루오로우라실, 6-메르캅토퓨린).
뉴클레오사이드. 정의. 질소 함유 염기와 오탄당 사이의 글리코시드 결합 형성. 뉴클레오시드의 가수분해. 뉴클레오사이드 항대사물질(아데닌 아라비노사이드).
뉴클레오티드. 정의. 구조. 인산으로 C5 오탄당 하이드록실의 에스테르화 동안 포스포에스테르 결합의 형성. 뉴클레오티드의 가수분해. Macroergic nucleotides (nucleoside polyphosphates - ADP, ATP 등). 뉴클레오티드-코엔자임(NAD+, FAD), 구조, 비타민 B5 및 B2의 역할.
핵산 - RNA 및 DNA. 정의. RNA와 DNA의 뉴클레오티드 구성. 기본 구조. 포스포다이에스터 결합. 핵산의 가수분해. 삼중항(codon), 유전자(cistron), 유전자 코드(genome) 개념의 정의. 국제 프로젝트 "인간 게놈".
DNA의 이차 구조. 2차 구조 형성에서 수소 결합의 역할. 상보적인 질소 염기 쌍. DNA의 3차 구조. 화학 물질의 작용에 따른 핵산 구조의 변화. 물질-돌연변이원의 개념.
지질. 정의, 분류. 비누화 및 불비누화 지질.
천연 고급 지방산은 지질의 구성 요소입니다. 가장 중요한 대표자: 팔미트산, 스테아르산, 올레산, 리놀레산, 리놀렌산, 아라키돈산, 에이코사펜타엔산, 도코사헥사엔산(비타민 F).
중성 지질. 아실글리세롤 - 천연 지방, 오일, 왁스.
인공 식품 하이드로 지방. 아실글리세롤의 생물학적 역할.
인지질. 인산. 포스파티딜콜린, 포스파티디에탄올아민 및 포스파티딜세린. 구조. 생체막 형성에 참여. 과산화세포막의 지질.
스핑고지질. 스핑고신과 스핑고미엘린. 당지질(cerebrosides, sulfatides 및 gangliosides).
불검화물 지질. 테르펜. 모노- 및 바이사이클릭 테르펜 6 약리학적 특성 일부 클래스의 모노-폴리 및 일부 클래스의 헤테로기능성 화합물(하이드로할로겐화물, 알코올, 하이드록시- 및 유기 화합물, 옥소산, 벤젠 유도체, 헤테로사이클, 알칼로이드)의 약리학적 특성. 화학적 특정 항염증제, 진통제, 방부제 및 약물 종류의 화학적 성질. 항생제.
6.3. 학문 분야 및 수업 유형 1. 주제 소개. 생물 유기 화합물의 분류, 명명법 및 연구 2. 유기 반응성 구조의 이론적 기초.
3. 유기 화합물의 생물학적으로 중요한 종류 5 특정 종류의 유기 화합물의 약리학적 특성. 일부 종류의 의약품 L-강의의 화학적 성질; PZ - 실습; LR - 실험실 작업; C - 세미나; SRS - 학생들의 독립적인 작업;
6.4 규율 강의 주제별 계획 1 1 주제 소개. 생물 유기 화학 발전의 역사, 3 2의 중요성 유기 화합물 AM Butlerova의 구조 이론. 4 2 원자의 상호 영향으로서의 이성질체: 7 1.2 "생물유기 화합물 연구를 위한 분류, 명명법 및 현대 물리화학적 방법" 및 "유기 화합물 구조 및 요인의 이론적 기초" 섹션에서 전달의 원인, 유형 및 방법 그들의 반응을 결정합니다. 15 5 몇몇 종류의 유기 화합물의 약리학적 특성. 화학 19 4 14 고급 카르복실산의 불용성 칼슘 염 검출 1 1 주제 소개. 권장 문헌으로 분류 및 작업.
생물 유기 화합물의 명명법. 3 2에 대한 작문 과제 완료 분자 내 원자의 상호 영향 권장 문헌을 참조하십시오.
4 2 유기농의 산도 및 염기도 권장 문헌을 참조하십시오.
5 2 유기 반응의 메커니즘 권장 문헌을 참조하십시오.
6 2 유기물의 산화 및 환원 권장 문헌을 참고하십시오.
7 1.2 섹션별 검토 권장 문헌으로 작업합니다. * 제안된 주제의 현대적인 물리화학적 방법, 생물유기 화합물에 대한 연구 수행, 다양한 유기 화합물 및 요인의 정보 검색, 인터넷 및 영어 데이터베이스 작업 8 3 이종 기능 생물유기 권장 문헌으로 작업.
9 3 생물학적으로 중요한 헤테로사이클. 권장 문헌으로 작업하십시오.
10 3 비타민(실험실 작업). 권장 문헌으로 작업하십시오.
12 4 알파-아미노산, 펩타이드 및 단백질. 권장 문헌으로 작업하십시오.
13 4 질소 염기, 뉴클레오시드, 권장 문헌을 참조하십시오.
뉴클레오티드 및 핵산. 15 5 일부의 약리학적 특성을 작성하기 위한 작문 작업 완료 권장 문헌을 사용합니다.
유기 화합물의 종류. 작문을 위한 작문 과제 완료 일부 클래스의 화학적 특성 화학식일부 약용 * - 학생이 선택한 작업.
유기 화합물.
유기 분자.
유기 분자.
유기 화합물.
유기 화합물.
사이. 입체이성질체.
일부 종류의 약물.
학기 중 학생은 실기 수업에서 최대 65점을 받을 수 있습니다.
한 번의 실습 수업에서 학생은 최대 4.3점을 받을 수 있습니다. 이 점수는 수업 참석(0.6점), 과외 활동을 위한 과제 완료(1.0점), 실험실 작업(0.4점) 및 구두 답변 및 시험 과제에 대해 점수가 부여됩니다(1.3에서 2.3점으로). 수업 참석, 과외 활동 및 실험실 작업을 위한 과제 완료에 대한 점수는 "예" - "아니오" 기준으로 부여됩니다. 구두 답변 및 시험 과제에 대한 점수는 긍정적인 답변의 경우 1.3에서 2.3점으로 구분되어 부여됩니다. 0-1.29점은 "불만족", 1.3-1.59 - "만족", 1.6 -1.99 - " 좋음", 2.0-2.3 - "훌륭함". 제어 작업에서 학생은 최대 5.0점을 얻을 수 있습니다. 수업 참석은 0.6점, 구두 답변은 2.0-4.4점입니다.
시험에 응시하려면 학생은 최소 45점을 받아야 하며 학생의 현재 성과는 다음과 같이 평가됩니다: 65-75점 - "우수", 54-64점 - "좋음", 45-53점 - " 만족", 45점 미만은 불만족입니다. 학생이 65점에서 75점("우수" 결과)의 점수를 받으면 시험에서 면제되고 기록부에 자동으로 "통과" 표시를 받아 시험에서 25점을 얻습니다.
시험에서 학생은 최대 25점을 받을 수 있습니다. 0-15.9점은 "불만족", 16-17.5 - "만족", 17.6-21.2 - "좋음", 21.3-25 - "훌륭함" 평가에 해당합니다. .
가산점 배분(학기당 최대 10점) 1. 강의 출석 - 0.4점(강의 100% 출석 - 학기당 6.4점)
2. 다음을 포함하여 최대 3점의 UIRS 참여:
제안된 주제에 대한 에세이 작성 - 0.3점;
최종 교육 및 이론 회의를 위한 보고서 및 멀티미디어 프레젠테이션 준비 3. NIRS 참여 - 다음을 포함하여 최대 5점:
부서에서 학생 과학계 회의 참석-0.3 점;
학생 과학계 회의 보고서 준비-0.5 점;
대학생 과학 회의에서 보고서 발표-1 점;
지역, 전 러시아 및 국제 학생 과학 회의에서 보고서 발표-3 점;
학생 과학 회의 컬렉션에 출판 - 2점;
동료 평가 과학 저널에 출판 - 5점;
4. 참여 교육적인 일부서에서 다음을 포함하여 최대 3점
과외 시간 동안 교육 작업을 위해 부서에서 수행하는 활동 조직에 참여-한 이벤트에 대해 2 점;
과외 시간 동안 교육 작업을 위해 부서에서 개최하는 행사에 참석 - 한 행사에 1점;
벌점 배분(학기당 총 10점 이내) 1. 부당한 사유로 인한 결석 - 0.66~0.67점(출석률 0% - 정당한 사유로 결석한 경우 10점) 현재 순위를 향상시키기 위해 수업을 해결할 권리가 있습니다.
통과가 무례한 경우 학생은 수업을 완료하고 0.8 감점 점수를 받아야 합니다.
학생이 교실에서 물리적 존재에서 해제되면 (아카데미의 명령에 따라) 과외 활동에 대한 과제가 완료되면 최대 점수가 부여됩니다.
6. 교육 및 방법론 정보 지원분야 1. N. A. Tyukavkina, Yu.I. Baukov, S.E. Zurabyan. 생물유기화학. M.: 드로파, 2009.
2. Tyukavkina N.A., Baukov Yu.I. 생물유기화학. M.: 드로파, 2005.
1. Ovchinikov Yu.A. 생물유기화학. M.: 깨달음, 1987.
2. Riles A., Smith K., Ward R. 유기 화학 기초. M.: 미르, 1983.
3. Shcherbak I.G. 생물학적 화학. 의대 교과서. S.-P. SPbGMU 출판사, 2005.
4. Berezov T.T., Korovkin B.F. 생물학적 화학. M.: 의학, 2004.
5. Berezov T.T., Korovkin B.F. 생물학적 화학. M.: 의학, Postupaev V.V., Ryabtseva E.G. 세포막의 생화학적 구성(의과대학 약학부 학생들을 위한 교과서). 하바롭스크, FESMU. 2001년
7. 소로스 교육 저널, 1996-2001.
8. 생물유기화학 실험실 연구 안내. N. A. 편집 모스크바 Tyukavkina:
의학, 7.3 교육 자료, 부서에서 준비 1. 학생들을 위한 생물 유기 화학의 실용적인 수업의 체계적인 개발.
2. 학생들의 독립적인 과외 활동의 방법론적 개발.
3. 보로딘 E.A., 보로디나 G.P. 생화학적 진단(혈액과 소변의 생화학적 매개변수의 생리학적 역할과 진단적 가치). 교과서 4판. 블라고베셴스크, 2010.
4. 보로디나 G.P., 보로딘 E.A. 생화학적 진단(혈액과 소변의 생화학적 매개변수의 생리학적 역할과 진단적 가치). 전자교과서. 블라고베셴스크, 2007.
5. 생물 유기 화학에 대한 학생들의 지식에 대한 컴퓨터 테스트 작업 (Borodin E.A., Doroshenko G.K., Egorshina E.V. 작성) Blagoveshchensk, 2003.
6. 의과대학 의과대학 학생들을 위한 생물유기화학 시험을 위한 생물유기화학 시험과제. 툴킷. (E. A. Borodin, G. K. Doroshenko 작성). 블라고베셴스크, 2002.
7. 의학부 학생들을 위한 생물유기화학 실습 수업을 위한 생물유기화학 테스트 과제. 툴킷. (E. A. Borodin, G. K. Doroshenko 작성). 블라고베셴스크, 2002.
8. 비타민. 툴킷. (Egorshina E.V. 편집). 블라고베셴스크, 2001.
8.5 장비에 대한 규율 보장 및 교육 자료 1 화학 유리 제품:
유리 제품:
1.1 화학 시험관 5000 실기 수업의 화학 실험 및 분석, UIRS, 1.2 원심분리기 시험관 2000 실기 수업의 화학 실험 및 분석, UIRS, 1.3 유리 막대 100 실기 수업의 화학 실험 및 분석, UIRS, 1.4. 다양한 부피의 플라스크(실습 수업에서 200개의 화학 실험 및 분석용, UIRS, 1.5개의 대용량 플라스크 - 0.5-2.0 30개의 실용 수업에서 화학 실험 및 분석, UIRS, 다양한 120개의 화학 실험 및 실용 수업의 분석용 비커 1.6개, UIRS, 1.7 대형 비커 50 실기 수업의 화학 실험 및 분석, UIRS, 작업자 준비 1.8 다양한 크기의 플라스크 2000 실기 수업의 화학 실험 및 분석, UIRS, 1.9 필터 깔때기 200 실기 수업의 화학 실험 및 분석, UIRS , 1.10 유리기구 실기수업, UIRS, 크로마토그래피 등의 화학 실험 및 분석).
1.11 알코올 램프 30 실기 수업의 화학 실험 및 분석, UIRS, 도자기 접시 1.12 잔다른 부피 (0.2-30 실습을 위한 시약 준비 1.13 유봉이 있는 박격포 실습을 위한 시약 준비, 화학 실험및 1.15 증발 컵
1.16 다양한 100 부피 플라스크 실습용 시약 준비, 화학 실험 1.17 각종 40 측정 실린더 실습용 시약 준비, 화학 실험 1.18 다양한 부피의 비커 30 실습용 시약 준비, 화학 실험 수업, UIRS, 마이크로피펫 ) 1.20 기계식 자동 15 실기 화학 실험 및 분석, UIRS, 1.21 기계식 자동 2 실기 화학 실험 및 분석, UIRS, 가변 용량 디스펜서 NIRS 1.22 전자 자동 1 실기 화학 실험 및 분석, UIRS, 1.23 가변 마이크로주사기 5 실기 수업의 화학 실험 및 분석, UIRS, 2 기술 장비:
2.1 시험관 랙 100 실기 수업의 화학 실험 및 분석, UIRS, 2.2 피펫 스탠드 15 실기 수업의 화학 실험 및 분석, UIRS, 2.3 금속 스탠드 15 실기 수업의 화학 실험 및 분석, UIRS, 가열 장치:
2.4 건조 캐비닛 3 건조 화학 유리 제품, 화학 물질 보관 2.5 공기 온도 조절기 2측정 중 인큐베이션 혼합물의 온도 제어 2.6 물 온도 조절기 2 측정 중 인큐베이션 혼합물의 온도 제어 2.7 전기 스토브 3 실습, 화학 실험 및 2.8 냉동고가 있는 냉장고를 위한 시약 준비 5 화학 시약, 용액 및 생물학적 물질의 보관 "Chinar", "Biryusa" 챔버, 실습, UIRS, NIRS "Stinol"
2.9 보관함 8 화학 시약 보관 2.10 금속 금고 1 유독물 보관시약 및 에탄올 3 범용 장비:
3.1 분석 댐퍼 2 실기 수업의 중량 분석, UIRS, NIRS 3.6 초원심분리기 1 실기(독일)에서 침강 분석 방법 시연 3.8 자기 교반기 2 실기 수업을 위한 시약 준비 3.9 전기 증류기 DE– 1 시약 3.10 온도계 10 3.11에서 화학 분석 중 온도 제어 비중계 세트 1 용액의 밀도 측정 4 특수 목적 장비:
4.1 혈청 단백질 전기영동법 실증 1차 전기영동 장치 4.2 혈청 지단백 분리법 실증 1차 전기영동 장치 4.3 컬럼 장비 크로마토그래피층에 의한 단백질 분리법 실증. 수업, NIRS 측정 장비:
광전색도계:
4.8 광도계 "SOLAR" 1 4.9 Spectrophotometer SF 16에서 유색 용액의 흡광도 측정 1 측정가시광선 및 UV 영역에서 용액의 흡광도 4.10 임상 분광광도계 1 스펙트럼 결정 방법을 사용하여 "Schimadzu - CL-770" 스펙트럼의 가시광선 및 UV 영역에서 용액의 흡광도 측정 4.11 고성능 1 HPLC 시연 방법(실습, UIRS, NIRS) 액체 크로마토그래프 "Milichrom - 4".
4.12 편광계 1 거울상이성질체의 광학적 활성 시연, 4.13 굴절계 1 시연굴절 측정 방법 4.14 pH 측정기 3 완충 용액 준비, 완충 용액 시연 5 투사 장비:
5.1 멀티미디어 프로젝터 및 2 멀티미디어 프리젠테이션 시연, 사진 및 오버헤드 프로젝터: 시연강의 슬라이드 및 실습 5.3 "Poeleng-semiautomatic" 5.6 시연용 장치 형태학 교육 건물에 할당됨. UIRS 및 NIRS 필름 영사기 동안 강의에서 투명 필름(오버헤드) 및 설명 자료 시연.
6 컴퓨팅:
6.1 대성당 네트워크 1 인터넷의 교육 리소스에 대한 액세스(화학, 생물학 및 인터넷 의학에 대한 국제 전자 데이터베이스가 있는 국가 및 개인용 컴퓨터) 교육 및 6.2 개인용 컴퓨터 부서의 교사를 위한 학생 부서의 인쇄 및 전자 직원 부서 교훈적인 자료교육 및 방법 론적 작업 과정에서 6.3 10 1을위한 컴퓨터 수업 시험 및 시험 중 실제 수업 자리에서 학생들의 지식에 대한 프로그래밍 된 테스트 (현재 7 학습 테이블 :
1. 펩타이드 결합.
2. 폴리펩티드 사슬 구조의 규칙성.
3. 단백질 분자의 결합 유형.
4. 이황화 결합.
5. 단백질의 종 특이성.
6. 단백질의 2차 구조.
7. 단백질의 3차 구조.
8. 미오글로빈과 헤모글로빈.
9. 헤모글로빈 및 그 유도체.
10. 혈장의 지단백질.
11. 고지혈증의 종류
12. 종이에 단백질 전기영동.
13. 단백질 생합성 계획.
14. 콜라겐과 트로포콜라겐.
15. 미오신과 액틴.
16. 비타민 결핍 PP(펠라그라).
17. 비타민제 B1.
18. 비타민제 C.
19. A 비타민 결핍증
20. 비타민 결핍증 D(구루병).
21. 프로스타글란딘은 불포화 지방산의 생리 활성 유도체입니다.
22. 카탈라민과 인돌라민으로부터 형성된 뉴로신.
23. 도파민의 비효소 반응 생성물.
24. 신경펩티드.
25. 고도 불포화 지방산.
26. 리포좀과 세포막의 상호작용.
27. 자유 산화(조직 호흡과 다름).
28. 오메가 6 및 오메가 3 계열의 PUFA.
2 프로그램의 다양한 섹션에 대한 슬라이드 세트 8.6 대화형 교육 자료(인터넷 기술), 멀티미디어 자료, 전자 도서관 및 교과서, 사진 및 비디오 자료 1 대화형 교육 자료(인터넷 기술) 2 멀티미디어 자료 Stonik V.A. (TIBOCH DSC SB RAS) “천연 화합물은 기본 5 Borodin E.A. (AGMA) “인간 게놈. Genomics, proteomics 및 저자 발표 6 Pivovarova Ye.N.(ICiG SB RAMS) "인간에 대한 유전자 발현 조절의 역할 저자 발표".
3 전자 도서관 및 교과서:
2 메드라인. 화학, 생물학 및 의학에 관한 전자 데이터베이스의 CD 버전.
3 생명 과학. 화학 및 생물학에 관한 전자 데이터베이스의 CD 버전.
4 캠브리지 과학 초록. 화학 및 생물학에 관한 전자 데이터베이스의 CD 버전.
5 PubMed - National Institutes of Health의 전자 데이터베이스 http://www.ncbi.nlm.nih.gov/pubmed/ 유기 화학. 전자도서관. (N. F. Tyukavkina, A.I. Khvostova 편집) - M., 2005.
유기농 및 일반 화학. 약. 학생을 위한 강의, 코스. (전자 설명서). M., 2005
4 비디오:
3 MES TIBOCH DSC 2월 RAS CD
5 사진 및 비디오 자료:저자의 사진 및 비디오 자료 카페 교수 웁살라(스웨덴), 그라나다(스페인), 일본 대학 의과대학(니가타, 오사카, 가나자와, 히로사키), IBMCh RAMS, 러시아 보건부의 IFChM, TIBOHE DSC의 1개 대학에 대한 E.A. Borodina. 2월 란.
8.1. 수업 번호 4 "산도 및 염기도에 대한 전류 제어(응답 표준 포함)에 대한 테스트 작업의 예유기 분자"
1. Bronsted-Lowry 산의 특징을 선택하십시오.
1. 수소 이온 수용액의 농도 증가 2. 수산화 이온 수용액의 농도 증가 3. 중성 분자 및 이온 - 양성자 기증자 4. 중성 분자 및 이온 - 양성자 수용체 5. 영향을 미치지 않음 매체의 반응 2. 유기 분자의 산도에 영향을 미치는 요인을 지정하십시오.
1. 헤테로원자의 전기음성도 2. 헤테로원자의 분극화 가능성 3. 라디칼의 성질 4. 해리 능력 5. 물에 대한 용해도 3. 나열된 화합물 중에서 가장 적합한 것을 선택하십시오. 강산브론스테드:
1. 알칸 2. 아민 3. 알코올 4. 티올 5. 카르복실산 4. 염기의 특성을 갖는 유기 화합물의 특성을 나타냅니다.
1. 양성자 수용체 2. 양성자 기증자 3. 해리 시 수산화 이온 제공 4. 해리하지 않음 5. 반응성을 결정하는 기본 특성 5. 주어진 화합물 중에서 가장 약한 염기 선택:
1.암모니아 2.메틸아민 3.페닐아민 4.에틸아민 5.프로필아민답변 기준) 1. 화합물의 부모 구조를 결정합니다.
해결책. 유기 화합물의 구조식에서 부모 구조의 선택은 IUPAC 대체 명명법에서 연속적으로 적용되는 여러 규칙에 의해 규제됩니다(교과서, 1.2.1 참조).
각 후속 규칙은 이전 규칙이 명확한 선택을 허용하지 않는 경우에만 적용됩니다. 화합물 I은 지방족 및 지환족 단편을 포함합니다. 첫 번째 규칙에 따르면 가장 높은 특성 그룹이 직접 연결된 구조가 상위 구조로 선택됩니다. 화합물 I에 존재하는 두 개의 특징적인 그룹(OH 및 NH,) 중에서 하이드록실 그룹이 가장 오래되었습니다. 따라서 시클로헥산의 구조는 이 화합물의 이름인 4-아미노메틸시클로헥산올에 반영된 부모 역할을 할 것입니다.
2. 많은 생물학적으로 중요한 화합물과 약물의 기본은 피리미딘과 이미다졸 핵을 포함하는 퓨린의 축합된 헤테로고리 시스템입니다. 산화에 대한 퓨린의 증가된 저항성을 설명하는 것은 무엇입니까?
해결책. 방향족 화합물높은 공액 에너지와 열역학적 안정성을 가지고 있습니다. 발현 중 하나 방향족 특성"외부"이긴 하지만 내산화성입니다.
방향족 화합물은 높은 학위일반적으로 산화 경향을 유발하는 불포화. 문제의 조건에서 제기된 질문에 대답하려면 퓨린이 방향족 시스템에 속한다는 것을 확립할 필요가 있습니다.
방향족성의 정의에 따르면, 켤레 닫힌 시스템이 나타나는 데 필요한(그러나 충분하지는 않은) 조건은 분자 내에 단일 구조를 갖는 평면 고리형 뼈대가 존재한다는 것입니다. 전자 구름. 퓨린 분자에서 모든 탄소 및 질소 원자는 sp2 혼성화 상태에 있으므로 모든 비결합은 동일한 평면에 있습니다. 이로 인해 주기에 포함된 모든 원자의 오비탈은 -skeleton의 평면에 수직이고 서로 평행하게 위치하여 모든 것을 포괄하는 단일 폐쇄 비편재화 Ti 전자 시스템의 형성과 상호 중첩되는 조건을 만듭니다. 주기의 원자(원형 결합).
방향족도는 또한 -전자의 수에 의해 결정되며, 이는 공식 4/7 + 2에 해당해야 합니다. 여기서 n은 계열입니다. 자연수 O, 1, 2, 3 등(Hückel의 규칙). 위치 1, 3, 7의 각 탄소 원자와 피리딘 질소 원자는 공액 시스템에 하나의 p-전자를 제공하고, 위치 9의 피롤 질소 원자는 비공유 전자쌍을 제공합니다. 퓨린의 공액 시스템은 10개의 전자를 포함하며, 이는 n = 2에서 Hückel 규칙에 해당합니다.
따라서 퓨린 분자는 방향족 특성을 가지며 산화에 대한 저항성은 이와 관련이 있습니다.
퓨린 회로에 이종 원자가 존재하면 α-전자 밀도가 고르지 않게 분포됩니다. 피리딘 질소 원자는 전자 끌기 특성을 나타내고 탄소 원자의 전자 밀도를 감소시킵니다. 이와 관련하여 일반적인 경우 산화 화합물에 의한 전자의 손실로 간주되는 퓨린의 산화는 벤젠에 비해 훨씬 더 어려울 것입니다.
8.3 테스트를 위한 테스트 작업(답변 표준이 포함된 하나의 옵션) 1. 조직 생성 요소의 이름을 지정합니다.
7.Si 8.Fe 9.Cu 2. 파이 결합을 갖는 작용기 지정:
1. 카르복실기 2. 아미노기 3. 수산기 4. 옥소기 5. 카르보닐기 3. 가장 높은 관능기를 나타냄:
1.-С=О 2.-SO3Н 3.-СII 4.-СООН 5.-OH 4. 포도당의 혐기성 분해의 결과 조직에서 젖산 CH3-CHOH-COOH가 형성되는 유기 화합물의 종류는 무엇입니까? ?
1.카르복실산 2.하이드록시산 3.아미노산 4.케토산
CH2-CH-CH-CH-CH-C=O
나는 나는 III 나는
오 오 오 오 오 오
1. 2,3,4,5,6-펜타하이드록시헥산알 2,6-옥소헥산펜탄올 1,2,3,4, 3. 포도당 4. 육탄당 5.1,2,3,4,5-펜타하이드록시헥산알- 6. 특성 표시 복합 시스템의 특징:1. 시그마 결합과 파이 결합의 전자 밀도 정렬 2. 안정성 및 낮은 반응성 3. 불안정성 및 높은 반응성 4. 시그마 결합과 파이 결합이 교대로 포함됨 5. 파이 결합은 -CH2 그룹에 의해 분리됨 7. 어떤 화합물의 Pi-Pi 접합이 일반적입니다.
1. 카로틴 및 비타민 A 2. 피롤 3. 피리딘 4. 포르피린 5. 벤즈피렌
1. 알킬 2.- OH 3.- NH 4.- COOH 5.- SO3H 9. -OH 그룹이 지방족 알코올에 미치는 영향:
1. 양의 유도 2. 음의 유도 3. 양의 중간체 4. 음의 중간체 5. -OH기의 위치에 따라 효과의 종류와 부호가 달라진다 10. 음의 중간체 효과를 갖는 라디칼을 선택한다 1. 할로겐 2. 알킬 라디칼 3. 아미노 그룹 4. 하이드록시 그룹 5. 카르복시기 11. 브뢴스테드-로리 산의 특징을 선택하십시오.
1. 수용액에서 수소 이온의 농도 증가 2. 수용액에서 수산화물 이온의 농도 증가 3. 중성 분자 및 이온 - 양성자 기증자 4. 중성 분자 및 이온 - 양성자 수용체 5. 영향을 미치지 않음 매체의 반응 12. 유기 분자의 산도에 영향을 미치는 요인을 지정하십시오.
1. 헤테로원자의 전기음성도 2. 헤테로원자의 분극화 가능성 3. 라디칼의 성질 4. 해리 능력 5. 물에 대한 용해도 13. 나열된 화합물 중에서 가장 강한 브뢴스테드 산을 선택합니다.
1. 알칸 2. 아민 3. 알코올 4. 티올 5. 카르복실산 14. 염기의 특성을 갖는 유기 화합물의 특성을 나타냅니다.
1. 양성자 수용체 2. 양성자 기증자 3. 해리 시 수산화 이온 제공 4. 해리 안 함 5. 반응성을 결정하는 기본 특성 15. 주어진 화합물 중에서 가장 약한 염기 선택:
1. 암모니아 2. 메틸아민 3. 페닐아민 4. 에틸아민 5. 프로필아민 16. 유기 화합물의 반응을 분류하는 데 사용되는 기호:
1. 화학적 결합 파괴 메커니즘 2. 반응의 최종 결과 3. 전체 공정의 속도를 결정하는 단계에 참여하는 분자 수 4. 결합을 공격하는 시약의 특성 17. 활성 산소종 선택:
1. 일중항 산소 2. 과산화물 디라디칼 -O-O-슈퍼옥사이드 이온 4. 하이드록실 라디칼 5. 삼중항 분자 산소 18. 친전자성 시약의 특징을 선택하십시오.
1. 부분적 또는 완전한 양전하를 갖는 입자 2. 공유 결합의 동종 분해에 의해 형성됨 3. 홀전자를 갖는 입자 4. 부분적 또는 완전한 음전하를 갖는 입자 5. 공유 결합의 이형 분해에 의해 형성 19 .친전자성 치환의 특징적인 반응이 있는 화합물을 선택하십시오.
1.alkenes 2.arenes 3.alkadienes 4.aromatic heterocycles 5.alkanes 20. 자유 라디칼 산화 반응의 생물학적 역할을 나타냅니다.
1. 세포의 식세포 활동 2. 세포막 파괴의 보편적 메커니즘 3. 세포 구조의 자가 재생 4. 많은 병리학적 과정의 발달에 결정적인 역할을 함 21. 친핵성 치환 반응을 특징으로 하는 유기 화합물 부류 선택 :
1. 알코올 2. 아민 3. 탄화수소의 할로겐 유도체 4. 티올 5. 알데하이드 22. 친핵성 치환 반응에서 기질의 반응성은 어떤 순서로 감소합니까?
1. 탄화수소 알코올 아민의 할로겐 유도체 2. 할로겐화 탄화수소의 아민 알코올 3. 알코올 할로겐화 탄화수소의 아민 4. 할로겐화 탄화수소 아민 알코올 23. 다음 화합물에서 다가 알코올을 선택하십시오.
1. 에탄올 2. 에틸렌 글리콜 3. 글리세린 4. 자일리톨 5. 소르비톨 24. 이 반응의 특징을 선택하십시오:
CH3-CH2OH --- CH2 = CH2 + H2O 1. 제거 반응 2. 분자내 탈수 반응 3. 가열 시 무기산 존재하에서 진행 4. 정상 조건에서 진행 5. 분자간 탈수 반응 염소 물질:
1. 마취 특성 2. 최루(눈물) 3. 방부 특성 26. 옥소 화합물에서 SP2-혼성화된 탄소 원자의 반응 특성을 선택하십시오.
1. 친핵성 첨가 2. 친핵성 치환 3. 친전자성 첨가 4. 균일 반응 5. 이종 분해 반응 27. 카르보닐 화합물의 친핵 공격 용이성은 어떤 순서로 감소합니까?
1. 카르복실산의 알데히드 케톤 무수물 에스테르 아미드 염 2. 카르복실산의 케톤 알데히드 무수물 에스테르 아미드 염 3. 카르복실산의 무수물 알데히드 케톤 에스테르 아미드 염 28. 이 반응의 특성을 결정하십시오.
1. 알데하이드에 대한 정성적 반응 2. 알데하이드 - 환원제, 산화은(I) - 산화제 3. 알데하이드 - 산화제, 산화은(I) - 환원제 4. 산화환원 반응 5. 알칼리성 환경에서 진행 6. 특성 of ketones 29 .주어진 카르보닐 화합물 중 바이오제닉 아민의 형성과 함께 탈카르복실화가 일어나는 것은 무엇입니까?
1. 카복실산 2. 아미노산 3. 옥소산 4. 하이드록시산 5. 벤조산 30. 상동 카복실산 계열에서 산 특성이 어떻게 변하는가:
1. 증가하다 2. 감소하다 3. 변하지 않는다
1. 하이드록시산 2. 옥소산 3. 아미노 알코올 4. 아미노산 5. 디카르복실산 32. 하이드록시산에는 다음이 포함됩니다.
1. 구연산 2. 유성 3. 아세토아세트산 4. 피루브산 5. 사과산 33. 선택 의약품 - 살리실산 유도체:
1. 파라세토몰 2. 페나세틴 3. 술폰아미드 4. 아스피린 5. PAS 34. 특정 약물 - p-아미노페놀 유도체:
1. 파라세토몰 2. 페나세틴 3. 술폰아미드 4. 아스피린 5. PAS 35. 특정 약물 - 술파닐산 유도체:
1. 파라세토몰 2. 페나세틴 3. 술폰아미드 4. 아스피린 5. PAS 36. A. M. Butlerov 이론의 주요 조항 선택:
1. 탄소 원자는 단순 결합과 다중 결합으로 연결되어 있습니다. 2. 유기 화합물의 탄소는 4가입니다. 3. 관능기는 물질의 특성을 결정합니다. 4. 탄소 원자는 개방 및 폐쇄 순환을 형성합니다. 5. 유기 화합물에서 탄소는 환원된 형태입니다. 37. 어떤 이성체가 공간적입니까?
1. 사슬 2. 다중 결합의 위치 3. 작용기 4. 구조적 5. 구성 38. "형태" 개념에 대해 전형적인 것을 선택하십시오.
1. 하나 이상의 시그마 결합 주위의 회전 가능성 2. 이성질체의 동형체 3. 결합 순서의 변화 4. 치환기의 공간적 배열의 변화 5. 전자 구조의 변화 39. 거울상이성질체와 부분입체이성질체 사이의 유사성을 선택하십시오:
1. 동일한 물리적 및 화학적 특성을 가짐 2. 빛의 편광면을 회전시킬 수 있음 3. 빛의 편광면을 회전시킬 수 없음 4. 입체이성질체임 5. 키랄 중심의 존재를 특징으로 함 40. 구성 이성질체와 형태 이성질체 사이의 유사성을 선택하십시오.
1. 이성질체 현상은 원자 및 원자 그룹의 공간에서 다른 위치와 관련이 있습니다. 2. 이성질체 현상은 시그마 결합 주위의 원자 또는 원자 그룹의 회전으로 인해 발생합니다. 3. 이성질체 현상은 분자 내 키랄성 중심의 존재로 인해 발생합니다. 4. 이성질체 현상은 파이 결합 평면에 대한 치환기의 다른 배열 때문입니다.
41. 생물학적으로 중요한 헤테로사이클의 일부인 헤테로원자의 이름을 지정하십시오.
1. 질소 2. 인 3. 황 4. 탄소 5. 산소 42. 포르피린의 일부인 5원 헤테로사이클을 나타냅니다.
1. 피롤리딘 2. 이미다졸 3. 피롤 4. 피라졸 5. 푸란 43. 니코틴산의 일부인 헤테로원자 1개를 포함하는 헤테로사이클:
1. 퓨린 2. 피라졸 3. 피롤 4. 피리딘 5. 피리미딘 44. 체내 퓨린 산화의 최종 산물 이름:
1. 하이포크산틴 2. 크산틴 3. 요산 45. 아편 알칼로이드 지정:
1. 스트리키닌 2. 파파베린 4. 모르핀 5. 레세르핀 6. 퀴닌 6. 인체의 전형적인 산화 반응:
1. 탈수소화 2. 산소 첨가 3. 전자 공여 4. 할로겐 첨가 5. 과망간산칼륨, 질산 및 과염소산과의 상호 작용 47. 유기 화합물에서 탄소 원자의 산화 정도를 결정하는 요인:
1. 수소보다 전기 음성도가 더 큰 원소의 원자와 결합한 수 2. 산소 원자와 결합한 수 3. 수소 원자와 결합한 수 48. 1차 원자의 산화 중에 형성되는 화합물 탄소 원자?
1. 1차 알코올 2. 2차 알코올 3. 알데히드 4. 케톤 5. 카르복실산 49. 옥시다제 반응의 특성 결정:
1. 산소가 물로 환원됨 2. 산소가 산화된 분자의 조성에 포함됨 3. 산소는 기질에서 분리된 수소를 산화하는 데 사용됨 4. 반응은 에너지 값을 가짐 5. 반응은 가소성 값 50을 가짐. 다음 중 제안된 기질은 세포에서 더 쉽게 산화되며 그 이유는 무엇입니까?
1. 포도당 2. 지방산 3. 부분적으로 산화된 탄소 원자 포함 4. 완전히 수소화된 탄소 원자 포함 51. 선택 알도스:
1.포도당 2.리보오스 3.과당 4.갈락토오스 5.디옥시리보오스
1. 섬유소 2. 전분 3. 글리코겐 4. 히알루산 5. 자당 53. 자연에서 가장 흔한 단당류를 선택하십시오.
1. 트리오스 2. 테트로오스 3. 오탄당 4. 육탄당 5. 칠당 54. 아미노당 선택:
1. 베타-리보스 2. 글루코사민 3. 갈락토사민 4. 아세틸갈락토사민 5. 데옥시리보스 55. 단당류 산화 제품 선택:
1.glucose-6-phosphate 2.glyconic(aldonic) acid 3.glycuronic(uronic) acid 4.glycosides 5.esters 56.이당류 선택:
1.말토스 2.식이섬유 3.글리코겐 4.수크로스 5.락토스 57. 호모다당류 선택:
1. 전분 2. 셀룰로오스 3. 글리코겐 4. 덱스트란 5. 유당 58. 유당 가수분해 중에 형성되는 단당류 선택:
1.beta-D-galactose 2.alpha-D-glucose 3.alpha-D-fructose 4.alpha-D-galactose 5.alpha-D-deoxyribose 59. 셀룰로오스의 특징을 고르시오.
1.선형의 식물성 다당류 2.구조 단위는 베타-D-포도당 3.정상적인 영양에 필요하며 밸러스트 물질입니다 4.인간의 주요 탄수화물 5.위장관에서 분해되지 않습니다 60.탄수화물의 유도체 선택 무라민의 일부입니다.
1.N-acetylglucosamine 2.N-acetylmuramic acid 3.glucosamine 4.glucuronic acid 5.ribulose-5-phosphate 61.다음에서 올바른 문장을 선택하십시오: 아미노산은...
1. 분자 내에 아미노기와 하이드록시기를 모두 포함하는 화합물 2. 하이드록실기와 카르복실기를 포함하는 화합물 3. 카르복실산의 유도체이며, 카르복실산의 라디칼에서 수소가 아미노기로 대체됨 4. 옥소기와 카르복실기를 포함하는 화합물 분자 5. 하이드록시 그룹과 알데히드 그룹을 포함하는 화합물 62. 아미노산은 어떻게 분류됩니까?
1. 라디칼의 화학적 특성에 따라 2. 물리적 및 화학적 특성에 따라 3. 작용기의 수에 따라 4. 불포화도에 따라 5. 추가 작용기의 성질에 따라 63. 방향족 아미노산을 선택합니다.
1.글리신 2.세린 3.글루타민 4.페닐알라닌 5.메티오닌 64. 산성 특성을 나타내는 아미노산 선택:
1. 류신 2. 트립토판 3. 글리신 4. 글루타민 5. 알라닌 65. 주요 아미노산 선택:
1. 세린 2. 라이신 3. 알라닌 4. 글루타민 5. 트립토판 66. 퓨린 질소 함유 염기 선택:
1. 티민 2. 아데닌 3. 구아닌 4. 우라실 5. 시토신 67. 피리미딘 질소 함유 염기 선택:
1.우라실 2.티민 3.시토신 4.아데닌 5.구아닌 68. 뉴클레오시드의 구성 요소를 선택합니다.
1. 퓨린 질소 염기 2. 피리미딘 질소 염기 3. 리보스 4. 데옥시리보스 5. 인산 69. 뉴클레오타이드의 구조적 구성 요소를 나타냅니다.
1. 퓨린 질소 염기 2. 피리미딘 질소 염기 3. 리보스 4. 데옥시리보스 5. 인산 70. DNA의 구별되는 특징을 명시하십시오:
1. 하나의 폴리뉴클레오티드 사슬에 의해 형성됨 2. 두 개의 폴리뉴클레오티드 사슬에 의해 형성됨 3.리보스 함유 4.데옥시리보스 함유 5.우라실 함유 6.티민 함유 71.비누화 가능한 지질 선택:
1. 중성 지방 2. 트리아실글리세롤 3. 인지질 4. 스핑고미엘린 5. 스테로이드 72. 불포화 지방산 선택:
1. 팔미트산 2. 스테아르산 3. 올레산 4. 리놀레산 5. 아라키돈산 73. 중성 지방의 특징적인 구성을 나타냅니다.
1. 메실알코올 + 팔미트산 2. 글리세린 + 부티르산 3. 스핑고신 + 인산 4. 글리세린 + 고급 카르복시산 + 인산 5. 글리세롤 + 고급 카르복시산 74. 인체에서 인지질이 수행하는 기능을 선택하십시오.
1.규제 2.보호 3.구조 4.에너지 75.당지질 선택:
1.포스파티딜콜린 2.세레브로사이드 3.스핑고미엘린 4.설파타이드 5.강글리오사이드
테스트에 대한 답변
8.4 배달에 필요한 실제 기술 및 작업(전체) 목록 1. 탄소 골격의 구조에 따라 유기 화합물을 분류하는 능력 및 2. 생물학적으로 중요한 물질의 이름 및 이름으로 공식을 작성하는 능력 및 구조식에 따른 의약품.3. 화학적 거동을 결정하기 위해 분자 내 관능기, 산성 및 염기성 중심, 공액 및 방향족 조각을 분리하는 능력 4. 유기 화학 변형의 방향 및 결과를 예측하는 능력 5. 교육, 과학 및 참조를 통한 독립적인 작업 기술 보유 문학; 연구를 수행하고 결론을 도출합니다.
6. 화학 유리 제품 취급 기술 보유.
7. 화학 실험실에서 안전한 작업 기술을 보유하고 부식성, 독성, 휘발성 유기 화합물을 취급하고 버너, 스피릿 램프 및 전기 가열 장치로 작업할 수 있는 능력.
1. 생물유기화학의 주제와 과제 의학 교육의 중요성.
2. 유기 화합물의 원소 구성은 생물학적 과정을 준수하는 이유입니다.
3. 유기 화합물의 분류. 클래스, 일반 공식, 기능 그룹, 개별 대표.
4. 유기 화합물의 명명법. 사소한 이름. 대체 IUPAC 명명법.
5. 주요 기능 그룹. 조상 구조. 대리인. 그룹 선임, 대리인. 관능기 및 치환기의 접두사 및 어미.
6. 유기 화합물 구조의 이론적 기초. AM Butlerov의 이론.
구조식. 구조 이성질체. 사슬과 위치 이성질체.
7. 유기 화합물의 공간 구조. 입체화학 공식.
분자 모델. 입체 화학에서 가장 중요한 개념은 유기 분자의 구성과 형태입니다.
8. 열린 사슬의 형태 - 가려진, 금지된, 경사진. 다양한 형태의 에너지와 반응성.
9. 시클로헥산(안락의자 및 욕조)의 예에 대한 순환 구조. 축 및 적도 연결.
10. 유기 화합물 분자에서 원자의 상호 영향. 그 원인, 발현. 분자의 반응성에 대한 영향.
11. 페어링. 공액 시스템, 공액 연결. 디엔의 파이-파이 컨쥬게이션. 컨쥬게이션 에너지. 복합 시스템의 안정성(비타민 A).
12. 경기장에서 페어링(pi-pi pairing). 방향성. Hückel의 규칙. 벤젠, 나프탈렌, 페난트렌. 벤젠 고리의 반응성.
13. 헤테로사이클에서의 접합(피롤 및 피리딘의 예에 대한 p-pi 및 pi-pi 접합).
헤테로사이클의 안정성 - 테트라피롤 화합물의 예에 대한 생물학적 중요성.
14. 채권의 양극화. 그 원인. 알코올, 페놀, 카르보닐 화합물, 티올의 분극. 분자의 반응성에 대한 영향 15. 전자적 효과. 시그마 결합을 포함하는 분자의 유도 효과. 유도 효과 기호.
16. 부타디엔-1,3의 예에 대한 공액 파이 결합이 있는 열린 사슬의 메소머 효과.
17. 방향족 화합물의 메소머 효과.
18. 전자 공여체 및 전자 수용체 치환기.
19. 1종 및 2종의 대리인. 벤젠 고리의 방향 규칙.
20. 유기 화합물의 산도 및 염기도. Brendsteth-Lowry의 산과 염기.
산-염기 쌍은 짝산과 염기입니다. Ka 및 pKa - 유기 화합물 산도의 정량적 특성. 유기 분자의 기능적 활성에 대한 산도 값.
21. 다양한 종류의 유기 화합물의 산도. 유기 화합물의 산도를 결정하는 요인은 수소와 결합된 비금속 원자의 전기음성도, 비금속 원자의 분극화 가능성, 비금속 원자와 결합된 라디칼의 성질입니다.
22. 유기 염기. 아민. 기본 이유. 지방족 및 방향족 아민의 염기성에 대한 라디칼의 영향.
23. 메커니즘에 따른 유기 화합물의 반응 분류. Homolytic 및 heterolytic 반응의 개념.
24. 알칸의 라디칼 유형별 치환 반응. 살아있는 유기체의 자유 라디칼 산화. 활성 양식산소.
25. 알켄의 친전자성 첨가. Pi-복합체, 카보양이온의 형성. 수화 반응, 수소화 반응.
26. 방향족 핵의 친전자성 치환. 중간 시그마 복합체의 형성. 벤젠 브롬화 반응.
27. 알코올의 친핵성 치환. 탈수 반응, 1차 및 2차 알코올의 산화, 에스테르 형성.
28. 카르보닐 화합물의 친핵성 첨가. 알데히드의 생물학적으로 중요한 반응: 산화, 알코올과 상호 작용할 때 헤미아세탈 형성.
29. 카르복실산의 친핵성 치환. 카르복실산의 생물학적으로 중요한 반응.
30. 유기 화합물의 산화, 생물학적 중요성. 유기 분자에서 탄소의 산화 상태. 다양한 종류의 유기 화합물의 산화성.
31. 에너지 산화. 산화 효소 반응.
32. 비에너지 산화. 옥시게나제 반응.
33. 식세포의 살균 작용에서 자유 라디칼 산화의 역할.
34. 유기화합물의 회수. 생물학적 중요성.
35. 다관능성 화합물. 다가 알코올 - 에틸렌 글리콜, 글리세린, 자일리톨, 소르비톨, 이노시톨. 생물학적 중요성. 글리세롤의 생물학적으로 중요한 반응은 산화, 에스테르 형성입니다.
36. 이염기성 디카르복실산: 옥살산, 말론산, 숙신산, 글루타르산.
숙신산에서 푸마르산으로의 전환은 생물학적 탈수소화의 한 예입니다.
37. 아민. 분류:
라디칼의 성질(지방족 및 방향족); -카운트 중라디칼(1차, 2차, 3차, 4차 암모늄 염기); - 아미노 그룹(모노- 및 디아민-)의 수에 따라. 디아민: 푸트레신 및 카다베린.
38. 헤테로기능성 화합물. 정의. 예. 화학적 특성 발현의 특징.
39. 아미노 알코올: 에탄올아민, 콜린, 아세틸콜린. 생물학적 중요성.
40. 하이드록시산. 정의. 일반 공식. 분류. 명명법. 이성질체.
모노카르복실산 하이드록시산의 대표: 락트산, 베타-하이드록시부티르산, 감마-하이드록시부티르산;
디카르복실산: 사과, 포도주; 트리카르복실산: 레몬; 방향족: 살리실산.
41. 하이드록시 산의 화학적 특성: 카복실, 수산기, 알파, 베타 및 감마 이성질체의 탈수 반응, 반응 생성물(락타이드, 불포화산, 락톤)의 차이.
42. 입체이성질체. 거울상이성질체 및 부분입체이성질체. 광학 이성질체의 원인으로서 유기 화합물 분자의 키랄성.
43. 하나의 키랄성 중심을 갖는 거울상 이성질체(락트산). 거울상 이성질체의 절대 및 상대 구성. 옥시산 키. D 및 L 글리세르알데히드. D 및 L 이성질체.
경주자.
44. 키랄 중심이 여러 개인 거울상 이성질체. 타르타르산 및 메소타르타르산.
45. 입체이성질체와 입체이성질체의 생물학적 활성
46. 푸마르산 및 말레산의 예에 대한 시스-및 트랜스-이성질체.
47. 옥소산. 정의. 생물학적으로 중요한 대표자: pyruvic, acetoacetic, oxaloacetic. 피루브산의 예에 대한 Ketoenol tautomerism.
48. 아미노산. 정의. 일반 공식. 아미노 그룹 위치 이성질체(알파, 베타, 감마). 알파 아미노산의 생물학적 중요성. 베타, 감마 및 기타 이성질체(베타아미노프로피온산, 감마아미노부티르산, 엡실론아미노카프로산)의 대표. 사이클릭 락톤을 형성하는 감마 이성질체의 탈수 반응.
49. 의약품의 기초가 되는 벤젠의 이종 기능성 유도체. p-아미노벤조산의 유도체 - PABA(엽산, 아네스테진). sulfanilic acid의 PABA 유도체(sulfonamides - streptocide)의 길항제.
50. 벤젠의 이종 기능성 유도체 - 의약품. 라미노페놀 유도체(파라세타몰), 살리실산 유도체(아세틸살리실산). 라미노살리실산 - PASK.
51. 생물학적으로 중요한 헤테로사이클. 정의. 분류. 구조 및 특성의 특징: 접합, 방향성, 안정성, 반응성. 생물학적 중요성.
52. 하나의 이종원자를 갖는 5원 헤테로사이클 및 그 파생물. 피롤(포르핀, 포르피린, 헴), 푸란(약물), 티오펜(비오틴).
53. 2개의 이종원자를 갖는 5원 헤테로사이클 및 그 파생물. 피라졸(5옥소 유도체), 이미다졸(히스티딘), 티아졸(비타민 B1-티아민).
54. 하나의 이종원자를 갖는 6원 헤테로사이클 및 그 파생물. 피리딘(니코틴산 - 산화환원 반응 참여, 비타민 B6-피리독살), 퀴놀린(5-NOC), 이소퀴놀린(알칼로이드).
55. 2개의 헤테로원자를 갖는 6원 헤테로사이클. 피리미딘(시토신, 우라실, 티민).
56. 융합 헤테로사이클. 퓨린(아데닌, 구아닌). 퓨린 산화 생성물 하이포크산틴, 크산틴, 요산).
57. 알칼로이드. 정의 및 일반적 특성. 니코틴과 카페인의 구조.
58. 탄수화물. 정의. 분류. 살아있는 유기체에서 탄수화물의 기능.
59. 단당. 정의. 분류. 대표자.
60. 펜토스. 대표 - 리보스 및 디옥시리보스. 구조, 개방형 및 순환식. 생물학적 중요성.
61. 헥소스. 알도스와 케토스. 대표자.
62. 단당류의 공식을 엽니다. 입체화학적 구성의 결정. 단당류 구성의 생물학적 중요성.
63. 순환 형태의 단당류 형성. 글리코시드 하이드록실. 알파 및 베타 아노머. 하워스 공식.
64. 단당류의 유도체. 인산 에스테르, 글리코닉산 및 글리쿠론산, 아미노당 및 이들의 아세틸 유도체.
65. 맥아당. 구성, 구조, 가수분해 및 중요성.
66. 유당. 동의어. 구성, 구조, 가수분해 및 중요성.
67. 자당. 동의어. 구성, 구조, 가수분해 및 중요성.
68. 동종다당류. 대표자. 전분, 구조, 특성, 가수분해 생성물, 가치.
69. 글리코겐. 동물의 몸에서 구조, 역할.
70. 섬유. 구조, 식물에서의 역할, 인간에 대한 중요성.
72. 헤테로다당류. 동의어. 기능. 대표자. 구조적 특징 - 이합체 단위, 구성. 1,3- 및 1,4-글리코시드 결합.
73. 히알루론산. 신체의 구성, 구조, 속성, 중요성.
74. 황산 콘드로이틴. 신체의 구성, 구조, 중요성.
75.무라민. 구성, 가치.
76. 알파 아미노산. 정의. 일반 공식. 명명법. 분류. 개인 대표. 입체이성질체.
77. 알파-아미노산의 화학적 성질. 양쪽성, 탈카르복실화, 탈아미노화 반응, 라디칼의 하이드록실화, 펩타이드 결합의 형성.
78. 펩티드. 개별 펩타이드. 생물학적 역할.
79. 단백질. 단백질 기능. 구조 수준.
80. 핵산의 질소 염기 - 퓨린과 피리미딘. 수정된 질소 염기 - 항대사물질(플루오로우라실, 메르캅토퓨린).
81. 뉴클레오사이드. 뉴클레오사이드 항생제. 뉴클레오티드. 핵산 및 자유 뉴클레오티드 구성의 모노뉴클레오티드는 조효소입니다.
82. 핵산. DNA와 RNA. 생물학적 중요성. 모노뉴클레오티드 사이의 포스포다이에스터 결합의 형성. 핵산의 구조 수준.
83. 지질. 정의. 생물학적 역할. 분류.
84. 고급 카르복실산 - 포화(팔미트산, 스테아르산) 및 불포화산(올레산, 리놀레산, 리놀렌산 및 아라키돈산).
85. 중성 지방 - 아실글리세롤. 구조, 의미. 동물성 및 식물성 지방.
지방 가수 분해 - 제품, 중요성. 식물성 기름, 인공 지방의 수소화.
86. 글리세로인지질 구조: 인산 및 질소 염기.
포스파티딜콜린.
87. 스핑고지질. 구조. 스핑고신. 스핑고미엘린.
88. 스테로이드. 콜레스테롤 - 구조, 의미, 유도체: 담즙산 및 스테로이드 호르몬.
89. 테르펜 및 테르페노이드. 구조 및 생물학적 중요성. 대표자.
90. 지용성 비타민. 일반적 특성.
91. 마취 수단. 디 에틸 에테르. 클로로포름. 의미.
92. 대사 과정의 약물 자극제.
93. 술폰아미드, 구조, 의미. 백색 연쇄상 구균.
94. 항생제.
95. 항염증제 및 해열제. 구조. 의미.
96. 항산화제. 특성. 의미.
96. 티올. 해독제.
97. 항응고제. 특성. 의미.
98. 바르비투르산염. 특성.
99. 진통제. 의미. 예. 아세틸살리실산(아스피린).
100. 방부제. 의미. 예. 푸라실린. 특성. 의미.
101. 항바이러스제.
102. 이뇨제.
103. 비경 구 영양 수단.
104. PABC, PASK. 구조. 특성. 의미.
105. 요오도포름. 제로폼.밸류.
106. 폴리글루신. 특성. 의미 107.포르말린. 특성. 의미.
108. 자일리톨, 소르비톨. 구조, 의미.
109. 레조르시놀. 구조, 의미.
110. 아트로핀. 의미.
111. 카페인. 구조. 의미 113. 푸라실린. 푸라졸리돈. 기능.값.
114. GABA, GOBA, 숙신산.. 구조. 의미.
115. 니코틴산. 구조, 의미
| 2009년에는 사하 공화국(야쿠티아) 전략 연구 센터가 조직한 국제적인 참여로 사하 공화국(야쿠티아)의 노동 시장 규제 메커니즘 개선에 관한 세미나가 열렸습니다. 세미나에는 주요 외국 과학 기관 대표들이 참석했으며, 러시아 연방, 극동 연방 ... " “노보시비르스크 주립 수상 운송 아카데미 규율: F.02, F.03 재료 과학. 구조 재료 기술 전문 분야의 작업 프로그램: 180400 산업 설비 및 기술 단지의 전기 구동 및 자동화 및 240600 선박 전기 장비 및 자동화 운영 Novosibirsk 2001 작업 프로그램부교수 S.V. 국가에 기초한 Gorelov 교육 수준더 높은 전문가 ... " «러시아 주립 석유 및 가스 대학 I.M. Gubkina 연구 부총장 승인 Prof. AV Muradov 2014년 3월 31일 프로그램 입학 시험방향 15.06.01 - I.M.의 이름을 딴 러시아 주립 석유 가스 대학 대학원생을위한 기계 공학. 2014/2015 학년도의 Gubkin 2014 년 모스크바 15.06.01 기계 공학 방향의 입학 시험 프로그램은 과학 전문 여권 (05.02.04, ... " "부록 5A: 정신 발달 심리학의 특수 분야 작업 프로그램 연방 주 예산 고등 전문 교육 기관 PYATIGORSK STATE LINGUISTIC UNIVERSITY Zavrumov _2012 전문 대학원 연구 19.00.07 과학의 교육학 심리학 분과: 19.00.00 심리학과 ... " "KBR 주립 중등 직업 교육 기관 Kabardino-Balkarian 자동차 및 도로 대학의 교육 과학부 Abregov 2013 숙련공, 직업별 직원을 위한 교육 프로그램 190631.01.01 Auto mechanic Qualification Automotive mechanic. 자동차 운전자, 주유소 운영자 교육 형태 - 정규직 Nalchik, 2013 CONTENTS 1. CHARACTERISTICS ... " « "Medical Scientific Center" 합작 투자(Novgorod)에서 수행된 장기의 혈액 공급 메커니즘에 대한 전통적인 관점을 기반으로 하는 허혈성 심장 질환 수학적 모델의 본질을 설명합니다. 통계에 따르면 관상동맥심장질환(CHD)은 현재 발병률 1위… “러시아 교통부 연방 철도 운송 기관 연방 주 예산 고등 전문 교육 기관 IRKUTSK STATE 통신 대학 IrGUPS (IrIIT) I APPROVE Dean EMF Pykhalov A.A. 2011년 인턴십 프로그램 C5. 피 인턴쉽, 3 코스. 특수 190300.65 철도 차량 철도전문화 PSG.2 캐리지 대학원 자격...» "러시아 연방 교육 과학부 Tverskaya 고등 전문 교육의 연방 주 예산 교육 기관 주립대학교물리학 및 기술 학부 일반 물리학과 승인 물리학 및 기술 학부 학장 B.B. Pedko 2012 3학년 학생들을 위한 원자핵 및 기본 입자의 규율 물리학 작업 프로그램 풀 타임교육 방향 222000.62 - 혁신, 프로필 혁신 관리(산업 및 영역별 ... " "고등 전문 교육 VORONEZH 주립 대학 (GOU VPO VSU)의 러시아 주립 교육 기관의 교육 과학부 노동법 부서장 Perederin S.V. 2011년 1월 21일 교육 분야 작업 프로그램 B 3.B.13 토지법 1. 교육/전문 방향의 코드 및 이름: 030900 법학 2. 교육/전문 프로필: 법학_ 3. 자격(학위) 졸업생: 법학사_ 4. 형식 .. ." “작업 프로그램은 고등 전문 교육을 위한 연방 주 교육 표준을 기반으로 작성되었으며 대략적인 기본 권장 사항을 고려했습니다. 교육 프로그램전문가 교육 130400.65 채광, 전문화 130400.65.10 채광 전기화 및 자동화. 1. 훈련을 마스터하는 목적 “목차 I. 해설 3 II. 2013년 전략 개발 프로그램 III의 6 시행 중 얻은 주요 결과. 부록 2 I. 설명 노트 대학의 전략 개발 프로그램의 목표와 목표는 프로그램 전체 기간 동안 변경되지 않고 매년 시행되는 해마다 점진적으로 달성되어 주석 프로그램의 부록에 설정된 지표의 달성을 보장합니다. . 목표 1 선진 교육기술 개발 과제...» "러시아 연방 교육 과학부 러시아 연방 교육청 블라디보스토크 주립 경제 서비스 대학교 _ 정치 철학 교육 프로그램전문 과정 03020165 정치학 블라디보스토크 VGUES Publishing House 2008 LBC 66.2 정치 철학 분야의 커리큘럼은 러시아 연방 고등 전문 교육의 국가 교육 표준 요구 사항에 따라 편집됩니다. 과정의 주제는 복잡한 사회 현상으로서의 정치, 그 가치와 목표, 기술 및 ...» «품질 시스템 전문 분야의 후보자 시험 프로그램 p. 2 of 5 05.16.04 FOUNDRY 전문 분야의 응시자 시험 문제는 전문 분야의 응시자 시험 프로그램에 따라 작성됩니다. 05.16.04 Foundry, 러시아 교육 과학부 명령에 의해 승인됨 아니요 2007년 10월 8일자 274. 1 질문 목록 1. 기계 공학에 사용되는 주조 합금의 분류. 합금의 주요 매개변수: 녹는점, ... " "대학 직원 V. V. Malkov 프로토콜 번호 _ 2013의 GAOU MO SPO MKETI 노동 이사 승인 회의에서 검토 및 채택 from_ 장기 목표 프로그램 2013-2015 Murmansk에 대한 Murmansk 경제 및 정보 기술 대학 개발 2013 2 1. 대학 개발 프로그램 여권. 이름 장기 목표 프로그램 2013년 경제 정보 기술 대학의 무르만스크 프로그램 개발(이하 프로그램이라고 함) 러시아 연방 법률의 근거 ... " "러시아 연방 교육 과학부 고등 전문 교육 모스크바 주립 산림 대학교 임업 보호 및 기계화 학부 및 l / s 작업 인공 ... " “UMR VV Krinitsin _2007의 부총장이 승인한 민간 항공 모스크바 주립 기술 대학교 민간 항공 연방 기관. 열역학 및 열 전달, SD.04(GOS에 따른 이름, 코드) Specialty 160901 Technical operation 항공기및 엔진 (국가 교육 표준에 따른 암호) 교수진 - 기계 부서 - 항공기 엔진 코스 - 3 연구 형태 - 풀 타임 학기 총 교육 시간 ... " "MC45 b 사용 설명서 MC45 사용 설명서 72E-164159-01EN Rev. B 2013년 1월 ii MC45 사용 설명서 이 출판물의 어떠한 부분도 Motorola의 서면 승인 없이는 어떤 형태나 전기적 또는 기계적 수단으로도 복제하거나 사용할 수 없습니다. 여기에는 사진 복사 또는 녹음을 수행하는 전자적 또는 기계적 수단은 물론 정보 저장 장치 및 검색 엔진이 포함됩니다 ... " “작업 프로그램은 다음을 기반으로 개발되었습니다. 1. 2000년 4월 5일에 승인된 학사 560800 농업 공학 교육 방향으로 고등 전문 교육의 연방 주 교육 표준(등록 번호 313 s/탱크). 2. 2001년 6월 27일에 승인된 기계 이론의 기본 분야의 모범적인 프로그램. 3. 22.04.13, No. 4에 대학 학술 위원회에서 승인한 작업 커리큘럼. 지도 교사: Ablikov V.A., 교수 _ Ablikov 16.06.13 교사: Ablikov V.A., 교수 _ Ablikov 16.06.13 Sokht K.A., 교수 _...» “러시아 연방 농업부 연방 주 예산 고등 전문 교육 기관 Moscow State Agroengineering University는 V.P. Goryachkina 기계 수리 및 신뢰성 부서 승인자: 통신 교육 학부 학장 P.A. Silaichev "_" _ 2013 작업 프로그램 전문 190601 - 자동차 및 자동차 산업 전문 653300 - 지상 운송 과정 6 학기 운영 ... " |
화학- 구조의 과학, 물질의 속성, 변형 및 동반 현상.
작업:
1. 물질 구조 연구, 분자 및 물질의 구조 및 특성 이론 개발. 물질의 구조와 다양한 특성 사이의 연관성을 확립하고 이를 바탕으로 물질의 반응성 이론, 동역학 및 메커니즘을 구축하는 것이 중요합니다. 화학 반응및 촉매 이벤트.
2. 원하는 특성을 가진 새로운 물질의 지시 합성 구현. 이미 알려져 있고 상업적으로 중요한 화합물의 보다 효율적인 합성을 위한 새로운 반응 및 촉매를 찾는 것도 여기서 중요합니다.
3. 화학의 전통적인 문제는 특별한 의미를 갖게 되었습니다. 그것은 화학적 대상 및 연구된 특성의 수의 증가와 인간이 자연에 미치는 영향의 결과를 결정하고 줄여야 할 필요성과 관련이 있습니다.
화학은 일반적인 이론 분야입니다. 한 물질을 다른 물질로 변형시키는 방법, 메커니즘 및 방법에 대해 움직이는 물질의 한 유형으로서 물질에 대한 현대 과학적인 이해를 학생들에게 제공하도록 고안되었습니다. 기본 화학 법칙에 대한 지식, 화학 계산 기술에 대한 지식, 개별 및 좁은 영역에서 작업하는 다른 전문가의 도움으로 화학이 제공하는 기회에 대한 이해는 다양한 공학 분야에서 원하는 결과를 크게 가속화하고 과학적 활동.
화학산업은 우리 나라에서 가장 중요한 산업 중 하나입니다. 그것에 의해 생성되는 화합물, 다양한 구성 및 재료는 기계 공학, 야금, 농업, 건설, 전기 및 전자 산업, 통신, 운송, 우주 기술, 의학, 일상 생활 등 현대 화학 산업 발전의 주요 방향은 새로운 화합물 및 재료의 생산과 기존 산업의 효율성 향상입니다.
의과대학에서는 일반화학, 생물유기화학, 생화학, 임상생화학을 공부합니다. 연속성 및 상호 연결성에서 화학 과학의 복잡성에 대한 학생들의 지식은 연구 및 실용다양한 현상, 속성 및 패턴은 성격 개발에 기여합니다.
의과 대학에서 화학 분야 연구의 특정 기능은 다음과 같습니다.
화학 및 의학 교육의 목표 간의 상호 의존성;
이 과정의 보편성과 근본적인 성격;
의사 교육의 성격과 일반적인 목표 및 전문 분야에 따라 콘텐츠 구축 기능;
다양한 형태의 공개와 함께 미시적 및 거시적 수준에서 화학적 대상에 대한 연구의 통일성 화학 조직자연, 환경 및 조건에 따라 단일 시스템 및 다양한 기능 (화학적, 생물학적, 생화학 적, 생리적 등)으로 나타납니다.
합성 물질의 생성에서 화학의 무한한 가능성과 의학에서의 중요성으로 인해 "사회-자연-생산-인간"시스템에서 의료를 포함한 실제 및 실습과 화학 지식 및 기술의 연결에 대한 의존성, 나노화학 개발, 환경 문제 해결 등 글로벌 문제인류.
1. 신체의 대사 과정과 에너지 과정의 관계
지구상의 생명 과정은 주로 단백질, 지방, 탄수화물과 같은 생물 물질에 태양 에너지가 축적되고 에너지 방출과 함께 살아있는 유기체에서 이러한 물질이 변형되기 때문입니다. 신체의 화학적 변형과 에너지 과정 사이의 관계에 대한 특히 명확한 이해는 이후에 실현되었습니다. A. Lavoisier(1743-1794)와 P. Laplace(1749-1827)의 작품.그들은 직접적인 열량 측정을 통해 삶의 과정에서 방출되는 에너지가 동물이 흡입하는 대기 산소에 의한 식품의 산화에 의해 결정된다는 것을 보여주었습니다.
신진 대사 및 에너지 - 살아있는 유기체에서 발생하는 물질 및 에너지의 변형 과정과 신체와 환경 간의 물질 및 에너지 교환 과정. 물질과 에너지의 대사는 유기체의 중요한 활동의 기초이며 생물과 무생물을 구별하는 생물의 가장 중요한 특징 중 하나입니다. 다양한 수준에서 가장 복잡한 조절에 의해 제공되는 신진 대사 또는 신진 대사에는 많은 효소 시스템이 관련됩니다. 신진대사 과정에서 몸에 들어간 물질은 조직의 자체 물질로 변환되어 몸에서 배설되는 최종 제품입니다. 이러한 변환 중에 에너지가 방출되고 흡수됩니다.
XIX-XX 세기의 발전과 함께. 열역학 - 열과 에너지의 상호 변환 과학 - 생화학 반응에서 에너지 변환을 정량적으로 계산하고 그 방향을 예측할 수 있게 되었습니다.
에너지 교환은 열을 전달하거나 작업을 수행하여 수행할 수 있습니다. 그러나 살아있는 유기체는 환경과 평형 상태에 있지 않으므로 비평형 개방계라고 할 수 있습니다. 그럼에도 불구하고 일정 기간 동안 관찰하면 유기체의 화학적 조성에 눈에 띄는 변화가 일어나지 않습니다. 하지만 그게 의미하는 건 아니야 화학 물질, 몸을 구성하는 어떤 변형도 겪지 마십시오. 반대로, 그들은 지속적이고 다소 집중적으로 재생되며, 이는 더 간단한 전구체 물질의 일부로 세포에 도입된 안정한 동위원소 및 방사성 핵종의 체내 복합 물질로의 통합 속도로 판단할 수 있습니다.
물질 교환과 에너지 교환 사이에 하나가 있습니다. 근본적인 차이. 지구는 상당한 양의 물질을 잃거나 얻지 않습니다. 생물권의 물질은 닫힌 주기로 교환됩니다. 반복적으로 사용됩니다. 에너지 교환은 다르게 수행됩니다. 닫힌 주기로 순환하지 않고 부분적으로 우주 공간으로 소산됩니다. 따라서 지구에서 생명을 유지하기 위해서는 지속적인 태양 에너지 유입이 필요합니다. 광합성 과정에서 1년 동안 지구본약 10 21 흡수 대변태양 에너지. 태양 전체 에너지의 0.02%에 불과하지만 인간의 손으로 만든 모든 기계가 사용하는 에너지보다 훨씬 많다. 순환에 참여하는 물질의 양도 그만큼 많습니다.
2. 생물 에너지학의 이론적 기초로서의 화학 열역학. 화학열역학의 주제와 방법
화학 열역학화학 에너지가 열, 전기 등 다른 형태로 전환되는 것을 연구하여 이러한 전환의 정량적 법칙과 주어진 조건에서 화학 반응의 자발적 발생 방향과 한계를 설정합니다.
열역학적 방법은 "시스템", "시스템 상태", " 내부 에너지시스템", "시스템 상태 기능".
물체열역학 공부는 시스템이다
동일한 시스템이 다른 상태에 있을 수 있습니다. 시스템의 각 상태는 열역학 매개변수의 특정 값 세트로 특징지어집니다. 열역학적 매개변수에는 온도, 압력, 밀도, 농도 등이 포함됩니다. 적어도 하나의 열역학적 매개변수가 변경되면 시스템 전체의 상태가 변경됩니다. 시스템의 열역학적 상태는 시스템의 모든 지점에서 열역학적 매개변수의 불변성을 특징으로 하고 (작업 비용 없이) 자발적으로 변경되지 않는 경우 평형 상태라고 합니다.
화학 열역학은 두 가지 평형 상태(최종 및 초기)에 있는 시스템을 연구하고 이를 바탕으로 지정된 방향으로 주어진 조건 하에서 프로세스의 자발적 흐름의 가능성(또는 불가능)을 결정합니다.
열역학 연구열과 일의 형태로 신체 사이의 에너지 전달과 관련된 다양한 유형의 에너지의 상호 변환. 열역학은 열역학 제1법칙과 제2법칙이라는 두 가지 기본 법칙을 기반으로 합니다. 연구 주제열역학에서 에너지는 화학 반응, 용해, 증발, 결정화 과정에서 에너지 형태의 상호 변환 법칙입니다.
화학 열역학은 열역학 방법으로 물질의 상호 작용 과정을 연구하는 물리 화학의 한 분야입니다.
화학 열역학의 주요 영역은 다음과 같습니다.
고전 화학 열역학, 일반적으로 열역학적 평형을 연구합니다.
화학 반응에 수반되는 열 효과를 연구하는 열화학.
분자 구조의 개념과 분자간 상호 작용에 대한 데이터를 기반으로 물질의 열역학적 특성을 모델링하는 솔루션 이론.
화학 열역학은 다음과 같은 화학 분야와 밀접한 관련이 있습니다. 분석 화학; 전기화학; 콜로이드 화학; 흡착 및 크로마토그래피.
화학 열역학의 발전은 열화학과 열역학의 두 가지 방식으로 동시에 진행되었습니다.
독립 과학으로서의 열화학의 출현은 화학 반응의 열적 영향 - Hess의 법칙 사이의 관계에 대한 St. Petersburg University의 교수 인 Herman Ivanovich Hess의 발견으로 간주되어야합니다.
3. 열역학 시스템: 고립, 폐쇄, 개방, 균질, 이질. 단계의 개념입니다.
체계- 정신적으로 또는 실제로 환경(시험관, 오토클레이브)과 격리된 일련의 상호작용 물질입니다.
화학 열역학은 한 상태에서 다른 상태로의 전이를 고려하는 반면 일부는 옵션:
· 등압- 일정한 압력에서;
· isochoric- 일정한 양으로;
· 등온- 일정한 온도에서;
· 등압 - 등온– 일정한 압력과 온도 등에서
열역학적 특성시스템은 여러 측면에서 표현될 수 있습니다. 시스템 상태 기능~라고 불리는 특성 함수: 내부에너지U , 엔탈피 시간 , 엔트로피 에스 , 깁스 에너지 G , 헬름홀츠 에너지 에프 . 특성 기능에는 한 가지 기능이 있습니다. 시스템의 주어진 상태를 달성하는 방법(경로)에 의존하지 않습니다. 그 값은 시스템의 매개변수(압력, 온도 등)에 의해 결정되며 물질의 양 또는 질량에 따라 달라지므로 물질 1몰을 참조하는 것이 일반적입니다.
에너지, 물질, 정보 전달 방식에 따라고려 중인 시스템과 환경 사이에서 열역학 시스템은 다음과 같이 분류됩니다.
1. 폐쇄형(격리형) 시스템- 에너지, 물질(방사선 포함) 또는 정보의 외부 기관과의 교환이 없는 시스템입니다.
2. 폐쇄 시스템- 에너지로만 교환되는 시스템.
3. 단열적으로 격리된 시스템 -열의 형태로만 에너지가 교환되는 시스템입니다.
4. 개방형 시스템에너지, 물질 및 정보를 교환하는 시스템입니다.
시스템 분류:
1) 가능한 경우 열 및 물질 전달: 격리, 폐쇄, 개방. 고립계는 환경과 물질이나 에너지를 교환하지 않습니다. 폐쇄계는 환경과 에너지를 교환하지만 물질은 교환하지 않습니다. 개방형 시스템은 물질과 에너지를 환경과 교환합니다. 고립계의 개념은 물리화학에서 이론적인 것으로 사용된다.
2) 내부 구조 및 특성에 따라: 균질 및 이질. 내부에 시스템을 속성이 다른 부분으로 나누는 표면이 없는 경우 시스템을 균질이라고 합니다. 화학적 구성 요소. 균질 시스템의 예는 산, 염기, 염의 수용액; 가스 혼합물; 개별 순수 물질. 이기종 시스템은 자체적으로 자연 표면을 포함합니다. 이종 시스템의 예로는 금속과 산, 기체와 고체, 서로 불용성인 두 액체 등 응집 상태가 다른 물질로 구성된 시스템이 있습니다.
단계- 이것은 시스템의 속성이 갑자기 변하는 표면에 의해 시스템의 다른 부분과 분리되는 동일한 구성, 물리적 및 화학적 특성을 갖는 이종 시스템의 균질 부분입니다. 상은 고체, 액체 및 기체입니다. 동종 시스템은 항상 한 단계로 구성되고 이기종 시스템은 여러 단계로 구성됩니다. 위상 수에 따라 시스템은 단상, 2상, 3상 등으로 분류됩니다.
5. 열역학 제1법칙. 내부 에너지. 등압 및 등압 열 효과 .
열역학 제1법칙- 열역학의 세 가지 기본 법칙 중 하나는 열역학 시스템의 에너지 보존 법칙입니다.
열역학 제1법칙은 독일 과학자 J.R. Mayer, 영국 물리학자 J.P. Joule, 독일 물리학자 G. Helmholtz의 연구 결과로 19세기 중반에 공식화되었습니다.
열역학 제1법칙에 따르면 열역학 시스템은 내부 에너지 또는 외부 에너지원에 의해서만 작동 .
열역학 제1법칙은 어떤 원천으로부터 에너지를 끌어오지 않고 일을 하는 제1종 영구 운동 기계의 존재 불가능성으로 공식화되는 경우가 많습니다. 일정한 온도에서 일어나는 과정을 등온, 일정한 압력에서 - 등압, 일정한 볼륨에서 - isochoric.공정 중에 환경과의 열 교환이 배제되는 방식으로 시스템이 외부 환경과 격리되어 있는 경우 이 공정을 공정이라고 합니다. 단열.
시스템의 내부 에너지.시스템이 한 상태에서 다른 상태로 전환되는 동안 일부 속성, 특히 내부 에너지가 변경됩니다. 유.
시스템의 내부 에너지는 분자, 원자, 원자핵그리고 전자. 내부 에너지에는 병진, 회전 및 진동 운동, 분자, 원자 및 아 원자 입자 사이에 작용하는 인력 및 반발력으로 인한 위치 에너지. 그것은 공간에서 시스템 위치의 위치 에너지를 포함하지 않으며 운동 에너지시스템 전체의 움직임.
내부 에너지는 시스템 상태의 열역학적 함수입니다. 이것은 시스템이 주어진 상태에 있을 때마다 내부 에너지가 이 상태에 고유한 특정 값을 취함을 의미합니다.
∆U \u003d U 2-U 1
여기서 U 1 및 U 2 - 시스템의 내부 에너지 안에최종 및 초기 상태 c, 각각.
열역학 제1법칙.계가 열에너지 Q와 역학적 에너지(일) A를 외부 환경과 교환함과 동시에 상태 1에서 상태 2로 넘어가면 열의 계가 방출하거나 흡수하는 에너지의 양은 Q나 일을 형성한다. A는 한 상태에서 다른 상태로 전환될 때 시스템의 총 에너지와 동일하며 기록됩니다.