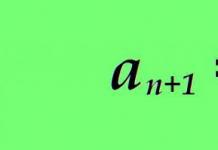03. Structura moleculei proteice (primar, secundar, terțiar, cuaternar). Tipuri de linkuri. Relația dintre structură și funcție
Fiecare proteină este caracterizată secvență specifică de aminoacizi și structură spațială individuală (conformație). Proteinele reprezintă cel puțin 50% din masa uscată a compușilor organici dintr-o celulă animală. În corpul uman, există până la 5 milioane de tipuri diferite de proteine. molecula proteica poate consta din unul sau mai multe lanțuri care conțin de la cincizeci până la câteva sute de resturi de aminoacizi. Moleculele care conțin mai puțin de cincizeci de reziduuri sunt clasificate ca peptide. Multe molecule conțin reziduuri de cisteină ale căror legături disulfurice leagă covalent porțiuni ale unuia sau mai multor lanțuri. LA stat nativ macromoleculele proteice au o conformaţie specifică. Caracteristica conformației unei proteine date este determinată de:
- secvența de resturi de aminoacizi și este stabilizată prin legături de hidrogen între peptidă și grupările laterale ale resturilor de aminoacizi,
- interacțiuni electrostatice și hidrofobe.
Structura primară a unei proteine. O legătură peptidică se formează atunci când reacții ale grupei amino a unui aminoacid și ale grupării carboxil a altuia cu eliberarea unei molecule de apă:
CH3-CH(NH2)-COOH + CH3-CH(NH2)-COOH ^ CH3-CH(NH2)-CO- NH-(CH3) CH-COOH + H2O
Aminoacizii legați printr-o legătură peptidică formează lanț polipeptidic. Legătura peptidică are o structură plană:
- atomii de C, O și N sunt în hibridizare sp;
- atomul de N are un orbital p cu o pereche de electroni singuratică;
- se formează un sistem p-n-conjugat, ceea ce duce la o scurtare a legăturii C-N (0,132 nm) și la restricția rotației (bariera de rotație este de ~63 kJ/mol).
Legătura peptidică are o transconfigurare predominant în raport cu planul legăturii peptidice. O structură similară a legăturii peptidice afectează formarea structurii secundare și terțiare a proteinei. Legătura peptidică este rigidă, covalentă, determinată genetic. În formulele structurale, este descrisă ca o legătură simplă, dar de fapt această legătură între carbon și azot are caracterul unei legături parțial duble. Acest lucru se datorează electronegativității diferite a atomilor C, N și O. Rotația în jurul legăturii peptidice este imposibilă, toți cei patru atomi se află în același plan, adică. coplanare. Rotația altor legături în jurul coloanei vertebrale polipeptidice este destul de liberă. Secvența de aminoacizi pentru fiecare proteină este unică și fixată genetic.
În funcție de numărul de reziduuri de aminoacizi incluse în moleculele peptidice, ele disting dipeptide, tripeptide, tetrapeptide etc. Se numesc peptide care conțin până la zece reziduuri de aminoacizi oligopeptide care conțin mai mult de zece reziduuri de aminoacizi - polipeptide. Se numesc polipeptide naturale cu o greutate moleculară mai mare de 6000 proteine.
structura secundara - aceasta este aranjarea spațială a lanțului polipeptidic sub formă de a-helix sau de pliere P, indiferent de tipurile de radicali laterali și de conformația acestora. L. Pauling și R. Corey au propus un model pentru structura secundară a unei proteine sub formă de a-helix, în care legăturile de hidrogen sunt închise între fiecare primul și al patrulea aminoacid, ceea ce vă permite să mențineți structura nativă a proteinei, să îndepliniți cele mai simple funcții și să o protejați de distrugere. Toate grupările de peptide participă la formarea legăturilor de hidrogen, ceea ce asigură o stabilitate maximă, reduce hidrofilitatea și crește hidrofobicitatea moleculei proteice. a-helix se formează spontan și este cea mai stabilă conformație corespunzătoare energiei libere minime. Cel mai comun element al structurii secundare este a-helix drept (aR). Lanțul peptidic de aici este îndoit elicoidal. Fiecare tură are 3,6 reziduuri de aminoacizi, pasul șurubului, adică distanța minimă dintre două puncte echivalente este de 0,54 nm; a-helix-ul este stabilizat prin legături de hidrogen aproape liniare între gruparea NH și gruparea CO a celui de-al patrulea rest de aminoacid. nepolar sau amfifil a-helicele cu 5-6 spire asigură adesea ancorarea proteinelor în membranele biologice (helicele transmembranare). B structuri pliate se formează și legături de hidrogen intercatenare încrucișate.Dacă lanțurile sunt orientate în direcții opuse, structura se numește foaie pliată anti-paralel(wa); dacă lanțurile sunt orientate în aceeași direcție, se numește structura foaie îndoită paralel(vp). Pe lângă cele obișnuite din lanțurile polipeptidice, există și structuri secundare neregulate, acestea. structuri standard care nu formează sisteme periodice lungi. Aceasta - în coturi ele sunt numite așa pentru că deseori împreunează vârfurile firelor β adiacente în agrafe β antiparalele). Îndoirile includ de obicei aproximativ jumătate din reziduurile care nu au căzut în structurile obișnuite ale proteinelor.
Legături care se stabilizează structura tertiara :
- forțe electrostatice de atracție între grupurile R care poartă grupe ionice încărcate opus (legături ionice);
- legături de hidrogen între grupările R polare (hidrofile);
- interacțiuni hidrofobe între grupările R nepolare (hidrofobe);
- legături disulfurice între radicalii a două molecule de cisteină.
Aceste legături sunt covalente. Ele măresc stabilitatea structurii terțiare, dar nu sunt întotdeauna necesare pentru răsucirea corectă a moleculei. În unele proteine, acestea pot lipsi cu totul.
Structura terțiară- unic pentru fiecare localizare proteică în spațiul lanțului polipeptidic, în funcție de numărul și alternanța aminoacizilor, i.e. determinat de structura primară a proteinei. Configurația moleculelor proteice poate fi fibrilare și globulare. Structura terțiară a multor proteine este alcătuită din mai multe globule compacte numite domenii. Domeniile sunt de obicei legate între ele prin punți subțiri, lanțuri polipeptidice amorfe alungite.În plus, motivele de pliere a lanțului polipeptidic se găsesc în proteine, asemănătoare ornamentelor de pe vazele indiene și grecești: motiv meandre, motiv cheie grecească, zigzag-„fulger” motiv.parte (cel puțin jumătate) din radicalii hidrofobi ai reziduurilor de aminoacizi este ascunsă de contactul cu apa din jurul proteinei. Există formarea unui fel de intramolecular " nuclee hidrofobe". Acestea conțin în special reziduuri voluminoase de leucină, izoleucină, fenilalanină și valină. Odată cu apariția structurii terțiare, proteina dobândește noi proprietăți - biologic. În special, manifestarea proprietăților catalitice este asociată cu prezența unei structuri terțiare în proteină. Proteinele fibrilare sunt proteine care au o structură filamentoasă alungită. Majoritatea proteinelor fibrilare sunt insolubile în apă, au o greutate moleculară mare și o structură spațială foarte regulată, care este stabilizată în principal prin interacțiuni (inclusiv cele covalente) între diferitele lanțuri polipeptidice. Lanțurile polipeptidice ale multor proteine fibrilare sunt paralele între ele de-a lungul aceleiași axe și forme fibre lungi (fibrile) sau straturi. Proteine globulare- proteine, în moleculele cărora lanțurile polipeptidice sunt strâns pliate în structuri sferice compacte - globule (structuri proteice terțiare).
Structura cuaternară - aceasta este o formațiune supramoleculară formată din două sau mai multe lanțuri polipeptidice interconectate necovalent, dar prin legături de hidrogen, interacțiuni electrostatice, dipol dipol și hidrofobe între resturile de aminoacizi situate la suprafață. Fiecare dintre proteinele care participă la structura terțiară în timpul formării structurii cuaternare numită subunitate sau protomer. Molecula rezultată se numește oligomer sau multimer. Proteinele oligomerice sunt adesea construite dintr-un număr par de protomeri cu greutăți moleculare identice sau diferite. La formarea structurii cuaternare a proteinei iau parte aceleași legături ca și la formarea structurii terțiare, cu excepția celor covalente. O trăsătură caracteristică a proteinelor cu structură cuaternară este capacitatea lor de a se auto-asambla. Interacțiunea protomerilor se realizează cu o specificitate ridicată, datorită formării a o duzină de legături slabe între suprafețele de contact ale subunităților, prin urmare, erorile în formarea structurii cuaternare a proteinelor sunt excluse.
Aproape tot proteine enzimatice au o structură cuaternară și constau de obicei dintr-un număr par de protomeri (doi, patru, șase, opt). Structura cuaternară a unei proteine presupune o astfel de asociere a proteinelor unei structuri terțiare, în care apar noi proprietăți biologice care nu sunt caracteristice unei proteine într-o structură terțiară.
Configurația spațială a unei proteine acestea. se numesc structuri terţiare şi cuaternare conformaţie. Dacă lanțul polipeptidic este luat de capete, întins și apoi eliberat, acesta se va plia de fiecare dată în aceeași structură caracteristică acestui tip de polipeptidă. În același timp, rezultă în mod evident din ceea ce s-a spus că prin schimbarea unui singur aminoacid din orice polipeptidă, vom obține o moleculă cu o structură complet diferită și, prin urmare, cu proprietăți diferite.
De compoziție chimică toate proteinele sunt împărțite în simplu, constând numai din reziduuri de aminoacizi, și complex. Cele complexe pot include ioni metalici (metaloproteine) sau pigment (cromoproteine), formează complexe puternice cu lipide (lipoproteine), acizi nucleici (nucleoproteine) și, de asemenea, leagă covalent un reziduu de acid fosforic (fosfoproteine), carbohidrați (glicoproteine).
Proteinele simple sunt împărțite în:
- fibrilare, solubile în apă (actină, miozină) și insolubile (keratină, elastina, colagen),
- globulare (albumine, globuline, protamine, histone, prolamine).
Structura chimică a proteinelor este reprezentată de alfa-aminoacizi legați într-un lanț printr-o legătură peptidică. La organismele vii, compoziția determină codul genetic. În procesul de sinteză, în majoritatea cazurilor, se folosesc 20 de aminoacizi de tip standard. Multe dintre combinațiile lor formează molecule de proteine cu o mare varietate de proprietăți. Resturile de aminoacizi suferă adesea modificări post-translaționale. Ele pot apărea înainte ca proteina să înceapă să-și îndeplinească funcțiile și în procesul activității sale în celulă. În organismele vii, mai multe molecule formează adesea complexe complexe. Un exemplu este asocierea fotosintetică.
Scopul conexiunilor
Proteinele sunt considerate o componentă importantă a nutriției umane și animale datorită faptului că toți aminoacizii necesari nu pot fi sintetizați în corpul lor. Unele dintre ele ar trebui să vină cu alimente proteice. Principalele surse de compuși sunt carnea, nucile, laptele, peștele, cerealele. Într-o măsură mai mică, proteinele sunt prezente în legume, ciuperci și fructe de pădure. Când sunt digerate de enzime, proteinele consumate sunt descompuse în aminoacizi. Ele sunt deja folosite în biosinteza propriilor proteine în organism sau sunt descompuse în continuare - pentru energie.

Referință istorică
Secvența de structură a proteinei insulinei a fost determinată pentru prima dată de Frederick Senger. Pentru munca sa, a primit Premiul Nobel în 1958. Sanger a folosit metoda de secvențiere. Folosind difracția cu raze X, structurile tridimensionale ale mioglobinei și hemoglobinei au fost obținute ulterior (la sfârșitul anilor 1950). Lucrarea a fost realizată de John Kendrew și Max Perutz.
Structura unei molecule de proteine
Include polimeri liniari. Ei, la rândul lor, constau din reziduuri de alfa-aminoacizi, care sunt monomeri. în plus, structura proteinei poate include componente care au o natură non-aminoacizică şi reziduuri de aminoacizi de tip modificat. La desemnarea componentelor se folosesc abrevieri de 1 sau 3 litere. Un compus care conține de la două până la câteva zeci de reziduuri este adesea denumit „polipeptidă”. Ca urmare a interacțiunii grupării alfa-carboxil a unui aminoacid cu gruparea alfa-amino a altuia, apar legături (în timpul formării structurii proteinei). În compus, capetele C- și N- sunt izolate, în funcție de ce grupă a restului de aminoacid este liberă: -COOH sau -NH2. În procesul de sinteză a proteinelor pe ribozom, de regulă, un reziduu de metionină acționează ca primul terminal; atașarea celor ulterioare se realizează la capătul C-terminal al celor precedente.

Niveluri de organizare
Au fost propuși de Lindrem-Lang. În ciuda faptului că această diviziune este considerată oarecum învechită, este încă folosită. S-a propus alocarea a patru niveluri de organizare a conexiunilor. Structura primară a unei molecule de proteine este determinată de codul genetic și de caracteristicile genei. Niveluri mai ridicate tind să se formeze în timpul plierii proteinelor. Structura spațială a unei proteine este în general determinată de lanțul de aminoacizi. Cu toate acestea, este destul de flexibil. Poate fi influențată de factori externi. În acest sens, este mai corect să vorbim despre conformația compusului, care este cea mai favorabilă și de preferat energetic.
1 nivel
Este reprezentată de secvența de resturi de aminoacizi ale lanțului polipeptidic. De regulă, este descris folosind denumiri de una sau trei litere. Structura primară a proteinelor este caracterizată prin combinații stabile de reziduuri de aminoacizi. Ei îndeplinesc anumite sarcini. Astfel de „motive conservatoare” rămân păstrate în cursul evoluției speciilor. Ele pot fi adesea folosite pentru a prezice problema unei proteine necunoscute. Evaluând gradul de similaritate (omologie) în lanțurile de aminoacizi din diferite organisme, se poate determina distanța evolutivă formată între taxonii care alcătuiesc aceste organisme. Structura primară a proteinelor este determinată prin secvențiere sau prin complexul inițial al ARNm-ului său folosind tabelul de coduri genetice.

Comandarea locală a unei secțiuni de lanț
Acesta este următorul nivel de organizare - structura secundară a proteinelor. Există mai multe tipuri. Ordinea locală a regiunii lanțului polipeptidic este stabilizată prin legături de hidrogen. Cele mai populare tipuri sunt:

Structura spațială
Structura terțiară a proteinelor include elemente de nivelul anterior. Ele sunt stabilizate prin diferite tipuri de interacțiuni. În acest caz, legăturile hidrofobe sunt de o importanță capitală. Stabilizarea presupune:
- interacțiuni covalente.
- Legături ionice care se formează între grupările laterale de aminoacizi care au sarcini opuse.
- Interacțiuni cu hidrogen.
- legături hidrofobe. În procesul de interacțiune cu elementele H2O din jur, proteina este pliată astfel încât grupările laterale nepolare de aminoacizi sunt izolate din soluția apoasă. Pe suprafața moleculei apar grupări hidrofile (polare).
Structura terțiară a proteinelor este determinată de rezonanța magnetică (nucleară), unele tipuri de microscopie și alte metode.
Principiul de pozare
Studiile au arătat că între 2 și 3 niveluri este convenabil să evidențiezi altul. Se numește „arhitectură”, „motiv de așezare”. Este determinată de aranjarea reciprocă a componentelor structurii secundare (catenele beta și elice alfa) în limitele unui globul compact - un domeniu proteic. Poate exista independent sau poate fi inclusă într-o proteină mai mare împreună cu altele similare. S-a stabilit că motivele de styling sunt mai degrabă conservatoare. Ele apar în proteine care nu au relații nici evolutive, nici funcționale. Definiția arhitecturii stă la baza clasificării raționale (fizice).

Organizarea domeniului
Odată cu aranjarea reciprocă a mai multor lanțuri de polipeptide în compoziția unui complex proteic, se formează o structură cuaternară a proteinelor. Elementele care alcătuiesc compoziția sa se formează separat pe ribozomi. Abia după ce sinteza este finalizată, această structură proteică începe să se formeze. Poate conține atât lanțuri polipeptidice diferite, cât și identice. Structura cuaternară a proteinelor este stabilizată prin aceleași interacțiuni ca la nivelul anterior. Unele complexe pot include câteva zeci de proteine.
Structura proteinelor: sarcini protectoare
Polipeptidele citoscheletului, acționând într-un fel ca întărire, conferă multor organele o formă și participă la schimbarea acesteia. Proteinele structurale oferă protecție organismului. Un exemplu de astfel de proteină este colagenul. Formează baza în substanța intercelulară a țesuturilor conjunctive. Keratina are și o funcție protectoare. Formează baza coarnelor, penelor, părului și a altor derivați ai epidermei. Când toxinele sunt legate de proteine, detoxifierea acestora din urmă are loc în multe cazuri. Așa se realizează sarcina de protecție chimică a organismului. Enzimele hepatice joacă un rol deosebit de important în procesul de neutralizare a toxinelor din corpul uman. Sunt capabili să descompună otravurile sau să le transforme într-o formă solubilă. Acest lucru contribuie la transportul mai rapid al acestora din organism. Proteinele prezente în sânge și în alte fluide corporale oferă protecție imună prin declanșarea unui răspuns atât la atacul agenților patogeni, cât și la răni. Imunoglobulinele (anticorpi și componente ale sistemului complementului) sunt capabile să neutralizeze bacteriile, proteinele străine și virușii.
Mecanism de reglare
Moleculele de proteine, care nu acționează nici ca sursă de energie, nici ca material de construcție, controlează multe procese intracelulare. Deci, datorită acestora, se realizează reglarea traducerii, transcripției, tăierii, a activității altor polipeptide. Mecanismul de reglare se bazează pe activitatea enzimatică sau se manifestă prin legarea specifică de alte molecule. De exemplu, factorii de transcripție, polipeptidele activatoare și proteinele represoare pot controla rata transcripției genelor. În același timp, ele interacționează cu secvențele reglatoare ale genelor. Protein fosfatazele și protein kinazele joacă cel mai important rol în controlul cursului proceselor intracelulare. Aceste enzime pornesc sau suprimă activitatea altor proteine prin adăugarea sau îndepărtarea grupărilor fosfat din ele.

Sarcina de semnal
Este adesea combinată cu o funcție de reglementare. Acest lucru se datorează faptului că multe polipeptide intracelulare și extracelulare pot transmite semnale. Factorii de creștere, citokinele, hormonii și alți compuși au această capacitate. Steroizii sunt transportați prin sânge. Interacțiunea hormonului cu receptorul acționează ca un semnal, datorită căruia este declanșat răspunsul celulei. Steroizii controlează conținutul de compuși din sânge și celule, reproducerea, creșterea și alte procese. Un exemplu este insulina. Reglează nivelul de glucoză. Interacțiunea celulelor se realizează prin intermediul compușilor proteici semnal transmis prin substanța intercelulară.
Transport de elemente
Proteinele solubile implicate în mișcarea moleculelor mici au o mare afinitate pentru substratul prezent în concentrație mare. De asemenea, au capacitatea de a o elibera cu ușurință în zonele cu conținut scăzut. Un exemplu este proteina de transport hemoglobina. Mișcă oxigenul din plămâni către alte țesuturi, iar din acestea transferă dioxid de carbon. Unele proteine membranare sunt, de asemenea, implicate în transportul moleculelor mici prin pereții celulari, modificându-le. Stratul lipidic al citoplasmei este rezistent la apă. Acest lucru previne difuzia moleculelor încărcate sau polare. Conexiunile de transport cu membrană sunt de obicei împărțite în purtători și canale.
Conexiuni de rezervă
Aceste proteine formează așa-numitele rezerve. Se acumulează, de exemplu, în semințele de plante, ouăle de animale. Astfel de proteine acționează ca o sursă de rezervă de materie și energie. Unii compuși sunt folosiți de organism ca rezervor de aminoacizi. Ei, la rândul lor, sunt precursorii substanțelor active implicate în reglarea metabolismului.
Receptorii celulari
Astfel de proteine pot fi localizate atât direct în citoplasmă, cât și încorporate în perete. O parte a conexiunii primește un semnal. De regulă, este o substanță chimică și, în unele cazuri - un efect mecanic (întindere, de exemplu), lumină și alți stimuli. În procesul de expunere a semnalului la un anumit fragment al moleculei - polipeptidul receptor - încep modificările conformaționale ale acestuia. Ele provoacă o modificare a conformației restului celulei, care realizează transmiterea stimulului către alte componente ale celulei. Trimiterea unui semnal se poate face în diferite moduri. Unii receptori sunt capabili să catalizeze o reacție chimică, în timp ce alții acționează ca canale ionice care se închid sau se deschid sub influența unui stimul. Unii compuși leagă în mod specific moleculele intermediare în interiorul celulei.
Polipeptide motorii
Există o întreagă clasă de proteine care asigură mișcarea corpului. Proteinele motorii sunt implicate în contracția musculară, mișcarea celulelor, activitatea flagelilor și a cililor. Datorita acestora se realizeaza si transport dirijat si activ. Kinezinele și dineinele efectuează transferul de molecule de-a lungul microtubulilor folosind hidroliza ATP ca sursă de energie. Acestea din urmă mută organele și alte elemente către centrozom din regiunile celulare periferice. Kinesinele se deplasează în direcția opusă. Dineinele sunt, de asemenea, responsabile pentru activitatea flagelilor și a cililor.
1. Structura primară a proteinei. Dependența proprietăților și conformației proteinelor de structura primară. Exemple de polimorfisme proteice, hemoglobina A și F, diferențe structurale și funcționale. Rolul hemoglobinei fetale în perioada de dezvoltare fetala . Modificări ereditare în structura primară - boli moleculare (anemia secerată).
Structura primară a unei proteine este secvența de aminoacizi din lanțul polipeptidic. Această structură este formată din legături peptidice între grupările α-amino și α-carboxil ale aminoacizilor (vezi 1.4.2). Rețineți că chiar și modificările mici ale structurii primare a unei proteine pot schimba semnificativ proprietățile acesteia. Un exemplu de boli care se dezvoltă ca urmare a modificărilor în structura primară a unei proteine sunt hemoglobinopatiile (hemoglobinozele).
Hemoglobina A (Hb A) este prezentă în globulele roșii ale adulților sănătoși. Sângele unor oameni conține hemoglobină anormală (alterată) - hemoglobină (Hb S). Singura diferență în structura primară a Hb S față de Hb A este înlocuirea unui rest de acid glutamic hidrofil cu un reziduu de valină hidrofob la capătul lanțurilor lor β.
După cum știți, principala funcție a hemoglobinei este transportul oxigenului către țesuturi. În condițiile presiunii parțiale reduse a O2, solubilitatea hemoglobinei S în apă și capacitatea acesteia de a lega și transporta oxigenul scade. În același timp, eritrocitele capătă o formă de semilună, sunt rapid distruse, în urma căreia se dezvoltă anemie (anemia secerată).
S-a stabilit că secvența de resturi de aminoacizi ale lanțului polipeptidic proteic poartă informațiile necesare formării structurii spațiale a proteinei. S-a stabilit că numai o variantă stabilă a structurii spațiale corespunde fiecărei secvențe polipeptidice. Procesul de pliere a unui lanț polipeptidic într-o structură tridimensională obișnuită se numește pliere.
Până de curând, se credea că formarea structurii spațiale a proteinei are loc spontan, fără participarea niciunui componente. Cu toate acestea, relativ recent s-a constatat că acest lucru este valabil numai pentru proteine relativ mici (de ordinul a 100 de resturi de aminoacizi). La procesul de pliere a proteinelor mai mari, iau parte proteine speciale - însoțitori, care creează posibilitatea formării rapide a structurii spațiale corecte a proteinei.
Un exemplu de polimorfism proteic este hemoglobina, care are multe forme. Hemoglobina A este hemoglobina normală a adultului. Această proteină este un tetramer format din două perechi de lanțuri polipeptidice - monomeri: doi monomeri cu lanț α și doi monomeri cu lanț β, sau doi monomeri α și doi monomeri δ. Hemoglobina F este tipul fetal de hemoglobină umană. Hemoglobina F este un heterotetramer format din două lanțuri α și două lanțuri γ de globină. Hemoglobina F are o afinitate crescută pentru oxigen (conține serină în loc de lizină) și permite unui volum relativ mic de sânge fetal să îndeplinească mai eficient funcțiile de furnizare a oxigenului. Totuși, hemoglobina F este mai puțin rezistentă la degradare și mai puțin stabilă. În ultimul trimestru de sarcină și după naștere, hemoglobina F este treptat - înlocuită cu hemoglobina A (HbA) „adultă”, un transportator de oxigen mai puțin activ, dar mai rezistent la distrugere și mai stabil. Bolile moleculare sunt tulburări ereditare în structura primară a pâinii. De exemplu, înlocuirea celui de-al șaselea aminoacid glutamin din subunitatea β a hemoglobinei cu valină duce la formarea hemoglobinei S și la faptul că molecula de hemoglobină în ansamblu nu își poate îndeplini funcția principală - transportul oxigenului; în astfel de cazuri, o persoană dezvoltă o boală - anemia cu celule falciforme.
2. Conformația moleculei proteice (structuri secundare și terțiare). Tipuri de legături intramoleculare în proteine. Proteine fibrilare și globulare (exemple). Structura cuaternară a proteinei. Exemple de structură și funcționare a proteinelor oligomerice.
Structura secundară a unei proteine reprezintă o metodă de pliere a unui lanț polipeptidic într-o conformație elicoidală sau de altă natură.În acest caz, se formează legături de hidrogen între grupările CO și NH ale scheletului peptidic al unui lanț sau al lanțurilor polipeptidice adiacente. Sunt cunoscute mai multe tipuri de structură secundară a lanțurilor peptidice, printre care α-helix și stratul pliat β sunt principalele.
α-helix- structura rigida, arata ca o tija. Partea interioară a acestei tije este creată de o coloană vertebrală peptidică strâns răsucită, radicalii de aminoacizi sunt direcționați spre exterior. În acest caz, grupa CO a fiecărui rest de aminoacid interacționează cu gruparea NH a celui de-al patrulea rest din acesta. Există 3,6 reziduuri de aminoacizi pe tură a helixului, iar pasul helixului este de 0,54 nm (Figura 2.1).
Figura 2.1.α-helix.
Unii aminoacizi împiedică plierea lanțului într-un α-helix, iar la locația lor, continuitatea helixului este întreruptă. Acești aminoacizi includ prolina (în care atomul de azot face parte dintr-o structură ciclică rigidă și rotația în jurul legăturii N-Cα devine imposibilă), precum și aminoacizi cu radicali încărcați care împiedică electrostatic sau mecanic formarea unei helix α. . Dacă într-o singură tură (aproximativ 4 resturi de aminoacizi) există doi astfel de radicali (sau mai mulți), aceștia interacționează și deformează spirala.
strat β-pliat diferă de α-helix prin faptul că are o formă mai degrabă plată decât ca tijă. Format prin legături de hidrogen în cadrul unuia sau mai multor lanțuri polipeptidice. Lanțurile de peptide pot fi dispuse în aceeași direcție (paralel) sau în direcții opuse (anti-paralel), asemănător cu burdufurile de acordeon. Radicalii laterali sunt localizați deasupra și sub planul stratului.

Figura 2.2. strat β-pliat.
Rețineți că tipul de structură secundară a unei proteine este determinat de structura sa primară. De exemplu, la locația reziduului de prolină (atomii inelului pirolidin din prolină se află în același plan), lanțul peptidic face o îndoire și nu se formează legături de hidrogen între aminoacizi. Prin urmare, proteinele cu un conținut ridicat de prolină (de exemplu, colagen) nu sunt capabile să formeze un a-helix. Radicalii de aminoacizi care poartă o sarcină electrică împiedică, de asemenea, spiralizarea.
2.1.3. Structura terțiară a unei proteine este distribuția în spațiu a tuturor atomilor unei molecule de proteine, sau cu alte cuvinte, împachetarea spațială a unui lanț polipeptidic spiralizat. Rolul principal în formarea structurii terțiare a proteinei îl joacă legăturile de hidrogen, ionice, hidrofobe și disulfurice, care se formează ca urmare a interacțiunii dintre radicalii de aminoacizi.
- Hidrogen legăturile se formează între doi radicali polari neîncărcați sau între radicali neîncărcați și încărcați, de exemplu, radicalii serină și glutamină:

- ionic pot apărea legături între radicalii cu încărcare opusă, de exemplu, radicalii glutamat și arginină:
- Hidrofob interacțiunile sunt caracteristice radicalilor nepolari, de exemplu, valina și leucina:
- disulfură
se formează legături între grupările SH a doi radicali de cisteină situate în diferite părți ale lanțului polipeptidic:
.
În funcție de forma moleculei și de caracteristicile formării structurii terțiare, proteinele sunt împărțite în globulare și fibrilare.
Proteine globulare- au forma sferică sau eliptică a moleculei (globul). În timpul formării unui globule, radicalii hidrofobi ai aminoacizilor sunt scufundați în regiunile interne, în timp ce radicalii hidrofili sunt localizați pe suprafața moleculei. Când interacționează cu faza apoasă, radicalii polari formează numeroase legături de hidrogen. Proteinele sunt menținute în stare dizolvată datorită învelișului de încărcare și hidratare. În organism, proteinele globulare îndeplinesc funcții dinamice (de transport, enzimatice, de reglare, de protecție). Proteinele globulare includ:
- Albumină - proteine plasmatice din sânge; conține multe reziduuri de glutamat și aspartat; precipitat la saturaţia 100% a soluţiei cu sulfat de amoniu.
- Globuline - proteine din plasmă sanguină; comparativ cu albumina, au o greutate moleculară mai mare și conțin mai puține reziduuri de glutamat și aspartat; precipită la o saturație de 50% a soluției cu sulfat de amoniu.
- Histones - fac parte din nucleele celulelor, unde formează un complex cu ADN-ul. Conțin multe reziduuri de arginină și lizină.
proteine fibrilare- au forma filamentoasa (fibrile), formeaza fibre si fascicule de fibre. Există multe legături încrucișate covalente între lanțurile polipeptidice adiacente. Insolubil în apă. Tranziția în soluție este împiedicată de radicalii nepolari ai aminoacizilor și de legăturile încrucișate dintre lanțurile peptidice. În organism, ele îndeplinesc în principal o funcție structurală, oferă rezistență mecanică țesuturilor. Proteinele fibrilare includ:
- Colagen - proteina din tesutul conjunctiv. În compoziția sa predomină aminoacizii glicină, prolină, hidroxiprolină.
- Elastină - mai elastic decât colagenul, face parte din pereții arterelor, țesutul pulmonar, în compoziția sa predomină aminoacizii glicină, alanină, valină.
- Keratină - o proteină a epidermei și derivați ai pielii, aminoacidul cisteină predomină în structura sa.
3. Hemoglobina este o proteină alosterică. Modificări conformaționale ale moleculei de hemoglobină. efect de cooperare. Regulatori ai afinității hemoglobinei pentru oxigen. Diferențele structurale și funcționale dintre mioglobină și hemoglobină.
Hemoproteinele includ: hemoglobină, mioglobină, citocromi, peroxidază, catalază. Aceste proteine conțin ca grup protetic bijuterie.

După structura sa chimică, hem este protoporfirina IX asociat cu fierul feros. Protoporfirina IX este un compus organic aparținând clasei porfirinelor. Protoporfirina IX conține patru inele pirol substituite legate prin punți de metină. =CH—. Substituenții de pe inelele pirol sunt: patru grupări metil CH3—, două benzi de vinil CH2=CH—şi două resturi de acid propionic — CH2—CH2—COOH. Hemul se conectează la partea proteică în felul următor. grupuri nepolare. protoporfirina IX interacționează cu regiunile hidrofobe ale aminoacizilor prin legături hidrofobe. În plus, există o legătură de coordonare între atomul de fier și radicalul histidin imidazol din lanțul proteic. O altă legătură de coordonare a atomului de fier poate fi folosită pentru a lega oxigenul și alți liganzi.
Prezența proteinelor care conțin hem în materialul biologic este detectată folosind un test cu benzidină (când se adaugă benzidină și peroxid de hidrogen, soluția de test devine albastru-verde).
comparați structura și funcția mioglobinei și hemoglobinei, amintiți-vă trăsăturile caracteristice ale fiecăreia dintre aceste proteine.
mioglobina- o cromoproteină prezentă în țesutul muscular și are o mare afinitate pentru oxigen. Greutatea moleculară a acestei proteine este de aproximativ 16.000 Da. Molecula de mioglobină are o structură terțiară și este un singur lanț polipeptidic legat de hem. Mioglobina nu are proprietăți alosterice (vezi 2.4.), Curba sa de saturație în oxigen are forma unei hiperbole (Figura 4). Funcția mioglobinei este de a crea o rezervă de oxigen în mușchi, care este consumată la nevoie, compensând lipsa temporară de oxigen.
Hemoglobina (Hb)- o cromoproteină prezentă în eritrocite și implicată în transportul oxigenului către țesuturi. Hemoglobina adultă se numește hemoglobină A (HbA). Greutatea sa moleculară este de aproximativ 65.000 Da. Molecula de Hb A are o structură cuaternară și include patru subunități - lanțuri polipeptidice (notate α1, α2, β1 și β2), fiecare dintre ele asociată cu un hem.
Amintiți-vă că hemoglobina este o proteină alosterică, moleculele sale se pot schimba reversibil de la o conformație la alta. Aceasta modifică afinitatea proteinei pentru liganzi. Conformația cu cea mai mică afinitate pentru ligand se numește conformație tensionată sau T-conformație. Conformația cu cea mai mare afinitate pentru ligand este denumită conformație relaxată sau R-conformație.
Diferiți factori de mediu pot schimba acest echilibru într-o direcție sau alta. Regulatorii alosterici care afectează afinitatea Hb pentru O2 sunt: 1) oxigenul; 2) concentrația H+ (pH-ul mediului); 3) dioxid de carbon (CO2); 4) 2,3-difosfoglicerat (DPG). Atașarea unei molecule de oxigen la una dintre subunitățile hemoglobinei promovează tranziția unei conformații tensionate la una relaxată și crește afinitatea pentru oxigen a altor subunități ale aceleiași molecule de hemoglobină. Acest fenomen se numește efect de cooperare. Natura complexă a legării hemoglobinei de oxigen este reflectată în curba de saturație a hemoglobinei O2, care are o formă de S (Figura 3.1).

Figura 3.1. Curbele de saturație a mioglobinei (1) și hemoglobinei (2) cu oxigen.
4. Funcţiile biologice ale proteinelor. Rolul organizării spațiale a lanțului polipeptidic în formarea centrilor activi. Interacțiunea proteinelor cu liganzii. Denaturarea proteinelor.
Proteinele joacă un rol esențial în organism, îndeplinind o varietate de funcții biologice.Reține cele mai importante dintre ele și exemple de proteine corespunzătoare studiind tabelul 2.2.
|
Tabelul 2.2 |
||||||||||||||||||||||||
2.2.2. Vă rugăm să rețineți că funcționarea oricărei proteine se bazează pe capacitatea sa de a interacționa selectiv cu molecule sau ioni (liganzi) strict definiți. De exemplu, pentru enzimele care catalizează reacții chimice, liganzii vor fi substanțe implicate în aceste reacții (substraturi), pentru proteine de transport - substanțe transportate etc. 2.2.3. Ligandul este capabil să interacționeze nu cu întreaga suprafață a moleculei de proteină, ci doar cu o anumită parte a acesteia, care este un centru de legare sau un centru activ. Acest centru este format din radicali aminoacizi apropiați spațial la nivelul structurii secundare sau terțiare a proteinei. Capacitatea ligandului de a interacționa cu situsul de legare se datorează acestora complementaritatea, adică corespondența reciprocă a structurii lor spațiale (asemănătoare cu interacțiunea „key-lock”). Legături necovalente (hidrogen, ionice, hidrofobe), precum și legături covalente se formează între grupările funcționale ale ligandului și locul de legare. Complementaritatea ligandului și a situsului de legare poate explica specificitatea (selectivitatea) ridicată a interacțiunii proteină-ligand. Este important de menționat că o modificare a structurii spațiale a proteinei în timpul denaturarii (vezi 2.4) duce la distrugerea centrilor de legare și la pierderea funcției biologice a proteinei. |
Denaturarea proteinelor se numește această modificare a proprietăților fizico-chimice (naturale) și, cel mai important, biologice native ale unei proteine din cauza unei încălcări a structurii sale cuaternare, terțiare și chiar secundare. Denaturarea proteinelor poate fi cauzată de:
- temperatura peste 60 ° C;
- radiații ionizante;
- acizi și alcali concentrați;
- săruri ale metalelor grele (mercur, plumb, cadmiu);
- compuși organici (alcooli, fenoli, cetone).
Proteinele denaturate se caracterizează prin:
- modificarea conformației moleculei;
- scăderea solubilității în apă;
- modificarea sarcinii moleculei;
- rezistență mai mică la acțiunea enzimelor proteolitice;
- pierderea activității biologice.
Vă rugăm să rețineți că în anumite condiții este posibilă restabilirea conformației originale (native) a proteinei după îndepărtarea factorului care a cauzat denaturarea. Acest proces se numește regenerare.
Amintiți-vă câteva exemple de utilizare a procesului de denaturare a proteinelor în medicină:
- pentru precipitarea proteinelor plasmatice sanguine la determinarea conținutului de substanțe neproteice din sânge;
- în timpul dezinfectării și igienizării;
- în tratamentul și prevenirea otrăvirii cu săruri de metale grele (laptele sau albușul de ou este folosit ca antidot);
- pentru a obține substanțe medicinale de natură proteică (denaturarea se folosește în condiții blânde, urmată de renativare).
5. Structura și rolul biologic al nucleotidelor.
|
acizi nucleici sau polinucleotidele sunt numite substanțe cu moleculare înaltă constând din nucleotide legate într-un lanț prin legături de 3”, 5”-fosfodiester. Fiecare nucleotidă constă dintr-o bază azotată, un carbohidrat (pentoză) și un reziduu de acid fosforic. Bazele azotate care alcătuiesc nucleotidele au următoarea structură:
Carbohidrații sunt reprezentați de riboză și dezoxiriboză:
4.1.2. O bază azotată și o pentoză conectate printr-o legătură N-glicozidică nucleozidă. Dacă riboza este prezentă în nucleozidă sub formă de pentoză, atunci este o ribonucleozidă, iar dacă deoxiriboză este prezentă, atunci este o dezoxiribonucleozidă. |
4.1.3. Nucleotide sunt nucleozide fosforilate. Reziduul de acid fosforic, de regulă, este atașat de gruparea hidroxil a pentozei în poziția 5" printr-o legătură esterică. Exemple:
Celulele conțin, de asemenea, difosfați nucleozidici și trifosfați nucleozidici care conțin două și, respectiv, trei resturi de acid fosforic. Rolul biologic al acestor compuși va fi luat în considerare mai jos.
6. Structuri primare și secundare ale ADN-ului. Regulile Chargaff. Principiul complementarității . Tipuri de legături în molecula de ADN. Rolul biologic al ADN-ului. Bolile moleculare sunt rezultatul mutațiilor genetice.
Structura primară a acizilor nucleici numit secvență de mononucleotide dintr-un lanț de ADN sau ARN . Structura primară a acizilor nucleici este stabilizată prin legături 3",5"-fosfodiester. Aceste legături sunt formate prin interacțiunea grupării hidroxil în poziția de 3" a reziduului pentoză al fiecărei nucleotide cu gruparea fosfat a nucleotidei adiacente (Figura 3.2),
Astfel, la un capăt al lanțului polinucleotidic există o grupare 5’-fosfat liberă (capătul 5’), iar la celălalt capăt există o grupare hidroxil liberă în poziția 3’ (capătul 3’). Secvențele de nucleotide sunt de obicei scrise în direcția de la capătul de 5" la capătul de 3".
ADN (acid dezoxiribonucleic) este conținută în nucleul celulei și are o greutate moleculară de aproximativ 1011 Da. Nucleotidele sale conțin baze azotate. adenină, guanină, citozină, timină , carbohidrați dezoxiriboză și reziduuri de acid fosforic. Conținutul de baze azotate dintr-o moleculă de ADN este determinat de regulile Chargaff:
1) numărul bazelor purinice este egal cu numărul celor pirimidinice (A + G = C + T);
2) cantitatea de adenina si citozina este egala cu cantitatea de timina si respectiv guanina (A = T; C = G);
3) ADN-ul izolat din celule de diferite specii biologice diferă unul de celălalt prin valoarea coeficientului de specificitate:
(G + C) / (A + T)
Aceste modele în structura ADN-ului sunt explicate prin următoarele caracteristici ale structurii sale secundare:
1) o moleculă de ADN este construită din două lanțuri de polinucleotide interconectate prin legături de hidrogen și orientate antiparalel (adică capătul 3 al unui lanț este situat opus capătului 5 al celuilalt lanț și invers);
2) se formează legături de hidrogen între perechi complementare de baze azotate. Adenina este complementara timinei; această pereche este stabilizată de două legături de hidrogen. Guanina este complementară citozinei; această pereche este stabilizată de trei legături de hidrogen (vezi figura b). Cu cât mai multe perechi G-C într-o moleculă de ADN, cu atât este mai mare rezistența acesteia la temperaturi ridicate și radiații ionizante;
3) ambele catene de ADN sunt răsucite într-o spirală având o axă comună. Bazele azotate sunt orientate spre interiorul helixului; pe lângă interacțiunile cu hidrogen, între ele apar și interacțiuni hidrofobe. Părțile de riboză fosfat sunt situate de-a lungul periferiei, formând coloana vertebrală a helixului (vezi Figura 3.4).
Figura 3.4. Diagrama structurii ADN-ului. 
7. Structuri primare și secundare ale ARN. Tipuri de ARN: caracteristici structurale. Componentele principale ale sistemului de sinteză a proteinelor. funcția ribozomului. Funcția de adaptare a ARNt și rolul ARNm în sinteza proteinelor.
ARN (acid ribonucleic) este conținută în principal în citoplasma celulei și are o greutate moleculară în intervalul 104 - 106 Da. Nucleotidele sale conțin baze azotate. adenină, guanină, citozină, uracil , carbohidrați riboza și reziduuri de acid fosforic. Spre deosebire de ADN, moleculele de ARN sunt construite dintr-un singur lanț de polinucleotide, care poate conține secțiuni complementare între ele (Figura 3.5). Aceste secțiuni pot interacționa între ele, formând elice duble, alternând cu secțiuni nespiralizate.

Figura 3.5. Schema structurii ARN de transfer.
În funcție de caracteristicile structurii și funcției, se disting trei tipuri principale de ARN:
1) mesager (mesager) ARN (ARNm) transmite informații despre structura proteinei de la nucleul celular la ribozomi;
2) transfer ARN (ARNt) efectuează transportul aminoacizilor la locul sintezei proteinelor;
3) ARN ribozomal (ARNr) fac parte din ribozomi, participă la sinteza proteinelor.
8. Biosinteza ADN-ului (replicare) și ARNm (transcripție). Procesele de „maturare” a transcriptului primar în timpul formării ARNm.
Biosinteza matricei- procesul de asamblare a noilor macromolecule din monomeri, a căror secvență este programată cu ajutorul acizilor nucleici. Moleculele folosite ca program în biosinteza matricei sunt numite matrici.
Cele trei biosinteze șablon principale inerente tuturor organismelor vii fără excepție sunt replicarea, transcripția și traducerea ADN-ului.
- Replicarea ADN-ului apare în nucleu, precede diviziunea celulară, drept urmare celulele fiice primesc un set complet de gene;
- transcriere de asemenea, efectuate în nucleu, în timpul căruia se formează matricea, transportul și ARN-urile ribozomale, care sunt implicate în sinteza proteinelor în celulă;
- difuzat apare pe ribozomi și duce la formarea unor proteine celulare specifice.
Legătura acestor procese se reflectă în postulatul de bază al biologiei moleculare: direcția fluxului de informații de la genotip la fenotip: ADN → ARN → proteină(săgețile indică direcția transferului de informații).
4.3.2. În plus, pentru unele tipuri de viruși, sunt caracteristice încă două tipuri de sinteze de matrice:
- Replicarea ARN - sinteza ARN pe o matrice ARN;
- transcriere inversă - Sinteza ADN folosind ca matriță o moleculă de ARN.
4.3.3. Să încercăm să formulăm regularitățile generale caracteristice tuturor biosintezelor matriceale.
- Monomerii (nucleotide, aminoacizi) nu pot participa direct la sinteza polimerilor; trebuie să fie în activ formă - nucleotide - sub formă de nucleozide trifosfați, aminoacizi - sub formă de compuși cu ARNt.
- Sinteza tuturor lanțurilor polinucleotidice și polipeptidice constă în trei etape principale- iniţierea, alungirea şi terminarea.
- Matricea are semnal special sau un grup de semnale pentru a identifica elementul de codare, de la care pleacă informații despre lanțul de biopolimer sintetizat. Acest semnal, de regulă, nu coincide cu punctul de început fizic al lanțului polimeric al matricei. Inițierea este procesul în care prima unitate monomeră este atașată la molecula matricei.
- Pentru fiecare act de inițiere a biosintezei, există un număr mare de acte de alungire, adică conectarea următorului monomer cu un lanț în creștere. În alungire sunt implicate trei componente: a) grupa terminală a polimerului sintetizat, b) elementul de codificare al matricei, c) molecula următoare a monomerului activ. Toate acestea trebuie fixate într-un anumit mod în centrul activ al enzimei sau al ribozomului.
- Fiecare act de alungire începe cu selectarea substratului prin enumerarea tuturor substraturilor prezente în sistem. Intrarea substratului dorit în centrul activ este un semnal pentru implementarea reacției enzimatice. legătura fragmentului monomer cu capătul catenei polimerice sintetizate. Adăugarea unui monomer la lanțul de creștere servește drept semnal pentru deplasarea centrului activ cu un element de codificare al matricei.
- Sfârșitul produsului de cele mai multe ori nu corespunde cu sfârșitul matricei, ar trebui să aibă un semnal special care asigură încetarea creșterii în lanț, adică rezilierea.
- Sinteza unei molecule biologic active, de regulă, nu se termină cu rezilierea. Polimerul rezultat suferă o serie de transformări, cum ar fi hidroliza parțială și combinarea mai multor lanțuri într-unul singur, modificarea monomerilor în compoziția polimerului, adăugarea unei părți protetice (la o polipeptidă) sau a unei apoproteine (la o polinucleotidă).
replicare- procesul de auto-duplicare a ADN-ului, sau biosinteza unei molecule de ADN fiică, complet identică cu molecula originală (matricea). Localizarea procesului este nucleul celular. Principiile de bază ale replicării ADN-ului:
- complementaritatea
- antiparalelism
- unipolaritate
- nevoie de sămânță- enzimele de sinteză a ADN-ului sunt capabile doar să construiască un lanț polinucleotidic existent, prin urmare, este mai întâi sintetizat un lanț scurt de ARN (primer sau primer), de care sunt atașate dezoxiribonucleotidele; primerul ARN care și-a îndeplinit rolul este îndepărtat;
- discontinuitate- unul dintre lanțurile fiice (conducătoare) crește continuu în procesul de replicare, iar celălalt (întârziat) - sub formă de fragmente lungi de câteva sute de nucleotide (fragmente Okazaki);
- semiconservatoare- în urma replicării se formează două ADN-uri duble fiice, fiecare dintre ele păstrând (conservând) neschimbată una dintre jumătățile ADN-ului matern.
4.4.2. Condiții necesare pentru replicarea ADN-ului:
1) Matrice - molecula de ADN (Figura 26.1, a);
2) Desfășurarea veverițelor - rupe legăturile de hidrogen dintre bazele complementare ale dublei helix ADN, rezultând formarea unei furci de replicare (Figura 26.1, b);
3) proteine de legare la ADN- uniți lanțurile de ADN separate și împiedicați reunirea lor inversă;
4) Primaza (ARN polimeraza)- o enzimă care sintetizează ARN-ul semințelor.
5) - trifosfați dezoxiribonucleozidici (dATP, dGTP, dTTP, dCTP). Ele sunt atașate de bazele azotate ale lanțurilor polinucleotidice folosind legături de hidrogen conform principiului complementarității;
6) ADN polimeraza - o enzimă care formează noi lanțuri polinucleotidice din trifosfații nucleozidici datorită formării legăturilor 3’,5’-fosfodiester. Sursele de energie sunt legături macroergice ale trifosfaților nucleozidici. Pe o ramură a furcii de replicare se sintetizează un lanț continuu, pe cealaltă, fragmente Okazaki (Figura 26.1, c);
7) ADN ligaza - o enzimă care leagă fragmentele Okazaki într-un singur lanț (Figura 26.1, d).
Ca rezultat, se formează două molecule de ADN identice (Figura 26.1, e).
Transcriere- biosinteza ARN pe un model de ADN. Procesul de transcripție are loc și în nucleul celulei. Principii de bază ale transcripției:
- complementaritatea- lanţurile sintetizate sunt complementare matricei;
- antiparalelism- capătul 5" al lanțului polinucleotidic sintetizat este opus capătului 3" al șablonului și invers;
- unipolaritate- sinteza lanţurilor polinucleotidice are loc întotdeauna în direcţia 5 „→ 3”;
- lipsă de semințe- biosinteza ARN nu necesita primer;
- asimetrie- sinteza catenei fiice are loc doar pe o catenă a matriței ADN, în timp ce a doua catenă este blocată.
4.5.2. Condiții necesare pentru transcriere:
- Matrice- o secțiune a unuia dintre lanțurile ADN (Figura 8.2, a);
- ARN polimerază dependentă de ADN este principala enzimă implicată în transcripție. Locul de atașare a enzimei la ADN este promotorul;
- Substraturi și surse de energie- ribonucleozide trifosfați (ATP, GTP, UTP, CTP). Ele se leagă de bazele azotate ale catenei de ADN transcris prin legături de hidrogen conform principiului complementarității.
9. Biosinteza proteinelor. Cod genetic. Secvența reacțiilor în timpul sintezei unui lanț polipeptidic (inițiere, alungire, terminare) în procesul de translație pe ribozomi. Modificarea post-translațională a moleculelor de proteine. Tulburări ale sintezei proteinelor în copilărie (kwashiorkor) .
|
Difuzare(din engleza. traducere- traducere) - traducerea informațiilor genetice conținute în ARNm într-o secvență liniară de aminoacizi dintr-un lanț polipeptidic. Această traducere se realizează prin intermediul codului genetic (biologic). 5.1.2.Cod genetic - secvenţa de nucleotide corespunzătoare anumitor aminoacizi. Codul genetic se caracterizează prin proprietăți:
5.1.3. Aminoacizii și tripleții de nucleotide care îi codifică nu sunt complementari unul cu celălalt. Prin urmare, trebuie să existe molecule adaptoare, fiecare dintre acestea putând interacționa atât cu un codon specific, cât și cu aminoacidul corespunzător. Aceste molecule sunt transfer ARN-uri(Figura 8.3). Fiecare ARNt conține un triplet de nucleotide - anticodon , care este complementar unui codon ARNm strict definit. Capătul 3’ al ARNt (site-ul acceptor) este locul de atașare a aminoacidului corespunzător codonului ARNm. |
Activarea aminoacizilor - etapa pregătitoare a biosintezei proteinelor - include legarea lor la ARNt-uri specifice cu participarea enzimei aminoacil-ARNt sintetaze. Reacția are loc în citoplasma celulelor.
Procesul de translație în sine include 3 etape - inițiere, alungire, terminare și are loc pe ribozomi.
Fiecare ribozom este format din subunități mari și mici (40S și 60S) și conține regiuni aminoacil (A) și peptidil (P). Situl peptidil leagă aminoacil-ARNt de inițiere, toate celelalte aminoacil-ARNt se leagă de situsul aminoacil.
1) Etapa de inițiere - începutul emisiunii. Condiții necesare pentru inițiere:
- codonul de început ARNm (AUG);
- factori de inițiere ai proteinei;
- subunități mici și mari ale ribozomului;
- GTP (sursă de energie pentru închiderea subparticulelor de ribozom);
- ioni de magneziu;
- aminoacil-ARNt de inițiere (ARNt metionil) - se leagă cu anticodonul său de codonul ARNm de inițiere din regiunea peptidil a ribozomului.
Ca urmare, a complex de iniţiere : ARNm - ribozom - metionil-ARNt (Figura 5.3, a).
2) Stadiul de alungire - alungirea lanțului polipeptidic cu 1 rest de aminoacid - are loc în trei etape:
- atașarea la complexul de inițiere aminoacil-ARNt corespunzător codonului situat în regiunea aminoacil a ribozomului (Figura 5.3, b);
- transpeptidație - formarea unei legături peptidice între resturile de aminoacizi (Figura 5.3, c). Sursa de energie - GTP;
- translocare - mișcarea ribozomului în raport cu ARNm cu 1 triplet (Figura 5.3, d). Sursa de energie - GTP. În timpul alungirii, iau parte factorii proteici.
Procesul descris se repetă de mai multe ori (în funcție de numărul de aminoacizi din lanț).
3) Etapa de încetare - sfarsitul emisiunii. Este asigurată de prezența în lanțul ARNm a unuia dintre codonii terminali (fără sens) - UAA, UGA sau UAG. Factorii de terminare a proteinei sunt implicați în eliberarea polipeptidei (Figura 5.3, e). Când unul dintre codonii fără sens apare în regiunea aminoacil, factorii de terminare stimulează activitatea hidrolazei peptidil transferazei. Din acest motiv, legătura dintre ARNt și peptidă este hidrolizată. GTP nu este necesar pentru această reacție. După aceea, lanțul peptidic, ARNt și ARNm părăsesc ribozomul, iar subparticulele sale se disociază.
Astfel, traducerea ARNm conduce la formarea unui lanț peptidic cu o secvență strict definită de resturi de aminoacizi. Următorul pas în formarea proteinelor este pliere, adică plierea lanțului peptidic într-o structură tridimensională obișnuită. Dacă o proteină constă din mai multe subunități, atunci plierea include și combinarea lor într-o singură macromoleculă.
Se crede că moleculele mici de proteine care conțin aproximativ 100 de resturi de aminoacil pot lua în mod independent o structură tridimensională, plierea lanțurilor de polipeptide mai mari necesită participarea unor proteine speciale - însoțitori.
Însoțitorii sunt numiți diferit proteine de șoc termic deoarece acestea asigură nu numai plierea corectă a proteinelor nou formate, ci și renaturarea proteinelor sintetizate anterior care au suferit denaturarea parțială în celulă sub influența diverșilor factori (supraîncălzire, iradiere, acțiunea radicalilor liberi etc.).
5.2.2. Modificări post-traduce moleculele de proteine pot include:
- proteoliză parțială (de exemplu, conversia unei proenzime într-o enzimă);
- adăugarea unei grupări protetice (reziduuri de acid fosforic, resturi de carbohidrați, grupări hem etc.);
- modificări ale lanțului lateral al reziduurilor de aminoacizi:
- hidroxilarea prolinei la hidroxiprolină în colagen,
- metilarea argininei în histonă,
- iodarea tirozinei în tiroglobulină).
5.2.3. Efectul substanțelor toxice și medicinale asupra biosintezei proteinelor. Biosinteza proteinelor este unul dintre cele mai complexe procese care au loc în celule. Întreruperea sau perversia sa este posibilă ca urmare a încălcării oricăreia dintre cele trei sinteze de matrice.
Astfel, mutagenii (benzo(a)piren, lindan) perturbă replicarea ADN-ului și astfel întrerup procesele de sinteză a proteinelor.
Unele substanțe toxice (gosipol) pot modifica rata de transcripție.
Medicamentele care afectează biosinteza proteinelor includ antibiotice și interferoni.
Antibioticele care blochează biosinteza matricei sunt utilizate în tratamentul bolilor infecțioase și al tumorilor maligne. (vezi tabelul 5.1).
Tabelul 5.1
Antibiotice care inhibă biosinteza matricei
10. Reglarea sintezei proteinelor. Ideea unui operon. Inducerea și reprimarea sintezei în corpul uman. Rolul hormonilor în reglarea acțiunii genelor. Inhibitori ai sintezei matricei - antibiotice, interferoni.
|
5.3.1. Operon (transcriere)- un set de gene care se pot porni și opri în funcție de nevoile metabolice ale celulei. Compoziția operonului, împreună cu gene structurale (SG) , care codifică structura anumitor proteine, include secțiuni de ADN care îndeplinesc funcții de reglare (Figura 5.4). Un grup de gene structurale responsabile pentru sinteza enzimelor unei căi metabolice este sub control gena operatorului (GO) situat în apropiere. Funcția genei operator este controlată de distanța spațială gena regulatoare (GR) , care produce proteina represoare , care este în formă activă sau inactivă. O proteină represoare activă este capabilă să se lege de o genă operator și să inhibe transcrierea genelor structurale, prin urmare inhibă sinteza proteinelor. Substanţele care inactivează proteina represoare sunt inductori sinteza proteinelor, care au efectul opus - corepresoare. Substraturile inițiale ale căilor metabolice pot acționa ca inductori, iar produsele finale ale acestor căi pot acționa ca corepresori. 5.3.2. Există două mecanisme de reglare a sintezei proteinelor - inducție și reprimare . Un exemplu de operon care este reglat inductiv este operon de lactoză , care, împreună cu gena operator, include 3 gene structurale care codifică enzimele de catabolism al lactozei (vezi Figura 5.4). Lactoză este inductorul acestui operon. La o concentrație mare de lactoză în mediu se sintetizează enzimele, la o concentrație scăzută - nu. |
5.3.3. Mecanismul represiunii este reglementat operon de histidină , care conține o genă operator și 10 gene structurale care codifică enzimele necesare pentru biosinteza histidinei (vezi Figura 5.5). Histidină este corepresorul acestui operon. La o concentrație mare de histidină în mediu, sinteza enzimelor se oprește; în absența histidinei, acestea sunt sintetizate.
11. Rolul enzimelor în metabolism. Enzimopatii ereditare în copilărie timpurie . varietate de enzime. Specificul acțiunii enzimelor. Clasificarea enzimelor. Izoenzime, multienzime.
Cursul proceselor metabolice în organism este determinat de acțiunea a numeroase enzime - catalizatori biologici de natură proteică. Ele accelerează reacțiile chimice și nu sunt consumate singure. Termen "enzimă" provine din cuvântul latin fermentul - aluat. Alături de acest concept, termenul echivalent este folosit în literatură "enzimă" (en zyme - în drojdie) de origine greacă. Prin urmare, ramura biochimiei care studiază enzimele se numește „enzimologie”.
Enzimologie formează baza cunoașterii la nivel molecular a celor mai importante probleme de fiziologie și patologie umană. Digestia nutrienților și utilizarea lor pentru producerea de energie, formarea componentelor structurale și funcționale ale țesuturilor, contracția musculară, transmiterea semnalelor electrice de-a lungul fibrelor nervoase, percepția luminii de către ochi, coagularea sângelui - fiecare dintre aceste mecanisme fiziologice este bazată pe acţiunea catalitică a anumitor enzime. S-a demonstrat că numeroase boli sunt perturbate direct de cataliza enzimatică; determinarea activității enzimelor din sânge și din alte țesuturi oferă informații valoroase pentru diagnosticul medical; enzimele sau inhibitorii lor pot fi utilizați ca substanțe medicinale. Astfel, cunoașterea celor mai importante caracteristici ale enzimelor și a reacțiilor catalizate de acestea este necesară pentru o abordare rațională a studiului bolilor umane, a diagnosticului și tratamentului acestora.
Clasificarea se bazează pe cea mai importantă caracteristică prin care o enzimă diferă de alta - aceasta este reacția catalizată de aceasta. Numărul de tipuri de reacții chimice este relativ mic, ceea ce a făcut posibilă împărțirea tuturor enzimelor cunoscute în prezent în 6 cele mai importante. clase în funcţie de tipul de reacţie catalizată. Aceste clase sunt:
- oxidoreductaze (reacții redox);
- transferaze (transfer de grupări funcționale);
- hidrolaze (reacții de scindare care implică apă);
- liazele (ruperea legăturilor fără participarea apei);
- izomeraze (transformări izomerice);
- ligaze (sinteză cu consumul de molecule de ATP).
7.4.3.
Enzimele din fiecare clasă sunt împărțite în subclasele
ghidat de structura substraturilor. Subclasele combină enzime care acționează pe substraturi construite în mod similar. Subclasele sunt împărțite în subsubclaseîn care rafinează şi mai riguros structura grupărilor chimice care deosebesc substraturile unele de altele. În cadrul subclaselor enumerați enzime individuale.
Toate diviziile clasificării au propriile numere. Astfel, orice enzimă primește propriul său număr de cod unic, format din patru numere separate prin puncte. Primul număr este clasa, al doilea este subclasa, al treilea este subclasa și al patrulea este numărul enzimei din subclasă. De exemplu, enzima α-amilaza, care descompune amidonul, este desemnată ca 3.2.1.1, unde:
3 - tipul de reacție (hidroliză);
2 — tipul de legătură în substrat (glicozidic);
1 - tipul de legătură (O-glicozidic);
1 este numărul enzimei din subsubclasă
Metoda de numerotare zecimală descrisă mai sus are un avantaj important: vă permite să ocoliți principalul inconvenient al enumerarii de la capăt la capăt a enzimelor, și anume necesitatea de a schimba numerele tuturor enzimelor ulterioare atunci când o enzimă nou descoperită este inclusă în lista. O nouă enzimă poate fi plasată la sfârșitul subclasei corespunzătoare fără a perturba restul numerotării. În același mod, atunci când se disting noi clase, subclase și subsubclase, acestea pot fi adăugate fără a perturba ordinea de numerotare a subdiviziunilor stabilite anterior. Dacă, după primirea unor noi informații, devine necesară modificarea numerelor unor enzime, numerele vechi nu sunt atribuite unor enzime noi pentru a evita neînțelegerile.
Vorbind despre clasificarea enzimelor, trebuie menționat și faptul că enzimele nu sunt clasificate ca substanțe individuale, ci ca catalizatori pentru anumite transformări chimice. Enzimele izolate din surse biologice diferite și care catalizează reacții identice pot diferi semnificativ în structura lor primară. Cu toate acestea, în lista de clasificare, toate apar sub același număr de cod.
Deci, cunoașterea numărului de cod al enzimei vă permite să:
- rezolvarea ambiguităților dacă diferiți cercetători folosesc același nume pentru diferite enzime;
- eficientizați căutarea informațiilor în bazele de date din literatură;
- obțineți informații suplimentare despre secvența de aminoacizi, structura spațială a enzimei și genele care codifică proteinele enzimei în alte baze de date.
Izoenzime - sunt forme multiple ale aceleiași enzime care catalizează aceeași reacție, dar diferă ca proprietăți fizice și chimice (afinitate pentru substrat, viteza maximă a reacției catalizate, mobilitate electroforetică, sensibilitate diferită la inhibitori și activatori, pH optim și stabilitate termică ). Izoenzimele au o structură cuaternară, care este formată dintr-un număr par de subunități (2, 4, 6 etc.). Izoformele enzimatice se formează ca urmare a diferitelor combinații de subunități.
Un exemplu este lactat dehidrogenaza (LDH), o enzimă care catalizează reacția reversibilă:
NADH 2 NAD +
piruvat ← LDH → lactat
LDH există sub formă de 5 izoforme, fiecare constând din 4 protomeri (subunități) de 2 tipuri M (mușchi) și H (inima). Sinteza protomerilor de tip M și H este codificată de doi loci genetici diferiți. Izoenzimele LDH diferă la nivelul structurii cuaternare: LDH 1 (HHHH), LDH 2 (HHHM), LDH 3 (HHMM), LDH 4 (HMMM), LDH 5 (MMMM).
Lanțurile polipeptidice de tip H și M au aceeași greutate moleculară, dar primele sunt dominate de aminoacizi carboxilici, cei din urmă de diaminoacizi, deci poartă o sarcină diferită și pot fi separate prin electroforeză.
Metabolismul oxigenului în țesuturi afectează compoziția izoenzimei LDH. Acolo unde domină metabolismul aerob, predomină LDH 1, LDH 2 (miocard, glandele suprarenale), unde metabolismul anaerob este LDH 4, LDH 5 (mușchii scheletici, ficat). În procesul de dezvoltare individuală a organismului în țesuturi, există o schimbare a conținutului de oxigen și a izoformelor LDH. La embrion predomină LDH 4, LDH 5. După naștere, în unele țesuturi există o creștere a conținutului de LDH 1, LDH 2.
Existența izoformelor crește capacitatea de adaptare a țesuturilor, organelor și a organismului în ansamblu la condițiile în schimbare. Prin modificarea compoziției izoenzimelor se evaluează starea metabolică a organelor și țesuturilor.
12. Proprietăţile enzimelor. Dependența vitezei de reacție enzimatică de concentrația enzimei și a substratului, temperatura și pH-ul mediului.
Natura proteică a enzimelor determină apariția în ele a unui număr de proprietăți care sunt în general necaracteristice catalizatorilor anorganici: oligodinamicitate, specificitate, dependența vitezei de reacție de temperatură, pH-ul mediului, concentrația enzimei și a substratului, prezența activatori și inhibitori.
Sub oligodinamic enzimele înțeleg eficiența ridicată a acțiunii în cantități foarte mici. O astfel de eficiență ridicată se explică prin faptul că moleculele de enzime se regenerează continuu în timpul activității lor catalitice. O moleculă tipică de enzimă se poate regenera de milioane de ori pe minut. Trebuie spus că catalizatorii anorganici sunt, de asemenea, capabili să accelereze conversia unei astfel de cantități de substanțe care este de multe ori mai mare decât propria lor masă. Dar niciun catalizator anorganic nu poate fi comparat cu enzimele din punct de vedere al eficienței.
Un exemplu este enzima renina, care este produsă de mucoasa gastrică a rumegătoarelor. O moleculă din acesta în 10 minute la 37°C este capabilă să provoace coagularea (coagularea) a aproximativ un milion de molecule de cazeinogen din lapte.
Un alt exemplu de eficiență ridicată a enzimelor este oferit de catalază. O moleculă a acestei enzime la 0°C descompune aproximativ 50.000 de molecule de peroxid de hidrogen pe secundă:
2 H2O2 2 H2O + O2
Acțiunea catalazei asupra peroxidului de hidrogen este de a schimba energia de activare a acestei reacții de la aproximativ 75 kJ/mol fără catalizator la 21 kJ/mol în prezența enzimei. Dacă platina coloidală este utilizată ca catalizator pentru această reacție, atunci energia de activare este de numai 50 kJ/mol.
7.2.2. Când se studiază influența oricărui factor asupra vitezei unei reacții enzimatice, toți ceilalți factori ar trebui să rămână neschimbați și, dacă este posibil, să aibă o valoare optimă.
O măsură a vitezei reacțiilor enzimatice este cantitatea de substrat care a suferit transformare pe unitatea de timp sau cantitatea de produs format. Modificarea vitezei se efectuează în stadiul inițial al reacției, când produsul este practic absent și nu are loc reacția inversă. În plus, în stadiul inițial al reacției, concentrația substratului corespunde cantității sale inițiale.
7.2.3. Dependența vitezei de reacție enzimatică (V) de concentrația enzimei [E](Figura 7.3). La o concentrație mare a substratului (de multe ori mai mare decât concentrația enzimei) și cu constanța altor factori, viteza reacției enzimatice este proporțională cu concentrația enzimei. Prin urmare, cunoscând viteza reacției catalizate de enzimă, se poate trage o concluzie despre cantitatea acesteia din materialul studiat.

Figura 7.3.Dependența vitezei reacției enzimatice de concentrația enzimei
7.2.4. Dependența vitezei de reacție de concentrația substratului [S]. Graficul dependenței are forma unei hiperbole (Figura 7.4). La o concentrație constantă a enzimei, viteza reacției catalizate crește odată cu creșterea concentrației de substrat până la valoarea maximă Vmax, după care rămâne constantă. Acest lucru ar trebui explicat prin faptul că, la concentrații mari de substrat, toate situsurile active ale moleculelor de enzime sunt legate de moleculele de substrat. Orice substrat în exces se poate lega de enzimă numai după ce produsul de reacție este format și site-ul activ este eliberat.

Figura 7.4.Dependența vitezei reacției enzimatice de concentrația substratului.
Dependența vitezei de reacție de concentrația substratului poate fi exprimată prin ecuația Michaelis-Menten:
 ,
,
unde V este viteza de reacție la concentrația substratului [S], Vmax este viteza maximă și KM este constanta Michaelis.
Constanta Michaelis este egală cu concentrația substratului la care viteza de reacție este jumătate din maxim. Determinarea KM și Vmax este de mare importanță practică, deoarece permite descrierea cantitativă a majorității reacțiilor enzimatice, inclusiv a reacțiilor care implică două sau mai multe substraturi. Diverse substanțe chimice care modifică activitatea enzimelor au efecte diferite asupra valorilor Vmax și KM.
7.2.5. Dependența vitezei de reacție de t - temperatura la care are loc reacția (Figura 7.5) este complex. Valoarea temperaturii la care viteza de reacție este maximă este temperatura optimă a enzimei. Temperatura optimă pentru majoritatea enzimelor din corpul uman este de aproximativ 40°C. Pentru majoritatea enzimelor, temperatura optimă este egală sau mai mare decât temperatura la care sunt păstrate celulele.

Figura 7.5. Dependența vitezei de reacție enzimatică de temperatură.
La temperaturi mai scăzute (0° - 40°C), viteza de reacție crește odată cu creșterea temperaturii. Când temperatura crește cu 10°C, viteza reacției enzimatice se dublează (coeficientul de temperatură Q10 este egal cu 2). Creșterea vitezei de reacție se explică prin creșterea energiei cinetice a moleculelor. Odată cu o creștere suplimentară a temperaturii, legăturile care susțin structura secundară și terțiară a enzimei se rup, adică denaturarea termică. Aceasta este însoțită de o pierdere treptată a activității catalitice.
7.2.6. Dependența vitezei de reacție de pH-ul mediului (Figura 7.6). La o temperatură constantă, enzima funcționează cel mai eficient într-un interval restrâns de pH. Valoarea pH-ului la care viteza de reacție este maximă este pH-ul optim al enzimei. Majoritatea enzimelor din corpul uman au un pH optim în intervalul de pH 6-8, dar există enzime care sunt active la valori ale pH-ului în afara acestui interval (de exemplu, pepsina, care este cea mai activă la pH 1,5-2,5). .
O modificare a pH-ului atât pe partea acidă, cât și pe cea alcalină față de cea optimă duce la o modificare a gradului de ionizare a grupurilor acide și bazice ale aminoacizilor care alcătuiesc enzima (de exemplu, grupele COOH de aspartat și glutamat, grupări NH2). de lizină etc.). Aceasta determină o modificare a conformației enzimei, rezultând o modificare a structurii spațiale a centrului activ și o scădere a afinității acestuia pentru substrat. În plus, la valori extreme ale pH-ului, enzima este denaturată și inactivată.

Figura 7.6. Dependența vitezei de reacție enzimatică de pH-ul mediului.
Trebuie remarcat faptul că pH-ul optim caracteristic unei enzime nu coincide întotdeauna cu pH-ul mediului său intracelular imediat. Acest lucru sugerează că mediul în care se află enzima își reglează activitatea într-o oarecare măsură.
7.2.7. Dependența vitezei de reacție de prezența activatorilor și inhibitorilor . Activatorii cresc viteza reacției enzimatice. Inhibitorii încetinesc viteza reacției enzimatice.
Ionii anorganici pot acționa ca activatori ai enzimelor. Se crede că acești ioni fac ca moleculele de enzimă sau substrat să adopte o conformație care promovează formarea unui complex enzimă-substrat. Aceasta crește probabilitatea interacțiunii dintre enzimă și substrat și, prin urmare, viteza reacției catalizate de enzimă. De exemplu, activitatea amilazei salivare este crescută în prezența ionilor de clorură.
13. Mecanismul de acţiune al enzimelor. Centru catalitic (activ). coenzime și cofactori. Inhibarea competitivă și necompetitivă. Utilizarea inhibitorilor competitivi ca medicamente.
centru activ (Ac) este o parte a moleculei de enzimă care interacționează în mod specific cu substratul și este direct implicată în cataliză. Ca, de regulă, este situat într-o nișă (buzunar). În Ac, se pot distinge două situsuri: locul de legare a substratului - zona substratului (pad de contact) și de fapt centru catalitic .
Majoritatea substraturilor formează cel puțin trei legături cu enzima, datorită cărora molecula de substrat este atașată la locul activ în singurul mod posibil, ceea ce asigură specificitatea de substrat a enzimei. Centrul catalitic oferă alegerea căii de transformare chimică și specificitatea catalitică a enzimei.
Un grup de enzime reglatoare au centrii alosterici , care se află în afara centrului activ. La centrul alosteric pot fi atașați modulatorii „+” sau „-“ care reglează activitatea enzimelor.
Există enzime simple, formate doar din aminoacizi, și complexe, care includ și compuși organici cu greutate moleculară mică de natură neproteică (coenzime) și (sau) ioni metalici (cofactori).
Coenzime - Acestea sunt substanțe organice de natură neproteică care participă la cataliză ca parte a situsului catalitic al centrului activ. În acest caz, se numește componenta proteică apoenzima și forma activă catalitic a unei proteine complexe - holoenzima . Astfel: holoenzima = apoenzima + coenzima.
Ele funcționează ca coenzime:
- pietre prețioase,
- nucleotide,
- coenzima Q,
- FAFS,
- Glutation
- derivați ai vitaminelor solubile în apă:
O coenzimă care este atașată unei proteine prin legături covalente se numește grupare prostetică . Acestea sunt, de exemplu, FAD, FMN, biotină, acid lipoic. Grupul protetic nu se separă de partea proteică. O coenzimă care este atașată la o proteină prin legături necovalente se numește cosubstrat . Acestea sunt, de exemplu, OVER +, NADP +. Cosubstratul este atașat de enzimă în momentul reacției.
Cofactori enzimatici - sunt ioni metalici necesari pentru manifestarea activitatii catalitice a multor enzime. Ca cofactori acționează ionii de potasiu, magneziu, calciu, zinc, cupru, fier etc. Rolul lor este variat, stabilizează moleculele substratului, situsul activ al enzimei, structura sa terțiară și cuaternară, asigură legarea substratului și cataliză. De exemplu, ATP unește kinazele numai împreună cu Mg2+.
14. Principalele mecanisme de reglare a acțiunii enzimelor și rolul acestora în reglarea metabolismului. Proenzime.
8.4.1. După cum sa menționat deja, enzimele sunt catalizatori a căror activitate poate fi reglată. Prin urmare, prin intermediul enzimelor, este posibil să se controleze rata reacțiilor chimice în curs de desfășurare în organism. Reglarea activității enzimelor poate fi realizată prin interacțiunea cu acestea a diferitelor componente biologice sau compuși străini (de exemplu, medicamente și otrăvuri), care sunt denumite în mod obișnuit. modificatori sau regulatori ai enzimelor. Sub acțiunea modificatorilor asupra enzimei, reacția poate fi accelerată (în acest caz se numesc activatori) sau încetiniți (caz în care sunt numite inhibitori).
8.4.2. Activarea enzimelor este determinată de accelerarea reacțiilor biochimice care are loc după acțiunea modificatorului. Un grup de activatori este format din substanțe care afectează regiunea locului activ al enzimei. Acestea includ cofactorii și substraturile enzimatice. Cofactorii (ionii metalici și coenzimele) nu sunt doar elemente structurale obligatorii ale enzimelor complexe, ci și activatori ai acestora.
Dintre ionii metalici, activitatea multor enzime este afectată de: NH4+, Na+, Mg2+, K+, Ca2+, Mn2+, Zn2+, Fe2+, Fe3+, Co2+. Ionii metalelor grele, de regulă, au un efect inhibitor. Acțiunea cationilor este în general destul de specifică, dar în majoritatea cazurilor enzima este activată de mai mult de un cation. Se observă și fenomenul de antagonism între ioni. Cel mai cunoscut antagonism este între Na+ și K+ și între Mg2+ și Ca2+.
Magneziul este un activator natural al enzimelor care acționează asupra substraturilor fosforilate (fosfataze, kinaze, sintetaze), dar în condiții in vitro poate fi înlocuit cu mangan.
Anionii au, în general, un efect redus asupra activității enzimelor, iar efectul lor este lipsit de specificitate. O excepție este amilaza, care este activată de cloruri și, într-o măsură mai mică, de alți halogeni. Efectul ionului de activare variază și în funcție de pH. Gradul de purificare a enzimei afectează, de asemenea, concentrația de activare a ionului și specificitatea activării. Enzimele foarte purificate se caracterizează printr-o selectivitate mai mare față de ionii de activare.
8.4.3. Efectul de activare al ionilor metalici este realizat în diferite moduri. Cel mai tipic mecanism este includerea unui ion în structura centrului catalitic al enzimei, care este inactiv fără el. Aceasta este o funcție tipică a metalului ca coenzimă. O altă funcție destul de comună a unui metal de activare este de a forma o legătură între o enzimă și un substrat sau între o enzimă, o coenzimă și un substrat. De exemplu, ionii Zn2+ din compoziția enzimei alcool dehidrogenază formează 2 legături de coordonare cu molecula de coenzimă NAD+, 3 legături de coordonare cu molecula de apoenzimă, iar a șasea legătură de coordonare atașează substratul.
Ionii metalici, precum și substraturile, coenzimele, precursorii acestora și analogii structurali, pot fi utilizați în practică ca medicamente care reglează activitatea enzimelor.
Dacă o proteină activă catalitic este numită enzimă (sau enzimă), atunci un precursor de enzimă inactiv se numește proenzimă (sau zimogen).
Activarea proteinelor prin proteoliză parțială este un proces larg răspândit în sistemele biologice. Aici sunt cateva exemple.
- enzimele digestive care hidrolizează proteinele sunt sintetizate în stomac și pancreas sub formă de proenzime: pepsina - sub formă de pepsinogen, tripsina - sub formă de tripsinogen etc.
- coagularea sângelui este o cascadă de reacții de activare proteolitică a proenzimelor. Acest lucru oferă un răspuns rapid la deteriorarea vasului de sânge.
- unii hormoni proteici sunt sintetizaţi ca precursori inactivi. De exemplu, insulina se formează din proinsulină.
- colagenul proteic al țesutului conjunctiv fibrilar se formează și din precursorul său, procolagenul.
15. Principiile determinării cantitative a enzimelor. Unități de activitate enzimatică. Principalele direcții de utilizare a enzimelor în medicină. Enzimodiagnostic, terapie enzimatică, utilizarea enzimelor ca reactivi.
Proprietatea unică a enzimelor de a accelera reacțiile chimice poate fi folosită pentru a cuantifica conținutul acestor biocatalizatori în materialul biologic (extract tisular, ser sanguin etc.). În condiții experimentale selectate corect, există aproape întotdeauna o proporționalitate între cantitatea de enzimă și viteza reacției catalizate; prin urmare, activitatea enzimei poate fi utilizată pentru a evalua conținutul său cantitativ în proba de testat.
Măsurarea activității enzimatice se bazează pe compararea vitezei unei reacții chimice în prezența unui biocatalizator activ cu viteza de reacție într-o soluție de control în care enzima este absentă sau inactivată.
Materialul de testat este plasat într-un mediu de incubare, unde se creează temperatura optimă, pH-ul mediului, concentrațiile de activatori și substraturi. În același timp, se pune o probă de control, în care nu se adaugă enzima. După un timp, reacția este oprită prin adăugarea diverșilor reactivi (schimbarea pH-ului mediului, provocând denaturarea proteinelor etc.) și analizând probele.
Pentru a determina viteza unei reacții enzimatice, trebuie să știți:
- diferența de concentrație a substratului sau a produsului de reacție înainte și după incubare;
- timpul de incubație;
- cantitatea de material luată pentru analiză.
Activitatea unei enzime este cel mai adesea evaluată prin cantitatea de produs de reacție rezultat. Acest lucru se face, de exemplu, atunci când se determină activitatea alanin aminotransferazei, care catalizează următoarea reacție:
Activitatea enzimatică poate fi calculată și pe baza cantității de substrat consumată. Un exemplu este o metodă pentru determinarea activității α-amilazei, o enzimă care descompune amidonul. Măsurând conținutul de amidon din probă înainte și după incubare și calculând diferența, se găsește cantitatea de substrat divizată în timpul incubației.
Există un număr mare de metode de măsurare a activității enzimatice, care diferă în tehnică, specificitate și sensibilitate.
Cel mai adesea folosit pentru a determina metode fotoelectrocolorimetrice . Aceste metode se bazează pe reacții de culoare cu unul dintre produsele de acțiune a enzimelor. În acest caz, intensitatea culorii soluțiilor rezultate (măsurată pe un colorimetru fotoelectric) este proporțională cu cantitatea de produs rezultat. De exemplu, în cursul reacțiilor catalizate de aminotransferaze, se acumulează α-cetoacizi, care dau compuși roșu-brun cu 2,4-dinitrofenilhidrazină:
Dacă biocatalizatorul studiat are o specificitate scăzută de acțiune, atunci este posibil să se aleagă un astfel de substrat, ca urmare a reacției cu care se formează un produs colorat. Un exemplu este determinarea fosfatazei alcaline, o enzimă care este răspândită în țesuturile umane; activitatea sa în plasma sanguină se modifică semnificativ în bolile ficatului și ale sistemului osos. Această enzimă într-un mediu alcalin hidrolizează un grup mare de esteri fosforici, atât naturali, cât și sintetici. Unul dintre substraturile sintetice este fosfatul de paranitrofenil (incolor), care într-un mediu alcalin se împarte în ortofosfat și paranitrofenol (galben).
Progresul reacției poate fi observat prin măsurarea intensității culorii care crește treptat a soluției:
Pentru enzimele cu o specificitate mare de acțiune, o astfel de selecție a substraturilor este, de regulă, imposibilă.
Metode spectrofotometrice se bazează pe modificarea spectrului ultraviolet al substanțelor chimice implicate în reacție. Majoritatea compușilor absorb razele ultraviolete, iar lungimile de undă absorbite sunt caracteristice anumitor grupuri de atomi prezente în moleculele acestor substanțe. Reacțiile enzimatice provoacă rearanjamente intramoleculare, în urma cărora spectrul ultraviolet se modifică. Aceste modificări pot fi înregistrate pe un spectrofotometru.
Metodele spectrofotometrice, de exemplu, determină activitatea enzimelor redox care conțin NAD sau NADP ca coenzime. Aceste coenzime acționează ca acceptori sau donatori de atomi de hidrogen și sunt astfel fie reduse, fie oxidate în procesele metabolice. Formele reduse ale acestor coenzime au un spectru ultraviolet cu un maxim de absorbție la 340 nm, formele oxidate nu au acest maxim. Deci, sub acțiunea lactat dehidrogenazei asupra acidului lactic, hidrogenul este transferat în NAD, ceea ce duce la o creștere a absorbției NADH la 340 nm. Valoarea acestei absorbții în unități optice este proporțională cu cantitatea de forma redusă rezultată a coenzimei.
Prin modificarea conținutului formei reduse a coenzimei, se poate determina activitatea enzimei.
Metode fluorometrice. Aceste metode se bazează pe fenomenul fluorescenței, care constă în faptul că obiectul studiat sub influența iradierii emite lumină cu o lungime de undă mai mică. Metodele fluorometrice pentru determinarea activității enzimatice sunt mai sensibile decât metodele spectrofotometrice. Relativ noi și chiar mai sensibile sunt metode chemiluminiscente folosind sistemul luciferină-luciferază. Astfel de metode fac posibilă determinarea vitezei reacțiilor care au loc cu formarea ATP. Când luciferina (un acid carboxilic complex) interacționează cu ATP, se formează adenilatul de luciferil. Acest compus este oxidat cu participarea enzimei luciferazei, care este însoțită de un fulger de lumină. Măsurând intensitatea fulgerelor luminoase, se poate determina cantitatea de ATP de ordinul mai multor picomoli (10-12 mol).
Metode titrimetrice . O serie de reacții enzimatice sunt însoțite de o modificare a pH-ului amestecului de incubare. Un exemplu de astfel de enzimă este lipaza pancreatică. Lipaza catalizează reacția:
Acizii grași rezultați pot fi titrați, iar cantitatea de alcali folosită pentru titrare va fi proporțională cu cantitatea de acizi grași eliberați și, în consecință, cu activitatea lipazei. Determinarea activității acestei enzime este de importanță clinică.
Metode de măsurare se bazează pe măsurarea într-un vas de reacție închis a volumului de gaz eliberat (sau absorbit) în timpul reacției enzimatice. Cu ajutorul unor astfel de metode, au fost descoperite și studiate reacțiile de decarboxilare oxidativă a acizilor piruvic și α-cetoglutaric, care procedează cu eliberarea de CO2. În prezent, aceste metode sunt rar utilizate.
Comisia Internațională pentru Enzimă a propus unitate de activitate a oricărei enzime să accepte o astfel de cantitate de enzimă care, în condiții date, catalizează conversia unui micromol (10-6 moli) de substrat pe unitatea de timp (1 min, 1 oră) sau a unui microechivalent al grupului afectat în cazuri unde este atacată mai mult de un grup din fiecare moleculă de substrat (proteine, polizaharide și altele). Se va preciza temperatura la care se desfășoară reacția. Rezultatele măsurătorilor activității enzimelor pot fi exprimate în unități activitate totală, specifică și moleculară.
Pentru o unitate activitatea totală a enzimei pe baza cantității de material luate pentru cercetare. Astfel, activitatea alanin aminotransferazei în ficatul șobolanilor este de 1670 μmol piruvat pe oră la 1 g de țesut; Activitatea colinesterazei în serul uman este de 250 μmol acid acetic pe oră per 1 ml de ser la 37°C.
O atenție deosebită a cercetătorului este cerută de valorile ridicate ale activității enzimatice atât în condiții normale, cât și patologice. Se recomandă lucrul cu niveluri scăzute de activitate enzimatică. Pentru a face acest lucru, sursa enzimei este luată într-o cantitate mai mică (serul este diluat de mai multe ori cu soluție salină și se prepară un procent mai mic de omogenat pentru țesut). În raport cu enzima, în acest caz, se creează condiții de saturație cu substratul, ceea ce contribuie la manifestarea adevăratei sale activități.
Activitatea totală a enzimei se calculează folosind formula:
Unde A- activitate enzimatică (totală), ∆C- diferența de concentrații de substrat înainte și după incubare; LA- cantitatea de material luată pentru analiză, t- timpul de incubație; n- reproducere.
Trebuie avut în vedere faptul că indicatorii activității enzimelor din serul sanguin și urina examinați în scopuri de diagnostic sunt exprimați în unități de activitate totală.
Deoarece enzimele sunt proteine, este important să se cunoască nu numai activitatea totală a enzimei din materialul de testat, ci și activitatea enzimatică a proteinei prezente în probă. Pentru o unitate activitate specifică luați o astfel de cantitate de enzimă care catalizează conversia a 1 μmol de substrat pe unitatea de timp per 1 mg de probă de proteină. Pentru a calcula activitatea specifică a unei enzime, este necesar să se împartă activitatea totală la conținutul de proteine din probă:
Cu cât enzima este mai prost purificată, cu cât proteinele de balast sunt mai străine în probă, cu atât activitatea specifică este mai mică. În timpul purificării, cantitatea de astfel de proteine scade și, în consecință, activitatea specifică a enzimei crește. Să presupunem că în materialul biologic original, care este sursa enzimei (ficat mărunțit, suspensie din țesutul vegetal), activitatea specifică a fost de 0,5 µmol/(mg proteină×min). După precipitarea fracționată cu sulfat de amoniu și filtrare pe gel prin Sephadex, a crescut la 25 µmol/(mg proteină x min), adică. crescut de 50 de ori. Evaluarea eficienței purificării preparatelor enzimatice este utilizată în producția de medicamente de natură enzimatică.
Activitatea specifică este determinată atunci când este necesară compararea activității diferitelor preparate ale aceleiași enzime. Dacă este necesară compararea activității diferitelor enzime, se calculează activitatea moleculară.
Activitatea moleculară (sau numărul de rotații ale enzimei) este numărul de moli ai substratului care suferă conversie sub acțiunea a 1 mol de enzimă pe unitatea de timp (de obicei 1 minut). Diferite enzime au activități moleculare diferite. Scăderea numărului de turnover-uri enzimatice are loc sub acţiunea inhibitorilor necompetitivi. Prin modificarea conformației centrului catalitic al enzimei, aceste substanțe reduc afinitatea enzimei pentru substrat, ceea ce duce la scăderea numărului de molecule de substrat care reacționează cu o moleculă de enzimă pe unitatea de timp.
16. Nutriția este o parte integrantă a metabolismului. Principalele componente ale dietei și rolul lor. Componente înlocuibile și de neînlocuit ale dietei. Dieta echilibrata. Consecințele alimentației dezechilibrate la copii .
complet numită dietă care satisface nevoile energetice ale unei persoane și conține cantitatea necesară de nutrienți esențiali care asigură creșterea și dezvoltarea normală a organismului.
Factori care afectează nevoia organismului de energie și nutrienți: sexul, vârsta și greutatea corporală a unei persoane, activitatea sa fizică, condițiile climatice, caracteristicile biochimice, imunologice și morfologice ale corpului.
Toți nutrienții pot fi împărțiți în cinci clase:
1. proteine; 2. grăsimi; 3. carbohidrați; 4. vitamine; 5. minerale.
În plus, orice dietă ar trebui să conțină apă ca solvent universal.
Componentele esențiale ale dietei sunt:
- aminoacizi esentiali - valina, izoleucina, leucina, lizina, metionina, fenilalanina, treonina, triptofanul;
- acizi grași esențiali (esențiali) - linoleic, linolenic, arahidonic;
- vitamine solubile în apă și grăsimi;
- elemente anorganice (minerale) - calciu, potasiu, sodiu, clor, cupru, fier, crom, fluor, iod și altele.
11.1.2. Dieta echilibrata. O dietă care conține nutrienți într-un raport optim pentru satisfacerea maximă a nevoilor plastice și energetice ale corpului uman se numește dieta echilibrata. Se crede că cel mai favorabil raport de proteine, grăsimi și carbohidrați este aproape de 1:1:4, cu condiția ca conținutul total de calorii al dietei să corespundă consumului de energie al unei anumite persoane. Deci, pentru un student de sex masculin care cântărește 60 kg, energia costă în medie 2900 kcal pe zi, iar dieta ar trebui să conțină: 80-100 g de proteine, 90 g de grăsimi, 300-400 g de carbohidrați.
17. Valoarea biologică a proteinelor alimentare. Cantitatea și calitatea proteinelor din alimentația umană. Aminoacizi înlocuibili și de neînlocuit. O combinație de produse alimentare care se completează între ele în compoziția de aminoacizi. Caracteristicile dietei proteice a copiilor. Consecințele nutriției insuficiente cu proteine la copii.
Rolul biologic al proteinelor alimentare constă în faptul că ei servesc drept sursă de neînlocuitși înlocuibil aminoacizi. Aminoacizii sunt folosiți de organism pentru a-și sintetiza propriile proteine; ca precursori ai substanţelor azotate neproteice (hormoni, purine, porfirine etc.); ca sursă de energie (oxidarea a 1 g de proteine dă aproximativ 4 kcal de energie).
Proteinele dietetice sunt împărțite în complete și incomplete.
Proteine alimentare complete - de origine animala, contin toti aminoacizii in proportiile necesare si sunt bine absorbiti de organism.
Proteine incomplete - de origine vegetala, nu contin, sau contin in cantitate insuficienta unul sau mai multi aminoacizi esentiali. Astfel, culturile de cereale sunt deficitare în lizină, metionină, treonină; proteina din cartofi conține puțină metionină și cisteină. Pentru a obține diete complete cu proteine, ar trebui să combinați proteine vegetale care se completează între ele în compoziția de aminoacizi, de exemplu, porumb și fasole.
Necesar zilnic: cel putin 50 g pe zi, in medie 80-100 g.
11.2.2. Deficitul de proteine în copilărie cauze: 1. scaderea rezistentei organismului la infectii; 2. oprirea creșterii din cauza sintezei deteriorate a factorilor de creștere; 3. insuficiență energetică a organismului (epuizarea depozitelor de carbohidrați și grăsimi, catabolismul proteinelor tisulare); 4. pierdere in greutate - hipotrofie. Cu înfometarea de proteine, se observă edem, care apare din cauza scăderii conținutului de proteine din sânge ( hipoalbuminemie) și tulburări în distribuția apei între sânge și țesuturi.
18. Digestia proteinelor. Proteinaze. Mecanismul de activare a proteinazelor din tractul gastrointestinal . Specificitatea (selectivitatea) hidrolizei legăturilor peptidice. Caracteristicile digestiei proteinelor în sugari, tulburări de digestie a proteinelor la copii . Putrefacția proteinelor (aminoacizii) în intestinul gros.
Digestia proteinelor, adică descompunerea lor în aminoacizi individuali, începe în stomac și se termină în intestinul subțire. Digestia are loc sub acțiunea sucurilor gastrice, pancreatice și intestinale, care conțin enzime proteolitice (proteaze sau peptidaze). Enzimele proteolitice aparțin clasei hidrolazelor. Ele catalizează hidroliza legăturilor peptidice CO-NH molecula proteica.
Toate enzimele proteolitice pot fi împărțite în două grupe:
- exopeptidază- catalizează ruperea legăturii peptidice terminale cu eliberarea aminoacidului N- sau C-terminal;
- endopeptidaza- hidrolizează legăturile peptidice din cadrul lanțului polipeptidic, produșii de reacție sunt peptide cu greutate moleculară mai mică.
10.1.3. Majoritatea enzimelor proteolitice implicate în digestia proteinelor și peptidelor sunt sintetizate și eliberate în cavitatea tractului digestiv sub formă de precursori inactivi - proenzime (zimogeni). Prin urmare, nu există digestia proteinelor celulelor care produc proenzime. Activarea proenzimelor se realizează în lumenul tractului gastrointestinal prin proteoliză parțială - scindarea unei părți a lanțului peptidic al zimogenului.
Cea mai mare parte a aminoacizilor formați în tractul digestiv ca urmare a digestiei proteinelor este absorbită în sânge și completează fondul de aminoacizi al organismului. O anumită cantitate de aminoacizi neabsorbiți suferă putrefacție în intestinul gros.
putrezind - transformări ale aminoacizilor cauzate de activitatea microorganismelor din intestinul gros. Consolidarea proceselor de degradare a aminoacizilor poate contribui la:
- aportul excesiv de proteine din alimente;
- tulburări congenitale și dobândite ale procesului de absorbție a aminoacizilor în intestin;
- scaderea motilitatii intestinale.
Ca urmare a degradarii aminoacizilor, se formează diverse substanțe, dintre care multe sunt toxice pentru organism. Câteva exemple de produse de degradare sunt date în Tabelul 10.2.
Tabelul 10.2
Produse de descompunere ai aminoacizilor din intestine.
10.2.2. Produșii de descompunere ai aminoacizilor sunt xenobiotice- substanțe care sunt străine organismului uman și trebuie neutralizate (inactivate).
19. Rolul lipidelor în organism. Lipide alimentare, necesar zilnic la copii de diferite vârste. Caracteristici ale utilizării lipidelor în diferite țesuturi. Țesut adipos brun. Depunerea și mobilizarea grăsimilor în țesutul adipos. Obezitatea.
Compoziția grăsimilor dietetice include în principal triacilgliceroli (98%), fosfolipide și colesterol. Triacilglicerolii de origine animală sunt bogati în acizi grași saturați și au o textură fermă. Grăsimile vegetale conțin mai mulți acizi grași nesaturați și au o consistență lichidă (uleiuri).
Rolul biologic: 1. sunt una dintre principalele surse de energie; 2. servesc ca sursă de acizi grași polinesaturați esențiali; 3. contribuie la absorbția vitaminelor liposolubile din intestine. Acizi grași polinesaturați necesare organismului pentru a construi fosfolipide, care formează baza tuturor structurilor membranare ale celulei și lipoproteinelor din sânge. În plus, acidul linoleic este utilizat pentru a sintetiza acidul arahidonic, care servește ca precursor pentru prostaglandine, prostacicline, tromboxani și leucotriene.
Necesar zilnic: 90-100 g, din care 30% ar trebui să fie uleiuri vegetale. Valoarea nutritivă a grăsimilor vegetale este mai mare decât a grăsimilor animale, deoarece cu un efect energetic egal - 9 kcal la 1 g, acestea conțin mai mulți acizi grași esențiali.
11.3.2. Încălcarea raportului dintre proporția de grăsimi vegetale și animale din dietă duce la o modificare a raportului dintre diferitele clase de lipoproteine din sânge și, ca urmare, la boli coronariene și ateroscleroză.
20. Digestia grăsimilor. Lipaze și fosfolipaze. Acizi biliari și acizi biliari perechi: structură, formare, rol biologic. Particularități ale digestiei lipidelor la copii . Tulburări de digestie a lipidelor.
Locul principal al digestiei lipidelor este intestinul subțire superior. Următoarele condiții sunt necesare pentru digestia lipidelor:
- prezența enzimelor lipolitice;
- condiții pentru emulsionarea lipidelor;
- valori optime ale pH-ului mediului (în intervalul 5,5 - 7,5).
10.3.2. Diferite enzime sunt implicate în descompunerea lipidelor. Grăsimile alimentare la un adult sunt descompuse în principal de lipaza pancreatică; lipaza se găsește și în sucul intestinal, în salivă; la sugari, lipaza este activă în stomac. Lipazele aparțin clasei hidrolazelor, ele hidrolizează legăturile esterice -O-CO- cu formarea de acizi grași liberi, diacilgliceroli, monoacilgliceroli, glicerol
Glicerofosfolipidele alimentare sunt expuse la hidrolaze specifice - fosfolipaze care scindează legăturile esterice dintre componentele fosfolipidelor. Specificitatea acțiunii fosfolipazelor este prezentată în Figura 10.4.

Figura 10.4. Specificitatea acțiunii enzimelor care descompun fosfolipidele.
Produsele hidrolizei fosfolipidelor sunt acizi grași, glicerol, fosfat anorganic, baze azotate (colină, etanolamină, serină).
Esterii de colesterol din dietă sunt hidrolizați de colesterol esteraza pancreatică pentru a forma colesterol și acizi grași.
10.3.3. Înțelegeți caracteristicile structurale ale acizilor biliari și rolul lor în digestia grăsimilor. Acizii biliari sunt produsul final al metabolismului colesterolului și sunt produși în ficat. Acestea includ: acizii colic (3,7,12-trioxicolanic), chenodeoxicolanic (3,7-dioxicolanic) și deoxicolic (3,12-dioxicolanic) (Figura 10.5, a). Primii doi sunt acizi biliari primari (formați direct în hepatocite), deoxicolici - secundari (deoarece se formează din acizi biliari primari sub influența microflorei intestinale).
În bilă, acești acizi sunt prezenți într-o formă conjugată, adică. sub formă de compuși cu glicină H2N-CH2-COOH sau taurină H2N-CH2-CH2-SO3H(Figura 10.5, b).

Figura 10.5. Structura acizilor biliari neconjugați (a) și conjugați (b).
15.1.4. Acizii biliari au amfifil proprietăți: grupările hidroxil și lanțul lateral sunt hidrofile, structura ciclică este hidrofobă. Aceste proprietăți determină participarea acizilor biliari la digestia lipidelor:
1) acizii biliari sunt capabili de emulsiona grăsimile, moleculele lor cu partea lor nepolară sunt adsorbite pe suprafața picăturilor de grăsime, în același timp, grupele hidrofile interacționează cu mediul acvatic înconjurător. Ca urmare, tensiunea superficială la interfața dintre faza lipidică și cea apoasă scade, drept urmare picăturile mari de grăsime sunt rupte în altele mai mici;
2) acizii biliari, împreună cu colipaza biliară, sunt implicați în activarea lipazei pancreatice, deplasându-și pH-ul optim către partea acidă;
3) acizii biliari formează complexe solubile în apă cu produși hidrofobi ai digestiei grăsimilor, ceea ce contribuie la aspiraţieîn peretele intestinului subțire.
Acizii biliari, care pătrund în enterocite împreună cu produsele hidrolizei în timpul absorbției, intră în ficat prin sistemul portal. Acești acizi pot fi resecretați în bilă în intestin și pot participa la procesele de digestie și absorbție. Astfel de circulatie enterohepatica acizii biliari pot fi administrați de până la 10 sau mai multe ori pe zi.
Structura și nivelurile de organizare structurală a proteinelor
Există patru niveluri de organizare structurală a proteinelor: primar, secundar, terțiar și cuaternar. Fiecare nivel are propriile sale caracteristici.
Structura primară a unei proteine
Structura primară a proteinelor este un lanț polipeptidic liniar de aminoacizi legați prin legături peptidice. Structura primară este cel mai simplu nivel de organizare structurală a unei molecule de proteine. Stabilitate ridicată îi este dată de legăturile peptidice covalente dintre gruparea α-amino a unui aminoacid și gruparea α-carboxil a unui alt aminoacid. [spectacol].
Dacă gruparea imino a prolinei sau hidroxiprolinei este implicată în formarea unei legături peptidice, atunci are o formă diferită [spectacol].
Când se formează legături peptidice în celule, gruparea carboxil a unui aminoacid este mai întâi activată și apoi se combină cu gruparea amino a altuia. Aproximativ același lucru se realizează sinteza de laborator a polipeptidelor.
O legătură peptidică este un fragment repetat al unui lanț polipeptidic. Are o serie de caracteristici care afectează nu numai forma structurii primare, ci și cele mai înalte niveluri de organizare a lanțului polipeptidic:

coplanaritate - toți atomii din grupul peptidic sunt în același plan;
capacitatea de a exista în două forme rezonante (forma ceto sau enol);
poziţia trans a substituenţilor în raport cu legătura C-N;
· capacitatea de a forma legături de hidrogen, iar fiecare dintre grupele peptidice poate forma două legături de hidrogen cu alte grupări, inclusiv cu cele peptidice.
Excepție fac grupele peptidice cu participarea grupării amino a prolinei sau hidroxiprolinei. Ele sunt capabile să formeze o singură legătură de hidrogen (vezi mai sus). Acest lucru afectează formarea structurii secundare a proteinei. Lanțul polipeptidic de la locul unde se află prolina sau hidroxiprolina este ușor îndoit, deoarece nu este ținut, ca de obicei, de o a doua legătură de hidrogen.
Nomenclatura peptidelor și polipeptidelor. Numele peptidelor este format din numele aminoacizilor lor constituenți. Doi aminoacizi formează o dipeptidă, trei o tripeptidă, patru o tetrapeptidă etc. Fiecare peptidă sau lanț polipeptidic de orice lungime are un aminoacid N-terminal care conține o grupare amino liberă și un aminoacid C-terminal care conține o grupare carboxil liberă. La denumirea polipeptidelor, toți aminoacizii sunt enumerați secvențial, începând de la N-terminal, înlocuind în numele lor, cu excepția terminalului C, sufixul -in la -il (deoarece aminoacizii din peptide nu mai au o grupare carboxil, ci unul carbonil). De exemplu, numele prezentat în Fig. 1 tripeptidă - leuc nămol fenilalan nămol treon în.
Caracteristicile structurii primare a proteinei. În coloana vertebrală a lanțului polipeptidic, structurile rigide (grupuri de peptide plate) alternează cu regiuni relativ mobile (-CHR) care sunt capabile să se rotească în jurul legăturilor. Astfel de caracteristici ale structurii lanțului polipeptidic afectează împachetarea acestuia în spațiu.
Dar viața de pe planeta noastră a apărut dintr-o picătură coacervată. Era, de asemenea, o moleculă de proteină. Adică, rezultă concluzia că acești compuși chimici sunt baza întregii vieți care există astăzi. Dar ce sunt structurile proteinelor? Ce rol joacă ei în viața corpului și a oamenilor astăzi? Ce tipuri de proteine există? Să încercăm să ne dăm seama.
Proteine: un concept general
Din punct de vedere, molecula substanței în cauză este o secvență de aminoacizi interconectați prin legături peptidice.
Fiecare aminoacid are două grupe funcționale:
- carboxil -COOH;
- o grupare amino -NH2.
Între ele are loc formarea de legături în diferite molecule. Astfel, legătura peptidică are forma -CO-NH. O moleculă de proteină poate conține sute sau mii de astfel de grupuri, va depinde de substanța specifică. Tipurile de proteine sunt foarte diverse. Printre acestea se numara si cele care contin aminoacizi esentiali pentru organism, ceea ce inseamna ca trebuie ingerati cu alimente. Există soiuri care îndeplinesc funcții importante în membrana celulară și citoplasma acesteia. Sunt izolați și catalizatorii biologici - enzime, care sunt și molecule de proteine. Ele sunt utilizate pe scară largă în viața umană și nu participă doar la procesele biochimice ale ființelor vii.
Greutatea moleculară a compușilor luați în considerare poate varia de la câteva zeci la milioane. La urma urmei, numărul de unități monomerice dintr-un lanț polipeptidic mare este nelimitat și depinde de tipul unei anumite substanțe. Proteina în forma sa pură, în conformația sa nativă, poate fi văzută atunci când se examinează un ou de găină într-o masă coloidală galben deschis, transparentă, densă, în interiorul căreia se află gălbenușul - aceasta este substanța dorită. Același lucru se poate spune despre brânza de vaci fără grăsimi.Acest produs este, de asemenea, proteine aproape pure în forma sa naturală.

Cu toate acestea, nu toți compușii luați în considerare au aceeași structură spațială. În total, se disting patru organizații ale moleculei. Speciile își determină proprietățile și vorbesc despre complexitatea structurii. De asemenea, se știe că moleculele mai încurcate spațial sunt supuse unei procesări extinse la oameni și animale.
Tipuri de structuri proteice
Sunt patru în total. Să aruncăm o privire la ce este fiecare dintre ele.
- Primar. Reprezintă secvența liniară obișnuită de aminoacizi conectați prin legături peptidice. Nu există răsturnări spațiale, nici spiralizare. Numărul de legături incluse în polipeptidă poate ajunge la câteva mii. Tipuri de proteine cu o structură similară sunt glicilalanina, insulina, histonele, elastina și altele.
- Secundar. Este format din două lanțuri polipeptidice care sunt răsucite sub formă de spirală și orientate unul spre celălalt prin ture formate. În acest caz, între ele se formează legături de hidrogen, ținându-le împreună. Așa se formează o singură moleculă de proteină. Tipurile de proteine de acest tip sunt următoarele: lizozimă, pepsină și altele.
- Conformatia tertiara. Este o structură secundară compactă și compactă. Aici apar și alte tipuri de interacțiuni, pe lângă legăturile de hidrogen - aceasta este interacțiunea van der Waals și forțele de atracție electrostatică, contact hidrofil-hidrofob. Exemple de structuri sunt albumina, fibroina, proteina de mătase și altele.
- Cuaternar. Cea mai complexă structură, care este mai multe lanțuri de polipeptide răsucite într-o spirală, rostogolite într-o bilă și unite toate împreună într-un glob. Exemple precum insulina, feritina, hemoglobina, colagenul ilustrează tocmai o astfel de conformație a proteinei.
Dacă luăm în considerare toate structurile date ale moleculelor în detaliu din punct de vedere chimic, atunci analiza va dura mult timp. Într-adevăr, cu cât configurația este mai mare, cu atât structura sa mai complexă și mai complicată, cu atât se observă mai multe tipuri de interacțiuni în moleculă.

Denaturarea moleculelor proteice
Una dintre cele mai importante proprietăți chimice ale polipeptidelor este capacitatea lor de a se descompune sub influența anumitor condiții sau agenți chimici. De exemplu, diferite tipuri de denaturare a proteinelor sunt larg răspândite. Ce este acest proces? Constă în distrugerea structurii native a proteinei. Adică, dacă inițial molecula avea o structură terțiară, atunci după acțiunea agenților speciali se va prăbuși. Cu toate acestea, secvența reziduurilor de aminoacizi rămâne neschimbată în moleculă. Proteinele denaturate își pierd rapid proprietățile fizice și chimice.
Ce reactivi pot duce la procesul de distrugere a conformației? Sunt câteva.
- Temperatura. Când este încălzit, are loc o distrugere treptată a structurii cuaternare, terțiare, secundare a moleculei. Vizual, acest lucru poate fi observat, de exemplu, atunci când prăjiți un ou obișnuit de găină. „Proteina” rezultată este structura primară a polipeptidei albuminei care a fost în produsul brut.
- Radiația.
- Acțiunea agenților chimici puternici: acizi, alcaline, săruri ale metalelor grele, solvenți (de exemplu, alcooli, eteri, benzen și altele).
Acest proces este uneori numit și topirea moleculei. Tipurile de denaturare a proteinelor depind de agentul sub a cărui acțiune s-a produs. În plus, în unele cazuri, are loc procesul invers. Aceasta este renaturarea. Nu toate proteinele sunt capabile să-și restabilească structura înapoi, dar o parte semnificativă dintre ele poate face acest lucru. Așadar, chimiști din Australia și America au efectuat renaturarea unui ou fiert de găină folosind niște reactivi și o metodă de centrifugare.
Acest proces este important pentru organismele vii în sinteza lanțurilor polipeptidice de către ribozomi și ARNr în celule.

Hidroliza unei molecule de proteine
Alături de denaturare, proteinele se caracterizează printr-o altă proprietate chimică - hidroliza. Aceasta este, de asemenea, distrugerea conformației native, dar nu a structurii primare, ci complet a aminoacizilor individuali. O parte importantă a digestiei este hidroliza proteinelor. Tipurile de hidroliză a polipeptidelor sunt următoarele.
- Chimic. Pe baza acțiunii acizilor sau alcalinelor.
- Biologic sau enzimatic.
Cu toate acestea, esența procesului rămâne neschimbată și nu depinde de ce tipuri de hidroliză a proteinelor au loc. Ca rezultat, se formează aminoacizi, care sunt transportați către toate celulele, organele și țesuturile. Transformarea lor ulterioară constă în participarea la sinteza de noi polipeptide, deja cele care sunt necesare pentru un anumit organism.
În industrie, procesul de hidroliză a moleculelor de proteine este utilizat doar pentru a obține aminoacizii doriti.

Funcțiile proteinelor în organism
Diferite tipuri de proteine, carbohidrați, grăsimi sunt componente vitale pentru funcționarea normală a oricărei celule. Și asta înseamnă întregul organism ca întreg. Prin urmare, rolul lor se datorează în mare măsură gradului ridicat de semnificație și ubicuitate în cadrul ființelor vii. Există mai multe funcții principale ale moleculelor polipeptidice.
- catalitic. Este realizat de enzime care au o structură proteică. Despre ele vom vorbi mai târziu.
- Structural. Tipurile de proteine și funcțiile lor în organism afectează în primul rând structura celulei în sine, forma acesteia. În plus, polipeptidele care îndeplinesc acest rol formează păr, unghii, cochilii de moluște și pene de pasăre. Ele sunt, de asemenea, o anumită armătură în corpul celulei. Cartilajul este, de asemenea, format din aceste tipuri de proteine. Exemple: tubulina, keratina, actina si altele.
- de reglementare. Această funcție se manifestă prin participarea polipeptidelor la procese precum: transcripție, traducere, ciclu celular, splicing, citire ARNm și altele. În toate acestea, ei joacă un rol important ca regulator.
- Semnal. Această funcție este îndeplinită de proteinele situate pe membrana celulară. Ei transmit semnale diferite de la o unitate la alta, iar acest lucru duce la comunicarea între țesuturi. Exemple: citokine, insulina, factori de creștere și altele.
- Transport. Unele tipuri de proteine și funcțiile lor pe care le îndeplinesc sunt pur și simplu vitale. Acest lucru se întâmplă, de exemplu, cu hemoglobina proteică. Transporta oxigenul de la celula la celula in sange. Pentru o persoană este de neînlocuit.
- Rezervă sau rezervă. Astfel de polipeptide se acumulează în plante și ouă de animale ca o sursă de nutriție și energie suplimentară. Un exemplu sunt globulinele.
- Motor. O funcție foarte importantă, mai ales pentru cele mai simple organisme și bacterii. La urma urmei, ei se pot mișca numai cu ajutorul flagelilor sau cililor. Și aceste organite, prin natura lor, nu sunt altceva decât proteine. Exemple de astfel de polipeptide sunt următoarele: miozină, actină, kinesină și altele.
Evident, funcțiile proteinelor din corpul uman și ale altor ființe vii sunt foarte numeroase și importante. Acest lucru confirmă încă o dată că fără compușii pe care îi luăm în considerare, viața pe planeta noastră este imposibilă.

Funcția protectoare a proteinelor
Polipeptidele pot proteja împotriva diferitelor influențe: chimice, fizice, biologice. De exemplu, dacă organismul este în pericol sub forma unui virus sau bacterii de natură extraterestră, atunci imunoglobulinele (anticorpii) intră în luptă cu ele, îndeplinind un rol protector.
Dacă vorbim despre efecte fizice, atunci fibrina și fibrinogenul, care sunt implicate în coagularea sângelui, joacă un rol important aici.
Proteinele alimentare
Tipurile de proteine din dietă sunt următoarele:
- complete - cele care contin toti aminoacizii necesari organismului;
- incomplete - cele în care există o compoziție incompletă de aminoacizi.
Cu toate acestea, ambele sunt importante pentru corpul uman. Mai ales primul grup. Fiecare persoană, mai ales în perioadele de dezvoltare intensivă (copilărie și adolescență) și pubertate, trebuie să mențină în sine un nivel constant de proteine. La urma urmei, am luat deja în considerare funcțiile pe care le îndeplinesc aceste molecule uimitoare și știm că practic nici un singur proces, nici o singură reacție biochimică din interiorul nostru nu poate face fără participarea polipeptidelor.
De aceea, este necesar să se consume în fiecare zi norma zilnică de proteine conținute în următoarele produse:
- ou;
- lapte;
- brânză de vacă;
- carne si peste;
- fasole;
- fasole;
- arahide;
- grâu;
- ovăz;
- linte și altele.
Dacă cineva consumă 0,6 g de polipeptidă pe kg de greutate pe zi, atunci unei persoane nu îi vor lipsi niciodată acești compuși. Dacă pentru o lungă perioadă de timp organismul nu primește proteinele necesare, atunci apare o boală, care poartă numele de foamete de aminoacizi. Acest lucru duce la tulburări metabolice severe și, ca urmare, la multe alte afecțiuni.

Proteine într-o celulă
În interiorul celei mai mici unități structurale dintre toate ființele vii - celulele - există și proteine. În plus, ele îndeplinesc aproape toate funcțiile de mai sus acolo. În primul rând, se formează citoscheletul celulei, format din microtubuli, microfilamente. Servește la menținerea formei, precum și la transportul în interior între organele. Diferiți ioni și compuși se mișcă de-a lungul moleculelor de proteine, ca de-a lungul canalelor sau șinelor.
Important este și rolul proteinelor scufundate în membrană și situate pe suprafața acesteia. Aici îndeplinesc atât funcții de receptor, cât și de semnal, participă la construcția membranei în sine. Ei stau de pază, ceea ce înseamnă că joacă un rol protector. Ce tipuri de proteine din celulă pot fi atribuite acestui grup? Sunt multe exemple, iată câteva.
- actina si miozina.
- Elastină.
- Keratină.
- Colagen.
- Tubulina.
- Hemoglobină.
- Insulină.
- Transcobalamina.
- Transferrina.
- Albumină.
În total, există câteva sute de diferite care se mișcă constant în interiorul fiecărei celule.
Tipuri de proteine din organism
Desigur, au o mare varietate. Dacă încercați să împărțiți cumva toate proteinele existente în grupuri, atunci puteți obține ceva ca această clasificare.

În general, multe caracteristici pot fi luate ca bază pentru clasificarea proteinelor găsite în organism. Unul nu există încă.
Enzime
Catalizatori biologici de natură proteică, care accelerează semnificativ toate procesele biochimice în curs. Schimbul normal este imposibil fără acești compuși. Toate procesele de sinteză și dezintegrare, asamblarea moleculelor și replicarea lor, traducerea și transcripția și altele sunt efectuate sub influența unui anumit tip de enzimă. Exemple de aceste molecule sunt:
- oxidoreductaze;
- transferaze;
- catalaza;
- hidrolaze;
- izomeraze;
- lyase și altele.
Astăzi, enzimele sunt folosite în viața de zi cu zi. Deci, în producția de pulbere de spălat, sunt adesea folosite așa-numitele enzime - aceștia sunt catalizatori biologici. Acestea îmbunătățesc calitatea spălării respectând regimul de temperatură specificat. Se leagă cu ușurință de particulele de murdărie și le îndepărtează de pe suprafața țesăturilor.
Cu toate acestea, datorită naturii lor proteice, enzimele nu tolerează apa prea fierbinte sau apropierea de medicamente alcaline sau acide. Într-adevăr, în acest caz, va avea loc procesul de denaturare.