II.1. Konformácie (rotačná izoméria)
Prechod od najjednoduchšieho organického uhľovodíka - metánu k jeho najbližšiemu homológu - etánu - prináša problémy priestorovej štruktúry, na riešenie ktorých nestačí poznať parametre diskutované v časti. V skutočnosti si možno bez zmeny uhlov alebo dĺžok väzby predstaviť mnoho geometrických foriem molekuly etánu, ktoré sa navzájom líšia vzájomnou rotáciou uhlíkových štvorstenov okolo väzby C-C, ktorá ich spája. V dôsledku tejto rotácie rotačné izoméry (konforméry) . Energia rôznych konformérov nie je rovnaká, ale pre väčšinu je energetická bariéra oddeľujúca rôzne rotačné izoméry organické zlúčeniny malý. Preto za normálnych podmienok spravidla nie je možné fixovať molekuly v jednej presne definovanej konformácii: zvyčajne v rovnováhe koexistuje niekoľko rotačných foriem, ktoré sa ľahko transformujú.
Spôsoby grafického znázornenia konformácií a ich nomenklatúra sú nasledovné. Začnime s molekulou etánu. Pre ňu možno predvídať existenciu dvoch konformácií, ktoré sa maximálne líšia energiou. Nižšie sú zobrazené ako perspektívne projekcie (1) („piliarske kozy“), bočné projekcie (2) a Newmanove vzorce (3).
V perspektívnej projekcii (1a, 1b) si treba predstaviť spojenie C-C idúce do diaľky; Atóm uhlíka vľavo je blízko pozorovateľa a atóm uhlíka vpravo je od neho ďalej.
V bočnom priemete (2a, 2b) ležia v rovine výkresu štyri atómy H; Atómy uhlíka sa v skutočnosti trochu rozprestierajú mimo túto rovinu, ale zvyčajne sa zjednodušene predpokladá, že tiež ležia v rovine výkresu. „Odvážne“ klinovité väzby zhrubnutím klinu naznačujú výstup z roviny smerom k pozorovateľovi atómu, ku ktorému je zhrubnutie obrátené. Prerušované klinovité spojenia označujú vzdialenosť od pozorovateľa.
V Newmanovej projekcii (3a, 3b) sa molekula uvažuje pozdĺž väzby C-C (v smere označenom šípkou vo vzorcoch la, b). Tri čiary rozbiehajúce sa v uhle 120° od stredu kruhu označujú väzby atómu uhlíka najbližšie k pozorovateľovi; čiary „vyčnievajúce“ spoza kruhu sú väzby vzdialeného atómu uhlíka.
Konformácia zobrazená vľavo sa nazýva zastreté : Tento názov nám pripomína, že atómy vodíka oboch skupín CH 3 sú oproti sebe. Zatienená konformácia má zvýšenú vnútornú energiu, a preto je nepriaznivá. Konformácia zobrazená vpravo sa nazýva inhibované , čo znamená, že voľná rotácia okolo väzby C-C je v tejto polohe „inhibovaná“, t.j. molekula existuje prevažne v tejto konformácii.
Minimálna energia potrebná na úplné otočenie molekuly okolo konkrétnej väzby sa nazýva rotačná bariéra pre toto spojenie. Rotačná bariéra v molekule, ako je etán, môže byť vyjadrená z hľadiska zmeny potenciálnej energie molekuly ako funkcie zmeny dihedrálny (torzný) uhol systémov. Dihedrálny uhol (označený tau) je znázornený na obrázku nižšie:

Energetický profil rotácie okolo väzby C-C v etáne je znázornený na nasledujúcom obrázku. Rotácia "zadného" atómu uhlíka je znázornená zmenou dihedrálneho uhla medzi dvoma znázornenými atómami vodíka. Pre jednoduchosť boli zvyšné atómy vodíka vynechané. Rotačná bariéra oddeľujúca dve formy etánu je len 3 kcal/mol (12,6 kJ/mol). Minimá krivky potenciálnej energie zodpovedajú inhibovaným konformáciám a maximá zodpovedajú okludovaným konformáciám. Keďže pri izbovej teplote môže energia niektorých molekulárnych zrážok dosiahnuť 20 kcal/mol (asi 80 kJ/mol), táto bariéra 12,6 kJ/mol sa dá ľahko prekonať a rotácia v etáne sa považuje za voľnú.

Zdôrazňujeme, že každý bod na krivke potenciálnej energie zodpovedá špecifickej konformácii. Body zodpovedajúce minimám zodpovedajú konformačným izomérom, tj prevládajúce zložky v zmesi všetkých možných konformácií .
Keď sa molekula stáva zložitejšou, zvyšuje sa počet možných konformácií, ktoré sa výrazne líšia v energii. Áno, pre n-bután môže byť zobrazený v šiestich rôznych konformáciách relatívnu polohu CH 3 skupiny, t.j. rotácia okolo centrálneho spojenia C-C. Nižšie sú konformácie n-butánu znázornené ako Newmanove projekcie. Konformácie zobrazené vľavo (vytieňované) sú energeticky nepriaznivé, prakticky sa realizujú iba inhibované.

Rôzne zatienené a inhibované konformácie butánu nie sú z hľadiska energie rovnaké. Zodpovedajúce energie všetkých konformácií vytvorených počas rotácie okolo centrálnej väzby C-C sú uvedené nižšie:



Keď sa molekula stáva zložitejšou, zvyšuje sa počet možných konformácií.
Takže konformácie sú rôzne neidentické priestorové formy molekuly, ktoré majú určitú konfiguráciu. Konforméry sú stereoizomérne štruktúry, ktoré sú v mobilnej rovnováhe a sú schopné vzájomnej konverzie rotáciou okolo jednoduchých väzieb.
Niekedy je bariéra pre takéto transformácie dostatočne vysoká na oddelenie stereoizomérnych foriem (príklad: opticky aktívne bifenyly;). V takýchto prípadoch sa už nehovorí o konforméroch, ale o skutočne existujúcom stereoizoméry .
II.2. Geometrická izoméria
Dôležitým dôsledkom rigidity dvojitej väzby (absencia rotácie okolo nej) je existencia geometrické izoméry . Najbežnejšie z nich sú cis-trans izoméry zlúčeniny etylénového radu obsahujúce nerovnaké substituenty na nenasýtených atómoch. Najjednoduchším príkladom sú izoméry buténu-2.

Geometrické izoméry majú to isté chemická štruktúra(rovnaké poradie chemickej väzby), líšiace sa priestorovým usporiadaním atómov, v konfigurácie . Tento rozdiel vytvára rozdiel vo fyzikálnych (ako aj chemických vlastnostiach). Geometrické izoméry, na rozdiel od konformérov, môžu byť izolované v čistej forme a existujú ako jednotlivé stabilné látky. Ich vzájomná premena zvyčajne vyžaduje energiu rádovo 125-170 kJ/mol (30-40 kcal/mol). Táto energia môže byť odovzdaná zahrievaním alebo ožarovaním.
V najjednoduchších prípadoch nomenklatúra geometrických izomérov nepredstavuje žiadne ťažkosti: cis- formy sú geometrické izoméry, v ktorých rovnaké substituenty ležia na rovnakej strane roviny väzby pí, tranz- izoméry majú rovnaké substituenty na rôznych stranách roviny pí väzby. V zložitejších prípadoch sa používa Z,E-názvoslovie . Jeho hlavný princíp: indikovať konfiguráciu indikovať cis-(Z, z nem. Zusammen – spolu) príp tranz-(E, z nem. Entgegen - oproti) umiestnenie starší poslanci s dvojitou väzbou.
V systéme Z,E sú substituenty s vyšším atómovým číslom považované za staršie. Ak sú atómy priamo spojené s nenasýtenými uhlíkmi rovnaké, potom prejdú do „druhej vrstvy“, ak je to potrebné - do „tretej vrstvy“ atď.
Uvažujme o aplikácii pravidiel Z,E-nomenklatúry na dvoch príkladoch.

| ja | II |
Začnime vzorcom I, kde je všetko vyriešené atómami „prvej vrstvy“. Po usporiadaní ich atómových čísel zistíme, že staršie substituenty každého páru (bróm v hornej časti vzorca a dusík v dolnej časti) sú v tranz-poloha, preto stereochemické označenie E:
 E-l-bróm-l-chlór-2-nitroetén
E-l-bróm-l-chlór-2-nitroetén
Na určenie stereochemického označenia štruktúry II je potrebné hľadať rozdiely vo „vyšších vrstvách“. V prvej vrstve sa skupiny CH 3, C 2 H 5, C 3 H 7 nelíšia. V druhej vrstve má skupina CH3 súčet atómových čísel tri (tri atómy vodíka), zatiaľ čo skupiny C2H5 a C3H7 majú po 8. To znamená, že skupina CH3 sa neuvažuje. je mladšia ako ostatné dve. Seniorské skupiny sú teda C2H5 a C3H7, je v cis-pozícia; stereochemické označenie Z.
 Z-3-metylheptén-3
Z-3-metylheptén-3
Ak by bolo potrebné určiť, ktorá skupina je staršia - C 2 H 5 alebo C 3 H 7, muselo by sa ísť k atómom „tretej vrstvy“ súčet atómových čísel v tejto vrstve by bol pre obe skupiny rovnaký až 3 a 8, t.j. C3H7 je staršia ako C2H5. V zložitejších prípadoch určenia prednosti treba brať do úvahy ďalšie podmienky, ako napríklad: atóm spojený dvojitou väzbou sa počíta dvakrát, spojený trojitou väzbou - trikrát; Z izotopov je starší ten ťažší (deutérium je staršie ako vodík) a niektoré ďalšie.
Všimnite si, že označenie Z nie sú synonymá cis- označenia, podobne ako označenia E, nie vždy zodpovedajú umiestneniu tranz-, Napríklad:

cis- 1,2-dichlórpropén-1 cis- 1,2-dichlór-1-brómpropén-1
Z-1,2-dichlórpropén-1 E-1,2-dichlór-1-brómpropén-1
Kontrolné úlohy
1. Bombicol – feromón (sexuálny atraktant) priadky morušovej – je E-10-Z-12-hexadekadienol-1. Nakreslite jeho štruktúrny vzorec.
2. Pomenujte nasledujúce zlúčeniny pomocou nomenklatúry Z,E:

II.3. Optická izoméria (enantioméria)
Medzi organickými zlúčeninami sú látky, ktoré dokážu otáčať rovinu polarizácie svetla. Tento jav sa nazýva optická aktivita a zodpovedajúce látky sú opticky aktívny . Opticky aktívne látky sa vyskytujú v pároch optické antipódy - izoméry, fyzikálne a chemické vlastnosti ktoré sú za normálnych podmienok totožné, s výnimkou jednej veci – znaku rotácie roviny polarizácie. (Ak má jeden z optických antipódov napríklad špecifickú rotáciu [POZNÁMKA 1] +20 o, potom druhý má špecifickú rotáciu -20 o).
II.4. Projekčné vzorce
Pre konvenčný obraz asymetrického atómu v rovine použite projekčné vzorce E. Fishera . Získajú sa premietnutím atómov, ku ktorým je pripojený asymetrický atóm, na rovinu. V tomto prípade je samotný asymetrický atóm zvyčajne vynechaný, pričom sa zachovajú iba pretínajúce sa čiary a symboly substituentov. Aby sa zapamätalo priestorové usporiadanie substituentov, v projekčných vzorcoch sa často zachováva prerušovaná zvislá čiara (horné a dolné substituenty sú odstránené za rovinou výkresu), ale často sa to nerobí. Nižšie sú uvedené rôznymi spôsobmi zaznamenanie projekčného vzorca zodpovedajúceho ľavému modelu na predchádzajúcom obrázku:

Tu je niekoľko príkladov projekčných vzorcov:

(+)-alanín (-)-butanol (+)-glyceraldehyd
Názvy látok označujú ich rotačné znaky: to znamená, že napríklad ľavostranný antipód butanolu-2 má priestorová konfigurácia , vyjadrené presne vyššie uvedeným vzorcom a jeho zrkadlový obraz zodpovedá pravotočivému butanolu-2. Definícia konfigurácie optických antipódov sa uskutočňuje experimentálne [POZNÁMKA 3].
V zásade môže byť každý optický antipód znázornený dvanástimi (!) rôznymi projekčnými vzorcami - podľa toho, ako je model pri premietaní umiestnený a z ktorej strany sa naň pozeráme. Na štandardizáciu projekčných vzorcov boli zavedené určité pravidlá ich zapisovania. Hlavná funkcia, ak je na konci reťaze, je teda zvyčajne umiestnená hore, hlavná reťaz je znázornená vertikálne.
Aby ste mohli porovnať „neštandardné“ písané projekčné vzorce, musíte poznať nasledujúce pravidlá pre transformáciu projekčných vzorcov.
1. Vzorce možno otáčať o 180° v rovine kreslenia bez zmeny ich stereochemického významu:

2. Dve (alebo akékoľvek párne číslo) prešmyky substituentov na jednom asymetrickom atóme nemenia stereochemický význam vzorca:

3. Jedna (alebo akýkoľvek nepárny počet) permutácií substituentov v centre asymetrie vedie k vzorcu pre optický antipód:

4. Otočenie o 90° v rovine výkresu zmení vzorec na antipodeálny, pokiaľ sa súčasne nezmení podmienka umiestnenia substituentov voči rovine výkresu, t.j. neuvažujte, že teraz sú bočné substituenty umiestnené za rovinou kresby a horné a spodné sú pred ňou. Ak použijete vzorec s bodkovanou čiarou, zmenená orientácia bodkovanej čiary vám to priamo pripomenie:

5. Namiesto permutácií môžu byť projekčné vzorce transformované otáčaním akýchkoľvek troch substituentov v smere alebo proti smeru hodinových ručičiek; štvrtý substituent nemení svoju polohu (táto operácia je ekvivalentná dvom permutáciám):

6. Projekčné vzorce nemožno odvodiť z roviny kresby (t. j. nemôžete ich napr. skúmať „vo svetle“ zo zadnej strany papiera – v tomto prípade sa zmení stereochemický význam vzorca).
II.5. Racemates
Ak vzorec látky obsahuje asymetrický atóm, neznamená to, že takáto látka bude mať optickú aktivitu. Ak pri normálnej reakcii (substitúcia v skupine CH 2, adícia na dvojitej väzbe a pod.) vznikne asymetrické centrum, potom je pravdepodobnosť vytvorenia oboch antipodových konfigurácií rovnaká. Preto sa napriek asymetrii každej jednotlivej molekuly výsledná látka ukáže ako opticky neaktívna. Tento druh opticky neaktívnej modifikácie pozostávajúci z rovnakého množstva oboch antipódov sa nazýva racemáty [POZNÁMKA 4] .
II.6. Diastereoméria
Zlúčeniny s niekoľkými asymetrickými atómami majú dôležité znaky, ktoré ich odlišujú od predtým diskutovaných jednoduchších opticky aktívnych látok s jedným centrom asymetrie.
Predpokladajme, že v molekule určitej látky sú dva asymetrické atómy; Nazvime ich podmienene A a B. Je ľahké vidieť, že sú možné molekuly s nasledujúcimi kombináciami:
Molekuly 1 a 2 sú pár optických antipódov; to isté platí pre pár molekúl 3 a 4. Ak porovnáme molekuly z rôznych párov antipódov - 1 a 3, 1 a 4, 2 a 3, 2 a 4 - navzájom, potom uvidíme, že uvedené páry nie sú optické antipódy: konfigurácia jedného asymetrického atómu je rovnaká, konfigurácia druhého nie je rovnaká. Toto všetko sú páry diastereoméry , t.j. priestorové izoméry, nie tvoriace navzájom optické antipódy.
Diastereoméry sa od seba líšia nielen optickou rotáciou, ale aj všetkými ostatnými fyzikálnymi konštantami: majú rôzne teploty topenia a varu, rôzne rozpustnosti atď. Rozdiely vo vlastnostiach diastereomérov často nie sú menšie ako rozdiely vo vlastnostiach medzi štruktúrnymi izomérmi .
Príkladom zlúčeniny tohto typu je kyselina chlórmalová

Jeho stereoizomérne formy majú nasledujúce projekčné vzorce:

erytro- formulárov treo- formulárov
Tituly erytro- A trio- pochádzajú z názvov sacharidov erytróza a treóza. Tieto názvy sa používajú na označenie relatívnej polohy substituentov v zlúčeninách s dvoma asymetrickými atómami: erytro -izoméry sú to tie, pre ktoré sa v štandardnom projekčnom vzorci na jednej strane (vpravo alebo vľavo) vyskytujú dva identické laterálne substituenty; trio -izoméry majú rovnaké bočné substituenty na rôznych stranách projekčného vzorca [POZNÁMKA 5].
Dvaja erytro- izoméry sú pár optických antipódov, keď sa zmiešajú, vytvorí sa racemát. Dvojica optických izomérov je a treo- formuláre; pri zmiešaní tiež produkujú racemát, ktorý sa svojimi vlastnosťami líši od racemátu erytro- formulárov. Celkovo teda existujú štyri opticky aktívne izoméry kyseliny chlórmallovej a dva racemáty.
S ďalším zvyšovaním počtu asymetrických centier sa zvyšuje počet priestorových izomérov a každé nové asymetrické centrum zdvojnásobuje počet izomérov. Je určená vzorcom 2 n, kde n je počet asymetrických centier.
Počet stereoizomérov sa môže znížiť v dôsledku čiastočnej symetrie, ktorá sa objavuje v niektorých štruktúrach. Príkladom je kyselina vínna, v ktorej je počet jednotlivých stereoizomérov znížený na tri. Ich projekčné vzorce:

Vzorec I je identický so vzorcom la: premení sa naň pri otočení o 180° v rovine výkresu, a preto nepredstavuje nový stereoizomér. Ide o opticky neaktívnu modifikáciu - mezo forme . Na rozdiel od racemátu, ktorý sa dá rozdeliť na optický antipódy, mezo- forma je v zásade nezničiteľná: každá z jej molekúl má jedno asymetrické centrum jednej konfigurácie a druhé - opačné. V dôsledku toho dochádza k intramolekulárnej kompenzácii rotácie oboch asymetrických centier.
Meso- Všetky opticky aktívne látky majú formy s niekoľkými identickými (t. j. spojenými s rovnakými substituentmi) asymetrickými centrami [POZNÁMKA 6]. Projekčné vzorce mezo- formy sa vždy dajú rozpoznať podľa toho, že sa vždy dajú rozdeliť vodorovnou čiarou na dve polovice, ktoré sú po napísaní na papieri formálne totožné, ale v skutočnosti sú zrkadlové:

Vzorce II a III znázorňujú optické antipódy kyseliny vínnej; pri ich zmiešaní vzniká opticky neaktívny racemát – hroznová kyselina.
II.7. Nomenklatúra optických izomérov
Najjednoduchší, najstarší, ale stále používaný systém nomenklatúry optických antipódov je založený na porovnaní projekčného vzorca nazývaného antipóda s projekčným vzorcom určitej štandardnej látky zvolenej ako „kľúč“. Pre alfa hydroxy kyseliny a alfa aminokyseliny je teda kľúčom horná časť ich projekčného vzorca (v štandardnej notácii):

L- hydroxykyseliny (X = OH) D- hydroxykyseliny (X = OH)
L-aminokyseliny (X = NH2) D- aminokyseliny (X = NH 2)
Konfigurácia všetkých alfa-hydroxykyselín, ktoré majú hydroxylovú skupinu vľavo v štandardnom písanom Fischerovom projekčnom vzorci, je označená znakom L; ak sa hydroxyl nachádza v projekčnom vzorci vpravo - znamienko D[POZNÁMKA 7] .
Kľúčom k označeniu konfigurácie cukrov je glyceraldehyd:

L-(-)-glyceraldehyd D-(+)-glyceraldehyd
V molekulách cukru označenie D- alebo L- odkazuje na konfiguráciu nižšie asymetrický stred.
systém D-,L- označenie má významné nevýhody: po prvé, označenie D- alebo L- označuje konfiguráciu iba jedného asymetrického atómu po druhé, pre niektoré zlúčeniny sa získajú rôzne symboly v závislosti od toho, či sa ako kľúč berie kľúč glyceraldehydu alebo hydroxykyseliny, napríklad:

Tieto nedostatky kľúčového systému obmedzujú jeho použitie v súčasnosti na tri triedy opticky aktívnych látok: cukry, aminokyseliny a hydroxykyseliny. Určené na všeobecné použitie „R,S-systém Kahn, Ingold a Prelog [POZNÁMKA 8].
Na určenie R- alebo S-konfigurácie optického antipódu je potrebné usporiadať štvorsten substituentov okolo asymetrického atómu uhlíka tak, aby najnižší substituent (zvyčajne vodík) mal smer „preč od pozorovateľa“. Potom, ak dôjde k pohybu počas prechodu v kruhu troch zostávajúcich substituentov od najstaršieho k priemeru v seniorskom veku a potom k najmladšiemu proti smeru hodinových ručičiek - Toto R -izomér (spojený s rovnakým pohybom ruky pri písaní písmena R), ak v smere hodinových ručičiek - Toto S- izomér (spojený s rovnakým pohybom ruky pri písaní písmena S).
Na určenie seniority substituentov na asymetrickom atóme sa používajú pravidlá pre výpočet atómových čísel, ktoré sme už uvažovali v súvislosti s Z,E nomenklatúrou geometrických izomérov (pozri).
Na výber R,S-notácií podľa projekčného vzorca je potrebné párnym počtom permutácií (ktoré, ako vieme, nemenia stereochemický význam vzorca) usporiadať substituenty tak, aby najmladší z ich (zvyčajne vodík) je na konci projekčného vzorca. Potom seniorita zostávajúcich troch substituentov, klesajúcich v smere hodinových ručičiek, zodpovedá označeniu R, proti smeru hodinových ručičiek - označenie S [POZNÁMKA 9]:

Kontrolné úlohy
3. Určite konfiguráciu asymetrického centra kyseliny askorbovej (vitamín C) (podľa R,S- nomenklatúra a v porovnaní s glyceraldehydom):

4. Alkaloid efedrín má vzorec:

Pomenujte toto pripojenie pomocou R,S- nomenklatúra.
5. Cysteín - neesenciálna aminokyselina, podieľa sa na regulácii metabolických procesov, je L kyselina -1-amino-2-merkaptopropiónová. Nakreslite jeho štruktúrny vzorec a uveďte jeho názov R,S- nomenklatúra.
6. Levomycetin (širokospektrálne antibiotikum) je D(-)-treo-1-para-nitrofenyl-2-dichlóracetylamino-propándiol-1,3. Nakreslite jeho štruktúru vo forme vzorca Fischerovej projekcie.
7. Synestrol je syntetický estrogénový liek s nesteroidnou štruktúrou. Uveďte jeho názov označujúci jeho stereochemickú konfiguráciu:

II.8. Stereochémia cyklických zlúčenín
Keď je reťazec atómov uhlíka uzavretý do rovinného cyklu, väzbové uhly atómov uhlíka sú nútené odchýliť sa od svojej normálnej tetraedrickej hodnoty a veľkosť tejto odchýlky závisí od počtu atómov v cykle. Čím väčší je uhol odchýlky valenčných väzieb, tým väčšia je energetická rezerva molekuly, tým je cyklus menej stabilný. Plochú štruktúru má však iba trojčlenný cyklický uhľovodík (cyklopropán); Vychádzajúc z cyklobutánu, molekuly cykloalkánu majú nerovinnú štruktúru, čo znižuje „napätie“ v systéme.
Molekula cyklohexánu môže existovať v niekoľkých konformáciách, v ktorých sú zachované „normálne“ väzbové uhly (pre jednoduchosť sú zobrazené iba atómy uhlíka):

Energeticky najpriaznivejšou konformáciou je konformácia I - takzvaná forma "kreslá". Konformácia II - "krútiť" - zaujíma medzipolohu: je menej priaznivá ako stoličková konformácia (kvôli prítomnosti zakrytých atómov vodíka v nej), ale priaznivejšia ako konformácia III. Konformácia III - "kúpeľ" - najmenej priaznivé z troch v dôsledku výrazného odpudzovania nahor smerujúcich atómov vodíka.
Úvaha o dvanástich CH-H väzby v konformácii stoličky nám umožňuje rozdeliť ich do dvoch skupín: šesť axiálne spojenia smerujúce striedavo hore a dole a šesť rovníkový spoje smerujúce do strán. V monosubstituovaných cyklohexánoch môže byť substituent buď v ekvatoriálnej alebo axiálnej polohe. Tieto dve konformácie sú zvyčajne v rovnováhe a rýchlo prechádzajú jedna do druhej prostredníctvom skrútenej konformácie:

Rovníková konformácia (e) je zvyčajne energeticky chudobnejšia, a preto výhodnejšia ako axiálna konformácia (a).
Keď sa v kruhoch objavia substituenty (bočné reťazce), výskumník čelí okrem problému konformácie samotného kruhu aj problémom konfigurácie substituentov : teda v prípade prítomnosti dvoch rovnakých alebo rôznych substituentov, cis-trans-izomér. Všimnite si, že hovorí o cis-trans-konfigurácia substituentov má zmysel len pri aplikácii na nasýtené malé a stredné kruhy (do C 8): v kruhoch s veľkým počtom jednotiek sa mobilita stáva tak významnou, že diskusie o cis- alebo tranz- postoje poslancov strácajú zmysel.
Klasickým príkladom sú teda stereoizomérne kyseliny cyklopropán-1,2-dikarboxylové. Existujú dve stereoizomérne kyseliny: jedna z nich má t.t. 139 o C, je schopný tvoriť cyklický anhydrid, a preto je cis-izomér. Ďalšia stereoizomérna kyselina t.t. 175 o C, netvorí cyklický anhydrid; Toto tranz-izomér [POZNÁMKA 10]:

Dve stereoizomérne 1,2,2-trimetylcyklopentán-1,3-dikarboxylové kyseliny sú navzájom v rovnakom vzťahu. Jedna z nich, kyselina gáforová, t.t. 187 °C, tvorí anhydrid, a preto je cis-izomér. Druhým je kyselina izokafrová, t.t. 171 o C, - netvorí anhydrid, tento tranz- izomér:
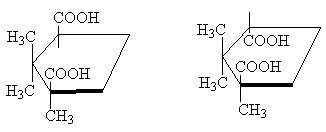
cis-trans-
Hoci molekula cyklopentánu nie je v skutočnosti rovinná, pre prehľadnosť je vhodné ju znázorniť v plochej forme, ako na obrázku vyššie, pričom treba mať na pamäti, že v cis- izomér má dva substituenty na jednej strane cyklu , a v tranz-izomér - na opačných stranách cyklu .
Disubstituované deriváty cyklohexánu môžu existovať aj v cis alebo trans forme:
Atóm uhlíka nemá monopol na vytváranie chirálnych centier v molekulách organických zlúčenín. Centrom chirality môžu byť tiež atómy kremíka, cínu a tetrakovalentného dusíka v kvartérnych amóniových soliach a terciárnych amínoxidoch:

V týchto zlúčeninách má centrum asymetrie tetraedrickú konfiguráciu, ako je asymetrický atóm uhlíka. Existujú však aj zlúčeniny s odlišnou priestorovou štruktúrou chirálneho centra.
Chirálne centrá tvorené atómami trojmocného dusíka, fosforu, arzénu, antimónu a síry majú pyramídovú konfiguráciu. V zásade možno stred asymetrie považovať za tetraedrický, ak sa osamotený elektrónový pár heteroatómu berie ako štvrtý substituent:

Môže sa vyskytnúť aj optická aktivita bez chirálne centrum v dôsledku chirality štruktúry celej molekuly ako celku ( molekulová chiralita alebo molekulárna asymetria ). Najtypickejším príkladom je prítomnosť chirálnej osi alebo chirálnej rovine .
Chirálna os sa objavuje napríklad u alénov obsahujúcich rôzne substituenty at sp 2-hybridné atómy uhlíka. Je ľahké vidieť, že zlúčeniny nižšie sú zrkadlové obrazy, a teda optické antipódy:

Os chirality je na obrázkoch znázornená šípkou.
Ďalšou triedou zlúčenín s chirálnou osou sú opticky aktívne bifenyly, ktoré majú orto-pozície majú objemné substituenty, ktoré sťažujú voľné otáčanie S-S spojenia pripojenie arénových kruhov:

Chirálna rovina vyznačuje sa tým, že sa dá rozlíšiť medzi „hore“ a „dole“, ako aj „pravou“ a „ľavou“ stranou. Príkladom zlúčenín s chirálnou rovinou je opticky aktívna tranz- cyklooktén a opticky aktívny derivát ferocénu.
S Medzi organickými zlúčeninami sú látky, ktoré dokážu otáčať rovinu polarizácie svetla. Tento jav sa nazýva optická aktivita a zodpovedajúce látky sú opticky aktívny. Opticky aktívne látky sa vyskytujú v pároch optické antipódy- izoméry, ktorých fyzikálne a chemické vlastnosti sú za normálnych podmienok rovnaké, s výnimkou jediného - znaku rotácie roviny polarizácie: jeden z optických antipódov vychyľuje rovinu polarizácie doprava (+, pravotočivý izomér), druhý vľavo (-, ľavotočivý).
Optická izoméria sa objaví, keď molekula obsahuje asymetrický atóm uhlíka. Toto je názov pre atóm uhlíka viazaný na štyri rôzne substituenty. Sú možné dve tetraedrické usporiadania substituentov okolo asymetrického atómu. Obidve priestorové formy sa nedajú spojiť žiadnou rotáciou; jeden z nich je zrkadlovým obrazom druhého.
Uvažovaný typ izomérie je tzv optická izoméria
, zrkadlová izoméria
alebo enantioméria
. Obe zrkadlové formy tvoria dvojicu optických antipódov resp enantioméry
.
Počet priestorových izomérov je určený Fischerovým vzorcom N = 2 n, kde n je počet asymetrických centier.
Projekčné vzorce
Pre konvenčný obraz asymetrického atómu v rovine použite projekčné vzorce E. Fishera. Získajú sa premietnutím atómov, ku ktorým je pripojený asymetrický atóm, na rovinu. V tomto prípade je samotný asymetrický atóm zvyčajne vynechaný, pričom sa zachovajú iba pretínajúce sa čiary a symboly substituentov. Aby sa zapamätalo priestorové usporiadanie substituentov, v projekčných vzorcoch sa často zachováva prerušovaná zvislá čiara (horné a dolné substituenty sú odstránené za rovinou výkresu), ale často sa to nerobí. Nižšie sú uvedené rôzne spôsoby, ako napísať vzorec projekcie zodpovedajúci ľavému modelu na predchádzajúcom obrázku:

Tu je niekoľko príkladov projekčných vzorcov:

Názvy látok ukazujú ich rotačné znaky. To znamená, že napríklad ľavostranný antipód butanolu-2 má priestorovú konfiguráciu presne vyjadrenú vyššie uvedeným vzorcom a jeho zrkadlový obraz zodpovedá pravotočivému butanolu-2. Konfigurácia optických antipódov je určená experimentálne.
Zmes pozostávajúca z rovnakých množstiev oboch antipódov sa nazýva racemát. Je opticky neaktívny a má vynikajúce hodnoty fyzikálnych konštánt.
V zásade môže byť každý optický antipód znázornený dvanástimi (!) rôznymi projekčnými vzorcami – podľa toho, ako sa model nachádza pri konštrukcii projekcie, z ktorej strany sa naň pozeráme. Na štandardizáciu projekčných vzorcov boli zavedené určité pravidlá ich zapisovania. Hlavná funkcia, ak je na konci reťaze, je teda zvyčajne umiestnená hore, hlavná reťaz je znázornená vertikálne.
Pravidlá pre prevod projekčných vzorcov:
1. Vzorce možno otáčať o 180° v rovine kreslenia bez zmeny ich stereochemického významu:

2. Dve (alebo akékoľvek párne číslo) prešmyky substituentov na jednom asymetrickom atóme nemenia stereochemický význam vzorca:

3. Jedna (alebo akýkoľvek nepárny počet) permutácií substituentov v centre asymetrie vedie k vzorcu pre optický antipód:

4. Otočenie o 90° v rovine kresby zmení vzorec na antipód, pokiaľ sa súčasne nezmení podmienka umiestnenia substituentov voči rovine kresby, t.j. neuvažujte, že teraz sú bočné substituenty umiestnené za rovinou kresby a horné a spodné sú pred ňou. Ak použijete vzorec s bodkovanou čiarou, zmenená orientácia bodkovanej čiary vám to priamo pripomenie:

5. Namiesto permutácií môžu byť projekčné vzorce transformované otáčaním akýchkoľvek troch substituentov v smere alebo proti smeru hodinových ručičiek; štvrtý substituent nemení svoju polohu (táto operácia je ekvivalentná dvom permutáciám):

6. Vzorce premietania nemožno odvodiť z roviny výkresu.
Iné typy opticky aktívnych látok
Táto časť uvádza niektoré ďalšie triedy organických zlúčenín, ktoré majú tiež optickú aktivitu (t. j. existujú ako páry optických antipódov).
Atóm uhlíka nemá monopol na vytváranie chirálnych centier v molekulách organických zlúčenín. Centrom chirality môžu byť tiež atómy kremíka, cínu a tetrakovalentného dusíka v kvartérnych amóniových soliach a terciárnych amínoxidoch:

V týchto zlúčeninách má centrum asymetrie tetraedrickú konfiguráciu, ako je asymetrický atóm uhlíka. Existujú však aj zlúčeniny s odlišnou priestorovou štruktúrou chirálneho centra.
pyramídový Konfigurácia má chirálne centrá tvorené atómami trojmocného dusíka, fosforu, arzénu, antimónu a síry. V zásade možno stred asymetrie považovať za tetraedrický, ak sa osamotený elektrónový pár heteroatómu berie ako štvrtý substituent:

Môže sa vyskytnúť aj optická aktivita bez chirálne centrum v dôsledku chirality štruktúry celej molekuly ako celku ( molekulová chiralita alebo molekulárna asymetria ). Najtypickejším príkladom je prítomnosť chirálnej osi alebo chirálnej rovine .
Chirálna os sa objavuje napríklad u alénov obsahujúcich rôzne substituenty at sp 2-hybridné atómy uhlíka. Je ľahké vidieť, že zlúčeniny nižšie sú nekompatibilné zrkadlové obrazy, a teda optické antipódy:

Ďalšou triedou zlúčenín s chirálnou osou sú opticky aktívne bifenyly, ktoré majú orto- polohy majú objemné substituenty, ktoré bránia voľnej rotácii okolo väzby C-C spájajúcej benzénové kruhy:

Chirálna rovina vyznačuje sa tým, že sa dá rozlíšiť medzi „hore“ a „dole“, ako aj „pravou“ a „ľavou“ stranou. Príkladom zlúčenín s chirálnou rovinou je opticky aktívna tranz- cyklooktén a opticky aktívny derivát ferocénu:

Diastereoméria
Zlúčeniny s niekoľkými asymetrickými atómami majú dôležité znaky, ktoré ich odlišujú od predtým diskutovaných jednoduchších opticky aktívnych látok s jedným centrom asymetrie.
Predpokladajme, že v molekule určitej látky sú dva asymetrické atómy; označme ich podmienečne ako A a B. Je ľahké vidieť, že sú možné molekuly s nasledujúcimi kombináciami (N = 2 2 = 4):
Molekuly 1 a 2 sú pár optických antipódov; to isté platí pre pár molekúl 3 a 4. Ak porovnáme molekuly z rôznych párov antipódov - 1 a 3, 1 a 4, 2 a 3, 2 a 4 - navzájom, potom uvidíme, že uvedené páry nie sú optické antipódy: konfigurácia jedného asymetrického atómu je rovnaká, konfigurácia druhého nie je rovnaká. Toto sú páry diastereoméry , t.j. priestorové izoméry, nie tvoriace navzájom optické antipódy.
Diastereoméry sa od seba líšia nielen optickou rotáciou, ale aj všetkými ostatnými fyzikálnymi konštantami: majú rôzne teploty topenia a varu, rôzne rozpustnosti atď. Rozdiely vo vlastnostiach diastereomérov často nie sú menšie ako rozdiely vo vlastnostiach medzi štruktúrnymi izomérmi .
Príkladom zlúčeniny tohto typu by mohla byť kyselina chlórmalová (2 rôzne chirálne centrá):

Jeho stereoizomérne formy majú nasledujúce projekčné vzorce:

| erytro-formy | treo-formy |
Tituly erytro- A trio- pochádzajú z názvov sacharidov erytróza a treóza. Tieto názvy sa používajú na označenie relatívnej polohy substituentov v zlúčeninách s dvoma asymetrickými atómami: erytro -izoméry sú tie, v ktorých sa v štandardnom projekčnom vzorci na jednej strane (vpravo alebo vľavo, dva konce písmena E) vyskytujú dva rovnaké laterálne substituenty; trio -izoméry majú rovnaké bočné substituenty na rôznych stranách projekčného vzorca. Dvaja erytro- izoméry sú pár optických antipódov, keď sa zmiešajú, vytvorí sa racemát. Dvojica optických izomérov je a treo- formuláre; pri zmiešaní tiež produkujú racemát, ktorý sa svojimi vlastnosťami líši od racemátu erytro- formulárov. Celkovo teda existujú štyri opticky aktívne izoméry kyseliny chlórmallovej a dva racemáty.
Počet stereoizomérov sa môže znížiť v dôsledku čiastočnej symetrie, ktorá sa objavuje v niektorých štruktúrach. Príkladom je kyselina vínna, v ktorej je počet jednotlivých stereoizomérov znížený na tri. Ich projekčné vzorce:

| ja | Ia | II | III |
Vzorec I je identický so vzorcom la, pretože sa naň premení pri otočení o 180° v rovine výkresu, a preto nepredstavuje nový stereoizomér. Táto opticky neaktívna modifikácia sa nazýva mezo forme . Všetky opticky aktívne látky majú mezoformy s niekoľkými identickými (t.j. spojenými s rovnakými substituentmi) asymetrickými centrami. Projekčné vzorce mezoforiem vždy spoznáte podľa toho, že sa dajú rozdeliť vodorovnou čiarou na dve polovice, ktoré sú po napísaní na papieri formálne totožné, no v skutočnosti sú zrkadlové (rovina vnútornej symetrie):

Vzorce II a III znázorňujú optické antipódy kyseliny vínnej; pri ich zmiešaní vzniká opticky neaktívny racemát – hroznová kyselina.
Nomenklatúra optických izomérov
Najjednoduchší, najstarší, ale stále používaný systém nomenklatúry optických antipódov je založený na porovnaní projekčného vzorca nazývaného antipóda s projekčným vzorcom určitej štandardnej látky zvolenej ako „kľúč“. Pre α-hydroxykyseliny a α-aminokyseliny je teda kľúčová horná časť ich projekčného vzorca (v štandardnej notácii):

Konfigurácia všetkých α-hydroxykyselín, ktoré majú hydroxylovú skupinu vľavo v štandardnom písanom Fischerovom projekčnom vzorci, je označená znakom L; ak sa hydroxyl nachádza v projekčnom vzorci vpravo - znamienko D
Kľúčom k označeniu konfigurácie zlúčenín je glyceraldehyd:

V molekulách cukru označenie D- alebo L- odkazuje na konfiguráciu nižšie asymetrický stred.
systém D-,L- označenie má významné nevýhody: po prvé, označenie D- alebo L- označuje konfiguráciu iba jedného asymetrického atómu po druhé, pre niektoré zlúčeniny sa získajú rôzne symboly v závislosti od toho, či sa ako kľúč berie kľúč glyceraldehydu alebo hydroxykyseliny, napríklad:

Tieto nedostatky kľúčového systému obmedzujú jeho použitie v súčasnosti na tri triedy opticky aktívnych látok: cukry, aminokyseliny a hydroxykyseliny. Určené na všeobecné použitie R,S-systém Kahn, Ingold a Prelog.
Na určenie R- alebo S-konfigurácie optického antipódu je potrebné usporiadať štvorsten substituentov okolo asymetrického atómu uhlíka tak, aby najnižší substituent (zvyčajne vodík) mal smer „preč od pozorovateľa“. Ak dôjde k pohybu pri prechode v okruhu troch zostávajúcich poslancov od najstaršieho k strednému v senioráte a následne k najmladšiemu proti smeru hodinových ručičiek - Toto S -izomér (spojený s rovnakým pohybom ruky pri písaní písmena S), ak v smere hodinových ručičiek - Toto R- izomér (spojený s pohybom ruky pri písaní písmena R).
Na určenie seniority substituentov na asymetrickom atóme sa používajú pravidlá pre výpočet atómových čísel, o ktorých sme už hovorili v súvislosti so Z,E nomenklatúrou geometrických izomérov.
Na výber R,S-notácií podľa projekčného vzorca je potrebné párnym počtom permutácií (ktoré, ako vieme, nemenia stereochemický význam vzorca) usporiadať substituenty tak, aby najmladší z ich (zvyčajne vodík) je na konci projekčného vzorca. Potom seniorita zostávajúcich troch substituentov, klesajúcich v smere hodinových ručičiek, zodpovedá označeniu R, proti smeru hodinových ručičiek - označenie S:

(Fisherova projekcia), spôsob zobrazenia priestoru v rovine. organizačné štruktúry spojenia s jedným alebo viacerými. chirálne centrá. Pri premietaní molekuly na rovinu (obr.) asymetrické. atóm je zvyčajne vynechaný, pričom sa zachovajú iba čiary kríženia a symboly substituentov; v tomto prípade sú substituenty umiestnené pred rovinou umiestnené vpravo a vľavo a za rovinou - hore a dole (bodkovaná čiara).
Fischerove vzorce pre molekulu s jednou asymetrickou. atóm (I), ako aj schému konštrukcie takéhoto vzorca pre zlúčeniny s dvomi asymetrickými. atómy (P) HOWORTHOVÉ VZORCE
HOWORTHOVÉ VZORCE
(Haworth f-ly), obraz v rovine priestorov. cyklické štruktúry spoj. Pri konštrukcii X. f. cyklus sa bežne považuje za plochý (v skutočnosti by molekula mohla byť v tvare stoličky alebo vane) a je premietaná do roviny pod určitým uhlom; v tomto prípade sa časť krúžku, ktorá je na nákrese najbližšie k pozorovateľovi, nachádza nižšie a je zvyčajne zvýraznená hrubšou čiarou (obr.). V monosacharidoch je atóm kyslíka kruhu zvyčajne umiestnený v hornej časti. preč od pozorovateľa (v prípade pyranózového cyklu - vpravo).
Vzorce podľa Fischera (a) a Hawortha (b) poskytujú monosacharidy -D-glukopyranózu (I) a -L-galaktofuranózu (II).
Atómy alebo skupiny atómov zobrazené vo Fischerových f-lahoch vľavo a vpravo, v X. f. sú umiestnené podľa toho. nad a pod rovinou cyklu. Bočné reťazce na atóme C-5 v pyranózach alebo na C-4 vo furanózach sú znázornené nad rovinou kruhu pre D-konfiguráciu atómu uhlíka a pod rovinou pre L-konfiguráciu (pozri obr. Stereochemická nomenklatúra).
Navrhol W. Haworth (Haworth) v roku 1926.
55. Zlúčeniny s hydroxylovou skupinou.
Hydroxylová skupina (hydroxyl) - funkčná skupina OH organických a anorganické zlúčeniny, v ktorom sú atómy vodíka a kyslíka spojené kovalentnou väzbou. IN organickej chémie tiež nazývaný " alkoholová skupina».
Fenoly sú deriváty aromatické uhľovodíky, ktorého molekuly obsahujú jednu alebo viac hydroxylových skupín priamo spojených s benzénovým kruhom.
Názvy fenolov sa zostavujú s prihliadnutím na skutočnosť, že pre rodičovskú štruktúru sa podľa pravidiel IUPAC zachováva triviálny názov „fenol“. Číslovanie atómov uhlíka benzénového kruhu začína od atómu priamo viazaného na hydroxylovú skupinu (ak ide o nadradenú funkciu) a pokračuje v takom poradí, aby existujúce substituenty dostali najnižšie čísla.
Najjednoduchším predstaviteľom tejto triedy je samotný fenol, C 6 H 5 OH.
Štruktúra fenolu. Jeden z dvoch osamelých elektrónových párov atómu kyslíka je vtiahnutý do -elektrónového systému benzénového kruhu (+M-EFFECT skupiny OH). To vedie k dvom efektom: a) hustota elektrónov v benzénovom kruhu sa zvyšuje a maximá hustoty elektrónov sú v orto a para polohách vzhľadom na OH skupinu; b) hustota elektrónov na atóme kyslíka naopak klesá, čo vedie k oslabeniu väzby O–H. Prvý účinok sa prejavuje vo vysokej aktivite fenolu v elektrofilných substitučných reakciách a druhý - vo zvýšenej kyslosti fenolu v porovnaní s nasýtenými alkoholmi.
Monosubstituované deriváty fenolu, napríklad metylfenol (krezol), môžu existovať vo forme troch štruktúrnych izomérov – orto-, meta- a para-krezolov:
Fyzikálne vlastnosti. Fenoly sú väčšinou kryštalické látky (metakrezol je kvapalný) pri izbovej teplote. Majú charakteristický zápach, sú dosť zle rozpustné v studenej vode, ale dobre rozpustné v horúcej vode a najmä v vodné roztoky alkálie. Fenoly tvoria silné vodíkové väzby a majú dosť vysoké teploty varu a topenia. Samotný fenol sú teda bezfarebné kryštály s tpl = 41 °C a tbp = 182 °C. Postupom času kryštály sčervenajú a stmavnú.
56. Päťčlenné heterocyklické zlúčeniny.
Päťčlenné heterocykly- organické cyklické zlúčeniny, ktoré obsahujú aspoň jeden heteroatóm.
Väčšina slávnych predstaviteľov:
| zástupca | Štrukturálny vzorec | Príbuzné zlúčeniny |
| Furan | furfural, kyselina pyroslitová, cumparone, izobenzfurán, tetrahydrofurán, 1,3-dioxolán | |
| tiofén | Tionaftén, Tioften, Tetrahydrotiofén, Tiolán, Tiolanoxid, Biotín | |
| Pyrrol | Indol, Oxindol, Indoxyl, Izatín, karbazol, Pyrolidín, 2-pyrolidón, N-metylpyrolidón, Prolín | |
| Oxazol | Benzoxazol, 2-oxazolín | |
| izoxazol |
57.Alkoholy nazývané alifatické zlúčeniny obsahujúce hydroxylovú skupinu (alkanoly, alkenoly, alkinoly); sa nazývajú hydroxyarény alebo aromatické hydroxyderiváty fenoly . Názov alkoholu vzniká pridaním prípony -ol k názvu príslušného uhľovodíka alebo na základe uhľovodíkového zvyšku. V závislosti od štruktúry uhľovodíkového radikálu sa alkoholy rozlišujú:
primárne:
sekundárne:
terciárny:
Monohydrické fenoly:
Fenoly sa vyznačujú silnejšími kyslé vlastnosti ako alkoholy, tieto netvoria vo vodných roztokoch karbóniové ióny AIk – O –, čo je spojené s menším polarizačným účinkom (elektroakceptorové vlastnosti acylových radikálov v porovnaní s aromatickými).
Alkoholy a fenoly však ľahko vytvárajú vodíkové väzby, takže všetky alkoholy a fenoly majú vyššie teploty varu ako zodpovedajúce uhľovodíky.
Ak uhľovodíkový radikál nemá výrazné hydrofóbne vlastnosti, potom sú tieto alkoholy vysoko rozpustné vo vode. Vodíková väzba určuje schopnosť alkoholov premeniť sa počas tvrdnutia skôr do sklovitého ako kryštalického stavu.
Zlúčeniny s dvoma alebo viacerými hydroxylovými skupinami sa nazývajú viacsýtne alkoholy a fenoly:
58. Lewisove kyseliny a zásady.
J. Lewis bol navrhnutý viac všeobecná teória kyseliny a zásady.
Lewisove základne - sú to donory elektrónových párov (alkoholy, alkoholátové anióny, étery, amíny atď.)
Lewisove kyseliny - sú to akceptory elektrónových párov , tie. zlúčeniny s voľným orbitálom (vodíkový ión a katióny kovov: H +, Ag +, Na +, Fe 2+; halogenidy prvkov druhej a tretej periódy BF 3, AlCl 3, FeCl 3, ZnCl 2; halogény; cín a zlúčeniny síry: SnCl 4, SO 3).
Bronstedova a Lewisova báza sú teda rovnaké častice. Brønstedova zásaditosť je však schopnosť pripojiť iba protón, zatiaľ čo Lewisova zásaditosť je širší pojem a znamená schopnosť interagovať s akoukoľvek časticou, ktorá má nízko položený neobsadený orbitál.
Lewisova acidobázická interakcia je interakcia donor-akceptor a akákoľvek heterolytická reakcia môže byť reprezentovaná ako Lewisova acidobázická interakcia:
Neexistuje jednotná stupnica na porovnanie sily Lewisových kyselín a zásad, pretože ich relatívna sila bude závisieť od toho, ktorá látka sa berie ako štandard (pre Bronstedove kyseliny a zásady je týmto štandardom voda). Na posúdenie jednoduchosti acidobázických interakcií podľa Lewisa R. Pearson navrhol kvalitatívnu teóriu „tvrdých“ a „mäkkých“ kyselín a zásad.
Pevné základy majú vysokú elektronegativitu a nízku polarizáciu. Ťažko sa oxidujú. Ich najvyššie obsadené molekulárne orbitály (HOMO) majú nízku energiu.
Mäkké základy majú nízku elektronegativitu a vysokú polarizáciu. Ľahko oxidujú. Ich najvyššie obsadené molekulárne orbitály (HOMO) majú vysokú energiu.
Tvrdé kyseliny majú vysokú elektronegativitu a nízku polarizáciu. Ťažko sa zotavujú. Ich najnižšie neobsadené molekulové orbitály (LUMO) majú nízku energiu.
Mäkké kyseliny majú nízku elektronegativitu a vysokú polarizáciu. Dajú sa ľahko obnoviť. Ich najnižšie neobsadené molekulové orbitály (LUMO) majú vysokú energiu.
Najtvrdšia kyselina je H +, najjemnejšia je CH 3 Hg +. Najtvrdšie bázy sú F- a OH-, najmäkšie I- a H-.
59. .Étery.
Étery - organickej hmoty mať vzorec R-O-R 1, kde R a R1 sú uhľovodíkové radikály. Malo by sa však vziať do úvahy, že takáto skupina môže byť súčasťou iných funkčných skupín zlúčenín, ktoré nie sú étermi].
- Podľa Williamsona
V laboratórnych podmienkach sa étery pripravujú podľa Williamsona interakciou halogénderivátov schopných reagovať s Sn2 a alkoxidovými a fenoxidovými iónmi. Reakcia prebieha hladko s halogénmetánom a primárnymi halogénalkánmi. V prípade sekundárnych halogénalkánov môže byť reakcia komplikovaná vedľajšou eliminačnou reakciou.
Fyzikálne vlastnosti
Étery sú mobilné, nízkovriace kvapaliny, mierne rozpustné vo vode a veľmi horľavé. Vykazujú slabo zásadité vlastnosti (pripájajú protón na atóm O).
Étery tvoria peroxidové zlúčeniny pod vplyvom svetla:
V dôsledku toho je pri destilácii éterov v laboratórnych podmienkach zakázané ich destilovať do sucha, pretože v tomto prípade dôjde k silnému výbuchu v dôsledku rozkladu peroxidov.
Najdôležitejšie estery
| Meno | Vzorec | Teplota topenia | Bod varu |
| Dimetyléter | CH3OCH3 | -138,5 °C | -24,9 °C |
| dietyléter | CH3CH2OCH2CH3 | -116,3 °C | 34,6 °C |
| Diizopropyléter | (CH3)2CHOCH(CH3)2 | -86,2 °C | 68,5 °C |
| anisol | -37 °C | 154 °C | |
| Oxiran | -111,3 °C | 10,7 °C | |
| tetrahydrofurán | -108 °C | 65,4 °C | |
| Dioxán | 11,7 °C | 101,4 °C | |
| Polyetylénglykol | HOCH2(CH20CH2)nCH20H | − | − |
Biologický význam
Arylétery sú konzervačné látky, antioxidanty, používané v parfumérskom priemysle. Niektoré étery majú insekticídny účinok.
60. Náhradná nomenklatúra (IUPAC) pre organické zlúčeniny.
V substitučnej nomenklatúre IUPAC je názov organickej zlúčeniny určený názvami hlavného reťazca (koreň slova), atómy uhlíka, v ktorých sú očíslované v určitom poradí, ako aj substituenty a funkčné skupiny (označené ako ako predpony alebo prípony). Akýkoľvek atóm alebo skupina atómov, ktoré nahrádzajú vodík, sa považuje za substituent. Funkčná skupina sa považuje za atóm alebo skupinu atómov neuhľovodíkovej povahy, ktoré určujú, či zlúčenina patrí do určitej triedy. Ak existuje niekoľko skupín, vyberie sa najstaršia:
IUPAC je všeobecne akceptovaná nomenklatúra a teraz je štandardom v chémii.
61. C-H oxidácia a C = C väzby.
62. Kovalentné väzby. Hybridizácia.
Kovalentná väzba (atómová väzba, homeopolárna väzba) - chemická väzba, vzniknutý prekrytím (socializáciou) dvojice valenčných elektrónových oblakov. Poskytovanie komunikácie elektronické oblaky(elektróny) sa nazývajú zdieľaný elektrónový pár. Kovalentná väzba je tvorená párom elektrónov zdieľaných medzi dvoma atómami a tieto elektróny musia zaberať dva stabilné orbitály, jeden z každého atómu.
A + + B → A: B
V dôsledku socializácie tvoria elektróny naplnenú energetickú hladinu. Väzba sa vytvorí, ak ich celková energia na tejto úrovni je menšia ako v počiatočnom stave (a rozdiel v energii nebude nič iné ako energia väzby).
Podľa teórie molekulové orbitály, prekrytie dvoch atómových orbitálov vedie v najjednoduchšom prípade k vytvoreniu dvoch molekulových orbitálov (MO): prepojenie MO A protiväzbový (uvoľňujúci) MO. Zdieľané elektróny sú umiestnené na nižšej energetickej väzbe MO. Orbitálna hybridizácia- hypotetický proces miešania rôznych (s, p, d, f) orbitálov centrálneho atómu polyatomickej molekuly s výskytom rovnakých orbitálov, ktoré sú svojimi charakteristikami ekvivalentné.
Typy hybridizácie
Tetraedrický model jedného z enantiomérov (obr. 10) je umiestnený v priestore tak, že reťazec atómov uhlíka je vo vertikálnej polohe a karboxylová skupina je navrchu. Väzby s neuhlíkovými substituentmi (H a OH) v chirálnom centre by mali smerovať k pozorovateľovi.
Ryža. 10. Konštrukcia Fischerovho projekčného vzorca kyseliny (+)-mliečnej
Potom sa model premietne na rovinu. Symbol asymetrického atómu je vynechaný, chápe sa ako priesečník zvislých a vodorovných čiar.
Tetraedrický model chirálnej molekuly pred projekciou môže byť umiestnený v priestore rôznymi spôsobmi, nielen ako je znázornené na obr. 7. Je len potrebné, aby spoje tvoriace vodorovnú čiaru na projekcii smerovali k pozorovateľovi a zvislé spoje - za rovinu výkresu.
Takto získané projekcie možno pomocou jednoduchých transformácií uviesť do štandardného tvaru, v ktorom uhlíkový reťazec umiestnené vertikálne a seniorská skupina(v kyseline mliečnej je to COOH) - zhora. Transformácie umožňujú dve operácie:
V projekčnom vzorci je dovolené zameniť miesta akýchkoľvek dvoch substituentov na rovnakom chirálnom centre párny počet krát (dve permutácie sú dostatočné);
Vzorec premietania sa môže otočiť v rovine kreslenia o 180° (čo zodpovedá dvom permutáciám), ale nie o 90°.
Tetraedrický model štruktúry organických zlúčenín navrhli J.G Van't Hoff a J.A.Bel v roku 1874. Dospeli k záveru, že ak sú dve molekuly stereoizoméry, potom ich možno opísať zrkadlovými vzorcami a ak jeden izomér. otočí rovinnú polarizáciu doľava, potom by sa mala druhá otočiť doprava. Na základe znamienka rotácie možno určiť relatívnu konfiguráciu stereoizomérov. Avšak medzi absolútna konfigurácia, t.j. Neexistuje žiadna priama korešpondencia so skutočným usporiadaním skupín okolo daného chirálneho centra a so znakom rotácie. Definujte absolútnu konfiguráciu chemické metódy ak nie je známa absolútna konfigurácia aspoň jedného chirálneho činidla (a to bol prípad na začiatku), je to nemožné. Spektrálne metódy môžu poskytnúť iba informácie o relatívnej konfigurácii. V súčasnosti existujú iba dve metódy na nezávislé určenie absolútnej konfigurácie: teoretický výpočet a štúdium anomálnej röntgenovej difrakcie na jadrách ťažkých prvkov.
Ale v koniec XIX- na začiatku 20. storočia tieto metódy neexistovali a preto chemici prišli s nasledovným riešením. Jedno pripojenie sme sa rozhodli brať ako štandard a ľubovoľne mu priradiť jednu z možných absolútnych konfigurácií. Voľba padla na glyceraldehyd, pretože štrukturálne súvisí s cukrami, ktoré v tom čase študoval Emil Fischer. (+) - Izoméru bola priradená absolútna konfigurácia a bol označený písmenom D ( dextriogyrus- vpravo) a zodpovedajúci (-) - izomér - s písmenom L ( laevogyrus- vľavo). Po výbere štandardu je možné k nemu priradiť konfiguráciu ďalších pripojení. Napríklad, keď sa oxiduje HgO, (+)-glyceraldehyd produkuje kyselinu (-)-glycerínovú. Táto reakcia neovplyvňuje asymetrický atóm, takže je veľmi nepravdepodobné, že sa zmení jeho konfigurácia, a preto kyselina (-)-glycerová patrí do série D.
Priradenie k D- alebo L-sérii iných štruktúrne príbuzných opticky aktívnych zlúčenín sa uskutoční porovnaním konfigurácie ich asymetrického atómu s konfiguráciou D- alebo L-glyceraldehydu. Napríklad v jednom z enantiomérov kyseliny mliečnej (I) v projekčnom vzorci je OH skupina vľavo, ako v L-glyceraldehyde, preto je enantiomér (I) klasifikovaný ako L-séria. Z rovnakých dôvodov je enantiomér (II) priradený k D-sérii. Takže z porovnania Fisherových projekcií sa určí relatívna konfigurácia.
Tieto vzorce sa zvyčajne používajú na priestorovú reprezentáciu molekúl obsahujúcich asymetrický atóm uhlíka : toto je štvorsten ( sp 3-hybridný) atóm uhlíka viazaný na štyri rôzne atómy alebo skupiny atómov.
Na znázornenie projekčného vzorca je štvorstenný model molekuly umiestnený tak, že asymetrický atóm je v rovine kresby a dve väzby z asymetrického atómu uhlíka ležia v horizontálnej rovine vyčnievajúcej k pozorovateľovi z roviny kresby. . Ďalšie dve spojenia by mali byť umiestnené vo vertikálnej rovine presahujúcej od pozorovateľa za rovinu kreslenia.
Pri použití Fischerových projekcií sa zvyčajne vynecháva symbol pre asymetrický atóm uhlíka:
Vždy treba brať do úvahy, že Fisherove vzorce sú projekcie do roviny a nemali by sa považovať za priestorové modely.
Preto je potrebné dodržiavať nasledujúce pravidlá:
projekčný vzorec zodpovedajúci konkrétnemu stereoizoméru nemožno odstrániť z roviny výkresu a nemožno ho otočiť v rovine o 90 o a 270 o;
formulu je možné otočiť o 180°

Ak sa poloha jednej atómovej skupiny nezmení, ďalšie tri sa môžu otáčať v smere alebo proti smeru hodinových ručičiek:

4.2. Optická aktivita* a chiralita
Optická aktivita označuje vlastnosť, schopnosť látky otáčať (odchýliť sa o určitý uhol) rovinu polarizovaného svetla.
Rotácia roviny polarizácie nastáva buď v smere hodinových ručičiek (pravá rotácia) alebo proti smeru hodinových ručičiek (ľavá rotácia).
Pre zlúčeninu obsahujúcu jeden asymetrický atóm uhlíka sú možné dva izoméry, ktoré sú vo vzájomnom vzťahu ako objekt a jeho zrkadlový obraz, ako je možné vidieť na príklade kyseliny mliečnej.


Dva izoméry, z ktorých každý je zrkadlový obraz iní sú tzv optické alebo zrkadlové izoméry .
Takáto dvojica zrkadlových izomérov sa nazýva enantioméry alebo optické antipódy .
Enantioméry majú to isté fyzikálne vlastnosti, s výnimkou smeru rotácie roviny polarizácie: vychyľujú polarizované svetlo pod rovnakým uhlom, ale v opačných smeroch.
Zlúčeniny, ktoré nie sú kompatibilné s ich zrkadlovým obrazom, sa nazývajú chirálny .
Chiralita (od cheir - ruka) je základným pojmom stereochémie, označujúca vlastnosť objektu byť nezlučiteľná s jeho zrkadlovým obrazom; je predpokladom optickej aktivity molekúl.
Zmes látok pozostávajúca z rovnakých množstiev oboch enantiomérov sa nazýva racemická zmes . Optická aktivita takejto zmesi je 0.
Stereoizoméry, ktoré nie sú enantioméry, sa nazývajú diastereoméry (podrobnosti pozri nižšie, časť 4.4.).
Všetky chirálne molekuly sú teda molekulami opticky aktívnych zlúčenín.
Existuje vzájomná zhoda medzi chiralitou a optickou aktivitou. Charakteristický znak chirálnych molekúl je absencia osi, stredu a roviny symetrie, ktoré sú prvky symetrie .
Os symetrie. Ak rotácia okolo osi prechádzajúcej cez molekulu pod uhlom 2π/n=360 o/n ju opäť uvedie do pôvodného stavu, potom sa takáto os nazýva os symetrie n-tého rádu С n . Je jasné, že pri hodnote n=1 v každom prípade rotácia okolo osi vracia molekulu do pôvodného stavu.
Napríklad molekula vody (a) má os symetrie druhého rádu (n=2), chlórmetán (b) má tretí rád a v benzéne (c) spolu so šiestimi osami umiestnenými v rovine cyklu (n =2), existuje ešte jedna os (n=6), ktorá je kolmá na rovinu cyklu.

Rovina symetrie. Ak rovina prechádzajúca cez molekulu (objekt) ju rozdelí na dve časti, ktoré sú navzájom spojené ako zrkadlové izoméry, potom ide o tzv. rovina symetrie . Voda má dve roviny symetrie a chlórmetán má tri.

Stred symetrie i- je to bod v strede molekuly v rovnakej vzdialenosti, od ktorej sú na tej istej priamke umiestnené dva ekvivalentné, ekvivalentné body danej molekuly.
Molekula nemôže mať viac ako jedno centrum symetrie.
Z hľadiska prítomnosti alebo neprítomnosti prvkov symetrie v molekulách je teda zvykom hovoriť o chirality A achiralita . Vo väčšine prípadov sa ich význam zhoduje s pojmami „asymetria“ a „symetria“. Chiralita je však oveľa širší pojem ako asymetria, pretože chirálna molekula môže obsahovať niektoré prvky symetrie. Z rovnakého dôvodu sa v stereochémii výraz „asymetrický“ atóm veľmi často nahrádza výrazom „centrum chirality“. Chiralita by sa preto mala chápať ako vlastnosť objektu byť nezlučiteľná s jeho zrkadlovým obrazom. Achirálna molekula obsahuje aspoň jeden prvok symetrie (buď stred alebo rovinu symetrie). Špeciálny prípad achirality je chiralita: schopnosť, vlastnosť achirálnej molekuly premeniť sa na chirálnu prostredníctvom jednorazovej zmeny v jednom štruktúrnom fragmente. Spravidla je takáto operácia možná, ak existuje prochirálne centrum – teda centrum obsahujúce dva rôzne a dva rovnaké substituenty. Nahradením jedného z týchto identických substituentov iným, odlišným od všetkých existujúcich, sa toto centrum zmení na chirálne:

Konfigurácia a konformácia
Stereoizoméry sa môžu líšiť konfigurácie (konfiguračné izoméry) alebo konformácie (konformačné izoméry).
Konfigurácia– priestorové usporiadanie atómov a/alebo atómových skupín okolo chirálneho centra, roviny dvojitej väzby alebo roviny kruhu a charakterizujúce určitý stereoizomér. Tento koncept má do značnej miery kvalitatívnu povahu a v podstate odráža stereochemickú vlastnosť špecifického usporiadania atómov v priestore okolo chirálneho centra danej molekuly.
Páry zlúčenín, ktoré sú konfiguračnými izomérmi, sú uvedené nižšie:

konformácia*- určitá geometria molekuly, určená vnútorná rotácia atómy alebo atómové skupiny okolo jednoduchých väzieb. V tomto prípade zostáva stereochemická konfigurácia molekuly nezmenená.
Newmanove projekcie sa používajú na zobrazenie konformácií. Pre etán sú možné dve hraničné konformácie: zatienená (I) a inhibovaná (II).

Bután sa líši od etánu v prítomnosti dvoch metylových skupín, a preto je pre túto molekulu možný väčší počet inhibovaných konformácií, ako je uvedené nižšie. Stabilnejšia konformácia I je označená ako proti: tu sú metylové skupiny od seba čo najďalej (dihedrálny uhol je 180 o). Ďalšie dve konformácie sú šikmé alebo inak gauche konformácie (II a III), v ktorých metylové skupiny zvierajú uhol 60°:



























