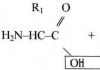
Альдегідами називаються органічні сполуки, в яких карбонільна група (С-О) пов'язана з воднем і радикалом R (залишки аліфатичних, ароматичних та гетероциклічних сполук):
Полярність карбонільної групи забезпечує полярність молекули в цілому, тому альдегіди мають вищі температури кипіння, ніж неполярні сполуки порівнянної молекулярної маси.
Оскільки атоми водню в альдегідах пов'язані лише з атомом вуглецю (близькі відносні електронегативності), міжмолекулярні водневі зв'язки не утворюються. Тому температури кипіння альдегідів нижчі, ніж у відповідних спиртів чи карбонових кислот. Як приклад можна порівняти температури кипіння метанолу (Т 65 ° С), мурашиної кислоти (Гкіп 101 ° С) і формальдегіду (7 ^, -21 ° С).
Нижчі альдегіди розчиняються у воді, ймовірно, внаслідок утворення водневих зв'язківміж молекулами розчиненої речовини та розчинника. Вищі альдегіди добре розчиняються у більшості звичайних органічних розчинників (спирти, ефіри). Нижчі альдегіди мають різкий запах, у альдегідів з С3-С6 дуже неприємний запах, у той час як вищі альдегіди мають квіткові запахи і застосовуються в парфумерії.
У хімічному відношенні альдегіди - дуже реакційні сполуки. Найбільш характерні для альдегідів реакції нуклеофільного приєднання, що з присутністю в молекулі електрофільного центру - карбонільного атома вуглецю групи С=0.
Багато з цих реакцій, наприклад, утворення оксимів, семікарбазонів та інших сполук, використовуються в якісному та кількісний аналізЛЗ групи альдегідів тому, що продукти приєднання альдегідів характеризуються певною для кожного альдегіду температурою плавлення. Так, альдегіди при струшуванні з насиченим розчином гідросульфіту натрію легко вступають у реакцію приєднання:
Продукти приєднання є солі, що мають певну температуру плавлення, добре розчинні у воді, але не розчинні в органічних розчинниках.
При нагріванні з розведеними кислотами гідросульфітні похідні гідролізуються до вихідних сполук.
Здатністю альдегідів утворювати гідросульфітні похідні користуються як для визначення справжності препарату з альдегідною групою в молекулі, так і для очищення альдегідів та виділення їх із сумішей з іншими речовинами, що не реагують із гідросульфітом натрію.
 |
|||||||||
Альдегіди також легко приєднують аміак та інші азотовмісні нуклеофіли. Продукти приєднання зазвичай малостійкі і легко піддаються дегідратації та полімеризації. циклічні сполуки, Що Утворюються в результаті полімеризації, при нагріванні з розведеними кислотами легко розкладаються, знову звільняючи альдегід:
| r-ch-nh2 | г з | -NH R-СС |
| -Зн2о " | ||
| він |
Альдегіди легко окислюються. Оксид срібла(І) та інші окислювачі з невисоким значенням окисного потенціалу здатні окислювати альдегіди. Наприклад, для альдегідів характерна реакція освіти срібного дзеркалаяка протікає з аміачним розчином AgN03:
AgN03 + 3NH3 - OH + NH4N03
Реактив Толленса
При цьому на стінках пробірки утворюється дзеркальний наліт металевого срібла:
2OH + RCOH 2Agi + RCOOH + 4NH3T + Н20
Аналогічно альдегіди можуть відновлювати мідь(П) до міді(1). Для реакції до розчину альдегіду додають реактив Фелінга (лужний розчин тартратного комплексу міді(П)) і нагрівають. Спочатку утворюється жовтий осад гідроксиду міді(1) - СіОН, а потім червоний - оксиду міді(1) - Си20:
2KNa + RCOH + 3NaOH + 2КОН -
2CuOHi + RCOONa + 4KNaC4H406 + 2H20 2CuOH - Cu20 + H20
До окисно-відновних відноситься також реакція взаємодії альдегідів з реактивом Несслера в лужному середовищі; при цьому випадає темний осад відновленої ртуті:
K2 + RCOH + ЗКОН - RCOOK + 4KI + Hgl + 2Н20
Слід мати на увазі, що реакція з реактивом Несслер більш чутлива, тому її використовують для виявлення домішок альдегідів в ЛЗ. Справжність лікарських засобів, що містять альдегідну групу, підтверджують менш чутливими реакціями: срібного дзеркала або з реактивом Фелінгу Деякі інші сполуки, наприклад, поліфеноли, також окислюються сполуками Ag(I) і Си(П), тобто. реакція не є специфічною.
Формальдегід та оцтовий альдегід схильні до полімеризації. Формальдегід полімеризується, утворюючи циклічні тримери, тетрамери або лінійні полімери. Реакція полімеризації протікає в результаті нуклеофільної атаки кисню однієї молекули карбонільного атома вуглецю;
Так, з 40% водного розчину формальдегіду (формаліну) утворюється лінійний полімер - параформ (і = 8 - 12), трімер та тетрамер.
Для альдегідів характерні наркотичні та дезінфікуючі властивості. Порівняно зі спиртами альдегідна група посилює токсичність речовини. Введення галогену в молекулу альдегіду підвищує його наркотичні властивості. Наприклад, наркотичні властивості хлоралю більш виражені, ніж у оцтового альдегіду:
![]() с!3с-сС
с!3с-сС
Отримання. Альдегіди можуть бути отримані окисленням первинних спиртівхромовою кислотою (Na2Cr04, H2S04) при кип'ятінні або перманганатом калію в лужному середовищі:
Дегідрування первинних спиртів здійснюють над мідним каталізатором (Сі, Сг203) за 300-400 °С.
Промислове виробництво метаналю засноване на парофазному окисненні метанолу із залізомолібденовим каталізатором:
2СН3ОН + 02 500 ~ 600 2СН2 = 0 + Н20
Розчин формальдегіду (формалін)
Отримання. Формалін – це водний розчин формальдегіду (40 %), стабілізований метанолом (6-10 %). Європейська Фармакопея містить ФС «Формальдегід розчин (35%)» (див. табл. 9.1). У лабораторних умовах формальдегід може бути одержаний дегідруванням метанолу над міддю або деполімеризацією параформу.
Визначення справжності. Фармакопейний спосіб – реакція срібного дзеркала.
Оскільки формальдегід легко вступає в реакції конденсації, наприклад, з гідроксиловмісними ароматичними сполукамиз утворенням пофарбованих сполук, ГФ рекомендує також використовувати для його ідентифікації реакцію з саліциловою кислотою, в результаті якої з'являється червоне фарбування:
|
||||||||||
|
||||||||||
|
||||||||||
Аналогічно протікає реакція з хромотроповою кислотою з утворенням синьо-фіолетових та червоно-фіолетових продуктів (ЕФ).
Для визначення справжності фармальдегіду можуть бути використані реакції з азотовмісними нуклеофілами, наприклад первинними амінами:
H-Ctf° + H2N-R - н-с^^К + Н20
N-заміщені іміни (основи Шиффа), що утворюються, малорозчинні, деякі з них пофарбовані, інші дають пофарбовані з'єднання з іонами важких металів. ЕФ пропонує реакцію з фенілгідразином. У присутності калію фериці-аніду в кислому середовищіутворюються продукти реакції інтенсивно червоного кольору.
Випробування на чистоту. Контроль домішки мурашиної кислоти здійснюють, визначаючи кислотність. Відповідно до ГФ, концентрація мурашиної кислоти у препараті не повинна перевищувати 0,2 %; встановлюють вміст мурашиної кислоти методом нейтралізації (ГФ). Згідно з ЕФ, метанол визначають методом газової хроматографії (9-15% об.). Сульфатна зола - не більше 0,1% у навішуванні 1,0 г.
I2 + 2NaOH - Nal + NaOI + Н20
Гіпойодит окислює формальдегід до мурашиної кислоти. Непрореагував гіпойодит при підкисленні розчину надлишком сірчаної кислоти перетворюється на йод, який відтитрують тіосульфатом натрію:
НСОН + NaOI + NaOH - HCOONa + Nal + H20 NaOI + Nal + H2S04 -*■ I2 + Na2S04 + H20 I2 + 2Na2S203 - Na2S406 + 2NaI
Можливе використання інших титруючих агентів при визначенні формальдегіду: водню пероксиду в лужному розчині, церію(ІУ) сульфату, натрію сульфіту.
Препарат можна розглядати як проліки, тому що фізіологічну дію має не сам гексаметилентетрамін, а формальдегід, що виділяється при розкладанні препарату в кислому середовищі. Саме цим пояснюється включення його до цього розділу (див. табл. 9.1).
Отримання. Уротропін (тетраазаадамантан) одержують конденсацією метаналю та аміаку з водних розчинів. Проміжний продукт реакції - гексагідро-1,3,5-тріазин:
| ll Гексагідро-Уротропін 1,3,5-трназин |
Визначення справжності. При нагріванні суміші препарату з розведеною сірчаною кислотою утворюється амонійна сіль, з якої при додаванні надлишку лугу виділяється аміак:
(CH2)6N4 + 2H2S04 + 6Н20 - 6НСОН + 2(NH4)2S04 (NH4)2S04 + 2NaOH - 2NH3t + Na2S04 + 2H20
Гексаметилентетрамін можна виявити також за червоним фарбуванням розчину при додаванні саліцилової кислоти після попереднього нагрівання з сірчаною кислотою (див. визначення справжності формальдегіду).
Випробування на чистоту. У препараті не допускається присутність домішок органічних сполук, параформ, солей амонію. ГФ вказує допустимі межі вмісту домішок хлоридів, сульфатів, важких металів.
Кількісне визначення. Для кількісного визначення гексаметилентетраміну ГФ пропонує використовувати метод нейтралізації. Для цього навішування препарату нагрівають із надлишком 0,1М розчину сірчаної кислоти. Надлишок кислоти відтитрують розчином лугу концентрацією 0,1 моль/л (індикатор метиловий червоний).
На здатності гексаметилентетраміну давати з йодом тетрайодиди заснований йодометричний метод кількісного визначення.
Альдегіди та кетони характеризуються присутністю в молекулі карбонільної групи. В альдегідах карбонільна група пов'язана з одним атомом водню та одним вуглеводневим радикалом. Усі альдегйди містять групу
звану альдегідною групою.
Загальна формула альдегідів:
Молекула альдегіду містить на два атоми водню менше, ніж молекула відповідного спирту

т. е. альдегід - це дегідрований (окислений) спирт. Звідси і походить назва «альдегід» - від з'єднання двох скорочених латинських слів alcohol dehydrogenatus (дегідрований спирт).
Граничні альдегіди та кетони мають однакову сумарну формулу
Номенклатура та ізомерія.Назви альдегідів походять від назв граничних кислот, які вони перетворюються при окисленні. Це тим, що багато кислот були відкриті і отримали назву раніше, ніж відповідні їм альдегіди.
Назви та формули деяких найпростіших альдегідів наведені нижче:

Для складання назв альдегідів за женевською номенклатурою додають до назви вуглеводню з таким самим числом вуглецевих атомів закінчення аль. У складних випадкахположення альдегідної групи позначають цифрою, яка ставиться після закінчення:

Ізомерія альдегідів обумовлена ізомерією ланцюга вуглецевих атомів вуглеводневого радикалу:

Назви кетонів по раціональній номенклатурі виробляють від назв радикалів, що входять до їх молекули, з додаванням закінчення кетон, наприклад:

Деякі кетони носять назви, що історично склалися, наприклад диметилкетон називається ацетоном.
За женевською номенклатурою назви кетонів виробляють додаючи до назви відповідного вуглеводню закінчення він. У разі розгалуженого ланцюга кетону нумерацію атомів вуглецю починають з того кінця, до якого ближче знаходиться розгалуження (за правилами нумерації вуглеводнів). Місце
займане карбонільною групою, позначається в назві дифрой, що стоїть після закінчення, наприклад:

Фізичні властивості. Перший член гомологічного ряду альдегідів – мурашиний альдегід – газ; середні представники рідини; вищі альдегіди – тверді речовини. Нижчі альдегіди мають різкий запах, добре змішуються з водою. Середні альдегіди розчиняються у воді помірно; вищі альдегіди – нерозчинні. Всі альдегіди добре розчиняються у спирті та ефірі.
Нижчі кетони - рідини з характерним запахом, що легко змішуються з водою. Вищі кетони – тверді речовини. Усі кетони добре розчиняються у спирті та ефірі.
Хімічні реакції альдегідів та кетонів.Альдегіди та кетони надзвичайно реакційноздатні органічні речовини. Багато їх реакцій протікають без нагрівання і тиску. Особливо характерні для альдегідів та кетонів реакції, які протікають за участю карбонільної групи. Існують, однак, деякі відмінності у реакціях альдегідів та кетонів. Як правило, альдегіди більш реакційні в порівнянні з кетонами.
Реакції приєднання: До карбонільної групи альдегідів та кетонів може приєднуватися ряд різних речовин. При цьому один із зв'язків, що з'єднують атоми кисню і вуглецю в карбонільній групі, розривається, і до вільних валентностей, що утворилися, приєднуються частини реагуючої речовини. Якщо речовина, що приєднується, містить водень, то останній завжди прямує до карбонільного кисню; карбонільна група при цьому перетворюється на гідроксильну:

З електронної точки зору ця "реакційна особливість карбонільного кисню в альдегідах і кетонах пояснюється тим, що електронні хмари, що утворюють зв'язок між атомами вуглецю та кисню в карбонільній групі, зрушені до атома кисню, оскільки останній сильніше притягує електрони, ніж атом вуглецю. В результаті подвійний зв'язок виявляється сильно поляризованим:
До поляризованого подвійного зв'язку різні речовиниприєднуються у певному напрямку. Розглянемо деякі реакції приєднання, характерні для альдегідів та кетонів.
Приєднання синильної кислоти Зв'язок у молекулі синильної кислоти також поляризований, і тому водень, який має деякий позитивний заряд, приєднується до атома кисню, а група атома вуглецю:

Отримані в цьому випадку середнення носять назву ціангіоринів (або оксинітрилів) і являють собою сполуки зі змішаними функціями (що містять одночасно гідроксил і ціаногрупу). Оксйнітрили служать вихідними речовинами для синтезу різних органічних сполук.
Приєднання бісульфіту натрію (кислого сірчистокислого натрію

Отримані сполуки (бісульфітні сполуки) – кристалічні речовини. Вони використовуються в лабораторній практиці для виділення альдегідів та кетонів у чистому стані з їх сумішей з іншими речовинами, так як легко розкладаються при
кип'ятінні з содою або розведеними кислотами з утворенням вихідних альдегідів та кетонів.
Приєднання металоорганічних сполук до карбонільної групи альдегідів та кетонів розглянуто на стор. 165.
Відновлення альдегідів і кетонів можна як реакцію приєднання молекули водню до карбонильной групі. При відновленні альдегідів утворюються первинні спирти, а при відновленні кетонів – вторинні:

Реакції заміщення серед альдегідів і кетонів призводять до заміни кисню карбонильной групи інші атоми чи радикали.
Дія п'ятигалогоїдного фосфору. При дії, наприклад, п'ятихлористого фосфору відбувається заміщення карбонільного кисню на два атоми хлору і утворюється дигалоїдне про лзводное вуглеводню:

Ці дигалоїдні сполуки, реагуючи з водою, здатні знову давати вихідні альдегіди та кетони.
Дія гідроксиламіну. При дії гідроксиламіну на альдегіди та кетони утворюються відповідно - альдоксими та кетоксими (гідроксиламін можна розглядати як аміак, у якого один атом водню заміщений на гідроксил):

Оксими, що виходять в результаті цієї реакції, в більшості випадків являють собою кристалічні речовини і служать для відкриття і виділення альдегідів і кетонів у чистому вигляді.
Реакція окислення. Альдегіди легко окислюються різними окислювачами, переходячи в карбонові кислоти:

Наприклад, альдегіди легко забирають кисень від оксидів деяких металів. На цій властивості заснована так звана реакція срібного дзеркала. Вона полягає в тому, що при нагріванні альдегіду з аміачним розчином окису срібла відбувається окислення альдегіду в кислоту і відновлення окису срібла до металевого срібла:
Металеве срібло осідає на стінках судини та утворює блискучу дзеркальну поверхню.
Кетони окислюються значно складніше. Лише при дуже енергійному окисленні відбувається розрив їх вуглецевого ланцюга утворюються дві кислоти, наприклад:

Реакції за участю атома водню в положенні щодо карбонільної групи.
Дія галоїдів. Карбонільна група в вальдегідах і кетонах сильно впливає на рухливість водневих атомів, що знаходяться у вуглецю, що стоїть поряд з карбонільною групою -положенні). Так, наприклад, при дії на альдегіди або кетони брому або хлору вони легко замінюють атоми водню в положенні:

Атоми галоїду, що вступили в положення до карбонільної групи альдегідів або кетонів, також мають дуже велику реакційну здатність.
Реакція конденсації. Реакціями конденсації називають такі реакції ущільнення, при яких відбувається утворення нових вуглець-вуглецевих зв'язків. Реакції конденсації можуть протікати без виділення простих молекул (води, аміаку, хлористого водню тощо) або з виділенням їх.
Альдегіди легко вступають у реакції конденсації. Так, наприклад, молекула оцтового альдегіду під дією невеликих кількостей розведеного лугу на холоді конденсується з іншою молекулою того ж альдегіду:

Отримана сполука, що містить альдегідну та спиртову групи, отримала назву альдоля (скорочена від альдегідоалкоголь), а наведена вище реакція - альдольної конденсації. Як видно з рівняння реакції, альдольна конденсація йде за рахунок рухомого атома водню -положенні до карбонільної групи.
В інших умовах конденсація може протікати з утворенням нового подвійного вуглець-вуглецевого зв'язку:

Отримана сполука називається кротоновим альдегідом, а реакція – кротоновою конденсацією.
Кетоньг також здатні до реакцій конденсації, які протікають дещо складніше, ніж для альдегідів.
Характерні реакції альдегідів.Для альдегідів, як сполук більш реакційних, ніж кетони, характерні ще наступні реакції:
Утворення складних ефірів. Якщо до альдегіду додати невелику кількість алкоголю алюмінію, то протікає енергійна реакція, при якій відбувається окислення однієї молекули альдегіду за рахунок відновлення іншої молекули альдегіду, і утворюється складний ефір:

Ця реакція носить назву реакції Тищенка, на ім'я російського вченого, що її відкрив.
Освіта ацеталей. При нагріванні альдегідів зі спиртами при невеликих кількостях мінеральних кислот відбувається реакція:

Отримане з'єднання носить назву ацеталю і являє собою простий ефір нестійкого двоатомного спирту:

Реакція утворення ацеталів оборотна. При гідролізі у присутності кислот ацеталі легко розпадаються з утворенням вихідних альдегідів та спиртів. 4
Полімеризація. Альдегіди можуть утворювати лінійні або циклічні полімери, причому в обох випадках залишки молекул альдегідів зв'язуються між собою через атом

Як речовини, що прискорюють процес полімеризації альдегідів, застосовуються мінеральні кислоти. Циклічні полімери при нагріванні розщеплюються на молекули вихідних альдегідів.
Способи одержання.Окислення спиртів. Як ми знаємо, при окисленні первинних спиртів утворюються альдегіди, при окисленні вторинних - кетони. Окислення можна проводити за допомогою різних окислювачів, наприклад, біхроматом калію в кислому середовищі або киснем повітря в присутності каталізаторів - платини, міді та ін. В обох випадках реакції протікають за схемою:

Одержання з дигалоїдвиробних вуглеводнів. Якщо обидва атоми галоїду знаходяться в одного і того ж вуглецевого атома, то при нагріванні таких галоїдпохідних з водою або краще з лугом відбувається утворення альдегідів або кетонів:

Дія води на ацетиленові вуглеводні (реакція Кучерова). При дії води на ацетилен у присутності солей двовалентної ртуті виходить оцтовий альдегід:

Гомологи ацетилену у цих умовах утворюють кетони:

Оксосинтез. Оксосинтезом називається спосіб отримання кисневмісних органічних сполук шляхом взаємодії ненасичених вуглеводнівз окисом вуглецю та воднем при підвищеній температурі, у присутності кобальтового каталізатора та при тиску . В результаті цього процесу утворюються альдегіди, що містять на один атом вуглецю більше, ніж вихідний олефін:

Мурашиний альдегід (формальдегід)Безбарвний газ із різким специфічним запахом; добре розчинний у воді. Водний розчин формальдегіду, що містить формальдегіду розчину, носить назву формаліну. При випаровуванні розчину формальдегід полімеризується з утворенням твердої суміші низькомолекулярних поліоксиметиленів (параформальдегід), під дією кислот, що знову дає формальдегід.
Формальдегід – перший член гомологічного ряду альдегідів. У загальній формулі
у формальдегіду замість алкільного радикалу знаходиться атом водню. Тому деякі Хімічні властивостіФормальдегід різко відрізняються від властивостей інших альдегідів цього ряду. Так, найрімер, при дії лугів формальдегід на відміну інших альдегідів жирного ряду, що осмоляються лугами, утворює метиловий спирт і сіль мурашиної кислоти;
За цієї реакції одна молекула формальдегіду відновлюється до спирту, а інша окислюється до кислоти.
Формальдегід у величезних кількостях застосовується для виробництва фенолоформальдегідних, карбамідних та інших синтетичних полімерів. Винятково цінними властивостями має високомолекулярний полімер формальдегіду - поліформальдегід (стор. 327).
Значна кількість формальдегіду йде на приготування ізопрену (2-метилбутадієну-1,3) вихідної речовини для отримання синтетичного каучуку.
Процес отримання ізопрену з формальдегіду та ізобутилену протікає у дві стадії за схемою:

Друга стадія процесу протікає при 200-220 ° С у присутності похідних фосфорної кислоти як каталізатор.
Формальдегід є вихідною речовиною для виробництва барвників, фармацевтичних препаратів, синтетичного каучуку, вибухових речовин та багатьох інших органічних сполук. Формальдегід отруйний і навіть у невеликих концентраціях діє дратівливо на слизові оболонки.
Формалін (водний розчин формальдегіду) досить широко застосовується як антисептик (знезаражуючий засіб). Цікаво, що консервуючу дію диму при копченні продуктів харчування (риба, м'ясо) пояснюють сильною антисептичною дією формальдегіду, що утворюється в результаті неповного згоряння палива і міститься в димі в невеликій кількості.
Промисловим методом одержання формальдегіду є каталітичне окиснення метанолу. Метанол окислюють у газовій фазі киснем повітря при 500-600 °С:

Як каталізатори, застосовуються металеві мідь або срібло, обложені на інертному пористому носії, або у вигляді металевої сітки. (Останнім часом стали застосовувати, більш ефективний залізоокисномолібденовий
каталізатор.) Для зниження температури процесу, що сприяє реакції окислення та збільшення виходу формальдегіду, до метанолу додають 10-12% води.
На рис. 15 наведено принципову схему отримання формальдегіду шляхом окислення Метанолу.
Випарник 2 надходять метанол з мірника 1 і очищене повітря через повітродувку 4. У випарнику рідкий метанол випаровується і змішується з повітрям, в результаті чого утворюється пароповітряна суміш з вмістом метанолу на суміші. Нагріта до 100 °С пароповітряна суміш надходить в контактний апарат 6, в якому відбувається окислення метанолу при

Мал. 15. Схема виробництва формальдегіду окисленням метанолу: 1 – мірник; 2 – випарник; 3 – фільтр; 4 - повітродувка; 5 - підігрівач; 6 – контактний апарат; 7 – холодильник; 8, 10 – абсорбери; 9 – проміжний холодильник.
Продукти реакції направляються в холодильник 7 де вони охолоджуються до 100-130 °С. Потім вони надходять в абсорбери 8 і 10, в яких поглинається формальдегід, що утворився. Абсорбер 8 зрошується розведеним розчином формальдегіду, що надходить з абсорбера 10, зрошуваного водою. Таким чином, отриманий формальдегід виходить з абсорбера у вигляді водного розчину, що містить 37,6% формальдегіду та близько 10% метанолу. Вихід формальдегіду близько 80%. Гази, що відходять з абсорбера 10, містять азот (близько 70%), водень (близько 20%) і невеликі кількості метану, кисню, окису і двоокису вуглецю.
Останнім часом отримав промислове застосування спосіб синтезу формальдегіду шляхом неповноцінного окислення концентрованого метану киснем повітря:

Каталізатором служать оксиди азоту. (Окислення проводять. при температурі близько 600 °С.
Оцтовий альдегід (ацетальдегід)СН3-СНТ. Безбарвна рідина з різким запахом, добре розчинна у воді; темп. кіп. +21°С. Під дією кислот він легко полімеризується в циклічні полімери - паральдегід (рідина), і метальдегід (тверда речовина).
Оцтовий альдегід є найважливішою вихідною сполукою для отримання оцтової кислоти, синтетичних полімерів, лікарських сполук та багатьох інших речовин.
У промисловості мають найбільшого поширення такі методи одержання ацетальдегіду:
1. Пряма гідратація ацетилену водяною парою у присутності рідких ртутних каталізаторів (за реакцією Кучерова).
3. Пряме окислення етилену киснем повітря в присутності рідких каталізаторів паладієвих.
Гідратація ацетилену в присутності ртутних каталізаторів проводить шляхом пропускання ацетилену, змішаного з водяною парою при 90-100°С, гідрататор, заповнений каталізатором, так званої «контактної» кислотою (розчин сірчанокислої ртуті в сірчаній кислоті). В гідрататор також надходить безперервно або періодично) металева ртуть, що утворює із сірчаною кислотою сірчанокислу ртуть. Суміш ацетилену з водяною парою барботує через кислотний шар; при цьому відбувається гідратація ацетилену та утворення ацетальдегіду. Парогазову суміш, що виходить з гідрататора, конденсують і виділений ацетальдегід відокремлюють від домішок. Вихід ацетальдегіду (вважаючи ацетилен) досягає 95%.
При гідратації ацетилену в присутності нертутних каталізаторів ацетилен розбавляють азотом, змішують з водяною парою і отриману парогазову суміш пропускають при високій температурінад нертутним каталізатором, наприклад оксидами цинку, кобальту, хрому чи інших металів. Тривалість контакту парогазової суміші з каталізатором становить частки секунди, внаслідок цього відсутні побічні реакції, що призводить до збільшення виходу ацетальдегіду і отримання більш чистого продукту.
Дуже перспективним промисловим методом отримання ацетальдегіду є пряме окислення етилену киснем повітря в присутності рідких каталізаторів паладієвих:

Реакція протікає значно більше складній схемі, чим це зображено вище, причому утворюється низка побічних продуктів. Процес проводять у трубчастих реакторах при температурі близько 120 ° С та тиску.
Ацетон (диметилкетон)Безбарвна рідина з характерним запахом, добре розчинна у воді, темп. кіп. 56,1 °С.
Ацетон є прекрасним розчинником багатьох органічних речовині тому широко застосовується в різних галузях промисловості (виробництво штучного волокна, лікарських препаратів та ін.). Ацетон використовують для синтезу різних органічних сполук.
З ацетону та ацетилену А. Є. Фаворським було отримано ізопрен. Реакція протікає у три стадії:

Основним промисловим методом отримання ацетону є одержання його із ізопропілбензолу одночасно з фенолом (стор. 234).
Деяка кількість ацетону виходить окислювальним дегідруванням або дегідруванням ізопропілового спирту.
Окисне дегідрування ізопропілового спирту може бути проведене над срібним каталізатором при 450-500 °C:

Як побічні продукти утворюються двоокис вуглецю, пропілен і оцтова кислота. Цей процес може проводитися також у рідкій фазі при атмосферному тиску та температурі близько 150 °С:

Перекис водню, що утворюється, використовується для різних синтезів, наприклад для отримання гліцерину з акролеїну (стор. 96).
Дегідрування ізопропілового спирту проводять у паровій фазі при 350-400 °С у присутності мідного каталізатора:

(Для найпростішого альдегіду R=H)
Класифікація альдегідів
За будовою вуглеводневого радикалу:
Граничні; наприклад:

Ненасичені; наприклад:

Ароматичні; наприклад:

Аліциклічні; наприклад:

Загальна формула граничних альдегідів

Гомологічний ряд, ізомерія, номенклатура

Альдегіди ізомерні іншому класу сполук – кетонам

наприклад:

Альдегіди та кетони містять карбонільну групу ˃C=O, тому називаються карбонільними сполуками.
Електронна будова молекул альдегідів
Атом вуглецю альдегідної групи знаходиться в стані sp 2 -гібридизації, тому всі зв'язку в цій групі розташовуються в одній площині. Хмари р-електронів, що утворюють π-зв'язок, перпендикулярні цій площині і легко зміщуються до більш негативного атома кисню. Тому подвійний зв'язок C=O (на відміну подвійного зв'язку C=C в алкенах) сильно поляризована.
Фізичні властивості

Хімічні властивості
Альдегіди - реакційні сполуки, що вступають у численні реакції. Найбільш характерні для альдегідів:
а) реакції приєднання по карбонільній групі; реагенти типу НХ приєднуються так:

б) реакції окиснення зв'язку C-Hальдегідної групи, в результаті яких утворюються карбонові кислоти:
I. Реакції приєднання
1. Гідрування (утворюються первинні спирти

2. Приєднання спиртів (утворюються напівацеталі та ацеталі)

У надлишку спирту в присутності HCl напівацеталі перетворюються на ацеталі:

ІІ. Реакції окиснення
1. Реакція «срібного дзеркала»

Спрощено:

Ця реакція є якісною реакцієюна альдегідну групу (на стінках реакційної судини утворюється дзеркальний наліт металевого срібла).
2. Реакція з гідроксидом міді (II)

Ця реакція також є якісною реакцією на альдегідну групу (випадає червоний осад Сu 2 O).
Формальдегід окислюється різними O-вмісними окислювачами спочатку до мурашиної кислоти і далі - до Н 2 СО 3 (СО 2 + Н 2 O):

ІІІ. Реакції ді-, три- та полімеризації
1. Альдольна конденсація

2. Тримеризація ацетальдегіду

3. Полімеризація формальдегіду
При тривалому зберіганні формаліну (40% водний розчин формальдегіду) в ньому відбувається полімеризація з утворенням білого осаду параформа:

IV. Реакція поліконденсації формальдегіду з фенолом

Зміст статті
АЛЬДЕГІДИ І КЕТОНИ– органічні сполуки, що містять фрагмент >C=O (вуглець, пов'язаний подвійним зв'язком з киснем, його називають карбонільним). У альдегідів карбонільний вуглець з'єднаний з атомом Н та органічною групою R (загальна формула RHC=O), а в кетонах – з двома органічними групами (загальна формула R 2 С=О).
Номенклатура альдегідів та кетонів. Групу -(Н)С=О називають альдегідною, для зв'язування з органічними групами у неї є лише одна вільна валентність, це дозволяє їй знаходиться тільки на кінці вуглеводневого ланцюга (але не в середині). При складанні назви альдегіду вказується назва відповідного вуглеводню, до якого додається суфікс «аль», наприклад, метаналь Н 2 С=О, етаналь Н 3 СС(Н)=О, пропаналь Н 3 ССН 2 С(Н)=О. У складніших випадках вуглецевий ланцюг групи R нумерують, починаючи з карбонильного вуглецю, потім за допомогою числових індексів вказують положення функціональних груп і різних заступників.
Мал. 1. НОМЕНКЛАТУРА АЛЬДЕГІДІВ. Заміщаючі та функціональні групи, а також відповідні ним цифрові індекси виділені різними кольорами.
Для деяких альдегідів часто використовують тривіальні (спрощені) назви, що склалися історично, наприклад, формальдегід Н 2 С=О, ацетальдегід Н 3 СС(Н)=О, кротоновий альдегід СН 3 СН=CHC(H)=O.
На відміну від альдегідної, кетонна група >C=O може знаходитися також у середині вуглеводневого ланцюга, тому в простих випадкахвказують назви органічних груп (згадуючи їх у порядку збільшення) і додають слово «кетон»: диметилкетон CH3-CO-CH3, метилетилкетон CH3CH2-CO-CH3. У складніших випадках положення кетонної групи у вуглеводневому ланцюгу вказують цифровим індексом, додаючи суфікс « він». Нумерацію вуглеводневого ланцюга починають з того кінця, що знаходиться ближче до кетонної групи (рис. 2).

Мал. 2. НОМЕНКЛАТУРА КЕТОНІВ. Замісні та функціональні групи та відповідні їм цифрові індекси виділені різними кольорами.
Для найпростішого кетону CH 3 -CO-CH 3 прийнята тривіальна назва - ацетон.
Хімічні властивості альдегідів та кетонів
визначаються особливостями карбонільної групи >C=O, що має полярність – електронна щільність між атомами С і О розподілена нерівномірно, зсунута до більш електронегативного атома О. В результаті карбонільна група набуває підвищеної реакційну здатність, що проявляється у різноманітних реакціях приєднання по подвійному зв'язку. У всіх випадках кетони менш реакційноздатні, ніж альдегіди, зокрема через просторові труднощі, створювані двома органічними групами R, найбільш легко бере участь в реакціях формальдегід Н 2 С=О.
1. Приєднання подвійного зв'язку С=О.
При взаємодії зі спиртами альдегіди утворюють напівацеталі – сполуки, що містять одночасно алкокси- та гідрокси-групу одного атома вуглецю: >C(OH)OR. Напівацеталі можуть далі реагувати ще з однією молекулою спирту, утворюючи повні ацеталі – сполуки, де в одного атома вуглецю знаходяться одночасно дві RО-групи: >C(OR) 2 . Реакцію каталізують кислоти та основи (рис. 3А). У разі кетонів приєднання спиртів до подвійного зв'язку С=О утруднено.
Подібним чином альдегіди та кетони реагують із синильною кислотою HCN, утворюючи гідроксинітрили – сполуки, що містять в одного атома вуглецю ОН- та CN-групу: >C(OH)Cє N (рис. 3Б). Реакція примітна тим, що дозволяє збільшувати вуглецевий ланцюг (виникає новий зв'язок С-С).
Точно так само (розкриваючи подвійний зв'язок С=О) аміак та аміни реагують з альдегідами та кетонами, продукти приєднання нестійкі та конденсуються з виділенням води та утворенням подвійного зв'язку C=N. У разі аміаку виходять іміни (рис. 3В), та якщо з амінів утворюються звані підстави Шиффа – сполуки, містять фрагмент >C=NR (рис. 3Г). Продукт взаємодії формальдегіду з аміаком дещо інший – це результат циклізації трьох проміжних молекул, в результаті виходить каркасна сполука гексаметилентетраміну, яка використовується в медицині як препарат уротропін (рис. 3Д).

2. Реакція конденсації. Для альдегідів і кетонів можлива конденсація, що проходить між двома молекулами однієї і тієї ж сполуки. При такій конденсації альдегідів подвійний зв'язок однієї з молекул розкривається, утворюється з'єднання, що містить одночасно альдегідну та ОН-групу, зване альдолем (альдегідоспірт). конденсацію, Що Протікає, називають, відповідно, альдольною, цю реакцію каталізують підстави (рис. 4А). Отриманий альдоль може далі конденсуватися з утворенням подвійного зв'язку С=З виділенням конденсаційної води. У результаті виходить ненасичений альдегід (рис. 4А, кротоновий альдегід). Таку конденсацію називають кротоновою за назвою першого з'єднання в ряді ненасичених альдегідів. Кетони також здатні брати участь у альдольної конденсації (рис. 4б), а друга стадія – кротонова конденсація, їм утруднена. В альдольної конденсації можуть спільно брати участь молекули різних альдегідів, а також одночасно альдегід та кетон, у всіх випадках відбувається подовження вуглецевого ланцюга. Кротоновий альдегід, що вийшов на останній стадії (рис. 4А), володіючи всіма властивостями альдегідів, може далі брати участь в альдольної і кротонової конденсації при взаємодії з черговою порцією ацетальдегіду, з якого він і був отриманий (рис. 4В). Таким способом можна подовжувати вуглеводневий ланцюг, отримуючи сполуки, в яких чергуються прості та подвійні зв'язки: СН=СН–СН=СН–.

Конденсація альдегідів і кетонів з фенолами йде з видаленням карбонільного атома (у вигляді води), а метиленова група СН 2 або заміщена метиленова група (СНR або СR 2) вбудовується між двома молекулами фенолу. Найбільш широко цю реакцію застосовують для одержання фенолоформальдегідних смол (рис. 5).

Мал. 5. КОНДЕНСАЦІЯ ФЕНОЛУ З ФОРМАЛЬДЕГІДОМ
3. Полімеризація карбонільних сполук протікає з розкриттям подвійного зв'язку С=О та властива, в основному, альдегідам. При упарюванні у вакуумі водних розчинів формальдегіду утворюється суміш циклічних сполук (в основному триоксиметилен) та лінійних продуктів з незначною довжиною ланцюга n = 8–12 (параформ). Полімеризацією циклічного продукту отримують поліформальдегід (рис. 6) – полімер з високою міцністю та хорошими електроізоляційними властивостями, що використовується як конструкційний матеріал у машино- та приладобудуванні.

Мал. 6. ПРОДУКТИ ПОЛІМЕРИЗАЦІЇ ФОРМАЛЬДЕГІДУ
4. Відновлення та окислення. Альдегіди і кетони є як би проміжні сполуки між спиртами і карбоновими кислотами: відновлення призводить до спиртів, а окислення - до карбонових кислот. При дії Н 2 (у присутності каталізатора Pt або Ni) або інших реагентів, що відновлюють, наприклад, LiAlH 4 , альдегіди відновлюються, утворюючи первинні спирти, а кетони - вторинні спирти (рис. 7, схеми А і Б).
Окислення альдегідів до карбонових кислот проходить досить легко в присутності Про 2 або при дії слабких окислювачів, таких як розчин аміаку гідроксиду срібла (рис. 7В). Ця ефектна реакція супроводжується утворенням срібного дзеркала внутрішньої поверхніреакційного приладу (частіше звичайної пробірки), її використовують для якісного виявлення альдегідної групи. На відміну від альдегідів, кетони більш стійкі до окислення, при їх нагріванні в присутності сильних окислювачів, наприклад, КМnО 4 утворюються суміші карбонових кислот, що мають укорочений (у порівнянні з вихідним кетоном) вуглеводневий ланцюг.

Мал. 7. ВІДНОВЛЕННЯ І ОКІСЛЕННЯ АЛЬДЕГІДІВ І КЕТОНІВ
Додатковим підтвердженням того, що альдегіди займають проміжне положення між спиртами і кислотами, є реакція, в результаті якої з двох молекул альдегіду виходять спирт і карбонова кислота (рис. 8А), тобто. одна молекула альдегіду окислюється, іншу відновлюється. У деяких випадках дві отримані сполуки – спирт та карбонова кислота – далі реагують між собою, утворюючи складний ефір (рис.8Б).

Мал. 8 . ОКИСЛЕННЯ ТА ВІДНОВЛЕННЯ АЛЬДЕГІДІВ
Одержання альдегідів та кетонів.
Найбільш універсальний спосіб – окислення спиртів, у своїй з первинних спиртів утворюються альдегіди, та якщо з вторинних – кетони (рис. 9А і Б). Це реакції, обернені до реакцій на рис. 7А та Б. Реакція повертає «назад», якщо змінено діючий реагент (окислювач замість відновника) і каталізатор, при окисленні спиртів ефективний мідний каталізатор.
У промисловості ацетальдегід отримують окисленням етилену (рис. 9В), на проміжній стадії утворюється спирт, у якого ОН-група «примикає» до подвійного зв'язку (вініловий спирт), такі спирти нестійкі і відразу ізомеризуються в карбонільні сполуки. Інший спосіб - каталітична гідратація ацетилену (рис. 9г), проміжне з'єднання - вініловий спирт. Якщо замість ацетилену взяти метилацетилен, то вийде ацетон (рис. 9Д). Промисловий спосіб одержання ацетону – окисленням кумолу. Ароматичні кетони, наприклад ацетофенон, отримують каталітичним приєднанням ацетильної групи до ароматичного ядра(Рис. 9Е).

Застосування альдегідів та кетонів.
Формальдегід Н 2 С=О (його водний розчин називають формаліном) використовують як дубитель шкіри та консервант біологічних препаратів.
Ацетон (СН 3) 2 С=О – широко застосовуваний екстрагент і розчинник лаків та емалей.
Ароматичний кетон бензофенон (С 6 Н 5) 2 С=Про запах герані, використовується в парфумерних композиціях і для ароматизації мила.
Деякі з альдегідів були спочатку знайдені у складі ефірних олій рослин, а згодом штучно синтезовані.
Аліфатичний альдегід СН 3 (СН 2) 7 С(Н)=О (тривіальна назва – пеларгоновий альдегід) міститься в ефірних оліях цитрусових рослин, має запах апельсина, його використовують як харчовий ароматизатор.
Ароматичний альдегід ванілін (рис. 10) міститься в плодах тропічної рослини ванілі, зараз частіше використовується синтетичний ванілін – широко відома ароматизуюча добавка до кондитерських виробів (рис. 10).

Мал. 10. ВАНІЛІН
Бензальдегід С 6 Н 5 С(Н)=Про запах гіркого мигдалю міститься в мигдальній олії і в ефірному маслі евкаліпта. Синтетичний бензальдегід використовується в харчових ароматичних есенціях та парфумерних композиціях.
Бензофенон (С 6 Н 5) 2 С=О та його похідні здатні поглинати УФ-промені, що визначило їх застосування в кремах і лосьйонах від засмаги, крім того, деякі похідні бензофенону мають протимікробну активність і застосовуються як консерванти. Бензофенон має приємний запах герані, і тому його використовують у парфумерних композиціях та для ароматизації мила.
Здатність альдегідів і кетонів брати участь у різних перетвореннях визначила їх основне застосування як вихідних сполук для синтезу різноманітних органічних речовин: спиртів, карбонових кислот та їх ангідридів, лікарських препаратів (уротропін), полімерних продуктів (фенолоформальдегідні смоли, поліформальдегідів) на основі бензальдегіду) та барвників.
Михайло Левицький
Альдегідами називають сполуки, молекули яких містять карбонільну групу, сполучену з атомом водню, тобто. загальна формула альдегідів може бути записана як
де R - вуглеводневий радикал, який може бути різного ступеня насиченості, наприклад, граничний або ароматичний.
Групу СНТ називають альдегідною.
Кетони – органічні сполуки, в молекулах яких міститься карбонільна група, поєднана з двома вуглеводневими радикалами. Загальну формулукетонів можна записати як:
де R і R' - вуглеводневі радикали, наприклад, граничні (алкіли) або ароматичні.
Гідрування альдегідів та кетонів
Альдегіди та кетони можуть бути відновлені воднем у присутності каталізаторів та нагріванні до первинних та вторинних спиртів відповідно:
Окислення альдегідів
Альдегіди легко можуть бути окислені навіть такими м'якими окислювачами, як гідроксид міді та розчин аміаку оксиду срібла.
При нагріванні гідроксиду міді з альдегідом відбувається зникнення початкового блакитного фарбування реакційної суміші, утворюється цегляно-червоний осад оксиду одновалентної міді:
В реакції з аміачним розчином оксиду срібла замість самої карбонової кислоти утворюється її амонійна сіль, оскільки аміак, що знаходиться в розчині, реагує з кислотами:
Кетони в реакцію з гідроксидом міді (II) і розчином аміачним оксиду срібла не вступають. Тому ці реакції є якісними на альдегіди. Так реакція з аміачним розчином оксиду срібла за правильної методики її проведення призводить до утворення на внутрішній поверхні реакційної судини характерного срібного дзеркала.
Очевидно, що якщо м'які окислювачі можуть окислити альдегіди, то само собою це можуть зробити сильніші окислювачі, наприклад, перманганат калію або дихромат калію. При використанні даних окислювачів у присутності кислот утворюються карбонові кислоти:
Хімічні властивості карбонових кислот
Карбоновими кислотами називають похідні вуглеводнів, що містять одну або декілька карбоксильних груп.
Карбоксільна група:
Як можна бачити, карбоксильна група складається з карбонільної групи-С(О)- , сполученої з гідроксильною групою-ОН.
У зв'язку з тим, що до гідроксильної групи безпосередньо прикріплена карбонільна, що має негативний індуктивний ефект. зв'язок О-Нє більш полярною, ніж у спиртах та фенолах. З цієї причини карбонові кислоти мають помітно більш виражені, ніж спирти і феноли, кислотними властивостями. У водних розчинах вони виявляють властивості слабких кислот, тобто. оборотно дисоціюють на катіони водню (Н+) та аніони кислотних залишків:
Реакції утворення солей
З утворенням солей карбонові кислоти реагують з:
1) металами до водню у низці активності:
2) аміаком
3) основними та амфотерними оксидами:
4) основними та амфотерними гідроксидамиметалів:
5) солями слабших кислот – карбонатами та гідрокарбонатами, сульфідами та гідросульфідами, солями вищих (з великим числом атомів вуглецю в молекулі) кислот:
Систематичні та тривіальні назви деяких кислот та їх солей представлені в наступній таблиці:
| Формула кислоти | Назва кислоти тривіальна/систематична | Назва солі тривіальна/систематична |
| HCOOH | мурашина/метанова | форміат/метаноат |
| CH 3 COOH | оцтова/етанова | ацетат/етаноат |
| CH 3 CH 2 COOH | пропіонова/пропанова | пропіонат/пропаноат |
| CH 3 CH 2 CH 2 COOH | масляна/бутанова | бутират/бутаноат |
Слід пам'ятати і зворотне: сильні мінеральні кислоти витісняють карбонові кислоти з їх солей як слабкіші:
Реакції за участю ОН групи
Карбонові кислоти вступають у реакцію етерифікації з одноатомними та багатоатомними спиртами в присутності сильних неорганічних кислот, при цьому утворюються складні ефіри:
Даного типу реакції відносяться до оборотних, у зв'язку з чим з метою усунення рівноваги у бік утворення складного ефіру їх слід здійснювати, відганяючи більш леткий складний ефір при нагріванні.
Зворотній реакції етерифікації процес називають гідролізом складного ефіру:
Необоротно дана реакція протікає в присутності лугів, оскільки кислота, що утворюється, реагує з гідроксидом металу з утворенням солі:
Реакції заміщення атомів водню у вуглеводневому заступнику
При проведенні карбонових реакцій з хлором або бромом у присутності червоного фосфору при нагріванні відбувається заміщення атомів водню при α-атомі вуглецю на атоми галогену:
У разі більшої пропорції галоген/кислота може відбутися глибше хлорування:
Реакції руйнування карбоксильної групи (декарбоксилювання)
Особливі хімічні властивості мурашиної кислоти
Молекула мурашиної кислоти, незважаючи на свої малі розміри, містить відразу дві функціональні групи:
У зв'язку з цим вона виявляє як властивості кислот, а й властивості альдегідів:
При дії концентрованої сірчаної кислоти мурашина кислота розкладається на воду та чадний газ.