ІІ.1. Конформації (поворотна ізомерія)
Перехід від найпростішого органічного вуглеводню - метану, для його найближчого гомологу - етану ставить проблеми просторової будови, на вирішення яких недостатньо знати розглянуті розділ параметри. Справді, не змінюючи ні валентних кутів, ні довжин зв'язків, можна уявити безліч геометричних форм молекули етану, що відрізняються один від одного взаємним поворотом вуглецевих тетраедрів навколо зв'язку С-С, що з'єднує їх. Внаслідок такого обертання виникають поворотні ізомери (конформери) . Енергія різних конформерів неоднакова, але енергетичний бар'єр, що розділяє різні поворотні ізомери, для більшості органічних сполукневеликий. Тому за звичайних умов, як правило, не можна зафіксувати молекули в одній строго певній конформації: зазвичай у рівновазі співіснують кілька поворотних форм, що легко переходять одна в одну.
Способи графічного зображення конформацій та його номенклатура такі. Розгляд почнемо із молекули етану. Для неї можна передбачати існування двох конформацій, що максимально розрізняються по енергії. Вони зображені нижче у вигляді перспективних проекцій (1) ("лісопильні козли"), бічних проекцій (2) та формул Ньюмена (3).
У перспективній проекції (1а, 1б) зв'язок С-С треба уявити собі вдалину; вуглецевий атом, що стоїть зліва, наближений до спостерігача, стоїть праворуч - віддалений від нього.
У бічній проекції (2а, 2б) чотири Н-атоми лежать у площині креслення; атоми вуглецю насправді дещо виходять із цієї площини, але зазвичай спрощено вважають їх також лежать у площині креслення. "Жирні" клиноподібні зв'язки потовщенням клина показують на вихід з площини до спостерігача того атома, до якого звернено потовщення. Пунктирні клиноподібні зв'язки відзначають віддалення від спостерігача.
У проекції Ньюмена (3а, 3б) молекулу розглядають уздовж зв'язку С-С (у напрямку, вказаному стрілкою на формулах 1а, б). Три лінії, що розходяться під кутом 120 про з центру кола, позначають зв'язки найближчого до спостерігача вуглецевого атома; лінії, що "висовуються" через коло - зв'язки віддаленого вуглецевого атома.
Зображену ліворуч конформацію називають заслоненою : назва ця нагадує про те, що атоми водню обох СН 3 -груп знаходяться один проти одного. Затулена конформація має підвищену внутрішню енергію, і тому невигідна. Конформацію, зображену праворуч, називають загальмованою , Маючи на увазі, що вільне обертання навколо зв'язку С-С "гальмується" у цьому становищі, тобто. молекула існує переважно у цій конформації.
Мінімум енергії, необхідний для повного обертання молекули навколо певного зв'язку називається бар'єром обертання для зв'язку. Бар'єр обертання в молекулі, подібній до етану, може бути виражений через зміну потенційної енергії молекули як функції зміни двогранного (торсійного) кута системи. Двогранний кут (тау, що позначається) зображений на малюнку, наведеному нижче:

Енергетичний профіль обертання навколо зв'язку С-С в етані показано на малюнку. Обертання "заднього" атома вуглецю зображено зміною двогранного кута між двома показаними атомами водню. Для простоти інші атоми водню опущені. Бар'єр обертання, що розділяє дві форми етану, становить лише 3 ккал/моль (12.6 кДж/моль). Мінімуми кривої потенційної енергії відповідають загальмованим конформаціям, максимуми – заслоненим. Оскільки при кімнатній температурі енергія деяких зіткнень молекул може досягати 20 ккал/моль (близько 80 кДж/моль), цей бар'єр в 12.6 кДж/моль легко долається і обертання в етані розглядають як вільне.

Наголосимо, що кожна точка на кривій потенційної енергії відповідає певній конформації. Крапки, що відповідають мінімумам, відповідають конформаційним ізомерам, тобто переважним компонентам у суміші всіх можливих конформацій .
З ускладненням молекули число можливих конформацій, що помітно відрізняються по енергії, зростає. Так, для н-бутану можна зобразити вже шість конформацій, що відрізняються взаємним розташуваннямСН 3-груп, тобто. поворотом навколо центрального зв'язку С-С. Нижче конформації н-бутану зображені у вигляді проекцій Ньюмена. Зображені зліва (заслонені) конформації енергетично невигідні, практично реалізуються лише загальмовані.

Різні заслонені та загальмовані конформації бутану неоднакові щодо енергії. Відповідні енергії всіх конформацій, що виникають при обертанні навколо центрального С-З зв'язку, представлені нижче:



У міру ускладнення молекули кількість можливих конфомацій зростає.
Отже, конформації - це різні неідентичні просторові форми молекули, мають певну конфігурацію. Конформери - це стереоізомерні структури, що знаходяться в рухомій рівновазі та здатні до взаємоперетворення шляхом обертання навколо простих зв'язків.
Іноді бар'єр таких перетворень стає досить високим, щоб розділити стереоізомерні форми (приклад – оптично активні дифеніли; ). У таких випадках говорять уже не про конформери, а про реально існуючі стереоізомерах .
ІІ.2. Геометрична ізомерія
Важливе наслідок жорсткості подвійного зв'язку (відсутності обертання навколо неї) – існування геометричних ізомерів . Найпоширеніші з них – це цис-транс-ізомери сполук етиленового ряду, що містять у ненасичених атомів неоднакові замісники. Найпростішим прикладом можуть бути ізомери бутена-2.

Геометричні ізомери мають однакове хімічна будова(однаковий порядок хімічного зв'язку), розрізняючись за просторовим розташуванням атомів, конфігурації . Ця різниця і створює різницю у фізичних (а також хімічних властивостях). Геометричні ізомери, на відміну конформерів, можуть бути виділені в чистому вигляді і існують як індивідуальні, стійкі речовини. Для взаємного перетворення необхідна зазвичай енергія порядку 125-170 кДж/моль (30-40 ккал/моль). Цю енергію можна повідомити нагріванням чи опроміненням.
У найпростіших випадках номенклатура геометричних ізомерів не становить труднощів: цис- формами називають геометричні ізомери, у яких однакові замісники лежать по один бік від площини пі-зв'язку, транс- ізомери мають однакові замісники на різних сторонах від площини пі-зв'язку. У складніших випадках застосовується Z,E-номенклатура . Її головний принцип: для позначення конфігурації вказують цис-(Z, від німецької Zusammen - разом) або транс-(Е, від німецької Entgegen - навпаки) розташування старших заступників при подвійному зв'язку.
У Z,E-системі старшими вважаються заступники з великим атомним номером. Якщо атоми, безпосередньо пов'язані з ненасиченими вуглецями, однакові, то переходять до "другого шару", у разі потреби - до "третього шару" тощо.
Розглянемо застосування правил Z,E-номенклатури двох прикладах.

| I | II |
Почнемо з формули I, де вирішується атомами " першого шару " . Розставивши їх атомні номери, отримаємо, що старші заступники кожної пари (бром у верхній частині формули та азот у нижній) знаходяться в транс-положенні, звідси випливає стереохімічне позначення Е:
 Е-1-бром-1-хлор-2-нітроетен
Е-1-бром-1-хлор-2-нітроетен
Для визначення стереохімічного позначення структури II необхідно шукати різницю у "вищих шарах". По першому шару групи СН 3 З 2 Н 5 З 3 Н 7 не відрізняються. У другому шарі у групи СН 3 сума атомних номерів дорівнює трьом (три атоми водню), у груп С 2 Н 5 і С 3 Н 7 - по 8. Значить, група СН 3 не розглядається - вона молодша за два інші. Таким чином, старші групи - це З 2 Н 5 і З 3 Н 7, він знаходяться в цис-положенні; стереохімічні позначення Z.
 Z-3-метилгептен-3
Z-3-метилгептен-3
Якби знадобилося визначити, яка група старша - З 2 Н 5 або З 3 Н 7 довелося б перейти до атомів "третього шару", сума атомних номерів у цьому шарі для обох груп виявилися б відповідно рівними 3 і 8, тобто. З 3 Н 7 старше, ніж З 2 Н 5 . У складніших випадках визначення старшинства треба враховувати додаткові умови, а саме: атом, пов'язаний подвійним зв'язком, вважається двічі, пов'язаний потрійний - тричі; у складі ізотопів старше тяжчий (дейтерій старше водню) та інших.
Зазначимо, що позначення Z не є синонімами цис-позначень, як і позначення Е не завжди відповідають розташуванню транс-, наприклад:

цис- 1,2-дихлорпропен-1 цис- 1,2-дихлор-1-бромпропен-1
Z-1,2-дихлорпропен-1 Е-1,2-дихлор-1-бромпропен-1
Контрольні завдання
1. Бомбікол - феромон (статевий атрактант) тутового шовкопряда - являє собою E-10-Z-12-гексадекадієнол-1. Зобразіть його структурну формулу.
2. Назвіть за Z, E-номенклатурою такі з'єднання:

ІІ.3. Оптична ізомерія (енантіомерія)
Серед органічних сполук зустрічаються речовини, здатні обертати площину поляризації світла. Це явище називають оптичною активністю, а відповідні речовини - оптично активними . Оптично активні речовини зустрічаються у вигляді пар оптичних антиподів - ізомерів, фізичні та хімічні властивостіяких у звичайних умовах однакові, за винятком одного – знака обертання площини поляризації. (Якщо один із оптичних антиподів має, наприклад, питоме обертання [ПРИМ.1] +20 про, то інший - питоме обертання -20 про).
ІІ.4. Проекційні формули
Для умовного зображення асиметричного атома на площині користуються проекційними формулами Е.Фішера . Їх одержують, проецируя на площину атоми, із якими пов'язаний асиметричний атом. При цьому сам асиметричний атом, як правило, опускають, зберігаючи лише лінії, що перехрещуються, і символи заступників. Щоб пам'ятати про просторове розташування заступників, часто зберігають у проекційних формулах уривчасту вертикальну лінію (верхній та нижній заступник видалені за площину креслення), проте часто цього не роблять. Нижче наведено різні способизапису проекційної формули, що відповідає лівій моделі на попередньому малюнку:

Наведемо кілька прикладів проекційних формул:

(+)-аланін (-)-бутанол (+)-гліцериновий альдегід
При назвах речовин наведено їх знаки обертання: це означає, наприклад, що лівообертальний антипод бутанолу-2 має просторову конфігурацію , що виражається саме наведеною вище формулою, а її дзеркальне зображення відповідає правообертального бутанолу-2. Визначення конфігурації оптичних антиподів проводиться експериментально [ПРИМ.3] .
У принципі, кожен оптичний антипод може бути зображений дванадцятьма (!) різними проекційними формулами - залежно від того, як розташована модель під час проекції, з якого боку ми дивимося на неї. Щоб стандартизувати проекційні формули, запроваджено певні правила їх написання. Так, головну функцію, якщо вона стоїть наприкінці ланцюга, прийнято ставити нагорі, головний ланцюг зображати вертикально.
Щоб зіставляти " нестандартно " написані проекційні формули, треба знати такі правила перетворення проекційних формул.
1. Формули можна обертати у площині креслення на 180 о, не змінюючи їх стереохімічного сенсу:

2. Дві (чи будь-яке парне число) перестановки заступників в одного асиметричного атома не змінюють стереохімічного змісту формули:

3. Одна (або будь-яка непарна кількість) перестановок заступників у асиметричного центру призводить до формули оптичного антипода:

4. Поворот у площині креслення на 90 про перетворює формулу на антиподну, якщо при цьому одночасно не змінити умову розташування заступників щодо площини креслення, тобто. не вважати, що тепер бічні заступники знаходяться за площиною креслення, а верхній та нижній – перед нею. Якщо користуватися формулою з пунктиром, то орієнтація пунктира, що змінилася, прямо нагадає про це:

5. Замість перестановок проекційні формули можна перетворювати шляхом обертання будь-яких трьох заступників за годинниковою стрілкою або проти неї; четвертий заступник у своїй положення не змінює (така операція еквівалентна двом перестановкам):

6. Проекційні формули не можна виводити з площини креслення (тобто не можна, наприклад, розглядати їх "на просвіт" зі зворотного боку паперу – при цьому стереохімічний зміст формули зміниться).
ІІ.5. Рацемати
Якщо у формулі речовини є асиметричний атом, це зовсім не означає, що така речовина матиме оптичну активність. Якщо асиметричний центр виникає під час нормальної реакції (заміщення групи СН 2 , приєднання з подвійного зв'язку тощо.), то можливість створення обох антиподних змін однакова. Тому, незважаючи на асиметрію кожної окремої молекули, речовина, що виходить, виявляється оптично неактивним. Такі оптично неактивні модифікації, що складаються з рівної кількості обох антиподів, називаються рацематами [ПРИМ.4] .
ІІ.6. Діастереомерія
З'єднання з декількома асиметричними атомами мають важливі особливості, що відрізняють їх від розглянутих раніше більш простих оптично активних речовин з одним центром асиметрії.
Припустимо, що в молекулі якоїсь речовини є два асиметричні атоми; позначимо їх умовно А та Б. Легко бачити, що можливі молекули з наступними комбінаціями:
Молекули 1 та 2 являють собою пару оптичних антиподів; те саме відноситься і до пари молекул 3 і 4. Якщо ж порівнювати один з одним молекули з різних пар антиподів - 1 і 3, 1 і 4, 2 і 3, 2 і 4, то ми побачимо, що перелічені пари не є оптичними антиподами: конфігурація одного асиметричного атома вони збігається, конфігурація іншого - не збігається. Все це пари діастереомірів , тобто. просторових ізомерів, не складових один з одним оптичних антиподів
Діастереомери відрізняються один від одного не тільки оптичним обертанням, а й усіма іншими фізичними константами: у них різні температури плавлення і кипіння, різні розчинності та ін.
Прикладом сполуки даного типу може бути хлоряблочна кислота

Її стереоізомерні форми мають такі проекційні формули:

еритро-форми трео-форми
Назви еритро- І трео- походять від назв вуглеводів еритрози та треози. Ці назви використовують із зазначення взаємного становища заступників у сполук із двома асиметричними атомами: еритро -ізомераминазивають ті, у яких два однакові бічні заступники стоять у стандартній проекційній формулі на одній стороні (праворуч або зліва); трео -ізомеримають однакові бічні замісники на різних сторонах проекційної формули [ПРИМ.5] .
Два еритро-ізомеру являють собою пару оптичних антиподів, при їх змішуванні утворюється рацемат. Парою оптичних ізомерів є і трео-форми; вони теж дають при змішуванні рацемат, що відрізняється за властивостями від рацемату. еритро-форми. Таким чином, всього існують чотири оптично активні ізомери хлорябкової кислоти і два рацемати.
При подальшому зростанні числа асиметричних центрів кількість просторових ізомерів зростає, причому кожен новий асиметричний центр удвічі збільшує кількість ізомерів. Воно визначається формулою 2 n де n - число асиметричних центрів.
Число стереоізомерів може зменшуватися через часткову симетрію, що з'являється в деяких структурах. Прикладом може бути винна кислота, яка має кількість індивідуальних стереоізомерів скорочується до трьох. Їхні проекційні формули:

Формула I ідентична з формулою Iа: перетворюється на неї при повороті на 180 про площині креслення і, отже, не зображує нового стереоізомеру. Це оптично неактивна модифікація. мезо-форма . На відміну від рацемату, який може бути розщеплений на оптичні антиподи, мезо-форма принципово нерозщеплювана: кожна її молекула має один асиметричний центр однієї конфігурації, другий - протилежної. Через війну відбувається внутримолекулярная компенсація обертання обох асиметричних центрів.
Мезо-форми є у всіх оптично активних речовин з декількома однаковими (тобто пов'язаними з однаковими замісниками) асиметричними центрами [ПРИМ.6]. Проекційні формули мезо-форм завжди можна дізнатися з того, що їх завжди можна розділити горизонтальною лінією на дві половини, які за записом на папері формально ідентичні, насправді ж дзеркальні:

Формули II та III зображують оптичні антиподи винної кислоти; при їх змішуванні утворюється оптично неактивний рацемат – виноградна кислота.
ІІ.7. Номенклатура оптичних ізомерів
Найпростіша, найстаріша, проте й нині ще вживана система номенклатури оптичних антиподів заснована на порівнянні проекційної формули званого антипода з проекційною формулою якоїсь стандартної речовини, обраної як "ключ". Так, для альфа-оксикислот та альфа-амінокислот ключем є верхня частина їх проекційної формули (у стандартному записі):

L-оксикислоти (Х = ВІН) D-оксикислоти (Х = ВІН)
L-амінокислоти (Х = NH 2) D-амінокислоти (Х = NH 2)
Конфігурацію всіх альфа-оксикислот, що мають у стандартно написаній проекційній формулі Фішера гідроксильну групу зліва, позначають знаком L; якщо ж гідроксил розташований у проекційній формулі праворуч – знаком D[ПРИМ.7] .
Ключем для позначення конфігурації цукрів служить гліцериновий альдегід:

L-(-)-гліцериновий альдегід D-(+)-гліцериновий альдегід
У молекулах цукрів позначення D-або L-відноситься до конфігурації нижньогоасиметричний центр.
Система D-,L-позначень має суттєві недоліки: по-перше, позначення D-або L-вказує конфігурацію тільки одного асиметричного атома, по-друге, для деяких сполук виходять різні позначення, залежно від того, чи взятий як ключ гліцериновий альдегід або оксикислотний ключ, наприклад:

Ці недоліки системи ключів обмежують її застосування нині трьома класами оптично активних речовин: цукрами, амінокислотами та оксикислотами. На загальне застосування розрахована "R,S-система Кана, Інгольда та Прелога [ПРИМ.8] .
Для визначення R або S-конфігурації оптичного антипода необхідно розташувати тетраедр замісників навколо асиметричного вуглецевого атома таким чином, щоб молодший заступник (зазвичай це водень) мав напрямок "від спостерігача". Тоді якщо рух при переході по колу трьох інших заступників від старшого до середнього за старшинством і потім до наймолодшого відбувається проти годинникової стрілки - це R -ізомер (асоціюється з таким самим рухом руки при написанні літери R), якщо за годинниковою стрілкою - це S- ізомер (асоціюється з таким самим рухом руки при написанні літери S).
Для визначення старшинства заступників у асиметричного атома використовуються правила підрахунку атомних номерів, які вже розглядалися у зв'язку з Z,E-номенклатурою геометричних ізомерів (див. ).
Для вибору R,S-позначень за проекційною формулою необхідно шляхом парного числа перестановок (що не змінюють стереохімічного змісту формули) розмістити заступники так, щоб молодший з них (зазвичай водень) виявився внизу проекційної формули. Тоді старшинство інших трьох заступників, що падає за годинниковою стрілкою, відповідає позначенню R, проти годинникової стрілки - позначенню S [ПРИМ.9] :

Контрольні завдання
3. Визначте конфігурацію асиметричного центру аскорбінової кислоти (вітаміну С) (по R,S-номенклатурі та порівняно з гліцериновим альдегідом):

4. Алкалоїд ефедрин має формулу:

Дайте назву цього з'єднання, використовуючи R,S-Номенклатуру.
5. Цистеїн - замінна амінокислота, що бере участь у регуляції процесів обміну речовин, є L-1-аміно-2-меркаптопропіонову кислоту. Зобразіть його структурну формулу і дайте назву за R,S-номенклатурі.
6. Левоміцетин (антибіотик широкого спектра дії) є D(-)-трео-1-пара-нітрофеніл-2-дихлорацетиламіно-пропандіол-1,3. Зобразіть його структуру як проекційної формули Фішера.
7. Синестрол – синтетичний естрогенний препарат нестероїдної будови. Дайте його назву із позначенням стереохімічної конфігурації:

ІІ.8. Стереохімія циклічних сполук
При замиканні ланцюга вуглецевих атомів плоский цикл валентні кути атомів вуглецю змушені відхилятися від свого нормального тетраедричного значення, причому величина цього відхилення залежить від числа атомів в циклі. Чим більший кут відхилення валентних зв'язків, тим більше має бути запас енергії молекули, тим менша стійкість циклу. Однак, плоска будова має лише тричленний циклічний вуглеводень (циклопропан); починаючи з циклобутану молекули циклоалканів мають хорошу будову, що знижує "напругу" в системі.
Молекула циклогексану може існувати у вигляді кількох конформацій, у яких зберігаються "нормальні" валентні кути (для спрощення показані лише атоми вуглецю):

Енергетично найбільш вигідною є конформація I – так звана форма "крісла". Конформація II - "твіст" - займає проміжне становище: вона менш вигідна, ніж конформація крісла (через наявність у ній заслонено розташованих атомів водню), але вигідніша, ніж конформація III. Конформація ІІІ - "ванна" - найменш вигідна з трьох внаслідок значного відштовхування спрямованих верхів атомів водню.
Розгляд дванадцяти зв'язків С-Ну конформації крісла дозволяє розділити їх на дві групи: шість аксіальних зв'язків, спрямованих по черзі то вгору, то вниз, та шість екваторіальних зв'язків, спрямованих у сторони. У монозаміщених циклогексанах заступник може бути або в екваторіальному, або в аксіальному положенні. Ці дві конформації зазвичай перебувають у рівновазі і швидко переходять одна в одну через конформацію твіст:

Екваторіальна конформація (е) зазвичай бідніша за енергію і тому вигідніша, ніж аксіальна (а).
З появою в циклах заступників (бічних ланцюгів) крім проблеми конформації самого циклу перед дослідником постають проблеми зміни заступників : так, у разі наявності двох однакових чи різних заступників з'являються цис-транс-ізомеру. Зазначимо, що говорити про цис-транс-конфігурації заступників має сенс лише у додатку до насичених малих і середніх циклів (до З 8): в кільцях з великою кількістю ланок рухливість стає настільки значною, що міркування про цис-або транс- Положення заступників втрачають сенс.
Так, класичним прикладом є стереоізомерні циклопропан-1,2-дикарбонові кислоти. Існують дві стереоізомерні кислоти: одна з них, що має т.пл. 139 про, здатна утворювати циклічний ангідрид і є, отже, цис-ізомером. Інша стереоізомерна кислота з т.пл. 175 про, циклічного ангідриду не утворює; це транс-ізомер [ПРИМ.10] :

У таких же відносинах один з одним знаходяться дві стереоізомерні 1,2,2-триметилциклопентан-1,3-дикарбонової кислоти. Одна з них камфорна кислота, т.пл. 187 про З, утворює ангідрид і, отже, є цис-ізомером. Інша – ізокамфорна кислота, т.пл. 171 про С - ангідриду не утворює, це транс-ізомер:
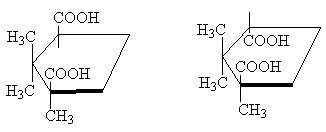
цис-транс-
Хоча молекула циклопентана насправді непогана, для наочності зручно зображати її в плоскому вигляді, як на наведеному вище малюнку, маючи на увазі, що в цис-ізомері два заступники знаходяться по один бік циклу , а в транс-ізомері - по різні боки циклу .
Дизаміщені похідні циклогексану також можуть існувати в цис- або транс-формі:
Атом вуглецю не має монополії на створення хіральних центрів у молекулах органічних сполук. Центром хіральності можуть бути атоми кремнію, олова, чотириковалентного азоту в четвертинних амонієвих солях і окисах третинних амінів:

У цих сполуках центр асиметрії має тетраедричну конфігурацію, як і асиметричний атом вуглецю. Існують, однак, і з'єднання з іншою просторовою структурою хірального центру.
Пірамідальну конфігурацію мають хіральні центри, утворені атомами тривалентного азоту, фосфору, миш'яку, сурми, сірки. В принципі, центр асиметрії можна вважати тетраедричним, якщо як четвертий заступник прийняти неподілену електронну пару гетероатома:

Оптична активність може виникати і без хірального центру, за рахунок хіральності структури всієї молекули в цілому ( молекулярна хіральність або молекулярна асиметрія ). Найбільш характерними прикладами є наявність хіральної осі або хіральної площини .
Хіральна вісь виникає, наприклад, в аленах, що містять різні заступники при sp 2-гібридних вуглецевих атомах Легко бачити, що наведені нижче сполуки є дзеркальними зображеннями, а отже, оптичними антиподами:

Вісь хіральності показано на малюнках стрілкою.
Інший клас сполук, що мають хіральну вісь - оптично активні біфеніли, що мають орто-положеннях об'ємні заступники, що ускладнюють вільне обертання навколо С-З зв'язку, що з'єднує аренові кільця:

Хіральна площина характеризується тим, що в неї можна розрізнити "верх" і "низ", а також "праву" та "ліву" сторони. Прикладом з'єднань з хіральною площиною можуть бути оптично активний транс-циклооктен та оптично активне похідне ферроцену.
ЗСеред органічних сполук зустрічаються речовини, здатні обертати площину поляризації світла. Це явище називають оптичною активністю, а відповідні речовини - оптично активними. Оптично активні речовини зустрічаються у вигляді пар оптичних антиподів- ізомерів, фізичні та хімічні властивості яких у звичайних умовах однакові, за винятком одного - знака обертання площини поляризації: один з оптичних антиподів відхиляє площину поляризації в право (+, правообертальний ізомер), інший - вліво (-, лівообертальний).
Оптична ізомерія з'являється тоді, коли в молекулі є асиметричний атом вуглецю. Так називають атом вуглецю, пов'язаний із чотирма різними заступниками. Можливі два тетраедричні розташування заступників навколо асиметричного атома. Обидві просторові форми не можна поєднати жодним обертанням; одна з них є дзеркальним зображенням іншого.
Розглянутий вид ізомерії називають оптичною ізомерією
, дзеркальною ізомерією
або енантіомерією
. Обидві дзеркальні форми складають пару оптичних антиподів або енантіомерів
.
Число просторових ізомерів визначають за формулою Фішера N = 2 n де n - число асиметричних центрів.
Проекційні формули
Для умовного зображення асиметричного атома на площині користуються проекційними формулами Е.Фішера. Їх одержують, проецируя на площину атоми, із якими пов'язаний асиметричний атом. При цьому сам асиметричний атом, як правило, опускають, зберігаючи лише лінії, що перехрещуються, і символи заступників. Щоб пам'ятати про просторове розташування заступників, часто зберігають у проекційних формулах уривчасту вертикальну лінію (верхній та нижній заступник видалені за площину креслення), проте часто цього не роблять. Нижче наведено різні способи запису проекційної формули, що відповідає лівій моделі на попередньому малюнку:

Наведемо кілька прикладів проекційних формул:

При назвах речовин наведено їх знаки обертання. Це означає, наприклад, що лівообертальний антипод бутанолу-2 має просторову конфігурацію, що виражається саме наведеною вище формулою, а її дзеркальне зображення відповідає правообертального бутанолу-2. Визначення зміни оптичних антиподів проводиться експериментально.
Суміш, що складається з рівної кількості обох антиподів, називається рацематом. Вона оптично неактивна, має відмінні значення фізичних констант.
У принципі, кожен оптичний антипод може бути зображений дванадцятьма (!) різними проекційними формулами - в залежності від того, як розташована модель при побудові проекції, з якого боку ми дивимося на неї. Щоб стандартизувати проекційні формули, запроваджено певні правила їх написання. Так, головну функцію, якщо вона знаходиться в кінці ланцюга, прийнято ставити нагорі, головний ланцюг зображати вертикально.
Правила перетворення проекційних формул:
1. Формули можна обертати у площині креслення на 180 о, не змінюючи їх стереохімічного сенсу:

2. Дві (чи будь-яке парне число) перестановки заступників в одного асиметричного атома не змінюють стереохімічного змісту формули:

3. Одна (або будь-яка непарна кількість) перестановок заступників у асиметричного центру призводить до формули оптичного антипода:

4. Поворот у площині креслення на 90 про перетворює формулу на антипод, якщо при цьому одночасно не змінити умову розташування заступників щодо площини креслення, тобто. не вважати, що тепер бічні заступники знаходяться за площиною креслення, а верхній та нижній – перед нею. Якщо користуватися формулою з пунктиром, то орієнтація пунктира, що змінилася, прямо нагадає про це:

5. Замість перестановок проекційні формули можна перетворювати шляхом обертання будь-яких трьох заступників за годинниковою стрілкою або проти неї; четвертий заступник у своїй положення не змінює (така операція еквівалентна двом перестановкам):

6. Проекційні формули не можна виводити із площини креслення.
Інші типи оптично активних речовин
У цьому розділі перелічені деякі інші класи органічних сполук, які також мають оптичну активність (тобто існують у вигляді пар оптичних антиподів).
Атом вуглецю не має монополії на створення хіральних центрів у молекулах органічних сполук. Центром хіральності можуть бути атоми кремнію, олова, чотириковалентного азоту в четвертинних амонієвих солях і окисах третинних амінів:

У цих сполуках центр асиметрії має тетраедричну конфігурацію, як і асиметричний атом вуглецю. Існують, однак, і з'єднання з іншою просторовою структурою хірального центру.
Пірамідальнуконфігурацію мають хіральні центри, утворені атомами тривалентного азоту, фосфору, миш'яку, сурми, сірки. В принципі, центр асиметрії можна вважати тетраедричним, якщо як четвертий заступник прийняти неподілену електронну пару гетероатома:

Оптична активність може виникати і без хірального центру, за рахунок хіральності структури всієї молекули в цілому ( молекулярна хіральність або молекулярна асиметрія ). Найбільш характерними прикладами є наявність хіральної осі або хіральної площини .
Хіральна вісь виникає, наприклад, в аленах, що містять різні заступники при sp 2-гібридних вуглецевих атомах Легко бачити, що наведені нижче сполуки є несумісними дзеркальними зображеннями, а отже, оптичними антиподами:

Інший клас сполук, що мають хіральну вісь - оптично активні біфеніли, які мають орто-положеннях об'ємні заступники, що ускладнюють вільне обертання навколо С-З зв'язку, що з'єднує бензольні ядра:

Хіральна площинахарактеризується тим, що в неї можна розрізнити "верх" і "низ", а також "праву" та "ліву" сторони. Прикладом з'єднань з хіральною площиною можуть бути оптично активний транс-циклооктен та оптично активне похідне ферроцену:

Діастереомерія
З'єднання з декількома асиметричними атомами мають важливі особливості, що відрізняють їх від розглянутих раніше більш простих оптично активних речовин з одним центром асиметрії.
Припустимо, що в молекулі якоїсь речовини є два асиметричні атоми; позначимо їх умовно А та Б. Легко бачити, що можливі молекули з наступними комбінаціями (N=2 2 =4):
Молекули 1 та 2 являють собою пару оптичних антиподів; те саме відноситься і до пари молекул 3 і 4. Якщо ж порівнювати один з одним молекули з різних пар антиподів - 1 і 3, 1 і 4, 2 і 3, 2 і 4, то ми побачимо, що перелічені пари не є оптичними антиподами: конфігурація одного асиметричного атома вони збігається, конфігурація іншого - не збігається. Це пари діастереомірів , тобто. просторових ізомерів, не складових один з одним оптичних антиподів
Діастереомери відрізняються один від одного не тільки оптичним обертанням, а й усіма іншими фізичними константами: у них різні температури плавлення і кипіння, різні розчинності та ін.
Прикладом сполуки даного типу може бути хлоряблучна кислота (2 різних хіральних центри):

Її стереоізомерні форми мають такі проекційні формули:

| еритро-форми | трео-форми |
Назви еритро- І трео- походять від назв вуглеводів еритрози та треози. Ці назви використовують із зазначення взаємного становища заступників у сполук із двома асиметричними атомами: еритро -ізомерами називають ті, у яких два однакових бічних заступники стоять у стандартній проекційній формулі на одній стороні (праворуч або ліворуч, два кінці літери Е); трео -ізомери мають однакові бічні замісники на різних сторонах проекційної формули. Два еритро-ізомеру являють собою пару оптичних антиподів, при їх змішуванні утворюється рацемат. Парою оптичних ізомерів є і трео-форми; вони теж дають при змішуванні рацемат, що відрізняється за властивостями від рацемату. еритро-форми. Таким чином, всього існують чотири оптично активні ізомери хлорябкової кислоти і два рацемати.
Число стереоізомерів може зменшуватися через часткову симетрію, що з'являється в деяких структурах. Прикладом може бути винна кислота, яка має кількість індивідуальних стереоізомерів скорочується до трьох. Їхні проекційні формули:

| I | Іа | II | III |
Формула I ідентична з формулою Iа, так як перетворюється на неї при повороті на 180 про площині креслення і, отже, не зображує нового стереоізомеру. Це оптично неактивна модифікація називається мезо-форма . Мезоформи є у всіх оптично активних речовин з декількома однаковими (тобто пов'язаними з однаковими замісниками) асиметричними центрами. Проекційні формули мезо-форм завжди можна дізнатися з того, що їх можна розділити горизонтальною лінією на дві половини, які за записом на папері формально ідентичні, насправді ж дзеркальні (площина внутрішньої симетрії):

Формули II та III зображують оптичні антиподи винної кислоти; при їх змішуванні утворюється оптично неактивний рацемат – виноградна кислота.
Номенклатура оптичних ізомерів
Найпростіша, найстаріша, проте й нині ще вживана система номенклатури оптичних антиподів, заснована на порівнянні проекційної формули званого антипода з проекційною формулою якоїсь стандартної речовини, обраної як "ключ". Так, для -оксикислот і -амінокислот ключем є верхня частина їх проекційної формули (у стандартному записі):

Конфігурацію всіх α-оксикислот, що мають у стандартно написаній проекційній формулі Фішера гідроксильну групу зліва, позначають знаком L; якщо ж гідроксил розташований у проекційній формулі праворуч – знаком D
Ключем для позначення конфігурації сполук є гліцериновий альдегід:

У молекулах цукрів позначення D-або L-відноситься до конфігурації нижньогоасиметричний центр.
Система D-,L-позначень має суттєві недоліки: по-перше, позначення D-або L-вказує конфігурацію тільки одного асиметричного атома, по-друге, для деяких сполук виходять різні позначення, залежно від того, чи взятий як ключ гліцериновий альдегід або оксикислотний ключ, наприклад:

Ці недоліки системи ключів обмежують її застосування нині трьома класами оптично активних речовин: цукрами, амінокислотами та оксикислотами. На загальне застосування розрахована R,S-система Кана, Інгольда та Прелога.
Для визначення R або S-конфігурації оптичного антипода необхідно розташувати тетраедр замісників навколо асиметричного вуглецевого атома таким чином, щоб молодший заступник (зазвичай це водень) мав напрямок "від спостерігача". Якщо рух при переході по колу трьох інших заступників від старшого до середнього за старшинством і потім до наймолодшого відбувається проти годинникової стрілки - це S -ізомер (асоціюється з таким самим рухом руки при написанні літери S), якщо за годинниковою стрілкою - це R- ізомер (асоціюється з рухом руки під час написання літери R).
Для визначення старшинства заступників у асиметричного атома використовуються правила підрахунку атомних номерів, вже нами розглянуті у зв'язку з Z,E-номенклатурою геометричних ізомерів.
Для вибору R,S-позначень за проекційною формулою необхідно шляхом парного числа перестановок (що не змінюють стереохімічного змісту формули) розмістити заступники так, щоб молодший з них (зазвичай водень) виявився внизу проекційної формули. Тоді старшинство решти трьох заступників, що падає за годинниковою стрілкою, відповідає позначенню R, проти годинникової стрілки - позначенню S:

(Проекції Фішера), спосіб зображення на площині просторів. структур орг. соед., мають один або дек. хіральних центрів. При проектуванні молекули на площину асимметрич. атом зазвичай опускають, зберігаючи лише лінії, що перехрещуються, і символи заступників; при цьому заступники, що знаходяться перед площиною, мають праворуч і ліворуч, а за площиною - вгорі і внизу (пунктирна лінія).
Ф-ли Фішера для молекули з одним асиметричним. атомом (I), а також схема побудови такої ф-ли для з'єднань з двома асиметричними. атомами (П) ХОУОРСА ФОРМУЛИ
ХОУОРСА ФОРМУЛИ
(Хеуорса ф-ли), зображення на площині просторів. структур цикліч. з'єдн. При побудові X. ф. цикл умовно вважають плоским (насправді молекула м. б. в конформації крісла або ванни) і проектують на площину під деяким кутом; при цьому ближня до спостерігача частина кільця на кресленні розташовується знизу і зазвичай виділяється жирнішою лінією (рис.). У моносахаридах кисневий атом циклу мають зазвичай наиб. видалення від спостерігача (у разі піранозного циклу – праворуч).
Формули Фішера (а) та Хоуорса (б)дам моносахаридів --D-глюкопіранози (I) та -L-галактофуранози (II).
Атоми або групи атомів, що зображуються у ф-лах Фішера ліворуч і праворуч, в X. ф. розташовуються соотв. над та під площиною циклу. Бічні ланцюги при атомі С-5 в піранозах або С-4 в фуранозах зображують над площиною циклу при D-конфігурації атома вуглецю і під площиною - при L-конфігурації (див. Номенклатура стереохімічна).
Запропоновано У. Хоуорсом (Хеуорсом) у 1926.
55. Сполуки з гідроксильною групою.
Гідроксильна група (гідроксил) - функціональна група OH органічних та неорганічних сполук, в якій атоми водню та кисню пов'язані ковалентним зв'язком. У органічної хіміїносить також назву « спиртової групи».
Фенолами називають похідні ароматичних вуглеводнівмолекули яких містять одну або кілька гідроксильних груп, безпосередньо з'єднаних з бензольним кільцем.
Назви фенолів складають з огляду на те, що для родоначальної структури за правилами ІЮПАК збережено тривіальну назву "фенол". Нумерацію атомів вуглецю бензольного кільця починають від атома, безпосередньо пов'язаного з гідроксильною групою (якщо вона є старшою функцією), і продовжують такою послідовністю, щоб наявні заступники отримали найменші номери.
Найпростіший представник цього класу - власне фенол, С6Н5ВІН.
Будова фенолу. Одна з двох неподілених електронних пар атома кисню втягується в -електронну систему бензольного кільця (+M-ЕФЕКТ групи ВІН). Це призводить до двох ефектів: а) збільшується електронна щільність в бензольному кільці, причому максимуми електронної щільності знаходяться в орто-і пара-положення по відношенню до групи ВІН; б) електронна щільність на атомі кисню, навпаки, зменшується, що призводить до ослаблення зв'язку О-Н. Перший ефект проявляється у високій активності фенолу в реакціях електрофільного заміщення, а другий - у підвищеній кислотності фенолу в порівнянні з граничними спиртами.
Монозаміщені похідні фенолу, наприклад метилфенол (крезол), можуть існувати у вигляді трьох структурних ізомерів - орто-, мета-і пара-крезолів:
Фізичні характеристики. Феноли здебільшого – кристалічні речовини (мета-крезол – рідина) при кімнатній температурі. Вони мають характерний запах, досить погано розчиняються в холодній воді, але добре - в гарячій і особливо в водних розчинахлугів. Феноли утворюють міцні водневі зв'язки і мають досить високі температурикипіння та плавлення. Так, власне фенол є безбарвними кристалами з t пл = 41 °С і t кип = 182 °С. З часом кристали червоніють і темніють.
56. П'ятичленові гетероциклічні сполуки.
П'ятичленові гетероцикли- органічні циклічні сполуки, до складу якого входить щонайменше один гетероатом.
Найбільш відомі представники:
| Представник | Структурна формула | Споріднені сполуки |
| Фуран | Фурфурол, Пірослизова кислота, Кумпарон, Ізобензфуран, Тетрагідрофуран, 1,3-діоксолан | |
| Тіофен | Тіонафтен, Тіофтен, Тетрагідротіофен, Тіолан, Тіоландіоксид, Біотин | |
| Піррол | Індол, Оксіндол, Індоксил, Ізатин, Карбазол, Пірролідин, 2-піролідон, N-метилпіролідон, Пролін | |
| Оксазол | Бензоксазол, 2-оксазолін | |
| Ізоксазол |
57.Спиртами називають аліфатичні сполуки, що містять гідроксильну групу (алканоли, алкеноли, алкіноли); гідроксиарени або ароматичні гідроксипохідні називаються фенолами . Назва спирту утворюється додаванням суфікса -ол до назви відповідного вуглеводню або на основі вуглеводневого радикалу. Залежно від будови вуглеводневого радикалу розрізняють спирти:
первинні:
вторинні:
третинні:
Одноатомні феноли:
Феноли характеризуються сильнішими кислотними властивостями, ніж спирти, останні у водних розчинах не утворюють карбонієві іони AIk - O -, що пов'язано з меншою поляризуючою дією (електроакцепторними властивостями акільних радикалів порівняно з ароматичними).
Спирти та феноли проте легко утворюють водневі зв'язки, тому всі спирти та феноли мають вищі температури кипіння, ніж відповідні вуглеводні.
Якщо вуглеводневий радикал не має яскраво виражених гідрофобних властивостей, то ці спирти добре розчиняються у воді. Водневий зв'язокобумовлює здатність спиртів переходити при затвердінні в склоподібний, а чи не кристалічний стан.
Сполуки з двома і більше гідроксильними групами називаються багатоатомними спиртами та фенолами:
58. Кислоти та основи по Льюїсу.
Дж. Льюїсом була запропонована більш загальна теоріякислот та основ.
Підстави Льюїса -це донори пари електронів (спирти, алкоголят-аніони, прості ефіри, аміни і т.д.)
Кислоти Льюїса –це акцептори пари електронів , тобто. сполуки, що мають вакантну орбіталь (іон водню та катіони металів: H + , Ag + , Na + , Fe 2+ ; галогеніди елементів другого та третього періодів BF 3 , AlCl 3 , FeCl 3 , ZnCl 2 ; галогени; сполуки олова та сірки: SnCl 4 , SO 3).
Таким чином, підстави Бренстеда та Льюїса – це одні й ті самі частинки. Проте основність по Бренстеду є здатність приєднувати лише протон, тоді як основність по Льюїсу – поняття ширше і означає здатність до взаємодії з будь-якою частинкою, що має вільну орбіталь.
Кислотно-основна взаємодія за Льюїсом є доноро-акцепторною взаємодією і будь-яку гетеролітичну реакцію можна представити як взаємодію кислоти та основи Льюїса:
Єдиної шкали для порівняння сили кислот і основ Льюїса не існує, тому що їх відносна сила залежатиме від того, яка речовина взята за стандарт (для кислот та основ Бренстеда таким стандартом є вода). Для оцінки легкості протікання кислотно-основної взаємодії за Льюїсом Р. Пірсоном була запропонована якісна теорія “жорстких” та “м'яких” кислот та основ.
Жорсткі основимають високу електронегативність і низьку поляризуемість. Вони важко окислюються. Їхні вищі зайняті молекулярні орбіталі (ВЗМО) мають низьку енергію.
М'які основимають низьку електронегативність і високу поляризацію. Вони легко окислюються. Їхні вищі зайняті молекулярні орбіталі (ВЗМО) мають високу енергію.
Жорсткі кислотимають високу електронегативність і низьку поляризацію. Вони важко відновлюються. Їхні нижчі вільні молекулярні орбіталі (НСМО) мають низьку енергію.
М'які кислотимають низьку електронегативність і високу поляризуемість. Вони легко відновлюються. Їхні нижчі вільні молекулярні орбіталі (НСМО) мають високу енергію.
Найжорсткіша кислота - Н + , найм'якша - СН 3 Hg +. Найбільш жорсткі основи – F - та OH - , найбільш м'які – I - та Н - .
59. . Прості ефіри.
Прості ефіри - органічні речовини, що мають формулу R-O-R 1 де R і R 1 - вуглеводневі радикали. Слід, однак, враховувати, що така група може входити до складу інших функціональних груп сполук, які не є простими ефірами.
- За Вільямсоном
У лабораторних умовах ефіри одержують за Вільямсоном взаємодією галогенопохідних, здатних вступати в реакцію Sn2 та алкоксид- та феноксид-іонами. Реакція протікає гладко з галогенметаном та первинними галогеналканами. У разі вторинних галогеналканів реакція може бути ускладнена побічною реакцією елімінування.
Фізичні властивості
Прості ефіри - рухомі легкокиплячі рідини, що малорозчинні у воді, дуже легко займисті. Виявляють слабоосновні властивості (приєднують протон атомом O).
Прості ефіри утворюють перекисні сполуки під впливом світла:
Внаслідок цього при перегонці простих ефірів у лабораторних умовах забороняється переганяти їх насухо, оскільки в цьому випадку станеться сильний вибух внаслідок розкладання пероксидів.
Найважливіші ефіри
| Назва | Формула | Температура плавлення | Температура кипіння |
| Диметиловий ефір | CH 3 OCH 3 | −138,5 °C | −24,9 °C |
| Діетиловий ефір | CH 3 CH 2 OCH 2 CH 3 | −116,3 °C | 34,6 °C |
| Діізопропіловий ефір | (CH 3) 2 CHOCH(CH 3) 2 | −86,2 °C | 68,5 °C |
| Анізол | −37 °C | 154 °C | |
| Оксиран | −111,3 °C | 10,7 °C | |
| Тетрагідрофуран | −108 °C | 65,4 °C | |
| Діоксан | 11.7 °C | 101.4 °C | |
| Поліетиленгліколь | HOCH 2 (CH 2 OCH 2) n CH 2 OH | − | − |
Біологічне значення
Арилові ефіри - консерванти, антиоксиданти, що застосовуються в парфумерній промисловості. Деякі прості ефіри мають інсектицидну дію.
60. Замісна номенклатура (ІЮПАК) органічних сполук.
У замісній номенклатурі ІЮПАК найменування органічної сполуки визначається назвами головного ланцюга (корінь слова), атоми вуглецю в якому нумеруються в певному порядку, а також заступників та функціональних груп (що позначаються у вигляді префіксів або суфіксів). Як заступник розглядається будь-який атом або група атомів, що заміщають водень. Функціональною групоювважається атом або група атомів невуглеводневого характеру, які визначають належність сполуки того чи іншого класу. Якщо груп кілька, то виділяють старшу:
ІЮПАК – загальноприйнята номенклатура, зараз вона є стандартом у хімії.
61. Окислення С-Нта С = З зв'язків.
62. Ковалентні зв'язки. Гібридизація.
Ковалентний зв'язок (Атомний зв'язок, гомеополярний зв'язок) - хімічний зв'язок, утворена перекриттям (узагальненням) пари валентних електронних хмар. Забезпечуючий зв'язок електронні хмари(електрони) називаються загальною електронною парою. Ковалентний зв'язок утворюється парою електронів, поділеної між двома атомами, причому ці електрони повинні займати дві стійкі орбіталі, по одній від кожного атома.
A · + · В → А: В
В результаті усуспільнення електрони утворюють заповнений енергетичний рівень. Зв'язок утворюється, якщо їх сумарна енергія на цьому рівні буде меншою, ніж у початковому стані (а різниця в енергії буде ні чим іншим, як енергією зв'язку).
Відповідно до теорії молекулярних орбіталей, перекриття двох атомних орбіталей призводить в найпростішому випадку до утворення двох молекулярних орбіталей (МО): сполучною МОі антизв'язуючою (розпушуючою) МО. Узагальнені електрони розташовуються на нижчій за енергією зв'язуючої МО. Гібридизація орбіталей- гіпотетичний процес змішування різних (s, p, d, f) орбіталей центрального атома багатоатомної молекули із виникненням однакових орбіталей, еквівалентних за своїми характеристиками.
Види гібридизації
Тетраедричну модель одного з енантіомерів (рис. 10) розташовують у просторі так, щоб ланцюг атомів вуглецю виявився у вертикальному положенні, а карбоксильна група - зверху. Зв'язки з невуглецевими заступниками (Н та ВІН) у хірального центру мають бути спрямовані до спостерігача.
Мал. 10.Побудова проекційної формули Фішера (+)-молочної кислоти
Після цього модель проектують на площину. Символ асиметричного атома при цьому опускається, під ним розуміють точку перетину вертикальної та горизонтальної ліній.
Тетраедрическую модель хіральної молекули перед проектуванням можна розташовувати у просторі по-різному, як так, як показано на рис. 7. Необхідно лише, щоб зв'язки, що утворюють на проекції горизонтальну лінію, були спрямовані до спостерігача, а вертикальні зв'язки – за площину малюнка.
Отримані таким чином проекції можна за допомогою нескладних перетворень призвести до стандартного виду, в якому вуглецевий ланцюгрозташована вертикально, а старша група(У молочній кислоті це СООН) – зверху. Перетворення дозволяють дві операції:
У проекційній формулі дозволяється міняти місцями два будь-які заступники в одного і того ж хірального центру парне число разів (двох перестановок буває достатньо);
Проекційну формулу дозволяється повертати у площині малюнка на 180° (що еквівалентно двом перестановкам), але не на 90°.
Тетраедричну модель будови органічних сполук запропонували Я.Г.Вант-Гофф і Ж.А.Ле-Бель в 1874 р. Вони дійшли висновку, що якщо дві молекули є стереоізомерами, їх можна описати дзеркальними формулами, і якщо один ізомер обертає площину поляризації вліво, то другий повинен обертати праворуч. За знаком обертання можна визначити відносну конфігурацію стереоізомерів. Однак між абсолютною конфігурацією, тобто. істинним розташуванням груп навколо даного хірального центру, і знаком обертання прямої відповідності немає. Визначити абсолютну конфігурацію хімічними методамиЯкщо не відома абсолютна конфігурація хоча б одного хірального реагенту (а так і було спочатку), неможливо. Спектральні методи можуть дати інформацію лише відносної конфігурації. В даний час існують лише два методи незалежного визначення абсолютної конфігурації: теоретичний розрахунок та дослідження аномальної дифракції рентгенівських променів на ядрах важких елементів.
Але в наприкінці XIX- На початку XX століття цих методів не існувало і тому хіміки придумали наступний вихід. Вирішили взяти як стандарт якесь одне з'єднання і довільно приписати йому одну з можливих абсолютних конфігурацій. Вибір припав на гліцериновий альдегід з тієї причини, що він структурно пов'язаний із цукром, який вивчав тоді Еміль Фішер. (+) - Ізомеру була приписана абсолютна конфігурація і він був позначений буквою D ( dextriogyrus- правий), а відповідний (-) - ізомер - літерою L ( laevogyrus– лівий). Як тільки вибрано стандарт, стало можливим співвідносити з ним конфігурацію інших з'єднань. Наприклад, при окисленні за допомогою HgO(+)-гліцериновий альдегід дає (-)-гліцеринову кислоту. Дана реакція не торкається асиметричного атома, тому дуже мало ймовірно, щоб його конфігурація змінилася, і отже (-)-гліцеринова кислота відноситься до D - ряду.
Віднесення до D- або L-ряду інших споріднених структурою оптично активних сполук проводиться шляхом порівняння конфігурації їх асиметричного атома з конфігурацією D- або L-гліцеринового альдегіду. Наприклад, в одного з енантіомерів молочної кислоти (I) у проекційній формулі група ОН знаходиться зліва, як у L-гліцеринового альдегіду, тому енантіомер (I) відносять до L-ряду. З тих же міркувань енантіомер (II) відносять до D-ряду. Так із порівняння проекцій Фішера визначають відносну конфігурацію.
Цими формулами зазвичай користуються для просторового зображення молекул, що містять асиметричний атом вуглецю : це тетраедричний ( sp 3-гібридний) атом вуглецю, пов'язаний з чотирма різними атомамичи групами атомів.
Для зображення проекційної формули тетраедрическую модель молекули мають у своєму розпорядженні так, щоб асиметричний атом знаходився в площині креслення, а два зв'язки від асиметричного атома вуглецю лежали в горизонтальній площині, що виступає до спостерігача з площини креслення. Два інші зв'язки повинні розташовуватися у вертикальній площині, що уникає спостерігача за площину креслення.
При використанні проекцій Фішера символ асиметричного атома вуглецю зазвичай опускають:
Слід завжди враховувати, що формули Фішера є проекціями на площину і їх слід розглядати як просторові моделі.
Тому необхідно дотримуватися таких правил:
проекційну формулу, що відповідає конкретному стереоізомеру, не можна виводити з площини креслення і не можна повертати в площині на 90 і 270 про;
можливий поворот формули на 180 о

якщо положення однієї атомної групи не змінювати, то решту трьох можна обертати за годинниковою або проти годинникової стрілки:

4.2. Оптична активність* та хіральність
Під оптичною активністю мають на увазі властивість, здатність речовини обертати (відхиляти на певний кут) площину поляризованого світла.
Поворот площини поляризації відбувається або за годинниковою стрілкою (праве обертання) або проти ходу годинникової стрілки (ліве обертання).
Для сполуки, що містить один асиметричний атом вуглецю, можливі два ізомери, які співвідносяться між собою як предмет та його дзеркальне відображення, що видно на прикладі молочної кислоти.


Два ізомери, кожен з яких є дзеркальним відображенняміншого, називаються оптичними або дзеркальними ізомерами .
Така пара дзеркальних ізомерів називається енантіомерами або оптичними антиподами .
Енантіомерам властиві однакові фізичні властивості, крім напряму обертання площині поляризації: вони відхиляють поляризоване світло однією й той самий кут, але у протилежних напрямах.
З'єднання, які несумісні зі своїм дзеркальним відображенням, прийнято називати хіральними .
Хіральність (від cheir – рука) – це основне поняття стереохімії, що означає властивість об'єкта бути несумісним зі своїм дзеркальним відображенням; є обов'язковою умовою оптичної активності молекул.
Суміш речовин, що складається з рівних кількостей обох енантіомерів, називається рацемічною сумішшю . Оптична активність такої суміші дорівнює 0.
Стереоізомери, які не є енантіомерами, називаються діастереомірами (Докладно див. нижче, розд. 4.4.).
Таким чином, усі хіральні молекули є молекулами оптично активних сполук.
Між хіральністю та оптичною активністю існує однозначна відповідність. Характерною особливістюхіральних молекул є відсутність осі, центру та площини симетрії, які є елементами симетрії .
Вісь симетрії.Якщо обертання навколо осі, що проходить через молекулу, на кут 2π/n=360 o /n знову наводить її на вихідний стан, то таку вісь називають віссю симетрії n-го порядку З n . Зрозуміло, що за значення n=1 у разі поворот навколо осі повертає молекулу в початковий стан.
Наприклад, молекула води (а) має вісь симетрії другого порядку (n=2), хлорметану (б) – третього порядку, а в бензолі (в) поряд з шістьма осями, що розташовуються в площині циклу (n=2), є ще одна вісь (n=6), яка перпендикулярна до площини циклу.

Площина симетрії.Якщо площина, що проходить через молекулу (об'єкт) ділить її на дві частини, що співвідносяться між собою як дзеркальні ізомери, то її називають площиною симетрії . Вода має дві площини симетрії, а хлорметан три.

Центр симетрії i- Це точка в центрі молекули, на рівній відстані від якої на одній прямій розташовуються дві еквівалентні, рівноцінні точки цієї молекули.
У молекулі може бути більше центру симетрії.
Таким чином, з точки зору наявності чи відсутності в молекулах елементів симетрії прийнято говорити про хіральності і ахіральності . Найчастіше за змістом вони збігаються з поняттями «асиметричність» і «симетричність». Натомість хіральність – це поняття набагато ширше, ніж асиметричність, оскільки хіральна молекула може містити деякі елементи симетрії. З цієї причини в стереохімії термін «асиметричний» атом часто замінюють терміном «центр хиральности». Отже, під хіральністю слід мати на увазі властивість об'єкта бути несумісним зі своїм дзеркальним відображенням. Ахіральна молекула містить принаймні один елемент симетрії (або центр, або площину симетрії). Приватним випадком ахіральності є прохірність: здатність, властивість ахіральної молекули переходити в хіральну шляхом одноразової зміни одного будь-якого структурного фрагмента. Як правило, така операція можлива за наявності прохірального центру – тобто центру, що містить два різні і два однакові заступники. Заміщення одного з таких однакових заступників на інший, який відрізняється від усіх наявних, перетворює цей центр на хіральний:

Конфігурація та конформація
Стереоізомери можуть відрізнятися конфігураціями (конфігураційні ізомери) або конформаціями (Конформаційні ізомери).
Конфігурація– просторове розташування атомів та/або атомних груп навколо хірального центру, площини подвійного зв'язку або площини циклу та характеризує певний стереоізомер. Це поняття переважно має якісний характері і по суті відбиває стереохімічну особливість конкретного розташування атомів у просторі навколо хірального центру цієї молекули.
Нижче показані пари сполук, що являють собою кофігураційні ізомери:

Конформація*- Певна геометрія молекули, обумовлена внутрішнім обертанняматомів чи атомних груп навколо простих зв'язків. У цьому стереохімічна зміна молекули залишається постійною.
Для зображення конформацій користуються проекціями Ньюмена. Для етану можливі дві граничні конформації – заслонена (I) та загальмована (II).

Бутан відрізняється від етану наявністю двох метильних груп, у зв'язку з чим для даної молекули можливо більше загальмованих конформацій, що показано нижче. Більш стійка конформація I позначається як анти-: тут метильні групи максимально віддалені одна від одної (двогранний кут дорівнює 180 о). Дві інші конформації - скошені, або інакше гош-конформації (II і III), в яких метильні групи утворюють кут 60 про:



























