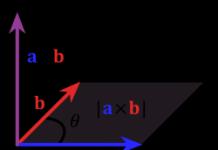
Fermentlar kinetikasi fermentlarning substrat bilan oʻzaro taʼsirining turli sharoitlariga (konsentratsiya, harorat, pH va boshqalar) qarab katalizlanadigan reaksiyalar tezligini oʻrganadi.
Biroq, fermentlar turli xil tashqi ta'sirlarning ta'siriga sezgir bo'lgan oqsillardir. Shuning uchun fermentativ reaktsiyalar tezligini o'rganishda ular asosan reaksiyaga kirishuvchi moddalarning konsentratsiyasini hisobga oladilar va harorat, muhitning pH, faollashtiruvchilar, ingibitorlar va boshqa omillarning ta'sirini minimallashtirishga va standart sharoitlarni yaratishga harakat qilishadi. Birinchidan, bu ma'lum bir ferment uchun optimal bo'lgan muhitning pH qiymati. Ikkinchidan, iloji bo'lsa, 25 ° C haroratni saqlash tavsiya etiladi. Uchinchidan, fermentning substrat bilan to'liq to'yinganligiga erishiladi. Bu nuqta ayniqsa muhimdir, chunki past substrat konsentratsiyasida barcha ferment molekulalari reaktsiyada qatnashmaydi (6.5-rasm, A), bu natija mumkin bo'lgan maksimaldan uzoq bo'lishini anglatadi. Katalizatsiyalangan reaktsiyaning eng katta kuchi, boshqa narsalar teng bo'lsa, har bir ferment molekulasi transformatsiyada ishtirok etsa, ya'ni. ferment-substrat kompleksining yuqori konsentratsiyasida (6.5-rasm, V). Agar substrat kontsentratsiyasi fermentning to'liq to'yinganligini ta'minlamasa (6.5-rasm, b), u holda reaksiya tezligi maksimal qiymatga etib bormaydi.
Guruch. 65.
A - past substrat konsentratsiyasida; 6 - substrat konsentratsiyasining etarli emasligi bilan; V - ferment substrat bilan to'liq to'yingan bo'lsa
Yuqoridagi sharoitlarda va fermentning substrat bilan toʻliq toʻyinganligida oʻlchanadigan fermentativ reaksiya tezligi deyiladi. fermentativ reaktsiyaning maksimal tezligi (V).
Ferment substrat bilan to'liq to'yinmaganda aniqlanadigan fermentativ reaksiya tezligi belgilanadi. v.
Ferment katalizini quyidagi diagramma orqali soddalashtirish mumkin:

bu erda F - ferment; S - substrat; FS - ferment-substrat kompleksi.
Ushbu jarayonning har bir bosqichi ma'lum bir tezlik bilan tavsiflanadi. Enzimatik reaksiya tezligining o'lchov birligi - vaqt birligida aylanadigan substratning mollari soni(normal reaksiya tezligi bilan bir xil).
Fermentning substrat bilan o'zaro ta'siri ferment-substrat kompleksining hosil bo'lishiga olib keladi, ammo bu jarayon teskari. To'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi reaktivlarning kontsentratsiyasiga bog'liq va tegishli tenglamalar bilan tavsiflanadi:
Muvozanat holatida (6.3) tenglama to'g'ri keladi, chunki to'g'ridan-to'g'ri va teskari reaktsiyalarning tezligi tengdir.
To'g'ridan-to'g'ri (6.1) va teskari (6.2) reaktsiyalarning tezlik qiymatlarini (6.3) tenglamaga almashtirib, biz tenglikni olamiz:
Muvozanat holati tegishli bilan tavsiflanadi muvozanat konstantasi K p, to'g'ridan-to'g'ri va teskari reaktsiyalar konstantalarining nisbatiga teng (6.5). Muvozanat konstantasining teskarisi deyiladi substrat konstantasi Ks, yoki ferment-substrat kompleksining dissotsilanish konstantasi:

(6.6) tenglamadan ko'rinib turibdiki, substrat konstantasi ferment-substrat kompleksining yuqori konsentratsiyasida kamayadi, ya'ni. katta barqarorlik bilan. Binobarin, substrat konstantasi ferment va substratning yaqinligini hamda ferment-substrat kompleksining hosil bo‘lishi va dissotsilanish tezligi konstantalarining nisbatini tavsiflaydi.
Fermentning substrat bilan to'yinganligi hodisasi Leonor Michaelis va Maud Mepten tomonidan o'rganilgan. Natijalarni matematik qayta ishlash asosida ular o'z nomlarini olgan (6.7) tenglamani oldilar, undan ko'rinib turibdiki, yuqori substrat konsentratsiyasida va substrat konstantasining past qiymatida fermentativ reaktsiya tezligi maksimal darajaga intiladi. . Biroq, bu tenglama cheklangan, chunki u barcha parametrlarni hisobga olmaydi:
Reaksiya jarayonida ferment-substrat kompleksi turli yo'nalishlarda o'zgarishi mumkin:
- asosiy moddalarga ajraladi;
- fermenti o'zgarmagan holda ajralib chiqadigan mahsulotga aylanadi.
Shuning uchun fermentativ jarayonning umumiy harakatini, tushunchasini tavsiflash Michaelis konstantalari Kt, fermentativ katalizning har uchala reaksiyasining tezlik konstantalari orasidagi bog'lanishni ifodalaydi (6.8). Agar ikkala shart ham ferment-substrat kompleksining hosil bo'lishi uchun reaktsiya tezligi konstantasiga bo'linsa, biz (6.9) ifodani olamiz:

(6.9) tenglamadan muhim xulosa kelib chiqadi: Michaelis doimiysi har doim substrat konstantasidan miqdori bo'yicha kattaroqdir. k 2 /k v
Raqamli K t reaktsiya tezligi maksimal mumkin bo'lgan tezlikning yarmiga teng bo'lgan substrat kontsentratsiyasiga teng va fermentning substrat bilan to'yinganligiga to'g'ri keladi, rasmda bo'lgani kabi. 6,5, b. Amalda har doim ham fermentning substrat bilan to'liq to'yinganligiga erishish mumkin emasligi sababli, bu aniq. K t uchun ishlatiladi qiyosiy xususiyatlar fermentlarning kinetik xususiyatlari.
Ferment substrat bilan to'liq to'yinmaganda fermentativ reaksiya tezligi (6.10) ferment-substrat kompleksining konsentratsiyasiga bog'liq. Proportsionallik koeffitsienti ferment va mahsulotning chiqishi uchun reaktsiya konstantasidir, chunki bu ferment-substrat kompleksining kontsentratsiyasini o'zgartiradi:
Transformatsiyalardan so'ng, yuqorida keltirilgan bog'liqliklarni hisobga olgan holda, ferment substrat bilan to'liq to'yinmaganda fermentativ reaktsiya tezligi (6.11) tenglama bilan tavsiflanadi, ya'ni. ferment, substrat kontsentratsiyasi va ularning yaqinligiga bog'liq K s:
Enzimatik reaksiya tezligining substrat kontsentratsiyasiga grafik bog'liqligi chiziqli emas. Shakldan ko'rinib turibdiki. 6.6, substrat konsentratsiyasining oshishi bilan ferment faolligining oshishi kuzatiladi. Biroq, fermentning substrat bilan maksimal to'yinganligiga erishilganda, fermentativ reaktsiya tezligi maksimal bo'ladi. Shuning uchun reaksiya uchun tezlikni cheklovchi omil ferment-substrat kompleksining hosil bo'lishidir.
Amaliyot shuni ko'rsatdiki, substrat kontsentratsiyasi, qoida tariqasida, birlikdan (10 6 -10 3 mol) kamroq qiymatlarda ifodalanadi. Hisob-kitoblarda bunday miqdorlar bilan ishlash juda qiyin. Shuning uchun G.Lineweaver va D.Byork fermentativ reaksiya tezligining grafik bogʻliqligini toʻgʻridan-toʻgʻri koordinatalarda emas, balki teskari koordinatalarda ifodalashni taklif qildilar. Ular teng miqdorlar uchun ularning teskarilari ham teng degan farazdan kelib chiqdilar:

Guruch. 6.6.
(6.13) ifodani o'zgartirgandan so'ng, biz deyilgan ifodani olamiz Lineweaver-Burk tenglamasi (6.14):
Lineweaver-Burk tenglamasining grafik bog'liqligi chiziqli (6.7-rasm). Kinetik xususiyatlar fermentlar quyidagicha tasniflanadi:
- ordinata o'qi bo'yicha kesilgan segment ga teng 1/V;
- abscissa o'qida kesilgan segment -1 ga teng / To t.

Guruch. 6.7.
Lineweaver-Burk usuli to'g'ridan-to'g'ri koordinatalarga qaraganda maksimal reaktsiya tezligini aniqroq aniqlashga imkon beradi, deb ishoniladi. Ferment inhibisyoniga oid qimmatli ma'lumotlarni ushbu grafikdan ham olish mumkin.
Michaelis-Menten tenglamasini o'zgartirishning boshqa usullari mavjud. Grafik bog'liqliklar fermentativ jarayonga turli xil tashqi ta'sirlarning ta'sirini o'rganish uchun ishlatiladi.
Enzimologiyaning bu bo'limi turli omillarning fermentativ reaksiya tezligiga ta'sirini o'rganadi. O'ylab umumiy tenglama bir substratni bitta mahsulotga aylantiruvchi teskari reaktsiyaning fermentativ katalizi (1),
Enzimatik reaktsiya tezligiga ta'sir qiluvchi asosiy omillarni nomlash kerak: substrat konsentratsiyasi [S], ferment konsentratsiyasi [E] va reaktsiya mahsuloti konsentratsiyasi [P].
Ayrim fermentlarning ularning substrati bilan oʻzaro taʼsirini fermentativ reaksiya V tezligining substrat konsentratsiyasiga [S] bogʻliqligi giperbolik egri chizigʻi bilan tasvirlash mumkin (19-rasm):

19-rasm. Enzimatik reaksiya tezligining substrat konsentratsiyasiga bog'liqligi.
Ushbu egri chiziqda uchta bo'limni ajratib ko'rsatish mumkin, bu fermentning substrat bilan o'zaro ta'sir qilish mexanizmining qoidalari bilan izohlanishi mumkin: OA - V ning [S] ga to'g'ridan-to'g'ri proportsional bog'liqligi bo'limi, fermentning faol markazlari. beqaror kompleks ES hosil bo'lishi bilan asta-sekin substrat molekulalari bilan to'ldiriladi; AB bo'limi - V ning [S] ga egri chiziqli bog'liqligi, fermentning faol markazlarining substrat molekulalari bilan to'liq to'yinganligiga hali erishilmagan. Yetib borishdan oldin ESni murakkablashtiring o'tish holati beqaror, E va S ga teskari dissotsiatsiyalanish ehtimoli hali ham yuqori; BC bo'limi - bog'liqlik nol tartibli tenglama bilan tavsiflanadi, kesma [S] o'qiga parallel, faol fermentlarning substrat molekulalari bilan to'liq to'yinganligiga erishildi, V=V max.
Egri chiziqning xarakterli shakli matematik jihatdan Briggs-Xaldan tenglamasi bilan tavsiflanadi:
V=V maks ● [S]/ Km + [S] (2),
Bu erda Km - Michaelis-Menten doimiysi, son jihatdan fermentativ reaktsiya tezligi yarim V max ga teng bo'lgan substrat konsentratsiyasiga teng.
Fermentning K m i qancha past bo'lsa, fermentning substratga yaqinligi shunchalik yuqori bo'lsa, substratning o'tish holatiga tezroq erishiladi va u reaksiya mahsulotiga aylanadi. Har bir guruhga xos ferment substrati uchun Km qiymatlarini topish ushbu fermentning hujayradagi biologik rolini aniqlashda muhim ahamiyatga ega.
Aksariyat fermentlar uchun giperbolik egri chiziqni qurish mumkin emas (19-rasm) bu holda ikki tomonlama o'zaro bog'lanishlar (Lineweaver-Burk) usuli qo'llaniladi, ya'ni. 1/[V] ning 1/[S] ga grafik bog’liqligi chizilgan (20-rasm). Har xil turdagi ingibitorlarning ferment faolligiga ta'sirini o'rganishda bunday egri chiziqlarni eksperimental ravishda qurish usuli juda qulaydir (batafsil matnga qarang).

20-rasm. 1/[V] ga nisbatan 1/[S] grafigi (Lineweaver-Burk usuli),
bu yerda y kesma qism - , x esa kesma qism -  , a - burchakning tangensi.
, a - burchakning tangensi.
Enzimatik reaksiya tezligi V ning ferment konsentratsiyasiga bog'liqligi [E].
Ushbu grafik bog'liqlik (21-rasm) optimal harorat va pH da ko'rib chiqiladi muhit, fermentning faol joylarining to'yingan kontsentratsiyasidan sezilarli darajada yuqori bo'lgan substrat konsentratsiyasida.

Guruch. 21. Ferment konsentratsiyasining fermentativ reaksiya tezligiga ta'siri.
Enzimatik reaksiya tezligining kofaktor yoki koenzim konsentratsiyasiga bog'liqligi. Murakkab fermentlar uchun shuni hisobga olish kerakki, gipovitaminozda vitaminlarning koenzim shakllarining etishmasligi, tanaga metall ionlarini qabul qilishning buzilishi, albatta, zarur bo'lgan fermentlar kontsentratsiyasining pasayishiga olib keladi. metabolik jarayonlarning borishi. Shuning uchun fermentning faolligi bevosita kofaktor yoki koenzimning konsentratsiyasiga bog'liq degan xulosaga kelish kerak.
Mahsulot konsentratsiyasining fermentativ reaktsiya tezligiga ta'siri. Inson tanasida sodir bo'ladigan qaytar reaktsiyalar uchun, to'g'ridan-to'g'ri reaktsiya mahsulotlari ferment tomonidan teskari reaktsiya uchun substrat sifatida ishlatilishi mumkinligini hisobga olish kerak. Shuning uchun oqim yo'nalishi va Vmax ga erishish momenti boshlang'ich substratlar va reaktsiya mahsulotlari konsentratsiyasining nisbatiga bog'liq. Masalan, transformatsiyani katalizlovchi alanin aminotransferaza faolligi:
Alanin + Alfa-ketoglutarat ↔ Piruvat + Glutamat
hujayradagi konsentratsiya nisbatiga bog'liq:
[alanin + alfa-ketoglutarat] / [piruvat + glutamat].
FERMENTLARNING TA'SIRI MEXANIZMASI. FERMENTLAR KATALIZASI NAZARIYALARI
Fermentlar, oqsil bo'lmagan katalizatorlar kabi, bu reaktsiyaning faollashuv energiyasini kamaytirish qobiliyati tufayli kimyoviy reaksiya tezligini oshiradi. Enzimatik reaksiyaning aktivlanish energiyasi davom etayotgan reaksiya tizimidagi o‘tish holatiga yetgan energiya qiymati va reaksiya boshida aniqlangan energiya o‘rtasidagi farq sifatida hisoblanadi (22-rasmdagi grafik bog‘liqlikka qarang).

Guruch. 22. Fermentsiz (1) va ferment ishtirokida (2) kimyoviy reaksiyaning energiya holatining reaksiya vaqtiga grafik bog’liqligi.
V.Genri va, xususan, L.Michaelis, M.Mentenlarning monosubstratning qaytar fermentativ reaksiyalari mexanizmini oʻrganish boʻyicha ishi E fermenti birinchi boʻlib oʻz substrati S bilan teskari va nisbatan tez birikib, ferment hosil boʻlishini taxmin qilishga imkon berdi. substrat kompleksi (ES):
E+S<=>ES (1)
ES shakllanishi tufayli yuzaga keladi vodorod aloqalari, faol markaz va aminokislotalar qoldiqlarining yon radikallari orasidagi elektrostatik, hidrofobik o'zaro ta'sirlar, ba'zi hollarda kovalent, koordinatsion aloqalar. funktsional guruhlar substrat. Murakkab fermentlarda substrat bilan aloqa qilish funktsiyasini strukturaning oqsil bo'lmagan qismi ham bajarishi mumkin.
Keyin ferment-substrat kompleksi ikkinchi, sekinroq, qaytariladigan reaktsiyada parchalanib, reaktsiya mahsuloti P va erkin ferment E hosil bo'ladi:
ES<=>EP<=>E+P (2)
Hozirgi vaqtda yuqorida qayd etilgan olimlar, shuningdek, Keylin D., Chance B., Koshland D. ("induktsiyalangan yozishmalar" nazariyasi) ishi tufayli harakat mexanizmining to'rtta asosiy nuqtasi haqida nazariy qoidalar mavjud. Fermentlarning kimyoviy reaktsiyalarni tezlashtirish qobiliyatini aniqlaydigan substratdagi ferment:
1. Orientatsiya va yondashuv . Ferment substrat molekulasini shunday bog'lashi mumkinki, ferment tomonidan hujum qilingan aloqa nafaqat katalitik guruhga yaqin joylashgan, balki unga nisbatan to'g'ri yo'naltirilgan. ES kompleksining orientatsiya va yaqinlik tufayli o'tish holatiga erishish ehtimoli sezilarli darajada oshadi.
2. Stress va kuchlanish : induksiyalangan yozishmalar. Substratning biriktirilishi ferment molekulasida konformatsion o'zgarishlarga olib kelishi mumkin, bu esa faol markazning strukturasining kuchlanishiga olib keladi, shuningdek, bog'langan substratni biroz deformatsiya qiladi va shu bilan ES kompleksining o'tish holatiga erishishni osonlashtiradi. E va S molekulalari o'rtasida induktsiya qilingan yozishmalar paydo bo'ladi.
ENZIMATIV REAKSIYA KINETIKASI
fermentativ reaktsiyalarning vaqt o'tishi bilan o'tish qonuniyatlarini, shuningdek ularning mexanizmini o'rganadi; bob kimyoviy kinetika.
Katalitik E fermenti ta'sirida S moddaning (substrat) P mahsulotiga aylanish sikli oraliq moddalar hosil bo'lishi bilan davom etadi. ulanish. X i:
Qayerda ki- individual elementar bosqichlarning tezlik konstantalari,
ferment-substrat kompleksining hosil bo'lishi X 1 (ES, Michaelis kompleksi).
Berilgan haroratda reaksiya tezligi ferment, substrat va muhit tarkibining kontsentratsiyasiga bog'liq. Enzimatik reaksiyalarning statsionar, statsionardan oldingi va relaksatsiya kinetikalari mavjud.
Statsionar kinetika. Oraliq ulanishlar orqali statsionar holatda. (dX i/dt= 0, i = 1, ..., n) va substratning ortiqcha bo'lishi bilan, bu erda [S] 0 va [E] 0 mos ravishda dastlabki konsentratsiyalardir. substrat va ferment, jarayonning kinetikasi konsentratsiyalarning doimiy, vaqt bilan o'zgarmas darajasi bilan tavsiflanadi. ulanish va jarayon tezligining ifodasi v 0, chaqirildi boshlang'ich statsionar tezlik quyidagi ko'rinishga ega (Michaelis-Menten tenglamasi):
 (1)
(1)
bu erda k mushukning qiymatlari va K m -> elementar bosqichlar tezligi konstantalarining funktsiyalari va tenglamalar bilan berilgan:

K mushukning qiymati
chaqirdi samarali katalitik jarayon tezligi konstantasi, parametr K m -> Michaelis doimiy. k mushuk qiymati
miqdori bilan belgilanadi maks. katalitikning sekin bosqichlari tumanlar va ba'zan chaqiriladi fermentning aylanishlar soni (ferment tizimi); k mushuk
katalitik sonini xarakterlaydi ferment tizimi tomonidan vaqt birligida bajariladigan tsikllar. Naib. umumiy, k mushuk qiymatiga ega. aniq uchun 10 2 -10 3 s -1 oralig'ida substratlar. Michaelis konstantasining odatiy qiymatlari 10 -3 - 10 -4 M oralig'ida yotadi.
Substratning yuqori konsentratsiyasida, ya'ni aylanish tezligi substratning kontsentratsiyasiga bog'liq bo'lmaganda va doimiy qiymatga yetganda, deyiladi. Maks. tezlik. Grafik jihatdan Michaelis-Menten tenglamasi giperboladir. Uni ikki tomonlama o'zaro bog'lanishlar usuli (Linewere-Burk usuli), ya'ni 1/[S] 0 ga bog'liqlikni 1/v qurish yoki boshqa usullar yordamida chiziqli qilish mumkin. (1) tenglamaning chiziqli shakli quyidagi ko'rinishga ega:
 (2)
(2)
Bu sizga qiymatlarni grafik tarzda aniqlash imkonini beradi K m va v max (1-rasm).

Guruch. 1. Mikaelis - Menten tenglamasining ikki tomonlama o'zaro munosabatlardagi chiziqli o'zgarishi grafigi (Lineweaver - Burk bo'yicha).
Kattalik K m > qon aylanish tezligi teng bo'lgan substrat konsentratsiyasiga son jihatdan tengdir, shuning uchun K m ko'pincha substrat va fermentning yaqinligining o'lchovi bo'lib xizmat qiladi, ammo bu faqat
Miqdorlar K m > Va pH qiymatlariga qarab farqlanadi. Bu katalizda ishtirok etuvchi ferment molekula guruhlarining ionlanish holatini va shu orqali katalitik faolligini o'zgartirish qobiliyati bilan bog'liq. samaradorlik. Eng oddiy holatda, pH ning o'zgarishi katalizda ishtirok etadigan fermentning kamida ikkita ionlashtiriladigan guruhining protonatsiyasi yoki deprotonatsiyasiga olib keladi. Agar bu holda ferment-substrat kompleksining uchta mumkin bo'lgan shakllaridan (ES, ESH va ESH 2) faqat bitta shakli (masalan, ESH) eritma mahsulotiga aylanishi mumkin bo'lsa, u holda bog'liqlik. pH darajasi quyidagi formula bilan tavsiflanadi:

Qayerda f = 1 + / Va f" = 1 +
+K" b />-T. chaqirdi Michaelisning pH-funktsiyalari va K a, K b Va K" a, K" b -> a va bresp guruhlarning ionlanish konstantalari. ozod ferment va ferment-substrat kompleksi. Lg koordinatalarida - pH bu bog'liqlik shaklda keltirilgan. 2 va egri chiziqning ko'tariluvchi, pH-mustaqil va tushuvchi shoxlariga teginishlarning qiyalik burchaklarining tangenslari mos ravishda +1, 0 va -1 ga teng bo'lishi kerak. Bunday grafikdan siz qiymatlarni aniqlashingiz mumkin pK a katalizda ishtirok etadigan guruhlar.

Guruch. 2. Katalitikning bog'liqligi pH dan logarifmikgacha bo'lgan konstantalar. koordinatalar
Enzimatik reaksiya tezligi har doim ham (1) tenglamaga bo'ysunmaydi. Eng ko'p uchraydigan holatlardan biri - allosterikning reaktsiyada ishtirok etishi. fermentlar (qarang ferment regulyatorlari), buning uchun fermentning to'yinganlik darajasining [S] 0 ga bog'liqligi giperbolik emas. belgi (3-rasm). Bu hodisa substratni bog'lashning kooperativligi bilan bog'liq, ya'ni ferment makromolekulasi joylaridan birida substratning bog'lanishi boshqa saytning substratiga yaqinligi oshgan (ijobiy kooperativlik) yoki kamayganida (salbiy kooperativlik).

Guruch. H Fermentning substrat bilan to'yinganlik darajasining musbat (I) va manfiy (II) kooperativlikka ega bo'lgan substrat kontsentratsiyasiga, shuningdek, u yo'qligida (III) bog'liqligi.
Oldindan barqaror holat kinetikasi. 10 -6 -10 -1 s vaqt oralig'ida ferment va substrat eritmalarini tez aralashtirish bilan barqaror statsionar holat hosil bo'lishidan oldingi vaqtinchalik jarayonlarni kuzatish mumkin. Ushbu oldingi statsionar rejimda, katta ortiqcha substratdan foydalanganda, differentsial tizim. Jarayonlarning kinetikasini tavsiflovchi tenglama chiziqli. Ushbu turdagi chiziqli differensial tizimning yechimi. Tenglama ko'rsatkichli hadlar yig'indisi bilan berilgan. Shunday qilib, kinetik uchun Yuqorida keltirilgan sxema bo'yicha mahsulot to'planish kinetikasi quyidagi shaklga ega:

qaerda A i ->, b va n -> elementar tezlik konstantalarining funktsiyalari; -mos belgining ildizlari. Daraja.
O'zaro kattalik deyiladi xarakterli jarayon vaqti:
Niintervallar ishtirokida oqadigan daryo uchun. ulanish, siz xarakteristikalar olishingiz mumkin. marta
Statsionardan oldingi rejimda fermentativ reaktsiyaning kinetikasini o'rganish bizga katalitik reaktsiyalarning batafsil mexanizmi haqida tasavvurga ega bo'lish imkonini beradi. sikl va jarayonning elementar bosqichlarining tezlik konstantalarini aniqlang.
Eksperimental ravishda, prestatsionar rejimda fermentativ reaktsiyaning kinetikasi to'xtatilgan reaktiv usul yordamida o'rganiladi (qarang. Jet-kinetik usullar), eritmaning tarkibiy qismlarini 1 ms ichida aralashtirish imkonini beradi.
Relaksatsiya kinetikasi. Tizimga tez bezovta qiluvchi ta'sir (harorat, bosim, elektr maydonining o'zgarishi) bilan tizimning yangi muvozanat yoki statsionar holatga erishish uchun zarur bo'lgan vaqti katalitik reaktsiyani aniqlaydigan jarayonlarning tezligiga bog'liq. fermentativ tsikl.
Agar muvozanat holatidan siljish kichik bo'lsa, jarayonning kinetikasini tavsiflovchi tenglamalar tizimi chiziqli bo'ladi. Tizimning yechimi komponentlar kontsentratsiyasining bog'liqligiga olib keladi, dek. ko'rsatkichlari bo'shashish vaqtlari xarakteriga ega bo'lgan ko'rsatkichli hadlar yig'indisi ko'rinishidagi jarayon bosqichlari. Tadqiqot natijasi intervallar soniga mos keladigan bo'shashish vaqtlari spektridir. jarayonda ishtirok etuvchi aloqalar. Bo'shashish vaqtlari jarayonlarning elementar bosqichlari tezligi konstantalariga bog'liq.
Dam olish texnikasi kinetika oraliq mahsulotlarni aylantirishning alohida elementar bosqichlarining tezlik konstantalarini aniqlash imkonini beradi. Gevşeme kinetikasini o'rganish usullari turlicha. qaror: ultratovushni yutish - 10 -6 -10 -10
s, haroratning sakrashi - 1O -4 -10 -6 s, elektr usuli. impuls - 10 -4 -10 -6 s, bosimning sakrashi - 10 -2 s. Enzimatik reaksiyalarning kinetikasini o'rganishda haroratning sakrash usuli qo'llanilishi topildi.
Enzimatik jarayonlarning makrokinetikasi. Fermentlarni parchalanishda immobilizatsiya qilish orqali geterogen katalizatorlar olish usullarini ishlab chiqish. ommaviy axborot vositalari (qarang Immobilizatsiyalangan fermentlar) substratning massa almashinuvini hisobga olgan holda jarayonlar kinetikasini tahlil qilishni talab qildi. Reaksiyalarning kinetikasi diffuziya qatlamining ta'sirini hisobga olgan holda va fermentning tashuvchi ichida tarqalishi paytida intradiffuziya qiyinchiliklari bo'lgan tizimlar uchun nazariy va eksperimental jihatdan o'rganildi.
Jarayonning kinetikasiga substratning diffuziya uzatilishi ta'sir qiladigan sharoitlarda, katalitik. tizim samaradorligi pasayadi. Samaradorlik koeffitsienti diffuziv ravishda kamaytirilgan substrat konsentratsiyasi bilan fermentativ oqim sharoitida mahsulot oqimi zichligining diffuziya cheklovlari bo'lmaganda amalga oshirilishi mumkin bo'lgan oqimga nisbatiga tengdir. Sof diffuziya hududida, jarayonning tezligi substratning massa o'tkazilishi bilan aniqlanganda, tashqi diffuziya inhibisyonu bo'lgan tizimlar uchun samaradorlik koeffitsienti diffuziya moduliga teskari proportsionaldir:

Qayerda
diffuziya qatlamining qalinligi, D - koeffitsient. substratning tarqalishi.
Birinchi darajali hududlarda intradiffuziya inhibisyoniga ega tizimlar uchun

qaerda F T- o'lchamsiz modul (Thiele moduli).
Kinetikani tahlil qilganda enzimatik reaktorlardagi naqshlar keng nazariydir. va tajriba. "Ideal" reaktor modellari ishlab chiqilgan: oqim reaktori (ideal aralashtirish bilan oqim reaktori), ideal siljishli oqim reaktori va membrana reaktori.
Ko'p fermentli jarayonlarning kinetikasi. Organizmda (hujayra) fermentlar yakka holda harakat qilmaydi, balki molekulalarning aylanish zanjirlarini katalizlaydi. Kinetik bilan ko'p fermentli tizimlarda R-ionlari. nuqtai nazarlarni izchil deb hisoblash mumkin. jarayonlar, o'ziga xos Har bir bosqichning fermentlari uning xususiyati:
Qayerda ,
javob. max, jarayon tezligi va Michaelis doimiysi i navbati bilan tumanning 1-bosqichi.
Jarayonning muhim xususiyati - barqaror statsionar holatni shakllantirish imkoniyati. Uning yuzaga kelishi sharti tengsizlik bo'lishi mumkin > v 0 , bu erda v 0 - cheklash bosqichining tezligi, eng kichik tezlik konstantasi bilan tavsiflanadi va shu bilan keyingi hamma narsaning tezligini aniqlaydi. jarayon. Barqaror holatda, cheklash bosqichidan keyin metabolitlarning kontsentratsiyasi tegishli fermentning Michaelis konstantasidan past bo'ladi.
Maxsus ko'p fermentli tizimlar guruhi oksidlanish-qaytarilishni amalga oshiradigan tizimlardan iborat. oqsil elektron tashuvchilar ishtirokidagi r-tsionlar. Tashuvchilar maxsus shakl elektron uzatishning deterministik ketma-ketligiga ega tuzilmalar, komplekslar. Kinetik. bu turdagi tizimlarning tavsifi parchalanish davrlarining holatini mustaqil o'zgaruvchi sifatida ko'rib chiqadi. elektron populyatsiya darajasi.
Ilova. F.r. k.da keng qoʻllaniladi tadqiqot amaliyoti fermentlar va ferment tizimlarining ta'sir mexanizmlarini o'rganish. Fermentlar fanining amaliy jihatdan muhim sohasi hisoblanadi muhandislik enzimologiyasi, F. r tushunchalari bilan ishlaydi. biotexnologiyani optimallashtirish uchun. jarayonlar.
Lit.: Poltorak O. M., Chuxray E. S., Enzimatik katalizning fizik-kimyoviy asoslari, M., 1971; Berezin I. V., Martinek K., asoslar fizik kimyo fermentativ kataliz, M., 1977; Varfolomeev S. D., Zaitsev S. V., Biokimyoviy tadqiqotlarda kinetik usullar, M.. 1982 yil. S. D. Varfolomeev.
Kimyoviy ensiklopediya. - M.: Sovet Entsiklopediyasi. Ed. I. L. Knunyants. 1988 .
Boshqa lug'atlarda "ENZYMATIVE REAKSIYA KINETIKASI" nima ekanligini ko'ring:
Katalitik radio siklik tezliklari massalar ta'siri qonuni bilan tavsiflangan bir qancha elementar harakatlardan iborat jarayon. Bu qonun ideal gaz aralashmalari, ideal suyuqliklar va ideal sirt qatlamlari uchun oddiy shaklga ega.... ... Kimyoviy ensiklopediya
Kinetika kimyoviy reaksiyalar, doktrinasi kimyoviy jarayonlar ularning vaqt, tezlik va mexanizmlarda yuzaga kelish qonuniyatlari haqida. Zamonaviy kimyo va kimyoning eng muhim sohalari... ... kimyoviy reaksiyalar kinetikasini o'rganish bilan bog'liq. Buyuk Sovet Entsiklopediyasi
KIMYOVIY KINETIKA- (yunoncha kinesis harakatidan), bo'lim nazariy kimyo, kimyo qonunlarini o'rganishga bag'ishlangan. reaktsiyalar. Bir necha turdagi kimyoviy moddalarni aniqlash mumkin. o'zaro ta'sirlar va birinchi navbatda, bir hil (bir hil) muhitda sodir bo'ladigan reaktsiyalarni reaktsiyalardan farqlash ... ... Katta tibbiy ensiklopediya
- (biokataliz), biokimyoviy tezlashuv. fermentlar deb ataladigan oqsil makromolekulalari ishtirokidagi ratsionlar. F. k. katalizning bir turi, garchi fermentatsiya (fermentatsiya) atamasi kimyo tushunchasi boʻlmagan qadimdan maʼlum boʻlgan. kataliz. Birinchi …… Kimyoviy ensiklopediya
- (lotincha re prefiksidan qarama-qarshi harakat va actio harakat ma'nosini bildiradi), atom yadrolarining o'zgarmasligi bilan ba'zilarini (boshlang'ich birikmalar) boshqalarga (oziq-ovqat mahsulotlari) aylantirish (farqli o'laroq). yadro reaksiyalari). R. x.dagi dastlabki birikmalar. ba'zan chaqiriladi ...... Kimyoviy ensiklopediya
- (lotincha fermentum starterdan) (fermentlar), tirik organizmlarda katalizator vazifasini bajaradigan oqsillar. Asosiy funktsiyalari F. organizmga kiradigan va metabolizm jarayonida hosil bo'lgan moddalarning konversiyasini tezlashtiradi (yangilash uchun). hujayra tuzilmalari, buni ta'minlash uchun ... Kimyoviy ensiklopediya
- (yunoncha pharmakon tibbiyoti va harakatdagi kinetikos so'zidan), kinetikani o'rganadi. lek bilan sodir bo'ladigan jarayonlarning naqshlari. Tanadagi qusish. Asosiy farmakokinetik jarayonlar: so'rilish, tarqatish, metabolizm va chiqarish (olib tashlash).... ... Kimyoviy ensiklopediya
Fermentlar kinetikasi turli omillarning (S va E kontsentratsiyasi, pH, harorat, bosim, ingibitorlar va aktivatorlar) fermentativ reaktsiyalar tezligiga ta'sirini o'rganadi. Enzimatik reaktsiyalar kinetikasini o'rganishdan asosiy maqsad fermentlarning ta'sir mexanizmini chuqurroq tushunishga imkon beradigan ma'lumotlarni olishdir.
Kinetik egri chiziq dastlabki reaksiya tezligini V 0 aniqlash imkonini beradi.
Substratning to'yinganligi egri chizig'i.
Reaksiya tezligining ferment kontsentratsiyasiga bog'liqligi.
Reaksiya tezligining haroratga bog'liqligi.
Reaksiya tezligining pH ga bog'liqligi.
|
|
Ko'pgina fermentlarning ta'siri uchun optimal pH 6,0-8,0 fiziologik diapazonda joylashgan. Pepsin pH 1,5-2,0 da faol, bu me'da shirasining kislotaligiga mos keladi. Arginaza, jigarga xos ferment, 10,0 faol. PH ning fermentativ reaksiya tezligiga ta'siri ferment va substrat molekulalarida ionogen guruhlarning ionlanish holati va darajasi bilan bog'liq. Bu omil oqsilning konformatsiyasini, faol markaz va substratning holatini, ferment-substrat kompleksining hosil bo'lishini va kataliz jarayonining o'zini belgilaydi. |
Substratning to'yinganligi egri chizig'ining matematik tavsifi, Michaelis doimiysi .
|
|
Substratning to'yinganlik egri chizig'ini tavsiflovchi tenglama Michaelis va Menton tomonidan taklif qilingan va ularning nomlarini oladi (Michaelis-Menten tenglamasi): V = (V MAX *[ S])/(Km+[ S]) , bu erda Km - Michaelis doimiysi. Hisoblash oson, V = V MAX /2 Km = [S] bo'lganda, ya'ni. Km - substrat konsentratsiyasi, bunda reaksiya tezligi ½ V MAX. V MAX va Km ni aniqlashni soddalashtirish uchun Michaelis-Menten tenglamasini qayta hisoblash mumkin. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
1/ V = Km/ V MAX *1/[ S] + 1/ V MAX Lineweaver-Burk tenglamasi. Lineweaver-Burk syujetini tavsiflovchi tenglama to'g'ri chiziq tenglamasi (y = mx + c), bu erda 1/V MAX y o'qidagi to'g'ri chiziqning kesishishi; Km/V MAX - to'g'ri chiziqning tangensi; to'g'ri chiziqning abscissa o'qi bilan kesishishi 1/Km qiymatini beradi. Lineweaver-Burk syujeti Km ni nisbatan kam sonli nuqtalardan aniqlash imkonini beradi. Ushbu grafik quyida muhokama qilinganidek, inhibitorlarning ta'sirini baholashda ham qo'llaniladi. Km qiymati juda katta farq qiladi: juda faol fermentlar uchun 10 -6 mol/l dan, past faol fermentlar uchun 10 -2 gacha. |
Km hisob-kitoblari amaliy ahamiyatga ega. Km dan 100 marta kattaroq substrat konsentratsiyasida ferment maksimal tezlikda ishlaydi, shuning uchun maksimal tezlik V MAX mavjud faol ferment miqdorini aks ettiradi. Ushbu holat preparatdagi ferment tarkibini baholash uchun ishlatiladi. Bundan tashqari, Km enzimopatiyalarni tashxislash uchun ishlatiladigan fermentning xarakteristikasi hisoblanadi.
Ferment faolligini inhibe qilish.
Fermentlarning o'ta xarakterli va muhim xususiyati ularning ma'lum ingibitorlar ta'sirida inaktivatsiyasidir.
Inhibitorlar - bular fermentlar tomonidan katalizlanadigan reaktsiyalarni qisman yoki to'liq inhibe qilishga olib keladigan moddalardir.
Enzimatik faollikni inhibe qilish qaytarilmas yoki qaytarilmas, raqobatbardosh yoki raqobatdosh bo'lmagan bo'lishi mumkin.
Qaytarib bo'lmaydigan inhibisyon - bu fermentning konformatsiyasini o'zgartiradigan faol joyda yoki boshqa maxsus markazda inhibitor molekulasini kovalent bog'lanishi natijasida fermentning doimiy inaktivatsiyasi. Erkin fermentning regeneratsiyasi bilan bunday turg'un komplekslarning dissotsiatsiyasi amalda istisno qilinadi. Bunday inhibisyonning oqibatlarini bartaraf etish uchun organizm yangi ferment molekulalarini sintez qilishi kerak.
Qaytariladigan inhibisyon - kovalent bo'lmagan bog'lanishlar tufayli inhibitorning ferment bilan muvozanatli kompleksi bilan tavsiflanadi, buning natijasida bunday komplekslar ferment faolligini tiklash bilan ajralib chiqishga qodir.
Inhibitorlarning raqobatbardosh va raqobatdosh bo'lmaganlarga bo'linishi uning zaiflashganligiga asoslanadi ( raqobatbardosh inhibisyon ) yoki zaiflashmagan ( raqobatdosh bo'lmagan inhibisyon ) substrat konsentratsiyasi oshganda ularning inhibitiv ta'siri.
Raqobatbardosh inhibitorlar - bular, qoida tariqasida, tuzilishi substratning tuzilishiga o'xshash birikmalardir. Bu ularga substratlar bilan bir xil faol joyda bog'lanish imkonini beradi, fermentning substrat bilan bog'lanish bosqichida o'zaro ta'sirini oldini oladi. Bog'langandan so'ng, inhibitor mahsulotga aylanishi mumkin yoki dissotsiatsiya sodir bo'lguncha faol joyda qolishi mumkin.
Qaytariladigan raqobatbardosh inhibisyon diagramma shaklida ifodalanishi mumkin:
E↔ E-I → E + P 1
S (faol emas)
Fermentni inhibe qilish darajasi substrat va ferment kontsentratsiyasining nisbati bilan belgilanadi.
Ushbu turdagi inhibisyonning klassik namunasi malat tomonidan suksinat dehidrogenaza (SDH) faolligini inhibe qilish bo'lib, u suksinatni substrat joyidan siqib chiqaradi va uning fumaratga aylanishiga to'sqinlik qiladi:

Inhibitorning faol joy bilan kovalent bog'lanishi fermentning inaktivatsiyasiga olib keladi (qaytarib bo'lmaydigan inhibisyon). Misol qaytarilmas raqobatbardosh inhibisyon triosefosfat izomerazaning 3-xloroatsetol fosfat bilan inaktivatsiyasi sifatida xizmat qilishi mumkin. Ushbu inhibitor substratning strukturaviy analogi dihidroksiaseton fosfat bo'lib, faol joydagi glutamik kislota qoldig'iga qaytarilmas tarzda bog'lanadi:
Ba'zi ingibitorlar turli fermentlarning faol joyida ma'lum bir funktsional guruh bilan o'zaro ta'sir qilib, kamroq tanlab ta'sir qiladi. Shunday qilib, yodoatsetat yoki uning amidini fermentning faol markazida joylashgan va katalizda ishtirok etuvchi aminokislota sisteinning SH guruhiga bog'lanishi ferment faolligining to'liq yo'qolishiga olib keladi:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Shuning uchun bu inhibitorlar katalizda ishtirok etadigan SH guruhlari bo'lgan barcha fermentlarni faolsizlantiradi.
Nerv gazlari (zarin, soman) ta'sirida gidrolazalarning qaytarilmas inhibisyoni ularning faol markazdagi serin qoldig'i bilan kovalent bog'lanishi bilan bog'liq.
Raqobatbardosh inhibisyon usuli tibbiyot amaliyotida keng qo'llanilishini topdi. Sulfanamid preparatlari, p-aminobenzoy kislota antagonistlari, metabolizatsiyalangan raqobatbardosh inhibitorlarga misol bo'la oladi. Ular bakterial o'sish uchun zarur bo'lgan p-aminobenzoatni foliy kislotasiga aylantiruvchi bakterial ferment - dihidropterat sintetaza bilan bog'lanadi. Bog'langan sulfanilamidning boshqa birikmaga aylanishi va foliy kislotasi hosil bo'lmasligi natijasida bakteriya nobud bo'ladi.
Raqobatbardosh bo'lmagan inhibitorlar odatda ferment molekulasi bilan substratni bog'lash joyidan farqli joyda bog'lanadi va substrat inhibitor bilan bevosita raqobatlashmaydi. Inhibitor va substrat turli markazlarga bog'langanligi sababli, E-I kompleksining ham, S-E-I kompleksining ham shakllanishi mumkin. S-E-I kompleksi ham mahsulot hosil qilish uchun parchalanadi, lekin E-S ga qaraganda sekinroq tezlikda, shuning uchun reaktsiya sekinlashadi, lekin to'xtamaydi. Shunday qilib, quyidagi parallel reaktsiyalar sodir bo'lishi mumkin:
E↔ E-I ↔ S-E-I → E-I + P
Qaytariladigan raqobatbardosh bo'lmagan inhibisyon nisbatan kam uchraydi.
Raqobatbardosh bo'lmagan inhibitorlar deyiladi allosterik raqobatbardoshlardan farqli o'laroq ( izosterik ).
Qaytariladigan inhibisyon Michaelis-Menten tenglamasi yordamida miqdoriy jihatdan o'rganilishi mumkin.
Raqobatbardosh inhibisyon bilan V MAX doimiy bo'lib qoladi va Km ortadi.
|
|
|
Raqobatsiz inhibisyon bilan V MAX kamayadi, Km esa o'zgarishsiz qoladi.
|
|
|
Agar reaksiya mahsuloti uning hosil bo'lishini katalizlovchi fermentni inhibe qilsa, bu inhibisyon usuli deyiladi retroinhibisyon yoki fikr-mulohazalarni inhibe qilish . Masalan, glyukoza glyukoza-6-fosfatazani inhibe qiladi, bu esa glyukoza-6-fosfat gidrolizlanishini katalizlaydi.
Ushbu inhibisyonning biologik ahamiyati ma'lum metabolik yo'llarni tartibga solishdir (keyingi darsga qarang).
AMALIY QISM
Talabalar uchun topshiriq
1. Mineral va organik kislotalar eritmalari ta'sirida va qizdirilganda oqsillarning denaturatsiyasini o'rganing.
2. Xamirturushda NAD koenzimini aniqlang.
3. Siydikdagi amilaza faolligini aniqlang (qon zardobi).
9. MUAMMOLARGA JAVOBLAR STANDARTLARI, darsda bilimlarni nazorat qilish uchun foydalaniladigan test savollari (ilova sifatida foydalanish mumkin)
10. MAVZU BO'YICHA MUMKIN O'QUV-TADQIQOT ISHLARINING MAXATI VA KO'lami.
(AIRSning tabiati va shaklini aniq ko'rsating: mavhum taqdimotlar tayyorlash, mustaqil tadqiqot o'tkazish, simulyatsiya o'yinlari, monografik adabiyotlar va boshqa shakllardan foydalangan holda kasallik tarixini to'ldirish)
Ferment reaksiya tezligi
Enzimatik reaksiya tezligi vaqt birligida aylantirilgan substrat miqdori yoki hosil bo'lgan mahsulot miqdori bilan o'lchanadi. Tezlik reaksiyaning dastlabki bosqichida tangensning egri chiziqqa moyillik burchagi bilan aniqlanadi.
Guruch. 2 Enzimatik reaksiya tezligi.
Nishab qanchalik tik bo'lsa, tezlik shunchalik yuqori bo'ladi. Vaqt o'tishi bilan reaktsiya tezligi odatda pasayadi, asosan substrat konsentratsiyasining pasayishi natijasida.
Enzimatik faollikka ta'sir qiluvchi omillar
F.ning taʼsiri bir qancha omillarga bogʻliq: harorat, atrof-muhit reaksiyasi (pH), ferment konsentratsiyasi, substrat konsentratsiyasi va oʻziga xos aktivatorlar hamda oʻziga xos boʻlmagan yoki oʻziga xos ingibitorlarning mavjudligi.
Ferment konsentratsiyasi
Yuqori substrat kontsentratsiyasida va boshqa omillar doimiy bo'lib qolsa, fermentativ reaktsiya tezligi ferment kontsentratsiyasiga mutanosib bo'ladi.

Guruch. 3 Enzimatik reaksiya tezligining ferment konsentratsiyasiga bog'liqligi.
Kataliz har doim ferment kontsentratsiyasi substrat konsentratsiyasidan ancha past bo'lgan sharoitlarda sodir bo'ladi. Shuning uchun ferment konsentratsiyasi ortishi bilan fermentativ reaksiya tezligi ham ortadi.
Harorat
Haroratning fermentativ reaktsiya tezligiga ta'siri Q 10 harorat koeffitsienti orqali ifodalanishi mumkin: Q 10 = (x + 10) ° C da reaktsiya tezligi) / (x ° C da reaksiya tezligi)
0-40°S oraligʻida fermentativ reaksiyaning Q10 qiymati 2. Boshqacha aytganda, haroratning har 10°C oshishi uchun fermentativ reaksiya tezligi ikki barobar ortadi.

Guruch. 4 Tuprik amilazasi kabi ferment faolligiga haroratning ta'siri.
Harorat ko'tarilgach, molekulalarning harakati tezlashadi va reaksiyaga kirishuvchi moddalar molekulalarining bir-biri bilan to'qnashuvi kuchayadi. Binobarin, ular o'rtasida reaktsiya paydo bo'lish ehtimoli ortadi. Eng katta faollikni ta'minlaydigan harorat optimal deb ataladi. Ushbu darajadan tashqarida, to'qnashuv chastotasining oshishiga qaramay, fermentativ reaktsiya tezligi pasayadi. Bu fermentning ikkilamchi va uchinchi darajali tuzilmalarining buzilishi, boshqacha aytganda, fermentning denaturatsiyaga uchrashi tufayli yuzaga keladi.

Guruch. 5 Turli haroratlarda fermentativ reaksiyaning borishi.
Harorat muzlash darajasiga yaqinlashganda yoki undan pastga tushganda, fermentlar inaktivlanadi, ammo denatürasyon sodir bo'lmaydi. Haroratning oshishi bilan ularning katalitik faolligi yana tiklanadi.
Quruq holatdagi oqsillar gidratlangan oqsillarga (oqsil jeli yoki eritmasi shaklida) qaraganda ancha sekin denatüratsiya qilinganligi sababli, quruq holatda fosforning inaktivatsiyasi namlik borligiga qaraganda ancha sekinroq sodir bo'ladi. Shuning uchun quruq bakterial sporlar yoki quruq urug'lar nam holatda bir xil sporlar yoki urug'larga qaraganda ancha yuqori haroratgacha qizdirishga bardosh bera oladi.
Substrat kontsentratsiyasi
Berilgan ferment kontsentratsiyasi uchun fermentativ reaksiya tezligi substrat konsentratsiyasi ortishi bilan ortadi.

Guruch. 6 Enzimatik reaksiya tezligining substrat konsentratsiyasiga bog'liqligi.
Nazariy maksimal reaktsiya tezligi Vmax ga hech qachon erishilmaydi, lekin shunday nuqta keladiki, substrat kontsentratsiyasining yanada oshishi reaktsiya tezligida sezilarli o'zgarishlarga olib kelmaydi. Buni yuqori substrat kontsentratsiyasida fosfor molekulalarining faol markazlari har qanday vaqtda amalda to'yinganligi bilan izohlash kerak. Shunday qilib, ortiqcha substrat mavjud bo'lishidan qat'i nazar, u faqat avval hosil bo'lgan ferment-substrat kompleksi mahsulotga va erkin fermentga ajralgach, ferment bilan birlashishi mumkin, shuning uchun substratning yuqori konsentratsiyasida fermentativ reaktsiya tezligi ikkala tomonidan ham cheklangan substrat konsentratsiyasi va ferment-substrat kompleksining dissotsiatsiyasi uchun zarur bo'lgan vaqt.
Doimiy haroratda har qanday fosfor tor pH oralig'ida eng samarali ishlaydi. Optimal pH qiymati reaksiya maksimal tezlikda davom etadigan qiymatdir.

Guruch. 7 Fermentlar faolligining pH ga bog'liqligi.
Yuqori va past pH da F.ning faolligi pasayadi. PH siljishi fosfor molekulalarining o'ziga xos shakli bog'liq bo'lgan ionlashtirilgan kislotali va asosiy guruhlarning zaryadini o'zgartiradi, natijada fosfor molekulalarining shakli va birinchi navbatda uning faol markazining shakli o'zgaradi. Agar pH juda keskin oʻzgarsa, F. denatüratsiyalanadi. Berilgan fosforning pH optimal xarakteristikasi har doim ham uning bevosita hujayra ichidagi muhitining pH qiymatiga to'g'ri kelmaydi. Bu F. joylashgan muhit uning faoliyatini maʼlum darajada tartibga solib turishini koʻrsatadi.