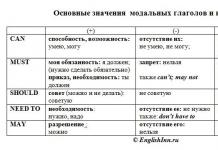
Kimyoviy tuzilishi
Benzol molekulasidagi uglerod atomlari odatdagi tekis oltiburchakni hosil qiladi, garchi u odatda cho'zilgan shaklda chizilgan.
Benzol molekulasining tuzilishi nihoyat uning asetilendan hosil bo'lish reaksiyasi bilan tasdiqlandi. Strukturaviy formulada uchta bitta va uchta ikkita o'zgaruvchan uglerod-uglerod aloqalari tasvirlangan. Ammo bunday tasvir molekulaning haqiqiy tuzilishini bildirmaydi. Haqiqatda, benzoldagi uglerod-uglerod aloqalari ekvivalentdir va ular bitta yoki qo'sh bog'lanishlardan farqli xususiyatlarga ega. Bu xususiyatlar benzol molekulasining elektron tuzilishi bilan izohlanadi.
Benzolning elektron tuzilishi
Benzol molekulasidagi har bir uglerod atomi sp 2 gibridlanish holatidadir. U ikkita qo'shni uglerod atomi va vodorod atomi bilan uchta y-bog' bilan bog'langan. Natijada tekis olti burchakli: barcha oltita uglerod atomlari va barchasi y-bog'lar C--C va C--H bir tekislikda yotadi. Gibridlanishda ishtirok etmaydigan to'rtinchi elektronning (p-elektron) elektron buluti gantel shakliga ega va benzol halqasi tekisligiga perpendikulyar yo'naltirilgan. Qo'shni uglerod atomlarining bunday p-elektron bulutlari halqa tekisligidan yuqorida va pastda bir-biriga yopishadi. Natijada oltita p-elektron umumiy hosil qiladi elektron bulut va bitta kimyoviy bog'lanish barcha uglerod atomlari uchun. Y-bog' tekisligining har ikki tomonida katta elektron tekislikning ikkita hududi joylashgan.
p-elektron buluti uglerod atomlari orasidagi masofaning qisqarishiga olib keladi. Benzol molekulasida ular bir xil va 0,14 nm ga teng. Bir va qo'sh bog'lanish holatida bu masofalar mos ravishda 0,154 va 0,134 nm bo'ladi. Bu shuni anglatadiki, benzol molekulasida bitta yoki qo'sh bog'lar mavjud emas. Benzol molekulasi bir xil tekislikda yotgan bir xil CH guruhlarining olti a'zoli barqaror siklidir. Benzoldagi uglerod atomlari orasidagi barcha bog'lanishlar ekvivalentdir, bu benzol halqasining xarakterli xususiyatlarini aniqlaydi. Buni ichida aylana (I) bo'lgan muntazam olti burchakli shaklidagi benzolning struktura formulasi eng aniq aks ettiradi. (Doira uglerod atomlari orasidagi bog'lanishlarning ekvivalentligini anglatadi.) Biroq, Kekulening qo'sh bog'lanishlarni (II) ko'rsatadigan formulasi ham tez-tez ishlatiladi.
Aromatik uglevodorodlar (Arenalar) molekulalarida bir yoki bir nechta benzol halqalarini o'z ichiga olgan organik birikmalar. Benzol halqasi yoki yadro, maxsus bog'lanish xususiyatiga ega bo'lgan uglerod atomlarining tsiklik guruhidir.
Umumiy formula -CnH2n-6
1. Vakillar:
MONOYALE
1. C 6 H 6 – benzol, arenlarning gomologik qatorining asoschisi
2. C 6 H 5 – CH 3 - toluol (metilbenzol)
3. C 6 H 5 – CH = C H 2 - stirol (vinilbenzol)
4. Ksilen (orto-, para-, meta-ksilen)
KO'P KO'P KO'P (QUYILGAN)
1. Naftalin
2.
Antrasen
2. Aromatik uglevodorodlarning tuzilishi :
Benzolning birinchi tuzilish formulasi 1865 yilda nemis kimyogari F.A.Kekule tomonidan taklif qilingan:

Benzol molekulasidagi C atomlari oddiy tekis olti burchakli shaklni hosil qiladi, garchi u ko'pincha cho'zilgan holda chizilgan.
Yuqoridagi formula oltita C atomining ekvivalentligini to'g'ri aks ettiradi, lekin benzolning bir qator maxsus xususiyatlarini tushuntirmaydi. Masalan, to'yinmagan bo'lishiga qaramay, u qo'shilish reaktsiyalariga moyil emas: brom suvi va kaliy permanganat eritmasini rangsizlantirmaydi, ya'ni. to'yinmagan birikmalarga xos bo'lgan sifatli reaksiyalar bilan tavsiflanmaydi .
Kekule strukturaviy formulasi uchta bitta va uchta o'zgaruvchan uglerod-uglerod aloqalarini o'z ichiga oladi. Ammo bunday tasvir molekulaning haqiqiy tuzilishini bildirmaydi. Aslida, benzoldagi uglerod-uglerod aloqalari ekvivalentdir. Bu uning molekulasining elektron tuzilishi bilan izohlanadi.
Benzol molekulasidagi har bir S atomi sp 2 gibridlanish holatidadir. U ikkita qo'shni C atomiga va uchta H atomiga bog'langan σ - ulanishlar. Natijada tekis olti burchakli bo'lib, unda barcha oltita C atomlari va barchasi mavjudσ -C–C va C–H bog’lari bir tekislikda yotadi (C–C bog’lar orasidagi burchak 120 o).
Guruch. Ta'lim sxemasi -benzol molekulasidagi bog'lar.
Uglerod atomining uchinchi p-orbitali gibridlanishda qatnashmaydi. U dumbbellga o'xshaydi va benzol halqasi tekisligiga perpendikulyar yo'naltirilgan. Qo'shni C atomlarining bunday p-orbitallari halqa tekisligidan yuqorida va pastda bir-biriga yopishadi.
Guruch. Benzol molekulasidagi uglerodning gibrid bo'lmagan 2p orbitallari
Natijada, oltita p-elektron (barcha oltita C atomidan) umumiy hosil bo'ladi π -elektron buluti va barcha C atomlari uchun yagona kimyoviy bog'lanish.
Guruch. Benzol molekulasi. Manzil π - elektron bulut
π -Elektron buluti C atomlari orasidagi masofaning qisqarishiga olib keladi.
Benzol molekulasida ular bir xil va 0,139 nm ga teng. Bir va qo'sh bog'lanish holatida bu masofalar mos ravishda 0,154 va 0,134 nm bo'ladi. Bu shuni anglatadiki, benzol molekulasida bitta va qo'sh bog'larning almashinuvi yo'q, lekin oddiy va juftlik o'rtasida maxsus bog' - "bir yarim" - aromatik bog'lanish deb ataladigan oraliq mavjud. Benzol molekulasida p-elektron bulutining bir xil taqsimlanishini ko'rsatish uchun uni ichida aylana bo'lgan muntazam olti burchakli shaklida tasvirlash to'g'riroqdir (doira C atomlari orasidagi bog'lanishlarning ekvivalentligini anglatadi):

3. Izomeriya, nomenklatura
Izomeriya mavjud radikallarning uglerod skeletining izomeriyasi va ularning benzol halqasidagi nisbiy joylashuvi bilan bog'liq. Ikki o'rinbosarning pozitsiyasi prefikslar yordamida ko'rsatilgan: orto- (o-), agar ular qo'shni uglerod atomlarida joylashgan bo'lsa (1, 2- pozitsiyasi), meta- (m-) bir uglerod atomi bilan ajratilgan uchun (1, 3-) va juft- (n-) bir-biriga qarama-qarshi bo'lganlar uchun (1, 4-).
Masalan, dimetilbenzol (ksilen) uchun:
orto-ksilen (1,2-dimetilbenzol)
meta-ksilen (1,3-dimetilbenzol)
para-ksilen (1,4-dimetilbenzol)
Aromatik uglevodorodlarning radikallari deyiladi aril radikallari . Radikal C 6 H 5 - deyiladi fenil.
Benzol birinchi marta ajratib olingan M. Faraday 1825 yilda London shahar ko'chalarini yoritish uchun ishlatiladigan yorug'lik gazidan tushgan kondensatsiyadan. Faraday o'tkir hidli bu suyuq, juda harakatchan moddani "karbüratlangan vodorod" deb atadi. Shuni ta'kidlash kerakki, o'sha paytda ham benzolning tarkibi aniqlangan teng qismlar uglerod va vodorod.
Biroz vaqt o'tgach, 1834 yilda Mitscherlich benzoy kislotasini dekarboksillash yo'li bilan tayyorlangan benzol. U, shuningdek, hosil bo'lgan birikmaning elementar tarkibini - C 6 H 6 ni aniqladi va unga o'z nomini taklif qildi - benzin. Biroq, Liebig bu nomga rozi bo'lmadi. Unga bu nom benzolni xinin va strixnin kabi uzoqdagi moddalar bilan tenglashtirgandek tuyuldi. Liebigga ko'ra, yangi birikma uchun yaxshiroq nom benzol, chunki u benzolning moylarga o'xshashligini ko'rsatadi (nemis tilidan ol- moy). Boshqa takliflar ham bor edi. Benzol Faraday tomonidan yorug'lik gazidan ajratilganligi sababli, Loran (1837) uning nomini taklif qildi. feno yunoncha "nur keltiruvchi" dan. Bu nom aniqlanmagan, ammo monovalent benzol qoldig'ining nomi shundan kelib chiqqan - fenil.
Faraday uglevodorodi omadsiz edi. Buning uchun taklif qilingan barcha nomlar noto'g'ri bo'lib chiqdi. Liebigning "benzol" nomidan kelib chiqadiki, birikma tarkibida gidroksil guruhi mavjud bo'lib, u erda yo'q. Xuddi shunday, Mitscherlichning "benzinida" azot o'z ichiga olgan funktsional guruh mavjud emas. Bundan tashqari, turli nomlarning mavjudligi kimyogarlarning bo'linishiga olib keldi. Nemis va rus ilmiy adabiyotlarida "benzol" nomi, ingliz va frantsuz tillarida esa "benzol" nomi yaratilgan ( bensen, toluol, ksilen).
Bir qarashda, benzolning tuzilishini aniqlash unchalik qiyin emasdek tuyuladi. Benzol molekulasida faqat ikkita element mavjud, har oltita uglerod atomiga oltita vodorod atomi to'g'ri keladi. Bundan tashqari, jismoniy va Kimyoviy xossalari benzol juda batafsil o'rganilgan. Biroq, bu ish ko'p o'n yillar davom etdi va faqat 1931 yilda yakunlandi.
Benzolning tuzilishini tushunishdagi eng qiyin to'siqlarni nemis kimyogari Kekule yengib chiqdi. Yuqoridan zamonaviy bilim u ilgari surgan gipotezaning ahamiyatini tushunish va baholash qiyin, unga ko'ra benzol molekulasi tsiklik tuzilishga ega (1865). Biroq, aynan shu faraz, mono- va ikki o'rinbosar benzollardagi izomerlar soni bilan birgalikda olinganida, Kekule shunday fikrga olib keldi. taniqli formula. Kekulega ko'ra, benzol olti a'zoli tsiklik birikma bo'lib, uchta o'zgaruvchan qo'sh bog'lanishga ega, ya'ni. siklogeksatrien
Aynan shu struktura bitta va faqat bitta o'rnini bosuvchi benzol va ikki o'rinbosar benzollarning uchta izomeri mavjudligiga mos keladi.
Kekule tuzilishi paydo bo'lgan paytdan boshlab, tanqid boshlandi, afsuski, u to'liq loyiq edi. Bu allaqachon qayd etilgan xarakterli xususiyat aromatik birikmalar- ularning o'ziga xos aromatik xususiyati. Benzol uchun Kekule tuzilishi aromatik birikmalarning bu xususiyatini tushuntirib bera olmadi. Bir qator hollarda u izomerlarning yo'qligini ham tushuntira olmadi, benzol uchun siklogeksatrien formulasi ularning mavjudligiga imkon berdi. Shunday qilib, orto-almashtirilgan benzollar ikkita izomerga ega bo'lishi mumkin
ammo ular topilmadi. Darhol ta'kidlab o'tamizki, bu qiyinchilikni yengish uchun Kekule benzolni harakatchan, fiksatsiyalanmagan, qo'sh bog'lanishga ega bo'lgan siklogeksatrien sifatida ko'rib chiqishni taklif qildi. Tez o'zgarish natijasida I ichida II va aksincha, benzol o'zini xuddi teng miqdordan tashkil topgan struktura sifatida tutadi I Va II.
Shunday qilib, Kekule benzolining asosiy kamchiligi bu ularning molekulasida benzol halqasi bo'lgan birikmalarning aromatik xususiyatini uning asosida tushuntirib bera olmaslikdir. Agar benzol siklogeksatrien bo'lsa, ya'ni. uchta qo'sh bog' bilan birikma bo'lsa, unda quyidagilar kerak bo'ladi:
Sovuqda ham oksidlanish oson suvli eritma KMnO 4,
Xona haroratida brom qo'shing va boshqa elektrofil qo'shilish reaktsiyalariga osonlik bilan kiring,
Xona haroratida nikel ishtirokida vodorod bilan tez vodorodlangan,
Benzol bu reaksiyalarga alkenlardan farqli ravishda istamay kiradi. Ammo aromatik birikmalar uchun almashtirish reaktsiyalari juda xarakterlidir. Bundan kelib chiqadiki, benzol siklogeksatrien bo'la olmaydi va Kekule formulasi benzolning haqiqiy tuzilishini aks ettirmaydi. Kekule benzolining asosiy kamchiligi - unda qo'sh bog'larning mavjudligi. Agar ular mavjud bo'lmasa, benzol alkenlarga xos xususiyatlarni ko'rsatishini kutish mumkin emas. Shu munosabat bilan, nima uchun Kekule formulasini "yaxshilash" bo'yicha barcha keyingi urinishlar benzolning tsiklik tuzilishini saqlab qolgan holda, uni qo'sh aloqalardan mahrum qilish shaklida bo'lganligi aniq bo'ladi. Bu formulalar III – VII Klaus (1867), Dyuar (1867), Armstrong-Bayer (1887), Tiele (1899) va Ladenburg (1869) tomonidan taklif qilingan.
Ushbu formulalarning hech biri benzolga xos bo'lgan barcha xususiyatlarni tushuntirib bera olmaydi. Bu faqat kvant kimyosining rivojlanishi bilan mumkin bo'ldi.
Ga binoan zamonaviy g'oyalar benzolning tuzilishi haqida, uning molekulasi tekis muntazam olti burchakli, uning tepalarida uglerod atomlari joylashgan sp 2 - gibrid holat. Oltita uglerod atomining har biri uchta trigonal gibrid orbital tufayli ikkitadan hosil bo'ladi σ -qo'shni uglerodlar bilan va boshqa vodorod bilan bog'lanadi. Bu bog'larning barchasi bir tekisda bir-biriga 120 0 burchak ostida joylashgan. Gibridlanishda uchtadan ikkitasigina ishtirok etadi R-uglerod atomlarining elektronlari. Shuning uchun, ta'limdan keyin σ -benzol halqasining oltita uglerodining har biridagi bog'lanishlar hali ham bittadan ko'p R-elektron. Ko'p o'nlab yillar davom etgan benzolning tuzilishini yaratish tarixidan ma'lumki, bu g'oya qanchalik qiyin bo'lgan. R-elektronlar faqat hosil bo'lish bilan juft bo'libgina qolmay, bir-biri bilan ustma-ust tushishga qodir π - ulanishlar. Ba'zi sharoitlarda Mumkin bulut qoplami R- o'ngdagi qo'shnisi ham, chapdagi qo'shnisi ham bo'lgan elektronlar
Agar molekula tsiklik tuzilishga ega bo'lsa, uglerodlar orasidagi masofalar bir xil va o'qlar bo'lsa, bu mumkin bo'ladi. R-elektronlar bir-biriga parallel. Agar molekula tekis tuzilishga ega bo'lsa, oxirgi shart bajariladi.
Benzol molekulasining bunday qurilishi bilan uglerod atomlari bir-biriga na bitta, na qo'sh bog'lar bilan bog'langan. Ushbu ulanishlar, ehtimol, "bir yarim" deb tasniflanishi kerak. Shuni aytib o'tish joizki, kristalli benzolning rentgen nurlari difraksion tahlili natijalariga ko'ra, benzoldagi barcha uglerod-uglerod bog'lari bir xil uzunlikdagi 0,14 nm ga ega, bu bitta (0,154 nm) va qo'sh (0,134 nm) bog'lar orasidagi oraliq hisoblanadi. .
Shunday qilib, zamonaviy g'oyalarga ko'ra Benzolda uglerodlar orasidagi odatiy qo'sh aloqalar mavjud emas. Binobarin, bunday birikma qo'sh bog'lanishlar tufayli xossalarni ko'rsatishini kutmaslik kerak. Shu bilan birga, benzol molekulasining sezilarli to'yinmaganligini inkor etib bo'lmaydi. Oltita uglerodli sikloalkan (sikloheksan) 12 ta vodorod atomini o'z ichiga oladi, benzolda esa bor-yo'g'i 6 ta. Bundan kelib chiqadiki, rasmiy ravishda benzol uchta qo'sh aloqaga ega bo'lishi va qo'shimcha reaktsiyalarda siklotrien kabi harakat qilishi mumkin. Haqiqatan ham, qo'shilish reaktsiyalari sharoitida benzol vodorod, galogen yoki ozonning uchta molekulasini qo'shadi.
Hozirgi vaqtda ilmiy va texnik adabiyotlarda ikkitadan foydalaniladi grafik tasvirlar benzol
Ulardan biri benzolning to'yinmaganligini, ikkinchisi esa uning aromatikligini ta'kidlaydi.
Benzolning tuzilishini uning bilan qanday bog'lashimiz mumkin xarakterli xususiyatlar, asosan uning aromatik xususiyati bilan? Nima uchun benzol noyob termodinamik barqarorlikni namoyon etadi?
Bir vaqtlar alkenlar juda oson vodorod molekulasini qo'shib, alkanlarga aylanishi ko'rsatilgan. Bu reaksiya har bir qoʻsh bogʻlanish uchun taxminan 125,61 kJ boʻlgan issiqlik chiqishi bilan davom etadi va gidrogenlanish issiqligi deb ataladi. Benzolning termodinamik barqarorligini baholash uchun gidrogenlanish issiqligidan foydalanishga harakat qilaylik.
Haqiqiy hayot siklogeksen, siklogeksadien va benzol siklogeksanga gidrogenlanadi.
Siklogeksenning gidrogenlanish issiqligi 119,75 kJ ni tashkil qildi. Keyin sikloheksadien uchun kutilgan qiymat 119,75 x 2 = 239,50 kJ (aslida 231,96 kJ) bo'lishi kerak. Agar benzolda uchta qoʻsh bogʻ (Kekule siklogeksatrien) boʻlsa, uning gidrogenlanish issiqligi 119,75 x 3 = 359,25 kJ boʻlishi kerak edi. Ikkinchi holatda eksperimental qiymat kutilganidan keskin farq qiladi. Benzolni gidrogenlash jarayonida faqat 208,51 kJ issiqlik chiqariladi, bu kutilgan qiymatdan 359,25 - 208,51 = 150,73 kJ ga kam. Bu energiya deyiladi rezonans energiyasi. Agar benzolning gidrogenatsiyasi kutilgan qiymatdan 150,73 kJ kamroq energiya ajratsa, bu faqat benzolning o'zida gipotetik siklogeksatrienga qaraganda 150,73 kJ kamroq energiya borligini anglatadi. Bundan kelib chiqadiki, benzol siklogeksatrien tuzilishiga ega bo'la olmaydi. Benzol molekulasining rezonans energiyasidagi barqarorligi unda izolyatsiyalangan qo'sh bog'larning yo'qligi va seksetning bitta elektron bulutining mavjudligi natijasidir. R-elektronlar.
Tuzilishining afzalliklari tufayli yuqori termodinamik barqarorlikka ega bo'lgan benzol kimyoviy reaktsiyalar paytida bu barqarorlikni saqlab qolish uchun har tomonlama harakat qiladi. Buni faqatgina amalga oshirish mumkinligi aniq kimyoviy reaksiya benzol halqasi o'zgarmagan. Bu imkoniyat faqat almashtirish reaktsiyalari bilan ta'minlanadi va shuning uchun qo'shilish reaktsiyalariga qaraganda aromatik birikmalar uchun almashtirish reaktsiyalari ko'proq xosdir. Elektrofil qo'shilish reaktsiyalari paytida aromatik birikma aromatik bo'lishni to'xtatadi va bu barqarorlikni aniq belgilaydigan rezonans energiyasi bilan birga ajoyib barqarorlikni yo'qotadi. Shu sababli, aromatik birikmalar, masalan, alkenlarga qaraganda, qo'shilish reaktsiyalarini ancha qiyinlashtiradi. Aromatik birikmalar ishtirokidagi qo'shilish reaksiyalarining yana bir xususiyati ularning murosasizligidir. Ular qo'shilish reaktsiyalariga kirmaydi yoki bir vaqtning o'zida hamma narsani qo'shadi. Buni benzoldan qisman gidrogenlash yoki xlorlash mahsulotlarini olish mumkin emasligi dalolat beradi. Agar bu reaktsiyalar allaqachon sodir bo'lsa, ular to'liq gidrogenlash yoki xlorlash mahsulotlari darhol olinadigan tarzda boradi.
Voqealarning bunday rivojlanishi oltidan iborat bitta elektron buluti bilan bog'liq R-benzoldagi elektronlar yoki uning oraliq variantlari chiqarib tashlanadi;
Elektron va fazoviy
benzol tuzilishi
10-sinf (professional daraja)
Maqsad. Aromatik bog'lanishlar, elektron tuzilish xususiyatlari va natijada benzolning kimyoviy xossalari haqida tushuncha hosil qiling.
Vazifalar. Aromatik uglevodorodlarning eng muhim vakili sifatida benzolning tuzilishini har tomonlama ko'rib chiqish; aromatiklik xususiyatini aniqlang.
Dars turi. Muammoli ma'ruza.
Talabalarning yanada muvaffaqiyatli o'rganish uchun motivatsiyasini oshirish uchun yangi mavzu, siz o'quvchilarning ismlari bilan kartalarni oldindan tayyorlashingiz, ularni aralashtirishingiz va dars oxirida hozir bo'lgan bir nechta maktab o'quvchilari savollar berishini e'lon qilishingiz mumkin, ammo bolalar keyinroq kimligini bilib olishadi.
SINFNING OLISHI
O'qituvchi. Sizningcha, "aromatik uglevodorodlar" nomi qayerdan kelgan?
Tabiiy ob'ektlardan ajratilgan aromatik uglevodorodlar (arenlar) sinfining birinchi vakillari o'ziga xos yoqimli hidga ega bo'lib, "aromatik" deb atalgan. Biroq, bugungi kunda "aromatik uglevodorod" tushunchasi butunlay boshqacha ma'noga ega.
Darsni kimyoviy xossalarni hisobga olish, olingan natijalarni taqqoslash va tahlil qilish va ularni umumlashtirishdan boshlash maqsadga muvofiqdir.
Ko'rgazmali eksperimentlar
1) Benzolga namlangan qog'ozning yonishi: benzol molekulasining mumkin bo'lgan to'yinmaganligini ko'rsatadi, chunki olov asetilen alangasi kabi tutunli.
2) Benzolga bromli suv va kaliy permanganat eritmasini qo`shish: benzol molekulasining to`yinmaganligini tasdiqlamaydi.
Shunga asoslanib, talabalar benzolning kimyoviy xossalarining o'ziga xosligi, shuning uchun molekulasining tuzilishi haqida xulosaga kelishadi.
Talabalar uchun savollar
1) Benzolning kimyoviy xossalarini aytib bering.
2) Moddaning xossalarini nima aniqlaydi?
3) Tutunli alanga nimani ko'rsatadi?
4) Kaliy permanganat va bromli suv bilan reaksiyaning etishmasligi nimani ko'rsatadi?
O'qituvchi benzolning yalpi formulasini (C 6 H 6) yozadi va chiziqli va tsiklik tuzilishning strukturaviy formulalarining mumkin bo'lgan variantlarini tuzishni taklif qiladi.
Tarixiy ma'lumotnoma
Uni talabalardan biri oldindan tayyorlab berishi yoki bir necha talaba tomonidan taqdimot shaklida tayyorlanishi mumkin.
1825 yilda M. Faraday uglevodorodni yorituvchi gazdan ajratib olib, uning tarkibi va xossalarini o‘rgandi. 1835-yilda E.Mitsherlix benzoy kislotani so‘nmagan ohak bilan qizdirib uglevodorodni oldi, u Faraday olgan modda bilan bir xil bo‘lib chiqdi. Mitscherlix uning formulasini o'rnatdi - C 6 H 6, Liebig keyinchalik uni benzol deb atadi.
Bir yarim asrdan ko'proq vaqt davomida ushbu uglevodorodga alohida e'tibor uning o'ziga xos xususiyatlari bilan izohlanadi.
Benzolning bunday xossalarini tushuntirishga birinchi urinish 1865 yilda A. Kekule tomonidan qilingan (1-rasm).
Kekule formulasi bilan bir qatorda boshqa benzol formulalari ham taklif qilingan (2-rasm).
O'qituvchi benzolning uchta vodorod molekulasi bilan siklogeksanni hosil qilish uchun o'zaro ta'siri va atsetilenni 500 ° C gacha qizdirilgan temir talaşlari orqali o'tkazish orqali benzol ishlab chiqarish haqida gapiradi, benzolning tuzilish formulasi o'zgaruvchan ikki va bitta olti burchakli olti burchakka mos kelishi kerakligini ta'kidlaydi. obligatsiyalar.
Tenglamalar doskaga yoziladi:
C 6 H 6 + 3 H 2 -> C 6 H 12,
3C 2 H 2 -> C 6 H 6.
Keyinchalik, o'qituvchi benzolning tsiklik tuzilishi to'g'risida ba'zi ma'lumotlarni taqdim etib, quyidagi fikrlarga e'tibor qaratadi: barcha atomlarning bir tekislikda joylashishi va qo'shni uglerod atomlarining yadrolari orasidagi bir xil masofa. Rentgen nurlari diffraktsiya usulining kashf etilishi tufayli benzol molekulasining tuzilishini tushuntirish mumkin bo'ldi: qachon sp 2-birdan gibridlanish s-orbitallar va ikkita p-orbitallar, uchta gibrid orbital hosil bo'ladi va bitta gibrid bo'lmagani qoladi R-orbital.
Gibrid orbitallar uchta bog'lanish hosil qiladi, gibrid bo'lmagan orbitallar esa tekislikka perpendikulyar joylashadi va bitta bog'lanish hosil qiladi. - elektron bulut.
Benzolning elektron tuzilishi kontseptsiyasi diskdagi jadvallar va modellar bilan qo'llab-quvvatlanadi " Elektron darslik. Ochiq kimyo 2,5"; diskdan hajmli modellar “O'quv elektron nashri. Virtual laboratoriya. Kimyo. 8–11-sinflar”.
O'qituvchi. O'ylab ko'raylik, agar molekulada -bog' bo'lsa, unda nega alkenlarga xos bo'lgan reaksiyalar (brom qo'shilishi va kaliy permanganat bilan oksidlanish) sodir bo'lmaydi?
JAVOB Oltita kombinatsiyasi-yagona -elektron sistemali bog`lar aromatik bog`lar deyiladi. Elektron zichligi teng taqsimlangan. Shuning uchun benzol molekulasida na bitta, na qo'sh bog'lar mavjud. Benzoldagi uglerod atomlari orasidagi barcha aloqalar ekvivalentdir, bu benzolga xos xususiyatlarni aniqlaydi. Oltita bilan bog'langan oltita uglerod atomining aylanishi-bog'lar va bitta elektron buluti benzol halqasi yoki benzol yadrosi deb ataladi.
Jismoniy usullar Tadqiqotlar quyidagilarni ko'rsatdi (jadvalga qarang).
Jadval
Benzol molekulasining tuzilishi
Eslatib o'taman, uglerod atomlarining sp 2 gibridlanishiga 120 ° bog'lanish burchagi mos keladi.
Shunday qilib, benzol molekulasining tuzilishini o'rganishni umumlashtiramiz.
Bu erda siz familiyalar bilan tayyorlangan kartalardan foydalanishingiz mumkin yoki siz manzil bo'yicha savol berishga harakat qilishingiz mumkin. Manzil oldindan tayyorlangan kartalarga yoziladi, masalan: "1-ko'cha, 3-uy, 1-kvartira", bu erda ko'cha - qator raqami, uy - stol raqami, kvartira - variant. Kartochka chiqariladi, bu manzilda "yashovchi" talaba aniqlanadi va savol beriladi, keyin keyingi karta chiqariladi.
Namuna savollar
1) Benzol molekulasining formulasi qanday?
2) Bu molekula tarkibidagi uglerod atomlari qanday gibridlanishga ega?
3) Aromatiklik nima?
4) Molekulaning tuzilishi moddaning xossalariga qanday ta'sir qiladi?
5) Benzol birinchi marta qaysi yilda va kim tomonidan olindi?
Aromatik uglevodorodlar organik birikmalarning siklik qatorining muhim qismini tashkil qiladi. Bunday uglevodorodlarning eng oddiy vakili benzoldir. Ushbu moddaning formulasi nafaqat uni boshqa bir qator uglevodorodlardan ajratib turdi, balki organik kimyoning yangi yo'nalishining rivojlanishiga turtki bo'ldi.
Aromatik uglevodorodlarning kashf etilishi
Aromatik uglevodorodlar 19-asr boshlarida topilgan. O'sha kunlarda ko'chalarni yoritish uchun eng keng tarqalgan yoqilg'i chiroq gazi edi. Uning kondensatidan buyuk ingliz fizigi Maykl Faraday 1825 yilda uch gramm yog'li moddani ajratib oldi, uning xususiyatlarini batafsil tavsiflab berdi va uni: karbüratlı vodorod deb nomladi. 1834 yilda nemis olimi, kimyogari Mitscherlix benzoy kislotani ohak bilan qizdirib, benzol oldi. Ushbu reaksiya formulasi quyida keltirilgan:
C6 H5 COOH + C6 H6 + CaCO3 ning CaO sintezi.
O'sha paytda noyob benzoy kislotasi ba'zi tropik o'simliklar tomonidan ajratilishi mumkin bo'lgan benzoy kislotasi qatronidan olingan. 1845 yilda ko'mir smolasida yangi birikma topildi, u sanoat miqyosida yangi moddani ishlab chiqarish uchun to'liq foydalanish mumkin bo'lgan xom ashyo edi. Benzolning yana bir manbai ayrim konlardan olinadigan neftdir. Sanoat korxonalarining benzolga bo'lgan ehtiyojini qondirish uchun neftning asiklik uglevodorodlarining ma'lum guruhlarini aromatizatsiya qilish yo'li bilan ham olinadi.
Ismning zamonaviy versiyasini nemis olimi Liebig taklif qilgan. "Benzol" so'zining ildizini topish kerak arab tillari- u erda "tuatqi" deb tarjima qilingan.
Benzolning fizik xossalari
Benzol o'ziga xos hidli rangsiz suyuqlikdir. Bu modda 80,1 o S haroratda qaynaydi, 5,5 o S da qattiqlashadi va oq kristall kukunga aylanadi. Benzol amalda issiqlik va elektr tokini o'tkazmaydi, suvda yomon eriydi va turli yog'larda yaxshi eriydi. Benzolning aromatik xossalari uning tuzilishining mohiyatini aks ettiradi ichki tuzilishi: nisbatan barqaror benzol halqasi va noaniq tarkibi.
Benzolning kimyoviy tasnifi
Benzol va uning gomologlari - toluol va etilbenzol - tsiklik uglevodorodlarning aromatik qatoridir. Ushbu moddalarning har birining tuzilishi benzol halqasi deb ataladigan umumiy tuzilishni o'z ichiga oladi. Yuqoridagi moddalarning har birining tuzilishi oltita uglerod atomi tomonidan yaratilgan maxsus tsiklik guruhni o'z ichiga oladi. U benzol aromatik halqasi deb ataladi.
Kashfiyot tarixi
Benzolning ichki tuzilishini yaratish bir necha o'n yillar davom etdi. Strukturaning asosiy tamoyillari (halqa modeli) 1865 yilda kimyogar A. Kekule tomonidan taklif qilingan. Afsonada aytilganidek, nemis olimi bu elementning formulasini tushida ko'rgan. Keyinchalik benzol deb ataladigan moddaning tuzilishining soddalashtirilgan imlosi taklif qilindi. Ushbu moddaning formulasi olti burchakli. Olti burchak burchaklarida joylashgan bo'lishi kerak bo'lgan uglerod va vodorod uchun belgilar olib tashlandi. Bu yon tomonlarida o'zgaruvchan bitta va qo'sh chiziqlar bilan oddiy oddiy olti burchak hosil qiladi. Benzolning umumiy formulasi quyidagi rasmda ko'rsatilgan.

Aromatik uglevodorodlar va benzol
Ushbu elementning kimyoviy formulasi, qo'shilish reaktsiyalari benzolga xos emasligini ko'rsatadi. Uning uchun, aromatik qatorning boshqa elementlarida bo'lgani kabi, benzol halqasida vodorod atomlarini almashtirish reaktsiyalari xosdir.
Sulfonlanish reaktsiyasi
Konsentrlangan sulfat kislota va benzolning o'zaro ta'sirini ta'minlash, reaktsiya haroratini oshirish orqali benzosulfon kislotasi va suv olish mumkin. Strukturaviy formula bu reaksiyada benzol quyidagicha bo'ladi:

Galogenlanish reaktsiyasi
Brom yoki xrom katalizator ishtirokida benzol bilan reaksiyaga kirishadi. Bu halogen hosilalarini hosil qiladi. Lekin nitrlanish reaksiyasi konsentrlangan nitrat kislota yordamida amalga oshiriladi. Reaksiyaning yakuniy natijasi azotli birikma:

Nitratsiya yordamida taniqli portlovchi modda ishlab chiqariladi - TNT yoki trinitotoluol. Tol benzolga asoslanganligini kam odam biladi. Ko'pgina boshqa benzol halqasi asosidagi nitro birikmalari ham portlovchi moddalar sifatida ishlatilishi mumkin
Benzolning elektron formulasi
Benzol halqasining standart formulasi benzolning ichki tuzilishini aniq aks ettirmaydi. Unga ko'ra, benzol uchta lokalizatsiyalangan p-bog'larga ega bo'lishi kerak, ularning har biri ikkita uglerod atomi bilan o'zaro ta'sir qilishi kerak. Ammo, tajriba shuni ko'rsatadiki, benzolda oddiy qo'sh bog'lar mavjud emas. Molekulyar formula benzol benzol halqasidagi barcha bog'lanishlar ekvivalent ekanligini ko'rish imkonini beradi. Ularning har birining uzunligi taxminan 0,140 nm ni tashkil qiladi, bu standart bitta bog'lanish uzunligi (0,154 nm) va etilen qo'sh bog'i (0,134 nm) o'rtasida oraliqdir. O'zgaruvchan bog'lar bilan tasvirlangan benzolning strukturaviy formulasi nomukammaldir. Benzolning yanada ishonchli uch o'lchamli modeli quyidagi rasmga o'xshaydi.

Benzol halqasi atomlarining har biri sp 2 gibridlanish holatidadir. U uchta valentlik elektronni sigma bog'larini hosil qilish uchun sarflaydi. Bu elektronlar ikkita qo'shni uglevod atomi va bitta vodorod atomini qamrab oladi. Shu bilan birga, ikkala elektron va S-S ulanishlari, H-H bir xil tekislikda.
To'rtinchi valentlik elektron benzol halqasining tekisligiga perpendikulyar joylashgan uch o'lchamli sakkizlik shaklidagi bulutni hosil qiladi. Har bir bunday elektron buluti benzol halqasi tekisligidan yuqorida va to'g'ridan-to'g'ri uning ostida ikkita qo'shni uglerod atomlari bulutlari bilan ustma-ust tushadi.
Ushbu moddaning n-elektron bulutlarining zichligi barcha uglerod bog'lari o'rtasida teng taqsimlangan. Shunday qilib, bitta halqali elektron bulut hosil bo'ladi. IN umumiy kimyo Ushbu tuzilish aromatik elektron seksteti deb ataladi.
Benzolning ichki bog'lanishlarining ekvivalentligi
Bu oltiburchakning barcha yuzlarining ekvivalentligi aromatik bog'lanishlarning tenglashishini tushuntiradi, ular xarakterli kimyoviy va jismoniy xususiyatlar, qaysi benzol bor. n-elektron bulutining bir xil taqsimlanishi formulasi va uning barcha ekvivalentligi ichki ulanishlar quyida ko'rsatilgan.

Ko'rib turganingizdek, bitta va qo'sh chiziqlar o'rniga ichki tuzilish doira shaklida tasvirlangan.
Benzolning ichki strukturasining mohiyati tsiklik uglevodorodlarning ichki tuzilishini tushunish uchun kalit beradi va bu moddalarni amaliy qo'llash imkoniyatlarini kengaytiradi.