












 Orqaga Oldinga
Orqaga Oldinga
Diqqat! Slaydni oldindan ko'rish faqat ma'lumot uchun mo'ljallangan va taqdimotning barcha xususiyatlarini aks ettirmasligi mumkin. Agar siz ushbu ish bilan qiziqsangiz, to'liq versiyasini yuklab oling.
O’quvchilarni kimyodan hisoblash masalalarini yechishga o’rgatishda o’qituvchilar bir qancha muammolarga duch kelishadi
- masalani yechishda o‘quvchilar muammolarning mohiyatini va ularni yechish jarayonini tushunmaydilar;
- topshiriqning mazmunini tahlil qilmaslik;
- harakatlar ketma-ketligini aniqlamang;
- kimyoviy tilni noto'g'ri ishlatish matematik operatsiyalar va belgilash jismoniy miqdorlar va boshqalar;
Bu kamchiliklarni bartaraf etish o`qituvchining hisoblash masalalarini yechishga o`rgatish bilan shug`ullanayotganda o`z oldiga qo`yadigan asosiy maqsadlaridan biridir.
O'qituvchining vazifasi talabalarni muayyan muammoni hal qilish uchun mantiqiy diagramma tuzish orqali muammolarning shartlarini tahlil qilishga o'rgatishdir. Muammoning mantiqiy diagrammasini tuzish o'quvchilarning ko'plab xatolarining oldini oladi.
Dars maqsadlari:
- muammoli vaziyatlarni tahlil qilish qobiliyatini rivojlantirish;
- hisoblash muammosining turini va uni yechish tartibini aniqlash qobiliyatini rivojlantirish;
- kognitiv, intellektual va ijodiy qobiliyatlarni rivojlantirish.
Dars maqsadlari:
- yechish usullarini egallaydi kimyoviy muammolar“Nazariydan olingan reaksiya mahsulotining massa ulushi” tushunchasidan foydalanish;
- hisoblash masalalarini yechish malakalarini shakllantirish;
- ishlab chiqarish jarayonlari bilan bog'liq materiallarni o'zlashtirishga yordam berish;
- rag'batlantirish chuqur o'rganish nazariy masalalar, ijodiy muammolarni hal qilishga qiziqish.
Darsning borishi
Vaziyatning sababi va mohiyatini aniqlaymiz, ular "nazariydan mahsulot rentabelligi bo'yicha" vazifalarda tasvirlangan.
Haqiqiy kimyoviy reaktsiyalarda mahsulot massasi har doim hisoblanganidan kamroq bo'ladi. Nega?
- Ko'pchilik kimyoviy reaksiyalar teskari bo'lib, oxiriga etib bormaydi.
- O'zaro aloqada bo'lganda organik moddalar Qo'shimcha mahsulotlar ko'pincha hosil bo'ladi.
- Geterogen reaksiyalarda moddalar yaxshi aralashmaydi, ba'zi moddalar esa oddiygina reaksiyaga kirishmaydi.
- Qism gazsimon moddalar bug'lanishi mumkin.
- Cho'kma paydo bo'lganda, moddaning bir qismi eritmada qolishi mumkin.
Xulosa:
- nazariy massa har doim amaliy massadan katta;
- Nazariy hajm har doim amaliy hajmdan kattaroqdir.
Nazariy rentabellik 100%, amaliy hosil har doim 100% dan kam.
Reaksiya tenglamasidan hisoblangan mahsulot miqdori nazariy hosil bo'lib, 100% ga to'g'ri keladi.
Reaksiya mahsulotining ulushi (- “etta”) - bu hosil bo'lgan moddaning massasining reaktsiya tenglamasidan foydalangan holda hisob-kitobga muvofiq olinishi kerak bo'lgan massaga nisbati.
"Mahsulot ishlab chiqarish" tushunchasi bilan bog'liq muammolarning uch turi:
1. Massalar beriladi boshlang'ich material Va reaktsiya mahsuloti. Mahsulot rentabelligini aniqlang.
2. Berilgan massalar boshlang'ich material va chiqish reaktsiya mahsuloti. Mahsulotning massasini aniqlang.
3. Berilgan massalar mahsulot va chiqish mahsulot. Boshlang'ich moddaning massasini aniqlang.
Vazifalar.
1. 21,3 g xlor bo'lgan idishda temir yondirilganda 24,3 g temir (III) xlorid olindi. Reaksiya mahsulotining unumini hisoblang.
2. Vodorod qizdirilganda 16 g oltingugurtdan o'tkazildi. Reaksiya mahsulotining unumi nazariy jihatdan mumkin bo'lgan 85% bo'lsa, hosil bo'lgan vodorod sulfidining hajmini (no) aniqlang.
3. Temir oksidi (III) ni kamaytirish uchun qanday hajmdagi uglerod oksidi (II) olindi, agar nazariy jihatdan mumkin bo'lgan 80% hosil bilan 11,2 g temir olingan bo'lsa.
Vazifani tahlil qilish.
Har bir muammo ma'lumotlar to'plamidan (ma'lum moddalar) - muammoning shartlaridan ("hosildorlik" va boshqalar) va savoldan (parametrlari topilishi kerak bo'lgan moddalar) iborat. Bundan tashqari, u siz izlayotgan narsalarni ma'lumotlar va ma'lumotlarni bir-biri bilan bog'laydigan bog'liqliklar tizimiga ega.
Tahlil vazifalari:
1) barcha ma'lumotlarni aniqlash;
2) ma'lumotlar va shartlar o'rtasidagi bog'liqlikni aniqlash;
3) berilgan va qidirilayotgan o'rtasidagi bog'liqlikni aniqlash.
Shunday qilib, keling, bilib olaylik:
1. Biz qanday moddalar haqida gapiramiz?
2. Moddalarda qanday o'zgarishlar yuz berdi?
3. Masala gapida qanday miqdorlar nomlanadi?
4. Muammo bayonida qanday ma'lumotlar - amaliy yoki nazariy - eslatib o'tilgan?
5. Reaksiya tenglamalari yordamida hisob-kitoblar uchun qaysi ma'lumotlardan to'g'ridan-to'g'ri foydalanish mumkin va qaysilari chiqishning massa ulushi yordamida aylantirilishi kerak?
Uch turdagi muammolarni hal qilish algoritmlari:
Mahsulot rentabelligini nazariy jihatdan mumkin bo'lgan foizda aniqlash.
1. Kimyoviy reaksiya tenglamasini yozing va koeffitsientlarni tartibga soling.
2. Moddalarning formulalari ostiga koeffitsientlar bo'yicha moddaning miqdorini yozing.
3. Amalda olingan massa ma'lum.
4. Nazariy massani aniqlang.
5. Reaksiya mahsulotining unumini (%) aniqlang, amaliy massani nazariyga havola qiling va 100% ga ko'paytiring.
6. Javobni yozing.
Agar mahsulot unumi ma'lum bo'lsa, reaksiya mahsulotining massasini hisoblash.
1. “Bergan” va “topish”ni yozing, tenglamani yozing, koeffitsientlarni tartibga soling.
2. Boshlovchi moddalar uchun moddaning nazariy miqdorini toping. n=
3. Koeffitsientlarga ko'ra reaksiya mahsuloti moddaning nazariy miqdorini toping.
4. Reaksiya mahsulotining nazariy massasini yoki hajmini hisoblang.
m = M * n yoki V = V m * n
5. Reaksiya mahsulotining amaliy massasini yoki hajmini hisoblang (nazariy massa yoki nazariy hajmni hosilning ulushiga ko'paytiring).
Reaksiya mahsulotining massasi va mahsulot unumi ma'lum bo'lsa, boshlang'ich moddaning massasini hisoblash.
1. Ma'lum amaliy hajm yoki massa berilgan, nazariy hajm yoki massani toping (mahsulotning rentabellik ulushidan foydalanib).
2. Mahsulot uchun moddaning nazariy miqdorini toping.
3. Koeffitsientlar bo'yicha boshlang'ich moddaning nazariy miqdorini toping.
4. Moddaning nazariy miqdoridan foydalanib, reaksiyadagi boshlang‘ich moddalarning massasi yoki hajmini toping.
Uy vazifasi.
Muammolarni hal qilish:
1. Oltingugurt (IV) oksidni oksidlash uchun 112 l (n.s.) kislorod oldik va 760 g oltingugurt (VI) oksidi oldik. Nazariy jihatdan mumkin bo'lgan foiz sifatida mahsulot rentabelligi qancha?
2. Azot va vodorodning oʻzaro taʼsiri natijasida 35% ga teng 95 g ammiak NH 3 hosil boʻldi. Reaksiya uchun azot va vodorodning qancha hajmlari olindi?
3. Ortiqcha uglerod bilan 64,8 g rux oksidi qaytarildi. Reaksiya mahsulotining unumi 65% bo'lsa, hosil bo'lgan metallning massasini aniqlang.
Ko'pgina kimyoviy reaktsiyalar faqat yorug'lik nurlanishi ta'sirida sodir bo'ladi. Bunday reaktsiyalarni qo'zg'atish uchun odatda ko'rinadigan yoki ultrabinafsha nurlanishdan foydalaniladi (to'lqin uzunligi l = 200 - 700 nm). Bir kvant yorug'lik energiyasi to'lqin uzunligi bilan quyidagicha bog'liq:
bu erda n - nurlanish chastotasi, h= 6,626. 10 -34 J. s - Plank doimiysi, c= 3. 10 8 m/s - yorug'lik tezligi. Bir mol yorug'lik kvantlari ba'zan deyiladi Eynshteyn.
Nur so'rilsa, u paydo bo'ladi asosiy reaktsiya(fotokimyoviy faollashuv) va molekula hayajonlangan elektron holatga o'tadi:
A+ h A*.
Hayajonlangan molekula keyingi o'zgarishlarni boshdan kechirishi mumkin ( ikkilamchi reaktsiyalar):
1) floresans, ya'ni. yorug'likning tez tarqalishi va asl elektron holatiga o'tish:
A*A+ h f.
Chiqarilgan yorug'likning chastotasi birlamchi jarayonda so'rilgan yorug'lik chastotasidan kamroq yoki unga teng: f .
2) Fosforessensiya- radiatsiyaviy bo'lmagan jarayonlar tufayli molekulaning boshqa qo'zg'aluvchan holatga o'tishi uchun zarur bo'lgan ma'lum vaqt kechikishi bilan yorug'lik chiqishi.
3) Deaktivatsiya ta'sirida:
4) Dissotsiatsiya:
5) Boshqa molekulalar bilan reaksiya:
Kvant rentabelligi fotokimyoviy reaksiya reaksiyaga kirishgan molekulalar sonining yutilgan fotonlar soniga nisbatiga teng. tomonidan ekvivalentlik qonuni Eynshteyn-Stark, har bir so'rilgan foton bitta molekulaning fotokimyoviy qo'zg'alishiga olib keladi. Demak, nazariy jihatdan birlamchi kvant rentabelligi har doim 1 ga teng.
Eksperimental kvant rentabelligi qiymatlari ikkilamchi jarayonlar (10-3) tufayli 1 dan sezilarli darajada og'ishi mumkin.< < 10 6). Высокие значения квантового выхода ( >1) zanjir reaktsiyasining paydo bo'lishini ko'rsating. Kam qiymatlar (< 1) характерны для реакций, включающих процессы релаксации, т.е. потери энергии возбуждения.
Fotokimyoviy reaksiyalarning kinetikasi massalar ta'siri qonunini ifodalovchi oddiy differensial tenglamalar bilan tavsiflanadi. Termik qo'zg'alish bilan an'anaviy reaktsiyalardan yagona farq shundaki, fotokimyoviy jarayonlarning tezligi boshlang'ich moddaning konsentratsiyasiga bog'liq emas, lekin fotokimyoviy ekvivalentlik qonuniga muvofiq, faqat so'rilgan yorug'lik intensivligi bilan belgilanadi.
8-1-misol. To'lqin uzunligi 436 nm bo'lgan yorug'lik CCl 4 dagi brom va sinnamik kislota eritmasidan 900 s davomida o'tdi. So'rilgan energiyaning o'rtacha miqdori 1,919 ni tashkil qiladi. 10 -3 J/s. Fotokimyoviy reaksiya natijasida brom miqdori 3,83 ga kamaydi. 10 19 molekula. Kvant rentabelligi qanday? Kvant rentabelligini tushuntiruvchi reaksiya mexanizmini taklif qiling.
Yechim. Reaktsiya natijasida 1,919 so'riladi. 10 -3. 900 = 1,73 J yorug'lik energiyasi. Bir mol kvantning energiyasi E=N A hc /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni(n hn
= /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni) = 1,73 / 2,74. 10 5 = 6,29. 10 -6. Reaksiyaning kvant rentabelligi /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni(n) = (3,83 . 10 19 /6.02 . 10 23) / 6.29 . 10 -6 = 10.
(Br 2) /
Ushbu kvant rentabellik qiymati zanjir reaktsiyasi uchun xos bo'lib, uning mexanizmi quyidagicha bo'lishi mumkin: n Br2+
Br + Br (zanjir yadrosi),
Br + C 6 H 5 CH=CHCOOH C 6 H 5 CHBr- CHCOOH
C 6 H 5 CHBr- CHCOOH + Br 2 C 6 H 5 CHBr- CHBrCOOH + Br
Br + Br Br 2 (zanjir uzilishi).
8-2-misol. M moddasi ishtirokida Cr (CO) 6 ning fotolizi quyidagi mexanizm bo'yicha davom etishi mumkin: n Cr(CO)6+ Cr(CO)5 + CO,
I Cr(CO) 5 + CO Cr(CO) 6 , 2
k Cr(CO) 5 + CO Cr(CO) 6 , 3
Cr(CO) 5 + M Cr(CO) 5 M, Cr(CO) 5 + CO Cr(CO) 6 , 4
Cr(CO) 5 M Cr(CO) 5 + M, Cr(CO)5 + CO, << Cr(CO) 5 + CO Cr(CO) 6 , So'rilgan yorug'lik intensivligi past deb faraz qilsak: f 4, omilni toping tenglamada/d = -f dt f. 1/ ning grafigi ekanligini ko'rsating.
[M] dan - to'g'ri chiziq. Yechim.
Cr(CO) 5 oraliq mahsulotiga kvazstatsionar kontsentratsiyalarning yaqinlashuvini qo'llaymiz:
Ushbu ifodadan kvazstatsionar kontsentratsiyani topish mumkin:
Reaksiya mahsuloti Cr(CO) 5 M hosil bo'lish tezligi quyidagilarga teng:
![]() ,
,
Kvazistatsionar kontsentratsiyani almashtirib, biz quyidagilarni topamiz: f omil qayerda
![]() .
.
O'zaro 1/ f[M] ga chiziqli bog'liq:
![]() .
.
8-1. Fotokimyoviy reaksiyaning aktivlanish energiyasi 30 kkal/mol. Ushbu reaktsiyani boshlash uchun yorug'likning minimal to'lqin uzunligi qancha bo'lishi kerak? Bu yorug'likning chastotasi qanday? (javob)
8-2. CH 3 I molekulasidagi C-I bog'lanish energiyasi 50 kkal/mol. Reaksiya mahsulotlarining kinetik energiyasi nimaga teng?
CH3I+ n CH3.
+I.
CH 3 I to'lqin uzunligi 253,7 nm bo'lgan UV nuriga ta'sir qilganda?
8-3. Vodorod yodidining fotolizi mexanizmi bo'yicha davom etuvchi kvant rentabelligini aniqlang: n HI+
H. +I. ,
H. + Salom H 2. + Men,
I. +I. I 2. (javob)
8-4. Fotokimyoviy reaksiyaning kvant unumini hisoblang
(CH 3) 2 CO C 2 H 6 + CO,
to'lqin uzunligi 313 nm bo'lgan UV nurlari ta'sirida davom etadi. Dastlabki ma'lumotlar: reaksiya idishining hajmi 59 ml; so'rilgan energiyaning o'rtacha miqdori 4,40 ni tashkil qiladi. 10 -3 J/s; nurlanish vaqti 7 soat; reaksiya harorati 56,7 o S; dastlabki bosim 766,3 Torr; Yakuniy bosim 783.2 Torr (javob)
8-5. Insonning to'r pardasidagi molekulalar, agar nurlanish tezligi 2,10 -16 Vt bo'lsa, optik asabga signal o'tkazishga qodir. Vizual sezgi hosil qilish uchun 1 soniya ichida retinaga tushishi kerak bo'lgan fotonlarning minimal sonini toping. Yorug'likning o'rtacha to'lqin uzunligi 550 nm ga teng bo'lishi mumkin (javob).
8-6. Yozda 1 gektar yashil maydondan uglevodlarning maksimal mumkin bo'lgan hosilini hisoblang. Dastlabki ma'lumotlar: quyosh energiyasi 1,0 kal/(sm 2. min); yoz kuni 8 soat; Nurlanishning 1/3 qismi xlorofillning yutilish mintaqasiga to'g'ri keladi (400 - 650 nm, o'rtacha to'lqin uzunligi 550 nm); kvant rentabelligi har bir foton uchun 0,12 birlik H 2 CO.(javob)
1. 8-7. Ammiak UV nurlari (to'lqin uzunligi 200 nm) ta'sirida parchalanadi, kvant rentabelligi 0,14 ga teng. 1 g ammiakni parchalash uchun qancha kaloriya yorug'lik kerak?
2. MgCO 3 (k) = MgO (k) + CO 2 (g) reaktsiyasidagi CO 2 ning muvozanat qisman bosimi 10 4 Pa ga teng bo'lgan haroratni aniqlang.
3. PtCl 4 (k) = PtCl 2 (k) + Cl 2 (g) reaktsiyasida Cl 2 ning muvozanat parsial bosimi 10 2 Pa bo'lgan haroratni aniqlang. Muvozanat doimiysi bo'lgan haroratni aniqlang K r
4. reaksiya CaCO 3 (k) = CaO (k) + CO 2 (g) 1 ga teng. CO 2 ning muvozanat parsial bosimi qanday? Muvozanat doimiysi bo'lgan haroratni aniqlang Mis sulfat CuSO 4 (k) = CuO (k) + SO 3 (g) ning termal parchalanish haroratini hisoblang, bunda muvozanat konstantasi.
5. Qaytariladigan reaksiya CO(g) + H 2 O(g) = H 2 (g) + CO 2 (g) ning barcha komponentlarining ma’lum bir haroratdagi muvozanat konsentrasiyalarini hisoblang, agar bu haroratda muvozanat konstantasi bo‘lsa. Muvozanat doimiysi bo'lgan haroratni aniqlang= 1, dastlabki aralashmada 44 g / l CO va 36 g / l H 2 O mavjud bo'lib, mahsulotlar yo'q edi. Bu reaksiyaning muvozanat konstantasi 1 bo‘lgan haroratni mos yozuvlar ma’lumotlaridan foydalanib toping.
6. CO komponentlarining boshlang'ich konsentratsiyasi (mol / l) bo'lgan gaz aralashmasida - 0,1; H 2 O - 0,5; CO 2 – 0,05; H 2 - 0,05, teskari kimyoviy reaktsiya sodir bo'ladi: CO (g) + H 2 O (g) = H 2 (g) + CO 2 (g).
7. bu reaktsiya ma'lum bir haroratda, agar muvozanat H 2 O konsentratsiyasi 0,45 mol / l bo'lganida o'rnatilgan bo'lsa. Muvozanat konstantasi K s
8. reaksiya N 2 (g) + 3H 2 (g) = 2NH 3 (g) ma'lum bir haroratda 0,5 ga teng. Muvozanat konsentrasiyalari (mol/l): H 2 – 0,1 va NH 3 – 0,05. Reaksiya boshida mahsulot yo‘q deb faraz qilgan holda azotning boshlang‘ich va muvozanat konsentrasiyalarini hisoblang. Ammiak hosildorligini oshirish shartlarini taklif qiling. Umumiy bosimning oshishi berilgan reaksiya muvozanatining siljishiga qanday ta'sir qiladi? Muvozanat konstantasi Hajmi 100 litr bo'lgan reaktorga ma'lum haroratda 30 g vodorod va 64 g azot kiritiladi. Barcha vodorodning yarmi N 2 (g) + 3H 2 (g) = 2NH 3 (g) reaktsiyasiga ko'ra reaksiyaga kirishganda muvozanat yuzaga keldi. Muvozanat konstantasini hisoblang
9. bu haroratda. Muvozanat aralashmasida normal sharoitga qarab necha litr azot qoladi?
10. N 2 (g) + 3H 2 (g) = 2NH 3 (g) reaktsiyasi bo'yicha ammiak sintezini amalga oshirish uchun 2 mol azot va 3 mol vodorod olindi. Reaktsiya 40 atm doimiy bosim va 500 K haroratda amalga oshirildi. Aralashmaning muvozanat tarkibini va ammiak unumini hisoblang.
Qaytariladigan reaksiya 2NO(g)+ muvozanat konstantasini hisoblang
11. Agar 10 litrli reaktorga 4 mol NO va 2 mol Cl 2 kiritilgan boʻlsa va muvozanat holatiga yetguncha 40% azot oksidi reaksiyaga kirishgan boʻlsa, maʼlum haroratda Cl 2 (g) = 2NOCl (g) boʻladi. Reaksiya mahsulotining unumi qanday? Agar reaksiya ekzotermik ekanligi ma'lum bo'lsa, harorat va umumiy bosimning oshishi reaksiya mahsulotining unumiga qanday ta'sir qiladi? Muvozanat konstantasi 10 litrli reaktorda doimiy haroratda 2SO 2 (g) + O 2 (g) = 2SO 3 (g) tenglamasiga ko'ra, teskari kimyoviy reaktsiya sodir bo'ladi. Muvozanat konstantasini hisoblang
12. bu reaktsiyadan, agar dastlabki aralashmada 2 mol SO 2 va 2 mol O 2 bo'lsa, mahsulot yo'q edi va tizimda muvozanat o'rnatilgunga qadar SO 2 ning dastlabki miqdorining 10% tizimda qoladi. . Reaksiya mahsulotining unumi qanday? Muvozanat konstantasi reaksiyalar 2SO 2 (g) + O 2 (g) = 2SO 3 (g). Muvozanat konsentrasiyalari (mol/l) ga teng bo'lsa, ma'lum haroratda bu reaksiyaning muvozanat konstantasini hisoblang: SO 2 – 0,02; O 2 – 0,1; SO 3 – 0,06. Reaksiya mahsuloti bo'lmasa, SO 2 va O 2 ning dastlabki konsentrasiyalari qanday bo'ladi? Haroratning oshishi va umumiy bosimning pasayishi bu reaksiya muvozanatining siljishiga qanday ta'sir qiladi?
13. 2SO 2 (g) + O 2 (g) = 2SO 3 (g) reaktsiyasi 1 atm doimiy bosim va 800 K haroratda amalga oshiriladi. Gaz aralashmasining boshlang'ich tarkibidagi muvozanat tarkibini toping: a. ) SO 2 - 2 mol, O 2 - 1 mol; b) SO 2 – 4 mol,
O 2 - 2 mol; mahsulot etishmayapti. Boshlang'ich tarkibi bu reaksiya mahsulotining unumiga qanday ta'sir qiladi?
14. H 2 (g) + I 2 (g) = 2HI (g) ma'lum bir haroratda reaktsiyaning muvozanat konstantasi 10. H 2 va I 2 ning dastlabki konsentratsiyalari 0,4 ga teng bo'lsa va HI ning muvozanat konsentratsiyasini hisoblang. Shunga ko'ra 0,5 mol / l va dastlabki daqiqada mahsulot yo'q edi.
15. Ayrim bir jinsli reaksiyaning kimyoviy muvozanati A(g)+
B(g) = 2D(g) reagentlarning quyidagi konsentrasiyalarida (mol/l) aniqlandi: Bilan A = 0,02; Bilan B = 0,08; Bilan D = 0,04. Hajmni o'zgartirmasdan muvozanat tizimiga 0,2 mol/l A moddasi qo'shildi, agar reaksiya 450 K doimiy haroratda olib borilgan bo'lsa, moddalarning yangi muvozanat konsentrasiyalarini va bu reaktsiyaning standart Gelmgolts energiyasini hisoblang. Muvozanat doimiysi bo'lgan haroratni aniqlang bu reaktsiya ma'lum haroratda?
16. A (g) + B (g) = C (g) + D (g) tizimida A va B gazlarini aralashtirishda quyidagi konsentratsiyalarda muvozanat o'rnatildi: Bilan A = 0,5 mol/l va Bilan C = 0,2 mol/l. Muvozanat konstantasi Muvozanat konstantasi 4 ga teng . 10−2. Mahsulotlar bo'lmagan taqdirda, A va B moddalarining dastlabki konsentratsiyasini toping. Reaksiya mahsulotlarining unumi qanday?
17. Dastlabki 1 L tizimi 27,5 g PCl 3 va 28,4 g Cl 2 dan iborat edi. 15,68 g xlor qolganda PCl 3 (g) + Cl 2 (g) = PCl 5 (g) muvozanat reaktsiyasi o'rnatildi. Barcha komponentlarning muvozanat konstantasi va muvozanat konsentratsiyasini hisoblang. Malumot ma'lumotlaridan foydalanib, muvozanat konstantasi topilgan qiymatga teng bo'lgan haroratni aniqlang. Umumiy bosim va haroratning o'zgarishi ushbu tizimdagi muvozanatning siljishiga qanday ta'sir qiladi?
18. Dastlabki aralashma gazsimon N 2 va H 2 dan iborat bo'lib, teng qisman bosimga ega. N 2 (g) + 3H 2 (g) = 2NH 3 (g) muvozanati o'rnatilgach, vodorod bosimi ikki baravar kamaydi. Tizimdagi umumiy bosim dastlabki bilan solishtirganda necha marta kamaydi?
19. Suyuq metanol CH 3 OH va gazsimon kislorod yopiq idishga kiritiladi. 2CH 3 OH (l) + 3O 2 (g) = 2CO 2 (g) + + 2H 2 O (l) reaktsiyasi natijasida muvozanatga erishilganda kislorodning qisman bosimi 2 marta kamaydi. Tizimdagi umumiy bosim dastlabki bilan solishtirganda necha marta o'zgargan?
20. Muvozanat konstantasini hisoblang Muvozanat doimiysi bo'lgan haroratni aniqlang reaksiya A(g) = B(g) + E(g) 500 K da, agar 400 K da u 50 ga teng bo'lsa. Bu harorat oralig'idagi reaksiyaning issiqlik effektini doimiy, -150 kJ ga teng deb hisoblash mumkin. Bu nimaga teng Muvozanat konstantasi bu haroratlarda bu reaktsiya?
21. N 2 (g) + 3H 2 (g) = 2NH 3 (g) reaktsiyasi uchun qiymatlar ma'lum Muvozanat doimiysi bo'lgan haroratni aniqlang ikki haroratda: 400 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 51,23, 500 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 0,2. Reaksiya entalpiyasi va entropiyasining haroratga bog'liqligini e'tiborsiz qoldirib, ushbu reaksiyaning boshqa barcha termodinamik funktsiyalarini hisoblang.
22. N 2 O 4 (g) = 2NO 2 (g) reaktsiyasi uchun qiymatlar ma'lum Muvozanat doimiysi bo'lgan haroratni aniqlang ikki haroratda: 298 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 0,15, 400 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 54,66. Reaksiya entalpiyasi va entropiyasining haroratga bog'liqligini e'tiborsiz qoldirib, ushbu reaksiyaning boshqa barcha termodinamik funktsiyalarini hisoblang.
23. CaCO 3 (k) = CaO (k) + CO 2 (g) reaktsiyasi uchun qiymatlar ma'lum. Muvozanat doimiysi bo'lgan haroratni aniqlang ikki haroratda: 900 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 0,011, 1100 K da Muvozanat doimiysi bo'lgan haroratni aniqlang= 0,84. Reaksiya entalpiyasi va entropiyasining haroratga bog'liqligini e'tiborsiz qoldirib, ushbu reaksiyaning boshqa barcha termodinamik funktsiyalarini hisoblang.
24. A(g) + B(g) = 2H(g) reaksiya doimiy bosimda amalga oshiriladi R 0 =
10 atm. Agar muvozanat konstantasi bo'lsa, ma'lum bir haroratda reaktsiya aralashmasining muvozanat tarkibini hisoblang Muvozanat doimiysi bo'lgan haroratni aniqlang bu haroratda 5 ga teng va reaksiyaga kirishuvchi moddalarning mollarining dastlabki miqdori teng edi /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni A – 1; /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni B – 2; /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni H – 0. A va B moddalarning aylanish darajalari va mahsulot unumi qanday?
25. A(g) + B(k) = 2H(g) reaksiya doimiy bosimda amalga oshiriladi R 0 =
2 atm. Muvozanat konstantasining ifodasini yozing Muvozanat doimiysi bo'lgan haroratni aniqlang. Agar muvozanat konstantasi bo'lsa, ma'lum bir haroratda reaktsiya aralashmasining muvozanat tarkibini hisoblang Muvozanat doimiysi bo'lgan haroratni aniqlang bu haroratda 4 ga teng va reaksiyaga kirishuvchi moddalarning mollarining dastlabki miqdori teng edi /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni A – 2; /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni B – 4; /l = 6,02. 10 23. 6.626. 10 -34. 3. 10 8 / 436. 10 -9 = 2,74. 10 5 J. Yutilgan yorug'lik kvantlarining mollar soni H – 0. B moddaning konversiya darajasi va H mahsulotining unumi qanday?
26. Muvozanat konstantasini ifodalang Muvozanat doimiysi bo'lgan haroratni aniqlang, Gibbs energiyasining o'zgarishi ∆ rG 0, entalpiya o'zgarishi ∆ r H 0 va entropiya ∆ r S 0 reaksiya CO 2 (g) + C (k) = 2CO (g) reaksiyalarning bir xil xarakteristikalari orqali C (k) + O 2 (g) = CO (g) va
2CO (g) + O 2 (g) = 2CO 2 (g).
27. C(k) + O 2 (g) = CO 2 (g) yoki MgCO 3 (k) = MgO(k) + CO 2 (g) reaksiyalarining qaysi birida haroratning muvozanatning siljishiga ta'sirini aniqlang (bo'limga) muvozanat konstantasi) ko'proq bo'ladi.
28. Muvozanat konstantasini hisoblang Muvozanat doimiysi bo'lgan haroratni aniqlang 1500 K reaksiyada
2CO 2 (g) = 2CO (g) + O 2 (g), agar 1000 K da bo'lsa Muvozanat doimiysi bo'lgan haroratni aniqlang = 3,7 . 10−16. (Reaksiyaning issiqlik effekti haroratga bog'liq emasligini ko'rib chiqing.)
29. Quyida bir qancha reaksiyalar uchun termokimyoviy tenglamalar keltirilgan. Bu sistemalardagi muvozanatning qaysi tomonga siljishini bashorat qiling: a) harorat ortishi bilan; b) umumiy bosimning oshishi bilan:
CH 4 (g) + CO 2 (g) = 2CO (g) + 2H 2 (g) ∆H > 0;
2CO(g) = CO 2 (g) + C(k) ∆H< 0;
MgCO 3 (k) = MgO (k) + CO 2 (g) ∆H > 0;
2HCl(g) = H 2 (g) + Cl 2 (g) ∆H > 0;
2H 2 O(g) = 2H 2 (g) + O 2 (g) ∆H > 0;
NH 3 (g) + HCl (g) = NH 4 Cl (k) ∆H< 0;
C 2 H 5 OH (l) = C 2 H 4 (g) + H 2 O (g) ∆H > 0;
2C(k) + 3H 2 (g) = C 2 H 6 (g) ∆H< 0;
N 2 (g) + O 2 (g) = 2NO (g) ∆H > 0.
Muvozanat konstantalari uchun ifodalarni yozing Muvozanat doimiysi bo'lgan haroratni aniqlang bu reaktsiyalar.
Amaliy topshiriqlar.
1. Agar ammiak chiqishining hajm ulushi 98% bo‘lsa, 20 g ammoniy xloridni ortiqcha kaltsiy gidroksid bilan qizdirib olish mumkin bo‘lgan ammiak hajmini hisoblang.
2NH 4 Cl + Ca(OH) 2 = 2NH 3 + H 2 O; Mr(NH4Cl) =53,5
NH 4 Cl +0,5Ca(OH) 2 = NH 3 +0,5H 2 O
1) Nazariy natijani hisoblang
20/53,5=X/22,4; X = 8,37 l (bu nazariy chiqish)
2) Amaliy natijani hisoblang
V (amaliy)=V (nazariy)/mahsulot rentabelligi*100%
V (amaliy) = 8,37 l * 98% / (bo'linish) 100% = 8,2 l
Javob: 8,2 l N NZ
2. Tarkibida 45% oltingugurt boʻlgan 320g oltingugurtli piritdan 405g sulfat kislota olindi (suvsiz kislota uchun hisoblangan). Sulfat kislota chiqishining massa ulushini hisoblang.
Sulfat kislota ishlab chiqarish sxemasini tuzamiz
320g 45% 405g, h-?
FeS 2 → S → H2SO4
1) Piritlardagi oltingugurtning ulushini hisoblang
2) Sulfat kislotaning nazariy unumini hisoblang

3) Mahsulot rentabelligini foiz sifatida hisoblang
H. Agar mahsulot unumining massa ulushi 90% bo'lsa, 200 kg fosfor kislotasi olish uchun zarur bo'lgan fosfor massasini hisoblang.
Fosfor kislotasini ishlab chiqarish sxemasini tuzamiz
X 200kg,k=90%
P → H3PO4
1) Fosfor kislotasining nazariy unumining massasini hisoblang
m t = 


2) Fosforning massasini hisoblang
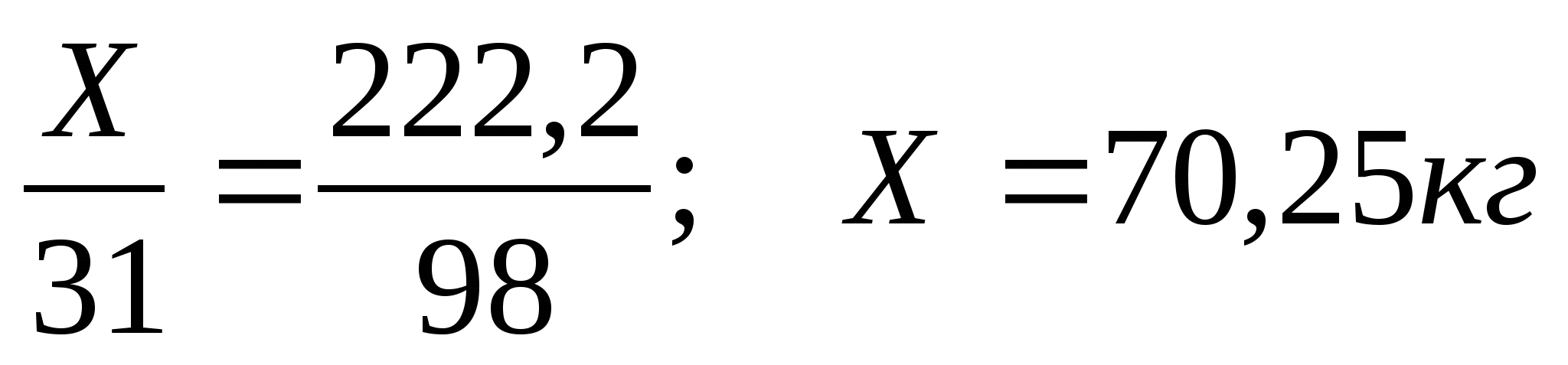
Javob: 70, Zkg
4. Doira sinfidagi yosh kimyogar kaliy nitrat va konsentrlangan sulfat kislota o‘rtasidagi almashinish reaksiyasi orqali nitrat kislota olishga qaror qildi. Massani hisoblang azot kislotasi, u 20,2 g kaliy nitratdan olingan, agar kislota hosilining massa ulushi 0,98 bo'lsa.
5. Ammoniy nitrit N H 4 NO 2 qizdirilganda azot va suv hosil bo'ladi. 6,4 g ammoniy nitritning parchalanishidan olinadigan azot hajmini (n.y) hisoblang, agar azot unumining hajm ulushi 89% bo'lsa.
6. Azot oksidi (II) unumining hajm ulushi 90% bo’lsa, laboratoriya sharoitida 5,6 l ammiakning katalitik oksidlanishidan olinishi mumkin bo’lgan azot oksidi (II) hajmini hisoblang.
7. Bariy metalli uning oksidini alyuminiy metall bilan qaytarib, alyuminiy oksidi va bariy hosil qiladi. Agar 4,59 kg bariy oksididan 3,8 kg bariy olingan bo‘lsa, bariy hosilining massa ulushini hisoblang.
Javob: 92,5%
8. 2,1 litr (N. y) azot oksidi (IV) olish uchun konsentrlangan nitrat kislotaning ortiqcha miqdori bilan reaksiyaga kirishish uchun misning qanday massasi zarurligini aniqlang, agar azot oksidi (IV) unumining hajm ulushi 94 ga teng bo‘lsa. %.
Javob: 3.19
9.Og'irligi 20 g bo'lgan oltingugurt oksidi (VI) ni olish uchun kislorod bilan oksidlanish reaksiyasi uchun oltingugurt oksidi (IV) ning qanday hajmini olish kerak. agar mahsulot rentabelligi 80% bo'lsa (no.).?
2SO 2 + O 2 = 2SO 3; V.(SO 2 ) = 22,4 l; Janob (SO 3 ) =80
1) Nazariy natijani hisoblang
m (nazariy) = 
2) SO 2 ning massasini hisoblang

10. Og'irligi 19,6 g bo'lgan kaltsiy oksidi aralashmasini 20 g og'irlikdagi koks bilan qizdirganda, og'irligi 16 g bo'lgan kaltsiy karbid olindi. Agar koksdagi uglerodning massa ulushi 90% bo'lsa, kaltsiy karbidining unumini aniqlang.
Javob: 71,4%
11.Og'irligi 50 g bo'lgan eritma orqali massa ulushi natriy yodid 15% ortiqcha xlordan o'tdi, 5,6 g og'irlikdagi yod ajralib chiqdi. Reaksiya mahsulotining unumini nazariy jihatdan mumkin bo'lgan foizdan aniqlang.
Javob: 88,2%.
12. Agar 10 kg natriy gidroksidni kremniy oksidi (IV) bilan eritib, 12,2 kg natriy silikat olinsa, natriy silikat unumini nazariy jihatdan % bilan aniqlang. Javob 80%
13. 4 kg alyuminiy oksididan 2 kg alyuminiy eritish mumkin. Nazariy jihatdan mumkin bo'lgan alyuminiy unumining massa ulushini hisoblang.
Javob: 94,3%
14. Massasi 160,5 g bo‘lgan ammoniy xlorid va kalsiy gidroksid aralashmasini qizdirish natijasida olingan ammiakning hajmini hisoblang, agar ammiak chiqishi nazariy jihatdan mumkin bo‘lgan hajm ulushi 78% bo‘lsa.
Javob: 52,4 l
15.Mahsulot unumi nazariy jihatdan mumkin bo'lgan 80% bo'lsa, 8 t ammiakli selitra olish uchun qancha ammiak kerak bo'ladi?
Javob: 2,IZt
16.Agar reaksiyaga 83,6 l asetilen kirsa va amaliy unumi nazariy jihatdan mumkin bo‘lganidan 80% bo‘lsa, Kucherov reaksiyasidan qancha atsetaldegid olish mumkin?
Javob: 131,Z6g
17. 738 g nitrobenzol olish uchun qanday miqdorda benzol kerak bo'ladi, agar amaliy unumi nazariy jihatdan 92% bo'lsa?
Javob: 508,75 g
1 8. 46,8 benzolni nitratlanganda 66,42 g nitrobenzol olindi. Nitrobenzolning amaliy unumini nazariy jihatdan mumkin bo'lgan foiz sifatida aniqlang.
19. Benzolning amaliy unumi 40% bo'lsa, 22,4 l asetilendan necha gramm benzol olish mumkin.?
20.Agar nitrlashdan olingan unum nazariy jihatdan 90% bo‘lsa, 30,75 g nitrobenzol olish uchun qanday hajmdagi benzol (r=0,9 g/sm 3) kerak bo‘ladi?
21. 32 g etilendan 44 g spirt olindi. Mahsulotning amaliy hosildorligini nazariy jihatdan mumkin bo'lgan foiz sifatida hisoblang.
22.Qancha gramm etil spirti 1 m 3 dan olinishi mumkin tabiiy gaz, 6% etilenni o'z ichiga oladi, agar amaliy hosil 80% bo'lsa?
23. Agar 29,6 g metilatsetat olish uchun uning unumi nazariy jihatdan mumkin bo‘lgan 80% bo‘lsa, qancha kislota va spirt kerak bo‘ladi?
24. 50% tsellyuloza bo'lgan 500 kg yog'och gidrolizlanganda 70 kg glyukoza olinadi. Uning amaliy rentabelligini nazariy jihatdan mumkin bo'lgan foiz sifatida hisoblang.
25. Tarkibida 40% glyukoza bo`lgan 250 kg talaşdan qancha glyukoza olinadi. Amaliy rentabelligi 85% bo'lgan glyukoza miqdoridan qancha spirt olish mumkin?
Javob: 43,43 g
26. Qaytarib 186 g anilin olish uchun necha gramm nitrobenzol olish kerak, uning unumi nazariy jihatdan 92% ni tashkil qiladi 27. Massani hisoblang. efir, bu 460 g chumoli kislotasi va 460 g etil spirtidan olingan. Nazariy jihatdan mumkin bo'lgan efir rentabelligi 80% ni tashkil qiladi.
28. Tarkibida 62% kaltsiy fosfat bo'lgan 1 tonna fosforit sulfat kislota bilan ishlov berilganda 910,8 kg superfosfat olindi. Superfosfat unumini nazariyga nisbatan % bilan aniqlang.
Ca 3 (PO 4) 2 + 2H 2 S 0 4 = Ca (H 2 P0 4) 2 + 2CaS 0 4
Z0.Kalsiy nitrat olish uchun 1t bo'r suyultirilgan nitrat kislota bilan ishlov berilgan. Shu bilan birga, kaltsiy nitratining hosildorligi nazariyaga nisbatan 85% ni tashkil etdi. Qancha selitra olindi?
Javob: 1394 kg
31. 56 kg azotdan 48 kg ammiak sintezlandi. Ammiakning unumi nazariyga nisbatan necha foizni tashkil etadi?
Javob: 70,5%
32. Sulfat kislota eritmasidan 34 kg ammiak o‘tkazildi. Ammoniy sulfatning unumi nazariy jihatdan 90% ni tashkil etdi. Necha kilogramm ammoniy sulfat olindi?
Javob: 118,8 kg
3. 34 kg ammiakning oksidlanishida 54 kg azot oksidi (II) olindi.
34. Laboratoriyada ammiak ammoniy xloridni söndürülmüş ohak bilan reaksiyaga kiritish orqali olinadi. Agar 107 g ammoniy xlorid iste’mol qilinsa va ammiak unumi nazariy jihatdan 90% bo’lsa, necha gramm ammiak olingan?
Javob: 30,6 g
35. 60 kg vodorod va mos miqdorda azotdan 272 kg ammiak sintezlandi. Ammiakning unumi nazariy jihatdan mumkin bo'lgan foizda qancha?
36. Tarkibida 2% aralashmalar bo‘lgan 86,7 g natriy nitratdan 56,7 g nitrat kislota olinadi, nazariy jihatdan mumkin bo‘lgan nitrat kislota unumi necha foizga teng?
Javob: 90%.
37. 63 kg 50% li nitrat kislota eritmasidan ammiak o’tkazilganda 38 kg ammiakli selitra olindi. Nazariy jihatdan mumkin bo'lgan foiz sifatida uning chiqishi qancha?
38. Fosfor kislotasini olish uchun tarkibida 50% kaltsiy fosfat bo'lgan 314 kg fosforit sarflangan. Fosfor kislotasining unumi 95% ni tashkil etdi, qancha kislota olindi?
Javob: 94, Zkg
39. 49 kg 50% li sulfat kislota eritmasi o‘chirilgan ohak bilan zararsizlantirildi, natijada 30,6 kg kaltsiy sulfat hosil bo‘ldi. Mahsulotning hosildorligini nazariy jihatdan % bilan aniqlang.
40.Fosfor texnologiyada reaksiya tenglamasi yordamida olinadi;
Saz (R0 4) 2 + 3SiO 2 +5S →ZSaSi O 3 + 2R +5SO
Agar 77 kg kaltsiy fosfatdan 12,4 kg bo'lib chiqsa, fosforning unumi nazariy jihatdan % necha bo'ladi?
Javob: 80,5%
41. Agar 15,2 kg bo'lsa, kaltsiy karbidining unumini% nazariy jihatdan hisoblang.
I4kg kaltsiy oksididan olingan.
42. Asetilen kalsiy karbidini suv bilan reaksiyaga kiritish orqali olinadi
CaC 2 + 2H 2 0 = Ca(OH) 2 + C 2 H 2
Tarkibida 5% aralashma boʻlgan 33,7 g kalsiy karbid isteʼmol qilinsa va atsetilen unumi nazariy jihatdan 90% boʻlsa, necha gramm asetilen olinadi?
Javob: 11,7 g
43.Qachon harakat xlorid kislotasi 50 g bo'rdan 20 g karbonat angidrid hosil bo'ladi. Uning rentabelligi nazariy rentabellikdan % qancha?
Javob: 90,9%
44. Tarkibida 10% aralashma boʻlgan 1 tonna ohaktosh yondirilganda karbonat angidrid unumi 95% ni tashkil qildi. Necha kilogramm karbonat angidrid hosil bo'ldi?
Javob: 376,2 kg.
45. Agar 10 kg kaustik sodani qum bilan eritib, 12,2 kg natriy silikat olinsa, natriy silikat unumini nazariy jihatdan %da aniqlang.


























