Aldegidlar deyiladi organik birikmalar, unda karbonil guruhi (CO) vodorod va radikal R (alifatik, aromatik va geterosiklik birikmalarning qoldiqlari) bilan bog'langan:
Karbonil guruhining qutbliligi butun molekulaning polaritesini ta'minlaydi, shuning uchun aldegidlar solishtirma molekulyar og'irlikdagi qutbsiz birikmalarga qaraganda yuqori qaynash nuqtalariga ega.
Aldegidlardagi vodorod atomlari faqat uglerod atomi bilan bog'langanligi sababli (yaqin nisbiy elektronegativlik), molekulalararo vodorod bog'lari hosil bo'lmaydi. Shuning uchun aldegidlarning qaynash nuqtalari tegishli spirtlar yoki karboksilik kislotalarga qaraganda past bo'ladi. Misol tariqasida metanol (T^ 65 °C), formik kislota (Gbp 101 °C) va formaldegidning (7^, -21 °C) qaynash nuqtalarini solishtirishimiz mumkin.
Pastki aldegidlar suvda eriydi, ehtimol hosil bo'lganligi sababli vodorod aloqalari erigan va erituvchi molekulalari o'rtasida. Yuqori aldegidlar eng keng tarqalgan organik erituvchilarda (spirtlar, efirlar) yaxshi eriydi. Pastki aldegidlar o'tkir hidga ega, C3-C6 li aldegidlar juda yoqimsiz hidga ega, yuqori darajadagi aldegidlar esa gul hidiga ega va parfyumeriyada qo'llaniladi.
Kimyoviy jihatdan aldegidlar juda reaktiv birikmalardir. Aldegidlar uchun eng tipik reaktsiyalar nukleofil qo'shilish reaktsiyalari bo'lib, bu elektrofil markaz molekulasida - C=0 guruhidagi karbonil uglerod atomining mavjudligi bilan bog'liq.
Oksimalar, yarimkarbazonlar va boshqa birikmalarning hosil bo'lishi kabi bu reaktsiyalarning ko'pchiligi sifat va miqdoriy tahlil Aldegidlar guruhidan dorilar, chunki aldegidlarning qo'shilish mahsulotlari har bir aldegid uchun xos bo'lgan erish nuqtasi bilan tavsiflanadi. Shunday qilib, aldegidlar natriy vodorod sulfitning to'yingan eritmasi bilan chayqalganda osongina qo'shilish reaktsiyasiga kiradi:
Qo'shilgan mahsulotlar - ma'lum bir erish nuqtasiga ega bo'lgan va suvda yaxshi eriydigan, lekin organik erituvchilarda erimaydigan tuzlar.
Suyultirilgan kislotalar bilan qizdirilganda gidrosulfit hosilalari o'zlarining asosiy birikmalariga gidrolizlanadi.
Aldegidlarning gidrosulfit hosilalarini hosil qilish qobiliyati molekulasida aldegid guruhi bo'lgan preparatning haqiqiyligini aniqlash uchun ham, aldegidlarni tozalash va natriy gidrosulfit bilan reaksiyaga kirishmaydigan boshqa moddalar bilan aralashmalardan ajratish uchun ham qo'llaniladi.
 |
|||||||||
Aldegidlar ammiak va boshqa azot o'z ichiga olgan nukleofillarni ham osonlik bilan qo'shadilar. Qo'shilgan mahsulotlar odatda beqaror va osongina suvsizlanish va polimerizatsiyaga uchraydi. Polimerlanish natijasida hosil bo'lgan siklik birikmalar suyultirilgan kislotalar bilan qizdirilganda oson parchalanadi va yana aldegidni chiqaradi:
| r-ch-nh2 | g z | -NH R-CC |
| -z2o" | ||
| U |
Aldegidlar oson oksidlanadi. Kumush (I) oksidi va boshqa oksidlanish potentsiali past bo'lgan oksidlovchi moddalar aldegidlarni oksidlash qobiliyatiga ega. Masalan, aldegidlar hosil bo'lish reaksiyasi bilan tavsiflanadi kumush oyna, AgN03 ammiak eritmasi bilan oqadi:
AgN03 + 3NH3 - OH + NH4N03
Tollens reaktivi
Bunday holda, probirkaning devorlarida metall kumushning oyna qoplamasi hosil bo'ladi:
2OH + RCOH 2Agi + RCOOH + 4NH3T + H20
Xuddi shunday, aldegidlar mis (II) ni mis (I) ga kamaytirishi mumkin. Reaksiyani amalga oshirish uchun aldegid eritmasiga Feling reaktivi (mis (II) tartrat kompleksining ishqoriy eritmasi) qo‘shiladi va qizdiriladi. Birinchidan, mis (1) gidroksidning sariq cho'kmasi CuOH, so'ngra mis (1) oksidning qizil cho'kmasi Cu20:
2KNa + RCOH + 3NaOH + 2KOH -
2CuOHi + RCOONa + 4KNaC4H406 + 2H20 2CuOH - Cu20 + H20
Oksidlanish-qaytarilish reaksiyasiga aldegidlarning ishqoriy muhitda Nessler reaktivi bilan reaksiyasi ham kiradi; bu holda, kamaytirilgan simobning quyuq cho'kmasi:
K2 + RCOH + ZKON - RCOOK + 4KI + Hgl + 2N20
Shuni yodda tutish kerakki, Nessler reaktivi bilan reaktsiya sezgirroq, shuning uchun u dorilardagi aldegid aralashmalarini aniqlash uchun ishlatiladi. Haqiqiylik dorilar aldegid guruhini o'z ichiga olganligi kamroq sezgir reaktsiyalar bilan tasdiqlanadi: kumush oyna yoki Feling reaktivi bilan. Ba'zi boshqa birikmalar, masalan, polifenollar ham Ag (I) va Cu (P) birikmalari bilan oksidlanadi, ya'ni. reaktsiya o'ziga xos emas.
Formaldegid va asetaldegid polimerlanishga moyil. Formaldegid siklik trimerlar, tetramerlar yoki chiziqli polimerlarni hosil qilish uchun polimerlanadi. Polimerizatsiya reaktsiyasi karbonil uglerod atomining bir molekulasining kislorodining boshqa molekuladagi nukleofil hujumi natijasida yuzaga keladi:
Shunday qilib, formaldegidning (formalin) 40% suvli eritmasidan chiziqli polimer - paraform (u = 8 - 12), trimer va tetramer hosil bo'ladi.
Aldegidlar giyohvandlik va dezinfektsiyalash xususiyatlari bilan ajralib turadi. Spirtli ichimliklar bilan solishtirganda, aldegid guruhi moddaning toksikligini oshiradi. Aldegid molekulasiga galogenning kiritilishi uning giyohvandlik xususiyatlarini oshiradi. Masalan, xloralning giyohvandlik xususiyatlari atsetaldegidnikiga qaraganda ancha aniq:
![]() s!3s-sS
s!3s-sS
Kvitansiya. Aldegidlar oksidlanish natijasida hosil bo'lishi mumkin asosiy spirtlar xrom kislotasi (Na2Cr04, H2S04) qaynatilganda yoki kaliy permanganat ishqoriy muhitda:
Birlamchi spirtlarning gidrogenatsiyasi mis katalizatori (Cu, Cr2O3) orqali 300-400 ° S da amalga oshiriladi.
Metanolning sanoat ishlab chiqarilishi metanolning temir-molibden katalizatori bilan bug 'fazali oksidlanishiga asoslangan:
2CH3OH + 02 500 ~600 2CH2=0 + H20
Formaldegid eritmasi (formalin)
Kvitansiya. Formalin - metanol (6-10%) bilan barqarorlashtirilgan formaldegidning (40%) suvli eritmasi. Evropa farmakopeyasida "Formaldegid eritmasi (35%)" FS mavjud (9.1-jadvalga qarang). Laboratoriya sharoitida formaldegidni misga nisbatan metanolni suvsizlantirish yoki paraformani depolimerizatsiya qilish orqali olish mumkin.
Haqiqiylikni aniqlash. Farmakopeya usuli - kumush oyna reaktsiyasi.
Formaldegid osonlik bilan kondensatsiya reaktsiyalariga kirishi sababli, masalan, gidroksil o'z ichiga olgan aromatik birikmalar rangli birikmalar hosil bo'lishi bilan Davlat jamg'armasi uni aniqlash uchun salitsil kislotasi bilan reaktsiyadan foydalanishni tavsiya qiladi, buning natijasida qizil rang paydo bo'ladi:
|
||||||||||
|
||||||||||
|
||||||||||
Xromotrop kislota bilan reaktsiya ko'k-binafsha va qizil-binafsha rangli mahsulotlar (EP) hosil bo'lishi bilan xuddi shunday davom etadi.
Farmatsevtikdegidning kimligini aniqlash uchun azot o'z ichiga olgan nukleofillar, masalan, birlamchi aminlar bilan reaktsiyalardan foydalanish mumkin:
H-Ctf° + H2N-R - n-s^^K + H20
Hosil boʻlgan N-almashtirilgan iminlar (Schiff asoslari) ozgina eriydi, ularning baʼzilari rangli, boshqalari ogʻir metallar ionlari bilan rangli birikmalar beradi. EF fenilgidrazin bilan reaktsiyani taklif qiladi. Kislotali muhitda kaliy ferrisiyanid borligida qizg'in qizil reaksiya mahsulotlari hosil bo'ladi.
Tozalik testlari. Formik kislota aralashmalarini nazorat qilish kislotalikni aniqlash orqali amalga oshiriladi. Global jamg'arma ma'lumotlariga ko'ra, preparatdagi formik kislota konsentratsiyasi 0,2% dan oshmasligi kerak; Chumoli kislotaning tarkibi neytrallash usuli (NF) bilan aniqlanadi. EF ma'lumotlariga ko'ra, metanol gaz xromatografiyasi bilan aniqlanadi (9-15% hajm). Sulfatlangan kul - 1,0 g namunada 0,1% dan ko'p emas.
I2 + 2NaOH - Nal + NaOI + H20
Gipoiodit formaldegidni chumoli kislotaga oksidlaydi. Eritma ortiqcha sulfat kislota bilan kislotalanganda, reaksiyaga kirishmagan gipoiodit yodga aylanadi, u natriy tiosulfat bilan titrlanadi:
NSO + NaOI + NaOH - HCOONa + Nal + H20 NaOI + Nal + H2S04 -*■ I2 + Na2S04 + H20 I2 + 2Na2S203 - Na2S406 + 2NaI
Formaldegidni aniqlashda boshqa titrlash vositalaridan foydalanish mumkin: ishqoriy eritmadagi vodorod peroksid, seriy (IV) sulfat, natriy sulfit.
Preparatni oldingi dori sifatida ko'rib chiqish mumkin, chunki fiziologik ta'sir geksametilentetraminning o'zi tomonidan emas, balki preparat kislotali muhitda parchalanganda ajralib chiqadigan formaldegid tomonidan amalga oshiriladi. Aynan shuning uchun u ushbu bo'limga kiritilgan (9.1-jadvalga qarang).
Kvitansiya. Geksamin (tetraazaadamantan) suvli eritmalardan metanal va ammiakni kondensatsiya qilish orqali olinadi. Reaksiya oraliq mahsuloti geksahidro-1,3,5-triazin:
| ll Geksahidro-Gurotropin 1,3,5-trnazin |
Haqiqiylikni aniqlash. Preparat aralashmasini suyultirilgan sulfat kislota bilan qizdirganda ammoniy tuzi hosil bo'ladi, undan ortiqcha ishqor qo'shilganda ammiak ajralib chiqadi:
(CH2)6N4 + 2H2S04 + 6H20 - 6HSON + 2(NH4)2S04 (NH4)2S04 + 2NaOH - 2NH3t + Na2S04 + 2H20
Geksametilentetramin, shuningdek, sulfat kislota bilan oldindan qizdirilgandan keyin salitsil kislotasi qo'shilganda eritmaning qizil ranglanishi bilan ham aniqlanishi mumkin (formaldegidni aniqlashga qarang).
Tozalik testlari. Preparat tarkibida organik birikmalar, paraform va ammoniy tuzlarining aralashmalari mavjudligiga yo'l qo'yilmaydi. Davlat jamg'armasi xloridlar, sulfatlar va og'ir metallarning aralashmalari uchun ruxsat etilgan chegaralarni belgilaydi.
Miqdori. Geksametilentetraminni miqdoriy aniqlash uchun GF neytrallash usulidan foydalanishni taklif qiladi. Buning uchun preparatning namunasi ortiqcha 0,1 M sulfat kislota eritmasi bilan isitiladi. Ortiqcha kislota konsentratsiyasi 0,1 mol/l (metil qizil indikator) ishqor eritmasi bilan titrlanadi.
Miqdorni aniqlashning yodometrik usuli geksametilentetraminning yod bilan tetraiodidlar berish qobiliyatiga asoslanadi.
Aldegidlar va ketonlar molekulasida karbonil guruhining mavjudligi bilan tavsiflanadi. Aldegidlarda karbonil guruhi bitta vodorod atomi va bitta uglevodorod radikali bilan bog'langan. Barcha aldegidlar bir guruhni o'z ichiga oladi
aldegid guruhi deb ataladi.
Aldegidlarning umumiy formulasi:
Aldegid molekulasida tegishli spirt molekulasiga qaraganda ikki kam vodorod atomi mavjud

ya'ni aldegid suvsizlangan (oksidlangan) spirtdir. Bu erda "aldegid" nomi kelib chiqqan - ikki qisqartirilgan lotin so'zlarining birlashmasidan spirt dehidrogenatus (dehidrogenlangan spirt).
To'yingan aldegidlar va ketonlar bir xil umumiy formulaga ega
Nomenklatura va izomeriya. Aldegidlarning nomlari ular oksidlanish jarayonida aylanadigan to'yingan kislotalarning nomlaridan kelib chiqadi. Bu ko'pgina kislotalarning tegishli aldegidlardan oldin kashf etilganligi va nomlanishi bilan izohlanadi.
Ba'zi oddiy aldegidlarning nomlari va formulalari quyida keltirilgan:

Jeneva nomenklaturasi bo'yicha aldegidlarning nomlarini tuzish uchun uglerod atomlari soni bir xil bo'lgan uglevodorod nomiga al oxiri qo'shiladi. IN qiyin holatlar Aldegid guruhining joylashuvi ushbu tugashdan keyin qo'yilgan raqam bilan ko'rsatiladi:

Aldegidlarning izomeriyasi uglevodorod radikalining uglerod atomlari zanjirining izomeriyasiga bog'liq:

Ratsional nomenklaturaga ko'ra, ketonlarning nomlari ularning molekulasiga kiruvchi radikallarning nomlaridan, keton qo'shilishi bilan olingan, masalan:

Ba'zi ketonlarning tarixiy nomlari bor, masalan, dimetil keton aseton deb ataladi.
Jeneva nomenklaturasiga ko'ra, ketonlar tegishli uglevodorod nomiga he oxirini qo'shish orqali nomlanadi. Tarmoqlangan keton zanjiri holatida uglerod atomlarini raqamlash filial eng yaqin joylashgan uchidan boshlanadi (uglevodorodlarni raqamlash qoidalariga muvofiq). Joy
Karbonil guruhi egallagan nomda oxiridan keyin difro bilan ko'rsatilgan, masalan:

Jismoniy xususiyatlar. Aldegidlarning gomologik qatorining birinchi a'zosi shaklli aldegid - gaz; suyuqlikning o'rtacha vakillari; yuqori aldegidlar qattiq moddalardir. Pastki aldegidlar o'tkir hidga ega va suv bilan yaxshilab aralashtiriladi. O'rtacha aldegidlar suvda o'rtacha eriydi; yuqori aldegidlar erimaydi. Barcha aldegidlar spirt va efirda yaxshi eriydi.
Pastki ketonlar suv bilan oson aralashadigan xarakterli hidga ega suyuqliklardir. Yuqori ketonlar qattiq moddalardir. Barcha ketonlar spirt va efirda yaxshi eriydi.
Aldegidlar va ketonlarning kimyoviy reaksiyalari. Aldegidlar va ketonlar juda reaktiv organik moddalardir. Ularning ko'pgina reaktsiyalari issiqlik va bosimsiz sodir bo'ladi. Karbonil guruhi ishtirokida sodir bo'ladigan reaktsiyalar, ayniqsa, aldegidlar va ketonlarga xosdir. Biroq, aldegidlar va ketonlarning reaktsiyalarida ba'zi farqlar mavjud. Umuman olganda, aldegidlar ketonlarga qaraganda faolroqdir.
Qo'shilish reaktsiyalari: aldegidlar va ketonlarning karbonil guruhiga bir qancha turli moddalar qo'shilishi mumkin. Bunda karbonil guruhidagi kislorod va uglerod atomlarini bog`lovchi bog`lardan biri uziladi va hosil bo`lgan erkin valentliklarga reaksiyaga kirishuvchi moddalarning qismlari qo`shiladi. Agar birlashtiruvchi moddada vodorod bo'lsa, ikkinchisi doimo karbonil kislorodga yo'naltiriladi; karbonil guruhi gidroksil guruhiga aylanadi:

Elektron nuqtai nazardan, bu "aldegidlar va ketonlardagi karbonil kislorodning reaktiv xususiyati bilan izohlanadi. elektron bulutlar, karbonil guruhidagi uglerod va kislorod atomlari o'rtasida bog'lanish hosil qilib, kislorod atomi tomon siljiydi, chunki ikkinchisi elektronlarni uglerod atomiga qaraganda kuchliroq tortadi. Natijada, qo'sh bog'lanish juda qutblangan bo'ladi:
Polarizatsiyalangan qo'sh bog'lanish tomon turli moddalar ma'lum bir yo'nalishda qo'shiling. Aldegid va ketonlarga xos bo'lgan ba'zi qo'shilish reaksiyalarini ko'rib chiqamiz.
Siyonik kislota qo'shilishi Siyonik kislota molekulasidagi bog'lanish ham qutblangan va shuning uchun kislorod atomiga bir oz musbat zaryadga ega bo'lgan vodorod, uglerod atomiga guruh qo'shiladi:

Olingan birikmalar siyangiorinlar (yoki oksinitrillar) deb ataladi va aralash funksiyali birikmalardir (tarkibida ham gidroksil, ham siyanoguruhlar mavjud boʻlib, ular turli organik birikmalar sintezi uchun boshlangʻich material boʻlib xizmat qiladi).
Natriy bisulfit qo'shilishi (kislotali natriy sulfid

Olingan birikmalar (bisulfit birikmalari) - kristalli moddalar. Ular laboratoriya amaliyotida aldegidlar va ketonlarni boshqa moddalar bilan aralashmasidan sof holatda ajratib olish uchun ishlatiladi, chunki ular oson parchalanadi.
asl aldegidlar va ketonlarni hosil qilish uchun soda yoki suyultirilgan kislotalar bilan qaynatiladi.
Aldegidlar va ketonlarning karbonil guruhiga metallorganik birikmalarning qo‘shilishi 165-betda muhokama qilinadi.
Aldegidlar va ketonlarning qaytarilishini vodorod molekulasining karbonil guruhiga qo'shilishi reaktsiyasi deb hisoblash mumkin. Aldegidlar qaytarilganda birlamchi spirtlar, ketonlar qaytarilganda ikkilamchi spirtlar hosil bo‘ladi:

Aldegidlar va ketonlar qatoridagi almashtirish reaksiyalari karbonil guruhining kislorodini boshqa atomlar yoki radikallar bilan almashtirishga olib keladi.
Fosfor pentagalidining ta'siri. Masalan, fosfor pentaklorid ta'sirida karbonil kislorod ikki xlor atomi bilan almashtiriladi va digalogenlangan uglevodorod hosil bo'ladi:

Ushbu digalid birikmalari suv bilan reaksiyaga kirishganda, yana asl aldegidlar va ketonlarni ishlab chiqarishga qodir.
Gidroksilaminning ta'siri. Gidroksilamin aldegidlar va ketonlarga ta'sir qilganda, mos ravishda aldoksimlar va ketoksimlar hosil bo'ladi (gidroksilamin ammiak sifatida ko'rib chiqilishi mumkin, unda bitta vodorod atomi gidroksil bilan almashtiriladi):

Hosil boʻlgan oksimlar koʻp hollarda kristall moddalar boʻlib, aldegid va ketonlarni sof holida ochish va ajratish uchun xizmat qiladi.
Oksidlanish reaksiyalari. Aldegidlar turli oksidlovchi moddalar bilan oson oksidlanadi, aylanadi karboksilik kislotalar:

Masalan, aldegidlar ba'zi metallarning oksidlaridan kislorodni osonlikcha olib tashlaydi. Kumush oyna reaksiyasi deb ataladigan narsa shu xususiyatga asoslanadi. Buning sababi shundaki, aldegid kumush oksidning ammiak eritmasi bilan qizdirilganda aldegid kislotaga oksidlanadi va kumush oksidi metall kumushga qaytariladi:
Metall kumush idishning devorlariga joylashadi va yorqin oyna yuzasini hosil qiladi.
Ketonlarning oksidlanishi ancha qiyin. Faqat juda kuchli oksidlanish bilan ularning yorilishi sodir bo'ladi uglerod zanjiri ikkita kislota hosil bo'ladi, masalan:

Karbonil guruhiga nisbatan -holatda vodorod atomi ishtirokidagi reaksiyalar.
Galogenlarning ta'siri. Valdegidlar va ketonlardagi karbonil guruhi uglerodda joylashgan vodorod atomlarining harakatchanligiga katta ta'sir ko'rsatadi, yonida turish karbonil guruhi bilan - pozitsiyasi). Masalan, aldegidlar yoki ketonlarga brom yoki xlor ta'sir qilganda ular vodorod atomlarini - holatida osongina almashtiradilar:

Aldegidlar yoki ketonlarning karbonil guruhiga - pozitsiyasiga kirgan galogen atomlari ham juda yuqori reaktivlikka ega.
Kondensatsiya reaktsiyalari. Kondensatsiya reaktsiyalari - bu yangi uglerod-uglerod aloqalari hosil bo'ladigan zichlash reaktsiyalari. Kondensatsiya reaksiyalari oddiy molekulalar (suv, ammiak, vodorod xlorid va boshqalar) ajralib chiqmasdan yoki ularning ajralib chiqishi bilan sodir bo'lishi mumkin.
Aldegidlar osonlik bilan kondensatsiya reaksiyalariga kirishadi. Masalan, asetaldegid molekulasi sovuqda oz miqdordagi suyultirilgan ishqor ta'sirida bir xil aldegidning boshqa molekulasi bilan kondensatsiyalanadi:

Aldegid va spirt guruhlarini o'z ichiga olgan hosil bo'lgan birikma aldol (aldegid spirtining qisqartmasi) deb ataladi va yuqoridagi reaktsiya aldol kondensatsiyasi deb ataladi. Reaksiya tenglamasidan ko'rinib turibdiki, aldol kondensatsiyasi karbonil guruhiga - pozitsiyasida harakatlanuvchi vodorod atomi tufayli sodir bo'ladi.
Bir oz boshqacha sharoitlarda kondensatsiya yangi uglerod-uglerod qo'sh aloqasi hosil bo'lishi bilan sodir bo'lishi mumkin:

Olingan birikma krotonaldegid, reaksiya esa kroton kondensatsiyasi deb ataladi.
Ketonglar, shuningdek, aldegidlarga qaraganda bir oz murakkabroq bo'lgan kondensatsiya reaktsiyalariga qodir.
Aldegidlarning xarakterli reaksiyalari. Aldegidlar uchun ketonlarga qaraganda faolroq birikmalar sifatida quyidagi reaksiyalar ham xarakterlidir:
Efirlarning hosil bo'lishi. Agar aldegidga oz miqdorda alyuminiy alkoksid qo‘shilsa, kuchli reaksiya sodir bo‘ladi, bunda bir aldegid molekulasining oksidlanishi boshqa aldegid molekulasining qaytarilishi hisobiga sodir bo‘ladi. efir:

Bu reaksiya uni kashf etgan rus olimi nomi bilan Tishchenko reaksiyasi deb ataladi.
Asetallarning hosil bo'lishi. Aldegidlar oz miqdorda mineral kislotalar ishtirokida spirtlar bilan qizdirilganda quyidagi reaksiya yuz beradi:

Olingan birikma asetal deb ataladi va beqaror ikki atomli spirtning efiriga o'xshaydi:

Asetal hosil bo'lish reaktsiyasi teskari. Kislotalar ishtirokida gidrolizlanganda asetallar oson parchalanib, asosiy aldegidlar va spirtlarni hosil qiladi. 4
Polimerizatsiya. Aldegidlar chiziqli yoki siklik polimerlar hosil qilishi mumkin va ikkala holatda ham aldegid molekulalarining qoldiqlari bir-biri bilan atom orqali bog‘lanadi.

Mineral kislotalar aldegidlarning polimerlanish jarayonini tezlashtiruvchi moddalar sifatida ishlatiladi. Qizdirilganda siklik polimerlar asl aldegid molekulalariga ajraladi.
Qabul qilish usullari. Spirtli ichimliklarni oksidlanishi. Bizga ma'lumki, birlamchi spirtlarning oksidlanishida aldegidlar, ikkilamchi spirtlarning oksidlanishida esa ketonlar hosil bo'ladi. Oksidlanish turli oksidlovchi moddalar yordamida, masalan, kislotali muhitda kaliy bixromat yoki katalizatorlar - platina, mis va boshqalar ishtirokida havo kislorodi yordamida amalga oshirilishi mumkin. Ikkala holatda ham reaktsiyalar quyidagi sxema bo'yicha boradi:

Digalogenlangan uglevodorodlardan tayyorlash. Agar ikkala halogen atomi bir xil uglerod atomida joylashgan bo'lsa, bunday galogen hosilalari suv bilan yoki ishqor bilan yaxshiroq qizdirilganda aldegidlar yoki ketonlar hosil bo'ladi:

Suvning asetilen uglevodorodlariga ta'siri (Kucherov reaktsiyasi). Ikki valentli simob tuzlari ishtirokida suv asetilenga ta'sir qilganda atsetaldegid olinadi:

Bunday sharoitda asetilenning gomologlari ketonlarni hosil qiladi:

Oksosintez. Oksosintez - kislorod o'z ichiga olgan organik birikmalarni reaksiyaga kirishish usuli. to'yinmagan uglevodorodlar at uglerod oksidi va vodorod bilan ko'tarilgan harorat, kobalt katalizatori ishtirokida va bosimda. Bu jarayonda asl olefinga qaraganda bir ko‘proq uglerod atomiga ega aldegidlar hosil bo‘ladi:

Formik aldegid (formaldegid) O'tkir, o'ziga xos hidli rangsiz gaz; suvda eriydi. Eritmada formaldegid bo'lgan formaldegidning suvli eritmasi formalin deb ataladi. Eritma bug'langanda formaldegid polimerlanib, past molekulyar og'irlikdagi polioksimetilenlarning (paraformaldegid) qattiq aralashmasini hosil qiladi, bu esa yana kislotalar ta'sirida formaldegid beradi.
Formaldegid - aldegidlarning gomologik turkumining birinchi a'zosi. Umumiy formulada
formaldegid alkil radikali o'rniga vodorod atomiga ega. Shuning uchun ba'zi Kimyoviy xossalari formaldegid ushbu seriyadagi boshqa aldegidlarning xususiyatlaridan keskin farq qiladi. Shunday qilib, masalan, ishqorlar ta'sirida formaldegid, ishqorlar bilan qatronli bo'lgan boshqa yog'li aldegidlardan farqli o'laroq, metil spirti va chumoli kislota tuzini hosil qiladi;
Bu reaksiyada formaldegidning bir molekulasi spirtga, ikkinchisi esa kislotagacha oksidlanadi.
Formaldegid fenol-formaldegid, karbamid va boshqa sintetik polimerlarni ishlab chiqarish uchun juda ko'p miqdorda ishlatiladi. Formaldegidning yuqori molekulyar og'irlikdagi polimeri, poliformaldegid juda qimmatli xususiyatlarga ega (327-bet).
Sintetik kauchuk uchun boshlang'ich material bo'lgan izoprenni (2-metilbutadien-1,3) tayyorlash uchun katta miqdordagi formaldegid ishlatiladi.
Formaldegid va izobutilendan izopren olish jarayoni quyidagi sxema bo'yicha ikki bosqichda davom etadi:

Jarayonning ikkinchi bosqichi 200-220 ° C da katalizator sifatida fosfor kislotasi hosilalari ishtirokida sodir bo'ladi.
Formaldegid bo'yoqlar, farmatsevtika, sintetik kauchuk, portlovchi moddalar va boshqa ko'plab organik birikmalar ishlab chiqarish uchun boshlang'ich material bo'lib xizmat qiladi. Formaldegid zaharli va hatto kichik konsentratsiyalarda ham shilliq qavatlarni bezovta qiladi.
Formalin (formaldegidning suvli eritmasi) antiseptik (dezinfektsiyalovchi) sifatida keng qo'llaniladi. Qizig'i shundaki, oziq-ovqat (baliq, go'sht) chekishda tutunning saqlovchi ta'siri yoqilg'ining to'liq yonmasligi natijasida hosil bo'lgan va tutun tarkibida kam miqdorda bo'lgan formaldegidning kuchli antiseptik ta'siri bilan izohlanadi.
Formaldegid ishlab chiqarishning sanoat usuli bu metanolning katalitik oksidlanishidir. Metanol gaz fazasida atmosfera kislorodi bilan 500-600 ° C da oksidlanadi:

Katalizator sifatida inert g'ovakli tayanchga yoki metall to'r ko'rinishida yotqizilgan metall mis yoki kumush ishlatiladi. (So'nggi paytlarda yanada samarali temir oksidi molibden
katalizator).
Shaklda. 15-rasmda metanolni oksidlash orqali formaldegid ishlab chiqarishning sxematik diagrammasi ko'rsatilgan.
Evaporatator 2 1-metrdan metanolni va puflagich 4 orqali tozalangan havoni oladi. Bug'latgichda suyuq metanol bug'lanadi va havo bilan aralashadi, natijada aralashmada metanol bo'lgan bug'-havo aralashmasi hosil bo'ladi. 100 ° C ga qadar qizdirilgan bug '-havo aralashmasi kontakt apparati 6 ga kiradi, unda metanolning oksidlanishi sodir bo'ladi.

Guruch. 15. Metanol oksidlanishi bilan formaldegid ishlab chiqarish sxemasi: 1 - o'lchash tanki; 2 - evaporatator; 3 - filtr; 4 - puflagich; 5 - isitgich; 6 - aloqa moslamasi; 7 - muzlatgich; 8, 10 - absorberlar; 9 - oraliq muzlatgich.
Reaktsiya mahsulotlari muzlatgich 7 ga yuboriladi, u erda ular 100-130 ° C gacha sovutiladi. Keyin ular 8 va 10 absorberlarga kiradi, ularda hosil bo'lgan formaldegid so'riladi, absorber 10 dan keladigan formaldegidning suyultirilgan eritmasi bilan sug'oriladi, suv bilan sug'oriladi. Shunday qilib, hosil bo'lgan formaldegid absorberni 37,6% formaldegid va taxminan 10% metanol o'z ichiga olgan suvli eritma shaklida qoldiradi. Formaldegidning hosildorligi taxminan 80% ni tashkil qiladi. Absorberdan 10 chiqadigan gazlar tarkibida azot (taxminan 70%), vodorod (taxminan 20%) va oz miqdorda metan, kislorod, karbon monoksit va karbonat angidrid mavjud.
So'nggi paytlarda konsentrlangan metanni atmosfera kislorodi bilan to'liq oksidlanish yo'li bilan formaldegidni sintez qilish usuli sanoatda qo'llanila boshlandi:

Katalizator azot oksidlaridir. (Oksidlanish taxminan 600 °C haroratda amalga oshiriladi.
Asetaldegid (asetaldegid) CH3-CHO. O'tkir hidli rangsiz suyuqlik, suvda yaxshi eriydi; sur'at. kip. +21°S. Kislotalarning ta'sirida u osonlik bilan siklik polimerlarga - paraldehit (suyuqlik) va metalldegidga (qattiq) polimerlanadi.
Asetaldegid sirka kislotasi, sintetik polimerlar, dorivor birikmalar va boshqa ko'plab moddalarni ishlab chiqarish uchun eng muhim boshlang'ich birikma hisoblanadi.
Sanoatda atsetaldegid ishlab chiqarishning quyidagi usullari eng keng tarqalgan:
1. Suyuq simob katalizatorlari ishtirokida (Kucherov reaksiyasidan foydalangan holda) atsetilenni suv bug'i bilan bevosita hidratsiya qilish.
3. Suyuq palladiy katalizatorlari ishtirokida etilenning atmosfera kislorodi bilan bevosita oksidlanishi.
Asetilenning simob katalizatorlari ishtirokida hidratsiyasi 90-100°S haroratda suv bug‘i bilan aralashtirilgan atsetilenni katalizator bilan to‘ldirilgan gidratatorga o‘tkazish yo‘li bilan amalga oshiriladi, ya’ni “kontakt” kislota (simob sulfatning sulfat kislotadagi eritmasi). ). Metall simob ham gidratatorga doimiy yoki vaqti-vaqti bilan kirib, sulfat kislota bilan simob sulfatini hosil qiladi. Kislota qatlami orqali asetilen va suv bug'ining pufakchalari aralashmasi; Bunday holda, asetilen gidratlari va atsetaldegid hosil bo'ladi. Gidratordan chiqadigan bug '-gaz aralashmasi kondensatsiyalanadi va ajratilgan asetaldegid aralashmalardan ajratiladi. Asetaldegidning unumi (asetilenni hisoblash) 95% ga etadi.
Asetilenni simob bo'lmagan katalizatorlar ishtirokida gidratlashda asetilen azot bilan suyultiriladi, suv bug'i bilan aralashtiriladi va hosil bo'lgan bug'-gaz aralashmasi o'tkaziladi. yuqori harorat simob bo'lmagan katalizator ustida, masalan, sink, kobalt, xrom yoki boshqa metallarning oksidlari. Bug '-gaz aralashmasining katalizator bilan aloqa qilish muddati sekundning bir qismini tashkil qiladi, buning natijasida hech qanday yon reaktsiyalar mavjud emas, bu asetaldegid va undan toza mahsulotning hosildorligini oshirishga olib keladi.
Asetaldegid ishlab chiqarishning juda istiqbolli sanoat usuli bu suyuq palladiy katalizatorlari ishtirokida etilenni atmosfera kislorodi bilan to'g'ridan-to'g'ri oksidlanishi:

Reaktsiya ko'proq davom etadi murakkab sxema yuqorida ko'rsatilganidan ko'ra va bir qator qo'shimcha mahsulotlar hosil bo'ladi. Jarayon quvurli reaktorlarda taxminan 120 ° C haroratda va bosimda amalga oshiriladi.
Aseton (dimetil keton) Xarakterli hidli rangsiz suyuqlik, suvda yaxshi eriydi, temp. kip. 56,1 °C.
Aseton ko'pchilik uchun ajoyib hal qiluvchi hisoblanadi organik moddalar, shuning uchun sanoatning turli sohalarida (sun'iy tola ishlab chiqarish, dori-darmonlar va boshqalar) keng qo'llaniladi. Aseton turli xil organik birikmalarni sintez qilish uchun ham ishlatiladi.
A. E. Favorskiy aseton va asetilendan izopren oldi. Reaktsiya uch bosqichda sodir bo'ladi:

Aseton ishlab chiqarishning asosiy sanoat usuli uni izopropilbenzoldan fenol bilan bir vaqtda olishdir (234-bet).
Asetonning bir qismi izopropil spirtini oksidlovchi dehidrogenlash yoki dehidrogenlash yoʻli bilan olinadi.
Izopropil spirtini oksidlovchi dehidrogenlash kumush katalizatorda 450-500 °C da amalga oshirilishi mumkin:

Qo'shimcha mahsulot sifatida karbonat angidrid, propilen va sirka kislotasi hosil bo'ladi. Bu jarayon suyuq fazada atmosfera bosimida va taxminan 150 °C haroratda ham amalga oshirilishi mumkin:

Olingan vodorod peroksid turli sintezlar uchun, masalan, akroleindan glitserin olish uchun ishlatiladi (96-bet).
Izopropil spirtining gidrogenatsiyasi bug 'fazasida 350-400 ° C da mis katalizator ishtirokida amalga oshiriladi:

(eng oddiy aldegid uchun R=H)
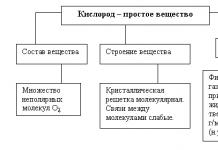
Aldegidlarning tasnifi
Uglevodorod radikalining tuzilishiga ko'ra:
Limit; Masalan:

Cheksiz; Masalan:

aromatik; Masalan:

Alitsiklik; Masalan:

To'yingan aldegidlarning umumiy formulasi

Gomologik qator, izomeriya, nomenklatura

Aldegidlar boshqa birikmalar sinfiga, ketonlarga izomerdir.

Masalan:

Aldegidlar va ketonlar ˃C=O karbonil guruhini o'z ichiga oladi va shuning uchun karbonil birikmalar deb ataladi.
Aldegid molekulalarining elektron tuzilishi
Aldegid guruhining uglerod atomi sp 2 gibridlanish holatida, shuning uchun bu guruhdagi barcha s bog'lar bir tekislikda joylashgan. p bog'ini hosil qiluvchi p elektron bulutlari bu tekislikka perpendikulyar bo'lib, elektron manfiyroq kislorod atomi tomon osongina siljiydi. Shuning uchun C=O qo‘sh bog‘ (alkenlardagi C=C qo‘sh bog‘lanishdan farqli o‘laroq) juda qutblangan.
Jismoniy xususiyatlar

Kimyoviy xossalari
Aldegidlar reaktiv birikmalar bo‘lib, ko‘p reaksiyalarga kirishadi. Aldegidlarning eng xarakterli xususiyatlari:
a) karbonil guruhida qo'shilish reaktsiyalari; HX tipidagi reagentlar quyidagicha qo'shiladi:

b) oksidlanish reaksiyalari C-H aloqalari aldegid guruhi, natijada karboksilik kislotalar hosil bo'ladi:
I. Qo‘shish reaksiyalari
1. Gidrogenatsiya (birlamchi spirtlar hosil bo'ladi

2. Spirtlarning qo'shilishi (gemiatsetallar va atsetallar hosil bo'ladi)

HCl borligida ortiqcha spirtda yarimatsetallar atsetallarga aylanadi:

II. Oksidlanish reaksiyalari
1. “Kumush oyna” reaksiyasi

Soddalashtirilgan:

Bu reaktsiya sifatli reaktsiya aldegid guruhida (reaktsiya idishining devorlarida metall kumushning oyna qoplamasi hosil bo'ladi).
2. Mis (II) gidroksid bilan reaksiyasi

Bu reaksiya, shuningdek, aldegid guruhi y (Cu 2 O cho'kmasining qizil cho'kmasi) ga sifatli reaktsiyadir.
Formaldegid turli xil O o'z ichiga olgan oksidlovchilar bilan oksidlanadi, avval chumoli kislotasiga, so'ngra H 2 CO 3 (CO 2 + H 2 O):

III. Di-, tri- va polimerlanish reaksiyalari
1. Aldol kondensatsiyasi

2. Asetaldegidning trimerizatsiyasi

3. Formaldegidning polimerlanishi
Formaldegidni (40% suvli formaldegid eritmasi) uzoq muddatli saqlash vaqtida unda oq paraformali cho'kma hosil bo'lishi bilan polimerlanish sodir bo'ladi:

IV. Formaldegidning fenol bilan polikondensatlanish reaksiyasi

Maqolaning mazmuni
ALDEGIDLAR VA KETONLAR– tarkibida >C=O fragmenti bo‘lgan organik birikmalar (kislorod bilan qo‘sh bog‘ bilan bog‘langan uglerod, u karbonil deb ataladi). Aldegidlarda karbonil uglerod H atomiga va R organik guruhiga (umumiy formula RHC=O), ketonlarda esa ikkitaga bog'langan. organik guruhlar(umumiy formula R 2 C=O).
Aldegidlar va ketonlarning nomenklaturasi. –(H)C=O guruhi aldegid deb ataladi, u organik guruhlar bilan bog‘lanish uchun faqat bitta erkin valentlikka ega, bu uni uglevodorod zanjirining faqat oxirida (lekin o‘rtada emas) joylashtirish imkonini beradi. Aldegid nomini tuzishda tegishli uglevodorodning nomi ko'rsatiladi, unga "al" qo'shimchasi qo'shiladi, masalan, metanal H 2 C=O, etanal H 3 CC(H)=O, propanal H 3 CCH 2 C(H)=O. Keyinchalik murakkab holatlarda R guruhining uglerod zanjiri karbonil ugleroddan boshlab raqamlanadi, so'ngra funktsional guruhlar va turli o'rinbosarlarning o'rnini ko'rsatish uchun raqamli indekslar qo'llaniladi.
Guruch. 1. ALDEGIDLARNING NOMENKLATURASI. O'rnini bosuvchi va funktsional guruhlar, shuningdek, ularga mos keladigan raqamli indekslar turli xil ranglarda ta'kidlangan.
Baʼzi aldegidlar uchun tarixan rivojlangan arzimas (soddalashtirilgan) nomlar koʻpincha qoʻllaniladi, masalan, formaldegid H 2 C=O, atsetaldegid H 3 CC(H)=O, krotonaldegid CH 3 CH=CHC(H)=O.
Aldegid guruhidan farqli o'laroq, keton guruhi >C=O ham uglevodorod zanjirining o'rtasida joylashgan bo'lishi mumkin, shuning uchun oddiy holatlar organik guruhlarning nomlarini ko'rsating (ularni o'sish tartibida eslatib o'ting) va "keton" so'zini qo'shing: dimetil keton CH 3 -CO - CH 3, metil etil keton CH 3 CH 2 - CO - CH 3. Keyinchalik murakkab holatlarda, uglevodorod zanjiridagi keton guruhining holati raqamli indeks bilan ko'rsatiladi va qo'shimchani qo'shadi. U" Uglevodorod zanjirining raqamlanishi keton guruhiga yaqinroq bo'lgan uchidan boshlanadi (2-rasm).

Guruch. 2. KETONLARNING NOMENKLATURASI. O'rnini bosuvchi va funktsional guruhlar va ularga mos keladigan raqamli indekslar turli ranglarda ta'kidlangan.
Eng oddiy keton CH 3 –CO–CH 3 uchun ahamiyatsiz nom qabul qilinadi - aseton.
Aldegidlar va ketonlarning kimyoviy xossalari
qutbli bo'lgan karbonil guruhi >C=O xususiyatlari bilan aniqlanadi - C va O atomlari orasidagi elektron zichligi notekis taqsimlanadi, ko'proq elektronegativ O atomiga o'tadi, natijada karbonil guruhi ortib boradi reaktivlik, bu qo'sh bog'lanishda turli xil qo'shilish reaktsiyalarida o'zini namoyon qiladi. Barcha holatlarda ketonlar aldegidlarga qaraganda kamroq reaktivdir, xususan, ikkita organik R guruhi tomonidan yaratilgan sterik to'siq tufayli, formaldegid H 2 C=O reaktsiyalarda eng oson ishtirok etadi.
1. C=O qo‘sh bog‘lanish orqali qo‘shish.
Spirtlar bilan o'zaro ta'sirlashganda aldegidlar yarimatsetallarni hosil qiladi - bir uglerod atomida ham alkoksi, ham gidroksi guruhini o'z ichiga olgan birikmalar: >C(OH)OR. Gemiatsetallar boshqa spirt molekulasi bilan reaksiyaga kirishib, to'liq atsetallarni hosil qilishi mumkin - bir uglerod atomi bir vaqtning o'zida ikkita RO guruhini o'z ichiga olgan birikmalar: >C(OR) 2. Reaksiya kislotalar va asoslar tomonidan katalizlanadi (3A-rasm). Ketonlarda C=O dagi qo'sh bog'ga spirt qo'shilishi qiyin.
Xuddi shunday, aldegidlar va ketonlar gidroksian kislotasi HCN bilan reaksiyaga kirishib, gidroksinitrillarni hosil qiladi - bitta uglerod atomida OH va CN guruhini o'z ichiga olgan birikmalar: >C(OH)Ce N (3B-rasm). Reaksiya diqqatga sazovordir, chunki u uglerod zanjirining ko'payishiga imkon beradi (yangi C-C aloqasi paydo bo'ladi).
Xuddi shunday (C=O qo‘sh bog‘ini ochish), ammiak va aminlar aldegidlar va ketonlar bilan reaksiyaga kirishadi, qo‘shilgan mahsulotlar beqaror bo‘lib, suv ajralib chiqishi va C=N qo‘sh bog‘ hosil bo‘lishi bilan kondensatsiyalanadi. Ammiakda iminlar olinadi (3C-rasm), aminlardan esa Shiff asoslari deb ataladigan - tarkibida >C=NR fragmenti bo'lgan birikmalar hosil bo'ladi (3D-rasm). Formaldegidning ammiak bilan o'zaro ta'siri mahsuloti biroz boshqacha - bu uchta oraliq molekulaning siklizatsiyasi natijasidir, natijada tibbiyotda urotropin preparati sifatida ishlatiladigan ramka birikmasi geksametilentetramin (3D-rasm).

2. Kondensatsiya reaksiyalari. Aldegidlar va ketonlar uchun bir xil birikmaning ikkita molekulasi o'rtasida kondensatsiya bo'lishi mumkin. Aldegidlarning bunday kondensatsiyasi bilan molekulalardan birining qo'sh aloqasi ochilib, aldol (aldegid spirti) deb ataladigan aldegid va OH guruhini o'z ichiga olgan birikma hosil qiladi. Hodisa sodir bo'ladigan kondensatsiya aldol deb ataladi va bu reaktsiya asoslar tomonidan katalizlanadi (4A-rasm). Hosil boʻlgan aldol yana kondensatsiyalanib, C=C qoʻsh bogʻ hosil qilishi va kondensatsiya suvini chiqarishi mumkin. Natijada to'yinmagan aldegid (4A-rasm, krotonaldegid) hosil bo'ladi. Bu kondensatsiya to'yinmagan aldegidlar qatoridagi birinchi birikma nomidan keyin krotonik kondensatsiya deb ataladi. Ketonlar aldol kondensatsiyasida ham ishtirok etishga qodir (4B-rasm), lekin ikkinchi bosqich, kroton kondensatsiyasi ular uchun qiyin. Aldol kondensatsiyasida har xil aldegidlarning molekulalari, shuningdek, aldegid ham, keton ham birgalikda ishtirok etishi mumkin, uglerod zanjiri uzayadi; Oxirgi bosqichda olingan krotonaldegid (4A-rasm) aldegidlarning barcha xossalariga ega bo‘lib, u olingan atsetaldegidning keyingi qismi bilan o‘zaro ta'sirlashganda, keyinchalik aldol va kroton kondensatsiyasida ishtirok etishi mumkin (4B-rasm). Shu tariqa uglevodorod zanjirini uzaytirish, bitta va qo‘sh bog‘lar almashinadigan birikmalarni olish mumkin: –CH=CH–CH=CH–.

Aldegidlar va ketonlarning fenollar bilan kondensatsiyasi karbonil O atomini (suv shaklida) olib tashlashni o'z ichiga oladi va ikki fenol molekulasi orasiga metilen guruhi CH2 yoki almashtirilgan metilen guruhi (CHR yoki CR2) kiritiladi. Bu reaksiya fenol-formaldegid smolalarini olish uchun eng keng tarqalgan (5-rasm).

Guruch. 5. FENOLNING FORMALDEGID BILAN KONDENSASI
3. Karbonil birikmalarining polimerlanishi C=O qo`sh bog`ning ochilishi bilan sodir bo`ladi va asosan aldegidlarga xosdir. Formaldegidning suvli eritmalari vakuumda bug'langanda, tsiklik birikmalar (asosan trioksimetilen) va kichik zanjir uzunligi n = 8-12 (paraformlar) bo'lgan chiziqli mahsulotlar aralashmasi hosil bo'ladi. Tsiklik mahsulotni polimerlash orqali poliformaldegid olinadi (6-rasm), polimer yuqori quvvat va mexanik va asbobsozlikda strukturaviy material sifatida ishlatiladigan yaxshi elektr izolyatsiyasi xususiyatlari.

Guruch. 6. FORMALDEGID POLİMERIZASINIY MAHSULOTLAR
4. Qaytarilish va oksidlanish. Aldegidlar va ketonlar spirtlar va karboksilik kislotalar orasidagi oraliq birikmalarga o'xshaydi: qaytarilish spirtlarga, oksidlanish esa karboksilik kislotalarga olib keladi. H2 (Pt yoki Ni katalizatori ishtirokida) yoki boshqa qaytaruvchi reagentlar, masalan, LiAlH4 ta'sirida aldegidlar qaytarilib, birlamchi spirtlarni, ketonlar esa ikkilamchi spirtlarni hosil qiladi (7-rasm, A va B sxemalari).
Aldegidlarning karboksilik kislotalarga oksidlanishi O 2 ishtirokida yoki kuchsiz oksidlovchi moddalar, masalan, kumush gidroksidning ammiak eritmasi ta'sirida juda oson kechadi (7B-rasm). Ushbu ajoyib reaktsiya kumush oynaning paydo bo'lishi bilan birga keladi ichki yuzasi reaktsiya qurilmasi (odatda oddiy probirka), u aldegid guruhini sifatli aniqlash uchun ishlatiladi. Aldegidlardan farqli o'laroq, ketonlar kuchli oksidlovchi moddalar ishtirokida qizdirilganda oksidlanishga chidamli bo'ladi, masalan, KMnO 4, qisqartirilgan (asl keton bilan solishtirganda) uglevodorod zanjiriga ega bo'lgan karboksilik kislotalarning aralashmalari hosil bo'ladi.

Guruch. 7. ALDEGIDLAR VA KETONLARNING KISHAYTIRISH VA OKSIDALANISHI
Aldegidlarning spirtli ichimliklar va kislotalar o'rtasida oraliq pozitsiyani egallashining qo'shimcha tasdig'i ikki aldegid molekulasidan spirt va karboksilik kislotaga olib keladigan reaktsiya (8A-rasm), ya'ni. bir aldegid molekulasi oksidlanadi, ikkinchisi esa qaytariladi. Ba'zi hollarda hosil bo'lgan ikkita birikma - spirt va karboksilik kislota - keyinchalik bir-biri bilan reaksiyaga kirishib, efir hosil qiladi (8B-rasm).

Guruch. 8 . ALDEGIDLARNI BIR VAQTDA OKSIDLANISH VA KIYTIRISH
Aldegidlar va ketonlarni tayyorlash.
Eng universal usul spirtlarning oksidlanishi bo'lib, unda birlamchi spirtlardan aldegidlar, ikkilamchi spirtlardan ketonlar hosil bo'ladi (9A va B-rasm). Bu shakldagi reaktsiyalarga qarama-qarshidir. 7A va B. Agar faol reagent o'zgartirilsa (qaytaruvchi vosita o'rniga oksidlovchi vosita) va spirtlarning oksidlanishi uchun katalizator, mis katalizatori samarali bo'lsa;
Sanoatda asetaldegid etilenning oksidlanishi bilan olinadi (9B-rasm), OH guruhi qo'sh bog'lanishga "qo'shni" bo'lgan spirt hosil bo'ladi (vinil spirti beqaror va darhol); karbonil birikmalariga izomerlanadi. Yana bir usul - asetilenning katalitik hidratsiyasi (9D-rasm), oraliq birikma vinil spirtidir. Agar siz asetilen o'rniga metil asetilenni olsangiz, siz aseton olasiz (9E-rasm). Aseton ishlab chiqarishning sanoat usuli kumenning oksidlanishidir. Asetofenon kabi aromatik ketonlar asetil guruhining katalitik qo'shilishi bilan tayyorlanadi. aromatik yadro(9E-rasm).

Aldegidlar va ketonlarni qo'llash.
Formaldegid H 2 C=O (uning suvdagi eritmasi formalin deb ataladi) biologik preparatlar uchun terini bo'yash vositasi va konservant sifatida ishlatiladi.
Aseton (CH 3) 2 C=O - laklar va emallar uchun keng qo'llaniladigan ekstraktor va erituvchi.
Aromatik keton benzofenon (C 6 H 5) 2 C=O geranium hidli, parfyumeriya kompozitsiyalarida va sovunni xushbo'ylash uchun ishlatiladi.
Aldegidlarning bir qismi dastlab o‘simlik efir moylarida topilgan va keyinchalik sun’iy ravishda sintez qilingan.
Alifatik aldegid CH 3 (CH 2) 7 C (H) = O (arzimas nomi pelargonaldegid) tsitrus o'simliklarining efir moylarida uchraydi, apelsin hidiga ega va oziq-ovqat aromati sifatida ishlatiladi.
Aromatik aldegid vanillin (10-rasm) tropik vanil o'simlikining mevalarida mavjud bo'lib, hozirda sintetik vanillin ko'proq ishlatiladi - taniqli xushbo'y qo'shimcha qandolatchilik(10-rasm).

Guruch. 10. VANILLIN
Benzaldegid C 6 H 5 C (H) = O achchiq bodom hidi bilan bodom moyida va efir moyi evkalipt. Sintetik benzaldegid oziq-ovqat aromati esensiyalari va parfyumeriya kompozitsiyalarida qo'llaniladi.
Benzofenon (C 6 H 5) 2 C=O va uning hosilalari ultrabinafsha nurlarini yutish qobiliyatiga ega, bu ularning quyosh kremlari va losonlarida ishlatilishini aniqladi, bundan tashqari, ba'zi benzofenon hosilalari mikroblarga qarshi faollikka ega va konservant sifatida ishlatiladi. Benzofenon yorongulning yoqimli hidiga ega, shuning uchun u parfyumeriya kompozitsiyalarida va sovunni xushbo'ylash uchun ishlatiladi.
Aldegidlar va ketonlarning turli o'zgarishlarda ishtirok etish qobiliyati ularning turli xil organik moddalar: spirtlar, karboksilik kislotalar va ularning angidridlari, dorilar (urotropin), polimer mahsulotlari (fenol-formaldegid smolalari, poliformaldegid) sintezi uchun boshlang'ich birikmalar sifatida asosiy ishlatilishini aniqladi. barcha turdagi xushbo'y moddalar (benzaldegid asosida) va bo'yoqlarni ishlab chiqarishda.
Mixail Levitskiy
Aldegidlar molekulalarida vodorod atomiga bog'langan karbonil guruhi mavjud bo'lgan birikmalar, ya'ni. aldegidlarning umumiy formulasini quyidagicha yozish mumkin
bu erda R uglevodorod radikali bo'lib, u turli darajadagi to'yingan bo'lishi mumkin, masalan, to'yingan yoki aromatik.
-CHO guruhi aldegid deb ataladi.
Ketonlar - molekulalarida ikkita uglevodorod radikaliga bog'langan karbonil guruhi bo'lgan organik birikmalar. Umumiy formula ketonlar quyidagicha yozilishi mumkin:
bu erda R va R' uglevodorod radikallari, masalan, to'yingan (alkil) yoki aromatik.
Aldegidlar va ketonlarning gidrogenlanishi
Aldegidlar va ketonlar katalizatorlar ishtirokida vodorod bilan qaytarilishi va mos ravishda birlamchi va ikkilamchi spirtlarga qizdirilishi mumkin:
Aldegid oksidlanishi
Aldegidlar mis gidroksidi va kumush oksidning ammiak eritmasi kabi engil oksidlovchi moddalar bilan ham oson oksidlanishi mumkin.
Mis gidroksidi aldegid bilan qizdirilganda reaktsiya aralashmasining dastlabki ko'k rangi yo'qoladi va mis oksidining g'isht-qizil cho'kmasi hosil bo'ladi:
Kumush oksidning ammiak eritmasi bilan reaksiyaga kirishganda, karboksilik kislota o'rniga uning ammoniy tuzi hosil bo'ladi, chunki eritmadagi ammiak kislotalar bilan reaksiyaga kirishadi:
Ketonlar mis (II) gidroksid va kumush oksidning ammiak eritmasi bilan reaksiyaga kirishmaydi. Shu sababli, bu reaksiyalar aldegidlar uchun sifatli hisoblanadi. Shunday qilib, kumush oksidning ammiak eritmasi bilan reaktsiya, to'g'ri amalga oshirilganda, reaktsiya idishining ichki yuzasida xarakterli kumush oyna hosil bo'lishiga olib keladi.
Shubhasiz, agar engil oksidlovchi moddalar aldegidlarni oksidlashi mumkin bo'lsa, unda kuchliroq oksidlovchi moddalar, masalan, kaliy permanganat yoki kaliy bixromat, tabiiy ravishda xuddi shunday qilishlari mumkin. Ushbu oksidlovchi moddalar kislotalar ishtirokida ishlatilsa, karboksilik kislotalar hosil bo'ladi:
Karboksilik kislotalarning kimyoviy xossalari
Karboksilik kislotalar bir yoki bir nechta karboksil guruhini o'z ichiga olgan uglevodorod hosilalari.
Karboksil guruhlariA:
Ko'rib turganingizdek, karboksil guruhi gidroksil guruhi -OH bilan bog'langan -C(O)- karbonil guruhidan iborat.
Karbonil guruhi gidroksil guruhiga to'g'ridan-to'g'ri bog'langanligi sababli, bu salbiy induktiv ta'sirga ega. OH ulanishi spirt va fenollarga qaraganda qutbliroqdir. Shu sababli, karboksilik kislotalar spirtlar va fenollarga qaraganda sezilarli darajada aniqroq, kislotali xususiyatlar. Suvli eritmalarda ular xossalarini namoyon qiladi kuchsiz kislotalar, ya'ni. vodorod kationlariga (H+) va kislota qoldiqlarining anionlariga teskari ajraladi:
Tuz hosil bo'lish reaktsiyalari
Tuzlarni hosil qilish uchun karboksilik kislotalar quyidagilar bilan reaksiyaga kirishadilar:
1) faollik qatoridagi metallardan vodorodga:
2) ammiak
3) asosiy va amfoter oksidlar:
4) asosiy va amfoter gidroksidlar metallar:
5) kuchsiz kislotalarning tuzlari - karbonatlar va bikarbonatlar, sulfidlar va gidrosulfidlar, yuqori (molekulasida uglerod atomlari ko'p bo'lgan) kislotalarning tuzlari:
Ba'zi kislotalar va ularning tuzlarining tizimli va ahamiyatsiz nomlari quyidagi jadvalda keltirilgan:
| Kislota formulasi | Kislota nomi trivial/sistematik | Tuz nomi ahamiyatsiz/sistematik |
| HCOOH | formik / metan | format/metanat |
| CH3COOH | sirka/etan | asetat/etanat |
| CH3CH2COOH | propion / propan | propionat/propanoat |
| CH 3 CH 2 CH 2 COOH | yog '/butan | butirat/butanoat |
Buning aksini ham yodda tutish kerak: kuchli mineral kislotalar karboksilik kislotalarni tuzlaridan kuchsizroqlari sifatida siqib chiqaradi:
OH guruhi ishtirokidagi reaksiyalar
Karboksilik kislotalar kuchli noorganik kislotalar ishtirokida bir atomli va ko‘p atomli spirtlar bilan esterlanish reaksiyasiga kirishadi, natijada efirlar hosil bo‘ladi:
Reaksiyaning bu turi teskari bo'ladi, shuning uchun muvozanatni efir hosil bo'lishiga qarab siljitish uchun ular qizdirilganda ko'proq uchuvchi efirni haydash orqali amalga oshirilishi kerak.
Esterlanish reaksiyasining teskarisi ester gidrolizi deb ataladi:
Bu reaktsiya ishqorlar ishtirokida qaytarilmas tarzda sodir bo'ladi, chunki hosil bo'lgan kislota tuz hosil qilish uchun metall gidroksid bilan reaksiyaga kirishadi:
Uglevodorod o'rnini bosuvchida vodorod atomlarini almashtirish reaktsiyalari
Karboksilik kislotalar xlor yoki brom bilan qizil fosfor ishtirokida reaksiyaga kirishganda, qizdirilganda a-uglerod atomidagi vodorod atomlari galogen atomlari bilan almashtiriladi:
Halojen/kislota nisbati yuqori bo'lsa, chuqurroq xlorlanish sodir bo'lishi mumkin:
Karboksil guruhini yo'q qilish reaktsiyalari (dekarboksillanish)
Chumoli kislotaning maxsus kimyoviy xossalari
Chumoli kislota molekulasi, kichik o'lchamiga qaramay, ikkita funktsional guruhni o'z ichiga oladi:
Shu munosabat bilan u nafaqat kislotalarning xususiyatlarini, balki aldegidlarning xususiyatlarini ham namoyon qiladi:
Konsentrlangan sulfat kislota ta’sirida chumoli kislota suv va uglerod oksidiga parchalanadi.