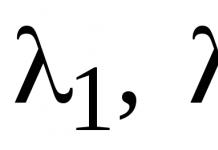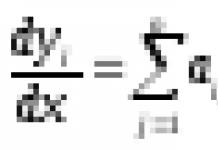Страница 1
Химические процессы сводятся к превращению молекул, т.е. к возникновению и разрушению связей между атомами. Поэтому важнейшей проблемой химии всегда была и остается проблема химического взаимодействия, тесно связанная со строением и свойствами вещества. Современная научная трактовка вопросов химического строения и природы химической связи дается квантовой
механикой
– теорией движения и взаимодействия микрочастиц (электронов, ядер и т.д.).
Одним из общих свойств материи является ее двойственность. Частицы материи обладают одновременно и корпускулярными и волновыми свойствами. Соотношение "волна – частица" таково, что с уменьшением массы частицы ее волновые свойства все более усиливаются, а корпускулярные – ослабевают. Когда же частица становится соизмеримой с атомом, наблюдаются типичные волновые явления. Одновременно оказывается невозможным описание движения и взаимодействия микрочастиц-волн законами движения тел с большой массой. Первый шаг в направлении создания волновой, или квантовой механики, законы которой объединяют и волновые, и корпускулярные свойства частиц, сделал де Бройлем (1924). Де Бройль высказал гипотезу, что с каждой материальной частицей связан некоторый периодический процесс. Если частица движется, то этот процесс представляется в виде распространяющейся волны, которую называют волной де Дройля
Или фазовой волной
Скорость частицы V связана с длиной волны λ соотношением де Бройля
где m – масса частицы (например, электрона);
h – постоянная Планка.
Уравнение (1) относится к свободному движению частиц. Если же частица движется в силовом поле, то связанные с ней волны описываются так называемой волновой функцией
Общий вид этой функции определил Шредингер (1926). Найдем волновую функцию следующим путем. Уравнение, характеризующее напряженность поля Еа плоской монохроматической волны света, можно записать в виде:
 , (2)
, (2)
где Еа0 – амплитуда волны;
ν – частота колебаний;
t – время;
λ – длина волны;
х – координата в направлении распространения волны.
Так как вторые производные от уравнения плоской волны (2), взятые по времени t и координате х, равны соответственно:
![]() , (3)
, (3)
![]() , (4)
, (4)
то ![]()
Подставляя λ=с/ V (с – скорость света), получаем волновое уравнение для плоской световой волны:
![]() , (5)
, (5)
Последующие преобразования основываются на предположениях, что распространение волн де Бройля описывается аналогичным уравнением, и что эти волны становятся стационарными и сферическими. Сначала представим, что по уравнению (5) изменяется значение новой функции ψ от координат (χ, y, z), имеющей смысл амплитуды некоторого колебательного процесса. Тогда, заменяя Еа на ψ, получим волновое уравнение в форме.
Недостатки модели Бора. Выдвинутая Бором модель атома до сих пор используется в ряде случаев. Ею можно пользоваться, интерпретируя расположение элементов в периодической таблице и закономерности изменения энергии ионизации элементов. Однако модель Бора имеет недостатки. 1. Эта модель не позволяет объяснить некоторые особенности в спектрах более тяжелых элементов, чем водород. 2. Экспериментально не подтверждается, что электроны в атомах вращаются вокруг ядра по круговым орбитам со строго определенным угловым моментом.
Двойственная природа электрона. Известно, что электромагнитное излучение способно проявлять как волновые, так и корпускулярные свойства (подобные свойствам частиц). В последнем случае оно ведет себя как поток частиц – фотонов. Энергия фотона связана с его длиной волны λ или частотой υ соотношением E = h · υ = h · c / λ (с = λ · υ),
где h
– поcтоянная Планка равна 6,62517∙10 -34 Дж∙с, c
– скорость света.
Луи де Бройль высказал смелое предположение, что аналогичные волновые свойства можно приписать и электрону. Он объединил уравнения Эйнштейна (E
= m ·
c 2) и Планка (E
= h ·
υ) в одно:
h · υ = m · c 2 h · с / λ = m · c 2 λ = h /m · c .
λ = h /m · ѵ,
где – ѵ скорость электрона. Это уравнение (уравнение де Бройля ), связывающее длину волны с его импульсом (m ѵ), и легло в основу волновой теории электронного строения атома. Де Бройль предложил рассматривать электрон как стоячую волну, которая должна умещаться на атомной орбите целое число раз, соответствующее номеру электронного уровня. Так, электрону, находящемуся на первом электронном уровне (n = 1), соответствует в атоме одна длина волны, на втором (n = 2) – две и т. д.
Двойственная природа электрона приводит к тому, что его движение не может быть описано определенной траекторией, траектория размывается, появляется «полоса неопределенности», в которой находится ē. Чем точнее мы будем стараться определить местонахождения электрона, тем менее точно будем знать о его скорости. Второй закон квантовой механики звучит так: «Невозможно одновременно с любой заданной точностью определить координаты и импульс (скорость) движущегося электрона» - это принцип неопределенности Гейзенберга. Эта вероятность оценивается уравнением Шредингера (основное уравнение квантовой механики):
H · ψ = E · ψ,
где H – оператор Гамильтона, указывающий на определенную последовательность операций с ψ – функцией. Отсюда Е = H · ψ / ψ. Уравнение имеет несколько решений. Волновая функция, являющаяся решением уравнения Шредингера, есть атомная орбиталь. В качестве модели состояния электрона в атоме принято представление об электронном облаке, плотность соответствующих участков которого пропорциональна вероятности нахождения там электрона.
Несмотря на невозможность точного определения положения электрона, можно указать вероятность нахождения электрона в определенном положении в любой момент времени. Из принципа неопределенности Гейзенберга вытекают два важных следствия.
1. Движение электрона в атоме – движение без траектории. Вместо траектории в квантовой механике введено другое понятие – вероятность пребывания электрона в определенной части объема атома, которая коррелирует с электронной плотностью при рассмотрении электрона в качестве электронного облака.
2. Электрон не может упасть на ядро. Теория Бора не объяснила это явление. Квантовая механика дала объяснение и этому явлению. Увеличение степени определенности координат электрона при его падении на ядро вызвало бы резкое возрастание энергии электрона до 10 11 кДж/моль и больше. Электрон с такой энергией вместо падения на ядро должен будет покинуть атом. Отсюда следует, что усилие необходимо не для того, чтобы удержать электрон от падения на ядро, а для того, чтобы «заставить» электрон находиться в пределах атома.
Список литературы :
Синкевич О.А., Стаханов И.Р.; Физика плазмы; издательство МЭИ, 1991 г
Синкевич О.А.; Волны и неустойчивости в сплошных сред; издательство МЭИ, 2016 г
Синкевич О.А.; Акустические волны плазме твердого тела; издательство МЭИ, 2007 г
Аретемов В.И., Левитан Ю.С., Синкевич О.А.; Неустойчивость и турбулентность в низкотемпературной плазме; издательство МЭИ, 1994/2008
Райдер Ю.П.; Физика газового разряда 1992/2010
Иванов А.А. Физика сильнонеравновесной плазмы 1977
Плазма – среда состоящие из нейтральных частиц (молекулы, атомы, ионы и электроны) в котором внешнее взаимодействие электромагнитного поля является главным.
Примеры плазмы: Солнце, электричество (молнии), Северное сеяние, сварка, лазеры.
Плазма бывает
Газовой (9 семестр). Плотность может варьироваться от 10 4 до 10 27 кг/м 3 , температуры от 10 5 до 10 7 К
Твердой (10 семестр).
Плазма по агрегатному состоянию бывает
Частичной . Это когда имеется смесь частиц которая часть из них ионизированная.
Полной Это когда все частицы ионизированные.
Способ получение плазмы на примере кислорода. Начинаем с температуры 0 К начиная нагревать, в начальном состоянии будет твердой, после достижение некоторого значение жидкой, а далее и газообразной. Начиная с некоторой температуры происходит диссипация и молекула кислорода разделяется на атомы кислорода. Если продолжать нагревать кинетической энергии у электронов будет достаточной чтобы покинуть атом и таким образом атом превратиться в ионн (частичная плазма).Если продолжать нагревать, то атомов просто не останется (полная плазма)
Физика плазмы основывается на следующих наук:
Классическую (ур. Ньютона)
Неревителийскую (U<
Ревителийскую
Термодинамика
Электродинамика
Механика движение заряженных тел
Квантовую
Кинетическая теория (ур. Больцмана)
Классическая механика во внешних электромагнитных полей
Рассмотрим случай, когда B=0.
Рассмотрим случай, когда E=0, U=(Ux,0,0); B=(0,0,Bz)


Рассмотрим случай, когда Е=(0,Еу,0) и В=(0,0,Вz). Пусть решение неоднородного уравнение имеет вид
Классическая механика во внешних электромагнитных полей с силой расталкиванием

Эффект Холла – ток течет не вектору электрического поля при наличии магнитного поля и столкновение частиц.
Электродинамика


Задача: имеется некоторая частица с зарядом (q ), определить E (r ). Примем следующие допущение: данная задача стационарная, нет токов так как частица 1 и не движется. Так как rot(B) и div(B) равны 0, то вектор B=0. Можно предположить, в данная задача будет имеет сферическую симметрию, а это означает что можно использовать теорему Остроградского-Гаусса.
Электромагнитное поле в плазме
Задача: имеется частица зарядом (q ), окруженная нейтральной плазмой . Допущение с предыдущей задачей не изменились, что означает B=0. Так как плазма нейтральная концентрация отрицательных зарядов и положительных будет одинаковой.

Плазменные колебания
Рассмотрим следующую задачу. Имеется 2 заряда протон и электрон. Так как масса протона много больше массы электрона, протон будет не подвижный. Неведомым способом отодвинем электрон на малое расстояние от состояния равновесия и отпустим его, получим следующее уравнение.
Уравнение электромагнитной волны
Рассмотрим следующее, токов нету, плотность заряда нету, тогда

Если поставить данное решение в уравнение электромагнитной волны, получится следующее
Уравнение электромагнитной волны с током (в плазме)
По сути не чем не отличается от прошлой задачи
Пускай решение данного уравнение имеет следующий вид, тогда
Если то электромагнитное волна проникает сквозь плазму, если нет то отражается и поглощается.
Термодинамика плазмы
Термодинамическая система – это такая система у которой нету обмена с внешней средой таких как энергии, импульса и информации.
Обычно определение термодинамических потенциалов определяют следующим образом
Если использовать приближение идеального газа для плазмы
Предположим что, все заряды это электроны, и расстояние между ними очень мало, тогда
В области слабой неотделанности можно построить наподобие вириального уравнения
В зоне квантовой внутренние энергия это внутренние энергия Фарадея
![]()
В зоне сильно неиделаьной плазмы проводимость веществ может резко меняться, что вещество становиться диэлектриком и проводником.
Расчет состава плазмы
Основной принцип данного расчета взят для нахождения концентраций химических элементов. Если данная система находится в равновесии при определенном температуре и давлении, то производная энергии Гиббса по количеству вещества равна 0.
Бывают различные ионизации: поглощение кванта, столкновение с возбужденным атомом, термическая и др. (рассматривается именно термическая дальше). Для нее получается следующая система уравнений.
Основная проблема заключается в том, что непонятно как зависит химический потенциал от концентрации для этого необходимо обратиться к квантовой физики.
По неведомым причинам это уравнение эквивалентная этому, в котором концентрация в свободной энергии перевернута. Так как тепловая длинная Де Бройля для атома и для иона является практически одинаковой, то они сокращаются. 2 возникает так как у электрона имеется 1 уровень энергии, а это его вес.
Если решить систему уравнений, то концентрация ионов определяется следующей формулой
![]()
Методика выше расписана для идеального ионизации, посмотрим, что измениться в случаи не идеальности.
![]()
Так как для, атома данная не идеальность равна 0, для иона и электрона они равны, больше никаких изменений не происходит, тогда уравнение Саха выглядит следующим образом.

Условия возникновение двух температурной плазмы
Речь пройдет, что в самой плазме среднее тепловая энергия очень сильно расходится для электронов по сравнению с атомами и ионами. А именно получается что температура для электронов достигается 10000 К, когда для атомов и ионов всего лишь 300 К.
Рассмотрим простой случай электрон в постоянном электрическом поле вызывающей термоэмисию электронов, тогда его скорость можно определить следующим образом
Рассмотрим похожее задачку, электрон соударяется с атомами, тогда получаемая мощность можно выразить
Кинетическая теория плазмы в процессе переноса
Данная теория построена для того чтобы в случаи не сплошной среды решить задачу правильно, при это в данной теории возможен переход.
Основа этой теории заложена в определении функции распределение частиц в некотором объеме с некоторой скорости в некоторый момент времени. (данная функция рассматривалась в ТТСВ, так что тут будет какой то повтор + данные письмена на столько зашифрованы что даже я не могу их восстановить).
![]()
Далее будет рассмотрена задача взаимодействия 2 частиц как-то двигающихся в пространстве. Данная задача преобразуется в более простую заменяя, что одна частица имеет относительную массу с относительной скорости, двигающаяся в некоторое поле в взаимодействия, которой не подвижной. Цель данной задачи насколько отклониться частица от своего первоначального движение. Наименьшее расстояние частицы до центра взаимодействия называют прицельным параметром.
Рассмотрим функцию в термодинамическом равновесии, тогда
А получаемая функция распределения является Максвелла

Проблема заключается в том, что в такой функции нельзя определить теплопроводность и вязкость.
Перейдем не посредственно к плазме. Пускай изучаемый процесс является стационарным, а сила F=qE, и атомы и ионы соответствуют распределению Максвелла.
При проверке порядков было определенно, что , что позволяет нам выкинуть малый член. Пускай искомая функция определяется следящим образом
![]()
Французский ученый Луи де Бройль, осознавая существующую в природе симметрию и развивая представления о двойственной корпускулярно-волновой природе света, выдвинул гипотезу об универсальности корпускулярно-волнового дуализма . Согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики – энергия Е и импульс р , а с другой – волновые характеристики – частота n и длина волны l . Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
Смелость гипотезы де Бройля заключалась именно в том, что соотношение (1) постулировалось не только для фотонов, но и для других микрочастиц, в частности для таких, которые обладают массой покоя. Таким образом, любой частице, обладающей импульсом, сопоставляют волновой процесс с длиной волны, определяемой по формуле де Бройля :
Это соотношение справедливо для любой частицы с импульсом р .
Определим некоторые основные свойства волн де Бройля. Рассмотрим свободно движущуюся со скоростью v частицу массой m . Вычислим для нее фазовую и групповую скорости волн де Бройля. Итак, фазовая скорость:
![]() , (3)
, (3)
где и , – волновое число. Так как c>v , то фазовая скорость волн де Бройля больше скорости света в вакууме.
Групповая скорость: ![]() .
.
Для свободной частицы, согласно теории относительности Эйнштейна, справедливо ![]() , тогда
, тогда
 .
.
Следовательно, групповая скорость волн де Бройля равна скорости частицы.
Согласно двойственной корпускулярно-волновой природе частиц вещества, для описания микрочастиц используются то волновые, то корпускулярные представления. Поэтому приписывать им все свойства частиц и все свойства волн нельзя. Значит, необходимо внести некоторые ограничения в применении к объектам микромира понятий классической механики.
В. Гейзенберг, учитывая волновые свойства микрочастиц и связанные с волновыми свойствами ограничения в их поведении, пришел к выводу, что объект микромира невозможно одновременно с любой наперед заданной точностью характеризовать и координатой и импульсом. Согласно соотношению неопределенностей Гейзенберга , микрочастица (микрообъект) не может иметь одновременно и определенную координату (x, y, z ), и определенную соответствующую проекцию импульса (p x , p y , p z ), причем неопределенности этих величин удовлетворяют условиям
т.е. произведение неопределенностей координаты и соответствующей ей проекции импульса не может быть меньше величины порядка h .
Из соотношения неопределенностей (4) следует, что, например, если микрочастица находится в состоянии с точным значением координаты (Dx =0), то в этом состоянии (Dp x ®¥), и наоборот. Таким образом, для микрочастицы не существует состояний, в которых ее координаты и импульс имели бы одновременно точные значения. Отсюда вытекает и фактическая невозможность одновременно с любой наперед заданной точностью измерить координату и импульс микрообъекта. Так как в классической механике принимается, что измерение координаты и импульса может быть произведено с любой точностью, то соотношение неопределенностей является , таким образом, квантовым ограничением применимости классической механики к микрообъектам .
В квантовой теории рассматривается также соотношение неопределенностей для энергии Е и времени t , т.е. неопределенности этих величин удовлетворяют условию
Подчеркнем, что DЕ – неопределенность энергии некоторого состояния системы, Dt – промежуток времени, в течение которого оно существует. Следовательно, система, имеющая среднее время жизни Dt , не может быть охарактеризована определенным значением энергии; разброс энергии возрастает с уменьшением среднего времени жизни. Из выражения (5) следует, что частота излученного фотона также должна иметь неопределенность , т.е. линии спектра должны характеризоваться частотой, равной . Опыт действительно показывает, что все спектральные линии размыты; измеряя ширину спектральной линии, можно оценить порядок времени существования атома в возбужденном состоянии.
2. Волновая функция и ее свойства
Итак, квантовая механика описывает законы движения и взаимодействия микрочастиц с учетом их волновых свойств. Однако при этом отмечается, что волны де Бройля (микрочастицы) не обладают всеми свойствами электромагнитных волн. Например, электромагнитные волны представляют собой распространяющееся в пространстве электромагнитное поле. Распространение волн де Бройля не связано с распространением в пространстве какого-либо электромагнитного поля. Экспериментально доказано, что равномерно и прямолинейно движущиеся заряженные частицы не излучают электромагнитных волн.
Из опытов по дифракции электронов следует, что в этих экспериментах обнаруживается неодинаковое распределение пучков электронов, отраженных или рассеянных по различным направлениям: в некоторых направлениях наблюдается большее число электронов, чем во всех других. С волновой точки зрения наличие максимумов числа электронов в некоторых направлениях означает, что эти направления соответствуют наибольшей интенсивности волн де Бройля. Другими словами, интенсивность волн в данной точке пространства определяет плотность вероятности попадания электронов в эту точку. Это послужило основанием для своеобразного статистического, вероятностного истолкования волн де Бройля.
Единственное правильное толкование волн материи, позволяющее согласовать между собой описанные факты, это статистическое толкование : интенсивность волны пропорциональна вероятности обнаружить частицу в данном месте. Для того, чтобы описать распределение вероятности нахождения частицы в данный момент времени в некоторой точке пространства, вводят функцию , называемую волновой функцией (или псифункцией). Определяли ее так, чтобы вероятность dW того, что частица находится в элементе объема dV , равнялась произведению и элемента объема dV :
Физический смысл имеет не сама функция Y, а квадрат ее модуля: , где Y * – функция, комплексно сопряженная с Y. Величина имеет смысл плотности вероятности : , т.е. определяет вероятность нахождения частицы в единичном объеме в окрестности точки с координатами x, y, z . Так как пребывание частицы где-либо в пространстве есть достоверное событие и его вероятность должна быть равна единице, то это значит, что волновая функция удовлетворяет условию нормировки вероятностей :
Итак, в квантовой механике состояние микрочастиц описывается принципиально по новому – с помощью волновой функции, которая является основным носителем информации об их корпускулярных и волновых свойствах. Это налагает на волновую функцию ряд ограничительных условий. Функция Y, характеризующая вероятность обнаружения действия микрочастицы в элементе объема, должна быть:
1. конечной (вероятность не может быть больше единицы);
2. однозначной (вероятность не может быть неоднозначной величиной);
3. непрерывной (вероятность не может изменяться скачком).
Волновая функция удовлетворяет принципу суперпозиции : если система может находиться в различных состояниях, описываемых волновыми функциями , то она также может находиться в состоянии Y, описываемом линейной комбинацией этих функций:
где С n (n =1, 2, …) – произвольные, вообще говоря, комплексные числа.
Сложение волновых функций (амплитуд вероятностей), а не вероятностей (определяемых квадратами модулей волновых функций) принципиально отличает квантовую теорию от классической статистической теории, в которой для независимых событий справедлива теорема сложения вероятностей .
Волновая функция, являясь основной характеристикой состояния микрообъектов, позволяет в квантовой механике вычислять средние значения физических величин, характеризующих данный микрообъект:
![]() .
.
где интегрирование ведется по всему бесконечному пространству, как и в случае (7).
3. Уравнение Шредингера.
Статистическое истолкование волн де Бройля и соотношение неопределенностей Гейзенберга привели к выводу, что уравнением движения в квантовой механике, описывающем движение микрочастиц в различных силовых полях, должно быть уравнение, из которого бы вытекали наблюдаемые на опыте волновые свойства частиц. Основное уравнение должно быть уравнением относительно волновой функции , так как именно она, или, точнее, величина , определяет вероятность пребывания частицы в момент времени t в объеме dV , т.е. в области с координатами x и x +dx , y и y +dy , z и z +dz . Так как искомое уравнение должно учитывать волновые свойства частиц, то оно должно быть волновым уравнением.
Основное уравнение нерелятивистской квантовой механики сформулировано в 1926 г. Э. Шредингером. Уравнение Шредингера, как и все основные уравнения физики (например, уравнения Ньютона в классической механике и уравнения Максвелла для электромагнитного поля), не выводится, а постулируется . Правильность этого уравнения подтверждается согласием с опытом получаемых с его помощью результатов, что, в свою очередь, придает ему характер закона природы. Уравнение Шредингера имеет вид:
![]() , (8)
, (8)
где , m
– масса частицы, D – оператор Лапласа ![]() , i
– мнимая единица, – функция потенциальной энергии частицы в силовом поле, в котором она движется, – искомая волновая функция частицы.
, i
– мнимая единица, – функция потенциальной энергии частицы в силовом поле, в котором она движется, – искомая волновая функция частицы.
Уравнение (8) справедливо для любой частицы, движущейся с малой (по сравнению со скоростью света) скоростью, т.е. v<
1) функция Y должна быть конечной , непрерывной и однозначной ;
2) производные ![]() должны быть непрерывны
;
должны быть непрерывны
;
3) функция должна быть интегрируема
, т.е. интеграл ![]() должен быть конечным
.
должен быть конечным
.
Уравнение (8) является общим уравнением Шредингера. Его также называют временным уравнением Шредингера , так как оно содержит производную от функции Y по времени. Однако для большинства физических явлений, происходящих в микромире, уравнение (8) можно упростить, исключив зависимость Y от времени, иными словами найти уравнение Шредингера для стационарных состояний – состояний с фиксированными значениями энергии . Это возможно, если силовое поле, в котором движется частица, стационарно, т.е. функция явно не зависит от времени и имеет смысл потенциальной энергии. В данном случае решение уравнения Шредингера может быть представлено в виде произведения двух функций, одна из которых есть функция только координат, другая – только времени, причем зависимость от времени выражается множителем , так что
где Е – полная энергия частицы, постоянная в случае стационарного поля. Подставляя это в (8), получим
откуда придем к уравнению, определяющему функцию y :
![]() . (9)
. (9)
Уравнение (9) называется уравнением Шредингера для стационарных состояний . В это уравнение в качестве параметра входит полная энергия Е частицы. В теории дифференциальных уравнений доказывается, что подобные уравнения имеют бесчисленное множество решений, из которых посредством наложения граничных условий отбирают решения, имеющие физический смысл. Для уравнения Шредингера такими условиями являются упомянутые выше условия регулярности волновых функций. Таким образом, реальный физический смысл имеют только такие решения, которые выражаются регулярными функциями y . Но регулярные решения имеют место не при любых значениях параметра Е , а лишь при определенном их наборе, характерном для данной задачи. Эти значения энергии называются собственными . Решения же, которые соответствуют собственным значениям энергии, называются собственными функциями . Собственные значения Е могут образовать как непрерывный, так и дискретный ряд. В первом случае говорят о непрерывном , или сплошном , спектре, во втором – о дискретном спектре .
4. Ядерная модель атома.
Общепринятую сегодня ядерную (планетарную) модель атома предложил Э. Резерфорд. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z – порядковый номер элемента в системе Менделеева, е – элементарный заряд), размер 10 -15 -10 -14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10 -10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра вращается Z электронов.
Попытки построить модель атома в рамках классической физики не привели к успеху. Преодоление возникших трудностей потребовало создания качественно новой – квантовой – теории атома. Первая попытка построения такой теории была предпринята Нильсом Бором. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний) : в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состоянием атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющее условию
где m e – масса электрона, v – его скорость по n -ой орбите радиуса r n .
Второй постулат Бора (правило частот) : при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (E n
и E m
– соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При E n
<E m
происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при E n
>E m
– его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот ![]() квантовых переходов определяет линейчатый спектр атома.
квантовых переходов определяет линейчатый спектр атома.
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы He + , Li 2+). Следуя Бору, рассмотрим движение электрона в такой системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение , предложенное Резерфордом, и уравнение (10), получим выражение для радиуса n -й стационарной орбиты:
![]() .
.
Откуда следует, что радиусы орбит растут пропорционально квадратам целых чисел. Для атома водорода (Z =1) радиус первой орбиты электрона при n =1, называемый первым боровским радиусом (а ), равен
![]() ,
,
что соответствует расчетам на основании кинетической теории газов.
Кроме этого, учитывая квантованные для радиуса n -й стационарной орбиты значения, можно показать, что энергия электрона может принимать только следующие дозволенные дискретные значения:
![]() ,
,
где знак минус означает, что электрон находится в связанном состоянии.
5. Атом водорода в квантовой механике.
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия He + , двукратно ионизированного лития Li ++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z =1),
![]() ,
,
где r – расстояние между электроном и ядром.
Состояние электрона в атоме водорода описывается волновой функцией y , удовлетворяющей стационарному уравнению Шредингера (9), учитывающему предыдущее значение потенциальной энергии:
 , (12)
, (12)
где m – масса электрона, Е – полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения (12) обычно используют сферическую систему координат: r , q , j . Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют.
1. Энергия . В теории дифференциальных уравнений доказывается, что уравнения типа (27) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции y , только при собственных значениях энергии
![]() , (13)
, (13)
т.е. для дискретного набора отрицательных значений энергии. Самый нижний уровень Е 1 , отвечающий минимальной возможной энергии, - основной , все остальные (E n >E 1 , n =1, 2, 3, …) – возбужденные . При E <0 движение электрона является связанным , а при E >0 – свободным ; область непрерывного спектра Е >0 соответствует ионизированному атому . Выражение (13) совпадает с формулой, полученной Бором для энергии атома водорода. Однако если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
2. Квантовые числа . В квантовой механике доказывается, что уравнению Шредингера (12) удовлетворяют собственные функции , определяемые тремя квантовыми числами: главным n , орбитальным l и магнитным m l .
Главное квантовое число n , согласно (13), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы:
n =1, 2, 3, …
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется , т.е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
где l – орбитальное квантовое число , которое при заданном n принимает значения l =0, 1, …, (n -1), т.е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнения Шредингера следует также, что вектор L l момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция L lz на направление z внешнего магнитного поля принимает квантованные значения, кратные:
 Рис. 1
Рис. 1
|
где m l – магнитное квантовое число , которое при заданном l может принимать значения m l =0, ±1, ±2, …, ±l , т.е. всего 2l +1 значений. Таким образом, магнитное квантовое число m l определяет проекцию момента импульса электрона на заданное направление , причем вектор момента импульса электрона в атоме может иметь в пространстве 2l +1 ориентаций.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m l характеризует ориентацию электронного облака в пространстве .
3. Спектр . Светящиеся газы дают линейчатые спектры испускания. В соответствии с законом Кирхгофа спектры поглощения газов также имеют линейчатую структуру. Все сериальные формулы спектра водорода могут быть выражены единой формулой, называемой обобщенной формулой Бальмера :
![]() , (16)
, (16)
где R =3,293×10 15 с -1 – постоянная Ридберга , m и n – целые числа, причем для данной серии n =m +1, m +2, m +3 и т.д. Всего различают шесть серий спектральных линий: серия Лаймана (m =1), серия Бальмера (m =2), серия Пашена (m =3), серия Брэкета (m =4), серия Пфунда (m =5), серия Хэмфри (m =6) (рис. 1).
6. Спин электрона. Принцип Паули. Принцип неразличимости
тождественных частиц.
В 1922 г. было обнаружено, что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю (14). Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту, поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т.е. расщепления быть не должно.
Для объяснения этого явления, а также ряда других трудностей в атомной физике было предложено, что электрон обладает собственным неуничтожимым механическим моментом импульса , не связанным с движением электрона в пространстве, – спином . Спин электрона (и всех других частиц) – квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) L s , то ему соответствует собственный магнитный момент. Согласно общим выводам квантовой механики, спин квантуется по закону
![]() ,
,
где s – спиновое квантовое число .
По аналогии с орбитальным моментом импульса, проекция L sz спина квантуется так, что вектор L s может принимать 2s +1 ориентаций. Так как в опытах наблюдались только две ориентации, то 2s +1=2, откуда s =1/2. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, аналогичным (15):
где m s – магнитное спиновое квантовое число ; оно может иметь только два значения: .
Распределение электронов в атоме подчиняется квантово-механическому закону, называемому принципом Паули или принципом исключения . В своей простейшей формулировке он гласит: «В любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: главного n , орбитального l , магнитного m l и спинового m s », т.е. Z(n, l, m l , m s) =0 или 1, где Z(n, l, m l , m s) – число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: n, l, m l , m s . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n , называют электронной оболочкой . В каждой из оболочек электроны распределяются по подоболочкам , соответствующим данному l . Поскольку орбитальное квантовое число принимает значения от 0 до n -1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2l +1).
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлементным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например, электронов. Все электроны имеют одинаковые физические свойства – массу, электрический заряд, спин и другие внутренние характеристики. Такие частицы называются тождественными .
Необычные свойства системы одинаковых тождественных частиц проявляются в фундаментальном принципе квантовой механики – принципе неразличимости тождественных частиц , согласно которому невозможно экспериментально различить тождественные частицы. В классической механике даже одинаковые частицы можно различить по положению в пространстве и импульсам, т.е. классические частицы обладают индивидуальностью.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность () нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, вообще лишен смысла: можно говорить лишь о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми.
7. Квантовые статистики. Вырожденный газ.
Основная задача статистической физики в квантовых статистиках состоит в нахождении функции распределения частиц системы по тем или другим параметрам – координатам, импульсам, энергиям и т.п., а также в отыскании средних значений этих параметров, характеризующих макроскопическое состояние всей системы частиц. Для систем фермионов и бозонов эти задачи решаются единообразно, но несколько различно в связи с тем, что бозоны не подчиняются принципу Паули. В соответствии с этим различаются две квантовые статистики: Ферми-Дирака и Бозе-Эйнштейна, в рамках которых определен вид функции распределения частиц системы по энергиям.
Напомним, что функция распределения по энергиям представляет собой долю от общего числа частиц, которые имеют энергию в интервале значений от W до W+dW :
![]() ,
,
где N – общее число частиц, f(W) – функция распределения по энергиям.
Для системы из n невзаимодействующих фермионов с энергией W (идеальный Ферми-газ) или системы из n невзаимодействующих бозонов с энергией W (идеальный Бозе-газ) были определены похожие функции распределения:
![]() , (17)
, (17)
где k – постоянная Больцмана, Т – термодинамическая температура, m - химический потенциал, представляющий собой изменение энергии системы при изменении на единицу числа частиц системы при изохорном или изоэнтропийном процессе. В рамках статистики Ферми-Дирака в (32) берут знак «+», т.е. в этом случае . Соответственно для Бозе-газа – знак «-» и .
Газ называется вырожденным , если его свойства отличаются от свойств классического идеального газа. В вырожденном газе происходит взаимное квантово-механическое влияние частиц газа, обусловленное неразличимостью тождественных частиц. Поведение фермионов и бозонов различно при вырождении.
Для характеристики степени вырождения газа вводится параметр вырождения А :
Функция распределения с помощью параметра вырождения для обеих квантовых статистик запишется в виде:
 .
.
Если параметр вырождения мал A<<1, то и функция распределения превращается в функцию распределения Максвелла-Больцмана , лежащую в основе классической статистики невырожденного газа:
Температурой вырождения называется температура, ниже которой отчетливо проявляются квантовые свойства идеального газа, обусловленные тождественностью частиц. Сравнительно легко можно грубо оценить температурный критерий вырождения газа. Вырождение обычных газов сказывается при низких температурах. Для фотонного и электронного газа в металлах это не справедливо. Электронный газ в металлах практически всегда вырожден. Только при температурах выше нескольких десятков тысяч градусов электроны металла подчинялись бы классической статистике Максвелла-Больцмана. Но существование металлов в конденсированном состоянии при таких температурах невозможно. Поэтому классическое описание поведения электронов в металлах приводит в электродинамике в ряде случаев к законам, резко противоречащих опыту. В полупроводниках концентрация электронного газа много меньше, чем в металлах. В этих условиях температура вырождения составляет порядка 10 -4 К и электронный газ в полупроводниках является невырожденным и подчиняется классической статистике. Примером вырожденного газа служит фотонный газ. Так как масса фотона равна нулю, то температура вырождения стремится к бесконечности. Фотонный газ при любой температуре является вырожденным. Атомные и молекулярные газы имеют весьма малые температуры вырождения. Например, для водорода при нормальных условиях температура вырождения составляет около 1 К. Для остальных газов, более тяжелых, чем водород, она еще меньше. Газы при нормальных условиях не бывают вырождены. Вырождение, связанное с квантовыми свойствами газов, проявляется значительно меньше, чем отклонение газов от идеальности, вызванное межмолекулярными взаимодействиями.
Максимальная энергия, которую могут иметь электроны проводимости в кристалле при 0 К называется энергией Ферми и обозначается E F . Наивысший энергетический уровень, занятый электронами, называется уровнем Ферми . Уровню Ферми соответствует энергия Ферми, которую имеют электроны на этом уровне. Уровень Ферми, очевидно, будет тем выше, чем больше плотность электронного газа. Работу выхода электрона из металла нужно отсчитывать от уровня Ферми, т.е. от верхнего из занятых электронами энергетических уровней.
8. Понятие о зонной теории твердых тел.
Используя уравнение Шредингера, в принципе можно рассмотреть задачу о кристалле, например найти возможные значения его энергии, а также соответствующие энергетические состояния. Однако как в классической, так и в квантовой механике отсутствуют методы точного решения такой задачи для случая многих частиц. Поэтому эта задача решается приближенно сведением задачи многих частиц к одноэлектронной задаче об одном электроне, движущемся в заданном внешнем поле. Подобный путь приводит к зонной теории твердого тела .
 Рис. 2
Рис. 2
|
Пока атомы изолированы, т.е. находятся друг от друга на макроскопических расстояниях, они имеют совпадающие схемы энергетических уровней. При образовании кристаллической решетки, т.е. при сближении атомов до межатомных расстояний решетки, взаимодействие между атомами приводит к тому, что энергетические уровни атомов смещаются, расщепляются и расширяются в зоны, образуя зонный энергетический спектр . На рис. 2 показано расщепление энергетических уровней в зависимости от расстояния между атомами. Видно, что заметно расщепляются и расширяются лишь уровни внешних, валентных электронов, наиболее слабо связанных с ядром и имеющих наибольшую энергию, а также более высокие уровни, которые в основном состоянии атома вообще электронами не заняты. Уровни же внутренних электронов либо совсем не расщепляются, либо расщепляются слабо. Таким образом, в твердых телах внутренние электроны ведут себя так же, как в изолированных атомах, валентные же электроны «коллективизированы» – принадлежат всему твердому телу.
Энергия внешних электронов может принимать значения в пределах закрашенных на рис. 2 областей, называемых разрешенными энергетическими уровнями . Каждая разрешенная зона «вмещает» в себя столько близлежащих дискретных уровней, сколько атомов содержит кристалл: чем больше в кристалле атомов, тем теснее расположены уровни в зоне. Расстояние между соседними энергетическими уровнями столь ничтожно (порядка 10 -22 эВ), что зоны можно считать практически непрерывными, однако факт конечного числа уровней в зоне играет важную роль для распределения электронов по состояниям. Разрешенные энергетические зоны разделены зонами запрещенных значений энергий, называемыми запрещенными энергетическими зонами . В них электроны находиться не могут. Ширина зон (разрешенных и запрещенных) не зависит от размера кристалла. Разрешенные зоны тем шире, чем слабее связь валентных электронов с атомами.
Зонная теория твердых тел позволила с единой точки зрения истолковать существование металлов, диэлектриков и полупроводников, объясняя различие в их электрических свойствах, во-первых, неодинаковым заполнением электронами разрешенных зон и, во-вторых, шириной запрещенных зон. Степень заполнения электронами энергетических уровней в зоне определяется заполнением соответствующих атомных уровней. В общем случае можно говорить о валентной зоне , которая полностью заполнена электронами и образована из энергетических уровней внутренних электронов свободных атомов, и о зоне проводимости (свободной зоне) , которая либо частично заполнена электронами, либо свободна и образована из энергетических уровней внешних «коллективизированных» электронов изолированных атомов. В зависимости от степени заполнения зон электронами и ширины запрещенной зоны возможны четыре случая (рис. 3).

На рис. 3, а самая верхняя зона, содержащая электроны, заполнена лишь частично, т.е. в ней имеются вакантные уровни. В данном случае электрон, получив сколь угодно малую энергетическую «добавку» (например, за счет теплового движения или электрического поля), сможет перейти на более высокий энергетический уровень той же зоны,