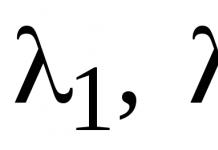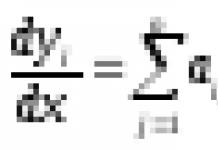Живой организм, обладающий уникальной структурной организацией обеспечивающей его фенотипические признаки и биологические функции, в своем структурно-функциональном единстве опирается на белковые тела (белки). Это философско-теоретическое представление, основанное на сравнительно небольших достижениях естествознания своего периода, было выдвинуто Ф.Энгельсом, который в своих трудах отмечал, что "Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, не находящееся в процессе разложения, мы без исключения встречаем и явления жизни" (цит. Энгельс Ф. Анти-дюринг. 1950, с.77).
Развитие представлений о белковых веществах
Представление о белках, как о классе соединений, формировалось в XVIII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, хрусталик глаза, кровь, молоко и т. п.) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие, клейкие растворы, свертывались при нагревании, при их высушивании получалась роговидная масса, при "анализе огнем" ощущался запах паленой шерсти или рога и выделялся аммиак. Беккари, выделивший в 1728 году первое белковое вещество из пшеничной муки, назвал его "клейковиной". Он же показал его сходство с продуктами животного происхождения, а поскольку все эти сходные свойства были известны для яичного белка, то новый класс веществ получил название белков.
Важную роль в изучении структуры белков сыграло развитие методов их разложения кислотами и пищеварительными соками. В 1820 г. А. Браконно (Франция) подвергал многочасовому действию серной кислоты кожу и другие ткани животных, затем нейтрализовал смесь, получал фильтрат, при выпаривании которого выпадали кристаллы вещества, названного им гликоколом ("клеевым сахаром"). Это была первая аминокислота, выделенная из белков. Ее структурная формула установлена в 1846 г.
В 1838 г., после систематического изучения элементарного состава разных белков, в которых были обнаружены углерод, водород, азот, кислород, сера и фосфор, голландский химик и врач Г. Я. Мульдер (1802-1880) предложил первую теорию строения белков - теорию протеина. Исходя из исследований элементного состава, Мульдер пришел к выводу, что все белки содержат одну или несколько групп ("радикалов") С 40 Н 62 N 10 O 2 , соединенных с серой или фосфором или с тем и другим вместе. Он предложил для обозначения этой группы термин "протеин" (от греч. protos - первый, важнейший), так как считал, что это вещество "без сомнения, важнейшее из всех известных тел органического царства, и без него, как кажется, не может быть жизни на нашей планете" (Цит. по кн.: Шамин А. Н. История химии белка. М.: Наука, 1977. С. 80.). Представление о существовании такой группы скоро было опровергнуто, а значение термина "протеины" изменилось, и сейчас он применяется как синоним термина "белки".
Дальнейшие исследования позволили к концу XIX в. выделить из белков свыше десятка аминокислот. Исходя из результатов изучения продуктов гидролиза белков А.Я. Данилевский первым предположил существование в белках связей -NН-СО-, как в биурете и в 1888 году выдвинул гипотезу строения белка, получившую название "теории элементарных рядов", а немецкий химик Э. Фишер, совместно с Гофмейстером, получившим в 1890 г. кристаллический белок - яичный альбумин, предложил в 1902 г. пептидную теорию строения белков.
В результате работ Э. Фишера стало ясно, что белки представляют собой линейные полимеры аминокислот, соединенных друг с другом амидной (пептидной) связью, а все многообразие представителей этого класса соединений могло быть объяснено различиями аминокислотного состава и порядка чередования разных аминокислот в цепи полимера. Однако эта точка зрения не сразу получила всеобщее признание: еще в течение трех десятилетий появлялись иные теории строения белков, в частности такие, которые основывались на представлении, что аминокислоты не являются структурными элементами белков, а образуются как вторичные продукты при разложении белков в присутствии кислот или щелочей.
Дальнейшие исследования были направленные на определение молекулярной массы белков с использованием ультрацентрифуги, сконструированной в 1925-1930 гг. Сенгером и получения белков в кристаллическом виде, являющимся надежным доказательством чистоты (гомогенности) препарата. В частности, в 1926 г. Д. Самнер выделил из семян канавалии белок (фермент) уреазу в кристаллическом состоянии; Д. Нортроп и М. Кунитц в 1930-1931 гг. получили кристаллы пепсина и трипсина.
В 1951 г. Полинг и Кори разработали модель вторичной структуры белка, названной альфа-спиралью. В 1952 г. Линдерстрём-Ланг предположил существование трех уровней организации белковой молекулы: первичный, вторичный, третичный. В 1953 г. Сенгер впервые расшифровал последовательность аминокислот в инсулине. В 1956 г. Мур и Стейн создали первый автоматический анализатор аминокислот. В 1958 г. Кендрью и в 1959 г. Перутц расшифровали трехмерные структуры белков - миоглобина и гемоглобина. В 1963 г. Цан синтезировал природный белок инсулин.
Таким образом, широко известное положение о природе жизни: "Жизнь есть способ существования белковых тел", сформулированное Ф. Энгельсом постепенно получало достоверное научное подтверждение.
| Таблица 1. Содержание белков в органах и тканях человека | |||||
| Органы и ткани | Содержание белков, % | Органы и ткани | Содержание белков, % | ||
| от массы сухой ткани | от общего белка тела | от массы сухой ткани | от общего белка тела | ||
| Кожа | 63 | 11,5 | Селезенка | 84 | 0,2 |
| Кости (твердые ткани) | 20 | 18,7 | Почки | 72 | 0,5 |
| Зубы (твердые ткани) | 18 | 0,1 | Поджелудочная железа | 47 | 0,1 |
| Поперечнополосатые мышцы | 80 | 34,7 | Пищеварительный тракт | 63 | 1,8 |
| Мозг и нервная ткань | 45 | 2,0 | Жировая ткань | 14 | 6,4 |
| Печень | 57 | 3,6 | Остальные жидкие ткани: | 85 | 1,4 |
| Сердце | 60 | 0,7 | Остальные плотные ткани | 54 | 14,6 |
| Легкие | 82 | 3,7 | Все тело | 45 | 100 |
В настоящее время абсолютно достоверно установлено, что белки (белковые вещества) составляют основу и структуры и функции всех живых организмов, для которых характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и в пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение - непременные атрибуты живых систем - имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т. е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков - ферментов.
По образному выражению одного из основоположников молекулярной биологии Ф. Крика, белки важны прежде всего потому, что они могут выполнять самые разнообразные функции, причем с необыкновенной легкостью и изяществом. Подсчитано, что в природе встречается примерно 10 10 -10 12 различных белков, обеспечивающих существование около 10 6 видов живых организмов различной сложности организации, начиная от вирусов и кончая человеком. Из этого огромного количества природных белков известны точное строение и структура ничтожно малой части - не более 2500. Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде надмолекулярных и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
В клетке Е.coli содержится около 3000 различных белков, а в организме человека насчитывается свыше 50000 разнообразных белков. Самое удивительное, что все природные белки состоят из большого числа сравнительно простых структурных блоков, представленных мономерными молекулами - аминокислотами, связанными друг с другом в полипептидные цепи. Природные белки построены из 20 различных аминокислот. Поскольку эти аминокислоты могут объединяться в самой разной последовательности, то они могут образовать громадное количество разнообразных белков. Число изомеров, которое можно получить при всевозможных перестановках указанного числа аминокислот в полипептиде исчисляется огромными величинами. Так, если из двух аминокислот возможно образование только двух изомеров, то уже из четырех аминокислот теоретически возможно образование 24 изомеров, а из 20 аминокислот - 2,4 x 10 18 разнообразных белков.
Нетрудно предвидеть, что при увеличении числа повторяющихся аминокислотных остатков в белковой молекуле число возможных изомеров возрастает до астрономических величин. Ясно, что природа не может позволить случайных сочетаний аминокислотных последовательностей, и для каждого вида характерен свой специфический набор белков, определяемый, как теперь известно, наследственной информацией, закодированной в молекуле ДНК живых организмов. Именно информация, содержащаяся в линейной последовательности нуклеотидов ДНК, определяет линейную последовательность аминокислот в полипептидной цепи синтезируемого белка. Образовавшаяся линейная полипептидная цепь сама теперь оказывается наделенной функциональной информацией, в соответствии с которой она самопроизвольно преобразуется в определенную стабильную трехмерную структуру. Таким образом, лабильная полипептидная цепь складывается, скручивается в пространственную структуру белковой молекулы, причем не хаотично, а в строгом соответствии с информацией, содержащейся в аминокислотной последовательности.
Наиболее богаты белковыми веществами ткани и органы человека и животных. Большинство этих белков хорошо растворимы в воде. Однако некоторые органические вещества, выделенные из хряща, волос, ногтей, рогов, костной ткани - нерастворимые в воде - также были отнесены к белкам, поскольку по своему химическому составу оказались близки к белкам мышечной ткани, сыворотки крови, яйца. Количественное содержание белков в различных тканях и органах человека приведено в табл. 1.1. В мышцах, легких, селезенке, почках на долю белков приходится более 70-80% сухой массы, а во всем теле человека до 45-50 % сухой массы.
Источником белка являются также микроорганизмы и растения. В отличие от животных тканей в растениях содержится значительно меньше белков (табл. 2).
Распределение белков между субклеточными структурами неравномерно: больше всего их в клеточном соке (гиалоплазме) (таб. 3). Содержание белков в органеллах определяется скорее размерами и количеством органелл в клетке.
Для изучения химического состава, строения и свойств белков их обычно выделяют или из жидких тканей, или из богатых белками органов животных, например сыворотки крови, молока, мышц, печени, кожи, волос, шерсти.
Белок и его характерные признаки
Элементный состав белков (таб. 4.) в пересчете на сухое вещество представлен 50-54% углерода, 21-23% кислорода, 6,5-7,3% водорода, 15-17% азота, 0,3-2,5 серы и до 0,5% зола. В составе некоторых белков открываются также в небольших количествах фосфор, железо, марганец, магний, йод и др.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по количеству белкового азота: массу азота, найденную при анализе, умножают на коэффициент 6,25 (100: 16 = 6,25). Но для некоторых белков этот признак нетипичен. Например, в протаминах содержание азота достигает 30%, поэтому только по элементному составу нельзя точно отличить белок от других азотсодержащих веществ организма.
Таким образом, учитывая элементарный состав, белками называют высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей, и имеющие сложную структурную организацию. Это определение объединяет характерные признаки белков, среди которых можно выделить следующие:
- довольно постоянная доля азота (в среднем 16% от сухой массы);
- наличие постоянных структурных звеньев - аминокислот;
- пептидные связи между аминокислотами, с помощью которых они соединяются в полипептидные цепи;
- большая молекулярная масса (от 4-5 тысяч до нескольких миллионов дальтон);
- сложная структурная организация полипептидной цепи, определяющая физико-химические и биологические свойства белков.
Структурные звенья, или мономеры, белков можно обнаружить после гидролиза: кислотного (HCl), щелочного (Ba(OH) 2) или/и реже ферментативного. Этот прием наиболее часто используют для изучения состава белков. Установлено, что при гидролизе чистого белка, не содержащего примесей, освобождается до 20 различных α-аминокислот L-ряда, которые являются мономерами белков. В белках аминокислоты соединяются в цепь ковалентными пептидными связями.
α-аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (-NH 2), например:
Молекулярная масса белков . Важнейшим признаком белков является большая молекулярная масса. В зависимости от длины цепи все полипептиды условно можно разделить на пептиды (содержат от 2 до 10 аминокислот), полипептиды (от 10 до 40 аминокислот) и белки (свыше 40 аминокислот). Если принять среднюю молекулярную массу одной аминокислоты около 100, то молекулярная масса пептидов приближается к 1000, полипептидов - до 4000, а белков - от 4-5 тыс. до нескольких миллионов (таб. 5.)
Сложная структурная организация белков . Некоторые природные полипептиды (состоящие, как правило, из одной аминокислоты) и искусственно полученные полипептиды имеют большую молекулярную массу, но отнести их к белкам нельзя. Отличить их от белков помогает такой уникальный признак, как способность белков к денатурации, т. е. потеря характерных физико-химических свойств и, главное, биологических функций, при действии веществ, не разрывающих пептидные связи. Способность к денатурации свидетельствует о сложной пространственной организации белковой молекулы, отсутствующей у обычных полипептидов.
| Страница 1 | всего страниц: 7 |
Белки - природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Строение белка.
У белков существует 4 уровня строения:
- первичная структура белка - линейная последовательность аминокислот в полипептидной цепи, свернутых в пространстве:
- вторичная структура белка - конформация полипептидной цепи, т.к. скручивание в пространстве за счет водородных связей между NH и СО группами. Есть 2 способа укладки: α -спираль и β - структура.
- третичная структура белка - это трехмерное представление закрученной α -спираль или β -структуры в пространстве:

Эта структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками. В образовании такой структуры участвуют противоположно заряженные ионы.
- четвертичная структура белка образуется за счет взаимодействия между разными полипептидными цепями:

Синтез белка.
В основе синтеза лежит твердофазный метод, в котором первая аминокислота закрепляется на полимерном носителе, а к ней последовательно подшиваются новые аминокислоты. После полимер отделяют от полипептидной цепи.
Физические свойства белка.
Физические свойства белка определяются строением, поэтому белки делят на глобулярные (растворимые в воде) и фибриллярные (нерастворимые в воде).
Химические свойства белков.
1. Денатурация белка (разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации - свертывание яичных белков при варке яиц.
2. Гидролиз белков - необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция - взаимодействие пептидной связи и солей меди (II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция - при реакции с азотной кислотой наблюдается желтое окрашивание.
Биологическое значение белка.
1. Белки - строительный материал, из него построены мышцы, кости, ткани.
2. Белки - рецепторы. Передают и воспринимают сигнал, поступающих от соседних клеток из окружающей среды.
3. Белки играют важную роль в иммунной системе организма.
4. Белки выполняют транспортные функции и переносят молекулы или ионы в место синтеза или накопления. (Гемоглобин переносит кислород к тканям.)
5. Белки - катализаторы - ферменты. Это очень мощные селективные катализаторы, которые ускоряют реакции в миллионы раз.
Есть ряд аминокислот, которые не могут синтезироваться в организме - незаменимые , их получают только с пищей: тизин, фенилаланин, метинин, валин, лейцин, триптофан, изолейцин, треонин.
Согласно новой рецензии, опубликованной на сайте Applied Physiology, Nutrition and Metabolism , важно не только количество потребляемого белка, но и его источник. Есть целых три причины заботиться об этом.
Прежде всего, любой источник белка, будь то курица или арахис, содержит разное количество аминокислот - строительного материала для белков. Из 20 возможных аминокислот девять просто необходимы организму. Эти аминокислоты вы можете получить только из пищи. Так что очень важно правильно , включив в него разные продукты, богатые белком.
Продукты животного происхождения (мясо, яйца, молочные продукты) включают все необходимые аминокислоты в том или ином количестве, но большинство продуктов растительного происхождения содержат только фракции девяти необходимых аминокислот.
«Это значит, что если вы решили получать белок только из орехов, то организм будет лишён важных аминокислот», - объясняет соавтор исследования Райавель Иланго (Rajavel Elango), специалист по питанию и метаболизму.
Когда вы получаете белок из продуктов растительного происхождения, важно правильно подобрать их разновидности и количество, чтобы получить полную дневную норму необходимых аминокислот.
Конечно, это не повод отказываться от своих пищевых предпочтений и получать белки только из , поедая их на завтрак, обед и ужин. Такой рацион, помимо белка, включает большое количество калорий, жира и холестерина, что негативно сказывается на вашей фигуре и здоровье в целом. И это вторая причина следить за тем, какие продукты вы выбираете для насыщения организма белком.
И, наконец, третья причина - самая важная. «Каждый продукт, который служит для вас источником белка, включает определённое количество витаминов и минералов, - утверждает Иланго. - Некоторые продукты богаты витамином B, другие - железом, в третьих вообще практически нет полезных веществ».
Ваш организм не сможет усвоить полученный белок с максимальной пользой при недостатке важных питательных веществ.
Хотите убедиться в том, что получаете белок из правильных продуктов? Вот несколько самых полезных источников белка.
Яйца
liz west/Flickr.com«Мало того, что в каждом яйце содержится по 6 г белка, это ещё и наиболее полезный белок», - утверждает Бонни Тауб-Дикс (Bonnie Taub-Dix), американский диетолог, блогер и автор книги «Прочитайте, прежде чем съесть».
Белок, получаемый из яиц, имеет самую высокую усвояемость и помогает формировать ткани организма. Кроме того, яйца богаты холином и витаминами B 12 и D - веществами, важными для поддержания общего уровня энергии и её запаса в клетках организма.
Несмотря на распространённое мнение о том, что холестерин из яиц негативно влияет на работу сердца, вследствие чего можно употреблять этот продукт не чаще 2–3 раз в неделю, учёные доказали обратное. По результатам исследования, опубликованного в British Medical Journal, было установлено, что одно яйцо в день не влияет на работу сердца и не увеличивает риск инсульта.
Творог
«В одной порции творога (150 г) содержится около 25 г белка и 18% дневной нормы кальция», - говорит диетолог Джим Уайт (Jim White). Кроме того, творог богат казеином, медленно усваиваемым белком, который блокирует чувство голода на несколько часов.
Курица
 James/Flickr.com
James/Flickr.com
Птица должна быть основой белковой диеты. Она содержит меньше насыщенных жиров, чем большинство других видов мяса, и около 40 г белка в одной грудке (20 г белка на 100 г мяса). Иланго советует делать выбор в пользу белого мяса так часто, как можете, чтобы потреблять меньше калорий.
Цельное зерно
Цельнозерновые продукты полезны для здоровья и включают в себя гораздо больше белка, чем продукты из обычной муки. Например, хлеб из пшеничной муки первого сорта содержит 7 г белка, а цельнозерновой хлеб - 9 г белка на 100 г продукта.
Что более важно, цельнозерновые продукты обеспечивают организм клетчаткой, полезны для сердца и помогают контролировать вес.
Рыба
 James Bowe/Flickr.com
James Bowe/Flickr.com
«Рыба с низким содержанием калорий и множеством питательных веществ - это отличный источник жирных кислот омега-3, которые обеспечивают здоровье сердца и стабилизируют настроение», - утверждает Тауб-Дикс.
Среди самых полезных рыб - лосось и тунец. В одной порции лосося содержится около 20 г белка и 6,5 г ненасыщенных жирных кислот. А тунец - это настоящий кладезь белка: 25 г на 100 г продукта.
Если вы хотите избавиться от лишнего жира в организме, также стоит включить в свой рацион блюда из лосося: он содержит только 10–12 г жиров, насыщенных и ненасыщенных. Диетологи советуют есть рыбу дважды в неделю в запечённом или жареном виде.
Бобовые
 cookbookman17/Flickr.com
cookbookman17/Flickr.com
Греческий (фильтрованный) йогурт
Греческий йогурт может послужить завтраком, лёгкой закуской или ингредиентом для разных блюд. По сравнению с обычным йогуртом, в греческом почти в два раза больше белка: вместо 5–10 г в одной порции йогурта - 13–20 г. Кроме того, в греческом йогурте довольно много кальция: 20% от дневной нормы.
Орехи
 Adam Wyles/Flickr.com
Adam Wyles/Flickr.com
Орехи известны как продукт, богатый полезными ненасыщенными жирными кислотами, однако в них также содержится много белка. Кроме того, как показало исследование, опубликованное в 2013 году в New England Journal of Medicine, люди, съедающие горсть орехов в день, на 20% меньше подвержены риску смерти от разных недугов.
Зелень
 Jason Bachman/Flickr.com
Jason Bachman/Flickr.com
Разные виды зелени и зелёных листовых овощей богаты белком. Например, в 100 г шпината содержится всего 22 ккал и около 3 г белка, а в петрушке - 47 ккал и 3,7 г белка. Несмотря на то что в зелени недостаточно необходимых аминокислот, вы можете комбинировать её с бобовыми и получать достаточно белка и полезных веществ.
А какие продукты, богатые белком, предпочитаете вы?
Тема: Белки - природные биополимеры
“Меняя каждый миг свой образ прихотливый,
капризна, как дитя, и призрачна, как дым,
кипит повсюду жизнь в тревоге суетливой,
великое смешав с ничтожным и смешным…”
С.Я. Надсон
| Методическая информация |
||||||||||||||||||||||||||||||
| Тип занятия | Интегрированный (биология + химия) проблемно-исследовательский мультимедиа урок |
|||||||||||||||||||||||||||||
| Формировать у обучающихся представление о свойствах и функциях белков в клетке и организме |
||||||||||||||||||||||||||||||
| Обучающие: дать понятие о белках - природных биополимерах, их многообразных функциях, химических свойствах белков; формировать знания об уникальных особенностях строения белков; углубить знания о взаимосвязи строения и функции веществ на примере белков; учить обучающихся, использованию знаний смежных предметов для получения более полной картины мира. Развивающие: развитие познавательного интереса, установление межпредметных связей; совершенствовать умения анализировать, сравнивать, устанавливать взаимосвязь между строением и свойствами. Воспитательные: показать материальное единство органического мира; формирование научного мировоззрения; |
||||||||||||||||||||||||||||||
| Метод проблемного изложения, частично-поисковый, эвристический, исследовательский |
||||||||||||||||||||||||||||||
| Функция преподавателя: | Управляющий поисковой работой обучающихся, консультант |
|||||||||||||||||||||||||||||
| Знания, умения, навыки и компетенции, которые обучающиеся актуализируют, приобретут, закрепят в ходе занятия: | Формируются такие мыслительные операции, как: сравнение свойств белка, классификация структур белковой молекулы, сравнительный анализ функций белка. Основные понятия: Аминокислоты, пептидная связь, полипептид, структура белка, функции белка, свойства белка, денатурация. Основные навыки: Работа с химическим оборудованием, работа по выявлению активности каталазы |
|||||||||||||||||||||||||||||
| Необходимое оборудование и материалы: | Компьютер, презентация по теме урока. Эксперимент: пробирки, штативы, спиртовка, держатель. Реактивы и материалы: р-р Белка куриного яйца, азотная кислота, р-р сульфата меди(II), щелочь, раствор 3% перекиси водорода, сырой и вареный картофель или мясо. |
|||||||||||||||||||||||||||||
| Ведущий тип деятельности: | Продуктивный, творческий, проблемный |
|||||||||||||||||||||||||||||
| Технологическая карта занятия |
||||||||||||||||||||||||||||||
| Мотивация: | Как изучение этой темы может вам помочь в вашей будущей профессии? |
|||||||||||||||||||||||||||||
| Ход занятия: |
||||||||||||||||||||||||||||||
| “Белки, жиры и углеводы, |
||||||||||||||||||||||||||||||
| Актуализация знаний | А знаете ли Вы: 8. Как появилась жизнь на Земле? Что лежит в основе жизни? Вот сегодня мы об этом и будем вести речь. План занятия: Определение. Функции белков. Состав и строение белков. Структура белков. Химические свойства белков. 6. Превращение белков в организме. |
|||||||||||||||||||||||||||||
| Как строение белка может быть связано с его свойствами и функциями? Гипотеза: Примеры белков История открытия: Состав белков Определение | Понять, каким образом белки осуществляют перечисленные выше многообразные функции, непросто. Единственный способ приблизиться к решению этой задачи - узнать, из чего построен белок, как расположены структурные элементы, составляющие его молекулу, по отношению друг к другу и в пространстве, как они взаимодействуют друг с другом и веществами внешней среды, т.е. изучить строение и свойства белков. |
|||||||||||||||||||||||||||||
| Раскрыть причинно- следственную зависимость: функции - строение. белки - полимеры, мономеры - аминокислоты |
||||||||||||||||||||||||||||||
| Назовите известные вам белки, укажите их местонахождение? глобулин - вакцина, родопсин - зрительный пурпур, В середине 19 века положено начало изучения белков, но только через 100 лет учёные систематизировали белки, определи их состав, а также сделали вывод, что белки - это главный компонент живых организмов. А.Я. Данилевский - наличие в белке пептидной связи Э.Фишер - синтезировал соединения белка Химический состав белка может быть представлен следующими данными: С -55%, О - 24%, Н - 7,3%, N - 19%, S -2,4%. На долю белков приходится более 50% общей массы органических соединений животной клетки: в мышцах - 80%, в коже - 63%, в печени - 57%, в мозге - 45%, в костях -28% Химические формулы некоторых белков : Пенициллин С16Н18О4N2 Казеин С1864Н3021О576N468 S2 Гемоглобин С3032Н4816 О872N780S8Fе4 - Давайте дадим определение термину БЕЛОК БЕЛКИ - биополимеры нерегулярного строения, мономерами которого являются 20 аминокислот разных типов. В химический состав аминокислот входят: С, О, Н, N, S. Белковые молекулы могут образовывать четыре простраственные структуры и выполняют в клетке и организме целый ряд функций: строительную, каталитическую, регуляторную, двигательную, транспортную |
||||||||||||||||||||||||||||||
| Функции белков | - Белки - основа живого на Земле, входят в состав кожи, мышечной и нервной ткани, волос, сухожилий, стенок сосудов животных и человека; это строительный материал клетки. Роль белков трудно переоценить, т.о. жизнь на нашей планете действительно можно рассматривать как способ существования белковых тел, осуществляющих обменом веществ и энергией с внешней средой. Поскольку белок содержит разнообразные функциональные группы, он не может быть отнесен к какому-нибудь из ранее изученных классов соединений. В нем как в фокусе сочетаются признаки соединений, относящихся к различным классам. Отсюда его многообразие. Это в сочетании с особенностями его структуры и характеризует белок как высшую форму развития вещества. |
|||||||||||||||||||||||||||||
| Структура белка | Составить конспект и ответить в процессе беседы на вопросы: Остатки каких аминокислот входят в состав молекул белка? (см.прил.) За счёт каких функциональных групп аминокислот происходит соединение их друг с другом? Что понимают под «первичной» структурой белка? Что представляет собой «вторичная» структура белка? Какие связи её удерживают? Что такое «третичная» структура? За счет, каких связей она образуется? В чем особенность четвертичной структуры? (В виде линейной последовательности аминокислот)
-Что собой представляет первичная структура белка? Какие связи стабилизируют вторичную структуру? (Пространственная конфигурация белковой молекулы свернутые в виде спирали. В формировании спиральной конфигурации полипептидной цепи играют роль водородные связи между -С=О и -N-H группами.. )
- Что собой представляет третичная структура белка ? (Э то конфигурация в виде закрученной вспираль полипептидной цепи. Она поддерживается взаимодействием разных функциональных групп полипептидной цепи. Так, между атомами серы образуется дисульфидный мостик, между карбоксильной и гидроксильной группами имеется сложноэфирный мостик, а между карбоксильной и аминогруппами может возникнуть солевой мостик. Для этой структуры характерны и водородные связи).
- Что собой представляет четвертичная структура белка? (Некоторые белковые макромолекулы могут соединяться друг с другом и образовывать относительно крупные агрегаты- макромолекулы белка).
Какие химические свойства будут характерны для белков? (Амфотерность связана с наличием в молекуле белка катионообразующих групп - аминогрупп и анионообразующих - карбоксильных группу. Знак заряда молекулы зависит от количества свободных групп. Если преобладают карбоксильные группы, то заряд молекулы - отрицательный (проявляются свойства слабой кислоты), еслиаминогруппы - то положительный (основные свойства)).
|
|||||||||||||||||||||||||||||
| Химические свойства белков | Для белков характерны реакции, в результате которых выпадает осадок. Но в одних случаях полученный осадок при избытке воды растворяется, а в других - происходит необратимое свертывание белков, т.е. денатурация. Происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы под влиянием внешних факторов: температура, действия химических реагентов, механического воздействия. При денатурации изменяются физические свойства белка, снижается растворимость, теряется биологическая активность К чему может привести денатурация? Нарушение антигенной чувствительности белка; Блокирование ряда иммунологических реакций; Нарушение обмена веществ; Воспаление слизистой оболочки ряда органов пищеварения (гастриты, колит); Камнеобразование (камни имеют белковую основу). Также для белков характерны: Свертывание белков при нагревании Осаждение белков солями тяжелых металлов и спиртом Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев. Белки подвергаются гниению (под действием гнилостных бактерий), при этом образуются метан (CH4), сероводород (H2S), аммиак (NH3), вода и другие низкомолекулярные продукты. Амфотерность Строение АК в общем виде: NH2-CH- COOH, где R - углеводородный радикал. СООН - карбоксильная группа / кислотные свойства/. NН2 - аминогруппа / основные свойства/. Процесс восстановления структуры белка называется ренатурацией Превращения белков в организме. Белки пищи → полипептиды → α-аминокислоты → белки организма |
|||||||||||||||||||||||||||||
| Как ведет себя белок по отношению к воде? |
|
|||||||||||||||||||||||||||||
| Гидролиз | Гидролиз белка - разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию α- аминокислот, из которых он был составлен.
Белки - Альбумозы - Дипептиды - Аминокислоты |
|||||||||||||||||||||||||||||
| Качественные, цветные реакции на белок | Ксантопротеиновая реакция - реакция на ароматические циклы. Белок + HNO3(к) → белый осадок → желтая окраска → оранжевая окраска + NH3 Как с помощью ксантопротеиновой реакции можно отличить натуральные шерстяные нитки от искусственных? |
|||||||||||||||||||||||||||||
| Биуретовая реакция - реакция на пептидные связи. Белок + Cu(OH)2 → фиолетовая окраска раствора Можно ли с помощью химии решить проблему дефицита белковой пищи? Должна медленно появиться розово-фиолетовая или пурпурная окраска. Это реакция на пептидные связи в соединениях. В присутствии разбавленного раствора Си в щелочной среде атомы азота пептидной цепи образуют окрашенный в пурпурный цвет комплекс с ионами меди (II). Биурет (производное мочевины) тоже содержит группу CONH - и поэтому дает эту реакцию. |
||||||||||||||||||||||||||||||
| Функции белка |
|
|||||||||||||||||||||||||||||
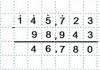
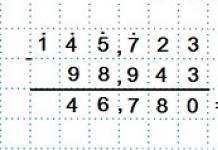
| Один стакан цельного молока содержит 288 мг кальция. Сколько нужно выпивать в день молока для снабжения вашего организма достаточным количеством этого элемента? Суточная потребность 800 мг Са. (Ответ. Для удовлетворения суточной потребности в кальции взрослый мужчина должен выпивать в день 2,7 стакана молока: 800 мг Са*(1 стакан молока/ 288 Са) = 2,7 стакана молока). В куске белого пшеничного хлеба 0,8 мг железа. Сколько кусков нужно съедать в день для удовлетворения суточной потребности в этом элементе. (Суточная потребность в железе 18 мг). (Ответ. 22,5 кусочка) 18 мг.: 0,8= 22,5 |
||||||||||||||||||||||||||||||
| Закрепление изученного материала Игра «Подними руку, если согласен» | Сейчас вы будете выполнять задание по изученной теме в виде теста. (Во время проверки обучающиеся меняются своими работами и оценивают работу соседа. Варианты правильных ответов на доске. По окончании проверки каждый выставляет оценку соседу) - Какая структура является самой прочной? Почему?
-Как можно с помощью проволоки, бус показать образование вторичной, третичной, четвертичной структур белка . За счет каких связей, взаимодействий это происходит? А теперь с помощью теста проверим, как вы усвоили материал. На ответ «Да» поднимаете руку. 1. В состав белков входят аминокислоты, прочно связанные между собой водородными связями (Нет) 2. Пептидной называют связь между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты. (Да) 3. Белки составляют основную часть органических веществ клетки. (Да) 4.Белок - мономер. (Нет) 5. Продукт гидролиза пептидных связей - вода. (Нет) 6. Продукты гидролиза пептидных связей - аминокислоты. (Да) 7. Белок - макромолекула. (Да) 8. Катализаторы клетки - это белки. (Да) 9. Существуют белки, переносящие кислород и углекислый газ. (Да) 10. Иммунитет не связан с белками. (Нет) |
|||||||||||||||||||||||||||||
| Высказывания о жизни и белках знаменитых людей | «Повсюду, где мы встречаем жизнь, мы находим, что она связана с каким-либо белковым телом». Ф.Энгельс «Анти-Дюринг» Знаменитый путешественник и естествоиспытатель Александр Гумбольдт еще на пороге 19 века давал такое определение жизни: «Жизнь есть способ существования белковых тел, существенным моментом которого является постепенный обмен веществ с окружающей их внешней природой; причем с прекращением этого обмена веществ прекращается и сама жизнь, что приводит к разложению белка». Определение, данное Ф.Энгельсом в работе«Анти-Дюринг», позволяет задуматься над тем, как современная наука представляет процесс жизни. «Жизнь - это переплетение сложнейших химических процессов взаимодействия белков между собой и другими веществами». |
|||||||||||||||||||||||||||||
Приложение № 1
Функции белков.
Каталитическая функция
Белок как фермент: Ферменты - белки, обладающие каталитической активностью, т.е. ускоряющие протекание реакций. Все ферменты катализируют только одну реакцию. Заболевания, вызываемые ферментной недостаточностью.
Пример: неперевариваемость молока (нет фермента лактазы); гиповитаминозы (витаминная недостаточность)
Определение активности ферментов в биологических жидкостях имеет большое значение для диагностики заболевания. Например, по активности ферментов в плазме крови определяют вирусный гепатит.
Ферменты используют как реактивы при диагностике некоторых заболеваний.
Ферменты используют для лечения некоторых болезней. Примеры: панкреатин, фестал, лидаза.
Ферменты используются в промышленности: при приготовлении безалкогольных напитков, сыров, консервов, колбас, копченостей.
Ферменты используются при обработке льна, конопли, для смягчения кожи в кожевенной промышленности, они входят в состав стиральных порошков.
Структурная функция
Белки являются структурным компонентом многих клеток. Например, мономеры актина итубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму.Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти,перья птиц и некоторые раковины.
Защитная функция
Существуют несколько видов защитных функций белков:
Физическая защита. В ней принимает участие коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоёв кожи (дермы)); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса.
Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играютферментыпечени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма.
Иммунная защита. Белки, входящие в состав крови и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атакупатогенов
Регуляторная функция
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируюттранскрипцию, трансляцию, а также активность других белков и др.
Регуляторную функцию белки осуществляют либо за счёт ферментативной активности), либо за счёт специфического связывания с другими молекулами, как правило, влияющего на взаимодействие с этими молекулами ферментов.
Сигнальная функция
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и разными организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Транспортная функция
Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов.
Запасная (резервная) функция белков
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений и яйцеклетках животных; белки третичных оболочек яйца (овальбумины) и основной белок молока (казеин) также выполняют, главным образом, питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессыметаболизма.
Рецепторная функция
Белковые рецепторы могут как находиться в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы. При воздействии сигнала на определённый участок молекулы — белок-рецептор — происходят её конформационные изменения. В результате меняется конформация другой части молекулы, осуществляющей передачу сигнала на другие клеточные компоненты.
Моторная (двигательная) функция
Целый класс моторных белков обеспечивает движения организма, например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амебоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт создайте презентацию
Коды пищевых добавок
| Е103, Е105, Е111, Е121, Е123,Е125,Е126, Е130, Е152. |
|
| 2. Подозрительные | Е104, ЕЕ122, Е141, Е150, Е171, Е173, Е180, Е241, Е477. |
| 3. Опасные | Е102, Е110, Е120, Е124,. Е127. |
| 4.Канцерогенные | Е131,Е210-Е217,Е240, Е330. |
| 5. Вызывающие расстройства кишечника | |
| 6. Вредные для кожи | |
| 7. Вызывающие нарушение давления | |
| 8. Провоцирующие появление сыпи | |
| 9. Повышающие уровень холестерина | |
| 10. Вызывающие расстройство желудка | Е338 Е341, Е407, Е450, Е461 - Е466 |
Практическая работа
Тема: «Химические свойства белков. Качественные (цветные) реакции на белки».
Цель : Изучить химические свойства белков. Познакомиться с качественными реакциями на белки. Активность фермента каталазы в живых и мертвых тканях..
«Денатурация белков»
Порядок выполнения.
Приготовьте раствор белка.
В пробирку налейте 4-5 мл раствора белка и нагрейте до кипения.
Отметьте изменения.
Охладите содержимое пробирки и разбавьте водой.

«Ксантопротеиновая реакция»
Порядок выполнения.
2. В пробирку прилейте 1 мл уксусной кислоты.
3. Содержимое пробирки нагрейте.
4. Охладите смесь и добавьте аммиак до щелочной среды.
5. Отметьте изменения.
« Биуретовая реакция »
Порядок выполнения.
1. В пробирку налейте 2-3 мл раствора белка.
2. Добавьте 2-3 мл раствора гидроксида натрия и 1-2 мл раствора медного купороса..
3. Отметьте изменения.
Качественные (цветные)
реакции на белки. Опыты №2 и №3
Ксантопротеиновая реакция
Белок + HNO3конц > ярко?желтое окрашивание
(обнаружение бензольных ядер)
Биуретовая реакция
Белок + NaOH+CuSO4 > красно-
фиолетовое окрашивание
(обнаружение пептидных связей)
«Доказательство наличие белка только в живых организмах»
Порядок выполнения.
1. В пробирках находятся свежевыжатый сок картофеля, кусочки сырого картофеля,
вареный картофель.
2. Добавьте в каждую пробирку 2-3 мл перекиси водорода.
3. Отметьте изменения. (каталаза - ферментный белок выделяется только в
присутствии молекулярной воды, растворенные в воде альбумины сворачиваются)
| Опыт | Что делали | Что наблюдали | Объяснение и выводы |
| 1. Качественные реакции на белки. | |||
| а) Биуретовая реакция. | К 2 мл раствора белка добавить раствор сульфата меди (II) и щелочи. | Красно-фиолетовое окрашивание. | При взаимодействии растворов образуется комплексное соединение между ионами Си2+ и полипептидами. |
| б) Ксантопротеиновая реакция. | К 2 мл раствора белка добавить по каплям концентрирующуюся азотную кислоту. | Желтое окрашивание. | Реакция доказывает, что в состав белков входят остатки ароматических аминокислот. |
| 2. Денатурация белка. | Пробирку № 3 с раствором белка нагреть. | Во всех трех случаях наблюдается необратимое свертывание белка — денатурация. | При нагревании, действии неразбавленного спирта, солей тяжелых металлов происходит разрушение вторичной и третичной структуры, с сохранением первичной. |


«Жизнь есть способ существования белковых тел…» Ф.Энгельс
Опорный конспект Приложение № 2- АМФОТЕРНОСТЬ
Кислая среда = по типу щелочи
[белок]+ + ОН- = по типу кислоты
- ГИДРОЛИЗ ……разрушение первичной структуры белка до α-аминлкислот
Качественные реакции
- БИУРЕТОВАЯ РЕАКЦИЯ (распознавание в молекуле белка пептидных связей).
Б. + CuSO4 + NaOH → фиолетовое окрашивание
………………………………
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ (обнаружение бензольных ядер).
Б. + HNO3 → желтое окрашивание
- ГОРЕНИЕ БЕЛКА ………………………..
N2, CO2, H2O - запах жженых перьев
- ДЕНАТУРАЦИЯ - ………………………..
высокая t разрушение
радиоактивное облучение 2-3 структуры
соли тяжелых Ме
Протеины ПротеидыБЕЛКИ - важнейшая составная часть живых организмов, входят в состав кожи, роговых покровов, мышечной и нервной ткани

 (простые) (сложные)
(простые) (сложные)



| 1 вариант | 2 вариант |
| 1. В состав аминокислот входят: а) только аминогруппы б) только карбоксильные группы в) аминогруппы и карбоксильные группы г) аминогруппы и карбонильные группы | 1. Аминокислотой является вещество, формула которого: а) СН3СН2 СОNН2 б) NН2СООН в) NН2СН2СН2СООН г) NН2СН2СОН |
| 2. Аминокислоты, которые не могут синтезироваться в организме человека, а поступают только с пищей, называются а) a -аминокислотами б) пищевыми в) -аминокислотами г) незаменимыми | 2. Аминокислоты - это а) бесцветные легкокипящие жидкости б) газы тяжелее воздуха в) кристаллические вещества розового цвета г) бесцветные кристаллические вещества |
| 3. При взаимодействии аминокислот со щелочами и кислотами образуются: в) дипептиды г) полипептиды | 3. Образование полипептидов происходит по типу реакции: а) полимеризации б) поликонденсации в) присоединения г) замещения |
| 4. Формула 3-аминопропановой кислоты: а) NН2СН2СООН б) NН2СН2СН2СООН в) NН2СН2СН2 NН2 г) NН2СН СН2СООН | 4. Самые слабые кислотные свойства проявляет кислота: а) уксусная б) хлоруксусная в) аминоуксусная г) дихлоруксусная |
| 5. Верным является утверждение, что аминокислоты это: а) твердые вещества молекулярного строения б) кристаллические вещества ионного строения в) жидкости, хорошо растворимые в воде г) кристаллические вещества с низкими температурами плавления | 5. Аминокислоты являются амфотерными соединениями, так как они взаимодействуют: а) с кислотами б) с щелочами в) со спиртами г) с кислотами и щелочами |
Ответы 1 - В, 2 - Г, 3 - А, 4 - Б, 5 - Б Ответы 1 - В, 2 - Г, 3 -Б, 4 -В, 5 - Г
| 1 вариант | 2 вариант |
| 1. Укажите название белка, выполняющего защитную функцию: | 1. Укажите название белка, выполняющего ферментативную функцию: а) гемоглобин, б) оксидаза, в) антитела. |
| 2. Белки - это..: а) полисахариды, б) полипептиды, в) полинуклеотиды. | 2. Биологические свойства белка определяет структура: а) третичная, б) вторичная, в) первичная. |
| 3. Первичная структура белка поддерживается за счёт связей: | 3. Вторичная структура белка поддерживается за счёт связей: а) ионных, б) пептидных, в) водородных. |
| 4. Гидролиз белка используется для: а) получения аминокислот, б) качественного обнаружения белка, в) разрушения третичной структуры | 4. Белки подвергаются реакциям: а) денатурации, б) полимеризации, в) поликонденсации. |
| 5. Аминокислоты, необходимые для построения белков, попадают в организм: а) с водой, б) с пищей, в) с воздухом. | 5. Какой из процессов наиболее сложен: а) микробиологический синтез, б) органический синтез, в) переработка растительного белка. |
Ответы: 1 - в, 2 - б, 3 - б, 4 - а, 5 - б. Ответ: 1 - б, 2 - в, 3 - в. 4 - а, 5 - б.
Тест «Белки»
1 . Какие химические элементы входят в состав белков?
а) углерод б) водород в) кислород г) сера д) фосфор е) азот ё) железо ж) хлор
2 . Сколько аминокислот участвуют в образовании белков?
а) 30 в) 20 б) 26 г) 10
3 . Сколько аминокислот являются незаменимыми для человека?
а) 16 б) 10 в) 20 г) 7
4 . В результате какой реакции образуется пептидная связь?
а) реакция гидролиза в) реакция поликонденсации
б) реакция гидратации г) все вышеперечисленные реакции
5 . Какая функциональная группа придает аминокислоте - кислотные, какая - щелочные свойства? (карбоксильная, аминогруппа).
6 . Какие связи образуют 1- первичную, 2- вторичную, 3- третичную структуры белка? Соотнесите:
а) ковалентные в) ионные
б) водородные г) такие связи отсутствуют
7 ) Определите структуры белковой молекулы:
1.  2.
2.

Таблица ответов
| Номер вопроса | |||||||
| Вариант ответа |
8) Денатурация - это разрушение белка до _____________структуры под действием________________, а также под действием растворов различных химических веществ (______,________, солей) и радиации.
9) Гидролиз - это разрушение _____________структуры белка под действием________________, а так же водных растворов кислот или щелочей.
10) Качественные реакции:
а) Биуретовая.
Белок + ___________________________ = _________________________
б) Ксантопротеиновая.
Белок + ___________________________ = __________________________
11) Установите соответствие между белками и их функцией в организме. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
БЕЛКИ: ФУНКЦИЯ:
А) гемоглобин 1)сигнальная
Б) ферменты 2) транспортная
В) антитела и антитоксины 3) структурная
4) каталитическая
5) защитная
12) Заполните значение белков:
| Функции | Значение |
|
| Строительная | Клеточные мембраны, покровные ткани, шерсть, перья, гора, волосы, хрящи |
|
| Транспортная | Накопление и транспорт по организму важнейших веществ |
|
| Энергетическая | Запас аминокислот для развития организма |
|
| Двигательная | Сократительные белки основа мышечных тканей |
|
| Защитная | Белки - антитела, антитоксины распознают и уничтожают бактерии и “чужеродные” вещества |
|
| Каталитическая | Белки - природные катализаторы (ферменты) |
|
| Сигнальная | Мембранные белки воспринимают внешние воздействия и передают сигнал о них внутрь клетки |
Вопросы к брифингу:
Белок иначе называют…
Что является мономерами белка?
Сколько незаменимых АК известно?
Каков атомарный состав белков?
Какая связь поддерживает вторичную структуру?
Как называется связь, образующая ППЦ?
Вторичная структура белковой молекулы в пространстве напоминает…
За счет каких взаимодействий образуются третичная структура?
Почему белки относят к ВМС?
Что в переводе с греческого означает “протеин”?
Что такое “денатурация”?
Как называется процесс взаимодействия белков с Н2О?
Классификация белков.
Состав и строение
пептидная связь
элементарный состав
молекулярная масса
аминокислоты
Химические и физические свойства.
Значение белков.
Список использованной литературы.
Введение
Белк и - высокомолекулярные азотистые органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Белки – основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%), причем растительному миру свойственно отклонение от этой средней величины в сторону понижения, а животному – повышения. Микроорганизмы обычно богаче белком (некоторые же вирусы являются почти чистыми белками). Таким образом, в среднем можно принять, что 10% биомассы на Земле представлено белком, то есть его количество измеряется величиной порядка 10 12 - 10 13 тонн. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например, процессы обмена веществ (пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов, являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц (актомиозин), опорные ткани организма (коллаген костей, хрящей, сухожилий) , покровы организма (кожа, волосы, ногти и т.п.) , состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества. Роль белков в живом организме подчеркивается уже самим их названием «протеины» (в переводе с греческого protos – первый, первичный) , предложенным в 1840 голландским химиком Г. Мульдером, который обнаружил, что в тканях животных и растений содержатся вещества, напоминающие по своим свойствам яичный белок. Постепенно было установлено, что белки представляют собой обширный класс разнообразных веществ, построенных по одинаковому плану. Отмечая первостепенное значение белков для процессов жизнедеятельности, Энгельс определил, что жизнь есть способ существования белковых тел, заключающийся в постоянном самообновлении химических составных частей этих тел.
Классификация белков.
Из-за относительно больших размеров белковых молекул, сложности их строения и отсутствия достаточно точных данных о структуре большинства белков еще нет рациональной химической классификации белков. Существующая классификация в значительной мере условна и построена главным образом на основании физико-химических свойств белков, источников их получения, биологической активности и других, нередко случайных, признаков. Так, по физико-химическим свойствам белки делят на фибриллярные и глобулярные, на гидрофильные(растворимые) и гидрофобные (нерастворимые) и т.п. По источнику получения белки подразделяют на животные, растительные и бактериальные; на белки мышечные, нервной ткани, кровяной сыворотки и т.п.; по биологической активности – на белки-ферменты, белки-гормоны, структурные белки, сократительные белки, антитела и т.д. Следует, однако, иметь в виду, что из-за несовершенства самой классификации, а также вследствие исключительного многообразия белков многие из отдельных белков не могут быть отнесены ни к одной из описываемых здесь групп.
Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.
Гистоны
Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция - регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи).
Протамины
Самая низкая молекулярная масса (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, функция - придают ДНК химическую устойчивость.
Глютелины
Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений. Нерастворимые в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Проламины
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот).
Протеиноиды
Белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы). Нерастворимые или трудно растворимые в воде, солевых и водно-спиртовых смесях белки с высоким содержанием серы. К протеиноидам относятся кератин, коллаген, фиброин.
Альбумины
Невысокой молекулярной массой (15-17 тыс.). Характерны кислые свойства. Растворимы в воде, и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке.
Глобулины
Молекулярная масса до 100 тыс.. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняющие функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям.
Сложные белки делят на ряд классов в зависимости от характера простетической группы.
Фосфопротеины
Имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.
Липопротеины
Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть - липидами и их производными. Основная функция липопротеинов - транспорт по крови липидов. В зависимости от количества белка и липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как - и -липопротеиды.
Металлопротеины
Гликопротеины
Простетическая группа представлена углеводами и их производными. Исходя из химического строения углеводного компонента, выделяют 2 группы:
Истинные - в качестве углеводного компонента наиболее часто встречаются моносахариды. Протеогликаны - построены из очень большого числа повторяющихся единиц, имеющих дисахаридный характер (гиалуроновая кислота, гипарин, хондроитин, каротинсульфаты).
Функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления.
Хромопротеины
Выполняют ряд функций: участие в процессе фотосинтеза и окислительно-восстановительных реакциях, транспорт С и СО 2 . Являются сложными белками, простетическая группа которых представлена окрашенными соединениями.
Нуклеопротеины
Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами - в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы - это комплексы вирусной нуклеиновой кислоты и белковой оболочки - капсида.