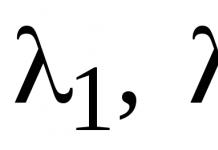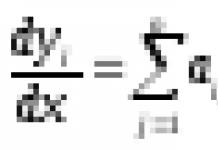9.5.1. Одна из главных функций мембран - участие в переносе веществ. Этот процесс обеспечивается при помощи трёх основных механизмов: простой диффузией, облегчённой диффузией и активным транспортом (рисунок 9.10). Запомните важнейшие особенности этих механизмов и примеры транспортируемых веществ в каждом случае.
Рисунок 9.10. Механизмы транспорта молекул через мембрану
Простая диффузия - перенос веществ через мембрану без участия специальных механизмов. Транспорт происходит по градиенту концентрации без затраты энергии. Путём простой диффузии транспортируются малые биомолекулы - Н2 О, СО2 , О2 , мочевина, гидрофобные низкомолекулярные вещества. Скорость простой диффузии пропорциональна градиенту концентрации.
Облегчённая диффузия - перенос веществ через мембрану при помощи белковых каналов или специальных белков-переносчиков. Осуществляется по градиенту концентрации без затраты энергии. Транспортируются моносахариды, аминокислоты, нуклеотиды, глицерол, некоторые ионы. Характерна кинетика насыщения - при определённой (насыщающей) концентрации переносимого вещества в переносе принимают участие все молекулы переносчика и скорость транспорта достигает предельной величины.
Активный транспорт - также требует участия специальных белков-переносчиков, но перенос происходит против градиента концентрации и поэтому требует затраты энергии. При помощи этого механизма через клеточную мембрану транспортируются ионы Na+ , K+ , Ca2+ , Mg2+ , через митохондриальную - протоны. Для активного транспорта веществ характерна кинетика насыщения.
9.5.2. Примером транспортной системы, осуществляющей активный транспорт ионов, является Na+ ,K+ -аденозинтрифосфатаза (Na+ ,K+ -АТФаза или Na+ ,K+ -насос). Этот белок находится в толще плазматической мембраны и способен катализировать реакцию гидролиза АТФ. Энергия, выделяемая при гидролизе 1 молекулы АТФ, используется для переноса 3 ионов Na+ из клетки во внеклеточное пространство и 2 ионов К+ в обратном направлении (рисунок 9.11). В результате действия Na+ ,K+ -АТФазы создаётся разность концентраций между цитозолем клетки и внеклеточной жидкостью. Поскольку перенос ионов неэквивалентен, то возникает разность электрических потенциалов. Таким образом, возникает электрохимический потенциал, который складывается из энергии разности электрических потенциалов Δφ и энергии разности концентраций веществ ΔС по обе стороны мембраны.

Рисунок 9.11. Схема Na+ , K+ -насоса.
9.5.3. Перенос через мембраны частиц и высокомолекулярных соединений
Наряду с транспортом органических веществ и ионов, осуществляемым переносчиками, в клетке существует совершенно особый механизм, предназначенный для поглощения клеткой и выведения из неё высокомолекулярных соединений при помощи изменения формы биомембраны. Такой механизм называют везикулярным транспортом .

Рисунок 9.12. Типы везикулярного транспорта: 1 - эндоцитоз; 2 - экзоцитоз.
При переносе макромолекул происходит последовательное образование и слияние окружённых мембраной пузырьков (везикул). По направлению транспорта и характеру переносимых веществ различают следующие типы везикулярного транспорта:
Эндоцитоз (рисунок 9.12, 1) — перенос веществ в клетку. В зависимости от размера образующихся везикул различают:
а) пиноцитоз — поглощение жидкости и растворённых макромолекул (белков, полисахаридов, нуклеиновых кислот) с помощью небольших пузырьков (150 нм в диаметре);
б) фагоцитоз — поглощение крупных частиц, таких, как микроорганизмы или обломки клеток. В этом случае образуются крупные пузырьки, называемые фагосомами диаметром более 250 нм.
Пиноцитоз характерен для большинства эукариотических клеток, в то время как крупные частицы поглощаются специализированными клетками - лейкоцитами и макрофагами. На первой стадии эндоцитоза вещества или частицы адсорбируются на поверхности мембраны, этот процесс происходит без затраты энергии. На следующей стадии мембрана с адсорбированным веществом углубляется в цитоплазму; образовавшиеся локальные впячивания плазматической мембраны отшнуровываются от поверхности клетки, образуя пузырьки, которые затем мигрируют внутрь клетки. Этот процесс связан системой микрофиламентов и является энергозависимым. Поступившие в клетку пузырьки и фагосомы могут сливаться с лизосомами. Содержащиеся в лизосомах ферменты расщепляют вещества, содержащиеся в пузырьках и фагосомах до низкомолекулярных продуктов (аминокислот, моносахаридов, нуклеотидов), которые транспортируются в цитозоль, где они могут быть использованы клеткой.
Экзоцитоз (рисунок 9.12, 2) — перенос частиц и крупных соединений из клетки. Этот процесс, как и эндоцитоз, протекает с поглощением энергии. Основными разновидностями экзоцитоза являются:
а) секреция - выведение из клетки водорастворимых соединений, которые используются или воздействуют на другие клетки организма. Может осуществляться как неспециализированными клетками, так и клетками эндокринных желёз, слизистой желудочно-кишечного тракта, приспособленными для секреции производимых ими веществ (гормонов, нейромедиаторов, проферментов) в зависимости от определённых потребностей организма.
Секретируемые белки синтезируются на рибосомах, связанных с мембранами шероховатого эндоплазматического ретикулума. Затем эти белки транспортируются к аппарату Гольджи, где они модифицируются, концентрируются, сортируются, и затем упаковываются в пузырьки, которые отщепляются в цитозоль и в дальнейшем сливаются с плазматической мембраной, так что содержимое пузырьков оказывается вне клетки.
В отличие от макромолекул, секретируемые частицы малых размеров, например, протоны, транспортируются из клетки при помощи механизмов облегчённой диффузии и активного транспорта.
б) экскреция - удаление из клетки веществ, которые не могут быть использованы (например, удаление в ходе эритропоэза из ретикулоцитов сетчатой субстанции, представляющей собой агрегированные остатки органелл). Механизм экскреции, по-видимому, состоит в том, что вначале выделяемые частицы оказываются в цитоплазматическом пузырьке, который затем сливается с плазматической мембраной.
Как правило, именно белки ответственны за функциональную активность мембран.
К таким белкам относятся разнообразные ферменты, транспортные белки, рецепторы, каналы, белки, образующие поры (аквапорины), то есть разнообразные белковые структуры, которые обеспечивают уникальность функций каждой мембраны.
Мембранные белки по биологической роли можно разделить на три группы:
I – белки-ферменты, обладающие каталитической активностью,
II – рецепторные белки, специфически связывающие те или иные вещества,
III – структурные белки.
Белки-ферменты
Наиболее распространены среди всех мембранных белков. В их число входят как интегральные (мембранные АТФазы), так и периферические (ацетилхолинэстераза, кислая и щелочная фосфатазы, РНКаза) белки.
Ферменты – большие молекулы, в то время как размеры молекул веществ (субстратов), вступающих в ферментативные реакции, обычно в тысячи раз меньше. Фермент взаимодействует с субстратом небольшим участком своей поверхности – активным центром. Специфичность фермента всегда определяется тем, насколько поверхность его активного центра соответствует поверхности субстрата. Этот принцип структурного соответствия повсеместно используется и в работе белков клеточных мембран. В дополнение к этому надо учесть, что конформация внедряющихся в мембрану белков зависит от мембранного бислоя, так что и их ферментативная активность контролируется мембранными липидами. Этот контроль может реализоваться благодаря как влиянию на сродство к субстратам или на их доступность, так и воздействию на длительность жизни (прочность) белковых ассоциатов мембранных ферментов, образующихся в клеточной мембране.
Ферменты входят в состав как плазматических, так и внутриклеточных мембран. Например, на наружной мембране эпителиальных клеток, выстилающих пищеварительные органы, имеются ферменты, осуществляющие расщепление питательных веществ еще до того, как они попадут внутрь клетки (этот процесс, открытый отечественным физиологом А.М. Уголевым носит название «мембранное пищеварение»). Наружная мембрана клеток печени содержит более 20 различных ферментов.
Мембранные ферменты нуждаются в контакте с окружающими их липидами. Когда их извлекают из липидного окружения (например, когда липиды экстрагируются из мембраны неполярными растворителями), работа мембранных ферментов нарушается (меняются особенности кинетики или характера влияния посторонних веществ или же вовсе прекращается). Активность таких мембранных ферментов удается частично восстановить, если к ним добавить липидные мицеллы.
Анализ природы липидов, активирующих мембранные ферменты, демонстрирует отсутствие строгой специфичности - определяющим является гидрофильно-липофильный коэффициент липидной смеси. В ряде случаев активировать делипидированный фермент удается даже детергентом. Однако такой реактивированный фермент теряет способность воспринимать регулирующие сигналы извне, которые управляли его работой в «живой» мембране.
Активирующее действие липидов на мембранные ферменты может быть, по меньшей мере, двояким. Во-первых, в присутствии липидов может меняться форма молекулы мембранного фермента, так что его активный центр становится доступным для субстрата. Во-вторых, липиды могут играть роль организатора ансамбля или конвейера, состоящего из многих ферментов.
Молекулы мембранных ферментов содержат большие неполярные гидрофобные участки. Поэтому в водной среде они агрегируют, из-за чего большая часть активных центров маскируется. В присутствии липидов мембранные ферменты организуются в ансамбли, окруженные аннулярными липидными молекулами, и их ферментативная активность может проявиться в полной мере. Для нормальной работы мембранных ферментов существенно, чтобы окружающие их липиды находились в жидком агрегатном состоянии.
Рецепторные белки
Рецепторными называют белки, специфически связывающие те или иные низкомолекулярные вещества. При связывании специфических лигандов рецепторные белки обратимо меняют свою форму. Эти изменения запускают внутри клетки ответные химические реакции. Таким способом клетка воспринимает различные сигналы, поступающие из внешней среды, и отвечает на них .
Белки-рецепторы и белки, определяющие иммунную реакцию клетки, – антигены, также могут быть как интегральными, так и периферическими компонентами мембраны.
Часто рецепторы входят в состав более сложных мембранных комплексов, содержащих белки-исполнители. Например, холинорецептор воспринимает сигнал от нейромедиатора и передает его на белок-каналообразователь. Эта реакция открывает проницаемость мембраны для ионов натрия и калия и формирует возбуждающий потенциал.
Доля белка в общей массе мембраны может колебаться в очень широких пределах – от 18% в миелине до 75% в митохондриальной мембране.
По расположению в мембране белки можно разделить на: интегральные и периферические .
Интегральные белки являются, как правило, гидрофобными и легко встраиваются в липидный бислой.
Взаимодействие такого белка с мембраной происходит в несколько стадий. Сначала белок адсорбируется на поверхности бислоя, изменяет свою конформацию , устанавливая гидрофобный контакт с мембраной. Затем происходит внедрение белка в бислой. Глубина внедрения зависит от силы гидрофобного взаимодействия и соотношения гидрофобных и гидрофильных участков на поверхности белковой глобулы. Гидрофильные участки белка взаимодействуют с примембранными слоями по одну или обе стороны мембраны. Фиксация белковой глобулы в мембране происходит благодаря электростатическим и гидрофобным взаимодействиям. Углеводная часть белковых молекул (если она имеется) выступает наружу. Интегральные белки в силу тесной связи с бислоем оказывают на него существенное воздействие: конформационные перестройки белка приводят к изменению состояния липидов, так называемой деформации бислоя.
Периферические белки обладают меньшей глубиной проникновения в липидный бислой, и, соответственно, более слабо взаимодействуют с липидами мембраны, оказывая, на них гораздо меньшее воздействие, чем интегральные.
По характеру взаимодействия с мембраной белки делятся на монотопические, битопические, политопические :
монотопические белки взаимодействуют с поверхностью мембраны (моно – одним из слоев липидов);
битопические пронизывают мембрану насквозь (би – двумя слоями липидов);
политопические пронизывают мембрану несколько раз (поли- многократное взаимодействие с липидами).
Понятно, что первые относятся к периферическим белкам, а вторые и третьи к интегральным.
Белки мембран можно так же классифицировать по выполняемой ими функции. В связи с этим выделяют структурные белки:
· белки – ферменты;
· белки – рецепторы;
· транспортные белки.
Особую группу составляют белки цитоскелета клетки. Строго говоря, эти белки не являются компонентами мембраны, примыкая к ней с цитоплазматической стороны. Белки цитоскелета входят в состав всех его компонентов: миофиламенты содержат молекулы белка актина; в состав микротрубочек входит белок тубулин, промежуточные филаменты также содерждат более полиморфный белковый комплекс. Цитоскелет не только обеспечивают эластичность мембраны, противостоят изменениям объема клетки, но, по-видимому, участвует в и различных внутри- и внеклеточных механизмах регуляции.
1. ТРАНСПОРТ ГИДРОФИЛЬНЫХ МОЛЕКУЛ, и, в частности, заряженных частиц. Например, транспорт ионов натрия и калия осуществляется K,Na-насосом.
2. ФЕРМЕНТАТИВНАЯ РОЛЬ.
Ферменты, заключенные в мембрану, обладают рядом особенностей каталитических свойств. У этих ферментов особая чувствительность к факторам окружающей среды.
РЕЦЕПТОРНАЯ РОЛЬ. Взаимодействие с гормонами, медиаторами осуществляется мембранными белками-гликопротеинами. Самостоятельно углеводный компонент не участвует в построении мембраны, но липиды и белки содержат углеводы.
Роль углеводных компонентов мембран
а) Участвуют в рецепции.
б) Обеспечивают взаимодействие клеток друг с другом.
в) Некоторые углеводные компоненты обеспечивают антигенную специфичность клеток. Например, эритроциты разных групп крови отличаются друг от друга по составу углеводных компонентов.
Мембраны асимметричны. 2 монослоя отличаются друг от друга по своему составу. Например, гликолипиды плазматической мембраны всегда находятся в наружном монослое. Асимметрия характерна и для белковых компонентов.
Аденилатциклаза. Ее активный центр находится на внутренней части мембраны. Белки-рецепторы свой углеводный компонент содержат с внешней стороны мембраны.
Важнейшим компонентом плазматических мембран является холестерин.
Холестерин взаимодействует с гидрофобными хвостами полярных молекул и ограничивает скорость диффузии липидов. Поэтому холестерин называют стабилизатором биологических мембран. Компоненты мембран не только движутся в пространстве, но и постоянно обновляются. Их место занимают новые молекулы.
В учебную программу входит только обмен ГФЛ и холестерина. Липоиды синтезируются на мембранах эндоплазматического ретикулума. Наблюдается постоянное передвижение липоидов от мембран ЭПС к другим мембранам.
СИНТЕЗ ХОЛЕСТЕРИНА
Протекает в основном в печени на мембранах эндоплазматического ретикулума гепатоцитов. Этот холестерин - эндогенный. Происходит постоянный транспорт холестерина из печени в ткани. Для построения мембран используется также пищевой (экзогенный) холестерин. Ключевой фермент биосинтеза холестерина - ГМГ-редуктаза (бета-гидрокси, бета-метил, глутарил-КоА редуктаза). Этот фермент ингибируется по принципу отрицательной обратной связи конечным продуктом - холестерином.
ТРАНСПОРТ ХОЛЕСТЕРИНА.
Пищевой холестерин транспортируется хиломикронами и попадает в печень. Поэтому печень является для тканей источником и пищевого холестерина (попавшего туда в составе хиломикронов), и эндогенного холестерина.
В печени синтезируются и затем попадают в кровь ЛОНП - липопротеины очень низкой плотности (состоят на 75% из холестерина), а также ЛНП - липопротеины низкой плотности(в их составе есть апобелок апоВ 100 .
Почти во всех клетках имеются рецепторы для апоВ 100 . Поэтому ЛНП фиксируются на поверхности клеток. При этом наблюдается переход холестерина в клеточные мембраны. Поэтому ЛНП способны снабжать холестерином клетки тканей.
Помимо этого, происходит и освобождение холестерина из тканей и транспорт его в печень. Транспортируют холестерин из тканей в печень липопротеины высокой плотности (ЛВП). Они содержат очень мало липидов и много белка. Синтез ЛВП протекает в печени. Частицы ЛВП имеют форму диска, и в их составе находятся апобелки апоА, апоС и апоЕ . В кровеносном русле к ЛНП присоединяется белок-фермент лецитинхолестеринацилтрансфераза (ЛХАТ) (смотрите рисунок).
АпоС и апоЕ могут переходить от ЛВП на хиломикроны или ЛОНП. Поэтому ЛВП являются донорами апоЕ и апоС. АпоА является активатором ЛХАТ.
ЛХАТ катализирует следующую реакцию:

Это реакция переноса жирной кислоты из положения R 2 на холестерин.
Реакция является очень важной, потому что образующийся эфир холестерина является очень гидрофобным веществом и сразу переходит в ядро ЛВП - так при контакте с мембранами клеток ЛВП удаляют из них избыток холестерина. Дальше ЛВП идут в печень, там разрушаются, и избыток холестерина удаляется из организма.
Нарушение соотношения между количеством ЛНП, ЛОНП и ЛВП может вызывать задержку холестерина в тканях. Это приводит к атеросклерозу. Поэтому ЛНП называют атерогенными липопротеинами, а ЛВП - антиатерогенными липопротеинами. При наследственном дефиците ЛВП наблюдаются ранние формы атеросклероза.
Клеточные мембраны имеют свойства полупроницаемости, то есть некоторые вещества через них проходят, а другие - нет. Вследствие этого те или другие соединения могут накапливаться с какой-то стороны от мембраны, создавая концентрационные градиенты. Так, в клетке и вне ее существенно
различается содержание большинства ионов (табл. 1), участвующих в выполнении многих физиологических процессов.
Таблица 1. Концентрация некоторых ионов внутри мышечного волокна и вне его (ммоль1л)
Кратко перечислим функциональное назначение ионов некоторых металлов, которые обладают наибольшей биологической активностью, которая оказывается внутри клетки (органоїда) или вне ее.
Так, натрий обеспечивает осмотическое давление, регулирует водный обмен между клетками и внеклеточным средой. Ионы натрия участвуют в поддержании кислотно-основного состояния (КОС) в организме. Во многих тканях они участвуют в электрохимических процессах, а также в регуляции функций нуклеиновых кислот, белков. С ними связано трансмембранное транспортировки отдельных веществ.
Немало функций калия совмещены с функциями натрия, но противоположные им. Это наблюдают как в электрохимических процессах, так и в воздействии на ферменты (калий активирует некоторые ферменты гликолиза, а натрий - удручает). Вместе с тем К" выполняет и "свои" функции. Например, его считают одним из регуляторов процессов транскрипции.
Функциональное назначение кальция настолько разнообразно и значимо для большинства органов и систем, регуляции его обмена обеспечивают несколько гормонов. Кальций необходим для секреторной активности практически всех железистых клеток. В большинстве клеток его считают одним из регуляторов внутриклеточных процессов. В то же время поступление в цитоплазму клеток большого количества свободного кальция неблагоприятное, поскольку в таком случае образуется малорастворимое соль фосфата кальция, под влиянием которой прекращается продуцирование и утилизация аденозинтрифосфорной кислоты (АТФ). Поэтому в клетках, где кальций используется для обеспечения функций (например, в мышечной - для сокращения), существует система его депо - саркоплазмами" 1-ный ретикулум (СР). Из него кальций выходит в цитоплазму на относительно короткий период. В русле крови этот ион участвует в обеспечении процессов гемостаза (спинення кровотечения). В крови более половины его концентрации находится в ионизированном состоянии, большая часть остального связана с белками, а меньшая - растворенными в крови веществами (цитратом). Многообразие функций кальция определяет необходимость поддержания его концентрации в крови на уровне 0,25 ммоль (0,5 ммоль1л).
Неорганические анионы (С1-, НСО, Н2Р04 и др.) также выполняют свойственные им функции, о чем речь пойдет в соответствующих разделах. Вследствие значимости для выполнения физиологических процессов указанных неорганических ионов механизмы, которые обеспечивают поступление и выход их через мембранные структуры, будет рассмотрен далее.
Функции белков мембран
Большинство функций мембран (перепонка) обусловлены их белковыми компонентами, которые выполняют роль ионных каналов, насосов, ферментов, рецепторов. Активность функции, которые они проявляют, зависит как от самих белков и их плотности на мембране, так и от ее липидов. Все указанные механизмы изменяются под влиянием сложной системы регуляции.
Транспортные белки
Диффузия.
Переход различных веществ через мембрану зависит от величины их молекулы, заряда, а также растворимости в липидах. Жирорастворимые соединения (СО2,02 и др.) могут относительно легко проникать сквозь мембрану, если возникают условия для их диффузии. Основной механизм, обеспечивающий процесс диффузии - концентрационный градиент вещества: он с большей концентрации перемещается в меньшую.
Но из-за того, что растворимость различных соединений в липидах неодинакова, скорость транспортировки так же разная. Так. растворимость углекислого газа выше, чем кислорода, поэтому он гораздо быстрее проникает через мембраны. А следовательно, он требует меньше концентрационный градиент.
Трансмембранное транспортировки большинства соединений, ионов происходит с помощью соответствующих систем. Если жирорастворимые небольшие полярные молекулы, такие как этанол и мочевина, в отношении легко проходят сквозь липидный слой мембраны, то сахара диффундируют со значительными трудностями.
Заряженные частицы также не могут пройти через липиды мембран. И ведущую роль в обеспечении этих процессов играют белковые структуры. Транспортировка веществ осуществляется с помощью следующих механизмов:
o пассивного;
o первично-активного;
o повторно-активного (совмещенного).
Пассивное транспортировки происходит специальными каналами без затраты энергии путем диффузии по концентрационным градиентом. Для заряженных частиц имеет значение еще и электрохимический градиент. Так, катионы калия, выходящих из клетки, содержащиеся в ней отрицательными анионами.
Активное транспортировки требует специальных белковых структур, что называют насосами, и обязательного использования энергии..
Сочетанное транспортировки обеспечивают белки, транспортирующие одновременно два соединения. Причем этот вид транспортировки может быть однонаправленным, когда оба соединения проникают через мембрану в одном направлении (симпорт), либо разнонаправленным (анти-порт). Соединенное транспортировка также требует энергии ионных насосов, но она не всегда используется в том участке плазматической мембраны, через который оно осуществляется (рис. 4, 5).
Белки-переносчики.
Соединяясь с веществом, что транспортируется и не может самостоятельно пройти через мембрану, переносчик обеспечивает моментальное 4 протягивания" сквозь липидный слой. Таким образом транспортируются ионы, амино - и органические кислоты, моноцукриди, нуклеотиды. Для кож

Рис. 4.
а - боковая подвижность липидов; б - вращательные движения; в - боковая подвижность белков; г - "флип-флоп" липидов; г- "флип-флоп" белков

Рис. 5. в
* - глюкоза (по Ю.П. Болдиревим)
ного из них существуют свои переносчики, плотность которых на мембранах разная и регулируемая. Для функционирования этой системы необходимо соблюдение нескольких условий:
а) вещество, которое транспортируется, пересекает мембрану только вместе с переносчиком;
б) молекула переносчика должна соединяться с молекулой вещества.
Ионные каналы.
наиболее Типичным считается трансмембранное транспортировки ионов, проходящих за одним из разновидностей белков-переносчиков, так называемыми каналами (порами). Важнейшие (и изучены на сегодня) три из них:
1) натриевый;
2) калиевый;
3) кальциевый.
Как правило, канал состоит из трех частей (рис. 6). Первая из них-водная пора, выстланная внутри гидрофильными группами. На внешней ее поверхности содержится участок, осуществляющий разделение ионов, - селективный фильтр. Управляет состоянием канала структура, что находится возле обращенного внутрь края поры и имеет название "ворота".
Ионы в растворе находятся в гидратованной форме, тоб

Рис. 6. Воротами канала управляет хеморецептор. До взаимодействия молекул АХ с рецептором ворота закрыты (а), после связывания с ним они растворяются (б; за Бы.И. Ходоровим)
то связаны с молекулами воды. Это увеличивает эффективные размеры катионов. Открытый канал (раскрытые ворота) позволяет ионам проходить через мембрану, оставаясь в водном окружении. Однако селективная участок настолько узкая, что часть водной оболочки ион теряет. Первый фактор, ограничивающий прохождение катионов каналом, - это размер селективного фильтра: для натриевого канала он составляет 0,3 х 0,5 нм, для калиевого - 0,3 х 0,3 нм. Кальциевый канал большего диаметра (0,65 нм), поэтому сквозь него может проходить не только Са2 а и № Другой фактор, регулирует прохождение ионов, - заряд стенки поры. В рассмотренных катионных каналах стенка пор имеет отрицательный заряд, поэтому через них могут проникать анионы - они отталкиваются.
Регуляцию состояния канала осуществляет воротный механизм. Его положение ("открыто" или "закрыто") в зависимости от места расположения канала на мембранах определяют: электрическим зарядом мембраны и специальными рецепторами, которые взаимодействуют с лигандом (биологически активным соединениям, например медиатором).
Ионные насосы.
Функциональное назначение биологических насосов заключается в поддержании внутри клетки постоянства ионного состава. их еще называют транспортными аденозинтрифосфатазами (АТФазами), ведь они обеспечивают транспорт ионов против концентрационного градиента, для чего нужна энергия АТФ. Наиболее типичные и на сегодня относительно хорошо изучены два насоса.
N0*-, ИС-АТФаза. В плазматической мембране содержится интегральный белок, обеспечивающий соединен антипорт Na+ и К+. Благодаря использованию энергии молекулы АТФ происходит выкачивание трех ионов натрия из клетки и накачки двух ионов калия. К+-насос состоит из двух субъединиц -а-липопротеина и $-гликопротеина (рис. 7).
Ферментативный центр его, что гидролизует АТФ, расположен на а-субъединице, обращенной внутрь клетки. Активация указанного фермента осуществляет натрий на внутренней ее поверхности. Калиесвязывательный центр расположен в той части молекулы, которая ориентирована в внеклеточную среду.
Схематично функцию одного цикла этого насоса можно описать следующим образом. Поступление ионов натрия в открытый сначала "внутренний вход" приводит к переходу фермента в конформационный состояние Е2 и последующего закрытия внутреннего и открытие внешнего канала. Для конформационного состояния Е2 характерно высокое сродство к ионам калия, которые замещают ионы натрия, выталкиваются. Связывание К+ и гидролиз АТФ вызывают возвращение АТ Фазы в восходящий

Рис. 7.
состояние Б,. Затем открывается внутренний канал, и ионы калия выталкиваются внутрь. Новый цикл требует новой молекулы АТФ.
Натриевый насос, его активность и количество не всегда стабильны. На активность насоса влияют синтезированные в клетке вторичные посредники на образец циклического аденозинмонофосфата (цАМФ), производные арахидоновой кислоты, диацилглицерол, а также внешние регуляторы, в частности гормоны. Например, йодсодержащие гормоны щитовидной железы увеличивают активность насоса.
Работа К+-Атфазы - один из наиболее энергозатратных механизмов: в среднем для ее функционирования тратится около 24 % всей энергии клеток, а в нейронах - до 70 %.
Са2+-А ТФаза. Энергетическая емкость этого насоса гораздо выше, чем Na+-, К+-Атфазы: для выкачивания одного Са2+ расходуется две АТФ, тогда как одна АТФ расходуется для транспортировки трех №+ и двух К1. Пусковой механизм этого насоса - сам кальций, малейшее изменение внутриклеточной концентрации которого запускает процесс его откачки.
Эндо - и екзоцитоз.
В некоторых клетках организма человека происходит особый вид транспортировки, что называется ендоцитозом. В следствие эндоцитозу в клетку проникают крупные частицы. Такой путь имеет две основные формы: пиноцитоз и фагоцитоз. С помощью пиноцитоза клетка поглощает небольшие капельки растворенных питательных веществ из внеклеточной жидкости и особенно - молекулы белков. Фагоцитоз обеспечивает проникновение в клетку крупных объектов, таких как бактерии, клетки, частицы разрушенной ткани.
пиноцитоза участвует клеточная мембрана большинства клеток, но особенно характерны эти механизмы для макрофагов, около 3 % мембраны которых постоянно задействованы в образовании пузырьков (везикул). Последние в диаметре достигают около 100-200 нм.
Типичный механизм поглощения белков. На поверхности мембраны клетки, в ее углублениях, размещены рецепторы для связывания с белком. На внутренней поверхности клетки к этому участку примыкает фибрилярный протеин (его называют клотрин) с актомиозиновыми белками. Взаимодействие белка, поглощаемого с рецептором приводит к углублению ямки, а сократительные белки закрывают края, вследствие чего образуется изолированный пузырек, где вместе с соединением, поглощается, оказывается часть внеклеточной жидкости. После этого пузырек отделяется от мембраны и проникает внутрь клетки, как правило, ближе к лизосом, ферменты которых расщепляют белок, что поступил.
Благодаря фагоцитоза клетки (а это в основном тканевые макрофаги и лейкоциты) поглощают субстанции, гораздо больше белковой молекулы (рис. 8).
От начала процесса фагоцитоза происходит связывание рецептора клетки с протеином или полицукридом мембраны бактерии или погибшей клетки. Когда начинается инвагинация мембраны, то все новые и новые участки мембраны фагоцита связываются с лигандами объекта, и постепенно клетка, фагоцитирует, оказывается погруженной в него. Сократительные белки сначала замыкают перешеек, а затем продвигают везикулу вглубь клетки.
Противоположный путь - екзоцитоз - это механизм, обеспечивающий выделение из клетки ряда веществ и процессы секреции. Немало органелл внутри клетки формируют пузырьки, заполненные веществом, которое по

Рис. 8.
нужно вывести из них. Типичными представителями таких соединений являются гормоны и ферменты, секретирующие железы.
Эндо - и екзоцитоз в клетках происходят непрерывно, к тому же у многих из них - достаточно интенсивно. Так, макрофаг всего за 1 час может поглощать в виде пузырьков двойную площадь поверхности своей цитоплазматической мембраны, что, естественно, должно успевать регенерировать.
Рецепторные белки.
Рецептор - это белковый комплекс, который воспринимает сигнал молекулы-передатчика. Рецептор может быть либо самостоятельной структурой, встроенной в мембрану в виде интегрального белка, или частью других функциональных белков, регулируя их активность. Причем до одного и того же химического агента на мембране могут быть несколько рецепторов. И эффект взаимодействия субстрата с рецептором может не всегда быть подобный, а в некоторых случаях даже диаметрально противоположный. Так, при взаимодействии гормона мозгового слоя надпочечников-адреналина (А) по-адренорецептором наблюдают сужение кровеносного сосуда, а с Р-рецептором - расширения.
Белки-ферменты
Немало периферических и отдельных фрагментов интегральных белков выполняют и ферментативные функции. Пример последних - указанные выше мембранные Атфазы, входящие в единую структуру ионных насосов.
Кроме того, белки-ферменты интегрального типа катализируют реакции, что, как правило, полностью перебегают с одной стороны биомембраны. К тому же, присоединив любой субстрат на одном боку, продукты реакции выделяют на противоположном. В таком случае ограниченная проницаемость мембран, обеспечивая пространственное разделение продуктов реакции, создает концентрационные градиенты.
Вторичные посредники.
Клетка имеет сложную систему внутриклеточных регуляторов активности - вторичных посредников. К ним относятся циклические нуклеотиды (цАМФ, цГМФ), кальций, кальций + кальмодулин, продукты гидролиза фосфолипидов (фосфорилированный фосфатыдилинозитол). Однако внутриклеточные системы регуляции ими не ограничиваются, выявлены новые соединения.
Вторичные посредники способствуют многочисленным изменениям в функциях клеток: превращают ферментную активность, стимулируют екзоцитоз, влияют на транскрипцию разных генов.
Все вторичные посредники активно взаимодействуют между собой. Обычно они находятся в клетке в сбалансированном соотношении, но после действия первого регулятора этот баланс нарушается, что и становится сигналом к изменению ее активности. Вторичные посредники влияют также и на чувствительность мембраны клетки к регулятору через регуляцию количества И сродства рецепторов к нему.