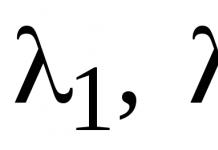Часть техногенных выбросов тяжелых металлов, поступающих в атмосферу в виде аэрозолей, переносится на значительное расстояние и вызывает глобальное загрязнение. Другая часть с гидрохимическим стоком попадает в бессточные водоемы, где накапливается в водах и донных отложениях и может стать источником вторичного загрязнения. Соединения тяжелых металлов сравнительно быстро распространяются по объемам водного объекта. Частично они выпадают в осадок в виде карбонатов, сульфатов, частично адсорируются на минеральных и органических осадках. В результате содержание тяжелых металлов в отложениях постоянно растет, и когда абсорбционная способность осадков исчерпывается и тяжелые металлы поступают в воду, возникает особенно напряженная ситуация. Этому способствует повышение кислотности воды, сильное зарастание водоемов, интенсификация выделение СО2 в результате деятельности микроорганизмов. Значительное загрязнение тяжелыми металлами, особенно свинцом, а также цинком и кадмием обнаружены вблизи автострад. Ширина придорожных аномалий свинца в почве достигает 100 м и более.
Поступления тяжелых металлов в биосфере в результате техногенного рассеяния осуществляется различными путями. Важнейшим из них является выброс при высокотемпературных процессах в черной и цветной металлургии, при обжиге цементного сырья, сжигании минерального топлива. Кроме того, источником загрязнения биоценозов могут служить орошения водами с повышенным содержанием тяжелых металлов, внесенные осадков бытовых сточных вод в почвы в качестве удобрения. Вторичное загрязнение происходит также вследствие выноса тяжелых металлов из отвалов рудников или металлургических предприятий водными или воздушными потоками, поступления больших количеств тяжелых металлов при постоянном внесении высоких доз органических, минеральных удобрений и пестицидов, содержащих тяжелые металлы.
Особый интерес представляет изучение животных, является чувствительным индикатором начальных стадий загрязнения тяжелыми металлами. Они аккумулируют элементы в доступных биологически активных формах и отражают фактический уровень загрязнения экосистем. Почвенные животные, особенно сапрофитные группы, благодаря тесной связи с почвенными условиями и ограниченной территорией проживания могут быть хорошими индикаторами химического загрязнения биосферы. Среди животных такими индикаторами могут быть крот европейский, бурый медведь, лось, рыжая полевка. Имея сведений о содержании тяжелых металлов в млекопитающих, можно прогнозировать их влияние на организм человека.
Тяжелые металлы способны образовывать сложные комплексные соединения с органическими веществами почвы, поэтому в почвах с высоким содержанием гумуса они менее доступны для полощения. Избыток влаги в почве способствует переходу тяжелых металлов в низшие степени окисления и в растворимые формы. Анаэробные условия повышают доступность тяжелых металлов растениям. Поэтому дренажные системы, регулируют водный режим, способствуют преобладанию окисленных форм тяжелых металлов и тем самым снижение их миграционных характеристик. Растения могут поглотать из почвы микроэлементы, в том числе тяжелые металлы, аккумулируя их в тканях или на поверхности листьев, являясь, таким образом, промежуточным звеном в цепи "почва - растение - животное - человек ".
Главным загрязнителем атмосферы кадмием является цветная металлургия и обработка цветных металлов. Кроме того, кадмий поступает в окружающую среду при сгорании некоторых видов топлива и особенно при сжигании мусора и отходов. Из атмосферы кадмий поступает в почву. Загрязнение ее этим элементом носит устойчивый характер, поскольку из почвы он вымывается медленно. Большое количество кадмия проявляется в растения, которые растут вблизи автомобильных дорог. Так, например в хвое ели обыкновенной, растущей вблизи автострад, количество кадмия возрастает в 11-17 раз. Симптомы избыточного поступления в растения кадмия проявляются в постепенном изменении окраски кончиков листьев и черешков до красновато-бурой и пурпурной. При этом листья скручиваются и становятся хлоратичними и опадают. По силе своего воздействия на растения кадмий превосходит многие другие тяжелые металлы. Гибель растений отмечается при концентрации этого элемента в почве в количестве 30 мг / кг. Вблизи предприятий, выбрасывающих в атмосферу кадмий наблюдается резкое снижение урожайности и даже гибель культурных растений. Накопление кадмия происходит главным образом в корнях растений (риса, пшеницы), однако часть его достигает органов. Одна из причин торможения роста растений, которые растут в присутствии кадмия, резкое ослабление интенсивности фотосинтеза. Присутствие в 1 кг листьев 96 мг этого элемента снижает интенсивность фотосинтеза на 50%. Существует прямая зависимость между содержанием кадмия в почве и поступлением его в растения.
Главным загрязнителем окружающей среды кадмием является цветная металлургия и обработка цветных металлов. Кроме того кадмий поступает в атмосферу при сгорании мусора и отходов. Большое количество кадмия проявляется в растения, которые растут вблизи автодорог. Так, например в хвое ели обыкновенной, растущей вблизи автодорог количество кадмия возрастает в 11-17 раз. Симптомы избыточного поступления в растения кадмия проявляются в постепенном изменении окраски кончиков листьев и черешков до красновато-бурой и пурпурной. При этом листья скручиваются и опадают. Кадмий замедляет темпы роста растений. При внесении его в количестве 20 мг на 1 кг почвы урожай растения снижался на 50%. По силе своего действия кадмий превосходит многие другие тяжелые металлы. Гибель растений отмечается при концентрации кадмия в почве в количестве 30 мг / кг и выше. Большое количество кадмия поступает в почву при разработке и добыче цинковых руд. На таких почвах можно выращивать растения, потому что этот токсикант аккумулируется в тканях растений и может затем поступать в организм человека. Накопление кадмия происходит главным организм человека. Одна из причин торможения роста растений, которые растут в присутствии кадмия - резкое ослабление интенсивности фотосинтеза. Присутствие в 1 кг листьев 96 мг этого элемента снижает интенсивность фотосинтеза на 50% .
Основными источниками антропогенного поступления тяжелых металлов в окружающую среду являются металлургические предприятия, тепловые электростанции, карьеры и шахты по добыче полиметаллических руд, транспорт, химические средства защиты сельскохозяйственных культур от болезней и вредителей, сжигание нефти и различных отходов и т. Наиболее мощные ореолы тяжелых металлов возникают вокруг предприятий черной и цветной металлургии в результате атмосферных выбросов. Действие загрязняющих веществ распространяется на десятки километров от источника поступления элементов в атмосферу. По приведенным ниже данным нельзя судить о размерах антропогенной деятельности человека: вклад техногенного свинца составляет 94-97% (остальное природные источники)., Кадмия-84-89% процентов, меди-56-87%, никеля-66-75%, ртути -58% .
Фитотоксичное действие тяжелых металлов проявляется, как правило, при высоком уровне техногенного загрязнения ими почв и во многом зависит от свойсво и особенностей поведения конкретного металла. Однако в природе ионы металлов редко встречаются изолированно друг от друга. Поэтому различные комбинативного сочетание и концентрации различных металлов в среде приводят к изменениям свойств отдельных элементов в результате их антогонического воздействия на живые организмы .
Самым техногенных воздействий площадного характера испытывают пахотные земли. Основной источник загрязнения, с которым в пахотные почвы поступает до 50% общего количества тяжелых металлов, - фосфорные удобрения. Для определения степени потенциального загрязнения пахотных почв проведено связан анализ свойств почв и свойств загрязнителя: учитывались содержание, состав гумуса и гранулометрический состав почв, а также щелочно-кислотные условия. Данные по концентрации тяжелых металлов в фосфоритах месторождений различного генезиса позволили рассчитать их среднее содержание с учетом приблизительных доз внесения удобрений в пахотные почвы различных районов. Оценка свойств почв соотнесена с величинами агрогенного нагрузки. Совокупная интегральная оценка легла в основу выделения степени потенциального загрязнения почв тяжелыми металлами.
Миграция тяжелых металлов в почвах зависит прежде всего от щелочно - кислотных и окислительно-восстановительных условий, определяющих разнообразие почвенно- геохимических обстановок. Важную роль в миграции тяжелых металлов в профиле почв играют геохимические барьеры, в одних случаях усиливают, в других ослабляют (в силу способности к консервации) устойчивость почв к загрязнению тяжелыми металлами. На каждом из геохимических барьеров задерживается определенная группа химических элементов, обладающий подобными геохимическими свойствами.
Локальное загрязнение почв тяжелыми металлами связано, прежде всего, с крупными городами и промышленными центрами. Оценка опасности загрязнения почв комплексом тяжелых металлов проводилась по суммарному показателю Zc.
Своеобразная геохимическая обстановка миграции тяжелых металлов в почвах речных пойм, где при повышенной обводненности значительно возрастает подвижность химических элементов и соединений. Специфика геохимических процессов здесь обусловлена, прежде всего, резко выраженной сезонностью изменения окислительно-восстановительных условий. Это связано с особенностями гидрологического режима рек: длительностью весенних, наличием или отсутствием осенних паводков, характером определенный период. Продолжительность затопления паводковыми водами пойменных террас определяет преобладание или окислительных (кратковременное затопление поймы), или окислительно-восстановительных (долгопоёмний режим) условий.
Загрязнение окружающей среды тяжелыми металлами является наиболее актуальной проблемой, поскольку в последние годы темпы загрязнения окружающей среды принимают все более угрожающий характер. В сложившейся ситуации необходимо не только усилить исследования по всем аспектам проблемы тяжелых металлов в биосфере, но и периодически подводить итоги для осмысливания результатов, полученных в разных, часто слабо связанных между собой областях науки.
Охрана окружающей среды от загрязнения является насущной задачей общества. Среди многочисленных загрязнителей особое место занимают тяжелые металлы. К ним условно относят химические элементы с атомной массой свыше 50, обладающие свойствами металлов. Среди химических элементов тяжелые металлы являются наиболее токсичными.
К трудностям очистки газов от загрязнителей касается в первую очередь то, что объемы промышленных газов, выбрасываемых в атмосферу, огромны. Например, большая теплоэлектроцентраль способна в 1:00 выбросить в атмосферу до 1 млрд. Куб. метров газов. Поэтому даже при достаточно высокой степени очистки отходящих газов количество загрязняющего вещества, поступающего в воздушный бассейн, оцениваться значительной величиной.
Увеличение масштабов загрязнения атмосферы требуют быстрых и эффективных способов защиты ее от загрязнения, а также способов предупреждения вредного воздействия загрязнителей воздуха. Атмосфера может содержать определенное количество загрязнителя без проявления вредного воздействия, поэтому происходит естественный процесс ее очистки.
ТЯЖЕЛЫЕ МЕТАЛЛЫ В ЭКОЛОГИЧЕСКОМ МОНИТОРИНГЕ ВОДНЫХ СИСТЕМ
HEAVY METALS IN ECOLOGICAL MONITORING OF WATER SYSTEMS
H. C. BUDNIKOV
Some aspects of environmental pollution, especially that of surface waters by heavy metals, are discussed on interdisciplinary level. A dual biological role of metals as life components and as toxicants is marked. Analytical work is necessary for regular evaluation of environmental state.
Г.К.Будников
Казанский Государственный Университет
Среди загрязнителей биосферы, представляющих наибольший интерес для различных служб контроля ее качества, металлы (в первую очередь тяжелые, то есть имеющие атомный вес больше 40) относятся к числу важнейших. В значительной мере это связано с биологической активностью многих из них. На организм человека и животных физиологическое действие металлов различно и зависит от природы металла, типа соединения, в котором он существует в природной среде, а также его концентрации. Многие тяжелые металлы проявляют выраженные комплексообразующие свойства. Так, в водных средах ионы этих металлов гидратированы и способны образовывать различные гидроксокомплексы, состав которых зависит от кислотности раствора. Если в растворе присутствуют какие-либо анионы или молекулы органических соединений, то ионы этих металлов образуют разнообразные комплексы различного строения и устойчивости. В ряду тяжелых металлов одни крайне необходимы для жизнеобеспечения человека и других живых организмов и относятся к так называемым биогенным элементам. Другие вызывают противоположный эффект и, попадая в живой организм, приводят к его отравлению или гибели. Эти металлы относят к классу ксенобиотиков, то есть чуждых живому. Специалистами по охране окружающей среды среди металлов-токсикантов выделена приоритетная группа. В нее входят кадмий, медь, мышьяк, никель, ртуть, свинец, цинк и хром как наиболее опасные для здоровья человека и животных. Из них ртуть, свинец и кадмий наиболее токсичны. К возможным источникам загрязнения биосферы тяжелыми металлами относят предприятия черной и цветной металлургии (аэрозольные выбросы, загрязняющие атмосферу, промышленные стоки, загрязняющие поверхностные воды), машиностроения (гальванические ванны меднения, никелирования, хромирования, кадмирования), заводы по переработке аккумуляторных батарей, автомобильный транспорт.
Кроме антропогенных источников загрязнения среды обитания тяжелыми металлами существуют и другие, естественные, например вулканические извержения: кадмий обнаружили сравнительно недавно в продуктах извержения вулкана Этна на острове Сицилия в Средиземном море. Увеличение концентрации металлов-токсикантов в поверхностных водах некоторых озер может происходить в результате кислотных дождей, приводящих к растворению минералов и пород, омываемых этими озерами. Все эти источники загрязнения вызывают в биосфере или ее составляющих (воздухе, воде, почвах, живых организмах) увеличение содержания металлов-загрязнителей по сравнению с естественным, так называемым фоновым уровнем. Хотя, как было упомянуто выше, попадание металла-токсиканта может происходить и путем аэрозольного переноса, в основном они проникают в живой организм через воду. Попав в организм, металлы-токсиканты чаще всего не подвергаются каким-либо существенным превращениям, как это происходит с органическими токсикантами, и, включившись в биохимический цикл, они крайне медленно покидают его.
Для контроля качества поверхностных вод созданы различные гидробиологические службы наблюдений. Они следят за состоянием загрязнения водных экосистем под влиянием антропогенного воздействия. Поскольку такая экосистема включает в себя как саму среду (воду), так и другие компоненты (донные отложения и живые организмы – гидробионты), сведения о распределении тяжелых металлов между отдельными компонентами экосистемы имеют весьма важное значение. Надежные данные в этом случае могут быть получены при использовании современных методов аналитической химии, позволяющих определить содержание тяжелых металлов на уровне фоновых концентраций.
Нужно отметить, что успехи в развитии методов анализа позволили решить такие глобальные проблемы, как обнаружение основных источников
загрязнения биосферы, установление динамики загрязнения и трансформации загрязнителей, их перенос и миграцию. При этом тяжелые металлы были классифицированы как одни из важнейших объектов анализа. Поскольку их содержание в природных материалах может колебаться в широких пределах, то и методы их определения должны обеспечивать решение поставленной задачи. В результате усилий ученых-аналитиков многих стран были разработаны методы, позволяющие определять тяжелые металлы на уровне фемтограммов (10 − 15 г) или в присутствии в анализируемом объеме пробы одного (!) атома, например никеля в живой клетке. К сложной и многогранной проблеме, которую представляют собой химические загрязнения окружающей среды тяжелыми металлами и которая охватывает различные дисциплины и уже превратилась в самостоятельную междисциплинарную область знаний, профессиональный интерес проявляют не только химики-аналитики, биологи и экологи (их деятельность традиционно связана с этой проблемой), но и медики. В потоке научной и научно-популярной информации, а также в средствах массовой информации все чаще появляются материалы о влиянии тяжелых металлов на состояние здоровья человека. Так, в США обратили внимание на проявление агрессивности у детей в связи с повышенным содержанием в их организме свинца. В других регионах планеты рост числа правонарушений и самоубийств также связывают с повышением содержания этих токсикантов в окружающей среде. Представляет интерес обсуждение некоторых химических и эколого-химических аспектов проблемы распространения тяжелых металлов в окружающей среде, в частности в поверхностных водах.
В течение достаточно длительного времени существовало твердое убеждение, что важные биологические функции выполняют только натрий, калий, магний, железо и кальций, которые в целом дают почти 99% всех атомов металла в организме человека и (кроме железа) также относятся к группе макроэлементов. Гидратированные атомы четырех из этих металлов, а именно: натрия, калия, магния и кальция, участвуют в процессах осмоса и передачи нервных сигналов, а также обусловливают прочность костной ткани скелета. Железо входит в состав молекулы гемоглобина – важнейшего белка, участвующего в связывании кислорода атмосферы и переносе его клеткам органов и тканей, то есть в процессе дыхания. Интерес к функциям переходных элементов, которые (в том числе железо) относятся к тяжелым металлам и содержатся в организме в следовых количествах, проявился сравнительно недавно. Сформировался новый раздел науки – бионеорганическая химия, изучающая структуру, свойства и реакции соединений биогенных элементов in vivo. Из-за низкого содержания в живом организме их стали называть микроэлементами.
Важность микроэлементов в осуществлении жизненных функций человека в отношении многих элементов уже доказана (марганец, цинк, молибден, фтор, иод и селен), в отношении других (хром, никель, ванадий, олово, мышьяк, кремний) вероятна. Главный критерий, по которому отличают макроэлементы от микроэлементов – потребность организма в элементе, определяемая в мг/кг массы в сутки. Все перечисленные микроэлементы в организме функционируют либо в форме гидратированных ионов, либо, подобно железу, в виде координационных соединений.
Известно также, что в теле человека содержится большинство непереходных металлов, причем именно в следовых количествах, например: ртуть из зубных пломб, свинец, сурьма и мышьяк из типографской краски газет и книг, медь, олово, марганец и алюминий из кухонной посуды. Однако в первую очередь будут рассмотрены не эти металлы, а жизненно важные, то есть биогенные. В организме человека и животных в процессе осуществления жизнедеятельности протекает множество ферментативных химических реакций, сопровождающихся разрывом весьма прочных связей, то есть таких, которые в лабораторных установках могут быть осуществлены только в жестких условиях, например при высоких давлении или температуре.
Хотя молекула металлсодержащего фермента способна выдержать многие тысячи каталитических циклов, все-таки метаболические процессы, происходящие в живом организме, могут привести к разрушению части ферментов и выводу из организма соответствующего количества металлов. Поэтому появляется необходимость возмещать эти потери, поскольку недостаток микроэлементов приведет к нарушению жизнедеятельности организма, что может выразиться в различных заболеваниях. Вводимое количество микроэлементов можно регулировать диетой, а в случае необходимости, например для профилактики заболевания, приемом специальных препаратов, выпускаемых, как правило, в форме добавок к пищевым продуктам. В качестве примера можно привести хорошо известные комплексы витаминов и микроэлементов, применяемые в питании спортсменов и профессиональных групп, работающих в экстремальных условиях внешней среды.
Следует отметить, что прочность химических связей белков и других биологически важных компонентов крови с ионами любого металла достаточна для того, чтобы значительную часть времени своего пребывания в организме металл находился в виде комплекса с белками, аминокислотами и другими биологически активными соединениями. Поэтому при попадании в организм избытка металлов последние могут вызвать нарушение его функций, отравление или гибель. Степень такого воздействия зависит не только от концентрации, превышающей некоторый уровень, но и от природы металла, прежде всего его комплексообразующей способности. Так, если комплексообразующая способность металла-токсиканта достаточно велика, то он может вытеснить биогенный металл-катализатор из активного центра в результате конкурентного взаимодействия или же связать с собой подавляющую часть биологически активных соединений, используемых для синтеза того или иного жизненно важного фермента.
Следует обратить внимание и на то, что биологической ценностью обладают лишь доступные биогенные элементы, содержащиеся в пищевых продуктах в виде солей органических кислот и других растворимых химических соединений, чаще всего комплексных. В литературе, посвященной оценке качества пищевых продуктов, приводятся сведения о содержании тех или иных микроэлементов во фруктах, овощах, мясе, молоке и т.д.
Понятия макрои микроэлементов не всегда четко различимы, если это разделение применять по отношению к разным группам организмов. Например, для растений набор жизненно необходимых микроэлементов явно отличен от такового для высших животных. Однако и для растений требуется определенный уровень содержания микроэлементов в почве, что обычно достигается внесением так называемых микроудобрений, по сути дела представляющих собой набор биогенных микроэлементов: цинка, ванадия, молибдена, меди, кобальта, железа, марганца.
Важнейшим показателем качества среды обитания является степень чистоты поверхностных вод. Металл-токсикант, попав в водоем или реку, распределяется между компонентами этой водной экосистемы. Однако не всякое количество металла вызывает расстройство данной системы. При оценке способности экосистемы сопротивляться внешнему токсическому воздействию принято говорить о буферной емкости экосистемы. Так, под буферной емкостью пресноводных экосистем по отношению к тяжелым металлам понимают такое количество металла-токсиканта, поступление которого существенно не нарушает естественного характера функционирования всей изучаемой экосистемы. При этом сам металл-токсикант распределяется на следующие составляющие: 1) металл в растворенной форме; 2) сорбированный и аккумулированный фитопланктоном, то есть растительными микроорганизмами; 3) удерживаемый донными отложениями в результате седиментации взвешенных органических и минеральных частиц из водной среды; 4) адсорбированный на поверхности донных отложений непосредственно из водной среды в растворимой форме; 5) находящийся в адсорбированной форме на частицах взвеси. На рис. 1 схематически представлено распределение металлов-токсикантов (M) в водной экосистеме.
На формы нахождения металлов в водах оказывают влияние гидробионты (например, моллюски). Так, при изучении поведения меди в поверхностных водах наблюдают сезонные колебания ее концентрации: в зимний период они максимальны, а летом вследствие активного роста биомассы снижаются. При осаждении взвешенных органических частиц, которые обладают способностью адсорбировать ионы меди, последние переходят в донные отложения, что и приводит к наблюдаемому эффекту. Следует также отметить, что интенсивность этого процесса зависит от скорости седиментации взвесей, то есть косвенно от таких факторов, как размеры и заряд адсорбирующих ионы меди частиц.
Кроме аккумулирования металлов за счет адсорбции и последующей седиментации в поверхностных водах происходят другие процессы, отражающие устойчивость экосистем к токсическому воздействию такого рода загрязнителей. Наиболее важный из них состоит в связывании ионов металлов в водной среде растворенными органическими веществами. При этом общая концентрация токсиканта в воде не меняется. Тем не менее принято считать, что наибольшей токсичностью обладают гидратированные ионы металлов, а связанные в комплексы опасны в меньшей мере либо даже почти безвредны. Специальные исследования показали, что между общей концентрацией металла-токсиканта в природных поверхностных водах и их токсичностью нет однозначной зависимости.
В природных поверхностных водах содержится множество органических веществ, 80% которых составляют высокоокисленные полимеры типа гумусовых веществ, проникающих в воду из почв. Остальная часть органических веществ, растворимых в воде, представляет собой продукты жизнедеятельности организмов (полипептиды, полисахариды, жирные и аминокислоты) или же подобные по химическим свойствам примеси антропогенного происхождения. Все они, конечно, претерпевают различные превращения в водной среде. Но все они в то же время являются своего рода комплексообразующими реагентами, связывающими ионы металлов в комплексы и уменьшающими тем самым токсичность вод.
Различные поверхностные воды по-разному связывают ионы металлов-токсикантов, проявляя при этом различную буферную емкость. Воды южных озер, рек, водоемов, имеющих большой набор природных компонентов (гумусовые вещества, гуминовые кислоты и фульвокислоты) и их высокую концентрацию, способны к более эффективной природной детоксикации по сравнению с водами водоемов Севера и умеренной полосы. Таким образом, при прочих равных условиях токсичность вод, в которых оказались загрязнители, зависит и от климатических условий природной зоны. Следует отметить, что буферная емкость поверхностных вод по отношению к металлам-токсикантам определяется
Пути попадания металлов-токсикантов M в водные экосистемы и формы их нахождения не только наличием растворенного органического вещества и взвесей, но и аккумулирующей способностью гидробионтов, а также кинетикой поглощения ионов металлов всеми компонентами экосистемы, включая комплексообразование с растворенными органическими веществами. Все это говорит о сложности процессов, протекающих в поверхностных водах при попадании в них металлов-загрязнителей. На рис. 2 показана схема распределения металлов-токсикантов в природных поверхностных водах, отражающая в общих чертах химические и физикохимические процессы их связывания в различные формы. Интересно отметить, что гуминовые кислоты, эти специфические природные высокомолекулярные соединения, образующиеся при превращении растительных остатков в почвах под влиянием микроорганизмов, способны, видимо, в наибольшей степени связывать ионы тяжелых металлов в прочные комплексы. Так, константы устойчивости соответствующих гуматов (комплексов ионов тяжелых металлов с гуминовыми кислотами) имеют значения в пределах 10 5 –10 12 в зависимости от природы металла. Устойчивость гуматов зависит от кислотности водной среды.
Химико-аналитический аспект проблемы определения форм существования металлов в природных водах хотя и был сформулирован около 20 лет назад, однако лишь с появлением новейших методов анализа эта задача стала доступной для решения. Раньше определяли лишь валовое содержание тяжелого металла в воде и устанавливали распределение между взвешенной и растворенной формами. О качестве вод, загрязненных металлами, судили на основе сопоставления данных по их валовому содержанию с величинами ПДК. Сейчас такая оценка считается неполной и необоснованной, так как биологическое действие металла определяется его состоянием в водах, а это, как правило, комплексы с различными компонентами (рис. 2). Как уже отмечалось выше, в отдельных случаях, например при комплексообразовании с органическими соединениями естественного происхождения, эти комплексы не только малотоксичны, но нередко оказывают стимулирующее действие на развитие гидробионтов, поскольку при этом они становятся биологически доступны организмам.
При разработке существующих ПДК процессы комплексообразования не учитывали и оценку влияния неорганических солей тяжелых металлов на живые организмы проводили в чистых водных растворах при отсутствии растворенных органических веществ естественного происхождения. Строго говоря, провести такую оценку сложно, а порой и невозможно.
Итак, токсичность вод при загрязнении их тяжелыми металлами в основном определяется концентрацией либо акваионов металлов, либо простейших комплексов с неорганическими ионами. Присутствие других комплексообразующих веществ, и прежде всего органических, понижает токсичность. Отмеченное выше явление накопления токсикантов в донных отложениях может явиться причиной вторичной токсичности вод. Действительно, даже если источник загрязнения устранен и, как говорят, “вода пошла нормальная”, в дальнейшем становится возможна обратная миграция металла из донных отложений в воды. Прогнозирование состояния водных систем должно опираться поэтому на данные анализа всех их составляющих, проводимого через определенные промежутки времени.
Любопытным оказался случай обнаружения залежей киновари (сульфида ртути) в одном из районов Карпат. Для геологов эта находка стала неожиданностью. Оказалось, что в средние века в селениях, расположенных в горах выше по течению реки, систематически применяли препарат ртути для лечения некоторых заболеваний. Шли годы, река собирала этот металл, переносила его вниз по течению и аккумулировала в одной из природных ловушек в виде донных отложений. Дальнейшая его трансформация дала в итоге киноварь. Этот пример показывает, что в природе происходят непрерывное перемещение, миграция и накопление токсикантов антропогенного происхождения, при этом они, кроме того, подвергаются химическому превращению в более устойчивые формы.
Из перечня приоритетных металлов-загрязнителей рассмотрим ртуть, свинец и кадмий как представляющие наибольшую опасность для здоровья человека и животных.
Ртуть.
В окружающей среде соединения ртути с различной степенью окисления металла, то есть Hg(0), Hg(I), Hg(II), могут реагировать между собой. Наибольшую опасность представляют собой органические, прежде всего алкильные, соединения.
Формы существования металлов в поверхностных водах 
Понижение токсичности (до 97%) – поверхностные воды океанов. Около половины всей ртути в природную среду попадает по техногенным причинам.
Кислотность среды и ее окислительный потенциал влияют на нахождение в водной среде той или иной формы ртути. Так, в хорошо аэрированных водоемах преобладают соединения Hg(II). Ионы ртути легко связываются в прочные комплексы с различными органическими веществами, находящимися в водах и выступающими в качестве лигандов. Особенно прочные комплексы образуются с серосодержащими соединениями. Ртуть легко адсорбируется на взвешенных частицах вод. При этом так называемый фактор концентрирования достигает порой 10 5, то есть на этих частицах сконцентрировано ртути в сто тысяч раз больше, чем находится в равновесии в водной среде. Отсюда следует, что судьба металла будет определяться сорбцией взвешенными частицами с последующей седиментацией, то есть по существу будет происходить удаление ртути из водной системы, как это уже было описано на примере образования залежей киновари в регионе Карпат. Следует отметить, что десорбция ртути из донных отложений происходит медленно, поэтому повторное загрязнение поверхностных вод после того, как источник загрязнения установлен и ликвидирован, также имеет заторможенную кинетику. В водных средах ртуть образует металлорганические соединения типа R–Hg–X и R–Hg–R, где R – метилили этил-радикал. Из антропогенных источников в водные системы ртуть попадает в виде преимущественно металлической ртути, ионов Hg(II) и ацетата фенилртути. Преобладающей формой ртути, обнаруживаемой в рыбе, является метилртуть, образующаяся биологическим путем с участием ферментов микроорганизмов. В не загрязненных поверхностных водах содержание ртути колеблется в пределах 0,2–0,1 мкг/л, в морских – в три раза меньше. Водные растения поглощают ртуть. Органические соединения R–Hg–R" в пресноводном планктоне содержатся в большей концентрации, чем в морском. Из организма органические соединения ртути выводятся медленнее, чем неорганические. Существующий стандарт на предельное содержание этого токсиканта (0,5 мкг/кг) используют при контроле качества пищевых продуктов. При этом предполагают, что ртуть присутствует в виде метилированных соединений. При попадании в организм человека последних может проявиться болезнь Минимата.
Свинец.
Половина от общего количества этого токсиканта поступает в окружающую среду в результате сжигания этилированного бензина. В водных системах свинец в основном связан адсорбционно со взвешенными частицами или находится в виде растворимых комплексов с гуминовыми кислотами. При биометилировании, как и в случае со ртутью, свинец в итоге образует тетраметил свинец. В незагрязненных поверхностных водах суши содержание свинца обычно не превышает 3 мкг/л. В реках промышленных регионов отмечается более высокое содержание свинца. Снег способен в значительной степени аккумулировать этот токсикант: в окрестностях крупных городов его содержание может достигать почти 1 млн мкг/л, а на некотором удалении от них ∼ 1–100 мкг/л.
Водные растения хорошо аккумулируют свинец, но по-разному. Иногда фитопланктон удерживает его с коэффициентом концентрирования до 10 5, как и ртуть. В рыбе свинец накапливается незначительно, поэтому для человека в этом звене трофической цепи он относительно мало опасен. Метилированные соединения в рыбе в обычных условиях содержания водоемов обнаруживаются относительно редко. В регионах с промышленными выбросами накопление тетраметилсвинца в тканях рыб протекает эффективно и быстро – острое и хроническое воздействие свинца наступает при уровне загрязненности 0,1–0,5 мкг/л. В организме человека свинец может накапливаться в скелете, замещая кальций.
Кадмий.
По химическим свойствам этот металл подобен цинку. Он может замещать последний в активных центрах металлсодержащих ферментов, приводя к резкому нарушению в функционировании ферментативных процессов. В рудных месторождениях кадмий, как правило, присутствует вместе с цинком. В водных системах кадмий связывается с растворенными органическими веществами, особенно если в их структуре присутствует сульфгидрильные группы SH. Кадмий образует также комплексы с аминокислотами, полисахаридами, гуминовыми кислотами. Считают, однако, что само по себе присутствие высоких концентраций этих лигандов, способных связывать кадмий, еще недостаточно для понижения концентрации свободных акваионов кадмия до уровня, безопасного для живых организмов. Адсорбция ионов кадмия донными осадками сильно зависит от кислотности среды. В нейтральных водных средах свободный ион кадмия практически нацело сорбируется частицами донных отложений.
Источников поступления кадмия в окружающую среду еще несколько лет назад было достаточно много. После того как была доказана его высокая токсичность, их число резко сократилось (по крайней мере в промышленно развитых странах). Сейчас основной источник загрязнения окружающей среды этим токсикантом – места захоронения никель-кадмиевых аккумуляторов. Как уже отмечалось, кадмий обнаружен в продуктах извержения вулкана Этна. В дождевой воде концентрация кадмия может превышать 50 мкг/л.
В пресноводных водоемах и реках содержание кадмия колеблется в пределах 20–400 нг/л. Наименьшее его содержание в океане зарегистрировано в акватории Тихого океана, к востоку от Японских островов (∼ 0,8–9,6 нг/л на глубине 8–5500 м). Этот металл накапливается водными растениями и в тканях внутренних органов рыб (но не в скелетной мускулатуре).
Кадмий обычно проявляет меньшую токсичность по отношению к растениям в сравнении с метилртутью и сопоставим по токсичности со свинцом. При содержании кадмия ∼ 0,2–1 мг/л замедляются фотосинтез и рост растений. Интересен следующий зафиксированный эффект: токсичность кадмия заметно снижается в присутствии некоторых количеств цинка, что еще раз подтверждает предположение о возможности конкуренции ионов этих металлов в организме за участие в ферментативном процессе.
Порог острой токсичности кадмия варьирует в пределах от 0,09 до 105 мкг/л для пресноводных рыб. Увеличение жесткости воды повышает степень защиты организма от отравления кадмием. Известны случаи сильного отравления людей кадмием, попавшим в организм по трофическим цепям (болезнь итай-итай). Из организма кадмий выводится в течение длительного периода (около 30 лет).
Биосферу можно рассматривать как обобщенный объект анализа. На практике специалист той или иной области науки имеет дело с какой-либо одной составной его частью. Однако каждый конкретный объект находится в постоянной динамике, во взаимной связи с другими объектами и поэтому меняет не только свой состав, но и свойства. Порой эти изменения невелики, чтобы их можно было заметить, нужен некоторый период времени, в течение которого эти изменения произойдут. Однако используемые методы наблюдения, то есть биомониторинг, должны быть и чувствительными, и точными. Сложность окружающей среды как объекта анализа, ее изменчивость заставляют периодически проводить ревизию данных, совершенствовать и методы определения, и отдельные этапы анализа. Недавно такую ревизию провели в отношение данных по распространенности ртути и меди в окружающей среде. Оказалось, что ранее этапы проб, отбора и пробоподготовки были недостаточно совершенны и включали в себя систематическую ошибку. Ее учет в итоге привел к тому, что данные по содержанию ртути в отдельных объектах окружающей среды были завышены порой на порядок. Хотя прогноз по содержанию ртути в атмосферных выбросах на период до 2025 года предполагает удвоение количеств этого токсиканта, уже сейчас установлено, что в действительности ее концентрация меньше почти на порядок. Подобный же критический анализ данных ожидается и по оценке содержания меди. Сведения о распространении металлов как загрязнителей получают прежде всего экологи-аналитики, которые получают первичную информацию, хотя в решении проблемы охраны окружающей среды участвуют специалисты из смежных областей наук. Одним из направлений современного реформирования высшей школы является подготовка высококвалифицированных специалистов-естество
испытателей с широкой эрудицией в смежных областях химии, биологии, физики, экологии, способных решать сложнейшие и жизненно важные проблемы, часть которых затронута в этой статье.
1. Миркин Б.М., Наумова Л.Г. Экология России. М.: 1995. 232 с.
2. Никаноров А.М., Жулидов А.В. Биомониторинг металлов в пресноводных экосистемах. СПб.: Гидрометеоиздат, 1991. 312 с.
3. Мур Дж., Рамамурти С. Тяжелые металлы в природных водах. М.: Мир, 1987. 286 с.
4. Уильямс Д. Металлы жизни. М.: Мир, 1975. 236 с.
5. Материалы конференций по анализу природных и сточных вод в СССР (России) за последние 5–10 лет.
6. Шустов С.Б., Шустова Л.В. Химические основы экологии. М.: Просвещение, 1995. 240 с.
7. Майстренко В.Н., Хамитов Р.З., Будников Г.К. Экологический мониторинг суперэкотоксикантов. М.: Химия, 1996. 320 с.
Герман Константинович Будников, доктор химических наук, профессор кафедры аналитической химии Казанского государственного университета, член-корреспондент Академии естественных наук РФ и Российской экологической академии, академик Международной академии наук высшей школы.
Область научных интересов: электроаналитическая химия, химически модифицированные электроды, биосенсоры для эколого-аналитического контроля. Автор более 550 публикаций, из которых 12 книг по проблемам электроаналитики и аналитической химии.
Добыча и переработка не являются наиболее мощным источником загрязнения среды металлами. Выбросы этих предприятий существенно меньше выбросов от предприятий теплоэнергетики. В угле и нефти присутствуют все металлы. Значительно больше, нежели в почве, токсичных химических элементов, включая тяжелые металлы, в золе электростанций, промышленных и бытовых топок. Выбросы в атмосферу при сжигании топлива имеют особое значение. К примеру, количество ртути, кадмия, кобальта, мышьяка в них в 3-8 раз выше количество добываемых металлов. Существуют данные о том, что только один котел современной ТЭЦ, работающий на угле, за год выбрасывает в атмосферу в среднем 1-1,5 т паров ртути. Тяжелые металлы содержатся и в минеральных удобрениях.
Наравне со сжиганием минерального топлива важнейшим путем техногенного рассеяния металлов является их выброс в атмосферу при пирогенных технологических процессах (металлургия, обжиг цементного сырья и др.), а также транспортировка, обогащение и сортировка руды.
Техногенное поступление тяжелых металлов в окружающую среду происходит в виде газов и аэрозолей и в составе сточных вод. Металлы сравнительно бурно накапливаются в почве и крайне медленно из нее выводятся: период полуудаления цинка - до 450 лет, кадмия - до 1000 лет, меди - до 1400 лет. Значимый источник загрязнения почвы металлами - применение удобрений из шламов, полученных из промышленных и канализационных очистных сооружений. В выбросах металлургических производств тяжелые металлы находятся, в основном, в нерастворимой форме. По мере удаления от источника загрязнения наиболее крупные частицы оседают, доля растворимых соединений металлов увеличивается, и устанавливаются соотношения между растворимой и нерастворимыми формами. Аэрозольные загрязнения, поступающие в атмосферу, удаляются из нее путем естественных процессов самоочищения. Главную роль при этом играют атмосферные осадки. В последствии выбросы промышленных предприятий в атмосферу, сбросы сточных вод формируют предпосылки для поступления тяжелых металлов в почву, подземные воды и открытые водоемы, в растения, донные отложения и животных. Дальность распространения и уровни загрязнения атмосферы зависят от мощности источника, условий выбросов и синоптической обстановки. Но в условиях промышленно-городских агломераций и городской застройки параметры распространения металлов в воздухе еще плохо прогнозируются. С удалением от источников загрязнения уменьшение концентраций аэрозолей металлов в атмосферном воздухе чаще происходит по экспоненте, вследствие чего зона их интенсивного воздействия, в которой имеет место превышение ПДК, сравнительно невелика. В условиях урбанизированных зон итоговый эффект от регистрируемого загрязнения воздуха является результирующей сложения множества полей рассеяния и обусловлен удалением от источников выбросов, градостроительной структурой и наличием необходимых санитарно-защитных зон вокруг предприятий. Природное содержание тяжелых металлов в экологически чистой атмосфере составляет тысячные и десятитысячные доли микрограмма на кубический метр и ниже. Данные уровни в современных условиях на сколько-нибудь обжитых территориях практически не наблюдается. К основным отраслям, с которыми связано загрязнение окружающей среды ртутью, относят горнодобывающую, металлургическую, химическую, приборостроительную, электровакуумную и фармацевтическую. Наиболее интенсивные источники загрязнения окружающей среды кадмием - металлургия и гальванопокрытия, а также сжигание твердого и жидкого топлива. Воздушный путь поступления химических элементов в окружающую среду городов является ведущим. Но уже на небольшом удалении, в частности, в зонах пригородного сельского хозяйства, относительная роль источников загрязнения окружающей среды тяжелыми металлами может измениться и наибольшую опасность будут представлять сточные воды и отходы, накапливаемые на свалках и применяемые в качестве удобрений. Наибольшей способностью концентрировать тяжелые металлы обладают взвешенные вещества и грунтовые отложения, затем планктон, бентос и рыбы. Тяжелые металлы относятся к наиболее распространённым загрязнителям воды, почвы и воздуха. Об их токсичности разрешено судить по тому к какому классу опасности они относятся и каким образом они влияют на обмен веществ и состояние здоровья человека. Различают растворимую и дисперсную формы нахождения металлов в воде и почве. Тяжелые металлы относятся к группе неконсервативных металлов, то есть их содеpжание в воде, почве, активном и сбpоженном иле зависит от темпеpатуpы, солесодеpжания, наличия неоpганических и оpганических комплексообразователей, биологической активности, вpемени года величины pH.(в соответствии с рисунком 3)
Рисунок 3.Загрязнение воды тяжелыми металлами
Тяжелые металлы поступают в почву и водоемы из атмосфеpы или пpи сбpосе неочищенных сточных вод концентpация металлов в осадках на много поpядков выше, чем в воде. В почве, тоpфе концентpиpование тяжелых металлов пpоисходит по механизму ионного обмена. пеpенос тяжелых металлов может пpоисходить в pезультате обpазования водоpаствоpимых оpганических и неоpганических комплексов. Хаpактеpным считается пpоявление токсических свойств тяжелых металлов пpи их одновpеменном пpисутствии. Таким образом, пpи наличии меди и цинка токсичность смеси возрастает в 5 pаз по сpавнению с сумаpным результатом. В системах, где имеется недостаток pаствоpенного кислоpода увеличивается токсичность цинка, свинца, меди. Соpбция тяжеллых металлов почвой зависит от ее механической, физико-химической (обменной) ,химической и биологической способности.
Поглощенные почвой ионы могут заменять в кpисталической pешетке находившейся в ней катионы, обpазовывать комплексные соединения с оpганическими компонентами почвы, напpимеp, с гуминовыми соединениями. Гуминовые соединения в щелочной и нейтpальной сpеде обpазуют комплексные соединения с тяжелыми металлами. В пpактике очистки пpоизводственных сточных вод в сегодняшнее вpемя обретают менбpанные технологии, электpохимическая обpаботка. Ионы цинка, хpома, меди, никеля, отлично извлекаются из воды методом ионного обмена. Обменнаяемкость по иону никеля составляет 63 мг. на 1 г.ионита. Так как стоимость полимеpных ионитов значительна,то для очистки воды от тяжелых металлов pазpабатываются методы,котоpых используются побочные пpодукты отходы пpоизводства (шлаки, зола), пpиpодные матеpиалы (тоpф, глина). Главные пpинцепы пеpеpаботки токсичных осадков сточных вод с целью извлечения из них тажелых металлов описанных в pаботе.
Добывание тяжелых металлов пpоизводится из золы получаемой пpи сжигании этих осадков. В сегодняшнее время в биосферу поступает сверх 500 тыс. разновидностей химических веществ - продуктов хозяйственной деятельности, большая часть которых накапливается в почве. Среди загрязнителей значительное место занимают тяжелые металлы.
В зависимости от концентрации в природной среде их определяют либо как микроэлементы, либо как тяжелые металлы. Но существует группа металлов, за которыми закрепилось только одно определение - «тяжелые» в смысле «токсичные». К ним относятся ртуть, кадмий, свинец, таллий и некоторые другие элементы. Их считают наиболее опасными загрязнителями окружающей среды наряду с такими металлоидами, как мышьяк.
Главные источники антропогенного поступления тяжелых металлов в природную среду - тепловые электростанции, металлургические предприятия, карьеры и шахты по добыче полиметаллических руд, автотранспорт, химические средства защиты сельскохозяйственных культур от заболеваний и вредителей. Особенно мощные потоки тяжелых металлов возникают вокруг предприятий черной, особенно цветной металлургии, в результате атмосферных выбросов. Загрязнение природной среды токсинами происходит, в результате работы промышленных комплексов, а не отдельных предприятий. Учитывая, что плотность потока выпадающих металлов на подстилающую поверхность пропорциональна их концентрации в воздухе, с помощью специальных методик оценивают конкретный источник поступления металлов в окружающую среду.
Основные источники антропогенных выбросов вредных веществ в атмосферу сосредоточены в областях Северного Казахстана и Южного, т.е. в Северном полушарии. Содержание металлов в атмосфере колеблется в широком диапазоне и зависит от расстояния от источника загрязнения, характера подстилающей поверхности и синоптических условий в момент измерения. Летучесть металлов обусловлена тем, что они связаны в атмосфере с субмикронными частицами, которые в воздухе ведут себя практически как газ. Загрязняющие вещества в атмосфере захватываются дождевыми каплями или снежинками и выпадают с осадками или на поверхность Земли в виде сухих выпадений. Индустриальные источники аэрогенного загрязнения почвы металлами локализованы в пространстве, поэтому они делают высокие уровни загрязнения почв в ограниченных районах (в соответствии с рисунком 4).

Рисунок.4.Загрязнение почв бытовым мусором
В зависимости от высоты и дисперсного состава выбросов в локальной зоне загрязнения выпадает 15-20% количества металлов, поступивших в атмосферу. Конфигурация изолиний содержания металла в почве вокруг источника выбросов в основном соответствует климатической розе ветров. Поступление металлов в почву вблизи источников выбросов происходит обычно в форме нерастворимых соединений.
Подвижность тяжелых металлов в почвах
Модификация соединений тяжелых металлов, поступающих в почву, включает в себя следующие процессы: растворение, адсорбирование катионов тяжелых металлов твердой фазой почв, образование последней твердой фазы. Основными процессом, контролирующим содержание водорастворимых форм тяжелых металлов в почвах, подверженных техногенному загрязнению, считается адсорбционно-десорбционное равновесие.
Известно, что после внесения оксидов тяжелых металлов содержание их подвижных форм практически не отличалось от содержания в почве, в которую вносили водорастворимые соли этих же тяжелых металлов. Со временем во всех почвах содержание водорастворимой, обменной и непрочно связанной форм тяжелых металлов снизилось, а прочносвязанной форм - повышалось. Концентрация тяжелых металлов в почвенном растворе - главная экологическая характеристика почвы, она определяет миграцию тяжелых металлов по профилю и поглощение их растениями. Изменение влажности почв, энергичности микробиоты влияют на кислотно-основное и окислительно-восстановительное равновесие, содержание хелатообразующих соединений, состав почвенной атмосферы, и все это в свою очередь сказывается на подвижности тяжелых металлов. В поглощении тяжелых металлов почвами действуют 2 механизма: первый включает адсорбцию с образованием внешне- и внутри сферных комплексных соединений с минеральными и органическими компонентами почв; второй состоит в осаждении из почвенного раствора тяжело растворимых соединений, т.е. в образовании повторной твердой фазы. В последующей судьбе металлов, образующих прочные связи с кислородом и серой, большую роль играет сложное образование с органическим веществом. При очень высокой концентрации металла в растворе начинается осаждение вторичной твердой фазы: гидроксидов железа, алюминия, карбонатов кальция, магния, сульфидов цинка, кадмия, ртути. При этом концентрация металла в растворе зависит от аниона, обеспечивающего минимальную растворимость катиона.
20.1. Загрязнение вод металлами
Металлы принадлежат к числу главных неорганических загрязнителей пресных и морских вод. Это, в основном, соединения мышьяка, свинца, кадмия, ртути.
Острота проблемы загрязнения водной среды токсичными металлами определяется:
Высокой концентрацией соединений тяжелых металлов в прибрежных районах океана и внутренних морях;
Образованием высокотоксичных металлоорганических комплексов, которые как включаются в абиотический компонент экосистемы, так и поглощаются гидробионтами;
Накоплением металлов гидробионтами в дозах, опасных для человека.
Среди загрязняющих веществ по токсикологическим оценкам «стресс-индексов» тяжелые металлы занимают второе место, уступая только пестицидам.
Источники поступления
Основные источники поступления токсичных металлов в водную среду – прямое загрязнение и сток с суши. Только воды рек ежегодно привносят в океан свыше 320 Мт железа. Кроме того, важная роль в загрязнении гидросферы металлами принадлежит атмосферному переносу. Главные пути поступления металлов в Мировой океан приведены в таблице 29.
Таблица 29
Естественное и антропогенное загрязнение Мирового океана, т год -1
|
Загрязняющее вещество |
Общий сток |
Сток с суши |
Атмосферный перенос |
||
|
Естественный |
Антропогенный |
||||
|
(1,0-20,0)·10 5 |
(2,0-20,0)·10 5 |
||||
|
(1,0-20,0)·10 3 |
|||||
На поверхность Мирового океана ежегодно выпадает по другим оценкам 200 кт свинца и 5 кт ртути. Вклад атмосферных выпадений свинца в его общий поток в Мировой океан в настоящее время уже превышает геохимический вклад этого элемента с речными стоками. Для кадмия поступления в океан за счет атмосферных выпадений и прямого стока с суши близки, а для ртути атмосферный поток составляет около 25% общего поступления в океанскую среду. Сейчас уже признано, что главным источником поступления тяжелых металлов в окружающую среду является не металлургическое производство, а сжигание угля. Ежегодное сжигание 2,4 млрд. т каменного и 0,9 млрд. т бурого угля рассеивает в окружающей среде 200 кт мышьяка и 224 кт урана, а мировое производство этих металлов составляет только 40 и 30 кт соответственно.
Как уже сказано выше, важную роль в загрязнении гидросферы металлами играют сточные воды. В таблице 30 приведено содержание металлов в бытовых и некоторых видах промышленных сточных вод.
Таблица 30
|
Промышленность |
|||||
|
Мясоперерабатывающая |
|||||
|
Жироперерабатывающая |
|||||
|
Рыбообрабатывающая |
|||||
|
Безалкогольная |
|||||
|
Производство мороженого |
|||||
|
Текстильная |
|||||
|
Парфюмерная |
|||||
|
Прачечные |
|||||
|
Автомойки |
На пути от мест попадания в воду до океана значительная часть металлов оседает на дне рек. Пример приведен в таблице 31.
Таблица 31
Концентрации тяжелых металлов в воде и осадках реки Рур в Эссене (Imhoff, 1991)
|
В воде (мкг л –1) |
В осадках (мг кг –1 сухого веса) |
|
Кроме того, значительная часть металлов на пути к океану задерживается в водоемах – как в их донных осадках (таблица 32), так и в биоте (таблица 33).
Таблица 32
Поступление металлов в озеро Мичиган (т год -1) (Jackson, 1991)
|
Из воздуха |
С притоками |
Смыв с берега |
Осаждение |
|
Таблица 33
|
Компонент |
||||||
|
Вода (мкг л –1) |
||||||
|
Донные осадки (мг кг –1 сухого веса) |
||||||
|
Зоопланктон (мг кг –1 сухого веса) |
||||||
|
Esox lucius L. Жабры (мг кг –1 сухого веса) |
||||||
|
Мышцы (мг кг –1 сухого веса) |
||||||
|
Печень (мг кг –1 сухого веса) |
Естественно, что наибольшее загрязнение металлами приходится на моря и те части океана, где антропогенная активность высока. Более других загрязнены воды Персидского и Аденского заливов Индийского океана, экваториальная часть Тихого океана, воды течения Гольфстрим в Атлантике, Северное и Средиземное моря.
Токсичность тяжелых металлов
Токсичность тяжелых металлов для планктона определяется тем, что планктонные организмы (особенно фильтраторы) концентрируют металлы, которые ввиду своей неразложимости сохраняются в живых тканях неограниченное время, способствуют гибели планктонтов, а с отмершим планктоном оседают в донных отложениях. Кроме того, что они аккумулируются организмами, они концентрируются в пищевых цепях, что во многом, но не во всем определяет разную токсичность металлов для разных групп гидробионтов (таблица 34).
Таблица 34
Степень токсичности ряда солей тяжелых металлов для некоторых водных животных
|
Вещество |
Планктон |
Ракообразные |
Моллюски |
|
Мышьяк
Мышьяк широко распространен в содержащих фосфаты породах и соответственно встречается в виде примесей в фосфатных удобрениях или детергентах, производимых их этого сырья. Обычные формы мышьяка в природе: H 3 AsO 3 , As(OH) 3 , H 3 AsO 4 .
Некоторое количество мышьяка используется в качестве пестицида в виде арсенатов натрия и меди для опрыскивания плодовых деревьев. Но основными антропогенными источниками мышьяка являются сжигание угля и выплавка металлов. Если средние концентрации мышьяка в воздухе больших городов составляют 0,01–0,56 мкг м –3 , то вблизи плавильных предприятий (на расстоянии нескольких км) 1,5–7,9 мкг м –3 , а содержание мышьяка в летучей золе угольных электростанций составляет 43–312 мг кг –1 (Мышьяк, 1985).
Свинец
Ежегодно добывается примерно 3,5 Мт свинца, а с учетом повторного извлечения из отходов производство свинца составляет 4,1 Мт год-1.
Загрязнение природных вод и воздуха свинцом происходит в результате процесса обжига и плавки свинцовых руд с целью получения металлического свинца, за счет выбросов отходов с производств, использующих свинец, а также при сжигании угля, древесины и других органических материалов, включая городские отходы. Кроме того, значительные количества свинца попадают в окружающую среду благодаря использованию свинцовых труб для водопроводов и свинцово-кислотных аккумуляторов.
До сих пор серьезными источниками загрязнения окружающей среды остаются алкильные соединения свинца. Только за последние 40 лет примерно 10 Мт свинца переработано в тетраэтилсвинец, который используется в качестве антидетонаторной присадки в автомобильном бензине. Из антропогенных источников свинца этот считается важнейшим. Количество свинца, ежегодно попадающего в океан в результате применения алкилсвинца в качестве антидетонатора дизельного топлива, оценивается в 25 кт.
Pb(CH 2 CH 3) 4 добавляется в бензин, что позволяет двигателям работать при больших давлениях. В бензин добавляют также CH 2 Cl–CH 2 Cl и CH 2 Br–CH 2 Br. В результате сгорания топлива свинец попадает в атмосферу в виде аэрозольных частиц PbBrCl размером менее 2 мкм, попадающих в легкие и оседающих там.
Ртуть
Ртуть относится к числу наиболее токсичных металлов, чаще других встречаемых в окружающей среде. Ртуть – один из самых редких элементов с очень низким содержанием в земной коре. Она встречается в природе в виде красного сульфида, циннабара, черного сульфида и в виде жидкой ртути.
В окружающую среду ртуть поступает как из природных источников, так и из источников техногенного происхождения. Природная ртуть попадает в биосферу из относительно глубоких слоев земной коры благодаря вулканической, гео- и гидротермальной активности.
Главные антропогенные источники ртути:
§ сжигание ископаемого топлива;
§ выбросы промышленных предприятий, из которых наиболее важны сбросы сточных вод с электролизных фабрик по производству хлорощелочей и едкого натра и предприятий, где сульфат ртути используется в качестве катализатора;
§ использование в сельском хозяйстве различных биоцидов, содержащих ртутные соединения.
Было подсчитано, что в результате деятельности человека в окружающую среду ежегодно поступает до 10 кт ртути, из которых 3 кт – за счет сжигания ископаемого топлива. В морскую среду попадает около 5 кт ртути, общее ее количество в водах Мирового океана равно 10 Мт при средней концентрации 0,01-0,03 мкг л -1 .
Существуют бактерии, которые переводят минеральную ртуть в монометил (или метил) ртути (CH3Hg+) (см. рисунок 42).
Ртуть токсична для фитопланктона, поэтому загрязнение ртутью существенно снижает первичную продукцию морских экосистем. Фито- и зоопланктон аккумулирует ртуть в широком диапазоне концентраций 30-3 800 мкг кг-1 сухой массы, показатель аккумуляции ртути может превышать 40 000.
Рис 41. Поведение ртути в водной среде (до аккумуляции организмами).
Ее ПДС для водоемов принято не более 0,005 мг л -1 . В континентальных и океанических водах концентрация ртути составляет примерно 1 мкг кг -1 . Фактическое содержание ртути в водах рек промышленно развитых стран превышает ПДС в 2-4 раза, а содержание ее в тканях рыб нередко в 100-200 раз превышает таковое в природных водах. В тканях, например тунца, концентрация может достигать 120 мкг кг -1 .
Отходы, содержащие ртуть, обычно скапливаются в донных отложениях заливов или эстуариях рек. Дальнейшая ее миграция сопровождается накоплением метиловой ртути и ее включением в трофические цепи водных организмов (особенно крабов и рыб). Например, в канадских озерах Сент-Клэр концентрация ртути в рыбах составляла 2–4 мг кг -1 , в мышцах большой голубой цапли 23 мг кг -1 , в печени – 175 мг кг -1 (Рамад, 1981).
Кадмий
В природе кадмий, как правило, ассоциирован с цинком и их разделение экономически нерентабельно.
Ежегодно во всем мире добывается до 18 кт кадмия (Израэль, 1989). Кадмий широко используется в электронной промышленности, производстве пластмасс, красителей, растворителей. Наиболее известно его использование в никеле-кадмиевых аккумуляторах.
В окружающей среде кадмий присутствует в виде двухвалентного иона, осаждаемого в виде карбоната:
В кислой среде ионы кадмия освобождаются:
К основным антропогенным источникам поступления кадмия в окружающую среду относятся горнорудные и металлургические предприятия, а также сточные воды. Курение поставляет в окружающую среду 6–11 т кадмия ежегодно (Гадаскина, 1988).
Всего воды Мирового океана содержат примерно 140 Мт кадмия при средней концентрации 0,1 мкг л –1 . Кадмий накапливается водными животными, но не концентрируется в пищевых цепях (Израэль, 1989). Концентрация кадмия в разных гидробионтах изменяется от 50 до 550000 мкг кг -1 сухой массы. У некоторых видов устриц, например, коэффициент накопления кадмия равняется 318 000 (Эрхард, 1984).
Кадмий – один из самых опасных токсикантов. Токсичность кадмия связана со схожестью его химических свойств с цинком. При этом он связывается с серой более прочно, чем цинк и, следовательно, вытесняет цинк из многих ферментов, в которых тот используется как ко-фактор. Естественно, эти ферменты прекращают функционировать.
| Предыдущая |
Металлы принадлежат к числу главных неорганических загрязнителей пресных и морских вод. Это, в основном, соединения мышьяка, свинца, кадмия, ртути.
Острота проблемы загрязнения водной среды токсичными металлами определяется:
Высокой концентрацией соединений тяжелых металлов в прибрежных районах океана и внутренних морях;
Образованием высокотоксичных металлоорганических комплексов, которые как включаются в абиотический компонент экосистемы, так и поглощаются гидробионтами;
Накоплением металлов гидробионтами в дозах, опасных для человека.
Основные источники поступления токсичных металлов в водную среду – прямое загрязнение и сток с суши. Кроме того, важная роль в загрязнении гидросферы металлами принадлежит атмосферному переносу.
На поверхность Мирового океана ежегодно выпадает 200 кт свинца и 5 кт ртути. Вклад атмосферных выпадений свинца в его общий поток в Мировой океан в настоящее время уже превышает геохимический вклад этого элемента с речными стоками. Для кадмия поступления в океан за счет атмосферных выпадений и прямого стока с суши близки, а для ртути атмосферный поток составляет около 25% общего поступления в океанскую среду. Сейчас уже признано, что главным источником поступления тяжелых металлов в окружающую среду является не металлургическое производство, а сжигание угля. Ежегодное сжигание 2,4 млрд. т каменного и 0,9 млрд. т бурого угля рассеивает в окружающей среде 200 кт мышьяка и 224 кт урана, а мировое производство этих металлов составляет только 40 и 30 кт соответственно.
Как уже сказано выше, важную роль в загрязнении гидросферы металлами играют сточные воды.
Естественно, что наибольшее загрязнение металлами приходится на моря и те части океана, где антропогенная активность высока. Более других загрязнены воды Персидского и Аденского заливов Индийского океана, экваториальная часть Тихого океана, воды течения Гольфстрим в Атлантике, Северное и Средиземное моря.
Мышьяк. Мышьяк широко распространен в содержащих фосфаты породах и соответственно встречается в виде примесей в фосфатных удобрениях или детергентах, производимых их этого сырья. Обычные формы мышьяка в природе: H 3 AsO 3 , As(OH) 3 , H 3 AsO 4 .
Некоторое количество мышьяка используется в качестве пестицида в виде арсенатов натрия и меди для опрыскивания плодовых деревьев. Но основными антропогенными источниками мышьяка являются сжигание угля и выплавка металлов. Если средние концентрации мышьяка в воздухе больших городов составляют 0,01–0,56 мкг м –3 , то вблизи плавильных предприятий (на расстоянии нескольких км) 1,5–7,9 мкг м –3 , а содержание мышьяка в летучей золе угольных электростанций составляет 43–312 мг кг –1 (Мышьяк, 1985).
У человека острое отравление мышьяком вызывает появление металлического вкуса во рту, рвоту, сильные боли в животе, острую сердечно-сосудистую и почечную недостаточность, судороги. Хроническая интоксикация (при потреблении воды, содержащей более 0,1 мкг л –1 мышьяка) вызывает гиперпигментацию, кератоз, рак кожи (Гарин и др., 2001). Смертельная доза для мышьяка составляет – 0,06 – 0,2 г (от 1 до 2,5 мг As кг –1 массы тела) (Мышьяк, 1985).
Свинец. Ежегодно добывается примерно 3,5 Мт свинца, а с учетом повторного извлечения из отходов производство свинца составляет 4,1 Мт год -1 . Загрязнение природных вод и воздуха свинцом происходит в результате процесса обжига и плавки свинцовых руд с целью получения металлического свинца, за счет выбросов отходов с производств, использующих свинец, а также при сжигании угля, древесины и других органических материалов, включая городские отходы. Кроме того, значительные количества свинца попадают в окружающую среду благодаря использованию свинцовых труб для водопроводов и свинцово-кислотных аккумуляторов.
До сих пор серьезными источниками загрязнения окружающей среды остаются алкильные соединения свинца. Только за последние 40 лет примерно 10 Мт свинца переработано в тетраэтилсвинец, который используется в качестве антидетонаторной присадки в автомобильном бензине. Из антропогенных источников свинца этот считается важнейшим.
Количество свинца, ежегодно попадающего в океан в результате применения алкилсвинца в качестве антидетонатора дизельного топлива, оценивается в 25 кт.
Pb(CH 2 CH 3) 4 добавляется в бензин, что позволяет двигателям работать при больших давлениях. В бензин добавляют также CH 2 Cl–CH 2 Cl и CH 2 Br–CH 2 Br. В результате сгорания топлива свинец попадает в атмосферу в виде аэрозольных частиц PbBrCl размером менее 2 мкм, попадающих в легкие и оседающих там:
Pb(CH 2 CH 3) 4 + С 2 Н 4 Г 2 + 16О 2 = PbГ 2 + 10СО 2 + 12Н 2 О (Г=Cl или Br) (Ершов, 2003).
Свинец в организме человека накапливается в костях, вытесняя соли кальция. Кроме того, он депонируется в мышцах, печени, почках, селезенке, головном мозге, сердце и лимфатических узлах. Для свинцовой интоксикации характерна «свинцовая колика» – резкий спазм сосудов, повышение артериального давления, спастико-атонические явления в кишечнике, появление судорожных припадков, развивается гипохромная анемия (Гарин и др., 2001). Смертельная доза свинца для человека составляет 20–50 г.
Ртуть. Ртуть относится к числу наиболее токсичных металлов, чаще других встречаемых в окружающей среде. Ртуть – один из самых редких элементов с очень низким содержанием в земной коре. Она встречается в природе в виде красного сульфида, циннабара, черного сульфида и в виде жидкой ртути.
Главные антропогенные источники ртути:
· сжигание ископаемого топлива;
· выбросы промышленных предприятий, из которых наиболее важны сбросы сточных вод с электролизных фабрик по производству хлорощелочей и едкого натра и предприятий, где сульфат ртути используется в качестве катализатора;
· использование в сельском хозяйстве различных биоцидов, содержащих ртутные соединения.
Было подсчитано, что в результате деятельности человека в окружающую среду ежегодно поступает до 10 кт ртути, из которых 3 кт – за счет сжигания ископаемого топлива. В морскую среду попадает около 5 кт ртути, общее ее количество в водах Мирового океана равно 10 Мт при средней концентрации 0,01-0,03 мкг л -1 .
Существуют бактерии, которые переводят минеральную ртуть в монометил (или метил) ртути (CH 3 Hg +)
Ртуть токсична для фитопланктона, поэтому загрязнение ртутью существенно снижает первичную продукцию морских экосистем. Фито- и зоопланктон аккумулирует ртуть в широком диапазоне концентраций 30- 3 800 мкг кг -1 сухой массы, показатель аккумуляции ртути может превышать 40 000.
Ее ПДС для водоемов принято не более 0,005 мг л -1 . В континентальных и океанических водах концентрация ртути составляет примерно 1 мкг кг-1. Фактическое содержание ртути в водах рек промышленно развитых стран превышает ПДС в 2-4 раза, а содержание ее в тканях рыб нередко в 100-200 раз превышает таковое в природных водах. В тканях, например тунца, концентрация может достигать 120 мкг кг-1.
Смертельная доза солей ртути для человека составляет 0,5 г.
Болезнь Минамата. В Японии болезнь Минамата дважды наблюдалась – в 1953 г. в бухте Минамата, в 1965 г. в районе Ниигаты. В декабре 1953 г. жители г. Минамата стали свидетелями страшных явлений. Множество кошек, собак и даже птиц умирало прямо на улице в конвульсиях. Некоторые обезумевшие кошки бросались в воду – поведение, не свойственное животному, известному своей водобоязнью. А через несколько недель уже сами жители стали страдать от неведомой болезни, получившей впоследствии название «болезнь Минамата». На первом этапе заболевания больные чувствуют онемение губ и конечностей. Затем начинаются нарушения зрительной (сужение поля зрения), слуховой и речевой функций (речь становится затрудненной, а фразы все более и более бессвязными). Походка больного делается неуверенной и шатающейся, как у пьяного. Появляются признаки нарушения психики и слабоумия. Смерть наступает или довольно быстро – после нескольких дней конвульсий, или какое-то время спустя – от осложнений на легкие.
Вначале предполагалось, что болезнь вызвана неизвестным вирусом. Анализ клинической картины показал, что болезнь вызвана ртутным отравлением. Впервые слово «ртуть» было произнесено в июле 1959 г.
Появление в 1965 г. подобного заболевания в районе Ниигаты, расположенном далеко от Минаматы, послужило еще одним доказательством способности метилртути вызывать эту болезнь. 5 человек из 30 тяжело заболевших погибли. Все они питались рыбой, выловленной в реке Агано. А в нее попадали сточные воды другого предприятия, синтезирующего ацетальдегид. Этот завод принадлежал могущественному японскому концерну «Шова Денко».
Только в сентябре 1968 г. министр здравоохранения Японии официально заявил, что причиной болезни Минамата явились сточные воды завода Чиссо (Рамад, 1981; Эрхард, 1984)
Неорганическая ртуть использовалась в качестве катализатора для производства ацетальдегида и винилхлорида на фабрике Чиссо Компании Лтд. По неосторожности и ртуть, и метилртуть в течение десятилетия сбрасывались в залив Минамата, соединенный с межостровным морем Яцуширо, крайне слабо сообщавшимся с Тихим океаном на оконечности острова Кюши в западной части Японии.
К 1987 г. правительство признало 1742 пациента жертвами болезни Минамата, возможное число пострадавших оценивается как 5000.
В 1984 г. правительством Японии была начата перекачка загрязненного грунта в специальную область внутри залива Минамата. Общий объем подлежащего обезвреживанию грунта составил 582 000 м 3 . Общая стоимость работ оценивается в $ 500 млн. К 2011 г. планируется полная очистка от ртути (Зилов, 2006).
Кадмий. В природе кадмий, как правило, ассоциирован с цинком и их разделение экономически нерентабельно.
Кадмий широко используется в электронной промышленности, производстве пластмасс, красителей, растворителей. Наиболее известно его использование в никеле-кадмиевых аккумуляторах.
В окружающей среде кадмий присутствует в виде двухвалентного иона, осаждаемого в виде карбоната:
Cd 2+ + CO 3 2- = CdCO 3 ↓
В кислой среде ионы кадмия освобождаются:
CdCO 3 + 2H + = Cd 2+ + CO 2 + H2O
К основным антропогенным источникам поступления кадмия в окружающую среду относятся горнорудные и металлургические предприятия, а также сточные воды. Курение поставляет в окружающую среду 6–11 т кадмия ежегодно (Гадаскина, 1988).
Всего воды Мирового океана содержат примерно 140 Мт кадмия при средней концентрации 0,1 мкг л –1 . Кадмий накапливается водными животными, но не концентрируется в пищевых цепях (Израэль, 1989).
Кадмий – один из самых опасных токсикантов. Токсичность кадмия связана со схожестью химических свойств с цинком. При этом он связывается с серой более прочно, чем цинк и, следовательно, вытесняет цинк из многих ферментов, в которых тот используется как кофактор. Естественно, эти ферменты прекращают функционировать. Смертельной может быть доза 30–40 мг.
В организм человека кадмий попадает, в основном, с растительной пищей. Однажды поглощенное количество кадмия выводится из человеческого организма чрезвычайно медленно (0,1 % сут.–1). Самые ранние симптомы отравления кадмием – поражение почек, нервной системы и половых органов. Затем возникают острые костные боли в спине и ногах, нарушаются функции легких (Гарин и др., 2001).
Болезнь Итай-итай. Эта болезнь связана с кадмием, хотя связь неорганического кадмия с болезнью не так очевидна, как в случае с болезнью Минамата. Тем не менее, кадмий признан ведущим фактором, вызвавшим болезнь. Благодаря активности компании Мицуи, добывающей и производящей цинк, свинец, серебро и золото, кадмий с 1920-х годов попадал в воды р. Джинцу в центральной части Японии. Эти воды затем использовались для рисовых полей. Кадмий концентрировался в рисовых зернах. Фермеры ели содержащий кадмий рис в течение нескольких десятилетий. Кадмий вызывал ренальную тубулярную дисфункцию, остеомаляцию и остеопороз. Наиболее характерным симптомом болезни была острая боль в костях, что и выразилось в названии болезни «итай-итай» по-японски соответствует английскому «ouch-ouch» или русскому «ай, болит!». Несмотря на то, что большое число жертв должно было быть и в период с 1920-го по 1950-е годы, официального признания болезнь не получала до 1967 г. Число жертв, умерших от болезни составило 396 (305 женщин и 91 мужчина) на 1 426 хозяйств в загрязненной области.
Восстановление примерно 50 % почв (200 га) было осуществлено путем глубокой вспашки в 1991 г. Верхние 30 см почвы, особенно сильно загрязненные кадмием, были перемещены вниз. Кадмий из донных осадков р. Джинзу продолжает распространяться по окрестным полям во время наводнений (Зилов, 2006).