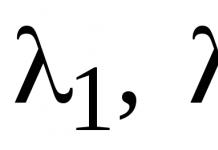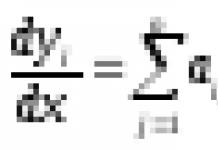03. Строение белковой молекулы (первичная, вторичная, третичная, четвертичная). Типы связей. Связь структуры с функцией
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). На долю белков приходится не менее 50% сухой массы органических соединений животной клетки. В организме человека насчитывается до 5 млн. различных видов белков. Белковая молекула может состоять из одной или нескольких цепей, содержащих от пятидесяти до нескольких сотен аминокислотных остатков. Молекулы, содержащие менее пятидесяти остатков, относят к пептидам . В состав многих молекул входят остатки цистеина, дисульфидные связи которых ковалентно связывают участки одной или нескольких цепей. В нативном состоянии белковые макромолекулы обладают специфической конформацией. Характерная для данного белка конформация определяется:
- последовательностью аминокислотных остатков и стабилизируется водородными связями между пептидными и боковыми группами аминокислотных остатков,
- электростатическими и гидрофобными взаимодействиями.
Первичная структура белка. Пептидная связь образуется при реакции аминогруппы одной аминокислоты и карбоксильной группы другой с выделением молекулы воды :
CH3-CH(NH2)-COOH + CH3- CH(NH2)-COOH ^ CH3-CH(NH2)-CO- NH-(CH3) СН-COOH + H2O
Связанные пептидной связью аминокислоты образуют полипептидную цепь . Пептидная связь имеет плоскостную структуру:
- атомы С, О и N находятся в sp -гибридизации;
- у атома N имеется р-орбиталь с неподеленной парой электронов;
- образуется р-п-сопряженная система, приводящая к укорочению связи С-N (0,132 нм) и ограничению вращения (барьер вращения составляет ~63 кДж/моль).
Пептидная связь имеет преимущественно трансконфигурацию относительно плоскости пептидной связи. Подобное строение пептидной связи сказывается на формировании вторичной и третичной структуры белка. Пептидная связь жесткая, ковалентная, генетически детерминированная. В структурных формулах изображается в виде одинарной связи, однако на самом деле эта связь между углеродом и азотом носит характер частично двойной связи. Это вызвано различной электроотрицательностью атомов С, N и O. Вокруг пептидной связи вращение невозможно, все четыре атома лежат в одной плоскости, т.е. компланарны. Вращение же других связей вокруг полипептидного остова достаточно свободно. Последовательность аминокислот для каждого белка уникальна и закреплена генетически.
По числу аминокислотных остатков, входящих в молекулы пептидов, различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до десяти аминокислотных остатков, называются олигопептидами , содержащие более десяти аминокислотных остатков - полипептидами . Природные полипептиды с молекулярной массой более 6000 называются белками.
Вторичная структура - это пространственное расположение полипептидной цепочки в виде а-спирали или Р-складчатости безотносительно к типам боковых радикалов и их конформации. Л. Полинг и Р. Кори предложили модель вторичной структуры белка в виде а-спирали , в которой водородные связи замыкаются между каждой первой и четвертой аминокислотой, что позволяет сохранять нативную структуру белка, осуществлять простейшие функции, защищать от разрушения. В образовании водородных связей принимают участие все пептидные группы, что обеспечивает максимальную стабильность, снижает гидрофильность и увеличивает гидрофобность белковой молекулы. а-спираль образуется самопроизвольно и является наиболее устойчивой конформацией, отвечающей минимуму свободной энергии. Наиболее распространенным элементом вторичной структуры является правая а-спираль (aR ). Пептидная цепь здесь изгибается винтообразно. Ha каждый виток приходится 3,6 аминокислотного остатка, шаг винта, т.е. минимальное расстояние между двумя эквивалентными точками, составляет 0,54 нм; а-спираль стабилизирована почти линейными водородными связями между NH-группой и СО-группой четвертого по счету аминокислотного остатка. Неполярные или амфифильные а-спирали с 5-6 витками часто обеспечивают заякоривание белков в биологических мембранах (трансмембранные спирали). B складчатых структурах также образуются поперечные межцепочечные водородные связи Если цепи ориентированы в противоположных направлениях, структура называется антипараллельным складчатым листом (ва); если цепи ориентированы в одном направлении, структура называется параллельным складчатым листом (вп). Кроме регулярных в полипептидных цепях есть еще и нерегулярные вторичные структуры, т.е. стандартные структуры, не образующие длинных периодических систем. Это - в-изгибы они называются так потому, что часто стягивают верхушки соседних в-тяжей в антипараллельных в-шпильках). В изгибы обычно входит около половины остатков, не опавших в регулярные структуры белков.
Связи, стабилизирующие третичную структуру :
- электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи);
- водородные связи между полярными (гидрофильными) R-группами;
- гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
- дисульфидные связи между радикалами двух молекул цистеина.
Эти связи ковалентные. Они повышают стабильность третичной структуры, но не всегда являются обязательными для правильного скручивания молекулы. В ряде белков они могут вообще отсутствовать.
Третичная структура - уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой белка. Конфигурация белковых молекул может быть фибриллярной и глобулярной . Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами . Между собой домены обычно бывают связаны тонкими перемычками вытянутыми аморфными полипептидными цепями Кроме того, в белках встречаются мотивы укладки полипептидной цепи, похожие на орнаменты на индейских и греческих вазах: мотив меандра, мотив греческого ключа, мотив зигзага-"молнии" При свертывании белковой глобулы значительная часть (не менее половины) гидрофобных радикалов аминокислотных остатков оказывается скрытой от контакта с окружающей белок водой. Происходит образование своеобразных внутримолекулярных «гидрофобных ядер ». В них особенно представлены объемные остатки лейцина, изолейцина, фенилаланина, валина. С появлением третичной структуры у белка появляются новые свойства - биологические . В частности, проявление каталитических свойств связано с наличием у белка третичной структуры. Фибриллярные белки - белки, имеющие вытянутую нитевидную структуру. Большинство фибриллярных белков не растворяется в воде, имеют большую молекулярную массу и высокорегулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои . Глобулярные белки - белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры - глобулы (третичные структуры белка).
Четвертичная структура - это надмолекулярное образование, состоящее из двух и более полипептидных цепей, связанных между собой нековалентно, а водородными связями, электростатическими, дипольдипольные и гидрофобными взаимодействиями между остатками аминокислот, находящихся на поверхности. Каждый из белков-участников третичной структуры при образовании четвертичной структуры называют субъединицей или протомером . Образовавшуюся молекулу называют олигомером, или мультимером . Олигомерные белки чаще построены из четного количества протомеров с одинаковыми или разными молекулярными массами. В образовании четвертичной структуры белка принимают участие те же связи, что и при образовании третичной структуры, за исключением ковалентных. Характерной особенностью белков с четвертичной структурой является их способность к самосборке. Взаимодействие протомеров осуществляется с высокой специфичностью, благодаря образованию десятка слабых связей между контактными поверхностями субъединиц, поэтому ошибки при формировании четвертичной структуры белков исключены.
Практически все белки-ферменты имеют четвертичную структуру и состоят, как правило, из четного числа протомеров (двух, четырех, шести, восьми). Четвертичная структура белка подразумевает такое объединение белков третичной структуры, при котором появляются новые биологические свойства, не характерные для белка в третичной структуре.
Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией . Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида. В то же время из сказанного, очевидно, следует, что, изменив всего лишь одну аминокислоту в каком-либо полипептиде, мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами.
По химическому составу все белки делят на простые , состоящие только из аминокислотных остатков, и сложные . Сложные могут включать ионы металла (металлопротеины) или пигмент (хромопротеины), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеины), углевода (гликопротеины).
Простые белки подразделяют на:
- фибриллярные, растворимые в воде (актин, миозин) и нерастворимые (кератин, эластин, коллаген),
- глобулярные (альбумины, глобулины, протамины, гистоны, проламины).
Химическая структура белков представлена альфа-аминокислотами, соединенными в цепочку посредством пептидной связи. В живых организмах состав определяет генетический код. В процессе синтеза в большинстве случаев применяется 20 аминокислот стандартного типа. Множеством их комбинаций формируются белковые молекулы с самыми разнообразными свойствами. Аминокислотные остатки часто подвергаются посттрансляционным модификациям. Они могут возникнуть и до того, как белок станет выполнять свои функции, и в процессе его активности в клетке. В живых организмах часто несколько молекул формируют сложные комплексы. В качестве примера можно привести фотосинтетическое объединение.
Назначение соединений
Белки считаются важной составляющей питания человека и животных в связи с тем, что в их организмах все необходимые аминокислоты синтезироваться не могут. Часть их должна поступать вместе с белковой пищей. Основными источниками соединений выступают мясо, орехи, молоко, рыба, зерновые. В меньшей степени протеины присутствуют в овощах, грибах и ягодах. При пищеварении посредством ферментов потребленные белки подвергаются разрушению до аминокислот. Они уже используются в биосинтезе собственных протеинов в организме либо подвергаются распаду дальше - для получения энергии.

Историческая справка
Последовательность структуры белка инсулина была определена впервые Фредериеом Сенгером. За свою работу он получил Нобелевскую премию в 1958 году. Сенгер использовал метод секвенирования. С помощью дифракции рентгеновского излучения впоследствии были получены трехмерные структуры миоглобина и гемоглобина (в конце 1950 гг.). Работы проводили Джон Кендрю и Макс Перуц.
Структура молекулы белка
Она включает в себя линейные полимеры. Они, в свою очередь, состоят из остатков альфа-аминокислот, являющихся мономерами. Кроме того, структура белка может включать компоненты, имеющие неаминокислотную природу, и аминокислотные остатки модифицированного типа. При обозначении компонентов применяются 1- либо 3-буквенные сокращения. Соединение, в состав которого входит от двух до нескольких десятков остатков, именуется часто как "полипептид". В результате взаимодействия альфа-карбоксильной группы одной аминокислоты с альфа-аминогруппой другой появляются (в процессе формирования структуры белка) связи. В соединении выделяют С- и N- концы, в зависимости от того, какая группа аминокислотного остатка является свободной: -СООН либо -NH 2 . В процессе синтеза белка на рибосоме в качестве первого концевого выступает, как правило, остаток метионина; присоединение последующих осуществляется к С-концу предыдущих.

Уровни организации
Они были предложены Линдрем-Лангом. Несмотря на то что данное деление считается несколько устаревшим, им все еще пользуются. Было предложено выделять четыре уровня организации соединений. Первичная структура молекулы белка определяется генетическим кодом и особенностями гена. Для более высоких уровней характерно формирование в ходе сворачивания протеина. Пространственная структура белка определяется в целом аминокислотной цепью. Тем не менее она достаточно лабильна. На нее могут оказывать влияние внешние факторы. В связи с этим более корректно говорить о конформации соединения, наиболее выгодной и предпочтительной энергетически.
1 уровень
Он представлен последовательностью аминокислотных остатков полипептидной цепи. Как правило, его описывают с использованием одно- либо трехбуквенных обозначений. Первичная структура белков отличается устойчивыми сочетаниями аминокислотных остатков. Они выполняют определенные задачи. Такие "консервативные мотивы" остаются сохраненными в ходе видовой эволюции. По ним достаточно часто можно предсказывать задачу неизвестного протеина. Оценивая степень сходства (гомологии) в аминокислотных цепях от различных организмов, можно определять эволюционное расстояние, образующееся между таксонами, которые составляют эти организмы. Первичная структура белков определяется методом секвенирования либо по исходному комплексу его мРНК с использованием таблицы генетического кода.

Локальное упорядочивание участка цепи
Это следующий уровень организации - вторичная структура белков. Существует несколько ее типов. Локальное упорядочивание участка цепи полипептида стабилизируется водородными связями. Наиболее популярными типами считаются:

Пространственное строение
Третичная структура белков включает в себя элементы предыдущего уровня. Они стабилизируются разными типами взаимодействий. Важнейшее значение при этом имеют гидрофобные связи. В стабилизации участвуют:
- Ковалентные взаимодействия.
- Ионные связи, формирующиеся между боковыми аминокислотными группами, имеющими противоположные заряды.
- Водородные взаимодействия.
- Гидрофобные связи. В процессе взаимодействия с окружающими элементами Н 2 О происходит сворачивание протеина так, чтобы боковые неполярные аминокислотные группы оказывались изолированными от водного раствора. Гидрофильные группы (полярные) оказываются на поверхности молекулы.
Третичная структура белков определяется методами магнитного (ядерного) резонанса, некоторыми видами микроскопии и прочими способами.
Принцип укладки
Исследования показали, что между 2 и 3 уровнями удобно выделить еще один. Его именуют "архитектурой", "мотивом укладки". Он определяется взаиморасположением компонентов вторичной структуры (бета-тяжей и альфа-спиралей) в границах компактной глобулы - белкового домена. Он может существовать самостоятельно либо быть включенным в состав более крупного протеина вместе с прочими аналогичными. Установлено, что мотивы укладки достаточно консервативны. Они встречаются в протеинах, не обладающих ни эволюционными, ни функциональными связями. Определение архитектуры лежит в основе рациональной (физической) классификации.

Доменная организация
При взаимном расположении нескольких цепей полипептидов в составе одного протеинового комплекса формируется четвертичная структура белков. Элементы, входящие в ее состав, образуются по отдельности на рибосомах. Только по завершении синтеза начинает образовываться данная структура белка. Она может содержать как различающиеся, так и идентичные полипептидные цепи. Четвертичная структура белков стабилизируется за счет тех же взаимодействий, что и на предыдущем уровне. Некоторые комплексы могут включать в себя несколько десятков протеинов.
Структура белка: защитные задачи
Полипептиды цитоскелета, выступая в некотором роде в качестве арматуры, придают многим органоидам форму, участвуют в ее изменении. Структурные протеины обеспечивают защиту организма. К примеру, таким белком является коллаген. Он формирует основу в межклеточном веществе соединительных тканей. Также защитной функцией обладает кератин. Он составляет основу рогов, перьев, волос и прочих производных эпидермиса. При связывании белками токсинов во многих случаях происходит детоксикация последних. Так выполняется задача по химической защите организма. Особенно важную роль в процессе обезвреживания токсинов в человеческом организме играют печеночные ферменты. Они способны расщеплять яды или переводить их в растворимую форму. Это способствует более быстрой транспортировке их из организма. Белки, присутствующие в крови и прочих биологических жидкостях, обеспечивают иммунную защиту, вызывая реакцию как на атаку патогенов, так и на повреждение. Иммуноглобулины (антитела и компоненты системы комплемента) способны нейтрализовывать бактерии, чужеродные протеины и вирусы.
Механизм регуляции
Белковые молекулы, не выступающие ни в качестве источника энергии, ни как строительный материал, контролируют многие внутриклеточные процессы. Так, за счет них осуществляется регулирование трансляции, транскрипции, слайсинга, деятельность прочих полипептидов. Механизм регуляции основывается на ферментативной активности или проявляется благодаря специфичному связыванию с прочими молекулами. К примеру, факторы транскрипции, полипептиды-активаторы и протеины- репрессоры способны контролировать интенсивность генной транскрипции. При этом они взаимодействуют с регуляторными последовательностями генов. Важнейшая роль в контроле над течением внутриклеточных процессов отводится протеинфосфатазам и протеинкиназам. Эти ферменты запускают либо подавляют активность прочих белков посредством присоединения или отщепления от них фосфатных групп.

Сигнальная задача
Ее часто объединяют с регуляторной функцией. Это связано с тем, что многие внутриклеточные, как и внеклеточные, полипептиды могут передавать сигналы. Такой способностью обладают факторы роста, цитокины, гормоны и прочие соединения. Стероиды транспортируются по крови. Взаимодействие гормона с рецептором выступает в качестве сигнала, за счет которого запускается ответная реакция клетки. Стероиды контролируют содержание соединений в крови и клетках, размножение, рост и прочие процессы. В качестве примера можно привести инсулин. Он регулирует уровень глюкозы. Взаимодействие клеток осуществляется посредством сигнальных белковых соединений, передаваемых по межклеточному веществу.
Транспорт элементов
Растворимые протеины, участвующие в перемещении малых молекул, имеют высокое сродство к субстрату, присутствующему в повышенной концентрации. Они обладают также способностью к легкому его высвобождению в областях с низким его содержанием. В качестве примера можно привести транспортный белок гемоглобин. Он перемещает из легких кислород к прочим тканям, а от них - переносит углекислый газ. В транспортировке малых молекул через стенки клетки, изменяя их, участвуют и некоторые мембранные белки. Липидный слой цитоплазмы обладает водонепроницаемостью. Благодаря этому предотвращается диффузия заряженных или полярных молекул. Мембранные транспортные соединения принято разделять на переносчиков и каналы.
Резервные соединения
Эти белки формируют так называемые запасы. Они накапливаются, например, в семенах растений, животных яйцеклетках. Такие белки выступают в качестве резервного источника вещества и энергии. Некоторые соединения используются организмом как аминокислотный резервуар. Они, в свою очередь, являются предшественниками активных веществ, участвующих в регулировании метаболизма.
Клеточные рецепторы
Такие белки могут располагаться как непосредственно в цитоплазме, так и встраиваться в стенку. Одной своей частью соединение принимает сигнал. В качестве него, как правило, выступает химическое вещество, а в ряде случаев - механическое воздействие (растяжение, к примеру), свет и прочие стимулы. В процессе воздействия сигнала на определенный фрагмент молекулы - полипептид-рецептор - начинаются ее конформационные изменения. Они провоцируют смену конформации остальной части, выполняющей передачу стимула на прочие компоненты клетки. Отправка сигнала может осуществляться разными способами. Одни рецепторы способны катализировать химическую реакцию, вторые - выступают в качестве ионных каналов, закрывающихся либо открывающихся под воздействием стимула. Некоторые соединения специфически связывают молекулы-посредники внутри клетки.
Моторные полипептиды
Существует целый класс белков, обеспечивающих движения организма. Моторные белки участвуют в сокращении мышц, перемещении клеток, активности жгутиков и ресничек. За счет них также выполняется направленные и активный транспорт. Кинезины и динеины осуществляют перенос молекул по ходу микротрубочек с использованием в качестве энергетического источника гидролиза АТФ. Вторые перемещают органоиды и прочие элементы по направлению к центросоме из периферических клеточных участков. Кинезины движутся в обратном направлении. Динеины, кроме того, отвечают за активность жгутиков и ресничек.
1. Первичная структура белка. Зависимость свойств и конформации белков от первичной структуры. Примеры полиморфизма белков, гемоглобин А и F , структурные и функциональные отличия. Роль фетального гемоглобина в период внутриутробного развития плода. Наследственные изменения первичной структуры — молекулярные болезни (серповидно-клеточная анемия).
Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. 1.4.2). Имейте в виду, что даже небольшие изменения первичной структуры белка могут значительно изменять его свойства. Примером заболеваний, развивающихся в результате изменения первичной структуры белка, являются гемоглобинопатии (гемоглобинозы) .
В эритроцитах здоровых взрослых людей присутствует гемоглобин А (Hb А) . В крови некоторых людей содержится аномальный (изменённый) гемоглобин - гемоглобин (Hb S). Единственное отличие первичной структуры Hb S от Hb A - замена гидрофильного остатка глутаминовой кислоты на гидрофобный остаток валина в концевом участке их β-цепей.
Как известно, основная функция гемоглобина -транспорт кислорода к тканям. В условиях пониженного парциального давления О2 снижается растворимость гемоглобина S в воде и его способность связывать и переносить кислород. Эритроциты принимают при этом серповидную форму, быстро разрушаются, вследствие чего развивается малокровие (серповидно-клеточная анемия] .
Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белка. Установлено, что каждой полипептидной последовательности соответствует только один стабильный вариант пространственной структуры. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, без участия каких-либо компонентов. Однако сравнительно недавно обнаружилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). В процессе фолдинга более крупных белков принимают участие специальные протеины - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
Примером полиморфизма белков является гемоглобин, имеющий множество форм. Гемоглоби́н A— нормальный гемоглобин взрослого человека. Этот белок представляет собой тетрамер, состоящий из двух пар полипептидных цепей — мономеров: двух мономеров α-цепей и двух мономеров β-цепей, или двух мономеров α и двух мономеров δ. Гемоглоби́н F— фетальный, плодный тип гемоглобина человека. Гемоглобин F — это белок-гетеротетрамер из двух α-цепей и двух γ-цепей глобина. Гемоглобин F обладает повышенным сродством к кислороду(в нём серин вместо лизина) и позволяет сравнительно малому объёму крови плода выполнять кислородоснабжающие функции более эффективно. Однако гемоглобин F обладает меньшей стойкостью к разрушению и меньшей стабильностью. В течение последнего триместра беременности и после рождения гемоглобин F постепенно — замещается «взрослым» гемоглобином А (HbA), менее активным транспортёром кислорода, но более стойким к разрушению и более стабильным. Молекулярные болезни - наследственные нарушения в первичной структуре булка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к образованию гемоглобина S и тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
2. Конформация белковой молекулы (вторичная и третичная структу-ры). Типы внутримолекулярных связей в белках. Фибриллярные и глобу-лярные белки (примеры). Четвертичная структура белка. Примеры строения и функциониро-вания олигомерных белков.
Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО-и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм (рисунок 2.1).
Рисунок 2.1. α-Спираль.
Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль.
β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.

Рисунок 2.2. β-Складчатый слой.
Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации.
2.1.3. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
- Водородные связи образуются между двумя полярными незаряженными радикалами или между незаряженным и заряженным радикалами, например, радикалами серина и глутамина:

- Ионные связи могут возникать между противоположно заряженными радикаламинапример, радикалами глутамата и аргинина:
- Гидрофобные взаимодействия характерны для неполярных радикалов, например, валина и лейцина:
- Дисульфидные
связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи:
.
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
- Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
- Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
- Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
- Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
- Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
- Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
3. Гемоглобин - аллостерический белок. Конформационные изменения молекулы гемоглобина. Кооперативный эффект. Регуляторы сродства гемоглобина к кислороду. Структурные и функциональные различия миоглобина и гемоглобина.
К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем .

По своему химическому строению гем представляет собой протопорфирин IX , связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН— . Заместителями в пиррольных кольцах являются: четыре метильные группы СН3— , две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН . Гем соединяется с белковой частью следующим образом. Неполярные группы. протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
равните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1).

Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом.
4. Биологические функции белков. Роль пространственной организации полипептидной цепи в образовании активных центров. Взаимодействие бел-ков с лигандами. Денатурация белков.
Белки играют важнейшую роль в организме, выполняя многообразные биологические функции.Запомните наиболее важные из них и примеры соответствующих белков, изучив таблицу 2.2.
|
Таблица 2.2 |
||||||||||||||||||||||||
2.2.2. Обратите внимание на то, что в основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами (лигандами) . Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), для транспортных белков - транспортируемые вещества и т.д. 2.2.3. Лиганд способен взаимодействовать не со всей поверхностью белковой молекулы, а только с определённым её участком, который представляет собой центр связывания или активный центр. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне вторичной или третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью , то есть взаимным соответствием их пространственной структуры (подобно взаимодействию «ключ - замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные), а также ковалентные связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок - лиганд. Важно отметить, что изменение пространственной структуры белка в процессе денатурации (см. 2.4) приводит к разрушению центров связывания и утрате биологической функции белка. |
Денатурацией белков называется это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. Денатурацию белка могут вызвать:
- температура выше 60° С;
- ионизирующая радиация;
- концентрированные кислоты и щёлочи;
- соли тяжёлых металлов (ртути, свинца, кадмия);
- органические соединения (спирты, фенолы, кетоны) .
Для денатурированных белков характерно:
- изменение конформации молекулы;
- уменьшение растворимости в воде;
- изменение заряда молекулы;
- меньшая устойчивость к действию протеолитических ферментов;
- потеря биологической активности.
Обратите внимание, что при определённых условиях возможно восстановление исходной (нативной) конформации белка после удаления фактора, вызвавшего денатурацию. Этот процесс получил название ренаживации.
Запомните некоторые примеры использования процесса денатурации белков в медицине:
- для осаждения белков плазмы крови при определении содержания небелковых веществ в крови;
- при проведении дезинфекции и санитарной обработки;
- при лечении и профилактике отравлений солями тяжёлых металлов (в качестве противоядия применяют молоко или яичный белок);
- для получения лекарственных веществ белковой природы (используется денатурация в мягких условиях с последующей ренативацией).
5. Строение и биологическая роль нуклеотидов.
|
Нуклеиновыми кислотами или полинуклеотидами называются высокомолекулярные вещества, состоящие из нуклеотидов, соединённых в цепь 3", 5"-фосфодиэфирными связями. Каждый нуклеотид состоит из азотистого основания, углевода (пентозы) и остатка фосфорной кислоты. Азотистые основания, входящие в состав нуклеотидов, имеют следующее строение:
Углеводы представлены рибозой и дезоксирибозой:
4.1.2. Азотистое основание и пентоза, соединённые N-гликозидной связью, образуют нуклеозид . Если в качестве пентозы в нуклеозиде присутствует рибоза, то это рибонуклеозид, а если дезоксирибоза - то это дезоксирибонуклеозид. |
4.1.3. Нуклеотиды представляют собой фосфорилированные нуклеозиды. Остаток фосфорной кислоты, как правило, присоединяется к гидроксильной группе пентозы в 5"-положении при помощи сложноэфирной связи. Примеры:
В клетках встречаются также нуклеозиддифосфаты и нуклеозидтрифосфаты, содержащие соответственно два и три остатка фосфорной кислоты. Биологическая роль этих соединений будет рассматриваться в дальнейшем.
6. Первичная и вторичная структуры ДНК. Правила Чаргаффа. Принцип комплементарности. Типы связей в молекуле ДНК. Биологическая роль ДНК. Молекулярные болезни - следствие генных мутаций.
Первичной структурой нуклеиновых кислот называется последовательность расположения мононуклеотидов в цепи ДНК или РНК . Первичная структура нуклеиновых кислот стабилизируется 3",5"-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3"-положении пентозного остатка каждого нуклеотида с фосфатной группой соседнего нуклеотида (рисунок 3.2),
Таким образом, на одном конце полинуклеотидной цепи имеется свободная 5"-фосфатная группа (5"-конец), а на другом - свободная гидроксильная группа в 3"-положении (3"-конец). Нуклеотидные последовательности принято записывать в направлении от 5"-конца к 3"-концу.
ДНК (дезоксирибонуклеиновая кислота) содержится в клеточном ядре и имеет молекулярную массу порядка 1011 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, тимин , углевод дезоксирибоза и остатки фосфорной кислоты. Содержание азотистых оснований в молекуле ДНК определяют правила Чаргаффа:
1) количество пуриновых оснований равно количеству пиримидиновых (А + Г = Ц + Т) ;
2) количество аденина и цитозина равно количеству тимина и гуанина соответственно (А = Т; Ц = Г) ;
3) ДНК, выделенные из клеток различных биологических видов, отличаются друг от друга величиной коэффициента специфичности:
(Г + Ц) /(А + Т)
Эти закономерности в строении ДНК объясняются следующими особенностями её вторичной структуры:
1) молекула ДНК построена из двух полинуклеотидных цепей, связанных между собой водородными связями и ориентированных антипараллельно (то есть 3"-конец одной цепи расположен напротив 5"-конца другой цепи и наоборот);
2) водородные связи образуются между комплементарными парами азотистых оснований. Аденину комплементарен тимин; эта пара стабилизируется двумя водородными связями. Гуанину комплементарен цитозин; эта пара стабилизируется тремя водородными связями (см. рисунок б) . Чем больше в молекуле ДНК пар Г-Ц, тем больше её устойчивость к действию высоких температур и ионизирующего излучения;
3) обе цепи ДНК закручены в спираль, имеющую общую ось. Азотистые основания обращены внутрь спирали; кроме водородных, между ними возникают также гидрофобные взаимодействия. Рибозофосфатные части расположены по периферии, образуя остов спирали (см. рисунок 3.4).
Рисунок 3.4. Схема строения ДНК. 
7. Первичная и вторичная структуры РНК. Типы РНК: особенности строения. Основные компоненты белоксинтезирующей системы. Функция рибосом. Адапторная функция тРНК и роль мРНК в синтезе белка.
РНК (рибонуклеиновая кислота) содержится преимущественно в цитоплазме клетки и имеет молекулярную массу в пределах 104 - 106 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, урацил , углевод рибоза и остатки фосфорной кислоты. В отличие от ДНК, молекулы РНК построены из одной полинуклеотидной цепи, в которой могут находиться комплементарные друг другу участки (рисунок 3.5). Эти участки могут взаимодействовать между собой, образуя двойные спирали, чередующиеся с неспирализованными участками.

Рисунок 3.5. Схема строения транспортной РНК.
По особенностям структуры и функции различают три основных типа РНК:
1) матричные (информационные) РНК (мРНК) передают информацию о структуре белка из клеточного ядра на рибосомы;
2) транспортные РНК (тРНК) осуществляют транспорт аминокислот к месту синтеза белка;
3) рибосомальные РНК (рРНК) входят в состав рибосом, участвуют в синтезе белка.
8. Биосинтез ДНК (репликация) и мРНК (транскрипция). Процессы "созревания" первичного транскрипта при образовании мРНК.
Матричный биосинтез - процесс сборки новых макромолекул из мономеров, последовательность которых запрограммирована с помощью нуклеиновых кислот. Молекулы, используемые в качестве программы в матричном биосинтезе, называют матрицами.
Тремя главными матричными биосинтезами, присущими всем без исключения живым организмам, являются репликация ДНК, транскрипция и трансляция.
- репликация ДНК происходит в ядре, предшествует делению клеток, в результате чего дочерние клетки получают полный набор генов;
- транскрипция также осуществляется в ядре, в ходе её образуются матричные, транспортные и рибосомальные РНК, участвующие в синтезе белка в клетке;
- трансляция происходит на рибосомах и приводит к образованию специфических клеточных белков.
Связь этих процессов отражена в основном постулате молекулярной биологии: направление потока информации от генотипа к фенотипу: ДНК → РНК → белок (стрелки обозначают направление передачи информации).
4.3.2. Кроме того, для некоторых видов вирусов характерны ещё два вида матричных синтезов:
- репликация РНК - синтез РНК на матрице РНК;
- обратная транскрипция - синтез ДНК с использованием в качестве матрицы молекулы РНК.
4.3.3. Попытаемся сформулировать общие закономерности, характерные для всех матричных биосинтезов.
- Мономеры (нуклеотиды, аминокислоты) непосредственно в синтезе полимеров участвовать не могут; они должны находиться в активной форме - нуклеотиды - в виде нуклеозидтрифосфатов, аминокислоты - в виде соединений с тРНК.
- Синтез всех полинуклеотидных и полипептидных цепей складывается из трёх основных этапов - инициации, элонгации и терминации.
- На матрице имеется специальный сигнал или группа сигналов, позволяющие опознать кодирующий элемент, с которого начинается информация о синтезируемой цепи биополимера. Этот сигнал, как правило, не совпадает с точкой физического начала полимерной цепи матрицы. Инициация - процесс, в котором происходит присоединение первого мономерного звена к молекуле-матрице.
- На каждый акт инициации биосинтеза приходится большое количество актов элонгации , т.е. соединения очередного мономера с растущей цепью. В элонгации участвуют 3 компонента: а) концевая группа синтезируемого полимера, б) кодирующий элемент матрицы, в) очередная молекула активного мономера. Все они должны быть зафиксированы определённым образом в активном центре фермента или рибосомы.
- Каждый акт элонгации начинается с отбора субстратов путём перебора всех присутствующих субстратов в системе. Попадание в активный центр нужного субстрата является сигналом для осуществления ферментативной реакции соединения мономерного фрагмента с концом синтезируемой полимерной цепи. Присоединение мономера к растущей цепи служит сигналом для перемещения активного центра на один кодирующий элемент матрицы .
- Конец продукта чаще всего не соответствует концу матрицы, на ней должен быть специальный сигнал, обеспечивающий прекращение роста цепи , т.е. терминацию.
- Синтез биологически активной молекулы, как правило, не заканчивается терминацией . Образующийся полимер претерпевает ряд превращений, таких как частичный гидролиз и объединение нескольких цепей в одну, модификация мономеров в составе полимера, присоединение простетической части (к полипептиду) или апопротеина (к полинуклеотиду).
Репликация - процесс самоудвоения ДНК, или биосинтез дочерней молекулы ДНК, полностью идентичной исходной молекуле (матрице). Локализация процесса - клеточное ядро. Основные принципы репликации ДНК:
- комплементарность
- антипараллельность
- униполярность
- потребность в затравке - ферменты, синтезирующие ДНК, способны лишь наращивать существующую полинуклеотидную цепь, поэтому вначале синтезируется короткая цепь РНК (затравка или праймер), к которой присоединяются дезоксирибонуклеотиды; выполнившая свою роль РНК-затравка удаляется;
- прерывистость - одна из дочерних цепей (лидирующая) в процессе репликации растёт непрерывно, а другая (отстающая) - в виде фрагментов длиной в несколько сот нуклеотидов (фрагментов Оказаки);
- полуконсервативность - в результате репликации образуются две двойные дочерние ДНК, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин материнской ДНК.
4.4.2. Условия, необходимые для репликации ДНК:
1) Матрица - молекула ДНК (рисунок 26.1, а);
2) Расплетающие белки - разрывают водородные связи между комплементарными основаниями двойной спирали ДНК, в результате чего образуется репликативная вилка (рисунок 26.1, б);
3) ДНК-связываюшие белки - присоединяются к разделившимся цепям ДНК и препятствуют их обратному воссоединению;
4) Праймаза (РНК-полимераза) - фермент, синтезирующий затравочную РНК.
5) - дезоксирибонуклеозидтрифосфаты (дАТФ, дГТФ, дТТФ, дЦТФ). Присоединяются к азотистым основаниям полинуклеотидных цепей при помощи водородных связей по принципу комплементарности;
6) ДНК-полимераза - фермент, который формирует из нуклеозидтрифосфатов новые полинуклеотидные цепи за счёт образования 3’,5’-фосфодиэфирных связей. Источником энергии служат макроэргические связи нуклеозидтрифосфатов. На одной ветви репликативной вилки синтезируется непрерывная цепь, на другой - фрагменты Оказаки (рисунок 26.1, в);
7) ДНК-лигаза - фермент, соединяющий фрагменты Оказаки в единую цепь (рисунок 26.1, г).
В результате образуются две идентичные молекулы ДНК (рисунок 26.1, д).
Транскрипция - биосинтез РНК на матрице ДНК. Процесс транскрипции также происходит в клеточном ядре. Основные принципы транскрипции:
- комплементарность - синтезируемые цепи комплементарны матрице;
- антипараллельность - 5"-конец синтезируемой полинуклеотидной цепи находится напротив 3"-конца матрицы и наоборот;
- униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5" → 3";
- беззатравочность - биосинтез РНК не требует наличия праймера;
- асимметричность - синтез дочерней цепи идёт только на одной цепи ДНК-матрицы, вторая при этом блокирована.
4.5.2. Условия, необходимые для транскрипции:
- Матрица - участок одной из цепей ДНК (рисунок 8.2, а);
- ДНК-зависимая РНК-полимераза - главный фермент, участвующий в транскрипции. Место присоединения фермента к ДНК - промотор;
- Субстраты и источники энергии - рибонуклеозидтрифосфаты (АТФ, ГТФ, УТФ, ЦТФ). Связываются с азотистыми основаниями транскрибируемой цепи ДНК водородными связями по принципу комплементарности.
9. Биосинтез белков. Генетический код. Последовательность реакций при синтезе полипептидной цепи (инициация, элонгация, терминация) в процессе трансляции на рибосомах. Посттрансляционная модификация молекул белков. Нарушения синтеза белка в детском возрасте (квашиоркор).
|
Трансляция (от англ. translation - перевод) - перевод генетической информации, заключённой в мРНК, в линейную последовательность аминокислот в полипептидной цепи. Этот перевод осуществляется посредством генетического (биологического) кода. 5.1.2. Генетический код - последовательность нуклеотидов, соответствующая определённым аминокислотам. Генетический код характеризуется свойствами:
5.1.3. Аминокислоты и триплеты нуклеотидов, кодирующие их, не комплементарны друг другу. Поэтому должны существовать молекулы-адапторы, каждая из которых может взаимодействовать как с определённым кодоном, так и с соответствующей аминокислотой. Такими молекулами являются транспортные РНК (рисунок 8.3). Каждая тРНК содержит триплет нуклеотидов - антикодон , который комплементарен строго определённому кодону мРНК. 3’-конец тРНК (акцепторный участок) является местом присоединения аминокислоты, соответствующей кодону мРНК. |
Активация аминокислот - подготовительный этап биосинтеза белка - включает связывание их со специфическими тРНК при участии фермента аминоацил-тРНК-синтетазы . Реакция происходит в цитоплазме клеток.
Собственно процесс трансляции включает 3 стадии - инициации, элонгации, терминации и происходит на рибосомах.
Каждая рибосома состоит из большой и малой субчастиц (40S и 60S) и содержит аминоацильный (А) и пептидильный (П) участки. Пептидильный участок связывает инициирующую аминоацил-тРНК, все остальные аминоацил-тРНК присоединяются к аминоацильному участку.
1) Стадия инициации - начало трансляции. Условия, необходимые для инициации:
- инициирующий кодон мРНК (АУГ);
- белковые факторы инициации;
- малая и большая субчастицы рибосомы;
- ГТФ (источник энергии для смыкания субчастиц рибосомы);
- ионы магния;
- инициирующая аминоацил-тРНК (метионил-тРНК) - связывается своим антикодоном с инициирующим кодоном мРНК в пептидильном участке рибосомы.
В результате образуется инициирующий комплекс : мРНК - рибосома - метионил-тРНК (рисунок 5.3, а).
2) Стадия элонгации - удлинение полипептидной цепи на 1 аминокислотный остаток - происходит в три шага:
- присоединение к инициирующему комплексу аминоацил-тРНК, соответствующей кодону, находящемуся в аминоацильном участке рибосомы (рисунок 5.3, б);
- транспептидация - образование пептидной связи между остатками аминокислот (рисунок 5.3, в). Источник энергии - ГТФ;
- транслокация - перемещение рибосомы относительно мРНК на 1 триплет (рисунок 5.3, г). Источник энергии - ГТФ. В ходе элонгации принимают участие белковые факторы.
Описанный процесс многократно повторяется (по количеству аминокислот в цепи).
3) Стадия терминации - окончание трансляции. Обеспечивается присутствием в цепи мРНК одного из терминирующих (бессмысленных) кодонов - УАА, УГА или УАГ. В освобождении полипептида участвуют белковые факторы терминации (рисунок 5.3, д). Когда в аминоацильном участке оказывается один из бессмысленных кодонов, факторы терминации стимулируют гидролазную активность пептидилтрансферазы. Благодаря этому гидролизуется связь между тРНК и пептидом. ГТФ для этой реакции не требуется. После этого пептидная цепь, тРНК и мРНК покидают рибосому, а её субчастицы диссоциируют.
Таким образом, трансляция мРНК приводит к формированию пептидной цепи со строго определённой последовательностью аминокислотных остатков. Следующий этап формирования белка -фолдинг , т.е. сворачивание пептидной цепи в правильную трёхмерную структуру. Если белок состоит из нескольких субъединиц, то фолдинг включает и объединение их в единую макромолекулу.
Считается, что небольшие белковые молекулы, содержащие около 100 аминоацильных остатков, могут самостоятельно принимать трёхмерную структуру, фолдинг более крупных полипептидных цепей требует участия специальных белков - шаперонов .
Шапероны называют иначе белками теплового шока, так как они не только обеспечивают правильный фолдинг вновь образованных белков, но и ренатурацию ранее синтезированных белков, подвергшихся в клетке частичной денатурации под действием различных факторов (перегрев, облучение, действие своблодных радикалов и т.д.).
5.2.2. Посттрансляционные модификации белковой молекулы могут включать:
- частичный протеолиз (например, превращение профермента в фермент);
- присоединение простетической группы (остатков фосфорной кислоты, углеводных остатков, гемовых групп и т.д.);
- модификации боковых цепей аминокислотных остатков:
- гидроксилирование пролина в гидроксипролин в коллагене,
- метилирование аргинина в гистоне,
- йодирование тирозина в тироглобулине).
5.2.3. Действие токсических и лекарственных веществ на биосинтез белка.
Биосинтез белка является одним из наиболее сложных процессов, протекающих в клетках. Его прерывание или извращение возможно в результате нарушения любого из трёх матричных синтезов.
Так, мутагены (бенз(а)пирен, линдан) нарушают репликацию ДНК и таким образом прерывают белоксинтезирующие процессы.
Некоторые токсические вещества (госсипол) могут изменять скорость транскрипции.
К лекарственным веществам, влияющим на биосинтез белка, относятся антибиотики и интерфероны.
Антибиотики, блокирующие матричные биосинтезы, используются в лечении инфекционных заболеваний и злокачественных опухолей. (см. таблицу 5.1).
Таблица 5.1
Антибиотики, ингибирующие матричные биосинтезы
10. Регуляция синтеза белка. Представление об опероне. Индукция и репрессия синтеза в организме человека. Роль гормонов в регуляции действия генов. Ингибиторы матричных синтезов - антибиотики, интерфероны.
|
5.3.1. Оперон (транскриптон) - совокупность генов, способных включаться и выключаться в зависимости от метаболических потребностей клетки. В состав оперона наряду соструктурными генами (СГ) , кодирующими структуру определённых белков, входят участки ДНК, выполняющие регуляторные функции (рисунок 5.4). Группа структурных генов, отвечающих за синтез ферментов одного метаболического пути, находится под контролем гена-оператора (ГО) , расположенного рядом. Функция гена-оператора контролируется пространственно удалённым от него геном-регулятором (ГР) , который продуцирует белок-репрессор , находящийся в активной либо в неактивной форме. Активный белок-репрессор способен связываться с геном-оператором и тормозить транскрипцию структурных генов, следовательно, подавлять синтез белков. Вещества, вызывающие инактивацию белка-репрессора, являются индукторами синтеза белка, оказывающие противоположный эффект - корепрессорами. В качестве индукторов могут выступать исходные субстраты метаболических путей, в качестве корепрессоров - конечные продукты этих путей. 5.3.2. Существуют два механизма регуляции синтеза белка - индукция и репрессия . Примером оперона, который регулируется по механизму индукции, является лактозный оперон , в состав которого наряду с геном-оператором входят 3 структурных гена, кодирующие ферменты катаболизма лактозы (см. рисунок 5.4). Лактоза является индуктором данного оперона. При высокой концентрации лактозы в среде ферменты синтезируются, при низкой концентрации - нет. |
5.3.3. По механизму репрессии регулируется гистидиновый оперон , содержащий ген-оператор и 10 структурных генов, кодирующих ферменты, необходимые для биосинтеза гистидина (см. рисунок 5.5). Гистидин является корепрессором данного оперона. При высокой концентрации гистидина в среде синтез ферментов прекращается, при отсутствии гистидина они синтезируются.
11. Роль ферментов в метаболизме. Наследственные энзимопатии в раннем детском возрасте. Многообразие ферментов. Специфичность действия ферментов. Классификация ферментов. Изоферменты, мультиферменты.
Протекание процессов обмена веществ в организме определяется действием многочисленных ферментов — биологических катализаторов белковой природы. Они ускоряют химические реакции и сами при этом не расходуются. Термин «фермент» происходит от латинского слова fermentum — закваска. Наряду с этим понятием в литературе используется равноценный термин «энзим» (en zyme - в дрожжах) греческого происхождения. Отсюда раздел биохимии, изучающий ферменты, получил название «энзимология».
Энзимология составляет основу познания на молекулярном уровне важнейших проблем физиологии и патологии человека. Переваривание пищевых веществ и их использование для выработки энергии, образование структурных и функциональных компонентов тканей, сокращение мышц, передача электрических сигналов по нервным волокнам, восприятие света глазом, свертывание крови — каждый из этих физиологических механизмов имеет в основе каталитическое действие определенных ферментов. Было показано, что многочисленные заболевания непосредственно нарушением ферментативного катализа; определение активности ферментов в крови и других тканях даёт ценные сведения для медицинской диагностики; ферменты или их ингибиторы могут применяться как лекарственные вещества. Таким образом, знание важнейших особенностей ферментов и катализируемых ими реакций необходимо при рациональном подходе к изучению заболеваний человека, их диагностике и лечению.
В основу классификации положен важнейший признак, по которому один фермент отличается от другого — это катализируемая им реакция. Число типов химических реакций сравнительно невелико, что позволило разделить все известные в настоящее время ферменты на 6 важнейших классов, в зависимости от типа катализируемой реакции. Такими классами являются:
- оксидоредуктазы (окислительно-восстановительные реакции);
- трансферазы (перенос функциональных групп);
- гидролазы (реакции расщепления с участием воды);
- лиазы (разрыв связей без участия воды);
- изомеразы (изомерные превращения);
- лигазы (синтез с затратой молекул АТФ).
7.4.3.
Ферменты каждого класса делят на подклассы,
руководствуясь строением субстратов. В подклассы объединяют ферменты, действующие на сходно построенные субстраты. Подклассы разбивают на подподклассы,
в
которых ещё строже уточняют структуру химических групп, отличающих субстраты друг от друга. Внутри подподклассов перечисляют индивидуальные ферменты.
Все подразделения классификации имеют свои номера. Таким образом, любой фермент получает свой уникальный кодовый номер, состоящий из четырёх чисел, разделённых точками. Первое число обозначает класс, второе - подкласс, третье - подподкласс, четвёртое - номер фермента в пределах подподкласса. Например, фермент α-амилаза, расщепляющая крахмал, обозначается как 3.2.1.1, где:
3 — тип реакции (гидролиз);
2 — тип связи в субстрате (гликозидная);
1 — разновидность связи (О-гликозидная);
1 — номер фермента в подподклассе
Вышеописанный десятичный способ нумерации имеет одно важное преимущество: он позволяет обойти главное неудобство сквозной нумерации ферментов, а именно: необходимость при включении в список вновь открытого фермента изменять номера всех последующих. Новый фермент может быть помещён в конце соответствующего подподкласса без нарушения всей остальной нумерации. Точно так же при выделении новых классов, подклассов и подподклассов их можно добавлять без нарушения порядка нумерации ранее установленных подразделений. Если после получения новой информации возникает необходимость изменить номера некоторым ферментам, прежние номера не присваивают новым ферментам, чтобы избежать недоразумений.
Говоря о классификации ферментов, следует также отметить, что ферменты классифицируются не как индивидуальные вещества, а как катализаторы определённых химических превращений. Ферменты, выделенные из разных биологических источников и катализирующие идентичные реакции, могут существенно отличаться по своей первичной структуре. Тем не менее в классификационном списке все они фигурируют под одним и тем же кодовым номером.
Итак, знание кодового номера фермента позволяет:
- устранить неоднозначности, если разные исследователи используют одно и то же название для различных ферментов;
- сделать поиск информации в литературных базах данных более эффективным;
- получить в других базах данных дополнительную информацию о последовательности аминокислот, пространственной структуре фермента, генах, кодирующих ферментные белки.
Изоферменты - это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, разной чувствительности к ингибиторам и активаторам, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц (2, 4, 6 и т.д.). Изоформы фермента образуются в результате различных комбинаций субъединиц.
В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию:
НАДН 2 НАД +
пируват ← ЛДГ → лактат
ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ 1 (НННН), ЛДГ 2 (НННМ), ЛДГ 3 (ННММ), ЛДГ 4 (НМММ), ЛДГ 5 (ММММ).
Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних - диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза.
Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ 1 , ЛДГ 2 (миокард, надпочечники), где анаэробный обмен - ЛДГ 4 , ЛДГ 5 (скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ 4 , ЛДГ 5 . После рождения в некоторых тканях происходит увеличение содержания ЛДГ 1 , ЛДГ 2 .
Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей.
12. Свойства ферментов. Зависимость скорости ферментативной реакции от концентрации фермента и субстрата, температуры и рН среды.
Белковая природа ферментов обусловливает появление у них ряда свойств, в целом нехарактерных для неорганических катализаторов: олигодинамичность, специфичность, зависимость скорости реакции от температуры, рН среды, концентрации фермента и субстрата, присутствия активаторов и ингибиторов.
Под олигодинамичностью ферментов понимают высокую эффективность действия в очень малых количествах. Такая высокая эффективность объясняется тем, что молекулы ферментов в процессе своей каталитической деятельности непрерывно регенерируют. Типичная молекула фермента может регенерировать миллионы раз в минуту. Надо сказать, что и неорганические катализаторы также способны ускорять превращение такого количества веществ, которое во много раз превышает их собственную массу. Но ни один неорганический катализатор не может сравниться с ферментами по эффективности действия.
Примером может служить фермент реннин, вырабатываемый слизистой оболочкой желудка жвачных животных. Одна молекула его за 10 минут при 37°С способна вызывать коагуляцию (створаживание) порядка миллиона молекул казеиногена молока.
Другой пример высокой эффективности ферментов даёт каталаза. Одна молекула этого фермента при 0°С расщепляет за секунду около 50 000 молекул пероксида водорода:
2 Н2О2 2 Н2О + О2
Действие каталазы на пероксид водорода заключается в изменении величины энергии активации этой реакции приблизительно от 75 кДж/моль без катализатора до 21 кДж/моль в присутствии фермента. Если же в качестве катализатора этой реакции используется коллоидная платина, то энергия активации составляет всего 50 кДж/моль.
7.2.2. При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальное значение.
Мерой скорости ферментативных реакций служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Изменение скорости проводят на начальной стадии реакции, когда продукт ещё практически отсутствует, и обратная реакция не идёт. Кроме того, на начальной стадии реакции концентрация субстрата соответствует его исходному количеству.
7.2.3. Зависимость скорости ферментативной реакции (V) от концентрации фермента [Е] (рисунок 7.3). При высокой концентрации субстрата (многократно превышающей концентрацию фермента) и при постоянстве других факторовскорость ферментативной реакции пропорциональна концентрации фермента. Поэтому зная скорость реакции, катализируемой ферментом, можно сделать вывод о его количестве в исследуемом материале.

Рисунок 7.3. Зависимость скорости ферментативной реакции от концентрации фермента
7.2.4. Зависимость скорости реакции от концентрации субстрата [S] . График зависимости имеет вид гиперболы (рисунок 7.4). При постоянной концентрации фермента скорость катализируемой реакции возрастает с увеличением концентрации субстрата до максимальной величины Vmax, после чего остаётся постоянной. Это следует объяснить тем, что при высоких концентрациях субстрата все активные центры молекул фермента оказываются связанными с молекулами субстрата. Любое избыточное количество субстрата может соединиться с ферментом лишь после того, как образуется продукт реакции и освободится активный центр.

Рисунок 7.4. Зависимость скорости ферментативной реакции от концентрации субстрата.
Зависимость скорости реакции от концентрации субстрата может быть выражена уравнением Михаэлиса — Ментен:
 ,
,
где V — скорость реакции при концентрации субстрата [S] , Vmax —максимальная скорость и KM —константа Михаэлиса.
Константа Михаэлиса равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. Определение KM и Vmax имеет важное практическое значение, так как позволяет количественно описать большинство ферментативных реакций, включая реакции с участием двух и более субстратов. Различные химические вещества, изменяющие активность ферментов, по-разному воздействуют на величины Vmax и KM.
7.2.5. Зависимость скорости реакции от t - температуры, при которой протекает реакция (рисунок 7.5), имеет сложный характер. Значение температуры, при котором скорость реакции максимальна, представляет собой температурный оптимум фермента. Температурный оптимум большинства ферментов организма человека приблизительно равен 40°С. Для большинства ферментов оптимальная температура равна или выше тойц температуры, при которой находятся клетки.

Рисунок 7.5. Зависимость скорости ферментативной реакции от температуры.
При более низких температурах (0° — 40°С) скорость реакции увеличивается с ростом температуры. При повышении температуры на 10°С скорость ферментативной реакции удваивается (температурный коэффициент Q10 равен 2). Повышение скорости реакции объясняется увеличением кинетической энергии молекул. При дальнейшем повышении температуры происходит разрыв связей, поддерживающих вторичную и третичную структуру фермента, то есть тепловая денатурация. Это сопровождается постепенной потерей каталитической активности.
7.2.6. Зависимость скорости реакции от рН среды (рисунок 7.6). При постоянной температуре фермент работает наиболее эффективно в узком интервале рН. Значение рН, при котором скорость реакции максимальна, представляет собой оптимум рН фермента. У большинства ферментов организма человека оптимум рН находится в пределах рН 6 - 8, но есть ферменты, которые активны при значениях рН, лежащих за пределами этого интервала (например, пепсин, наиболее активный при рН 1,5 - 2,5).
Изменение рН как в кислую, так и в щелочную сторону от оптимума приводит к изменению степени ионизации кислых и основных групп аминокислот, входящих в состав фермента (например, СООН-группы аспартата и глутамата, NН2-группы лизина и т.д.). Это вызывает изменение конформации фермента, в результате чего изменяется пространственная структура активного центра и снижение его сродства к субстрату. Кроме того, при экстремальных значениях рН происходит денатурация фермента и его инактивация.

Рисунок 7.6. Зависимость скорости ферментативной реакции от рН среды.
Следует отметить, что свойственный ферменту оптимум рН не всегда совпадает с рН его непосредственного внутриклеточного окружения. Это позволяет предположить, что среда, в которой находится фермент, в какой-то мере регулирует его активность.
7.2.7. Зависимость скорости реакции от присутствия активаторов и ингибиторов . Активаторы повышают скорость ферментативной реакции. Ингибиторы понижают скорость ферментативной реакции.
В качестве активаторов ферментов могут выступать неорганические ионы. Предполагают, что эти ионы заставляют молекулы фермента или субстрата принять конформацию, способствующую образованию фермент-субстратного комплекса. Тем самым увеличивается вероятность взаимодействия фермента и субстрата, а следовательно и скорость реакции, катализируемой ферментом. Так, например, активность амилазы слюны повышается в присутствии хлорид-ионов.
13. Механизм действия ферментов. Каталитический (активный) центр. Коферменты и кофакторы. Конкурентное и неконкурентное ингибирование. Использование конкурентных ингибиторов как лекарственных препаратов.
Активный центр (Ац) - это часть молекулы фермента, которая специфически взаимодействует с субстратом и принимает непосредственное участие в катализе. Ац, как правило, находиться в нише (кармане). В Ац можно выделить два участка: участок связывания субстрата - субстратный участок (контактная площадка) и собственно каталитический центр .
Большинство субстратов образует, по меньшей мере, три связи с ферментом, благодаря чему молекула субстрата присоединяется к активному центру единственно возможным способом, что обеспечивает субстратную специфичность фермента. Каталитический центр обеспечивает выбор пути химического превращения и каталитическую специфичность фермента.
У группы регуляторных ферментов есть аллостерические центры , которые находятся за пределами активного центра. К аллостерическому центру могут присоединяться “+” или “-“ модуляторы, регулирующие активность ферментов.
Различают ферменты простые, состоят только из аминокислот, и сложные, включают также низкомолекулярные органические соединения небелковой природы (коферменты) и (или) ионы металлов (кофакторы).
Коферменты - это органические вещества небелковой природы, принимающие участие в катализе в составе каталитического участка активного центра. В этом случае белковую составляющую называют апоферментом , а каталитически активную форму сложного белка - холоферментом . Таким образом: холофермент = апофермент + кофермент.
В качестве коферментов функционируют:
- гемы,
- нуклеотиды,
- коэнзим Q,
- ФАФС,
- Глутатион
- производные водорастворимых витаминов:
Кофермент, который присоединен к белковой части ковалентными связями называется простетической группой . Это, например, FAD, FMN, биотин, липоевая кислота. Простетическая группа не отделяется от белковой части. Кофермент, который присоединен к белковой части нековалентными связями называется косубстрат . Это, например, НАД + , НАДФ + . Косубстрат присоединяется к ферменту в момент реакции.
Кофакторы ферментов - это ионы металлов, необходимые для проявления каталитической активности многих ферментов. В качестве кофакторов выступают ионы калия, магния, кальция, цинка, меди, железа и т.д. Их роль разнообразна, они стабилизируют молекулы субстрата, активный центр фермента, его третичную и четвертичную структуру, обеспечивают связывание субстрата и катализ. Например, АТФ присоединяется к киназам только вместе с Mg 2+ .
14. Основные механизмы регуляции действия ферментов и их роль в регуляции метаболизма. Проферменты.
8.4.1. Как уже отмечалось, ферменты, относятся к катализаторам, активность которых может регулироваться. Поэтому через ферменты можно контролировать скорость протекающих химических реакций в организме. Регуляция активности ферментов может осуществляться путем взаимодействия с ними различных биологических компонентов или чужеродных соединений (например, лекарств и ядов), которые принято называть модификаторами или регуляторами ферментов. Под действием модификаторов на фермент реакция может ускоряться (в этом случае их называют активаторами ) или замедляться (в этом случае их называют ингибиторами ).
8.4.2. Активация ферментов определяется по ускорению биохимических реакций, наступающему после действия модификатора. Одну группу активаторов составляют вещества, влияющие на область активного центра фермента. К ним относятся кофакторы ферментов и субстраты. Кофакторы (ионы металлов и коферменты) являются не только обязательными структурными элементами сложных ферментов, но и по существу их активаторами.
Из ионов металлов на активность многих ферментов влияют: NH4+, Na+, Mg2+, K+, Ca2+, Mn2+, Zn2+, Fe2+, Fe3+, Co2+. Ионы тяжелых металлов, как правило, оказывают ингибирующее влияние. Действие катионов в основном довольно специфично, но в большинстве случаев фермент активируется более, чем одним катионом. Наблюдается также явление антагонизма между ионами. Наиболее известен антагонизм между Na+ и К+ и между Mg2+ и Са2+.
Магний является природным активатором ферментов, действующих на фосфорилированные субстраты (фосфатазы, киназы, синтетазы), но в условиях in vitro может быть заменён марганцем.
Анионы в общем мало влияют на активность ферментов, и их воздействие лишено специфичности. Исключением является амилаза, активируемая хлоридами, а также, в меньшей степени, другими галогенами. Влияние активирующего иона изменяется также в зависимости от рН. Степень очистки фермента также влияет на активирующую концентрацию иона и на специфичность активации. Высокоочищенные ферменты характеризуются большей избирательностью по отношению к активирующим ионам.
8.4.3. Активирующее действие ионов металлов реализуется различными путями. Наиболее типичным механизмом является включение иона в структуру каталитического центра фермента, который без него не проявляет активности. Это типичная функция металла в роли кофермента. Другой, довольно частой функцией активирующего металла является образование связи между ферментом и субстратом, или между ферментом, коферментом и субстратом. Например, ионы Zn2+ в составе фермента алкогольдегидрогеназы образуют 2 координационные связи с молекулой кофермента НАД+, 3 координационные связи с молекулой апофермента, а шестая координационная связь присоединяет субстрат.
Ионы металлов, так же как и субстраты, коферменты, их предшественники и структурные аналоги, можно использовать на практике в качестве препаратов, регулирующих активность ферментов.
Если каталитически активный белок называется ферментом (или энзимом), то неактивный предшественник фермента называется проферментом (или зимогеном).
Активация белков путем частичного протеолиза - процесс, широко распространенный в биологических системах. Вот несколько примеров.
- пищеварительные ферменты, гидролизующие белки, синтезируются в желудке и поджелудочной железе в виде проферментов: пепсин - в виде пепсиногена, трипсин - в виде трипсиногена и т.д.
- свертывание крови представляет собой каскад реакций протеолитической активации проферментов. Это обеспечивает быструю ответную реакцию на повреждение кровеносного сосуда.
- некоторые белковые гормоны синтезируются в виде неактивных предшественников. Например, инсулин образуется из проинсулина.
- фибриллярный белок соединительной ткани коллаген также образуется из предшественника — проколлагена.
15. Принципы количественного определения ферментов. Единицы ак-тивности ферментов. Основные направления использования ферментов в медицине. Эн-зимодиагностика, энзимотерапия, использование ферментов как реагентов.
Уникальное свойство ферментов ускорять химические реакции может быть использовано для количественного определения содержания этих биокатализаторов в биологическом материале (тканевом экстракте, сыворотке крови и т.д.). При правильно подобранных экспериментальных условиях почти всегда существует пропорциональность между количеством фермента и скоростью катализируемой реакции, поэтому по активности фермента можно судить о количественном содержании его в исследуемой пробе.
Измерение ферментативной активности основывается на сравнении скорости химической реакции в присутствии активного биокатализатора со скоростью реакции в контрольном растворе, в котором фермент отсутствует или инактивирован.
Исследуемый материал помещают в инкубационную среду, где созданы оптимальные температура, рН среды, концентрации активаторов и субстратов. Одновременно осуществляют постановку контрольной пробы, в которую фермент не добавляют. Спустя некоторое время реакцию останавливают путём добавления различных реагентов (изменяющих рН среды, вызывающих денатурацию белков и т.д.) и проводят анализ проб.
Для того чтобы определить скорость ферментативной реакции, необходимо знать:
- разность концентраций субстрата или продукта реакции до и после инкубации;
- время инкубации;
- количество материала, взятое для анализа.
Наиболее часто активность фермента оценивают по количеству образовавшегося продукта реакции. Так поступают, например, при определении активности аланинаминотрансферазы, катализирующей следующую реакцию:
Активность фермента можно рассчитывать также исходя из количества израсходованного субстрата. В качестве примера можно привести способ определения активности α-амилазы - фермента, расщепляющего крахмал. Измерив содержание крахмала в пробе до и после инкубации и вычислив разность, находят количество субстрата, расщеплённого за время инкубации.
Существует большое количество методов измерения активности ферментов, различающихся по технике исполнения, специфичности, чувствительности.
Чаще всего для определения применяются фотоэлектроколориметрические методы . В основе этих методов лежат цветные реакции с одним из продуктов действия ферментов. При этом интенсивность окраски получаемых растворов (измеренная на фотоэлектроколориметре) пропорциональна количеству образовавшегося продукта. Например, в процессе реакций, катализируемых аминотрансферазами, накапливаются α-кетокислоты, которые дают с 2,4-динитрофенилгидразином соединения красно-бурого цвета:
Если исследуемый биокатализатор обладает низкой специфичностью действия, то можно подобрать такой субстрат, в результате реакции с которым образуется окрашенный продукт. Примером может служить определение щелочной фосфатазы - фермента, широко распространённого в тканях человека, его активность в плазме крови существенно меняется при заболеваниях печени и костной системы. Этот фермент в щелочной среде гидролизует большую группу фосфорнокислых эфиров, как природных, так и синтетических. Одним из синтетических субстратов является паранитрофенилфосфат (бесцветный), который в щелочной среде расщепляется на ортофосфат и паранитрофенол (жёлтого цвета).
За ходом реакции можно наблюдать, измеряя постепенно нарастающую интенсивность окраски раствора:
Для ферментов, обладающих высокой специфичностью действия, такой подбор субстратов, как правило, невозможен.
Спектрофотометрические методы основаны на изменении ультрафиолетового спектра химических веществ, принимающих участие в реакции. Большинство соединений поглощает ультрафиолетовые лучи, причём поглощаемые длины волн характерны для присутствующих в молекулах этих веществ определённых групп атомов. Ферментативные реакции вызывают внутримолекулярные перегруппировки, в результате которых меняется ультрафиолетовый спектр. Эти изменения можно зарегистрировать на спектрофотометре.
Спектрофотометрическими методами, например, определяют активность окислительно-восстановительных ферментов, содержащих в качестве коферментов НАД или НАДФ. Эти коферменты действуют как акцепторы или доноры атомов водорода и, таким образом, либо восстанавливаются, либо окисляются в процессах метаболизма. Восстановленные формы этих коферментов имеют ультрафиолетовый спектр с максимумом поглощения при 340 нм, окисленные формы этого максимума не имеют. Так, при действии лактатдегидрогеназы на молочную кислоту происходит перенос водорода на НАД, что приводит к увеличению поглощения НАДН при 340 нм. Величина этого поглощения в оптических единицах пропорциональна количеству образовавшейся восстановленной формы кофермента.
По изменению содержания восстановленной формы кофермента можно определить активность фермента.
Флюориметрические методы. В основе этих методов лежит явление флюоресценции, которое заключается в том, что исследуемый объект под влиянием облучения излучает свет с более короткой длиной волны. Флюориметрические методы определения активности ферментов более чувствительны, чем спектрофотометрические. Сравнительно новыми и ещё более чувствительными являются хемилюминесцентные методы с применением люциферин-люциферазной системы. Такие методы позволяют определять скорость реакций, протекающих с образованием АТФ. При взаимодействии люциферина (карбоновой кислоты сложного строения) с АТФ образуется люцифериладенилат. Это соединение окисляется при участии фермента люциферазы, что сопровождается световой вспышкой. Измеряя интенсивность световых вспышек, удаётся определять количества АТФ порядка нескольких пикомолей (10-12 моль).
Титрометрические методы . Ряд ферментативных реакций сопровождается изменением рН инкубационной смеси. Примером такого фермента является липаза поджелудочной железы. Липаза катализирует реакцию:
Образующиеся жирные кислоты могут быть оттитрованы, причём количество щёлочи, израсходованное на титрование, будет пропорционально количеству выделившихся жирных кислот и, следовательно, активности липазы. Определение активности этого фермента имеет клиническое значение.
Манометрические методы основаны на измерении в закрытом реакционном сосуде объёма газа, выделившегося (или поглощённого) в ходе энзиматической реакции. С помощью таких методов были открыты и изучены реакции окислительного декарбоксилирования пировиноградной и α-кетоглутаровой кислот, протекающие с выделением СО2. В настоящее время эти методы используются редко.
Международная комиссия по ферментам предложила за единицу активности любого фермента принимать такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля (10-6 моль) субстрата в единицу времени (1 мин, 1 час) или одного микроэквивалента затронутой группы в тех случаях, когда атакуется более одной группы в каждой молекуле субстрата (белки, полисахариды и другие). Должна быть указана температура, при которой проводится реакция. Результаты измерений активности ферментов могут быть выражены в единицах общей, удельной и молекулярной активности.
За единицу общей активности фермента в расчёте на количество материала, взятого для исследования . Так, активность аланинаминотрансферазы в печени крыс равна 1670 мкмоль пирувата в час на 1 г ткани; активность холинэстеразы в сыворотке крови человека составляет 250 мкмоль уксусной кислоты в час на 1 мл сыворотки при 37°C.
Особого внимания исследователя требуют высокие значения активности фермента как в норме, так и в патологии. Рекомендуется работать с небольшими показателями активности фермента. Для этого источник фермента берут в меньшем количестве (сыворотку разводят в несколько раз физиологическим раствором, а для ткани готовят меньший процентный гомогенат). По отношению к ферменту в таком случае создаются условия насыщения субстратом, что способствует проявлению его истинной активности.
Общая активность фермента рассчитывается с помощью формулы:
где а - активность фермента (общая), ΔС - разность концентраций субстрата до и после инкубации; В - количество материала, взятого на анализ, t - время инкубации; n - разведение.
Следует иметь в виду, что показатели активности ферментов сыворотки крови и мочи, исследуемых в диагностических целях, выражают в единицах общей активности.
Поскольку ферменты являются белками, важно знать не только общую активность фермента в исследуемом материале, но и ферментативную активность белка, находящегося в данной пробе. За единицу удельной активности принимают такое количество фермента, которое катализирует превращение 1 мкмоль субстрата в единицу времени в расчёте на 1 мг белка пробы . Для вычисления удельной активности фермента необходимо общую активность разделить на содержание белка в пробе:
Чем хуже очищен фермент, тем больше в пробе находится посторонних балластных белков, тем ниже удельная активность. В ходе очистки количество таких белков уменьшается, и соответственно удельная активность фермента повышается. Предположим, в исходном биологическом материале, являющемся источником фермента (измельчённая печень, кашица из растительной ткани), удельная активность была равна 0,5 мкмоль/ (мг белка× мин). После дробного осаждения сульфатом аммония и гель-фильтрации через сефадекс она повысилась до 25 мкмоль/ (мг белка× мин), т.е. увеличилась в 50 раз. К оценке эффективности очистки ферментных препаратов прибегают при производстве лекарственных средств энзиматической природы.
Удельную активность определяют в том случае, когда нужно сопоставить активность разных препаратов одного и того же фермента. Если требуется сравнить активность разных ферментов, рассчитывают молекулярную активность.
Молекулярная активность (или число оборотов фермента) - это количество моль субстрата, подвергающееся превращению под действием 1 моль фермента в единицу времени (обычно в 1 минуту). Разным ферментам присуща неодинаковая молекулярная активность. Уменьшение числа оборотов ферментов происходит под действием неконкурентных ингибиторов. Изменяя конформацию каталитического центра фермента, эти вещества понижают сродство фермента к субстрату, что приводит к уменьшению числа молекул субстрата, реагирующих с одной молекулой фермента в единицу времени.
16. Питание - составная часть обмена веществ. Основные компо-ненты пищевого рациона и их роль. Заменимые и незаменимые компоненты пищевого рациона. Сбалансированное питание. Последствия несбалансированного питания у детей.
Полноценным называется рацион, соответствующий энергетическим потребностям человека и содержащий необходимое количество незаменимых пищевых веществ, обеспечивающих нормальный рост и развитие организма.
Факторы, влияющие на потребность организма в энергии и питательных веществах: пол, возраст и масса тела человека, его физическая активность, климатические условия, биохимические, иммунологические и морфологические особенности организма.
Все питательные вещества можно разделить на пять классов:
1. белки; 2. жиры; 3. углеводы; 4. витамины; 5. минеральные вещества.
Кроме того, любая диета должна содержать воду, как универсальный растворитель.
Незаменимыми компонентами пищевого рациона являются:
- незаменимые аминокислоты - валин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан;
- незаменимые (эссенциальные) жирные кислоты - линолевая, линоленовая, арахидоновая;
- водо- и жирорастворимые витамины;
- неорганические (минеральные) элементы - кальций, калий, натрий, хлор, медь, железо, хром, фтор, йод и другие.
11.1.2. Сбалансированный пищевой рацион. Диета, содержащая питательные вещества в соотношении, оптимальном для максимального удовлетворения пластических и энергетических потребностей организма человека, называется сбалансированным пищевым рационом. Считается, что самым благоприятным является соотношение белков, жиров и углеводов близкое к 1:1:4, при условии что общая калорийность рациона соответствует энергозатратам данного человека. Так, для студента-юноши весом 60 кг, энергозатраты составляют в среднем 2900 ккал в сутки и рацион должен содержать: 80-100 г белков, 90 г жиров, 300 - 400 г углеводов.
17. Биологическая ценность пищевых белков. Количество и качество белков в питании человека. Заменимые и незаменимые аминокислоты. Комбинирование пищевых продуктов, взаимо-дополняющих по аминокислотному составу. Характеристика белковой диеты детей. Последствия недостаточного белкового питания у детей.
Биологическая роль пищевых белков заключается в том, что они служат источником незаменимых и заменимых аминокислот. Аминокислоты используются организмом для синтеза собственных белков; в качестве предшественников небелковых азотистых веществ (гормонов, пуринов, порфиринов и др.); как источник энергии (окисление 1 г белков даёт примерно 4 ккал энергии).
Пищевые белки делятся на полноценные и неполноценные.
Полноценные пищевые белки - животного происхождения, содержат в своём составе все аминокислоты в необходимых пропорциях и хорошо усваиваются организмом.
Неполноценные белки - растительного происхождения, не содержат, или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Так, зерновые культуры, дефицитны по лизину, метионину, треонину; в белке картофеля мало метионина и цистеина. Для получения полноценных по белку пищевых рационов, следует комбинировать растительные белки, дополняющие друг друга по аминокислотному составу, например, кукурузу и бобы.
Суточная потребность: не менее 50 г в сутки, в среднем 80-100 г.
11.2.2. Белковая недостаточность в детском возрасте вызывает: 1. снижение сопротивляемости организма инфекциям; 2. остановку роста вследствие нарушения синтеза факторов роста; 3. энергетическую недостаточность организма (истощение углеводных и жировых депо, катаболизм тканевых белков); 4. потерю массы тела - гипотрофию. При белковом голодании наблюдаются отеки, которые возникают вследствие снижения содержания белков в крови (гипоальбуминемии ) и нарушения распределения воды между кровью и тканями.
18. Переваривание белков. Протеиназы. Механизм активации протеиназ желудочно-кишечного тракта. Специфичность (избира-тельность) гидролиза пептидных связей. Особенности переваривания белков у детей грудного возраста, нарушения переваривания белков у детей. Гниение белков (аминокислот) в толстом кишечнике.
Переваривание белков, то есть расщепление их до отдельных аминокислот, начинается в желудке и заканчивается в тонком кишечнике. Переваривание происходит под действием желудочного, панкреатического и кишечного соков, которые содержат протеолитические ферменты (протеазы или пептидазы). Протеолитические ферменты относятся к классу гидролаз. Они катализируют гидролиз пептидных связей СО—NН белковой молекулы.
Все протеолитические ферменты можно разделить на две группы:
- экзопептидазы - катализируют разрыв концевой пептидной связи с освобождением N- или С-концевой аминокислоты;
- эндопептидазы - гидролизуют пептидные связи внутри полипептидной цепи, продуктами реакции являются пептиды с меньшей молекулярной массой.
10.1.3. Большинство протеолитических ферментов, участвующих в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде неактивных предшественников - проферментов (зимогенов). Поэтому не происходит переваривания белков клеток, вырабатывающих проферменты. Активация проферментов осуществляется в просвете желудочно-кишечного тракта путём частичного протеолиза - отщепления части пептидной цепи зимогена.
Основная масса аминокислот, образовавшихся в пищеварительном тракте в результате переваривания белков, всасывается в кровь и пополняет аминокислотный фонд организма. Определённое количество невсосавшихся аминокислот подвергается гниению в толстом кишечнике.
Гниение - превращения аминокислот, вызванные деятельностью микроорганизмов в толстом кишечнике. Усилению процессов гниения аминокислот могут способствовать:
- избыточное поступление белков с пищей;
- врождённые и приобретённые нарушения процесса всасывания аминокислот в кишечнике;
- снижение моторной функции кишечника.
В результате гниения аминокислот образуются различные вещества, многие из которых являются токсичными для организма. Некоторые примеры продуктов гниения приводятся в таблице 10.2.
Таблица 10.2
Продукты гниения аминокислот в кишечнике.
10.2.2. Продукты гниения аминокислот являются ксенобиотиками - веществами, чужеродными для организма человека и должны быть обезврежены (инактивированы).
19. Роль липидов в организме. Пищевые липиды, суточная потребность у детей разного возраста. Особенности использования липидов в различных тканях. Бурая жировая ткань. Депонирование и мобилизация жиров в жировой ткани. Ожирение.
В состав пищевых жиров входят в, основном, триацилглицеролы (98%), фосфолипиды и холестерол. Триацилглицеролы животного происхождения содержат много насыщенных жирных кислот и имеют твёрдую консистенцию. Растительные жиры содержат больше ненасыщенных жирных кислот и имеют жидкую консистенцию (масла).
Биологическая роль: 1. являются одним из основных источников энергии; 2. служат источником незаменимых полиненасыщенных жирных кислот; 3. способствуют всасыванию из кишечника жирорастворимых витаминов. Полиненасыщенные жирные кислоты необходимы организму для построения фосфолипидов, формирующих основу всех мембранных структур клетки и липопротеинов крови. Кроме того, линолевая кислота используется для синтеза арахидоновой кислоты, служащей предшественником простагландинов, простациклинов, тромбоксанов и лейкотриенов.
Суточная потребность: 90-100 г, из них 30% должны приходиться на растительные масла. Пищевая ценность растительных жиров выше, чем животных, так как при равном энергетическом эффекте - 9 ккал на 1 г, они содержат больше незаменимых жирных кислот.
11.3.2. Нарушение соотношения доли растительных и животных жиров в рационе приводит к изменению соотношения в крови различных классов липопротеинов и, как следствие, к ишемической болезни сердца и атеросклерозу.
20. Переваривание жиров. Липазы и фосфолипазы. Желчные кислоты и парные желчные кислоты: строение, образование, биологическая роль. Особенности переваривания липидов у детей. Нарушения переваривания липидов.
Основным местом переваривания липидов является верхний отдел тонкого кишечника. Для переваривания липидов необходимы следующие условия:
- наличие липолитических ферментов;
- условия для эмульгирования липидов;
- оптимальные значения рН среды (в пределах 5,5 - 7,5).
10.3.2. В расщеплении липидов участвуют различные ферменты. Пищевые жиры у взрослого человека расщепляются в основном панкреатической липазой; обнаруживается также липаза в кишечном соке, в слюне, у грудных детей активна липаза в желудке. Липазы относятся к классу гидролаз, они гидролизуют сложноэфирные связи -О-СО- с образованием свободных жирных кислот, диацилглицеролов, моноацилглицеролов, глицерола
Поступающие с пищей глицерофосфолипиды подвергаются воздействию специфических гидролаз - фосфолипаз, расщепляющих сложноэфирные связи между компонентами фосфолипидов. Специфичность действия фосфолипаз показана на рисунке 10.4.

Рисунок 10.4. Специфичность действия ферментов, расщепляющих фосфолипиды.
Продуктами гидролиза фосфолипидов являются жирные кислоты, глицерол, неорганический фосфат, азотистые основания (холин, этаноламин, серин).
Пищевые эфиры холестерола гидролизуются панкреатической холестеролэстеразой с образованием холестерола и жирных кислот.
10.3.3. Уясните особенности структуры желчных кислот и их роль в переваривании жиров. Желчные кислоты - конечный продукт обмена холестерола, образуются в печени. К ним относятся: холевая (3,7,12-триоксихолановая), хенодезоксихолевая (3,7-диоксихолановая)и дезоксихолевая (3, 12-диоксихолановая) кислоты (рисунок 10.5, а). Две первые являются первичными желчными кислотами (образуются непосредственно в гепатоцитах), дезоксихолевая - вторичной (так как образуется из первичных желчных кислот под влиянием микрофлоры кишечника).
В желчи эти кислоты присутствуют в конъюгированной форме, т.е. в виде соединений с глицином Н2N-СН2-СООН или таурином Н2N-СН2-СН2-SO3H (рисунок 10.5, б).

Рисунок 10.5. Строение неконъюгированных (а) и конъюгированных (б) желчных кислот.
15.1.4. Желчные кислоты обладают амфифильными свойствами: гидроксильные группы и боковая цепь гидрофильны, циклическая структура гидрофобна. Эти свойства обусловливают участие желчных кислот в переваривании липидов:
1) желчные кислоты способны эмульгировать жиры, их молекулы своей неполярной частью адсорбируются на поверхности жировых капель, в то же время гидрофильные группы вступают во взаимодействие с окружающей водной средой. В результате снижается поверхностное натяжение на границе раздела липидной и водной фаз, вследствие чего крупные жировые капли разбиваются на более мелкие;
2) желчные кислоты наряду с колипазой желчи участвуют в активировании панкреатической липазы , сдвигая её оптимум рН в кислую сторону;
3) желчные кислоты образуют с гидрофобными продуктами переваривания жиров водорастворимые комплексы, что способствует их всасыванию в стенку тонкого кишечника.
Желчные кислоты, проникающие в процессе всасывания вместе с продуктами гидролиза в энтероциты, через портальную систему поступают в печень. Эти кислоты могут повторно секретироваться с желчью в кишечник и участвовать в процессах переваривания и всасывания. Такая энтеро-гепатическая циркуляция желчных кислот может осуществляться до 10 и более раз в сутки.
Строение и уровни структурной организации белков
Выделяют четыре уровня структурной организации белков: первичный, вторичный, третичный и четвертичный. Каждый уровень имеет свои особенности.
Первичная структура белка
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты [показать] .
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид [показать] .
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:

· копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости;
· способность существовать в двух резонансных формах (кето- или енольной форме);
· транс-положение заместителей по отношению к С-N-связи;
· способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Номенклатура пептидов и полипептидов . Название пептидов складывается из названий входящих в них аминокислот. Две аминокислоты дают дипептид, три - трипептид, четыре - тетрапептид и т. д. Каждый пептид или полипептидная цепь любой длины имеет N-концевую аминокислоту, содержащую свободную аминогруппу, и С-концевую аминокислоту, содержащую свободную карбоксильную группу. Называя полипептиды, перечисляют последовательно все аминокислоты, начиная с N-концевой, заменяя в их названиях, кроме С-концевой, суффикс -ин на -ил (так как аминокислоты в пептидах имеют уже не карбоксильную группу, а карбонильную). Например, название изображенного на рис. 1 трипептида - лейцил фенилаланил треонин .
Особенности первичной структуры белка . В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (-СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
По жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения - основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
Белки: общее понятие
С точки зрения молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
- карбоксильную -СООН;
- амино-группу -NH 2 .
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы - ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток - это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.

Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой - глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей - это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур - альбумин, фиброин, белок шелка и прочие.
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.

Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся "белок" - это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.

Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство - гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения - гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.

Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
- Каталитическая. Ее осуществляют ферменты, которые имеют белковую природу строения. О них скажем позже.
- Структурная. Виды белков и их функции в организме прежде всего влияют на структуру самой клетки, ее форму. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
- Регуляторная. Данная функция проявляется в участии полипептидов в таких процессах, как: транскрипция, трансляция, клеточный цикл, сплайсинг, считывание мРНК и прочих. Во всех них они играют важную роль регулировщика.
- Сигнальная. Данную функцию выполняют белки, находящиеся на мембране клеток. Они передают различные сигналы от одной единицы к другой, и это приводит к сообщению тканей между собой. Примеры: цитокины, инсулин, факторы роста и прочие.
- Транспортная. Некоторые виды белков и их функции, которые они выполняют, являются просто жизненно необходимыми. Так происходит, например, с белком гемоглобином. Он осуществляет транспорт кислорода от клетки к клетке в составе крови. Для человека он незаменим.
- Запасная или резервная. Такие полипептиды накапливаются в растениях и яйцеклетках животных как источник дополнительного питания и энергии. Пример - глобулины.
- Двигательная. Очень важная функция, особенно для простейших организмов и бактерий. Ведь они способны передвигаться только при помощи жгутиков или ресничек. А эти органоиды по своей природе не что иное, как белки. Примеры таких полипептидов следующие: миозин, актин, кинезин и прочие.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.

Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними "в бой", выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные - те, что содержат все необходимые для организма аминокислоты;
- неполноценные - те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.

Белки в клетке
Внутри самой маленькой структурной единицы всего живого - клетки - также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.

Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы - это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.