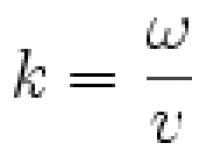Химическая связь - это взаимодействия электронов и атомного ядра одной частицы (атома, иона, молекулы и т. д.) с электронами и атомным ядром другой частицы, удерживающие эти частицы в стабильном или метастабильном химическом соединении. Современное описание химической связи проводится на основе квантовой механики. Основные характеристики химической связи - прочность, длина, полярность.
Типы связи
- Одноэлектронная химическая связь
- Металлическая связь
- Ковалентная связь
- Ионная связь
- Ван-дер-ваальсова связь
- Водородная связь
- Двухэлектронная трёхцентровая химическая связь
Простейшая одноэлектронная ковалентная химическая связь
Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном. Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы.
Примерами таких химических соединений являются молекулярные ионы: H 2+ , Li 2+ , Na 2+ , K 2+ , Rb 2+ , Cs 2+
Одинарная ковалентная связь

Одинарная ковалентная химическая связь создаётся связывающей электронной парой. Во всех существующих теориях (теория валентных связей, теория молекулярных орбиталей, теория отталкивания валентных электронных пар, боровская модель химической связи) связывающая электронная пара располагается в пространстве между атомами молекулы. Различают полярную и неполярную ковалентную связи.
Неполярная ковалентная связь имеет место в гомоядерных двухатомных молекулах, в которых связывающая электронна я пара равноудалена от обоих ядер молекулярной системы.
Расстояние d между атомными ядрами можно рассматривать как сумму ковалентных радиусов соответствующих атомов.
Расстояние между атомными ядрами в одинарной двухэлектронной ковалентной связи короче аналогичного расстояния в простейшей одноэлектронной химической связи.
Кратные ковалентные связи
Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л.Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей.


Гибридизация Полинга для двух S- и двух p- электронов позволила объяснить направленность химических связей, в частности тетраэдрическую конфигурацию метана. Для объяснения структуры этилена из четырёх равноценных Sp3- электронов атома углерода приходится вычленять один p-электрон для образования дополнительной связи, получившей название π-связи. При этом три оставшиеся Sp2-гибридные орбитали располагаются в плоскости под углом 120° и образуют основные связи, например, плоскую молекулу этилена.
В случае молекулы ацетилена в гибридизации принимают участие (по Полингу) всего лишь одна S- и одна p-орбитали, при этом образуются две Sp-орбитали, расположенные под углом в 180° и направленные в противоположные сороны. Две «чистые» p-орбитали атомов углерода попарно перекрываются во взаимоперпендикулярных плоскостях, образуя две π-связи линейной молекулы ацетилена.
Взгляды Л.Полинга нашли отражение в его книге «Природа химической связи, на долгие годы ставшей настольной книгой химика. В 1954 году Л.Полинг удостоен Нобелевской премии по химии с формулировкой «За исследование природы химической связи и его применение для опеделения структуры сложных соединений».
Однако физический смысл избирательной гибридизации атомных орбиталей оставался неясным, гибридизация представляла собой алгебраические преобразования, которым не могла быть приписана физическая реальность.
Лайнус Полинг предпринял попытку улучшения описания химической связи, исключив избирательность гибридизации орбиталей в молекулах непредельных соединений и создав теорию изогнутой химической связи. В своём докладе на симпозиуме по теоретической органической химии, посвящённой памяти Кекуле (Лондон, сентябрь 1958 года), Л.Полинг предложил новый путь описания двойной связи как комбинации двух одинаковых изогнутых химических связей, а тройной связи - трёх изогнутых химических связей. На этом
симпозиуме Л.Полинг со всей категоричностью утверждал:
Могут найтись химики, полагающие что чрезвычайно важным новшеством… явилось описание σ,π- описания для двойной или тройной связи и сопряжённых систем вместо описания с помощью изогнутых связей. Я же утверждаю, что σ,π- описание менее удовлетворительно, чем описание с помощью изогнутых связей, что это нововведение является только переходящим и вскоре отомрёт.
В новой теории Полинга все связывающие электроны становились равноценными и равноудалёнными от линии, соединяющей ядра молекулы. Теория изогнутой химической связи Полинга учитывала статистическую интерпретацию волновой функции М.Борна, кулоновскую электронную корреляцию электронов. Появился физический смысл - природа химической связи полностью определяется электрическим взаимодействием ядер и электронов. Чем больше связывающих электронов, тем меньше межъядерное расстояние и прочнее химическая связь между атомами углерода.
Трёхцентровая химическая связь
Дальнейшее развитие представлений о химической связи дал американской физикохимик У.Липскомб, разработавший теорию двухэлектронных трёхцентровых связей и топологическую теорию, позволяющую предсказывать строение ещё некоторых гидридов бора (бороводородов).
Электронная пара в трёхцентровой химической связи становится общей для трёх ядер атомов. В простейшем представителе трёхцентровой химической связи - молекулярном ионе водорода H3+ электронная пара удерживает в едином целом три протона.
В молекуле диборана функционируют четыре одинарные ковалентные связи B-H и две двухэлектронные трёхцентровые связи. Межъядерное расстояние в одинарной ковалентной связи B-H составляет 1,19 Å, в то время как аналогичное расстояние в трёхцентровой связи B-H-B составляет 1,31 Å. Угол трёхцентровой связи B-H-B (φ) равен 830. Комбинация двух трёхцентровых связей в молекуле диборана позволяет удерживать ядра атомов бора на расстоянии dB-B = 2 · 1,31 · sin φ/2 = 1,736 Å. Ядра связывающих атомов водорода удалены от плоскости, в которой расположены четыре одинарные ковалентные связи B-H, на расстоянии h = 1,31 · cos φ/2 = 0,981 Å.
Трёхцентровые связи могут реализоваться не только в треугольнике из двух атомов бора и одного атома водорода, но и между тремя атомами бора, например в каркасных бороводородах (пентаборан - B 5 H 9 , декаборан - B 10 H 4 и др.). В этих структурах есть обычные (концевые) и входящие в трёхцентровую связь (мостиковые) атома водорода и треугольники из атомов бора.
Существование боранов с их двухэлектронными трёхцентровыми связями с «мостиковыми» атомами водорода нарушало каноническое учение о валентности. Атом водорода, считавшийся ранее стандартным одновалентным элементом, оказался связанным одинаковыми связями с двумя атомами бора и стал формально двухвалентным элементом. Работы У.Липскомба по расшифровке строения боранов расширяли представления о химической связи. Нобелевский комитет удостоил Уильяма Нанна Липскомба премии по химии за 1976 год с формулировкой "За исследования структуры боранов (боргидритов), проясняющие проблемы химических связей).
Многоцентровая химическая связь
В 1951 году Т.Кили и П.Посон неожиданно при синтезе дициклопентадиенила получили совершенно новое железоорганическое соединение. Получение неизвестного ранее исключительно устойчивого жёлто-оранжевого кристаллического соединения железа сразу привлекло к себе внимание.

Э.Фишер и Д.Уилкинсон независимо друг от друга установили структуру нового соединения - два кольца циклопентадиенила расположены параллельно, слоями, или в виде «сэндвича» с атомом железа, расположенным между ними по центру (рис.8). Название «ферроцен» было предложено Р.Вудвордом (вернее, сотрудником его группы Д.Уайтингом). В нём отражено наличие в соединении атома железа и десяти углеродных атомов (zehn - десять).
Все десять связей (C-Fe) в молекуле ферроцена равноценны, величина межъядерного расстояния Fe-c - 2,04 Å. Все атомы углерода в молекуле ферроцена структурно и химически эквивалентны, длина каждой связи C-C 1,40 - 1,41 Å (для сравнения, в бензоле длина связи C-C 1,39 Å). Вокруг атома железа возникает 36- электронная оболочка.
В 1973 году Эрнст Отто Фишер и Джефри Уилкинсон были удостоены Нобелевской премии по химии с формулировкой «За новаторскую, проделанную независимо друг от друга работу, в области металлоорганических, так называемых сандвичевых соединений». Индвар Линдквист, член Шведской королевской академии наук, в своей речи при презентации лауреатов, заявил, что «открытие и доказательство новых принципов связей и структур, имеющихся в сандвичевых соединениях, являются значительным достижением, практическую значимость которых в настоящее время ещё невозможно предсказать».
В настоящее время получены дициклопентадиенильные производные многих металлов. Производные переходных металлов имеют ту же структуру и ту же природу связи, что и ферроцен. Лантаноиды образуют не сандвичеву структуру, а конструкцию, напоминающую трёхлучевую звезду[ Атомы La, Ce, Pr, Nd создают, следовательно, пятнадцати центровую химическую связь.
Вскоре вслед за ферроценом был получен дибензолхром. По той же схеме получены дибензолмолибден и дибензолванадий]. Во всех соединениях этого класса атомы металла удерживают в едином целом два шестичленных кольца. Все 12 связей металл-углерод в этих соединениях идентичны.

Синтезирован также ураноцен [бис(циклооктатетраен)уран], в котором атом урана удерживает два восьмичленных кольца. Все 16 связей уран-углерод в ураноцене идентичны. Ураноцен получают взаимодействием UCl 4 со смесью циклооктатетраена и калия в тетрагидрофуране при минус 300 C.
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Внутримолекулярные химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными .
Химическая связь
между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов , в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
– это способность атома притягивать (удерживать) внешние (валентные) электроны . Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А: В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная , ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – этохимическая связь, образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами ) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность ,
- насыщаемость ,
- полярность ,
- поляризуемость .
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108 о 28′.
Насыщаемость — это спосбность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется .
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H 2 . Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Люьиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры : H 2 (H-H), O 2 (O=O), S 8 .
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами ) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO 2 , NH 3 .
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор ), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей .
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH 4 + , в ионах органических аминов , например, в ионе метиламмония CH 3 -NH 2 + ;
– в комплексных соединениях , химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO 3 , NaNO 3 , в некоторых других соединениях азота;
– в молекуле озона O 3 .
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении . Кратность связи достаточно легко можно определить из значения атомов, образующих молекулу.
Например , в молекуле водорода H 2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O 2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N 2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи
– это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А 2 и В 2:
Длину химической связи можно примерно оценить по радиусам атомов , образующих связь, или по кратности связи , если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается , т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов .
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример . Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na ) 2 ) 8 ) 1 — 1e = +11Na +) 2 ) 8
Пример . Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl ) 2 ) 8 ) 7 + 1e = +17Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы , но и группы атомов . Например: ион аммония NH 4 + , сульфат-ион SO 4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na 2 + SO 4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи :
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов , образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов . Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями
Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения .
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом , а также кислорода с водородом , в меньшей степени азота с водородом .
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H 2 O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H 2 O-H 2 S-H 2 Se-H 2 Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Простая (одинарная) связь Типы связей в биоорганических соединениях.
| Наименование параметра | Значение |
| Тема статьи: | Простая (одинарная) связь Типы связей в биоорганических соединениях. |
| Рубрика (тематическая категория) | Химия |
Ковалентная связь. Кратная связь. Неполярная связь. Полярная связь.
Валентные электроны. Гибридная(гибридизованная) орбиталь. Длина связи
Ключевые слова.
Характеристика химических связей в биоорганических соединениях
АРОМАТИЧНОСТЬ
ЛЕКЦИЯ 1
СОПРЯЖЕННЫЕ СИСТЕМЫ: АЦИКЛИЧЕСКИЕ И ЦИКЛИЧЕСКИЕ.
1. Характеристика химических связей в биоорганических соединениях. Гибридизация орбиталей атома углерода.
2. Классификация сопряженных систем: ациклические и циклические.
3 Виды сопряжения: π , π и π , р
4. Критерии устойчивости сопряженных систем - ʼʼ энергия сопряженияʼʼ
5. Ациклические(нециклические) сопряженные системы, виды сопряжения. Основные представители (алкадиены, непредельные карбоновые кислоты, витамин А, каротин, ликопин).
6. Циклические сопряженные системы. Критерии ароматичности. Правило Хюккеля. Роль π-π- , π-ρ-сопряжения в образовании ароматических систем.
7.Карбоциклические ароматические соединения: (бензол, нафталин, антрацен, фенантрен, фенол, анилин, бензойная кислота)- строение, образование ароматической системы.
8. Гетероциклические ароматические соединения (пиридин, пиримидин, пиррол, пурин, имидазол, фуран, тиофен)- строение, особенности образования ароматической системы. Гибридизация электронных орбиталей атома азота при образовании пяти - и шестичленных гетероароматических соединений.
9. Медико- биологическое значение природных соединений, содержащих сопряженные системы связей, и ароматических.
Исходный уровень знаний для усвоения темы (школьный курс химии) :
Электронные конфигурации элементов(углерод, кислород, азот, водород, сера. галогены), понятие ʼʼорбитальʼʼ, гибридизация орбиталей и пространственная ориентация орбиталей элементов 2 периода., виды химических связей, особенности образования ковалентных σ-и π –связей, изменение электроотрицательности элементов в периоде и группе, классификацию и принципы номенклатуры органических соединений.
Органические молекулы образованы посредством ковалентных связей. Ковалентные связи возникают между двумя ядрами атомов за счёт общей (обобществленной) пары электронов. Такой способ относится к обменному механизму. Образуются неполярные и полярные связи.
Неполярные связи характеризуются симметричным распределением электронной плотности между двумя атомами, которые эта связь соединяет.
Полярные связи характеризуются несимметричным (неравномерным) распределением электронной плотности, происходит ее смещение в сторону более электроотрицательного атома.
Ряды электроотрицательности (составлены в сторону уменьшения)
А) элементы: F > O > N > C1 > Br > I ~~ S > C > H
Б) атом углерода: C (sp) > C (sp 2) > C (sp 3)
Ковалентные связи бывают двух типов: сигма (σ) и пи (π).
В органических молекулах сигма (σ) связи образованы электронами, расположенными на гибридных(гибридизованных) орбиталях, электронная плотность располагается между атомами на условной линии их связывания.
π -Связи (пи -связи) возникают при перекрывании двух негибридизованных р-орбиталей. Главные оси их располагаются параллельно друг другу и перпендикулярны линии σ -связи. Сочетание σ и π --связей носит название двойная(кратная) связь, состоит из двух пар электронов. Тройная связь состоит из трех пар электронов- одна σ - и две π -связи.(в биоорганических соединениях встречается крайне редко).
σ -Связи участвуют в образовании скелета молекулы, они являются главными, а π -связи можно рассматривать как дополнительные, но придающие молекулам особые химические свойства.
1.2. Гибридизация орбиталей атома углерода 6 С
Электронная конфигурация невозбужденного состояния атома углерода
выражается распределением электронов 1s 2 2s 2 2p 2 .
При этом в биоорганических соединениях, как впрочем, и в большинстве неорганических веществ, атом углерода имеет валентность равную четырем.
Происходит переход одного из 2s электронов на свободную 2р орбиталь. Возникают возбужденные состояния атома углерода, создающие возможность образования трех гибридных состояний, обозначаемых как С sp 3 , С sp 2 , С sp .
Гибридная орбиталь имеет характеристики, отличные от ʼʼчистыхʼʼ s, p, d- орбиталей и является ʼʼ смесьюʼʼ двух или более типов негибридизованных орбиталей .
Гибридные орбитали свойственны атомам только в молекулах.
Понятие гибридизации введено в 1931г Л.Полингом, лауреатом Нобелевской премии,.
Рассмотрим расположение в пространстве гибридных орбиталей.
С s p 3 --- -- -- ---
В возбужденном состоянии образуются 4 равноценные гибридные орбитали. Расположение связей соответствует направлению центральных углов правильного тетраэдра, величина угла между двумя любыми связями равна 109 0 28 , .
В алканах и их производных (спирты, галогеналканы, амины) все атомы углерода, кислорода, азота находятся в одинаковом гибридном sp 3 cостоянии. Атом углерода образует четыре, атом азота три, атом кислорода две ковалентные σ -связи. Вокруг этих связей возможно свободное вращение частей молекулы относительно друг друга.
В возбужденном состоянии sp 2 возникает три равноценные гибридные орбитали, расположенные на них электроны образуют три σ -связи, которые располагаются в одной плоскости, угол между связями 120 0 . Негибридизованные 2р - орбитали двух соседних атомов образуют π -связь. Она располагается перпендикулярно плоскости, в которой находятся σ -связи. Взаимодействие р-электронов носит в данном случае название ʼʼ бокового перекрыванияʼʼ. Кратная связь не допускает вокруг себя свободного вращения частей молекулы. Фиксированное положение частей молекулы сопровождается образованием двух геометрических плоскостных изомерных форм, которые носят название: цис(cis) – и транс(trans)- изомеры. (цис-лат - по одну сторону, транс- лат - через).
π -связь
Атомы, связанные двойной связью, находятся в состоянии гибридизации sp 2 и
присутствуют в алкенах, ароматических соединениях, образуют карбонильную группу
>С=О, азометиновую группу (имино группу) -СН= N-
С sp 2 - --- -- ---
Структурная формула органического соединения изображается с помощью структур Льюиса (каждая пара электронов между атомами заменяется черточкой)
С 2 Н 6 СН 3 - СН 3 H H
1.3. Поляризация ковалентных связей
Ковалентная полярная связь характеризуется неравномерным распределением электронной плотности. Для обозначения направления смещения электронной плотности используют два условных изображения.
Полярная σ – связь . Смещение электронной плотности обозначают стрелкой вдоль линии связи. Конец стрелки направлен в сторону более электроотрицательного атома. Появление частичных положительных и отрицательных зарядов указывают с помощью буквы ʼʼ бʼʼ ʼʼ дельтаʼʼ с нужным знаком заряда.
б + б- б+ б + б- б + б-
СН 3 - > О<- Н СН 3 - > С1 СН 3 - > NН 2
метанол хлорметан аминометан (метиламин)
Полярная π -связь . Смещение электронной плотности обозначают полукруглой (выгнутой) стрелкой над пи-связью также направленной в сторону более электроотрицательного атома. ()
б + б- б+ б-
Н 2 С = О СН 3 - С ===О
метаналь |
СН 3 пропанон -2
1.Определите тип гибридизации атомов углерода, кислорода, азота в соединениях А, Б, В. Назовите соединения, используя правила номенклатуры IUPAC .
А. СН 3 -СН 2 - СН 2 -ОН Б. СН 2 = СН – СН 2 - СН=О
В. СН 3 - N Н– С 2 Н 5
2. Сделайте обозначения, характеризующие направление поляризации всех указанных связей в соединениях (А – Г)
А. СН 3 – Вr Б. С 2 Н 5 – О- Н В. СН 3 -NН- С 2 Н 5
Г. С 2 Н 5 – СН= О
Простая (одинарная) связь Типы связей в биоорганических соединениях. - понятие и виды. Классификация и особенности категории "Простая (одинарная) связь Типы связей в биоорганических соединениях." 2017, 2018.
Рис.1. Орбитальные радиусы элементов (r a) и длина одноэлектронной химической связи (d)
Простейшая одноэлектронная химическая связь создаётся единственным валентным электроном . Оказывается, что один электрон способен удерживать в едином целом два положительно заряженных иона. В одноэлектронной связи кулоновские силы отталкивания положительно заряженных частиц компенсируются кулоновскими силами притяжения этих частиц к отрицательно заряженному электрону. Валентный электрон становится общим для двух ядер молекулы.
Примерами таких химических соединений являются молекулярные ионы: H 2 + , Li 2 + , Na 2 + , K 2 + , Rb 2 + , Cs 2 + :
Полярная ковалентная связь возникает в гетероядерных двухатомных молекулах (рис.3). Связывающая электронная пара в полярной химической связи приближена к атому с более высоким первым потенциалом ионизации .
Характеризующее пространственную структуру полярных молекул расстояние d между атомными ядрами можно приближённо рассматривать как сумму ковалентных радиусов соответствующих атомов.
Характеристика некоторых полярных веществСдвиг связывающей электронной пары к одному из ядер полярной молекулы приводит к появлению электрического диполя (электродинамика) (рис.4).
Расстояние между центрами тяжести положительного и отрицательного зарядов называют длиной диполя. Полярность молекулы, как и полярность связи, оценивают величиной дипольного момента μ, представляющего собой произведение длины диполя l на величину электронного заряда :
Кратные ковалентные связи
Кратные ковалентные связи представлены непредельными органическими соединениями, содержащими двойную и тройную химические связи. Для описания природы непредельных соединений Л.Полинг вводит понятия сигма- и π-связей, гибридизации атомных орбиталей .
Гибридизация Полинга для двух S- и двух p- электронов позволила объяснить направленность химических связей, в частности тетраэдрическую конфигурацию метана . Для объяснения структуры этилена из четырёх равноценных Sp 3 - электронов атома углерода приходится вычленять один p-электрон для образования дополнительной связи, получившей название π-связи. При этом три оставшиеся Sp 2 -гибридные орбитали располагаются в плоскости под углом 120° и образуют основные связи, например, плоскую молекулу этилена (рис.5).
В новой теории Полинга все связывающие электроны становились равноценными и равноудалёнными от линии, соединяющей ядра молекулы. Теория изогнутой химической связи Полинга учитывала статистическую интерпретацию волновой функции М.Борна , кулоновскую электронную корреляцию электронов . Появился физический смысл - природа химической связи полностью определяется электрическим взаимодействием ядер и электронов. Чем больше связывающих электронов, тем меньше межъядерное расстояние и прочнее химическая связь между атомами углерода.
Трёхцентровая химическая связь
Дальнейшее развитие представлений о химической связи дал американской физикохимик У.Липскомб , разработавший теорию двухэлектронных трёхцентровых связей и топологическую теорию, позволяющую предсказывать строение ещё некоторых гидридов бора (бороводородов) .
Электронная пара в трёхцентровой химической связи становится общей для трёх ядер атомов. В простейшем представителе трёхцентровой химической связи - молекулярном ионе водорода H 3 + электронная пара удерживает в едином целом три протона (рис.6).

Рис.7.Диборан
Существование боранов с их двухэлектронными трёхцентровыми связями с «мостиковыми» атомами водорода нарушало каноническое учение о валентности . Атом водорода, считавшийся ранее стандартным одновалентным элементом, оказался связанным одинаковыми связями с двумя атомами бора и стал формально двухвалентным элементом. Работы У.Липскомба по расшифровке строения боранов расширяли представления о химической связи. Нобелевский комитет удостоил Уильяма Нанна Липскомба премии по химии за 1976 год с формулировкой "За исследования структуры боранов (боргидритов), проясняющие проблемы химических связей).
Многоцентровая химическая связь
Рис.8.Молекула ферроцена
Рис.9.Дибензолхром
Рис.10.Ураноцен
Все десять связей (C-Fe) в молекуле ферроцена равноценны, величина межъядерного расстояния Fe-c - 2,04 Å. Все атомы углерода в молекуле ферроцена структурно и химически эквивалентны, длина каждой связи C-C 1,40 - 1,41 Å (для сравнения, в бензоле длина связи C-C 1,39 Å). Вокруг атома железа возникает 36- электронная оболочка .
Динамика химической связи
Химическая связь достаточно динамична. Так, металлическая связь трансформируется в ковалентную в процессе фазового перехода при испарении металла. Переход металла из твёрдого в парообразное состояние требует затраты больших количеств энергии.
В парах указанные металлы состоят практически из гомоядерных двухатомных молекул и свободных атомов. При конденсации паров металла ковалентная связь превращается в металлическую.
Испарение солей с типичной ионной связью, например фторидов щелочных металлов, приводит к разрушению ионной связи и образованию гетероядерных двухатомных молекул с полярной ковалентной связью. При этом имеет место образование димерных молекул с мостиковыми связями.
Характеристика химической связи в молекулах фторидов щелочных металлов и их димерах.
При конденсации паров фторидов щелочных металлов полярная ковалентная связь трансформируется в ионную с образованием соответствующей кристаллической решётки соли.
Механизм перехода ковалентной в металлическую связь
Рис.11. Соотношение между радиусом орбитали электронной пары r e и длиной ковалентной химической связи d
Рис.12.Ориентация диполей двухатомных молекул и образование искажённого октаэдрического фрагмента кластера при конденсации паров щелочных металлов
Рис.13.Объёмноцентрированное кубическое расположение ядер в кристаллах щелочных металлов и связывающего звена
Дисперсное притяжение (силы Лондона) обуславливает межатомное взаимодействие и образование гомоядерных двухатомных молекул из атомов щелочных металлов.
Образование ковалентной связи металл-металл сопряжено с деформацией электронных оболочек взаимодействующих атомов - валентные электроны создают связывающую электронную пару, электронная плотность которой концентрируется в пространстве между атомными ядрами возникшей молекулы. Характерной особенностью гомоядерных двухатомных молекул щелочных металлов является большая длина ковалентной связи (в 3,6-5,8 раза больше длины связи в молекуле водорода) и низкая энергия её разрыва.
Указанное соотношение между r e и d определяет неравномерность распределения электрических зарядов в молекуле - в средней части молекулы сосредоточен отрицательный электрический заряд связывающей электронной пары, а на концах молекулы - положительные электрические заряды двух атомных остовов.
Неравномерность распределения электрических зарядов создаёт условия взаимодействия молекул за счёт ориентационных сил (силы Ван-дер-Ваальса). Молекулы щелочных металлов стремятся ориентироваться таким образом, чтобы по сосоедству оказывались разноимённые электрические заряды. В результате между молекулами действуют силы притяжения. Благодаря наличию последних, молекулы щелочных металлов сближаются и более менее прочно стягиваются между собой. Одновременно происходит некоторая деформация каждой из них под действием ближе расположенных полюсов соседних молекул (рис.12).
Фактически, связывающие электроны исходной двухатомной молекулы, попадая в электрическое поле четырёх положительно заряженных атомных остовов молекул щелочных металлов отрываются с орбитального радиуса атома и становятся свободными.
При этом связывающая электронная пара становится общей уже для системы с шестью катионами. Начинается построение кристаллической решётки металла на этапе кластера . В кристаллической решётке щелочных металлов чётко выражена структура связывающего звена, имеющего форму искажённого сплющенного октаэдра - квадратной бипирамиды, высота которой и рёбра базиса равны величина постоянной трансляционной решётки a w (рис.13).
Величина постоянной трансляционной решётки a w кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми », которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла - проводить электрический ток .
При сопоставлении процесса конденсации паров щелочных металлов с процессом конденсации газов, например, водорода, проявляется характерная особенность в свойствах металла. Так, если при конденсации водорода проявляются слабые межмолекулярные взаимодействия, то при конденсации паров металла протекают процессы, характерные для химических реакций. Сама конденсация паров металла идёт в несколько стадий и может быть описана следующей процессией: свободный атом → двухатомная молекула с ковалентной связью → металлический кластер → компактный металл с металлической связью.
Взаимодействие молекул галогенидов щелочных металлов сопровождается их димеризацией. Димерную молекулу можно рассматривать как электрический квадруполь (рис.15). В настоящее время известны основные характеристики димеров галогенидов щелочных металлов (длины химической связи и валентные углы между связями).
Длина химической связи и валентные углы в димерах галогенидов щелочных металлов (Э 2 X 2)(газовая фаза).
| Э 2 X 2 | X=F | X=Cl | X=Br | X=I | ||||
|---|---|---|---|---|---|---|---|---|
| d ЭF , Å | d ЭCl , Å | d ЭBr , Å | d ЭI , Å | |||||
| Li 2 X 2 | 1,75 | 105 | 2,23 | 108 | 2,35 | 110 | 2,54 | 116 |
| Na 2 X 2 | 2,08 | 95 | 2,54 | 105 | 2,69 | 108 | 2,91 | 111 |
| K 2 X 2 | 2,35 | 88 | 2,86 | 98 | 3,02 | 101 | 3,26 | 104 |
| Cs 2 X 2 | 2,56 | 79 | 3,11 | 91 | 3,29 | 94 | 3,54 | 94 |
В процессе конденсации действие ориентационных сил усиливается, межмолекулярное взаимодействие сопровождается образованием кластеров, а затем и твёрдого вещества. Галогениды щелочных металлов образуют кристаллы с простой кубической и объёмно-центрированной кубической решёткой.
Тип кристаллической решётки и постоянная трансляционной решётки для галогенидов щелочных металлов.
В процессе кристаллизации происходит дальнейшее увеличение межатомного расстояния, приводящее к срыву электрона с орбитального радиуса атома щелочного металла и передаче электрона атому галогена с образованием соответствующих ионов. Силовые поля ионов равномерно распределяются во всех направлениях в пространстве. В связи с этим в кристаллах щелочных металлов силовое поле каждого иона координирует отнюдь не один ион с противоположным знаком, как принято качественно представлять ионную связь (Na + Cl -).
В кристаллах ионных соединений понятие простых двухионных молекул типа Na + Cl - и Cs + Cl - теряет смысл, поскольку ион щелочного металла связан с шестью ионами хлора (в кристалле хлористого натрия) и с восемью ионами хлора (в кристалле хлористого цезия. При этом все межионные расстояния в кристаллах равноудалены.
Примечания
- Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 124. - 320 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 132-136. - 320 с.
- Ганкин В.Ю., Ганкин Ю.В. Как образуется химическая связь и протекают химические реакции. - М .: издат.группа "Граница", 2007. - 320 с. - ISBN 978-5-94691296-9
- Некрасов Б. В. Курс общей химии. - М .: Госхимиздат, 1962. - С. 88. - 976 с.
- Паулинг Л. Природа химической связи / под редакцией Я.К.Сыркина. - пер. с англ. М.Е.Дяткиной. - М.-Л.: Госхимиздат, 1947. - 440 с.
- Теоретическая органическая химия / под ред. Р.Х.Фрейдлиной. - пер. с англ. Ю.Г.Бунделя. - М .: Изд. иностранной литературы, 1963. - 365 с.
- Леменовский Д.А., Левицкий М.М. Российский химический журнал (журнал Российского химического общества им. Д.И.Менделеева). - 2000. - Т. XLIV, вып.6. - С. 63-86.
- Химический энциклопедический словарь / гл. ред. И.Л.Кнунянц. - М .: Сов. энциклопедия, 1983. - С. 607. - 792 с.
- Некрасов Б. В. Курс общей химии. - М .: Госхимиздат, 1962. - С. 679. - 976 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. - М .: «Химия», 1987. - С. 155-161. - 320 с.
- Гиллеспи Р. Геометрия молекул / пер. с англ. Е.З. Засорина и В.С. Мастрюкова, под ред. Ю.А Пентина. - М .: «Мир», 1975. - С. 49. - 278 с.
- Справочник химика. - 2-е изд., перераб. и доп. - Л.-М.: ГНТИ Химической литературы, 1962. - Т. 1. - С. 402-513. - 1072 с.
- Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ.. - М .: «Химия», 1987. - С. 132-136. - 320 с.
- Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми). Успехи физических наук.. - 1962. - Т. 78, вып.2. - 291 с.
См. также
- Химическая связь - статья из Большой советской энциклопедии
- Химическая связь - Chemport.ru
- Химическая связь - Физическая Энциклопедия
Атомы большинства элементов не существуют отдельно, так как могут взаимодействовать между собой. При этом взаимодействии образуются более сложные частицы.
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
Характеристика ионной связи
 Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Химическое взаимодействие, которое образуется из-за притяжения ионов
, имеющих разные заряды, называется ионным. Такое происходит, если связываемые атомы имеют существенную разницу в электроотрицательности (то есть способности притягивать электроны) и электронная пара переходит к более электроотрицательному элементу. Результатом такого перехода электронов от одного атома к другому является образование заряженных частиц - ионов. Между ними и возникает притяжение.
Наименьшими показателями электроотрицательности обладают типичные металлы , а наибольшими - типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет .
Примеры образования
 Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Образование связи в хлориде натрия (nacl) обусловлено передачей электрона от атома Na к атому Cl с образованием соответствующих ионов:
Na 0 - 1 е = Na + (катион)
Cl 0 + 1 е = Cl — (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Ba 0 - 2 е = Ba 2+
S 0 + 2 е = S 2-
Ва отдаёт свои два электрона сере в результате чего образуются анионы серы S 2- и катионы бария Ba 2+ .
Металлическая химическая связь
 Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Число электронов внешних энергетических уровней металлов невелико, они легко отрываются от ядра. В результате такого отрыва образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются по объёму металла и постоянно связываются и отрываются от атомов.
Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Mg - 2е <-> Mg 2+
Cs - e <-> Cs +
Ca - 2e <-> Ca 2+
Fe - 3e <-> Fe 3+
Ковалентная: полярная и неполярная
 Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Наиболее распространённым видом химического взаимодействия является ковалентная связь. Значения электроотрицательности элементов, вступающих во взаимодействие, отличаются не резко, в связи с этим происходит только смещение общей электронной пары к более электроотрицательному атому.
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого — свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
- простые или одинарные;
- двойные;
- тройные.
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные — трёх.
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
- неполярную;
- полярную.
Неполярную связь образуют одинаковые атомы, а полярную - разные по электроотрицательности.
 Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие близких по электроотрицательности атомов называют неполярной связью. Общая пара электронов в такой молекуле не притянута ни к одному из атомов, а принадлежит в равной мере обоим.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном — отрицательный заряд, а на менее — положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:
- Длина определяется расстоянием между ядрами взаимодействующих атомов.
- Полярность определяется смещением электронного облака к одному из атомов.
- Направленность - свойство образовывать ориентированные в пространстве связи и, соответственно, молекулы, имеющие определённые геометрические формы.
- Насыщаемость определяется способностью образовывать ограниченное число связей.
- Поляризуемость определяется способностью изменять полярность под действием внешнего электрического поля.
- Энергия необходимая для разрушения связи, определяющая её прочность.
 Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
Примером ковалентного неполярного взаимодействия могут быть молекулы водорода (H2) , хлора (Cl2), кислорода (O2), азота (N2) и многие другие.
H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (H2S), соляной кислоты (HCL), воды (H2O), метана (CH4) , оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами — ионную, простые вещества неметаллы — ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.