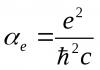2.2. История создания Периодической системы.
Зимой 1867-68 года Менделеев начал писать учебник "Основы химии" и сразу столкнулся с трудностями систематизации фактического материала. К середине февраля 1869 года, обдумывая структуру учебника, он постепенно пришел к выводу, что свойства простых веществ (а это есть форма существования химических элементов в свободном состоянии) и атомные массы элементов связывает некая закономерность.
Менделеев многого не знал о попытках его предшественников расположить химические элементы по возрастанию их атомных масс и о возникающих при этом казусах. Например, он не имел почти никакой информации о работах Шанкуртуа, Ньюлендса и Мейера.
Решающий этап его раздумий наступил 1 марта 1869 года (14 февраля по старому стилю). Днем раньше Менделеев написал прошение об отпуске на десять дней для обследования артельных сыроварен в Тверской губернии: он получил письмо с рекомендациями по изучению производства сыра от А. И. Ходнева - одного из руководителей Вольного экономического общества.
В Петербурге в этот день было пасмурно и морозно. Под ветром поскрипывали деревья в университетском саду, куда выходили окна квартиры Менделеева. Еще в постели Дмитрий Иванович выпил кружку теплого молока, затем встал, умылся и пошел завтракать. Настроение у него было чудесное.
За завтраком Менделееву пришла неожиданная мысль: сопоставить близкие атомные массы различных химических элементов и их химические свойства. Недолго думая, на обратной стороне письма Ходнева он записал символы хлора Cl и калия K с довольно близкими атомными массами, равными соответственно 35,5 и 39 (разница всего в 3,5 единицы). На том же письме Менделеев набросал символы других элементов, отыскивая среди них подобные "парадоксальные" пары: фтор F и натрий Na, бром Br и рубидий Rb, иод I и цезий Cs, для которых различие масс возрастает с 4,0 до 5,0, а потом и до 6,0. Менделеев тогда не мог знать, что "неопределенная зона" между явными неметаллами и металлами содержит элементы - благородные газы, открытие которых в дальнейшем существенно видоизменит Периодическую систему.
После завтрака Менделеев закрылся в своем кабинете. Он достал из конторки пачку визитных карточек и стал на их обратной стороне писать символы элементов и их главные химические свойства. Через некоторое время домочадцы услышали, как из кабинета стало доноситься: "У-у-у! Рогатая. Ух, какая рогатая! Я те одолею. Убью-у!". Эти возгласы означали, что у Дмитрия Ивановича наступило творческое вдохновение. Менделеев перекладывал карточки из одного горизонтального ряда в другой, руководствуясь значениями атомной массы и свойствами простых веществ, образованных атомами одного и того же элемента. В который раз на помощь ему пришло доскональное знание неорганической химии. Постепенно начал вырисовываться облик будущей Периодической системы химических элементов. Так, вначале он положил карточку с элементом бериллием Be (атомная масса 14) рядом с карточкой элемента алюминия Al (атомная масса 27,4), по тогдашней традиции приняв бериллий за аналог алюминия. Однако затем, сопоставив химические свойства, он поместил бериллий над магнием Mg. Усомнившись в общепринятом тогда значении атомной массы бериллия, он изменил ее на 9,4, а формулу оксида бериллия переделал из Be 2 O 3 в BeO (как у оксида магния MgO). Кстати, "исправленное" значение атомной массы бериллия подтвердилось только через десять лет. Так же смело действовал он и в других случаях.
Постепенно Дмитрий Иванович пришел к окончательному выводу, что элементы, расположенные по возрастанию их атомных масс, выказывают явную периодичность физических и химических свойств. В течение всего дня Менделеев работал над системой элементов, отрываясь ненадолго, чтобы поиграть с дочерью Ольгой, пообедать и поужинать.
Вечером 1 марта 1869 года он набело переписал составленную им таблицу и под названием "Опыт системы элементов, основанной на их атомном весе и химическом сходстве" послал ее в типографию, сделав пометки для наборщиков и поставив дату "17 февраля 1869 года" (это по старому стилю).
Так был открыт Периодический закон, современная формулировка которого такова: Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
Отпечатанные листки с таблицей элементов Менделеев разослал многим отечественным и зарубежным химикам и только после этого выехал из Петербурга для обследования сыроварен.
До отъезда он еще успел передать Н. А. Меншуткину, химику-органику и будущему историку химии, рукопись статьи "Соотношение свойств с атомным весом элементов" - для публикации в Журнале Русского химического общества и для сообщения на предстоящем заседании общества.
18 марта 1869 года Меншуткин, который был в то время делопроизводителем общества, сделал от имени Менделеева небольшой доклад о Периодическом законе. Доклад сначала не привлек особого внимания химиков, и Президент русского химического общества, академик Николай Зинин (1812-1880) заявил, что Менделеев делает не то, чем следует заниматься настоящему исследователю. Правда, через два года, прочтя статью Дмитрия Ивановича "Естественная система элементов и применение ее к указанию свойств некоторых элементов", Зинин изменил свое мнение и написал Менделееву: "Очень, очень хорошо, премного отличных сближений, даже весело читать, дай Бог Вам удачи в опытном подтверждении Ваших выводов. Искренне Вам преданный и глубоко Вас уважающий Н. Зинин". Не все элементы Менделеев разместил в порядке возрастания атомных масс; в некоторых случаях он больше руководствовался сходством химических свойств. Так, у кобальта Co атомная масса больше, чем у никеля Ni, у теллура Te она также больше, чем у иода I, но Менделеев разместил их в порядке Co - Ni, Te - I, а не наоборот. Иначе теллур попадал бы в группу галогенов, а иод становился родственником селена Se.
Своей жене и детям. А может быть, он и знал, что умирает, но не хотел тревожить и волновать заранее семью, которую любил горячо и нежно». В 5 ч. 20 мин. 20 января 1907 г. Дмитрий Иванович Менделеев скончался. Похоронен он на Волковском кладбище в Петербурге, недалеко от могил своей матери и сына Владимира. В 1911 г. инициативе передовых русских ученых был организован Музей Д.И. Менделеева, куда...
Станция московского метрополитена, научно-исследовательское судно для океанографических исследований, 101-й химический элемент и минерал - менделеевит. Русскоязычные учёные-шутники иногда спрашивают: "А не еврей ли Дмитрий Иванович Менделеев, уж больно странная фамилия, не от фамилии ли "Мендель" она произошла?" Ответ на этот вопрос чрезвычайно прост: "Все четыре сына Павла Максимовича Соколова, ...
Лицейском экзамене, на котором старик Державин благословил юного Пушкина. Роль метра довелось сыграть академику Ю.Ф.Фрицше известному специалисту в органической химии. Кандидатская диссертация Д.И.Менделеев окончил Главный Педагогический институт в 1855 г. Кандидатская диссертация "Изоморфизм в связи с другими отношениями кристаллической формы к составу" стала его первой крупной научной...
Преимущественно по вопросу о капиллярности и поверхностном натяжении жидкостей, а часы досуга проводил в кругу молодых русских ученых: С.П. Боткина, И.М. Сеченова, И.А. Вышнеградского, А.П. Бородина и др. В 1861 г. Менделеев возвращается в Санкт-Петербург, где возобновляет чтение лекций по органической химии в университете и издает замечательный по тому времени учебник: "Органическая химия", в...
Всё материальное, что нас окружает в природе, будь то космические объекты, обычные земные предметы или живые организмы, состоит из веществ. Разновидностей их существует много. Ещё в древности люди заметили, что они способны не только изменять своё физическое состояние, но и превращаться в другие вещества, наделённые иными свойствами по сравнению с первоначальными. Но вот законы, согласно которым происходят подобные преобразования материи, человек понял не сразу. Для того чтобы сделать это, необходимо было правильно выявить основу вещества и классифицировать существующие в природе элементы. Подобное стало возможным лишь только в середине XIX века с открытием периодического закона. Истории его создания Д.И. Менделеевым предшествовали долгие годы работы, а формированию данного рода знаний способствовал многовековой опыт всего человечества.
Когда были заложены основы химии?
Умельцы античных времён достаточно преуспели в литье и плавке различных металлов, зная множество секретов их трансмутации. Они передали свои знания и опыт потомкам, которые использовали их вплоть до времён Средневековья. Считалось, что неблагородные металлы вполне возможно превратить в ценные, что, собственно, и было основной задачей химиков вплоть до 16-го столетия. В сущности, в подобной идее были заложены ещё философско-мистические представления древнегреческих учёных о том, что вся материя строится из неких «первоэлементов», способных перевоплощаться один в другой. Несмотря на видимую примитивность такого подхода, он сыграл свою роль в истории открытия Периодического закона.

Панацея и белая тинктура
Занимаясь поиском первоосновы, алхимики свято верили в существование двух фантастических веществ. Одним из них был прославленный в легендах философский камень, именуемый также жизненным эликсиром или панацеей. Считалось, что подобное средство не только было безотказным способом превращения в золото ртути, свинца, серебра и прочих веществ, но также служило чудодейственным универсальным лекарством, исцеляющим любые человеческие недуги. Другой элемент, носивший название белой тинктуры, не относился к разряду столь эффективных, но наделялся способностью превращать в серебро остальные вещества.
Рассказывая предысторию открытия периодического закона, невозможно не упомянуть о знаниях, накопленных алхимиками. Они олицетворяли собой образец символического мышления. Представители этой полумистической науки создали некую химическую модель мира и процессов, происходящих в нём на космическом уровне. Стремясь понять суть всех вещей, они подробнейшим образом записывали лабораторные приёмы, оборудование и сведения о химической посуде, с большой скрупулёзностью и старательностью относясь к передаче своего опыта коллегам и потомкам.

Потребность в классификации
Значительных по объёму сведений о самых разных химических элементах к XIX веку накоплено было достаточно, что породило естественную необходимость и желание учёных их систематизировать. Но для проведения подобной классификации требовались дополнительные экспериментальные данные, а также не мистические, а реальные знания о строении веществ и сути основы устройства материи, которых пока не было. К тому же имеющиеся сведения о значении атомных масс известных в те времена химических элементов, на основе которых производилась систематизация, не отличались особой точностью.
Но попытки классификации в среде естествоиспытателей неоднократно предпринимались ещё задолго до осознания истинной сути вещей, составляющей ныне основу современной науки. А в указанном направлении работали многие учёные. Рассказывая кратко о предпосылках открытия периодического закона Менделеева, следует упомянуть о примерах подобных объединений элементов.
Триады
Учёные тех времён чувствовали, что свойства, проявляемые самыми разнообразными веществами, находятся в несомненной зависимости от величин их атомных масс. Понимая это, химик из Германии Иоганн Дёберейнер предложил свою систему классификации элементов, составляющих основу материи. Случилось это в 1829 году. И событие это было достаточно серьёзным продвижением в науке для того периода её развития, а также важным этапом в истории открытия периодического закона. Дёберейнер объединил известные элементы в сообщества, дав им наименование «триады». По существующей системе при этом масса крайних элементов оказывалась равна среднему от суммы атомных масс того члена группы, который находился между ними.

Попытки расширить границы триад
Недостатков в упомянутой системе Дёберейнера было достаточно. К примеру, в цепочке бария, стронция, кальция отсутствовал сходный с ними по строению и свойствам магний. А в сообществе теллура, селена, серы не хватало кислорода. Многие другие похожие вещества также не удалось классифицировать согласно системе триад.
Указанные идеи пытались развивать многие другие химики. В частности немецкий учёный Леопольд Гмелин стремился раздвинуть "тесные" рамки, расширив группы классифицируемых элементов, распределив их в порядке эквивалентных весов и электроотрицательности элементов. Его структуры образовывали не только триады, но и тетрады, пентады, но немецкому химику так и не удалось уловить суть периодического закона.
Спираль де Шанкуртуа
Ещё более сложную схему построения элементов придумал Александр де Шанкуртуа. Он расположил их на плоскости, свёрнутой в цилиндр, распределив по вертикалям с наклоном в 45° в порядке возрастаниях атомных масс. Как предполагалось, по линиям, параллельным оси данной объёмной геометрической фигуры, должны были располагаться вещества со сходными свойствами.

Но на деле идеальной классификации не получилось, так как на одну вертикаль иногда попадали отнюдь не родственные элементы. К примеру, рядом с щелочными металлами оказался совсем другого химического поведения марганец. И в одну "компанию" попали сера, кислород и совсем с ними не сходный элемент титан. Однако подобная схема тоже внесла свою лепту, заняв своё место в истории открытия периодического закона.
Другие попытки создания классификаций
Следом за описанными свою систему классификации предложил Джон Ньюлендс, заметив, что сходство в свойствах элементов, расставленных в соответствии с увеличением атомной массы, проявляет каждый восьмой член из получившегося ряда. Найденную закономерность учёному пришло в голову сравнить со структурой расположения музыкальных октав. При этом он присваивал каждому из элементов свой порядковый номер, располагая их горизонтальными рядами. Но подобная схема опять не получилась идеальной и была оценена весьма скептически в научных кругах.

С 1964 до 1970 гг. таблицы, упорядочивающие химические элементы, создавали также Одлинг и Мейер. Но подобные попытки снова имели свои недостатки. Всё это происходило уже накануне открытия Менделеевым периодического закона. А некоторые труды с несовершенными попытками классификации публиковались даже после того, как таблица, который мы пользуемся и по сей день, была представлена миру.
Биография Менделеева
Родился гениальный русский учёный в городе Тобольске в 1834 году в семье директора гимназии. В доме, кроме него, было ещё шестнадцать братьев и сестёр. Не обделённый вниманием, как самый младший из детей, Дмитрий Иванович с самого незначительного возраста поражал всех необыкновенными способностями. Родители, несмотря на трудности, стремились дать ему самое лучшее образование. Так, Менделеев окончил сначала гимназию в Тобольске, а затем Педагогический институт в столице, сохранив при этом в душе глубокий интерес к наукам. И не только к химии, но и к физике, метеорологии, геологии, технологии, приборостроению, воздухоплаванию и другим.
Вскоре Менделеев защитил диссертацию и стал доцентом Петербургского университета, где читал лекции по органической химии. В 1865 году он представил коллегам свою докторскую на тему «О соединении спирта с водой». Годом открытия периодического закона стал 1969 г. Но этому достижению предшествовало 14 лет напряжённой работы.

О великом открытии
Учитывая ошибки, неточности, а также позитивный опыт коллег, Дмитрий Иванович сумел систематизировать химические элементы самым удобным способом. Он также заметил периодическую зависимость свойств соединений и простых веществ, их формы от значения атомных масс, о чём и говорится в формулировке периодического закона, данного Менделеевым.
Но подобные прогрессивные идеи, к сожалению, далеко не сразу нашли отклик в сердцах даже русских учёных, которые приняли эту инновацию весьма настороженно. А в среде деятелей зарубежной науки, особенно в Англии и Германии, закон Менделеева и вовсе нашёл самых ярых противников. Но очень скоро положение изменилось. Что же послужило причиной? Гениальная смелость великого русского учёного спустя некоторое время явилась миру в доказательствах его блестящей способности научного предвидения.

Новые элементы в химии
Открытие периодического закона и структура периодической таблицы, созданной им, позволили не только осуществить систематизацию веществ, но и сделать ряд предсказаний о наличии в природе многих неизвестных в те времена элементов. Именно поэтому Менделееву удалось претворить на практике то, что до него не удавалось другим учёным.
Прошло всего пять лет, и догадки начали подтверждаться. Француз Лекок де Буабодран открыл новый металл, который назвал галлий. Его свойства оказались очень сходными с предсказанным Менделеевым в теории экаалюминием. Узнав об этом, представители учёного мира тех времён были ошеломлены. Но на этом удивительные факты совсем не закончились. Далее шведом Нильсоном был обнаружен скандий, гипотетическим аналогом которого оказался экабор. А близнецом экасилиция стал открытый Винклером германий. С тех самых пор закон Менделеева начал утверждаться и приобретать всё новых сторонников.
Новые факты гениального предвидения
Создатель настолько увлёкся красотой своей идеи, что взял на себя смелость сделать некоторые допущения, правомерность которых позднее самым блестящим образом подтвердилась практическими научными открытиями. К примеру, некоторые вещества Менделеев расположил в своей таблице вовсе не в соответствии с возрастанием атомных масс. Он предвидел, что периодичность в более глубоком смысле наблюдается всё-таки не только в связи с возрастанием атомного веса элементов, а ещё и по другой причине. Великий учёный догадался, что масса элемента зависит от количества в его строении каких-то более элементарных частиц.
Таким образом, периодического закона некоторым образом натолкнуло представителей науки на мысль о составляющих атома. А учёные вскоре наступившего 20-го столетия - века грандиозных открытий - многократно убедились, что свойства элементов зависят от величины зарядов атомных ядер и строения его электронной оболочки.

Периодический закон и современность
Таблица Менделеева, оставаясь неизменной в своей основе, впоследствии многократно дополнялась и переделывалась. В ней образовалась так называемая нулевая группа элементов, включающая в себя инертные газы. Успешно решена была также проблема размещения редкоземельных элементов. Но несмотря на дополнения, значение открытия периодического закона Менделеева в первоначальном варианте переоценить достаточно трудно.
Позднее, с и явления радиоактивности, были до конца поняты причины успеха подобной систематизации, а также периодичности свойств элементов различных веществ. Вскоре в указанной таблице нашли своё место также изотопы радиоактивных элементов. Основой классификации многочисленных членов ячеек стал атомный номер. А в середине XX века окончательно была обоснована последовательность расположения элементов в таблице, зависящая от заполнения орбиталей атомов передвигающимися с огромной скоростью вокруг ядра электронами.
В своей работе 1668 года Роберт Бойль привёл список неразложимых химических элементов. Было их на тот момент всего пятнадцать. При этом учёный не утверждал, что кроме перечисленных им элементов больше не существует и вопрос об их количестве оставался открытым.
Через сто лет французский химик Антуан Лавуазье составил новый список из известных науке элементов. В его реестр попали 35 химических веществ, из которых 23 были впоследствии признаны теми самыми неразложимыми элементами.
Работа по поиску новых элементов велась химиками во всём мире и продвигалась вполне успешно. Решающую роль в этом вопросе сыграл русский учёный-химик Дмитрий Иванович Менделеев: именно ему пришла в голову идея о возможности существования взаимосвязи между атомной массой элементов и их местом в "иерархии". По его собственным словам "надо искать... соответствия между индивидуальными свойствами элементов и их атомными весами".
Сопоставляя между собой известные в то время химические элементы, Менделеев после колоссальной работы обнаружил в итоге ту зависимость, общую закономерную связь между отдельными элементами, в которой они предстают как единое целое, где свойства каждого элемента является не чем-то само собой существующим, а периодически и правильно повторяющимся явлением.
Так в феврале 1869 года был сформулирован периодический закон Менделеева . В том же году 6 марта доклад, подготовленный Д.И. Менделеевым, под названием "Соотношение свойств с атомным весом элементов" был представлен Н.А. Меншуткиным на заседании Русского химического общества.
В том же году публикация появилось в немецком журнале "Zeitschrift für Chemie", а в 1871 году в журнале "Annalen der Chemie" вышла развёрнутая публикация Д.И. Менделеева, посвящённая его открытию - "Die periodische Gesetzmässigkeit der Elemente" (Периодическая закономерность химических элементов).
Создание периодической таблицы
Несмотря на то, что идея сформировалась у Менделеева за довольно короткий срок, оформить свои умозаключения он долго не мог. Ему было важно представить свою идею в виде ясного обобщения, строгой и наглядной системы. Как сказал однажды сам Д.И. Менделеев в беседе с профессором А.А. Иностранцевым: "Все в голове сложилось, а выразить таблицей не могу".
По данным биографов, после этого разговора учёный работал над созданием таблицы три дня и три ночи, не ложась спать. Он перебирал различные варианты, в которых могли бы быть скомбинированы элементы для организации в таблицу. Осложнялась работа и тем, что на момент создания периодической системы далеко не все химические элементы были известны науке.
В 1869-1871 годах Менделеев продолжал развивать выдвинутые и принятые научным сообществом идеи периодичности. Одним из шагов было введение понятия о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов.
Именно на основе этого, а также с опорой на результаты, полученные в ходе изучения последовательности изменения стеклообразующих оксидов, Менделеев исправил значения атомных масс 9 элементов, в числе которых были бериллий, индий, уран и другие.
В ходе работы Д.И. Менделеев стремился заполнить пустые клетки составленной им таблицы. В результате в 1870 году им было предсказано открытие неизвестных на тот момент науке элементов. Менделеев вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов:
- "экаалюминия" - открыт в 1875 году, назван галлием,
- "экабора" - открыт в 1879 году, назван скандием,
- "экасилиция" - открыт в 1885 году, назван германием.
Следующие его реализовавшиеся прогнозы - открытие ещё восьми элементов, в том числе полония (открыт в 1898 году), астата (открыт в 1942-1943 годах), технеция (открыт в 1937 году), рения (открыт в 1925 году) и франция (открыт в 1939 году).
В 1900 году Дмитрий Иванович Менделеев и Уильям Рамзай пришли к выводу о необходимости включения в периодическую систему элементов особой, нулевой группы. Сегодня эти элементы называются благородными газами (до 1962 года эти газы называли инертными).

Принцип организации периодической системы
В своей таблице Д.И. Менделеев расположил химические элементы по рядам в порядке возрастания их массы, подобрав длину рядов таким образом, чтобы химические элементы в одной колонке имели похожие химические свойства.
Благородные газы - гелий, неон, аргон, криптон, ксенон и радон неохотно реагируют с другими элементами и проявляют низкую химическую активность и потому находятся в крайней правой колонке.
В противоположность этому элементы самой левой колонки - литий, натрий, калий и прочие реагируют с другими веществами бурно, процесс носит взрывной характер. Аналогично ведут себя элементы в других колонках таблицы - внутри колонки эти свойства подобны, но варьируются при переходе от одной колонки к другой.
Периодическая система в своем первом варианте просто отражала существующее в природе положение дел. Первоначально таблица никак не объясняла, почему это должно быть именно так. И только с появлением квантовой механики стал понятен истинный смысл расположения элементов в периодической таблице.
Химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе. Начиная с номера 93 идут искусственные элементы, созданные в лабораторных условиях.
Не потеряйте. Подпишитесь и получите ссылку на статью себе на почту.
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы

Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.

Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Министерство образования и науки Российской Федерации
Управление образования Администрации г. Твери
Муниципальное образовательное учреждение
«Вечерняя (сменная) общеобразовательная школа № 2» г. Твери
Конкурса ученических рефератов «Кругозор»
Реферат на тему:
История открытия Периодического закона и Периодической системы химических элементов Дмитрия Ивановича Менделеева
ученица 8-в группы МОУ ВСОШ № 2 г. Твери
Руководитель:
учитель химии высшей категории
МОУ ВСОШ № 2 г. Твери
Введение………………………...........................................................................3
1.Предпосылки открытия Периодического закона ……..4
1.1. Классификация ………………………………………..4
1.2. Триады Дёберейнера и первые системы элементов…………………….4
1.3. Спираль де Шанкуртуа ………………………………………………..5
1.5.Таблицы Одлинга и Мейера……………………………………………….7
2.Открытие Периодического закона…………………...9
Заключение…………………………………………………………………. 16
Список литературы………………………………………………………….17
Введение
Периодический закон и Периодическая система химических элементов – основа современной химии.
Менделеева названы города, заводы, учебные заведения, научно-исследовательские институты. В честь в России утверждена золотая медаль – она присуждается за выдающиеся работы по химии. Имя ученого присвоено Российскому химическому обществу. В честь ежегодно в Тверской области проводятся Региональные Менделеевские чтения. Даже элементу с порядковым номером 101 было дано название менделевий, в честь Дмитрия Ивановича.
Главнейшей заслугой было открытие периодического закона и создание периодической системы химических элементов, которые обессмертили его имя в мировой науке. Этот закон и периодическая система – основа всего дальнейшего развития учения об атомах и элементах, они являются фундаментом химии и физики наших дней.
Цель работы: изучить предпосылки возникновения периодического закона и периодической системы химических элементов и оценить вклад в данное открытие Дмитрия Ивановича Менделеева.
1.Предпосылки открытия Периодического закона
Поиски основы естественной классификации химических элементов и их систематизации начались задолго до открытия Периодического закона. Ко времени открытия Периодического закона было известно 63 химических элемента, описаны состав и свойства их соединений.
1.1 Классификация
Выдающийся шведский химик разделил все элементы на металлы и неметаллы на основе различий в свойствах образованных ими простых веществ и соединений. Он определил, что металлам соответствуют основные оксиды и основания, а неметаллам кислотные оксиды и кислоты .
Таблица 1. Классификация
1.2. Триады Дёберейнера и первые системы элементов
В 1829 году немецкий химик Иоганн Вольфганг Дёберейнер предпринял первую значимую попытку систематизации элементов. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами .
Сущность предложенного закона триад Дёберейнера состояла в том, что атомная масса среднего элемента триады была близка к полусумме (среднему арифметическому) атомных масс двух крайних элементов триады. Несмотря на то, что триады Деберейнера в какой-то мере являются прообразами менделеевских групп, эти представления в целом ещё слишком несовершенны. Отсутствие магния в едином семействе кальция, стронция и бария или кислорода в семействе серы, селена и теллура является результатом искусственного ограничения совокупностей сходных элементов лишь тройственными союзами. Очень показательна в этом смысле неудача Деберейнера выделить триаду из четырех близких по своим свойствам элементов: P, As, Sb, Bi. Дёберейнер отчётливо видел глубокие аналогии в химических свойствах фосфора и мышьяка, сурьмы и висмута, но, заранее ограничив себя поисками триад, он не смог найти верного решения. Спустя полвека Лотар Майер скажет, что если бы Дёберейнер хоть ненадолго отвлекся от своих триад, то он сразу же увидел бы сходство всех этих четырех элементов одновременно .
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами.
1.3. Спираль де Шанкуртуа (1862 г.)
Профессор Парижской высшей школы Александр Бегье де Шанкуртуа располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания (т. н. земная спираль ). При развертывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы - ничего общего с ними не имеющий титан . Так впервые родилась мысль о периодичности свойств элементов, но на нее не обратили внимания, и вскоре она оказалась забытой.
Вскоре после спирали де Шанкуртуа американский учёный Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с их атомными массами. Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии. Джон Ньюлендс , безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Он писал , что в такой последовательности повторяются свойства элементов, эквивалентные веса (массы) которых отличаются на 7 единиц, или на значение, кратное 7, т. е. как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую.
Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам. Лондонское химическое общество встретило его закон октав равнодушно и предложило Ньюлендсу попробовать расположить элементы по алфавиту и выявить какую-либо закономерность.
1.5.Таблицы Одлинга и Мейера
В том же 1864 году появилась первая таблица немецкого химика Лотара Мейера; в неё были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.
Рис.3.Таблица химических элементов Мейера
В 1870 году вышла работа Мейера, содержащая новую таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов . Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин « периодичность», уже предложенный к тому времени Менделеевым.
2. Открытие Периодического закона
Существует несколько рассказов близких людей о том, как был открыт периодический закон; эти рассказы передавались очевидцами устно, затем проникли в печать и стали своего рода легендами, проверить которые до сих пор не представилось возможным из-за отсутствия соответствующих документальных данных. Интересен рассказ профессора геологии СПб. Университета (), близкого друга . , посещавший как раз в те дни, когда он открывал периодический закон, приводит любопытные штрихи того, как трудился над созданием своей системы элементов , опубликовавший рассказ, писал:
«О завершающей творческий процесс интуиции Менделеева заслуженный профессор Александр Александрович Иностранцев Любезно сообщил мне в высшей степени интересные вещи. Однажды, уже будучи секретарем физико-математического факультета , А. А. зашел проведать Менделеева, с которым, как ученый и близкий друг, был в непрестанном духовном общении. Видит: Д. И. стоит у конторки, по-видимому, в мрачном, угнетенном состоянии.
Чем вы заняты, Дмитрий Иванович?
Менделеев заговорил о том, что впоследствии воплотилось в периодическую систему элементов, но в ту минуту закон и таблица еще не были сформированы: «Все в голове сложилось,- с горечью прибавил Менделеев, - а выразить таблицей не могу». Немного позднее оказалось следующее. Менделеев три дня и три ночи, не ложась спать, проработал у конторки, пробуя скомбинировать результаты своей мысленной конструкции в таблицу, но попытки достигнуть этого оказались неудачными. Наконец, под влиянием крайнего утомления Менделеев лег спать и тотчас заснул. «Вижу во сне таблицу, где элементы расставлены как нужно. Проснулся, тотчас записал на клочке бумаги, - только в одном месте впоследствии оказалась нужной поправка» .
Далее необходимо учесть свидетельство самого в "Основах химии" о том, как он при окончательном оформлении своей классификации элементов воспользовался карточками, на которых были написаны данные об отдельных элементах . Карточки были нужны именно для выявления неизвестной ещё зависимости между элементами, а вовсе не для её окончательного оформления. А главное, о чем свидетельствует первоначальный черновик таблицы , карточки с написанными на них элементами располагались первоначально не в порядке групп и рядов (периодов), а только в порядке групп (периоды ещё не были вначале открыты). Группы же размещались одна под другой и это именно размещение групп привело к открытию, что вертикальные столбцы (периоды) элементов примыкают друг к другу, образуя общий непрерывный ряд элементов, в котором периодически повторяются определенные химические свойства. В этом, собственно говоря, и состояло открытие периодического закона.
К тому же, если бы было уже известно существование не только групп, но и периодов элементов, то не было бы никакой нужды прибегать к карточкам для отдельных элементов.
Третий рассказ, переданный опять-таки со слов самого, исходит от близкого друга - выдающегося чешского химика . Этот рассказ был опубликован Браунером в 1907г. после смерти его великого друга; в 1930г. он был перепечатан в сборнике трудов чехословацких химиков. Во время второй мировой войны этот рассказ привел Gerald Druce в написанной им биографии Богуслава Браунера. По словам Браунера , рассказал ему о том, каким образом составление учебника по химии, т. е. "Основ химии", помогло открыть и сформулировать периодический закон.
"Когда я начал писать мой учебник,- говорил Браунеру,- я чувствовал, что необходима система, которая позволила бы мне распределить химические элементы. Я нашел, что все существующие системы являются искусственными, а потому непригодны для моей цели; я же добивался установления естественной системы. С этой целью я написал на маленьких кусочках картона знаки элементов и их атомные веса, после чего я начал группировать их различными способами соответственно их сходству. Но этот способ не удовлетворял меня до тех пор, пока я не расположил картонки одну после другой соответственно возрастанию атомного веса. Когда я расположил в таблице первый ряд:
H=1, Li=7, Be=9, B=11, C=12, N=14, O=16, F=19,
я обнаружил, что следующие элементы могут образовывать второй ряд под первым, но начинающиеся под литием. Далее я нашел, что в этом новом ряду:
Na=23, Mg=24, Al=27, Si=28, P=31, S=32, Cl=35,5
у натрия повторяется каждое свойство лития; то же происходит у следующих элементов. Такое же повторение встречается в третьем ряду, после определенного периода, и продолжается во всех рядах" .
Таков рассказ , переданный с его слов. Далее в пояснение и развитие этого рассказа говорится, что "расположил сходные элементы в группы и соответственно возрастанию атомных весов в ряды, в которых свойства и характер элементоа изменились постепенно, как это видно выше. На левой стороне его таблицы стали "электроположительные" элементы, на правой "электроотрицательные". Он провозгласил свой закон в следующих словах"
Таким образом, рассказ, переданный им со слов, касается не всего открытия в целом и не всей истории создания естественной системы элементов, а лишь заключительного этапа этого открытия, когда на основании уже созданной системы смог открыть и сформулировать лежащий в основе этой системы периодический закон химических элементов. Короче говоря, переданный Браунером рассказ касается не истории составления системы элементов, а истории формулировки периодического закона на основании уже составленной системы.
Указанние на существование четвертой версии содержится в редакционном послесловие ко второму тому избранных сочинений, изданному в 1934г. и содержащему работы, относящиеся в периодическому закону . пишет, что в указанном тому "не помещена лишь одна статья "Comment j"ai trouve la loi periodique" как более биографического характера". Ссылки на то, где эта статья опубликована, почему-то не дал. Эта статья, естественно, вызывала огромный интерес, поскольку, судя по её названию, можно было ожидать, что она даст наконец, ответ на интересующий всех химиков вопрос о том, как был открыт периодический закон, причем этот ответ будет получен не от третьих лиц со слов, а от него самого. Ссылка на то, что эта статья была исключена проф. как якобы более биографического характера, казалось совершенно не обоснованной. Именно поэтому её надо было бы включить в сборник работ по периодическому закону, а не исключать из этого сборника. В результате поисков этой статьи было обнаружено, что во французском журнале по чистой и прикладной химии за 1899г. была действительно напечатана статья под интригующим названием "Comment j"ai trouve le systeme periodique des elements" ("Как я нашел периодическую систему элементов"). В примечании к этой статье редакция журнала сообщает, что она обратилась к Д. И, Менделееву по случаю состаявшегося избрания его в 1899г. иностранным членом-корреспондентом Парижской Академии наук с просьбой написать для журнала о своей периодической системе. исполнил эту просьбу с большой охотой и прислал во французский журнал свою работу, написанную по-русски. Перевод этой работы на французский язык был осуществлен самой редакцией.
Ближайшее ознакомление с текстом опубликованной на французском языке статья показывает, что это - не какая-то новая работа, а точный перевод с его статьи "Периодическая законность химических элементов", которую написал для Энциклопедического словаря Брокгауза и Ефрона, и она была напечатана в XXIII томе этого словаря в 1898г. Очевидно, переводчик или редакция французского журнала для придания большего интереса изменили показавшееся слишком сухим название: "Периодическая законность химических элементов" на интригующее: "Как я нашел периодическую систему элементов". В остальном же все осталось без изменения, и ничего биографического к своей статье не добавил.
Таковы легенды и рассказы о том, как была открыта периодическая система химических элементов. Все порожденные ими неясности можно выше считать устраненными благодаря нахождению и изучению новых материалов, относящихся к истории этого великого открытия.

Рис.4. «Опыт системы элементов»
6 марта 1869 года на заседании Русского химического общества, в отсутствии Менделеева (Менделеев находился на сыроварнях в Тверской области и, возможно, заезжал в свое имение «Боблово» в Московской области), сообщение об открытии периодического закона сделал, получивший для очередного номера своего журнала («Журнал Русского химического общества») статью .
В 1871 года в итоговой статье «Периодическая законность химических элементов» Менделеев дал следующую формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице вид, ставший классическим (так называемый короткий вариант).
В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных весов, но и решился назвать эти закономерности общим законом природы. На основании предположения, что атомная масса предопределяет свойства элемента, он взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов.

Рис.5. Периодическая система химических элементов
Д. И. Менделеев на протяжении многих лет боролся за признание Периодического закона; его идеи получили признание только после того, как были открыты предсказанные Менделеевым элементы: галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886) - соответственно экаалюминий, экабор и экасилиций. С середины 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.
Заключение
Периодический закон сыграл огромную роль в развитии химии других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение. После открытия Периодического закона стало ясно, что атомы всех элементов должны быть построены по единому принципу, а их строение должно отображать периодичность свойств элементов. Таким образом, периодический закон стал важным звеном в эволюции атомно-молекулярного учения, оказав значительное влияние на разработку теории строения атома. Он также способствовал формулировке современного понятия "химический элемент" и уточнению представлений о простых и сложных веществах. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону.
«Будут появляться и умирать новые теории, блестящие обобщения. Новые представления будут сменять наши уже устаревшие понятия об атоме и электроне. Величайшие открытия и эксперименты будут сводить на нет прошлое и открывать на сегодня невероятные по новизне и широте горизонты - всё это будет приходить и уходить, но Периодический закон Менделеева будет всегда жить и руководить исканиями».
Список литературы
2. . Основы химии. - Т. 2. – М. –Л.: Госхимиздат, 1947. - 389 с.
3. . Избранные лекции по химии. – М.: Высш. шк.,1968. - 224 с.
4. . Новые материалы по истории открытия периодического закона. - М. –Л.: Изд-во Акад. наук СССР,1950. - 145 с.
5. . Философский анализ первых трудов о периодическом законе (). - М.: Изд-во Акад. наук СССР,1959. - 294 с.
6. . Философия изобретения и изобретение в философии. - Т.2. - М.: Наука и школа,1922.- С.88.