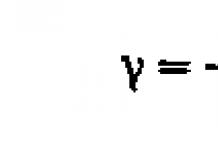Массовые доли обычно выражают в процентах:
ω%(О) = 100 % – ω%(Н) = 100 % – 11,1 % = 88,9 %.
Вопросы для контроля
1. Какие частицы обычно образуются в результате соединения атомов?
2. Чем можно выразить состав любой молекулы?
3. Что называется индексами в химических формулах?
4. Что показывают химические формулы?
5. Как формулируется закон постоянства состава?
6. Что такое молекула?
7. Чему равна масса молекулы?
8. Что такое относительная молекулярная масса?
9. Чему равна массовая доля данного элемента в данном веществе?
1. Опишите качественный и количественный состав молекул следую-
щих веществ: метан СН4 , сода Na2 CO3 , глюкоза С6 Н12 О6 , хлор Сl2 , сульфат алюминия Al2 (SO4 )3 .
2. Молекула фосгена состоит из одного атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины состоит из одного атома углерода, одного атома кислорода и двух атомных групп NH 2 . Напишите формулы фосгена и мочевины.
3. Подсчитайте общее число атомов в следующих молекулах: (NH 4 )3 PO4 , Ca(H2 PO4 )2 , 2 SO4 .
4. Рассчитайте относительные молекулярные массы веществ, которые указаны в упражнении 1.
5. Чему равны массовые доли элементов в следующих веществах: NH 3 , N2 O, NO2 , NaNO3 , KNO3 , NH4 NO3 ? В каком из этих веществ массовая доля азота наибольшая и в каком - наименьшая?
§ 1.5. Простые и сложные вещества. Аллотропия.
Химические соединения и смеси
Все вещества делятся на простые и сложные .
Простые вещества - это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента
соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение . К ним отно-
сятся: водород Н 2 , кислород О 2 , азот N 2 , фтор F 2 , хлор Сl 2 , бром Вr 2 , йод I 2 . Все эти вещества состоят из двухатомных
молекул . (Обратите внимание, что названия простых веществ
совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение , т. е. состоят из атомов, между которыми существуют определенные связи (их характер мы рассмотрим в разделе «Химическая связь и строение вещества»). Примерами таких простых веществ являются все металлы (железо Fe , медь Сu , натрий Na и т. д.) и некоторые неметаллы (углерод С , кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами . К ним относятся: гелий Не ,
неон Ne , аргон Аr , криптон Кr , ксенон Хе , радон Rn . Эти простые вещества состоят из химически не связанных друг с другом атомов .
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно,
а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия - это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными
видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует
два простых вещества. Одно из них состоит из двухатомных молекул О2 и имеет такое же название, как и элемент - кислород. Другое простое вещество состоит из трехатомных молекул О3 и имеет собственное название - озон:
Кислород О2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение крис-
таллов . Примером являются аллотропные модификации углерода С - алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества - это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: HCI, H 2 O, NaCl, CO 2 ,
H2 SO4 , Cu(NO3 )2 , C6 H12 O6 и т. д.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраня-
ются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Например, хлорид натрия NaCl может образоваться из простых веществ - металлического натрия Na и газообразного хлора Cl 2 . Физические и химические свойства NaCI отличаются от свойств Na и Сl 2 .
В природе, как правило, встречаются не чистые вещества,
а смеси веществ. В практической деятельности мы также
обычно используем смеси веществ. Любая смесь состоит из
двух или большего числа веществ, которые называются ком-
понентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О 2 (21 % по объему), азота N 2 (78 %), углекислого газа СО 2 и др. Смесями являются рас-
творы многих веществ, сплавы некоторых металлов и т. д. Смеси веществ бывают гомогенными (однородными) и ге-
терогенными (неоднородными).
Гомогенные смеси - это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси - это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок +
Порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в них твердых веществ (вода + мел).
Жидкие растворы, которые являются важнейшими представителями гомогенных систем, мы будем подробно изучать в нашем курсе.
Важнейшие отличия смесей от химических соединений:
1. В смесях свойства отдельных веществ (компонентов)
сохраняются.
2. Состав смесей не является постоянным.
Вопросы для контроля
1. На какие два типа делятся все вещества?
2. Что такое простые вещества?
3. Какие простые вещества имеют молекулярное строение (названия и формулы)?
4. Какие простые вещества имеют атомное строение? Приведите примеры.
5. Какие простые вещества состоят из не связанных друг с другом атомов?
6. Что такое аллотропия?
7. Что называется аллотропными видоизменениями (модификациями)?
8. Почему число простых веществ больше числа химических элементов?
9. Что такое сложные вещества?
10. Сохраняются ли свойства простых веществ при образовании из них сложного вещества?
11. Что такое гомогенные смеси? Приведите примеры.
12. Что такое гетерогенные смеси? Приведите примеры.
13. Чем отличаются смеси от химических соединений?
Задания для самостоятельной работы
1. Напишите формулы известных вам: а) простых веществ (5 примеров); б) сложных веществ (5 примеров).
2. Разделите вещества, формулы которых приведены ниже, на простые и сложные: NH 3 , Zn, Br2 , HI, C2 H5 OH, К, СО, F2 , C10 H22 .
3. Элемент фосфор образует три простых вещества, отличающихся, в частности, цветом: белый, красный и черный фосфор. Чем являются эти простые вещества по отношению друг к другу?
§ 1.6. Валентность элементов. Графические формулы веществ
Рассмотрим химические формулы соединений некоторых
Как видно из этих примеров, атомы элементов хлора, кислорода, азота, углерода присоединяют не любое, а только определенное число атомов водорода (1, 2, 3, 4 атома соответственно).
Между атомами в химических соединениях существуют химические связи . Напишем формулы, в которых каждая хи-
мическая связь обозначается черточкой:
Такие формулы называются графическими .
Графические формулы веществ - это формулы, которые показывают порядок соединения атомов в молекулах и число связей, которые образует каждый атом.
Число химических связей, которые образует один атом данного элемента в данной молекуле, называется валентностью элемента.
Валентность обычно обозначается римскими цифрами: I, II, III, IV, V, VI, VII, VIII.
Во всех рассматриваемых молекулах каждый атом водорода образует одну связь: следовательно, валентность водорода равна единице (I).
Атом хлора в молекуле HCl образует одну связь, его валентность в этой молекуле равна I. Атом кислорода в молекуле H2 O образует две связи, его валентность равна II. Валентность
азота в NH3 равна III, а валентность углерода в CH4 - IV. Некоторые элементы имеют постоянную валентность.
Элементы с постоянной валентностью - это элементы, которые во всех соединениях проявляют одинаковую валент-
Элементами с постоянной валентностью I являются: водород Н , фтор F , щелочные металлы: литий Li , натрий Na ,
калий К , рубидий Rb , цезий Cs .
Атомы этих одновалентных элементов всегда образуют
только одну химическую связь.
Элементы с постоянной валентностью II:
кислород О , магний Mg , кальций Са , стронций Sr , барий Ва , цинк Zn .
Элемент с постоянной валентностью III - алюминий Al.
Большинство элементов имеют переменную валентность.
Элементы с переменной валентностью - это элементы, которые в разных соединениях могут иметь различные значения валентности* .
Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (табл. 4).
* Физический смысл валентности, причины существования элементов с постоянной и переменной валентностью мы рассмотрим после изучения теории строения атомов.
Таблица 4
Наиболее характерные значения валентности некоторых элементов
Элементы |
Наиболее характерные |
валентности |
|
II, III, IV, VI, VII |
|
Для определения валентности таких элементов в какомлибо данном соединении можно использовать правило ва-
лентности.
Согласно этому правилу, в большинстве бинарных соединений типа А m В n произведение валентности элемента А (х) на число его атомов (т) равно произведению валентности элемен-
та В (у) на число его атомов (п):
х · т = у · п * .
Определим, например, валентность фосфора в следующих соединениях:
х I |
х" II |
РН3 |
Р2 O5 |
Валентность водорода |
Валентность кислорода |
постоянна и равна I |
постоянна и равна II |
х · 1 = 1 · 3 |
х" · 2 = 2 · 5 |
х = 3 |
х" = 5 |
РН3 |
Р2 O5 |
Фосфор в РН3 является |
Фосфор в Р2 О5 является |
трехвалентным |
пятивалентным |
элементом |
элементом |
* Правило валентности не применяется для бинарных соединений, в которых атомы одного элемента непосредственно соединяются друг с другом. Например, правилу валентности не подчиняется пер-
оксид водарода Н2 О2 , так как в его молекуле существует связь между атомами кислорода: Н-О-О-Н.

Используя правило валентности, можно составлять формулы бинарных соединений, т. е. определять индексы в этих формулах.
Составим, например, формулу соединения алюминия с кислородом. Аl и О имеют постоянные значения валентности, со-
ответственно III и II:
Наименьшее общее кратное (НОК) чисел 3 и 2 равно 6. Разделим НОК на валентность Аl:
6: 3 = 2 и на валентность О: 6: 2 = 3
Эти числа равны индексам у символов соответствующих
элементов в формуле соединения:
Аl2 O3
Рассмотрим еще два примера.
Составить формулы соединений, которые состоят из:
Обратите внимание, что в большинстве бинарных соеди-
нений атомы одного элемента непосредственно друг с другом не соединяются.
Напишем графические формулы всех соединений, которые мы рассматривали в этом параграфе:
Сравните число черточек для каждого элемента с его валентностью, которая указана в тексте параграфа.
Вопросы для контроля
1. Что такое валентность элемента?
2. Какими цифрами обычно обозначается валентность?
3. Что такое элементы с постоянной валентностью?
4. Какие элементы имеют постоянную валентность?
5. Что такое элементы с переменной валентностью? Укажите наиболее характерные значения валентности для хлора, серы, углерода, фосфора, железа.
6. Как формулируется правило валентности?
7. Как называются формулы, которые показывают порядок соединения атомов в молекулах и валентность каждого элемента?
Задания для самостоятельной работы
1. Определите валентность элементов в следующих соединениях: AsH 3 , СuО, N 2 O 3 , CaBr 2 , AlI 3 , SF 6 , K 2 S, SiO 2 , Mg 3 N 2 .
Составьте графические формулы этих веществ.
2. Определите индексы т и n в следующих формулах:
Hm Sen , Pm Cln , Pbm On , Om Fn , Fem Sn Напишите графические формулы этих веществ.
3. Составьте молекулярные и графические формулы соединений хрома с кислородом, в которых хром проявляет валентность II , III и VI .
4. Составьте формулы соединений, которые состоят из:
а) марганца (II) и кислорода; б) марганца (IV) и кислорода; в) марганца (VI) и кислорода; г) хлора (VII) и кислорода; д) бария и кислорода. Напишите графические формулы этих веществ.
§ 1.7. Моль. Молярная масса
Масса вещества выражается в кг, г или других единицах
Единицей количества вещества является моль.
Большинство веществ состоит из молекул или атомов.
Моль - это количество вещества, которое содержит столько молекул (атомов) этого вещества, сколько атомов содержится в 12 г (0,012 кг) углерода С.
Определим число атомов С в 12 г углерода. Для этого разделим 0,012 кг на абсолютную массу атома углерода m a (C) (см. § 1.3):
0,012 кг/19,93 · 10–27 кг ≈ 6,02 · 1023 .
Из определения понятия «моль» следует, что это число
равно числу молекул (атомов) в одном моле любого вещества. Оно называется числом Авогадро и обозначается сим-
волом N A :
(Отметим, что число Авогадро - очень большое число!)
Если вещество состоит из молекул, то 1 моль - это 6,02 · 1023 молекул этого вещества.
Например: 1 моль водорода Н2 - это 6,02 · 1023 молекул Н2 ; 1 моль воды Н2 О - это 6,02 · 1023 молекул Н2 О;
1 моль глюкозы С6 Н12 О6 - это 6,02 · 1023
молекул С6 Н12 О6 .
Если вещество состоит из атомов, то 1 моль - это 6,02 · 1023 атомов этого вещества.
Например: 1 моль железа Fe - это 6,02 · 1023 атомов Fe;
1 моль серы S - это 6,02 · 1023 атомов S. Следовательно:
1 моль любого вещества содержит Авогадрово число частиц, из которых состоит это вещество, т. е. приблизительно 6,02 · 1023 молекул или атомов.
Количество вещества (т. е. число молей) обозначается латинской буквой п (или греческой буквой v ). Любое данное число молекул (атомов) обозначается буквой N .
Количество вещества n равно отношению данного числа молекул (атомов) N к числу молекул (атомов) в 1 моле NA .
В ходе урока вы узнаете о качественных и количественных составах органических веществ, о том, что представляет собой простейшая, молекулярная, структурная формула.
Одной простейшей формуле могут соответствовать много молекулярных формул.
Формула, которая показывает порядок соединения атомов в молекуле, называется структурной формулой.
Гексен и циклогексан имеют одинаковые молекулярные формулы С 6 Н 12 , но это два разных вещества с разными физическими и химическими свойствами. См. табл. 1.
Табл. 1. Различие свойств гексена и циклогексана
Для характеристики органического вещества необходимо знать не только состав молекулы, но и порядок расположения атомов в молекуле - строение молекулы.
Строение веществ отражают структурные (графические) формулы, в которых ковалентные связи между атомами обозначают черточками - валентными штрихами.
В органических соединениях углерод образует четыре связи, водород - одну, кислород - две, а азот - три.
Валентность. Число ковалентных неполярных или полярных связей, которые может образовывать элемент, называют валентностью
Связь, которая образована одной парой электронов, называется простой или одинарной связью.
Связь, которая образована двумя парами электронов, называется двойной связью, ее обозначают двумя черточками, как знак «равно». Три электронных пары образуют тройную связь, которую обозначают тремя черточками. См. табл. 2.
|
|
Табл. 2. Примеры органических веществ с разными связями
На практике обычно применяют сокращенные структурные формулы , в которых не обозначены связи углерода, кислорода и других атомов с водородом:


Рис. 1. Объёмная модель молекулы этанола
Структурные формулы передают порядок, в котором атомы соединены друг с другом, но не передают расположение атомов в пространстве. Структурные формулы - это двумерный рисунок, а молекулы трехмерны, т.е. объемны, это показано на примере этанола на рис. 1.
На уроке освещался вопрос о качественных и количественных составах органических веществ, о том, что представляет собой простейшая, молекулярная, структурная формула.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 6-7 (с.11) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. -М.: Просвещение, 2012.
2. Почему органические вещества, состав которых отражается одной и той же молекулярной формулой, имеют разные и химические и физические свойства?
3. Что показывает простейшая формула?
Рассмотрим качественный и количественный состав веществ. Определим его особенности для соединений органического и неорганического происхождения.
Что показывает качественный состав вещества
Он демонстрирует виды атомов, которые есть в анализируемой молекуле. К примеру, вода образована водородом и кислородом.
Молекула включает в себя атомы натрия и кислорода. В серной кислоте содержатся водород, кислород, сера.

Что показывает состав количественный
Он демонстрирует количественное содержание каждого элемента внутри сложного вещества.
К примеру, в воде находится два атома водорода и один кислорода. Серная кислота состоит из двух водородов, одного атома серы, четырех кислородов.
В составе три атома водорода, один фосфор, четыре атома кислорода.
Качественный и количественный состав веществ есть и у органических веществ. Например, метан содержит один углерод и четыре водорода.

Способы определения состава вещества
Качественный и количественный состав веществ можно определить химическим путем. К примеру, при разложении молекулы сложного соединения образуется несколько молекул с более простым составом. Так, при нагревании карбоната кальция, состоящего из кальция, углерода, четырех атомов кислорода, можно получить два и углерода.
И образующиеся в ход химического разложения соединения могут иметь различный качественный и количественный состав веществ.
Простые и сложные соединения могут быть молекулярного, а также немолекулярного состава.
Первая группа находится в разных агрегатных состояниях. Например, сахар является твердым веществом, вода - жидкая, кислород - газ.
Соединения немолекулярного строения при стандартных условиях находятся в твердом виде. К ним относятся соли. В процессе нагревания они плавятся, переходят из твердого вида в жидкое состояние.

Примеры определения состава
«Опишите качественный и количественный состав следующих веществ: оксида серы (4), оксида серы (6)». Такое задание является типовым в школьном курсе неорганической химии. Для того чтобы справиться с ним, сначала нужно составить формулы предложенных соединений, пользуясь валентностями либо степенями окисления.
В обоих предложенных оксидах присутствуют одни и те же химические элементы, следовательно, их качественный состав одинаковый. Они включают в себя атомы серы и кислорода. А вот в количественном соотношении результаты будут отличаться.
В первом соединении содержится два атома кислорода, а во втором их шесть.
Выполним следующее задание: «Опишите качественный и количественный состав веществ H2S».
Молекула сероводорода состоит из атома серы и двух водородов. Качественный и количественный состав вещества H2S позволяет предугадывать его химические свойства. Так как в составе присутствует катион водорода, сероводород способен проявлять окислительные свойства. Например, подобные характеристики проявляются во взаимодействии с активным металлом.
Информация о качественном и количественном составе вещества актуальна и для органических соединений. Например, зная количественное содержание компонентов в молекуле углеводорода, можно определить его принадлежность к определенному классу веществ.
Такая информация позволяет предугадывать химические и физические характеристики анализируемого углеводорода, выявлять его специфические свойства.
Например, зная, что в составе есть четыре атома углерода и десять водородов, можно сделать вывод о принадлежности данного вещества к классу предельных (насыщенных) углеводородов, имеющих общую формулу СпН2п+2. Для всех представителей данного гомологического ряда характерны по радикальному механизму, а также окисление кислородом воздуха.
Заключение
Любое неорганическое и органическое вещество имеет определенный количественный и качественный состав. Информация необходима для установления физических и химических свойств анализируемого неорганического соединения, а для органических веществ состав позволяет устанавливать принадлежность к классу, выявлять характерные и специфические химические свойства.
Химические формулы
Материал параграфа поможет вам:
> выяснить, что такое химическая формула;
> читать формулы веществ, атомов, молекул, ионов;
> правильно использовать термин «формульная единица»;
> составлять химические формулы ионных соединений;
> характеризовать состав вещества, молекулы, иона по химической формуле.
Химическая формула.
У каждого вещества есть название. Однако, по названию нельзя определить, из каких частиц состоит вещество, сколько и каких атомов содержится в его молекулах, ионах, какие заряды имеют ионы. Ответы на такие вопросы дает особая запись - химическая формула.
Химическая формула - это обозначение атома, молекулы, иона или вещества с помощью символов химических элементов и индексов.
Химической формулой атома является символ соответствующего элемента. Например, атом Алюминия обозначают символом Al, атом Силиция - символом Si. Такие формулы имеют и простые вещества - металл алюминий, неметалл атомного строения кремний.
Химическая формула молекулы простого вещества содержит символ соответствующего элемента и нижний индекс - маленькую цифру, записанную ниже и справа. Индекс указывает на количество атомов в молекуле.
Молекула кислорода состоит из двух атомов Оксигена. Ее химическая формула - O 2 . Эту формулу читают, произнося сначала символ элемента, потом - индекс: «о-два». Формулой O 2 обозначают не только молекулу, но и само вещество кислород.
Молекулу O 2 называют двухатомной. Из подобных молекул (их общая формула - E 2) состоят простые вещества Гидрогена, Нитрогена, Флуора, Хлора, Брома, Иода.
Озон содержит трёхатомные молекулы, белый фосфор - четырехатомные, а сера - восьмиатомные. (Напишите химические формулы этих молекул.)
Н 2
O 2
N 2
Cl 2
Br 2
I 2
В формуле молекулы сложного вещества записывают символы элементов, атомы которых содержатся в ней, а также индексы. Молекула углекислого газа состоит из трех атомов: одного атома Карбона и двух - Оксигена. Ее химическая формула - CO 2 (читается «цэ-о-два»). Запомните: если в молекуле есть один атом какого-либо элемента, то соответствующий индекс, т. е. I, в химической формуле не пишут. Формула молекулы углекислого газа является также и формулой самого вещества.
В формуле иона дополнительно записывают его заряд. Для этого спользуют верхний индекс. В нем цифрой указывают величину заряда (единицу не пишут), а потом - знак (плюс или минус). Например, ион Натрия с зарядом +1 имеет формулу Na + (читается «натрий-плюс»), ион Хлора с зарядом - I - СГ - («хлор-минус»), гидроксид-ион с зарядом - I - ОН - («о-аш-минус»), карбонат-ион с зарядом -2 - CO 2- 3 («цэ-о-три-два-минус»).
Na + , Cl -
простые ионы
ОН - , СО 2- 3
сложные ионы
В формулах ионных соединений сначала записывают, не указывая зарядов, положительно заряженные ионы , а потом - отрицательно заряженные (табл. 2). Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Таблица 2
Формулы некоторых ионных соединений
В некоторых химических формулах группу атомов или сложный ион записывают в скобках. В качестве примера возьмем формулу гашеной извести Ca(OH) 2 . Это ионное соединение. В нем на каждый ион Ca 2+ приходится два иона ОН - . Формула соединения читается «кальций -о-аш-дважды», но не « кальций-о-аш-два».
Иногда в химических формулах вместо символов элементов записывают «посторонние» буквы, а также буквы-индексы. Такие формулы часто называют общими. Примеры формул этого типа: ECI n , E n O m , Fe x O y. Первой
формулой обозначают группу соединений элементов с Хлором, второй - группу соединений элементов с Оксигеном, а третью используют, если химическая формула соединения Феррума с Оксигеном
неизвестна и
ее следует установить.
Если нужно обозначить два отдельных атома Неона, две молекулы кислорода, две молекулы углекислого газа или два иона Натрия, используют записи 2Ne, 20 2 , 2С0 2 , 2Na + . Цифру перед химической формулой называют коэффициентом. Коэффициент I, как и индекс I, не пишут.
Формульная единица.
А что означает запись 2NaCl? Молекул NaCl не существует; поваренная соль - ионное соединение, которое состоит из ионов Na + и Сl - . Пару этих ионов называют формульной единицей вещества (она выделена на рис. 44, а). Таким образом, записью 2NaCl представлены две формульные единицы поваренной соли, т. е. две пары ионов Na + и С l- .
Термин «формульная единица» используют для сложных веществ не только ионного, но и атомного строения. Например, формульной единицей для кварца SiO 2 является совокупность одного атома Силиция и двух атомов Оксигена (рис. 44, б).

Рис. 44. формульные единицы в соединениях ионного(а) атомного строения (б)
Формульная единица - это мельчайший «кирпичик» вещества, его наименьший повторяющийся фрагмент. Этим фрагментом может быть атом (в простом веществе), молекула
(в простом или сложном веществе),
совокупность атомов или ионов (в сложном веществе).
Упражнение. Составить химическую формулу соединения, которое содержит ионы Li + i SO 2- 4 . Назвать формульную единицу этого вещества.
Решение
В ионном соединении сумма зарядов всех ионов равна нулю. Это возможно при условии, если на каждый ион SO 2- 4 приходится два иона Li + . Отсюда формула соединения - Li 2 SO 4 .
Формульной единицей вещества являются три иона: два иона Li + и один ион SO 2- 4 .
Качественный и количественный состав вещества.
Химическая формула содержит информацию о составе частицы или вещества. Характеризуя качественный состав, называют элементы, которые образуют частицу или вещество, а характеризуя количественный состав, указывают:
Количество атомов каждого элемента в молекуле или сложном ионе;
соотношение атомов разных элементов или ионов в веществе.
Упражнение
. Описать состав метана CH 4 (молекулярное соединение) и кальцинированной соды Na 2 CO 3 (ионное соединение)
Решение
Метан образован элементами Карбоном и Гидрогеном (это качественный состав). Молекула метана содержит один атом Карбона и четыре атома Гидрогена; их соотношение в молекуле и в веществе
N(C): N(H) = 1:4 (количественный состав).
(Буквой N обозначают количество частиц - атомов, молекул, ионов.
Кальцинированная сода образована тремя элементами - Натрием, Карбоном и Оксигеном. Она содержит положительно заря женные ионы Na + , поскольку Натрий - металлический элемент и отрицательно заряженные ионы CO -2 3 (качественный состав).
Соотношение атомов элементов и ионов в веществе таковы:
Выводы
Химическая формула - это запись атома, молекулы, иона, вещества с помощью символов химических элементов и индексов. Количество атомов каждого элемента указывают в формуле с помощью нижнего индекса, а заряд иона - верхним индексом.
Формульная единица - частица или совокупность частиц вещества, представленная его химической формулой.
Химическая формула отражает качественный и количественный состав частицы или вещества.
?
66. Какую информацию о веществе или частице содержит химическая формула?
67. В чем состоит отличие между коэффициентом и нижним индексом в химических записях? Ответ дополните примерами. Для чего используют верхний индекс?
68. Прочитайте формулы: P 4 , KHCO 3 , AI 2 (SO 4) 3 , Fe(OH) 2 NO 3 , Ag + , NH + 4 , CIO - 4 .
69. Что обозначают записи: 3H 2 0, 2Н, 2Н 2 , N 2 , Li, 4Cu, Zn 2+ , 50 2- , NO - 3 , ЗСа(0Н) 2 , 2СаС0 3 ?
70. Запишите химические формулы, которые читаются так: эс-о-три; бор- два-о-три; аш-эн-о-два; хром-о-аш-трижды; натрий-аш-эс-о-четыре; эн-аш-четыре-дважды-эс; барий-два-плюс; пэ-о-четыре-три-минус.
71. Составьте химическую формулу молекулы, которая содержит: а) один атом Нитрогена и три атома Гидрогена; б) четыре атома Гидрогена, два атома Фосфора и семь атомов Оксигена.
72. Что является формульной единицей: а) для кальцинированной соды Na 2 CO 3 ; б) для ионного соединения Li 3 N; в) для соединения B 2 O 3 , которое имеет атомное строение?
73. Составьте формулы всех веществ, в состав которых могут входить лишь такие ионы: K + , Mg2 + , F - , SO -2 4 , ОН - .
74. Охарактеризуйте качественный и количественный состав:
а) молекулярных веществ - хлора Cl 2 , гидроген пероксида (перекиси водорода)H 2 O 2 , глюкозы C 6 H 12 O 6 ;
б) ионного вещества - натрий сульфата Na 2 SO 4 ;
в) ионов H 3 O + , HPO 2- 4 .
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. - К.: ВЦ «Академія», 2008. - 136 с.: іл.
Содержание урока конспект урока и опорный каркас презентация урока интерактивные технологии акселеративные методы обучения Практика тесты, тестирование онлайн задачи и упражнения домашние задания практикумы и тренинги вопросы для дискуссий в классе Иллюстрации видео- и аудиоматериалы фотографии, картинки графики, таблицы, схемы комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения рефераты шпаргалки фишки для любознательных статьи (МАН) литература основная и дополнительная словарь терминов Совершенствование учебников и уроков исправление ошибок в учебнике замена устаревших знаний новыми Только для учителей календарные планы учебные программы методические рекомендации