Получения ж. из руд был изобретен в зап. части Азии во 2-м тысячелетии до н. э.; вслед за тем применение ж. распростран. в Вавилоне, Египте, Греции; на смену бронз , в. пришел железный в. По содержанию в литосфере (4,65 мае. %) ж. занимает 2-е место среди металлов (на 1-м алюминий) и образует ок. 300 минералов (оксиды, сульфиды , силикаты , карбонаты и т.д.).
Ж. может существовать в виде трех аллот-ропич. модификаций: a-Fe с ОЦК, y-Fe с ГЦК и 8-Fe с ОЦК кристаллич . решетками; a-Fe ферромагнитно вплоть до 769 "С (точка Кюри). Модификации y~Fe и б-Fe парамагнитны. Полиморфные превращения ж. и стали при нагревании и охлаждении открыл в 1868 г. Д. К. Чернов. Fe проявляет перем. валентность (наиб, устойчивы соединения 2- и 3-валентного ж.). С кислородом ж. образует оксиды FeO, Fe2O3 и Fe3O4. Плотность ж. (при содержании примесей < 0,01 мае %) 7,874 г/ /см3, /т=1539"С, /КИЛ*3200«С.
Ж. - важнейший металл соврем, техники. В чистом виде из-за низкой прочн. практич. не использ. Осн. масса ж. применяется в виде весьма разных по составу и св-вам сплавов. На долю сплавов ж. приходится ~ 95 % всей ме-таллич. продукции.
Чистое Fe получают в относит, небольших кол-вах электролизом водных р-ров его солей или восстановлением водородом. Достат. чистое ж. получают прямым восстановл. не-посредст. из рудных концентратов (минуя домен , печь), водородом, природ, газом или углем при относит, низких темп-pax (губчатое Fe, железный порошок, металлизов. окатыши):
Губчатое железо - пористая масса с высоким содержанием железа, получ. восстановлением оксидов при / < /пл. Сырье - ж. руда, окатыши, железорудный концентрат и прокатная окалина , а восстановитель -углерод (некоксующийся уголь , антрацит , торф, сажа), газы (водород, конверторов., природ, и др. горючие газы) или их сочетание. Г. ж. для выплавки качеств, стали в электропечах, должно иметь степень металлизации рем/реобш ^ 85 % (желат. 92-95 %) и пустой породы < 4-5 %. Содержание углерода зависит от способа произ-ва г. ж. В процессах FIOR, SL-RN и HIB получают г. ж. с 0,2-0,7 % С, в процессе Midrex 0,8-2,5 % С. При газ. восстановлении содерж. 0,01-0,015 % S. Фосфор присутствует в виде оксидов и после расплавления переходит в шлак. Из г. ж., получаемого способами H-Iron, Heganes и Сулинского мет. з-да с 97-99 % FeM механич. измельчением с последующим отжигом изготовляют жел. порошок. Общая пористость г. ж. из руды - 45- 50 %, из окатышей 45-70 %. Насыпная масса - 1,6-2,1 т/м3. Для г. ж. характерна большая уд. поверхность , к-рая, включая внутр. пов-ть открытых пор, сост. 0,2-1 М3/г. Г. ж. имеет по-выш. склонность к вторичному окислению. При темп-pax в печи ниже 550-575 °С охлажд. металлизов. продукт пирофорен (самовозгорается на воздухе при комн. темп-ре). В совр. процессах г. ж. получают при / > 700 °С, что снижает его активность и позволяет хранить на воздухе (в отсутствии влаге) без заметного снижения степени металлизации. Г. ж., произвел, по высокотемп-рной технологии - при / > 850 °С, обладает низкой склонностью ко вторичному окислению при увлажнении, что обеспеч. безопасную транспортировку его в открытых вагонах, перевозку морским (речным) транспортом, хранение в открытых штабелях;
Железо прямого получения - железо, получаемое химич., электрохимич . или химико-термич. способами непосредст. из руды, минуя домен, печь, в виде порошка , губч. железа (металлизов. окатышей), крицы или жидкого металла. Наиб, развитие получило произ-во губч. железа при 700-1150 °С методами газ. восстановления руды (окатышей) в шахтных печах и с помощью тв. топлива во вращ. печах. Ж. п. п. с 88-93 % FeM, используется как шихта для выплавки стали, а с более высоким содержанием (98- 99 %) для произ-ва жел. порошка;
Карбонильное железо - порошок железа, получаемый при термич. разложении пентакарбонила железа; отличается высокой чистотой;
самородное железо - ж., встречающееся в природе в виде минералов. Различают по условиям нахождения теллурич. или земное (никель-железо) и метеоритное (космическое) с. ж. Теллурич. железо - редкий минерал - модификация a-Fe, встречается в виде отд. чешуек, зерен, губч. масс и скоплений. Состав - тв. р-р Fe и Ni (до 30 % Ni). Метеоритное с. ж. образуется в процессах формирования космич. тел и попадает на Землю в виде метеоритов; содержит до 25 % Ni. Цвет серо-стальной до черного, металлич. блеск, непрозрачно, тв. баллов 4-5 по минералогич . шкале, у = 7,3-8,2 г/см3 (в зависимости от содержания Ni). Сильно магнитно, хорошо куется;
Электролитическое железо - ж., получаемое электролитич. рафинированием; отличается высокой чистотой по примесям (<0,02 % С; 0,01 % О2);
электротехническое железо - применяемая в электротехнике сталь (или так наз. технич. чистое железо) с суммарным содерж. примесей до 0,08-0,10 %, в т. ч. до 0,05 % С. Э.ж. имеет малое уд. электрич. сопротивление , обладает повыш. потерями на вихревые токи, в связи с чем применение его ограничено в осн. магнитопроводами пост, магнитного потока (полюсные наконечники, магнитопроводы, реле и т.п.);
А-железо - низкотемп-рная модификация железа с ОЦК решеткой (при 20 °С а = 286,645 пм), устойчивая < 910 °С; a-Fe ферромагнитно при t < 769 °С (точка Кюри);
У-железо - высокотемп-рная модификация железа с ГЦК решеткой (а= 364 пм), устойчива при 910-1400 °С; парамагнитна;
5-железо - высокотемп-рная модификация железа с ОЦК решеткой (а = 294 пм), устойчива от 1400 °С до tm, парамагнитна.
В организме человека содержится около 5 г железа, большая часть его (70%) входит в состав гемоглобина крови.
Физические свойства
В свободном состоянии железо - серебристо-белый металл с сероватым оттенком. Чистое железо пластично, обладает ферромагнитными свойствами. На практике обычно используются сплавы железа - чугуны и стали.
Fe - самый главный и самый распространенный элемент из девяти d-металлов побочной подгруппы VIII группы. Вместе с кобальтом и никелем образует «семейство железа».
При образовании соединений с другими элементами чаще использует 2 или 3 электрона (В = II, III).
Железо, как и почти все d-элементы VIII группы, не проявляет высшую валентность, равную номеру группы. Его максимальная валентность достигает VI и проявляется крайне редко.
Наиболее характерны соединения, в которых атомы Fe находятся в степенях окисления +2 и +3.
Способы получения железа
1. Техническое железо (в сплаве с углеродом и другими примесями) получают карботермическим восстановлением его природных соединений по схеме:

Восстановление происходит постепенно, в 3 стадии:
1) 3Fe 2 O 3 + СО = 2Fe 3 O 4 + СO 2
2) Fe 3 O 4 + СО = 3FeO +СO 2
3) FeO + СО = Fe + СO 2
Образующийся в результате этого процесса чугун содержит более 2% углерода. В дальнейшем из чугуна получают стали - сплавы железа, содержащие менее 1,5 % углерода.
2. Очень чистое железо получают одним из способов:
а) разложение пентакарбонила Fe
Fe(CO) 5 = Fe + 5СО
б) восстановление водородом чистого FeO
FeO + Н 2 = Fe + Н 2 O
в) электролиз водных растворов солей Fe +2
FeC 2 O 4 = Fe + 2СO 2
оксалат железа (II)
Химические свойства
Fe - металл средней активности, проявляет общие свойства, характерные для металлов.
Уникальной особенностью является способность к «ржавлению» во влажном воздухе:
В отсутствие влаги с сухим воздухом железо начинает заметно реагировать лишь при Т > 150°С; при прокаливании образуется «железная окалина» Fe 3 O 4:
3Fe + 2O 2 = Fe 3 O 4
В воде в отсутствие кислорода железо не растворяется. При очень высокой температуре Fe реагирует с водяным паром, вытесняя из молекул воды водород:
3 Fe + 4Н 2 O(г) = 4H 2
Процесс ржавления по своему механизму является электрохимической коррозией. Продукт ржавления представлен в упрощенном виде. На самом деле образуется рыхлый слой смеси оксидов и гидроксидов переменного состава. В отличие от пленки Аl 2 О 3 , этот слой не предохраняет железо от дальнейшего разрушения.
Виды коррозии

Защита железа от коррозии

1. Взаимодействие с галогенами и серой при высокой температуре.
2Fe + 3Cl 2 = 2FeCl 3
2Fe + 3F 2 = 2FeF 3
Fe + I 2 = FeI 2
Образуются соединения, в которых преобладает ионный тип связи.
2. Взаимодействие с фосфором, углеродом, кремнием (c N 2 и Н 2 железо непосредственно не соединяется, но растворяет их).
Fe + Р = Fe x P y
Fe + C = Fe x C y
Fe + Si = Fe x Si y
Образуются вещества переменного состава, т к. бертоллиды (в соединениях преобладает ковалентный характер связи)
3. Взаимодействие с «неокисляющими» кислотами (HCl, H 2 SO 4 разб.)
Fe 0 + 2Н + → Fe 2+ + Н 2
Поскольку Fe располагается в ряду активности левее водорода (Е° Fe/Fe 2+ = -0,44В), оно способно вытеснять Н 2 из обычных кислот.
Fe + 2HCl = FeCl 2 + Н 2
Fe + H 2 SO 4 = FeSO 4 + Н 2
4. Взаимодействие с «окисляющими» кислотами (HNO 3 , H 2 SO 4 конц.)
Fe 0 - 3e - → Fe 3+
Концентрированные HNO 3 и H 2 SO 4 «пассивируют» железо, поэтому при обычной температуре металл в них не растворяется. При сильном нагревании происходит медленное растворение (без выделения Н 2).
В разб. HNO 3 железо растворяется, переходит в раствор в виде катионов Fe 3+ а анион кислоты восстанавливется до NO*:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2Н 2 O
Очень хорошо растворяется в смеси НСl и HNO 3
5. Отношение к щелочам
В водных растворах щелочей Fe не растворяется. С расплавленными щелочами реагирует только при очень высоких температурах.
6. Взаимодействие с солями менее активных металлов
Fe + CuSO 4 = FeSO 4 + Cu
Fe 0 + Cu 2+ = Fe 2+ + Cu 0
7. Взаимодействие с газообразным монооксидом углерода (t = 200°C, P)
Fe(порошок) + 5CO (г) = Fe 0 (CO) 5 пентакарбонил железа
Соединения Fe(III)
Fe 2 O 3 - оксид железа (III).
Красно-бурый порошок, н. р. в Н 2 O. В природе - «красный железняк».
Способы получения:
1) разложение гидроксида железа (III)
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
2) обжиг пирита
4FeS 2 + 11O 2 = 8SO 2 + 2Fe 2 O 3
3) разложение нитрата
Химические свойства
Fe 2 O 3 - основный оксид с признаками амфотерности.
I. Основные свойства проявляются в способности реагировать с кислотами:
Fe 2 О 3 + 6Н + = 2Fe 3+ + ЗН 2 О
Fe 2 О 3 + 6HCI = 2FeCI 3 + 3H 2 O
Fe 2 О 3 + 6HNO 3 = 2Fe(NO 3) 3 + 3H 2 O
II. Слабокислотные свойства. В водных растворах щелочей Fe 2 O 3 не растворяется, но при сплавлении с твердыми оксидами, щелочами и карбонатами происходит образование ферритов:
Fe 2 О 3 + СаО = Ca(FeО 2) 2
Fe 2 О 3 + 2NaOH = 2NaFeО 2 + H 2 O
Fe 2 О 3 + MgCO 3 = Mg(FeO 2) 2 + CO 2
III. Fe 2 О 3 - исходное сырье для получения железа в металлургии:
Fe 2 О 3 + ЗС = 2Fe + ЗСО или Fe 2 О 3 + ЗСО = 2Fe + ЗСO 2
Fe(OH) 3 - гидроксид железа (III)
Способы получения:
Получают при действии щелочей на растворимые соли Fe 3+ :
FeCl 3 + 3NaOH = Fe(OH) 3 + 3NaCl
В момент получения Fe(OH) 3 - красно-бурый слизистоаморфный осадок.
Гидроксид Fe(III) образуется также при окислении на влажном воздухе Fe и Fe(OH) 2:
4Fe + 6Н 2 O + 3O 2 = 4Fe(OH) 3
4Fe(OH) 2 + 2Н 2 O + O 2 = 4Fe(OH) 3
Гидроксид Fe(III) является конечным продуктом гидролиза солей Fe 3+ .
Химические свойства
Fe(OH) 3 - очень слабое основание (намного слабее, чем Fe(OH) 2). Проявляет заметные кислотные свойства. Таким образом, Fe(OH) 3 имеет амфотерный характер:
1) реакции с кислотами протекают легко:
2) свежий осадок Fe(OH) 3 растворяется в горячих конц. растворах КОН или NaOH с образованием гидроксокомплексов:
Fe(OH) 3 + 3КОН = K 3
В щелочном растворе Fe(OH) 3 может быть окислен до ферратов (солей не выделенной в свободном состоянии железной кислоты H 2 FeO 4):
2Fe(OH) 3 + 10КОН + 3Br 2 = 2K 2 FeO 4 + 6КВr + 8Н 2 O
Соли Fe 3+
Наиболее практически важными являются: Fe 2 (SO 4) 3 , FeCl 3 , Fe(NO 3) 3 , Fe(SCN) 3 , K 3 4- желтая кровяная соль = Fe 4 3 берлинская лазурь (темно-синий осадок)
б) Fe 3+ + 3SCN - = Fe(SCN) 3 роданид Fe(III) (р-р кроваво-красного цвета)
Железо — всем известный химический элемент. Он относится к средним по химической активности металлам. Свойства и применение железа мы рассмотрим в этой статье.
Распространенность в природе
Существует довольно большое количество минералов, в состав которых входит феррум. Прежде всего, это магнетит. Он на семьдесят два процента состоит из железа. Его химическая формула — Fe 3 O 4 . Данный минерал еще называют магнитный железняк. Он обладает светло-серым цветом, иногда с темно-серым, вплоть до черного, с металлическим блеском. Наибольшее его месторождение среди стран СНГ находится на Урале.
Следующий минерал с высоким содержанием железа — гематит — он на семьдесят процентов состоит из данного элемента. Его химическая формула — Fe 2 O 3 . Его еще называют красным железняком. Он обладает окраской от красно-коричневой до красно-серой. Наибольшее месторождение на территории стран СНГ находится в Кривом Роге.
Третий по содержанию феррума минерал — лимонит. Здесь железа шестдесят процентов от общей массы. Это кристаллогидрат, то есть в его кристаллическую решетку вплетены молекулы воды, его химическая формула — Fe 2 O 3 .H 2 O. Как понятно из названия, данный минерал имеет желто-коричневатый цвет, изредка бурый. Он является одной из главных составляющих природных охр и используется в качестве пигмента. Его также называют бурый железняк. Самые крупные места залегания — Крым, Урал.
В сидерите, так называемом шпатовом железняке, сорок восемь процентов феррума. Его химическая формула — FeCO 3 . Его структура неоднородна и состоит из соединенных вместе кристаллов разного цвета: серых, бледно-зеленых, серо-желтых, коричнево-желтых и др.
Последний часто встречающийся в природе минерал с высоким содержанием феррума — пирит. Он обладает такой химической формулой FeS 2 . Железа в нем находится сорок шесть процентов от общей массы. Благодаря атомам серы данный минерал имеет золотисто-желтую окраску.
Многие из рассмотренных минералов применяются для получения чистого железа. Кроме того, гематит используют в изготовлении украшений из натуральных камней. Вкрапления пирита могут иметься в украшениях из лазурита. Кроме этого, в природе железо встречается в составе живых организмов — оно является одним из важнейших компонентов клетки. Данный микроэлемент обязательно должен поступать в организм человека в достаточном количестве. Лечебные свойства железа во многом связаны с тем, что данный химический элемент является основой гемоглобина. Поэтому употребление феррума хорошо сказывается на состоянии крови, а следовательно, и всего организма в целом.
Железо: физические и химические свойства
Рассмотрим по порядку два этих больших раздела. железа — это его внешний вид, плотность, температура плавления и т. д. То есть все отличительные черты вещества, которые связаны с физикой. Химические свойства железа — это его способность вступать в реакцию с другими соединениями. Начнем с первых.
Физические свойства железа
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.

Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.
Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, - единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
С точки зрения химии
Данный элемент относится к металлам средней активности. Но химические свойста железа являются типичными и для всех остальных металлов (кроме тех, которые находятся правее водорода в электрохимическом ряду). Оно способно реагировать со многими классами веществ.
Начнем с простых
Феррум вступает во взаимодействие с килородом, азотом, галогенами (йодом, бромом, хлором, фтором), фосфором, карбоном. Первое, что нужно рассмотреть, - реакции с оксигеном. При сжигании феррума образуются его оксиды. В зависимости от условий проведения реакции и пропорций между двумя участниками они могут быть разнообразными. Как пример такого рода взаимодействиям можно привести следующие уравнения реакций: 2Fe + O 2 = 2FeO; 4Fe + 3O 2 = 2Fe 2 O 3 ; 3Fe + 2O 2 = Fe 3 O 4 . И свойства оксида железа (как физические, так и химические) могут быть разнообразными, в зависимости от его разновидности. Такого рода реакции происходят при высоких температурах.

Следующее — взаимодействие с азотом. Оно также может произойти только при условии нагревания. Если взять шесть молей железа и один моль азота, получим два моля нитрида железа. Уравнение реакции будет выглядеть следующим образом: 6Fe + N 2 = 2Fe 3 N.
При взаимодействии с фосфором образуется фосфид. Для проведения реакции необходимы такие компоненты: на три моля феррума - один моль фосфора, в результате образуется один моль фосфида. Уравнение можно записать следующим образом: 3Fe + P = Fe 3 P.
Кроме того, среди реакций с простыми веществами можно также выделить взаимодействие с серой. При этом можно получить сульфид. Принцип, по которому происходит процесс образования данного вещества, подобен описанным выше. А именно происходит реакция присоединения. Для всех химических взаимодействий подобного рода нужны специальные условия, в основном это высокие температуры, реже — катализаторы.
Также распространены в химической промышленности реакции между железом и галогенами. Это хлорирование, бромирование, йодирование, фторирование. Как понятно из названий самих реакций, это процесс присоединения к атомам феррума атомов хлора/брома/йода/фтора с образованием хлорида/бромида/йодида/фторида соответственно. Данные вещества широко используются в разнообразных отраслях промышленности. Кроме того, феррум способен соединяться с кремнием при высоких температурах. Благодаря тому что химические свойства железа разнообразны, его часто используют в химической отрасли промышленности.
Феррум и сложные вещества
От простых веществ перейдем к тем, молекулы которых состоят из двух и более различных химических элементов. Первое, что нужно упомянуть, - реакцию феррума с водой. Здесь проявляются основные свойства железа. При нагревании воды вместе с железом образуется (называется он так потому, что при взаимодействии с той же водой образует гидроксид, по-другому говоря — основание). Итак, если взять по одному молю обоих компонентов, образуются такие вещества, как диоксид феррума и водород в виде газа с резким запахом — также в молярных пропорциях один к одному. Уравнение такого рода реакции можно записать следующим образом: Fe + H 2 O = FeO + H 2 . В зависимости от пропорций, в которых смешать эти два компонента, можно получить ди- либо триоксид железа. Оба этих вещества очень распространены в химической промышленности, а также используются во многих других отраслях.
С кислотами и солями
Так как феррум находится левее водорода в электрохимическом ряду активности металлов, он спосособен вытеснять данный элемент из соединений. Примером этому является реакция замещения, которую можно наблюдать при добавлении железа к кислоте. Например, если смешать в одинаковых молярных пропорциях железо и сульфатную кислоту (она же серная) средней концентрации, в результате получим сульфат железа (ІІ) и водород в одинаковых молярных пропорциях. Уравнение такой реакции будет выглядеть таким образом: Fe + H 2 SO 4 = FeSO 4 + H 2 .
При взаимодействии с солями проявляются восстановительные свойства железа. То есть с помощью него можно выделить менее активный металл из соли. Например, если взять один моль и столько же феррума, то можно получить сульфат железа (ІІ) и чистую медь в одинаковых молярных пропорциях.
Значение для организма
Один из самых распространенных в земной коре химических элементов — железо. мы уже рассмотрели, теперь подойдем к нему с биологической точки зрения. Феррум выполняет очень важные функции как на клеточном уровне, так и на уровне всего организма. В первую очередь железо является основой такого белка, как гемоглобин. Он необходим для транспорта кислорода по крови от легких ко всем тканям, органам, к каждой клетке организма, в первую очередь к нейронам головного мозга. Поэтому полезные свойства железа невозможно переоценить.

Кроме того что он влияет на кровеобразование, феррум также важен для полноценного функционирования щитовидной железы (для этого нужен не только йод, как некоторые считают). Также железо принимает участие во внутриклеточном обмене веществ, регулирует иммунитет. Еще феррум в особенно большом количестве содержится в клетках печени, так как помогает нейтрализовать вредные вещества. Также он является одним из главных компонентов многих видов ферментов нашего организма. В суточном рационе человека должно содержаться от десяти до двадцати миллиграмм данного микроэлемента.
Продукты, богатые железом
Таких немало. Они есть как растительного, так и животного происхождения. Первые — это злаки, бобовые, крупы (в особенности гречка), яблоки, грибы (белые), сухофрукты, шиповник, груши, персики, авокадо, тыква, миндаль, финики, помидоры, брокколи, капуста, черника, ежевика, сельдерей и др. Вторые — печень, мясо. Употребление продуктов с высоким содержанием железа особенно важно в период беременности, так как организм формирующегося плода требует большого количества данного микроэлемента для полноценного роста и развития.
Признаки недостатка в организме железа
Симптомами слишком маленького количества феррума, поступающего в организм, являются усталость, постоянное замерзание рук и ног, депрессии, ломкость волос и ногтей, снижение интеллектуальной активности, пищеварительные расстройства, низкая работоспособность, нарушения в работе щитовидной железы. Если вы заметили несколько из этих симптомов, то стоит увеличить количество продуктов с содержанием железа в своем рационе либо купить витамины или пищевые добавки с содержанием феррума. Также обязательно нужно обратиться к врачу, если какие-либо из этих симптомов вы ощущаете слишком остро.

Использование феррума в промышленности
Применение и свойства железа тесно связаны. В связи с его ферромагнитностью, его применяют для изготовления магнитов — как более слабых для бытовых целей (сувенирные магниты на холодильник и т. д.), так и более сильных — для промышленных целей. В связи с тем что рассматриваемый металл обладает высокой прочностью и твердостью, его с древности использовали для изготовления оружия, доспехов и других военных и бытовых инструментов. К слову, еще в Древнем Египте было известно метеоритное железо, свойства которого превосходят таковые у обычного металла. Также такое особенное железо использовалось и в Древнем Риме. Из него изготавливали элитное оружие. Щит или меч, выполненный из метеоритного металла, мог иметь только очень богатый и знатный человек.

Вообще, металл, который мы рассматриваем в данной статье, является самым разносторонне используемым среди всех веществ данной группы. Прежде всего, из него изготавливаются сталь и чугун, которые применяются для производства всевозможных изделий, необходимых как в промышленности, так и в повседневной жизни.
Чугуном называется сплав железа и углерода, в котором второго присутствует от 1,7 до 4,5 процента. Если второго меньше, чем 1,7 процента, то такого рода сплав называется сталью. Если углерода в составе присутствует около 0,02 процента, то это уже обыкновенное техническое железо. Присутствие в сплаве углерода необходимо для придания ему большей прочности, термоустойчивости, стойкости к ржавлению.
Кроме того, в стали может содержаться много других химических элементов в качестве примесей. Это и марганец, и фосфор, и кремний. Также в такого рода сплав для придания ему определенных качеств могут быть добавлены хром, никель, молибден, вольфрам и многие другие химические элементы. Виды стали, в которых присутствует большое количество кремния (около четырех процентов), используются в качестве трансформаторных. Те, в составе которых много марганца (вплоть до двенадцати-четырнадцати процентов), находят свое применение при изготовлении деталей железных дорог, мельниц, дробилок и других инструментов, части которых подвержены быстрому стиранию.
Молибден вводят в состав сплава, чтобы сделать его более термоустойчивым — такие стали используются в качестве инструментальных. Кроме того, для получения всем известных и часто используемых в быту в виде ножей и других бытовых инструментов нержавеющих сталей необходимо добавление в сплав хрома, никеля и титана. А для того чтобы получить ударостойкую, высокопрочную, пластичную сталь, достаточно добавить к ней ванадий. При вводе в состав ниобия можно добиться высокой устойчивости к коррозии и воздействию химически агрессивных веществ.
Минерал магнетит, который был упомянут в начале статьи, нужен для изготовления жестких дисков, карт памяти и других устройств подобного типа. Благодаря магнитным свойствам, железо можно найти в устройстве трансформаторов, двигателей, электронных изделий и др. Кроме того, феррум могут добавлять в сплавы прочих металлов для придания им большей прочности и механической устойчивости. Сульфат данного элемента применяют в садоводстве для борьбы с вредителями (наряду с сульфатом меди).

Являются незаменимыми при очистке воды. Кроме того, порошок магнетита используется в черно-белых принтерах. Главный способ применения пирита — получение из него серной кислоты. Данный процесс происходит в лабораторных условиях в три этапа. На первой стадии пирит феррума сжигают, получая при этом оксид железа и диоксид серы. На втором этапе происходит превращение диоксида сульфура в его триоксид при участии кислорода. И на завершающей стадии полученное вещество пропускают через в присутствии катализаторов, тем самым и получая серную кислоту.
Получение железа
В основном добывают данный металл из двух основных его минералов: магнетита и гематита. Делают это с помощью восстановления железа из его соединений углеродом в виде кокса. Делается это в доменных печах, температура в которых достигает двух тысяч градусов по шкале Цельсия. Кроме того, есть способ восстановления феррума водородом. Для этого необязательно наличие доменной печи. Для осуществления данного метода берут специальную глину, смешивают ее с измельченной рудой и обрабатывают водородом в шахтной печи.
Заключение
Свойства и применение железа разнообразны. Это, пожалуй, самый важный в нашей жизни металл. Став известным человечеству, он занял место бронзы, которая на тот момент была основным материалом для изготовления всех орудий труда, а также оружия. Сталь и чугун во многом превосходят сплав меди с оловом с точки зрения своих физических свойств, устойчивости к механическим воздействиям.
Кроме того, железо на нашей планете более распространено, чем многие другие металлы. его в земной коре составляет почти пять процентов. Это четвертый по распространенности в природе химический элемент. Также данный химический элемент очень важен для нормального функционирования организма животных и растений, прежде всего потому, что на его основе построен гемоглобин. Железо является важнейшим микроэлементом, употребление которого важно для поддержания здоровья и нормальной работы органов. Кроме вышеперечисленного, это единственный металл, который обладает уникальными магнитными свойствами. Без феррума невозможно представить нашу жизнь.
- Обозначение - Fe (Iron);
- Период - IV;
- Группа - 8 (VIII);
- Атомная масса - 55,845;
- Атомный номер - 26;
- Радиус атома = 126 пм;
- Ковалентный радиус = 117 пм;
- Распределение электронов - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 ;
- t плавления = 1535°C;
- t кипения = 2750°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,83/1,64;
- Степень окисления: +8, +6, +4, +3, +2, +1, 0;
- Плотность (н. у.) = 7,874 г/см 3 ;
- Молярный объем = 7,1 см 3 /моль.
Соединения железа :
Железо является самым распространенным металлом в земной коре (5,1% по массе) после алюминия .
На Земле железо в свободном состоянии встречается в незначительных количествах в виде самородков, а также в упавших метеоритах.
Промышленным способом железо добывают на железнорудных месторождениях, из железосодержащих минералов: магнитного, красного, бурого железняка.
Следует сказать, что железо входит в состав многих природных минералов, обуславливая их природную окраску. Окраска минералов зависит зависит от концентрации и соотношения ионов железа Fe 2+ /Fe 3+ , а также от атомов, окружающих эти ионы. Например, присутствие примесей ионов железа влияет на окраску многих драгоценных и полудрагоценных камней: топазов (от бледно-желтого до красного), сапфиров (от голубого до темно-синего), аквамаринов (от светло-голубого до зеленовато-голубого) и проч.
Железо содержится в тканях животных и растений, например, в организме взрослого человека присутствует около 5 г железа. Железо является жизненно важным элементом, оно входит в состав белка гемоглобина, участвуя в транспортировке кислорода от легких к тканям и клеткам. При недостатке железа в организме человека развивается малокровие (железодефицитная анемия).

Рис. Строение атома железа
.
Электронная конфигурация атома железа - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +8, +6, +4, +3, +2, +1, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью.

Рис. Степени окисления железа: +2, +3.
Физические свойства железа:
- металл серебристо-белого цвета;
- в чистом виде достаточно мягкий и пластичный;
- хобладает хорошей тепло- и электропроводимостью.
Железо существует в виде четырех модификаций (различаются строением кристаллической решетки): α-железо; β-железо; γ-железо; δ-железо.
Химические свойства железа
- реагирует с кислородом, в зависимости от температуры и концентрации кислорода могут образовываться различные продукты или смесь продуктов окисления железа (FeO, Fe 2 O 3 , Fe 3 O 4):
3Fe + 2O 2 = Fe 3 O 4 ; - окисление железа при низких температурах:
4Fe + 3O 2 = 2Fe 2 O 3 ; - реагирует с водяным паром:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2 ; - мелко раздробленное железо реагирует при нагревании с серой и хлором (сульфид и хлорид железа):
Fe + S = FeS; 2Fe + 3Cl 2 = 2FeCl 3 ; - при высоких температурах реагирует с кремнием, углеродом, фосфором:
3Fe + C = Fe 3 C; - с другими металлами и с неметаллами железо может образовывать сплавы;
- железо вытесняет менее активные металлы из их солей:
Fe + CuCl 2 = FeCl 2 + Cu; - с разбавленными кислотами железо выступает в роли восстановителя, образуя соли:
Fe + 2HCl = FeCl 2 + H 2 ; - с разбавленной азотной кислотой железо образует различные продукты восстановления кислоты, в зависимости от ее концентрации (N 2 , N 2 O, NO 2).
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун - это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).

Рис. Доменная печь
.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.

Рис. Процесс выплавки чугуна в доменной печи
.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C - 3Fe 2 O 3 + CO = 2Fe 3 O 4 + CO 2 ;
- 600°C - Fe 3 O 4 + CO = 3FeO + CO 2 ;
- 800°C - FeO + CO = Fe + CO 2 ;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
- параллельно идет процесс восстановления оксидов кремния и марганца (входят в железную руду в виде примесей), кремний и марганец входят в состав выплавляющегося чугуна:
- SiO 2 + 2C = Si + 2CO;
- Mn 2 O 3 + 3C = 2Mn + 3CO.
- при термическом разложении известняка (вносится в доменную печь) образуется оксид кальция, который реагирует с оксидами кремния и алюминия, содержащихся в руде:
- CaCO 3 = CaO + CO 2 ;
- CaO + SiO 2 = CaSiO 3 ;
- CaO + Al 2 O 3 = Ca(AlO 2) 2 .
- при 1100°C процесс восстановления железа прекращается;
- ниже шахты располагается распар, самая широкая часть доменной печи, ниже которой следует заплечник, в котором выгорает кокс и образуются жидкие продукты плавки - чугун и шлаки, накапливающиеся в самом низу печи - горне;
- в верхней части горна при температуре 1500°C в струе вдуваемого воздуха происходит интенсивное сгорание кокса: C + O 2 = CO 2 ;
- проходя через раскаленный кокс, оксид углерода (IV) превращается в оксид углерода (II), являющийся восстановителем железа (см. выше): CO 2 + C = 2CO;
- шлаки, образованные силикатами и алюмосиликатами кальция, располагаются выше чугуна, защищая его от действия кислорода;
- через специальные отверстия, расположенные на разных уровнях горна, чугун и шлаки выпускаются наружу;
- бОльшая часть чугуна идет на дальнейшую переработку - выплавку стали.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
Железо в чистом виде получают различными методами: электролизом водных растворов его солей, термическим разложение в вакууме пентокарбонила Ж. и др.Технически чистое железо – “Армко железо”,”Вит” и др. марки производят в мартеновских печах. В Табл.2 приводится содержание примесей в нек. марках железа., полуаемых приведенными выше методами. Все эти методы за исключением мартеновского весьма дороги.
Основным промышленным методом получения Ж. служит производство его в виде различных сплавов с углеродом – чугунов и углеродистых сталей. При восстановлении железа в доменных печах образуется чугун, в машиностроении используют в основном сталь. Чугуны получают доменным процессом.
Химизм доменного процесса следующий:
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
Чугуны по назначению разделяются на передельный и литеный.Передельный чугун – идет на дальнейшую переработку в углеродистые и др. стали. Литейный – для производства чугунных отливок. Хромисто – никилевые чугуны для дальнейшего извлечения из них никеля либо изготовления малолигированных никелевых и хромо – никелевых сталей.
Мартеновкий, конверторный и электроплавильный сводятся к удалению избыточного углерода и вредных рпимесей путем их выжигания и к доводке содержания лигирующих элементов до заданного.
Максимальное содержание углерода в чугуне 4,4%, кремния 1,75%, марганца 1,75%, фосфора 0,30%, серы 0,07%. В сталеплавильной печи содержание углерода, кремния и марганца нужно понизить до десятых долей процента. Передел чугуна осуществляется посредством реакций окисления, проводимых при высоких температурах.Железо, содержание которого в чугуне значительно выше, чем других веществ, частично окисляется:
2Fe + O2 = 2FeO + Q
Оксид железа (II), перемешиваясь с расплавом, окисляет кремний, марганец фосфор и углерод:
Si + 2FeO = SiO2 + 2Fe + Q
Mn + FeO = MnO + Fe + Q
2P + 5FeO = P2O5 + 5Fe + Q
C + FeO = CO + Fe – Q
После завершения окислительных реакций в сплаве содержится оксид железа (II) от которого необходимо избавиться. Кроме того, нужно довести до установленных норм содержание в стали углерода, кремния и марганца.Этого достигают добавляя раскислители, например ферромарганец. Марганец реагирует с оксидом железа (II):
Mn + FeO = MnO + Fe
Углероистые стали классифицируются след. образом:
основная мартеновская сталь
кислая мартеновская сталь
конверторная сталь
электросталь
Сжность металлургич процесса получения Ж. и сталей, включая доменный процесс и передел чугуна, является причиной постоянного развития и совершенствования метода прямого получения Ж. из железных руд.
Синтез 2,2-диэтоксииндандиона
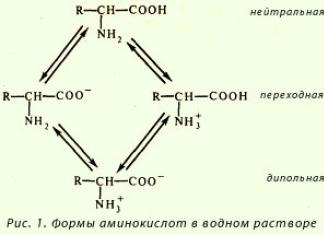
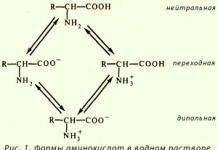
Аминокислоты, пептиды
и протеины, или белки образуют группу химически и биологически родственных
соединений, которым принадлежит очень важная роль в жизненных процессах. При
полном гидролиз...