Контрольная работа по теме:
«Происхождение жизни на Земле»
Вариант 1
Часть А
1.
б) наличием катализаторов;
г) обменными процессами.
2.
а) анаэробные гетеротрофы;
б) аэробные гетеротрофы;
в) автотрофы;
г) организмы-симбионты.
3. К такому общему свойству живого, как саморегуляция, относится:
а) наследственность;
б) изменчивость;
в) раздражимость;
г) онтогенез.
4. Сущность теории абиогенеза состоит в:
в) сотворении мира Богом;
5. Кристалл не является живой системой, т.к.:
а) он не способен к росту;
в) ему не свойственна раздражимость;
6. Опыты Луи Пастера доказали возможность:
а) самозарождения жизни;
г) биохимической эволюции.
7.
а) радиоактивность;
б) наличие жидкой воды;
в) наличие газообразного кислорода;
г) масса планеты.
8. Углерод является основой жизни на Земле, т.к. он:
9. Исключите лишнее:
а) 1668 г.;
б) Ф.Реди;
в) мясо;
г) бактерии.
10.
а) Л.Пастер;
б) А.Левенгук;
в) Л.Спалланцани;
г) Ф.Реди.
Часть Б
Закончите предложения.
1. Теория, постулирующая сотворение мира Богом (Творцом), – … .
2. Доядерные организмы, не имеющие ограниченного оболочкой ядра и органоидов, способных к самовоспроизведению, – … .
3. Фазовообособленная система, взаимодействующая с внешней средой по типу открытой системы, – … .
4. Советский ученый, предложивший коацерватную теорию происхождения жизни, – … .
5. Процесс, в результате которого организм приобретает новую комбинацию генов, – … .
Часть В
Дайте краткие ответы на следующие вопросы.
1. Каковы общие признаки живой и неживой материи?
2. Почему при возникновении первых живых организмов в атмосфере Земли должен был отсутствовать кислород?
3. В чем состоял опыт Стенли Миллера? Что соответствовало «первичному океану» в этом опыте?
4. В чем заключается основная проблема перехода от химической эволюции к биологической?
5. Перечислите основные положения теории А.И. Опарина.
Вариант 2
Часть А
Выпишите номера вопросов, рядом с ними запишите буквы правильных ответов.
1. Живое отличается от неживого:
а) составом неорганических соединений;
в) взаимодействием молекул друг с другом;
г) обменными процессами.
2. Первыми живыми организмами на нашей планете были:
а) анаэробные гетеротрофы;
б) аэробные гетеротрофы;
в) автотрофы;
г) организмы-симбионты.
3.
а) метаболизм;
б) репродукция;
в) раздражимость;
г) онтогенез.
4. Сущность теории биогенеза состоит в:
а) происхождении живого из неживого;
б) происхождении живого от живого;
в) сотворении мира Богом;
г) занесении жизни из Космоса.
5. Звезда не является живой системой, т.к.:
а) она не способна к росту;
в) она не обладает раздражимостью;
6.
а) самозарождения жизни;
б) появления живого только из живого;
в) занесения «семян жизни» из Космоса;
г) биохимической эволюции.
7. Из перечисленных условий наиболее важным для возникновения жизни является:
а) радиоактивность;
б) наличие воды;
в) наличие источника энергии;
г) масса планеты.
8. Вода является основой жизни, т.к.:
а) является хорошим растворителем;
г) обладает всеми перечисленными свойствами.
9. Исключите лишнее:
а) 1924 г.;
б) Л.Пастер;
в) мясной бульон;
г) бактерии.
10. Расположите в логической последовательности следующие имена:
а) Л.Пастер;
б) С.Миллер;
в) Дж.Холдейн;
г) А.И. Опарин.
Часть Б
Закончите предложения.
1. Процесс образования живыми организмами органических молекул из неорганических за счет энергии солнечного света – … .
2. Доклеточные образования, обладавшие некоторыми свойствами клеток (способность к обмену веществ, самовоспроизведению и т.п.), – … .
3. Разделение раствора белков, содержащего и другие органические вещества, на фазы с большей или меньшей концентрацией молекул – … .
4. Английский физик, предположивший, что адсорбция была одним из этапов концентрирования органических веществ в ходе предбиологической эволюции – … .
5. Свойственная всем живым организмам система записи наследственной информации в молекулах ДНК в виде последовательности нуклеотидов – … .
Часть В
1. В чем состоял опыт Стенли Миллера? Что соответствовало «молниям» в этом опыте?
2. Почему масса планеты, на которой может возникнуть жизнь, не должна быть больше 1/20 массы Солнца?
3. К какой стадии развития жизни на Земле можно отнести слова гоголевского героя: «Числа не помню. Месяца тоже не было. Было черт знает что такое»?
4. Какие условия необходимы для возникновения жизни?
5. Что такое панспермия? Кто из известных вам ученых придерживался этой теории?
Вариант 3
Часть А
Выпишите номера вопросов, рядом с ними запишите буквы правильных ответов.
1. Живое отличается от неживого:
а) составом неорганических соединений;
б) способностью к самовоспроизведению;
в) взаимодействием молекул друг с другом;
г) обменными процессами.
2. Первыми живыми организмами на нашей планете были:
а) анаэробные гетеротрофы;
б) аэробные гетеротрофы;
в) автотрофы;
г) организмы-симбионты.
3. К такому общему свойству живого как, самообновление, относится:
а) метаболизм;
б) репродукция;
в) раздражимость;
г) онтогенез.
4. Сущность креационизма состоит в:
а) происхождении живого из неживого;
б) происхождении живого от живого;
в) сотворении мира Богом;
г) занесении жизни из Космоса.
5. Река не является живой системой т.к.:
а) она не способна к росту;
б) она не способна к размножению;
в) она не способна к раздражимости;
г) не все свойства живого ей присущи.
6. Опыт Франческо Реди доказал невозможность:
а) самозарождения жизни;
б) появления живого только из живого;
в) занесения «семян жизни» из космоса;
г) биохимической эволюции.
7. Из перечисленных условий наиболее важным для возникновения жизни является:
а) радиоактивность;
б) наличие воды;
в) безгранично долгое время эволюции;
8. В период возникновения жизни в атмосфере Земли должен был отсутствовать кислород, т.к.:
а) он является активным окислителем;
б) обладает высокой теплоемкостью;
в) увеличивает свой объем при замерзании;
г) все вышеперечисленное в комплексе.
9. Исключите лишнее:
а) 1953 г.;
б) бактерии;
в) С.Миллер;
г) абиогенный синтез.
10. Расположите в логической последовательности следующие фамилии:
а) Л.Пастер;
б) Ф.Реди;
в) Л.Спалланцани;
г) А.И. Опарин.
Часть Б
Закончите предложения.
1. Образование органических молекул из неорганических вне живых организмов – … .
2. Пузырьки жидкости, окруженные белковыми пленками, возникающие при взбалтывании водных растворов белков, – … .
3. Способность воспроизводить себе подобные биологические системы, которая проявляется на всех уровнях организации живой материи, – … .
4. Американский ученый, предложивший термическую теорию происхождения протобиополимеров, – … .
5. Белковые молекулы, ускоряющие течение биохимических превращений в водных растворах при атмосферном давлении, – … .
Часть В
Дайте краткий ответ на поставленный вопрос.
1. В чем основное отличие горения дров от «горения» глюкозы в клетках?
2. Каковы три современные точки зрения на проблему происхождения жизни?
3. Почему именно углерод является основой жизни?
4. В чем состоял опыт Стенли Миллера?
5. Каковы основные этапы химической эволюции?
Вариант 4
Часть А
Выпишите номера вопросов, рядом с ними запишите буквы правильных ответов.
1. Живое отличается от неживого:
а) составом неорганических соединений;
б) способностью к саморегуляции;
в) взаимодействием молекул друг с другом;
г) обменными процессами.
2. Первыми живыми организмами на нашей планете были:
а) анаэробные гетеротрофы;
б) аэробные гетеротрофы;
в) автотрофы;
г) организмы-симбионты.
3. К такому общему свойству живого, как самовоспроизведение, относится:
а) метаболизм;
б) репродукция;
в) раздражимость;
г) онтогенез.
4. Сущность теории панспермии состоит в:
а) происхождении живого из неживого;
б) происхождении живого от живого;
в) сотворении мира Богом;
г) занесении на Землю «семян жизни» из Космоса.
5. Ледник не является живой системой т.к.:
а) он не способен к росту;
б) он не способен к размножению;
в) он не способен к раздражимости;
г) не все свойства живого ему присущи.
6. Опыт Л.Спалланцани доказал невозможность:
а) самозарождения жизни;
б) появления живого только из живого;
в) занесения «семян жизни» из Космоса;
г) биохимической эволюции.
7. Из перечисленных условий наиболее важным для возникновения жизни является:
а) радиоактивность;
б) наличие воды;
в) наличие определенных веществ;
г) определенная масса планеты.
8. Углерод является основой жизни, т.к. он:
а) является самым распространенным на Земле элементом;
б) первым из химических элементов стал взаимодействовать с водой;
в) имеет небольшой атомный вес;
г) способен образовывать устойчивые соединения с двойными и тройными связями.
Продолжение следует
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей
. Высаливание. Различные белки выпадают в осадок при разной концентрации соли в растворе. Постепенно повышая ее концентрацию, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольшой концентрации солей.
5 Гель-фильтрация - метод молекулярного просеивания молекул через набухшие гранулы сефа-декса (трехмерные полисахаридные цепи декстра-на, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируются с колонки.
Ультрацентрифугирование - метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжелые белки образуют фракции, расположенные ближе ко дну кюветы, более легкие - к поверхности.
Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных нерастворимых полимеров. Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть возрастающими концентрациями NaCl; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, прикрепленный к ионогенным группам смолы. Аффинная хроматография - наиболее специфический метод выделения индивидуальных белков. К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок.
Электрофорез белков
Метод основан на том, что при определённом значении рН и ионной силы раствора бел-
ки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-).
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду,в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, а,-глобулины, а2-глобулины, в-глобулины и у-глобулины Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
3) Хроматография. Принцип основан на способности веществ специфически адсорбироваться на адсорбенте, заключенном в колонке.
Ионообменная хроматография
метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий.
В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы.
Различают положительно заряженные анио-нообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу, и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу содержащую анионные группы.
Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионооб-менник. При пропускании раствора белка через колонку прочность связывания белка с анионо-обменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионообменнике, можно смыть буферными растворами с различной концентрацией соли, и разными значениями рН. Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли -СМЫВАются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок.
Классификация аминокислот
Строение пептида
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками..
Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную -карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название «пептидный остов» (
Пептиды различаются по аминокислотному составу, количеству и порядку аминокислот.
2. Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу
Связь между углеродным атомом и аминогруппой или а-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. -углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, В живых организмах пептидные связи в белках разрываются с помощью специальных про-теолитических ферментов Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию
7. Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Методы изучения первичной структуры белка.
Кислотный гидролиз белка
Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в течение 24 ч. В результате разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты
Разделение аминокислот с помощью ионообменной хроматографии Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой.
Количественный анализ полученных фракций. нагреваютотдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты.
2. Определение аминокислотной
последовательности в белке
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная?-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного?-складчатог
9. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. В стабилизации третичной структуры белка принимают участие:
ковалентные связи (между двумя остатками цистеина - дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Связь с первичной структурой. Третичная структура в значительной степени предопределена первичной структурой. Усилия по предсказанию третичной структуры белка основываясь на первичной структуре известна как задача предсказания структуры белка. Однако, окружающая среда, в которой белок сворачивается существенно определяет конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом включают окружающую среду косвенно.Супервторичная структура белков. сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков.она формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания а-спиралей и б-структур часто обозначают как "структурные мотивы".
В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль - в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК
3. Супервторичная структурав виде "цинкового пальца"
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. "Цинковый палец" - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя - гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина
4. Супервторичная структура
в виде "лейциновой застёжки-молнии"
Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых "лейциновая застёжка-молния".
10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами.Цепи белков соединенные ковалентными связями (например дисульфидными)поэтому инсулин мономерный белок.
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров.
Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β - цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Активные центры возникают при образовании четвертичной структуры.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Альфа спирали в протомере обозначают латинскими буквами от A до H,начиная с N конца
Кооперативные изменения конформациипротомеров.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода.Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой.
Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров.
Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
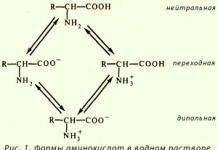
Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО –) и основные (NH 3 +) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н + при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез ) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативнойконформации.
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н + . При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н + присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н + снижается и положительно заряженные группы белка (NH 3 + -группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость . Так как большинство белков несет много заряженных групп, то в целом они водорастворимы . Растворимость объясняется:
- наличием заряда и взаимоотталкиванием заряженных молекул белка,
- наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды


Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов - свинца или ртути.
РЕНАТУРА́ЦИЯ - процесс восстановления структурной организации биополимера (белковой молекулы или молекул нуклеиновых кислот). Ренатурация возможна только при обратимой денатурации. Ренатурация лежит в основе многих биологических механизмов.
Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Ренатурация возможна только если затронута третичная или вторичная структура. При этом восстанавливаются функции данного белка.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности,гидрофобны взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Вызывать денатурацию белков могут разнообразные факторы , перечисленные ниже.
Нагревание или излучение белка , например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует).
Сильные кислоты, щелочи, соли денатурируют белок . Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы денатурируют белок . Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты денатурируют белок . Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
13.Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы.
К свойствам белковых растворов относятся:
1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция . Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля).
2. Белковые растворы в отличие от истинных обладают малой скоростьюдиффузии .
3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе . Очистка белковых препаратов от посторонних примесей лежит в основе работы "искусственной почки " при лечении острой почечной недостаточности.
4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки.
5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней.
Главными факторами устойчивости белка в растворе служат заряд молекулы и гидратная оболочка.
Общий поверхностный заряд белковой молекулы при растворении в воде определяется суммой зарядов отдельных аминокислотных остатков, из которых построен белок. Если в составе протеина преобладают "щелочные" аминокислоты (аргинин, лизин), то молекула в целом заряжается по-ложительно; при преобладании дикарбоновых аминокислот - отрицательно. Одноименно заряженные белковые молекулы в растворе отталкиваются друг от друга, что препятствует их осаждению.
Важной особенностью белка является способность менять величину и даже знак заряда при изменении рН среды, что связано с обратимостью диссоциации ионогенных групп в аминокислотных остатках (см. выше). Так, при добавлении кислоты к раствору белка часть СОО^-групп, связывая избыток протонов, рекомбинирует до СООН-групп; при этом их отрицательные заряды исчезают, а все положительные заряды сохраняются. Это ведет к сдвигу общего заряда белка в положительную сторону.
Для каждого белка можно подобрать такое значение рН среды, при котором количество положительных зарядов в молекуле сравняется с количеством отрицательных, а их алгебраическая сумма будет равна нулю. Это значение рН (не обязательно нейтральное!) называется изоэлектриче-ской точкой белка (ИЭТ). При сдвиге рН в кислую или щелочную сторону
Рис. 2.4. Изменение заряда белковой молекулы при сдвигах рН среды
С локальными поверхностными зарядами белка связано наличие гидратной оболочки: молекулы-диполи воды "облепляют" белок в один или несколько слоев в зависимости от величины заряда. Одно из основных качеств гидратной оболочки - упругость; при столкновении гидратирован-ных молекул белка в растворе они не слипаются, а отскакивают друг от друга, что препятствует их выпадению в осадок. Для осаждения белков нужно нейтрализовать заряд молекулы, доведя рН среды до ИЭТ, и "снять" гидратную оболочку действием концентрированных растворов солей (высаливание) или спирта.
Реакции осаждения белков
Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Обратимое осаждение. Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Высаливание
.
Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция.
Сущность реакции заключается в дегидратации молекул белка.
Реактивы:
1) неразведенный яичный белок;
2) насыщенный раствор сульфата аммония;
3) NaOH, 10% раствор,
4) CuSO4, 1% раствор;
5) дистиллированная вода;
6) сульфат аммония в порошке.
Необратимое осаждение белков .
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором - отрицательный заряд, что повышает их устойчивость в растворе.
Реактивы:
1) яичный белок, 1% раствор;
2) уксусная кислота, 1% и 10% растворы;
3) NaOH, 10% раствор.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.

Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О 2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О 2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер 177 , Гис 40 , Асп 85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
- Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
- существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
- существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О 2 , транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.

Рис. 1-26. Связывание гексокиназы с глюкозой.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
· Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением.
Анализ и выделение пептидов (белков)1.
Препаративное разделение – выделение одного или нескольких
компонентов смеси в индивидуальном состоянии
2.
Аналитическое разделение – идентификация и количественное
определение компонентов в смеси (в том числе химическая и
стереохимическая чистота)
Аналитическое разделение может предшествовать препаративному
с целью выбора метода разделения и определения его оптимальных
условий.
Методы разделения
1. Обращенно-фазная высокоэффективная жидкостная хроматография- используется для разделения белков и пептидов, наиболее популярный
вариант ВЭЖХ
2. Ионообменная хроматография – один широко используемых в практике
методов выделения
3. Гель-проникающая хроматография (гель фильтрация) – разделение на
основе молекулярной массы
4. Аффинная хроматография – разделение с использованием
биоспецифических лигандов
5. Электрофорез – разделение белков и пептидов на основе различной
подвижности в электрическом поле
6. Многомерное разделение – 2D-электрофорез и многомерная
хроматография наиболее скрупулезный метод анализа
Чем белки (пептиды) отличаются друг от друга?
СвойствоРазличия
Метод разделения
Аминокислотный
состав
Заряженность
молекулы
Гидрофобность
Ионообменная хроматография
Капиллярный электрофорез
Гидрофобная хроматография
Специфичекие
сайты
связывания
Аффинность к другим
молекулам
Аффинная хроматография
Количество АКостатков
Размер
Гель-проникающая
хроматография
Гель-электрофорез
Принципиальная схема колоночной хроматографии
1.2.
3.
4.
Уравновешивание
Нанесение образца
и промывка
Элюция
Регенерация
Ионнообменная хроматография
Принцип – взаимодействие зарядов белка (пептида) сзаряженными группами на поверхности носителя.
Носитель:
Для небольших пептидов проводят хроматографирование на
полимерных катионитах (сульфированный сополимер
стирола и дивинилбензола) или анионитах (-N+R3)
Для выделения крупных пептидов (белков) используют носители
(целлюлоза, декстран, агароза) способные набухать в водной
среде, тем самым обеспечивать лучшие условия
проницаемости крупных молекул по сравнению со смолами на
основе полистирола.
Ионнообменная хроматография на СМ-целлюлозе
Гидрофобная хроматография
Принцип – взаимодействие гидрофобных групп носителя сгидрофобными областями (АК) пептида (белка)
Носитель: силикагель с привитыми гидрофобными цепями
(или группами)
-
Идеален для разделения смесей небольших пептидов
(например после ферментативного расщепления)
Высокая скорость разделения
Воспроизводимость
Высокая чувствительность (небольшие количества)
Афинная хроматография
Задача – выделить белок (пептид) с низким содержанием в смеси (клеточный экстракт,биологические жидкости)
Принцип – биоспецифическое связывание (сродство) лиганда и белка
Носитель: инертный пористый материал (агароза, полиакриламид, кросс-сшитый
декстран, стеклянные шарики), к которому ковалентно через спейсер присоединен
лиганд.
Лиганд (моноспецифический): гормоны (рецепторы), ингибиторы ферментов или
аналоги ферментных субстратов (ферменты), антитела (антигены), белки
(рекомбинантные белки), лектины (гликопротеины), фосфорилхолин (Среактивный белок).
Афинная хроматография С-реактивного белка
В ответ на инфекцию или повреждение тканей резкоувеличивается концентрация некоторых белков
плазмы крови, имеющих общее название "белки
острой фазы". К этим белкам относится и Cреактивный белок (CRP , от англ. C-reactive
protein). С-реактивный белок появляется в
сыворотке вскоре после повреждения тканей и
начала воспаления.
CRP человека состоит из пяти идентичных,
нековалентно связанных полипептидных цепей,
образующих замкнутый пентамер. Важное
свойство CRP - способность связываться с
фосфорилхолином.
фосфорилхолин
O
O
O
H
P
O
O
N
Me
Me
Me
O
NH2
N
O
H
P
O
O
N
Me
Me
Me
Биоспецифический сорбент
Гель-хроматография (гель-фильтрация)
Принцип – разделение по молекулярной массе белков(пептидов)
Носитель: гидрофильные декстраны с поперчными
сшивками (сефадексы) и полиакриламидные гели
(биогели), которые различаются размером гранул и
частотой поперечных сшивок. Выбор носителя
определяется молкулярной массой разделяемых
пептидов (белков)
Недостаток – невозможно разделить молекулы с близкими
массами!!!
Электорофорез
Электрофорез белков - способ разделения смеси белков на фракции или индивидуальныебелки.
Электрофорез белков применяют как для анализа компонентов смеси белков, так и для
получения гомогенного белка.
Проблема: электрофоретическая подвижность зависит от заряда белка и его молекулярной
массы (пространственной конфигурации)
Наиболее распространенным вариантом электрофоретического анализа белков, является
электрофорез белков в полиакриламидном геле в присутствии додецилсульфата натрия (SDSPAGE, 1970 году Лэммли (U. K. Laemmli)).
SDS
1. белки после обработки SDS находятся в полностью
денатурированном состоянии;
2. количество молекул SDS, связанных с полипептидом,
пропорционально его длине, и, следовательно, молекулярной
массе;
3. собственный заряд полипептида несущественен в сравнении с
зарядом связанного с ним SDS.
4. Полипептиды имеют одинаковый удельный заряд и
разделяются обратно пропорционально логарифму их
молекулярной массы.
Для визуализации результатов электрофореза чаще всего используют окрашивание гелей
красителем Кумасси (Coomassie blue) или серебром
2-D электрофорез
Разделениепо заряду
Разделение
по размеру
(SDS PAGE)
Двумерный электрофорез (2-DE 2-D электрофорез) используется для анализа белковых молекул.
Смесь белков разделяется в двух направлениях по 2 различным свойствам. К таким свойствам
относятся – изоэлектрическая точка, масса белка в нативном и денатурированном
состоянии.
Двумерный электрофорез начинается с одномерного, а затем разделенные молекулу подвергаются
второму разделению в направлении 90 градусов по направлению к первому форезу.
Мало вероятно что 2 молекулы будут обладать двумя одинаковыми индивидуальными свойствами,
поэтому белки более эффективно разделяются 2-D электрофорезом, чем обычным
электрофорезом.
Изоэлектрическая точка (IEP) – значение рН при котором молекула не заряжена (нейтральна).
1. Разделение по изоэлектрической точке
Разделение белков (пептидов) по IEP называется изоэлектрическое фокусирование (IEF). Белки
распределяются по гелю в первом направлении и «накапливаются в изоэлектрической точке
(заряд белка нейтральный)
2. Разделение по массе
Используется стандартный SDS-электрофорез в направлении перпендикулярном первому.
Хемоспецифическая хроматография
S-S-HS-
Задача – селективное выделение из смеси
пептидов, содержащих определенные
функцианальные группы (чаще всего SH)
Принцип – образование ковалентной связи между
пептидом и носителем
S-S
Носитель: сефароза, пористое стекло, кремнезем,
содержащие дисульфидную группировку
S-S
S-S
S
S
-SH
Отделение белков от низкомолекулярных примесей
Метод мембранных сит (диализ)
Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей.
Разделение белков по молекулярной массе
Гель-хроматография
Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование
Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).
Электрофорез

Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда.
Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).

ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
1. Всем больным с подозрением на кардиогенный шок проводят катетеризацию легочной артерии, используя вены шеи, предплечья, бедра.
Давление заклинивания в легочной артерии (которое может быть приравнено к диастолическому давлению в легочной артерии при отсутствии выраженного обструктивного заболевания легких) должно быть в пределах 15-18 мм рт. ст. или выше.
Если давление заклинивания в легочной артерии ниже, то организм или обезвожен (например, вследствие массивного применения диуретиков), или же у него развился синдром брадикардии-гипотензии (рефлекс Бецольда-Яриша), часто отмечаемый при нижнем инфаркте миокарда.
В таких случаях внутривенно вводят либо изотонический раствор натрия хлорида, альбумин, плазму, либо низкомолекулярный декстран до тех пор, пока давление заклинивания в легочной артерии не достигнет уровня 18 мм рт. ст.
Действие изотонического раствора натрия хлорида и глюкозы непродолжительно, так как эти вещества легко проходят через капиллярные мембраны, покидая таким образом циркуляторное русло.
При выраженной брадикардии можно применять внутривенно атропина сульфат или электрокардиостимуляцию.
2. У всех больных с подозрением на кардиогенный шок давление мониторируют прямым (инвазивным) способом, причем катетер по возможности подводят максимально близко к аорте.
Определение давления в периферической артерии (например, в лучевой) может давать неправильные результаты.
Предпочтительнее применять относительно длинные катетеры, вводимые через лучевую, плечевую или бедренную артерии.
Через катетеры в периферической и легочной артериях постоянно медленно вводят раствор гепарина (1 ЕД/мл в 5% растворе глюкозы или изотоническом растворе натрия хлорида). Для измерения диуреза в мочевой пузырь вводят катетер Фолея.
3. Пока больному устанавливают катетер в периферическую и легочную артерию для оценки тяжести шока и измерения давления заклинивания в легочной артерии.
АД следует поддерживать дофамином, добутамином, норадреналином, амриноном или различными комбинациями этих препаратов (например, дофамин + добутамин).
Если в дальнейшем у больного обнаружится гиповолемия (по данным катетеризации легочной артерии), то инфузию вазопрессорных аминов постепенно прекращают и начинают проводить замещение ОЦК.
4. Лечение больных, у которых диагноз кардиогенного шока подтвержден данными инвазивного измерения АД и соответствующей клинической картиной, состоит в следующем:
а) начинают инфузию дофамина (3-5 мкг/кг в 1 мин) или добутамина (3-10 мкг/кг в 1 мин). Если эффект недостаточен, дозу увеличивают до 20-50 мкг/кг в 1 мин (для дофамина) или до 20-40 мкг/кг в 1 мин (для добутамина).
Если и эта доза недостаточна, пробуют вводить оба препарата одновременно или к одному из препаратов присоединяют инфузию норадреналина со скоростью 2-8 мкг/ кг в 1 мин.
Изопротеренол при кардиогенном шоке противопоказан.
Для больного с умеренной артериальной гипотензией (систолическое АД 80-90 мм рт. ст.) бывает достаточно введения добутамина.
При более выраженном снижении АД назначают дофамин или норадреналин;
б) больного быстро доставляют в лабораторию ангиографии и предпринимают попытку устранить окклюзию коронарной артерии с помощью баллонной ангиопластики;
в) мобилизуют группу контрпульсации (внутриаортальной или наружной); больного консультирует кардиолог (если это не сделано ранее), а руководителя блока интенсивной терапии ставят в известность о наличии больного, находящегося в состоянии кардиогенного шока.
5. При кардиогенном шоке часто оказывается эффективной внутриаортальная или наружная контрпульсация.
Некоторым больным показано неотложное коронарное шунтирование.
Самые тяжелые больные с признаками кардиогенного шока или те из них, состояние которых не улучшилось в течение 24-48 ч от начала контрпульсации и проведения коронарной баллонной ангиопластики, должны быть направлены на оперативное лечение.
Состояние больных, находящихся в состоянии кардиогенного шока, вызванного механическими осложнениями острого инфаркта миокарда (митральная регургитация или разрыв межжелудочковой перегородки), нередко улучшается после хирургического вмешательства.
Больным с диффузной гипокинезией и акинезией левого желудочка, но без механических осложнений инфаркта миокарда операция коронарного шунтирования, как правило, не показана, но баллонная ангиопластика у них часто бывает эффективной.
Коронарную баллонную ангиопластику проводят в ангиографической лаборатории на фоне контрпульсации.
Затем больного возвращают в блок интенсивной терапии или же перевозят в операционную.
Если решено производить катетеризацию, то исследования должны быть выполнены как можно раньше.
Классификация липидов, их химические св-ва и биологические ф-ии. Липиды- это гетерогенная многочисленная группа органических соединений со сходными физико-химическими свойствами и структурой. По химич. строению они делятся на: простые липиды (Эфиры жир. Кислот и спиртов); конъюгированные (сложные) и производные липидов (вит. D, Е и К). Простые липиды делятся на: 1. Жиры, 2. Масла(эфиры жир. кислот и глицерола); 3. Воска (эфиры жир. кислот с длинноцепочечными алифатическими спиртами). Конъюгированные липиды делятся на:1. Фосфолипиды (фосфатидные кислоты, лецитины, плазмалогены); 2. Гликолипиды (цероброзиды, ганглиозиды и цитолипиды); 3. Сульфалипиды; 4. Липопротеины. По функциям бывают:1. Структурные и рецепторные компоненты мембран и клеточных поверхностей; 2. Энергетическое ДЕПО; 3. Сигнальные молекулы и биологические регуляторы. Классы липопротеинов учавствующих в переносе липидов и холестерина в организме человека: 1. Хилонекроны; 2. Липопротеины очень низкой плотности; 3. Липопротеины низкой плотности; 4. Липопротеины высокой плотности. Ф-ии липидов: 1. Структурная.В сочетании фосфолипиды с белками образуют биологические мембраны; 2.Энергетическая. В процессе окисления жиров происходит высвобождение большого количества энергии, именно она и идёт на образование АТФ; 3. Теплоизоляционная и защитная; 4. Смазывающая и водоотталкивающая; 5. Регуляторная.
5 (3).Общая характеристика биологических функций белков. Белки- высокомолекулярные органические в-ва,состоящие из соед-ых в цепочку пептидной связью L- аминокислот. В организме человека белки выполняют следующие функции: Каталитическая или ферментативная - все ферменты имеют белковую природу. Регуляторная - специал. Белки-маски осущ-ют регуляцию доставки к генам в ДНК. Рецепторная - ф-я заключ-ся в избир-ом связывании гормонов,биологически активных в-в и медиаторов на поверхности мембран или внутри клеток. Транспортная - только белки осущ-ют перенос в-в в крови, например, липопротеины, гемоглобин, трансферрин. Структурная - белки формируют в-во соед-ой ткани (коллаген, эластин, кератин, протеогликаны), участвуют в построении мембран и цитоскелета. Сократительная - сущ-ет ряд белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Генно-регуляторная- осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Трофическая - белки яв-ся источником С.S.N и др. элементов. Иммунологическая или защитная - все антитела имеют белковую природу: интерфероны, фибриногены. Сигнальная - белки участв. В передаче сигнала в клетку. Энергетическая - при расщеплении аминокислот сост-их белки, клетка получает 16-18% необходимой энергии.
6 (2).Роль белков в жизнедеятельности организма. Современные представления о структуре белков. Белки́- высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. Роль: белки служат материалом для построения клеток, тканей и органов, образования ферментов и большинства гормонов, гемоглобина и друг. соединений. Формируют соединения, обеспечивающие иммунитет к инфекциям. Участвуют в процессе усвоения жиров, углевод, витаминов, минерал. в-в, белки- важная часть питания человека. Структура: крайне важна трёхмерная структура- формируется в результате взаимодействия структур более низких уровней. Выделяют 4 уровня структуры белка: Первичная - последовательность аминокислот в полипептидной цепи. Именно в таком виде белок образ-ся на рибосомах. Благодаря водородным связям м/д радикалами отдельные участки белковой молекулы закручив-ся в спираль или формируют складчатый слой. Вторичная - образ-ся в результате взаимодействия мж функционирующими группами, входящими в состав пептидного остова. Различают два варианта вторич структуры: a-спираль и b- конфигурацию. Третичная - пространственное строение полипептидной цепи, представлена структура в виде нитки запутанной, если ее положить на ладонь и покатать другой ладонью- альфа спираль свернута в компактную глобулу. В стабилизации третичной структуры принимают участие: ковалентные связи (дисульфидные мостики); ионные (в аминокислот. остатках); водородные связи; гидрофобные взаимодействия (на поверхности молекул). Четверичная - когда белки состоят из 2-ух и более полипептид. Цепей, связ-ых м/д собой нековалентными (не пептидными и не дисульфидными) связями.
7. Пептидная связь и ее характерные черты. Первичная структура белков и ее свойства. Вторичная структура белков: виды, факторы стабилизации. Первичная структура белка - последовательность аминокислотных остатков в полипептидной цепи. Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты. Пептидная связь является частично двойной и частично одинарной. Заместители по отношению к пептидной связи могут находиться в цис- или транс-положении, причем транс-пептидная связь является более стабильной. Свойства первичной структуры белка: 1.Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК; 2. Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот. Пептидные цепи белков организованы во вторичную структуру , стабилизированные водородными связями. Атом кислорода каждой пептидной группы образует при этом водородную связь c NH-группой, соответствующей пептидной связи. При этом формируются следующие структуры: α-спираль, β-структура и β-изгиб. α-Спираль- наиболее выгодная структура. На один ее виток приходится 3,6 аминокислотного остатка. β-структура - образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, т.к. внутрицепочечные контакты отсутствуют. Полипептидная цепь в β-структуре сильно вытянута и имеет спиральную или зигзагообразную форму. Водородные связи менее прочны по сравнению с таковыми при антипараллельном расположении аминокислотных остатков. β-изгиб. Глобулярные белки имеют шарообразную форму.
8 (5).Третичная структура белка. Глобулярные и фибриллярные белки. Связи стабилизирующие третичную структуру. Примеры организации третичной структуры белков. Третичная структура- пространственное строение полипептидной цепи, структура представлена в виде запутан. Нитки, если ее положить на ладонь и покатать ее другой ладонью- в виде глобулы. В стабилизации третич. структуры принимают участие: ковалентные связи (мж двумя остатками цистеинами- дисульфидные мостики); ионные (в аминокислот остатках); водородные связи; гидрофобные (на поверхности молекул). Белки по форме клубка делят на 2 группы: глобулярные (близки к форме шара) и фибриллярные (нитевидные,близкие к форме эллипса). Пример- альбулин, кератин. Фибрилляр . белки имеют палочковобразную вытянутую форму, нерастворимы в воде и физически прочные (коллаген, эластин, миозин, фибрин- свертывает кровь). Глобулярные - водорастворимы, выполняют динамическую ф-ю- ферменты иммуноглобулины и транспортные белки гемоглобин и альбулин. Коллагены - молекулы состоят из 3 полипептидных цепей, называемых α-цепями. В состав коллагенов могут входить 3 одинаковые или разные цепи. Первичная структура α-цепей коллагена необычна, т.к каждая третья аминокислота в полипептидной цепи представлена глицином, так же имеется пролин и аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней. Эластин - в отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются в исходную форму. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
9 (6). Принципы организации четвертичной структуры белков. Кооперативные изменения конформации субъединиц. Примеры реализации кооперативных эффектов (гемоглобин, аллостерические ферменты). Четвертичная структура- когда белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными)связями, обычно связаны гидрофильно-гидрофобными связями, при помощи водородных и ионных. Подобные белки называются олигомерами , а составляющие их индивидуальные полипептидные цепи-протомерами , мономерами или субъединицами.В результате формируется молекула в виде шара (глобуляр.белки) или нити(фибриллярные).Отдельные глобулы называются субъединицами. У гемоглобина, например, имеется по две α и β субъединицы. Наличие нескольких субъединиц -увеличивает степень насыщения кислородом.Четвертичная структура свойственна большинству ферментов.Кооперативные изменения конформации субъединиц. Субъединица – это функционально активная часть молекулы белка.Конформа́ция- пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей.Кооперативные изменения конформации субъединиц - это изменение расположения атомов в определенной молекуле всех полипептидных цепей (протомеров) четвертичной структуры белка(олигомеров) при присоединении лиганда (молекулы или ионы, связанные с центральным атомом) только к одному из белков.Конформационные изменения,произошедшие в других протомерах(цепях),облегчают присоединение следующей молекулы,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы.Т.о каждая присоединяющаяся молекула будет присоединятся легче первой в 300 раз,а также способствует более легкому отщеплению последующих молекул.Аллостерические ферменты - это ферменты, активность которых регулируется количеством молекул субстрата и эффекторами. Они играют важную роль в метаболизме.Аллостерическая регуляция имеет большое значение в следующих ситуациях: при анаболических процессах и при катаболических процессах.Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
10 (7).Денатурация и ренатурация белка. Денатурирующие факторы. Денатурация белков- это потеря белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы. Как правило, денатурация белка необратима, но в некоторых случаях после устранения денатурирующего агента может произойти «ренатурация » - восстановление вторичной и третичной структур, свойств, т.е белки возвращают свою природную структуру. Механизмы денатурации . Любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Наглядным примером яв-ся- образование «белка» при жарке яиц.
11 (10). Классификация, структурные компоненты и биологические функции сложных белков (хромопротеины, гемопротеины, флавопротеины, металлопротеины). Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Функции: уч-ют в фотосинтезе, дыхание клеток и целостного организма; транспорт O 2 и CO 2 ; ОВР; свето-и цветовосприятие и др. Магнийпорфирин вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление H 2 O на H 2 и O 2 . Гемопротеины катализируют обратную реакцию – образование H 2 O, связанное с освобождением энергии. Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми. Некоторые флавопротеины содержат ионы металлов. Типичными представителями флавопротеинов, являются ксантин-оксидаза, альдегидоксидаза, ацил-КоА-дегидрогеназа и транспортирующий электроны флавопротеин.. Негемовое железо связывается с белковым компонентом, отличающимся от гемсодержащих хромопротеинов. Железо ковалентно связано с атомом серы остатка цистеина в белке. При кислотном гидролизе такого белка освобождается железо и H 2 S. К группеГемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо (или магний)-порфирины, но различные по составу и структуре белки. К Металлопротеинам относятся биополимеры, содержащие белок и ионы какого-либо одного или нескольких металлов: ферритин, трансферрин, гемосидерин. Белки, координационно связанные с атомами металлов в составе сложных белков-ферментов, для которых металл служит или мостиком между белковым компонентом и субстратом, или, что более вероятно, металл в них непосредственно выполняет каталитическую функцию.
Способы разделения и очистки белков.
Получение белков из биологического материала (тканей, органов) требует такие последовательные стадии как: дробление биологического материала и разрушение клеточных мембран; фракционирование органелл, содержащих те или иные белки; перевод белков в растворённое состояние; разделение смеси белков на индивидуальные белки. Для разрушения биологического материала используют методы : создание однород. структуры в ткане, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком. Создание однород. структуры в ткане- определ. ткань помещают в сосуд с пестиком, пестик вращается и измельчает и растирает ткань о стенки сосуда.Замораживания и оттаивания ткани - в результатеобразующиеся кристаллы льда разрушают оболочки клеток.После разрушения ткани нерастворимые части осаждают центрифугированием. Удаление из раствора небелковых веществ . Нуклеиновые кислоты, липиды и др. небелковые вещества можно удалить из раствора, используя их свойства. Липиды легко удаляются из р-ра добавлением орган-ких растворителей, например ацетона. Методы очистки белков . Очистка белков от других белков, находящихся в р-ре, полученном из данной ткани. Т.к. белки обладают лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах. Также нужно учитывать термостабильность и устойчивость в кислых р-ах. Сначала нужно удалить из р-ра основную массу балластных белков, которые значительно отличаются от выделяемого белка свойствами.
13 (26). Денатурация и ренатурация. Молекулярная гибридизация нуклеиновых кислот. Денатурация свойственна макромалекулам, имеющим пространственную организацию. Она может быть вызвана нагреванием, воздействием химических веществ, которые нарушают Ван-дер-Вальсовы взаимодействия, разрывают водородные связи, стабилизирующие вторичную и третичную структуры. При нагревании происходит разделение двунитевой ДНК на одиночные полинуклеотидные цепи. При медленном охлаждении они снова воссоединяются по принципу комплементарности, образуются двунитевая полинуклеотидная цепь ДНК – этот процесс называется ренатурацией и при быстром охлаждении она не происходит. Денатурация бывает полной и частичной, обратимой и необратимой. Необратимой будет при разрушении фосфодиэфирных связей между нуклеотидами. Гибридизация нуклеиновых кислот. Все клетки одного организма содержат абсолютно одинаковые молекулы ДНК. Поэтому, если из клеток разных тканей выделить ДНК, денатурировать её и разделить цепи, а потом смешать одноцепочечные молекулы, то одноцепочечные молекулы, выделенные из разных клеток могут полностью комплиментарно спариться- образовать совершенный гибрид ДНК-ДНК.В том случае, если смешиваются ДНК разных организмов, то степень их комплим. спарив. будет зависеть от степени родстатва организмов или видов-образуются несовершенные гибриды ДНК-ДНК.
14 (12).Понятие о ферментах. структурно-функциональная организация ферментов. Ферменты-белки обладающие каталит. активностью, способны ускорять биохим-е р-ции. По своему строению могут быть простыми и сложными белками. Простетическую (небелковую) группу ферментов называют коферментом, а белковую - апоферментом. Апоферментная и коферментная группы сами по себе неактивны, лишь соединенные друг с другом более или менее прочными связями они образуют функционально активный комплекс, получивший название холофермента. Апоферментом определяется специфичность фермента (способность его взаимодействовать только с определенным веществом (субстратом) или группой веществ); тогда как коферментная группа часто выступает в роли акцептора тех или иных отщепляемых от субстрата атомов или функциональных групп, а в некоторых случаях выполняет и каталитическую функцию. Структурно-функц. организация ферментов. Центры ферментов: молекула фермента взаимодействует с S не всей своей поверхностью, а определенными участками. На поверхности фермента различают: Активный центр (это участок фермента, который взаимодействует с S. Наиболее часто в состав актив. центров входят функциональные группы таких аминокислот: ОН – группы серина, треонина, тирозина; SН – группы цистеина; NН – группа гистидина; СООН – группы глутамата и аспартата;NН2 – группы аргинина и лизина.В сложных ферментах в активный центр входят кофакторы (небелковые компоненты): простетические группы, коферменты, ионы металлов. Активный центр является комплементарным к строению S, имеется соответствие Е и S как “ключа и замка”. В структуре активного центра выделяют: участок, который связывается с S: контактный (“якорный”) участок;каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании S. Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический центр, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают. Активный и аллостерический центры локализуются на разных субъединицах фермента. При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными.
15 (16). Классификация и номенклатура ферментов. Все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы:1.Оксидоредуктазы; 2.Трансферазы; 3.Гидралазы; 4.Лиазы; 5.Изомеразы; 6.Лигазы (синтетазы).1.Оксидредуктазы – ферменты, катализирующие ОВР: а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода, б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода, в) цитохромы – это ферменты, переносящие электроны. г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н 2 О 2 2. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор.- аминотрансферазы, переносят NH 2 ;- метилтрансферазы, переносят CH 3 ;- фосфотрансферазы, переносят PO 3 H 2 ;- ацилтрнсферазы.3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи(они принимают участие в реакциях гидролиза). Все ферменты пищеварительного тракта относятся к гидролазам: эстеразы – разрывают сложно-эфирную связь; пептидазы – разрывают пептидную связь; гликозидазы – разрывают гликозидные связи. 4. Лиазы - ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют: декарбоксилазы – катализируют отщепление CO 2 . альдолазы – катализируют расщепление связи между атомами углерода. гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи. Ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь. 5.Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку. 6.Лигазы (синтетазы) – катализируют образование более сложных вещ-в из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других. Номенклатура ферментов: 1)Тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа. 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.Первая цифра говорит о типе катализируемой реакции, указывая на номер класса. Вторая уточняет действие фермента – номер подкласса. Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс. Четвёртая – порядковый номер фермента.
16 (13). Общие принципы ферментативного катализа. Отличие ферментов от неорганических катализаторов. В основу современной теории о ферм.катализе положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. По этой теории весь процесс катализа можно разделить на 3 этапа:1)образование фермент-субстратного комплекса. Происходит диффузия субстрата к ферменту и субстрат, в соответствии с принципом комплиментарности, связывается с активным центром фермента. Реагенты связаны водородными, ионными, гидрофобными, в некоторых случаях и ковалентными связями. Эта стадия непродолжительна, зависит от концентрации субстрата и от скорости диффузии его к активному центру. Энергия активации исходных веществ при этом изменяется незначительно. На этой стадии проявляется эффект концентрирования субстрата на поверхности фермента – эффект ориентации. 2)происходит последовательное преобразование первичного фермент-субстратного комплекса в 1 или несколько активированных. Эта стадия медленная, ее длительность зависит от величины энергии активации данной реакции. В эту стадию происходит разрыв старых связей и образование новых, при этом энергия активации значительно снижается. 3)отделение продуктов от активного центра фермента и диффузия их в окружающую среду. Эта стадия непродолжительна, ее скорость определяется скоростью диффузии продуктов в окружающую среду. Отличия между ферментами и неорг. катализаторами (общие свойства ферментов ): сложность строения; высокая мощность действия; специфичность; это вещ-ва с регулируемой активностью; действуют в мягких условиях организма.
17. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, факторов среды (рН,температуры). Число молекул S, претерпивающих изменение в течение минуты, в расчете на единицу веса E при оптимальных условиях его действия называется молекулярной активностью E. При увеличении кол-cтва E скорость ферментативной р-ции повыш-ся до некоторого предела, который характеризуется количеством S, доступным действию E. Зависимость скорости ферментативной реакции от концентрации S может быть описана уравнением:
где V -скорость ферментативной реакции, Vmax - максимальная скорость ее при бесконечно большой концентрации субстрата, S - концентрация субстрата в моль/л, Кm - константа Михаэлиса (она соответствует концентрации субстрата, при которой скорость реакции равна половине максимальной). Зависимость скорости от кол-ва фермента . При условии избытка S скорость р-ции пропорциональна кол-ву E, но при избыточном количестве E прирост скорости реакции будет снижаться, поскольку уже не будет хватать S. Зависимость скорости реакции от температуры . Скорость ферментативных реакций зависит от температуры: при повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур - до 50-60 °С. Зависимость скорости реакции от рН . Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре, а это влияет на сродство S к активному центру и на каталитический механизм. Кроме того, изменение ионизации белка вызывает конформационные изменения молекулы E. Зависимость скорости реакции от времени . По мере увеличения времени инкубации скорость реакции снижается.Это может происходить вследствие уменьшения концентрации S, увеличения скорости обратной реакции (в результате накопления продукта прямой реакции), ингибирования E продуктом реакции, денатурации фермента. При количественном определении E и кинетических исследованиях измеряют начальную скорость реакции.
18. Уравнение Михаэлиса- Ментен. Зависимость скорости ферментативной реакции от концентрации субстрата. В 1913 г. Михаэлис и Ментен создали теорию ферментативной кинетики, исходя из того, что фермент (Е) вступает во взаимодействие с субстратом (S) с образованием промежуточного фермент субстратного комплекса (ЕS), который далее распадается на фермент и продукт реакции по уравнению:
19 (15). Механизм действия ферментов. Специфичность действия ферментов(стереохимическая, реакционная и субстратная: абсолютная, групповая). Структура и роль каталитического центра. 1. Происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ это приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата. 2. происходит "узнавание" ферментом своего S. 3 . происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра и соответствующими группировками в молекуле S. 4 . образуется активный фермент-субстратный комплекс. При этом происходит хим. преобразование S с участием каталитического центра и кофермента. В результате этого молекула S меняет свою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей. 5. фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент. Фермент из реакции выходит в неизменном виде.-Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов:1. Абсолютная специфичность – способность фермента катализировать превращение только одного S. .2. Относительная специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи. 3. Относительная групповая специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав S. 4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Реакционная специфичность фермента -это специфичность фермента к определённой реакции. Каталитический центр - это та область актив. центра фермента, которая непосредственно участвует в хим. преобразованиях S. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Если фермент явл-ся сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в его входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.
20 (14). Кофакторы и коферменты, их значение для деятельности ферментов. Коферментные функции витаминов. Коферменты - это орган. вещ-ва аминокислотной природы, непосредственно участвующие в катализе в составе фермента. Простые, относятся обычно к классу гидролаз, практически все гидролитические ферменты состоят только изаминокислот. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками(для каталитической активности многих ферментов кроме белковой части необходим второй компонент-кофактор). Есть каталитически актив. фермент вместе с кофактором-холофермент. Это каталитически актив. фермент, состоящий из белковой и небелковой части кофактора. Белковая часть холофермента-апофермент. У холофермента ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Оказывается апофермент резко повышает каталитическую активность кофактора, а кофактор в свою очередь стабилизирует белковую часть, делает ее более устойчивой и менее уязвимой к денатурирующим агентам. Кофакторы - это некоторые полипептиды, группы нуклеотидов и их производные и, наконец, ионы некоторых металлов. Классификация: 1) Кофакторы жирного ряда (глютатион, липоевая кислота, долихол фосфат). 2 Кофакторы алифатического ряда (убихинон или коэнзим Q). 3) Кофакторы гетероциклического ряда. 4) не содержащие витаминов - геминовые кофакторы. Основой этих кофакторов является гемовое железо. 5) Кофакторы-нуклеотиды.Коферментные функции витаминов . Ф-ции водорастворимых вытаминов-образование коферментов и простетич. групп ферментовитамины. Связанные с разл. витаминами ферменты принимают участие во мн. важнейших процессах обмена веществ: энергетич. обмене, биосинтезе и превращениях аминокислот, жирных кислот, пуриновых и пиримидиновых оснований. Некоторые жирорастворимые витамины также выполняют коферментные функции. Ф-ции др. жирорастворимых витаминов: витамин Е стабилизирует и защищает ненасыщ. липиды биол. мембран от окисления; витамин D необходим для осуществления транспорта ионов Са и остатков фосфорной кислоты через клеточные барьеры в процессах их всасывания в кишечнике, реабсорбции в почках и мобилизации из скелета.
21 (19). Регуляция активности ферментов. Ковалентная модификация. Аллостерическая регуляция. Каталитические и регуляторные центры. Понятие об иммобилизированных ферментов и их применение в медицине. Ферменты-регулируемые катализаторы.В качестве регуляторов могут выступать метаболиты, яды. Различают: активаторы – вещ-ва, увеличивающие скорость реакции;ингибиторы – вещ-ва, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами S. Активация с помощью металлов протекает по различным механизмам: а)металл входит в состав каталитического участка активного центра; б)металл с S образуют комплекс; в)за счет металла образуется мостик между S и активным центром фермента.S также являются активаторами. При увеличении концентрации S скорость р-ции повышается. По достижению концентрации насыщения S эта скорость не изменяется. Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента: 1) частичный протеолиз. 2) фосфорилирование - дефосфорилирование. Аллостерическая регуляция . Аллостерич-е ферменты построены из двух или большего числа субъединиц. Одна субъединица имеет каталитический центр, др.- регуляторный центр. Если в среде есть аллостерический ингибитор, он присоединяется к регуляторному центру, что ведет к изменению конформации регуляторной субъединицы; вследствие этого изменяется конформация и каталитической субъединицы, в том числе каталитического активного центра. В результате активность фермента снижается. Чем выше концентрация аллостерического ингибитора, тем больше молекул фермента блокируется им и тем меньше скорость превращения субстрата. Аналогично происходит и активация ферментов при действии аллостерических активаторов. Иммобилизованные ферменты – это ферменты, ковалентно присоединенные к любому органическому или неорганическому полимеру. Их можно многократно использовать, при этом их активность снижается незначительно. При этом обеспечивается их высокая специфичность действия и высокая стабильность. В медицине иммобилизованные ферменты используются как лекарственные препараты.
22(18).Ингибирование активности ферментов: обратимое и необратимое; конкурентное, неконкурентное и бесконкурентное. Ингибитор – это вещ-во, вызывающее специфическое снижение активн-ти фермента. Инактивация –денатурация белка в результате действия денатурирующих агентов. По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые. Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активн-ти. Обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата. По механизму действия выделяют: 1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной р-ции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с S. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы.2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с S. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его. Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. Неконкурентные ингибиторы: а)цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут. б)ионы тяжёлых металлов и их органические соединения. в)фармакологические средства, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.3) Субстратное ингибирование (бесконкурентное) – торможение ферментативной реакции, вызванное избытком S. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Лекарственные препараты как конкурентные ингибиторы. Например.:четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина(S) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий.
23. Применение ферментов в медицине. Понятие об энзимопатологии, энзимодиагностике и энзимотерапии. 1.Химический метод – количественное определение S или продуктов с помощью хим. реагентов. 2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения S при характеристической длине волны.3. Манометрический метод – определение кол-ва газа, выделяющегося в процессе р-ции (оксидазы – по поглощению О 2 , декарбоксилазы – по выделению СО 2). 4. Поляриметрический метод – фиксируется изменение оптического вращения. 5. Хроматографический – количественное определение S или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами). Удельная активность – это число единиц активности (Е) на мг белка. Энзимопатология -заболевания, которые обусловлены отсутствием или снижением активности ферментов. В основном это – наследственные болезни, обусловленные генетическими нарушениями(дефекты ферментов обмена фенилаланина возникают при снижении активности фенилаланингидроксилазы-фенилпировиноградная олигофрения). Энзимодиагностика это использование определения активности ферментов в биологиче ских жидкостях для выявления тех или иных заболеваний. Энзимотерапия это использование ферментных препаратов для лечения заболеваний.
24 (22) . Структурные компоненты нуклеиновых кислот. Биологическое значение и функции нуклеиновых кислот. Нуклеиновая к-та - высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют функции по хранению, передаче и реализации наследственной информации. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U).Одна из основных функций нуклеиновых кислот состоит в детерминации синтеза белков. Информация о структуре белков, закодированная в нуклеотидной последовательности ДНК.
25. Вторичная и третичная структура ДНК. Типы РНК и их ф-ции . Вторичная структура ДНК-двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов - наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура(клубок) - пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина - дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Типы РНК и их функции. Три типа РНК: – транспортные (тРНК), матричные (мРНК) и рибосомальные (рРНК). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительности жизни и выполняемым функциям. Транспортные РНК -описывается универсальной моделью «клеверного листа». В состав тРНК входят минорные основания, представленные метилированными основаниями, изомерами и аналогами пиримидинов. Минорные основания делают тРНК устойчивыми к действию нуклеаз и поддерживают определенную третичную структуру молекулы. Антикодон имеет жесткую архитектуру, которая позволяет ему быстро считывать мРНК. Матричные РНК эукариот и прокариот различаются по строению. Этот тип РНК имеет одинаковое строение 5′- и 3′-концов.На 5′ конце присутствует модифицированный нуклеотид 7-метилгуанозин-5′-трифосфат – кэп. Рибосомальные РНК принимают участие в образовании рибонуклеопротеинов, формирующих немембранные комплексы – рибосомы. Клетки прокариот и эукариот содержат рибосомы, имеюшие общий план строения. В рибосомы входят высокомолекулярные рРНК, дающие начало 30S-40S- и 50S-60S-субчастицам рибосом; рРНК взаимодействуют с мРНК и аминоацил-тРНК в процессе трансляции. рРНК содержат несколько модифицированных нуклеотидов. Чаще всего это метильные производные азотистых оснований или рибозы. Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи. Биспиральные и линейные участки этих молекул формируют постоянные вариабельные домены, которые затем укладываются в более компактные структуры более высокого порядка.
26 (23). Строение и уровни организации нуклеиновых кислот. Первичная структура нуклеиновых кислот. Видовые различия первичной структуры нуклеиновых кислот. Нуклеиновая к-та - высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Уровни структурной организации : 1. первичная структура. РНК и ДНК построены однотипно – представлены полинуклеотидной цепью, состоящей из отдельных мононуклеотодов, соединённых между собой 3’→5’-фосфодиэфирными связями. 2. вторичная структура. Представляет собой двойную спираль, состоящую из 2 полинуклеотидных цепей, закрученных вокруг одной общей оси. Эти цепи антипараллельны, т.е. одна идет в направлении 5’→3’, а другая 3’→5’. Пуриновому основанию одной цепи соответствует пиримидиновое основание другой цепи – эти основания комплиментарны друг другу. Вторичная структура стабилизируется водородными связями и гидрофобными взаимодействиями. Видовые различия первичной структуры: Существуют два типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты(РНК). те, и другие представляют собой полимерные молекулы, построенные из мономерных блоков – нуклеотидов: ДНК – из дезоксирибонуклеотидов, а РНК – из рибонуклеотидов.
27 (24). Вторичная и третичная структура ДНК. Строение и организация хроматина. Вторичная структура ДНК-двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов - наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура(клубок) - пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина - дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Хроматин -это вещ-во хромосом - комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, - надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа. Нить ДНК с нуклеосомами образует нерегулярную структуру (фибриллу). Если хроматин упакован плотно-гетерохроматин, ДНК, находящаяся в гетерохроматине не транскрибируется. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно-эухроматином. Плотность упаковки хроматина во многом определяется модификациями гистонов - ацетилированием и фосфорилированием.
28. Репликация ДНК как один из видов матричных синтезов. Этапы репликации. Особенности процесса в эукариотических клетках. Репликация (самоудвоение, биосинтез) ДНК. Основные этапы: 1 . образование репликативных вилок при участии ДНК-раскручивающих белков, вызывающих разрыв водородных связей между комплементарными основаниями. 2 . синтез новых нитей ДНК при участии ДНК-полимеразы, катализирующей образование фосфодиэфирной связи между новыми нуклеотидами. Присоединение нуклеотидов идет в соответствии с принципом комплементарности. Синтез идет 5’-конца к 3’-концу. На одной цепи синтез происходит непрерывно, а на другой - прерывается с образованием коротких фрагментов. В результате на одной цепи образуются короткие фрагменты - фрагменты Оказаки; 3 . соединение коротких фрагментов с помощью ДНК-лигазы с образованием дочерних нитей. В результате репликации на одной материнской нити синтезируются 2 комплементарных дочерних ДНК (из одной молекулы ДНК образуются 2 копии ДНК).Значение репликации состоит в передаче информации от ДНК матери к дочерней ДНК. Особености репликация линейных геномов эукариот:геномы кольцевые замкнутые характерны для многих бактерий, их плазмид и некоторых вирусов. У большинства др. организмов геном представлен линейными молекулами ДНК в составе одной или нескольких хромосом. Существует так называемая проблема отстающей цепи ДНК. Синтез отстающей цепи ДНК происходит в виде коротких фрагментов Оказаки, для инициации синтеза которых требуются РНК- затравки. После удаления затравки на конце одной из вновь синтезированных молекул ДНК образуется одноцепочечная, которая не может быть заполнена ДНК-полимеразой, поскольку она не функционирует в отсутствие праймера. Вследствие этого в каждом раунде репликации должно было бы происходить укорачивание хромосом с обоих концов, что приводило бы к потере генетической информации, закодированной в концевых фрагментах ДНК. Кроме того, большие размеры молекул ДНК, заключенных в индивидуальные хромосомы, требуют специальной организации их реплицирующего аппарата.
29. Репликация плазмид. Особенности репликации вирусного генома. Интерфероны, их биологическое действие и применение в медицине. Плазмида- внехромосомный самовоспроизводящийся генетич. элемент бактерий. Представляет собой кольцевую двухцепочечную молекулу ДНК, закрученную в суперспираль. Каждая плазмида является самостоятельным репликоном, сама контролирует собственную репликацию и поддерживается в клетке в определенном, характерном для нее числе копий. Особенности репликации вир-го генома: I) вирусная частица (вирион) содержит только один вид нуклеиновых кислот - или ДНК, или РНК; 2) вирионы не имеют собственного метаболизма, не содержат клеточных органелл, в том числе рибосом, и очень часто состоят только из нуклеиновой кислоты, заключенной в белковую оболочку=>вирусы способны размножаться исключительно за счет использования метаболического аппарата другой клетки.Цикл размножения вируса начинается с его прикрепления к поверхности клетки. Вирион содержит рецепторы, узнающие определенные вещества мембраны клетки-хозяина; После прикрепления вирион проникает чз мембрану внутрь клетки; иногда в клетку попадает только нуклеиновая кислота вириона. Затем с использованием аппарата клетки-хозяина начинается репликация вирусного генома и синтез вирусных белков; из них путем самосборки образуются новые вирионы, которые освобождаются из клетки, либо разрушая ее. Интерфероны - ряд белков со сходными св-ми, выделяемых клетками организма в ответ на вторжение вируса. Они способны подавлять внутриклеточное размножение ДНК- и РНК-вирусов. В медицине интерфероны применяют для профилактики и лечения респираторных вирусных инфекций.
30 (29). Биосинтез РНК (транскрипция). Строение РНК-полимеразы. Зависимость локализации считываемого участка и направления считывания от структуры промотора. Этапы транскрипции. Посттранскрипционная модификация РНК. Процессинг РНК. Транскрипция- передача информации с ДНК на РНК. Элементарная единица транскрипции-оперон (транскриптон)- участок ДНК, подвергающийся транскрипции. В опероне выделяют информативные участки - экзоны и неинформативные участки - интроны. В начале оперона выделяют промотор (P) - это начальный участок оперона, к которому присоединяется РНК-полимераза. Рядом с промотором располагается оператор (О) - регуляторная зона, место присоединения генов-регуляторов. В конце оперона располагается терминатор (Т) - участок, содержащий стоп-сигнал.Строение РНК-полимеразы. Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. Этапы транскрипции: 1. инициация; 2. элонгация; 3. терминация;4.процессинг (созревание) РНК. Инициация - присоединение ДНК-зависимой РНК-полимеразы к промотору, что приводит к разрыву водородных связей между комплементарными нуклеотидами и расхождение нитей ДНК. Элонгация - это передвижение РНК-полимеразы вдоль нити ДНК, сопровождающееся образованием фосфодиэфирных связей между рибонуклеотидами. Присоединение рибонуклеотидов происходит в соответствии с принципом комплементарности. Этот синтез идет от 5" конца к 3". Данная фаза протекает до тех пор, пока ДНК-полимераза не достигнет стоп-сигнала->терминация. В результате процессов транскрипции образуется транскрипт (пре-иРНК). Он почти полностью соответствует транскриптону. Посттранскрипционная модификация РНК. Процессинг РНК. Начинается следующий этап - процессинг - посттранскриптационное созревание РНК. Это удаление излишков - вырезаются неинформативные участки; сплайсинг - сшивка, соединение информативных участков. При этом иРНК укорачивается.Из пре-иРНК образуется иРНК. Далее иРНК соединяется с белком-информером, в результате чего образуется комплекс иРНК+ белок =информосома, который может выходить из ядра и транспортироваться в цитоплазму к рибосоме, где начинается – трансляция.
31. Основной постулат молекулярной биологии. Генетический код и его характерные черты. Акцепторная роль тРНК. Синтез аминоацил-тРНК как регуляторный механизм трансляции. Основной постулат молекулярной биологии. Передача наследственной информации от материнской клетки к дочерней осуществляется при помощи ДНК-репликация. Для использования генетической информации необходимы РНК, образуемые на матрице ДНК-транскрипция. Далее РНК непосредственно участвуют на всех этапах синтеза белковых молекул трансляция, обеспечивающих структуру и деятельность клетки. Генетический код . Генетическая информация, содержащаяся в ДНК и в иРНК, заключена в последовательности расположения нуклеотидов в молекулах. Последовательность расположения нуклеотидов в иРНК определяет последовательность расположения аминокислот в белках. Этот код называют генетическим. Код триплетен . В состав РНК входят 4 нуклеотида: А, Г, Ц, У(каждая из 20 аминокислот зашифрована последовательностью 3 нуклеотидов, т. е. триплетом, который получил название кодон)Код однозначен. Каждый триплет шифрует только одну аминокислоту. Код универсален . Код един для всех живущих на Земле существ. Акцепторная роль тРНК. тРНК-осуществляет доставку аминокислот к рибосоме. Связывается с аминокислотами, образуя комплекс аминоацил-тРНК, при помощи аминоацил-тРНК-синтетазы. Синтез аминоацил-участие в регуляции. Аминоацил-тРНК-синтетаза- фермент, катализирующий образование аминоацил-тРНК в реакции этерификации определенной аминокислоты с соответствующей ей молекулой тРНК. Для каждой аминокислоты существует своя аминоацил-тРНК-синтетаза.
32 (31). Этапы трансляции. Состав трансляционного аппарата клетки. Строение и механизм функционирования рибосом. Роль РНК в процессе трансляции. Участие белковых комплексов инициации, элонгации и терминации в биосинтезе полипептидной цепи. Трансляция - перевод генетического текста иРНК в последовательность аминокислот в белке. Этапы трансляции :1. Рекогниция. Происходит связывание АК со своей тРНК. 2. Инициация . Состоит из 7 фаз: а) подготовка рибосомы к трансляции. Рибосома взаимодействует с фактором инициации, в результате разделяется на малую и большую субъединицы. б) подготовка РНК-матрицы к трансляции; в) подготовка инициаторной аминоацил-тРНК. г) образование инициирующего комплекса. д) связывание мРНК с инициирующим комплексом. е) поиск и комплементарное взаимодействие со стартовым кодоном. ж) формирование 80S-рибосомы. В образовавшейся рибосоме выделяют 2 участка: Р-участок, там будет происходить образование пептидных связей; А-участок (аминоацильный участок) – служит для присоединения аминоацильной- тРНК. 3. Элонгация состоит из 3-х фаз: а)присоединение следующей аминоацил-тРНК в соответствии со смыслом следующего кодона матрицы; б) пептизация ; в)транслокация или перемещение. Рибосома перемещается на 1 кодон в направлении 3’-конца тРНК. При достижении рибосомой нонсенс-кодона элонгация прекращается и наступает терминация. 4. Терминация. Нонсенс-кодон распознается белковыми R-факторами (факторы освобождения) в А-участке рибосом. В результате действия R-факторов обеспечивается диссоциация элементов трансляционного аппарата и в цитоплазму высвобождаются рибосома, иРНК, полипептид. Трансляция включает 3 этапа: инициация, элонгация, терминация. 5. Процессинг белка - Это совокупность изменений в структуре белка, которые заканчиваются формированием структурно и функционально зрелой белковой молекулы.он может быть 2-х видов: а)котрансляционный, протекающий во время трансляции; б)посттрансляционный – химическая модификация белка происходит после трансляции. Рибосомы . Каждая рибосома состоит из малой и большой субъединиц. Содержит рРНК, а также около 80 различных белков, в том числе и ферментов. Трансляция - синтез белка рибосомой на основе информации, записанной в матричной РНК. мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3"-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5"-конце мРНК, а также позиционирование стартового кодона мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК и участии факторов инициации. Таким образом, распознавание антикодона происходит на малой субъединице.
Регуляция биосинтеза белка на уровне репликации и транскрипции. Регуляция биосинтеза белка на этапе трансляции. Посттрансляционная модификация белков. Основные уровни регуляции биосинтеза: 1. Регуляция синтеза белка на стадии репликации. Регуляция возможна путем добавления (или удаления) кодирующих (или регуляторных) участков на ДНК. Если удалить матрицу, то и синтеза белка с нее не будет, а если увеличить дозу определенного гена в ДНК, то появится возможность ускорить построение белков на многих одинаковых матрицах. В большинстве случаев наличие избыточной генетической информации отрицательно сказывается на жизнеспособности клеток, а ее недостаток, возникающий из-за недорепликации ДНК, приводит к их гибели из-за отсутствия жизненно важных генов. 2. На уровне транскрипции.
Варианты: а)групповая репрессия генов белками – гистонами; б)амплификация генов - увеличение числа копий заданного участка ДНК или гена. в)регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. 3. регуляция на уровне трансляции: тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов; избирательная дискриминация иРНК; механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК. 4. Регуляция биосинтеза белков путем посттрансляционной модификации: приводила к образованию общей полипептидной цепи, разрезаемой в дальнейшем на индивидуальные белки специфическими протеиназами. Посттрансляционная модификация белков. Модификации происходят в ЭПС и аппарате Гольджи. Однако множество других ковалентных модификаций протекает в первую очередь именно в цитозоле. Некоторые из них стабильны и необходимы для активности белка. Посттрансляционные модификации включают в себя фосфорилирование факторов транскрипции протеинкиназами, гликозилирование, ацилирование, циклизацию, амидирование, гидроксилирование и метилирование различных остатков аминокислот. Многие из перечисленных модификаций являются критическими для биологической активности пептидов.
34. Теория оперонной регуляции транскрипции. Ф-ии и особые зоны промотора. В 1961 году при исследовании индукции синтеза фермента-β-галактозидазы, участвующего в расщеплении лактозы в клетках E. coli , было установлено следующее: когда клетки E. Coli растут на среде, сод