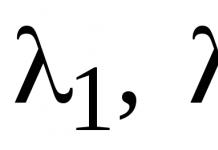Рассказ о газообразных соединениях фосфора, и прежде всего о фосфине, наверное, стоило бы начать со слов: «мерцающий свет, появляющийся на болотах (знаменитые «блуждающие огни») — результат самопроизвольного воспламенения фосфина». Ну а следующее определение — уже энциклопедического толка: «фосфин, или фосфористый водород (PH 3) — это бесцветный газ с неприятным запахом (гниющей рыбы, чеснока или промышленного карбида), ядовит, образуется при биохимическом восстановлении эфиров фосфорной кислоты, преимущественно в анаэробных условиях, т. е. без доступа кислорода».
Соединения фосфора в природе
В природе встречается множество и других газообразных фосфорорганических соединений, в молекулах которых атом фосфора P соединен с атомом углерода C. Их насчитываются тысячи. Многие из них входят в состав экосистем, в том числе в живые клетки растений и микроорганизмов. Самая большая группа соединений со связями C-P открыта лет пятьдесят назад именно в живых объектах.
Есть в почвах и фосфонаты — производные фосфорорганических соединений с сохранившимися связями C-Р. Их, правда, немного, не более 1-2% от содержащегося в органике фосфора, поэтому на пашне их можно выявить далеко не всегда, зато в болотистых почвах и на лугах их содержание повышается до 3-4%.
В обычных (аэробных) условиях природные соединения органического и минерального фосфора — это фосфаты (ортофосфаты). Их существует великое множество. Для органических фосфатов характерна связь C-О-Р, иными словами, углерод и фосфор соединяются через атом кислорода.
Одна из удивительных загадок природы состоит в том, что органические фосфаты в живых системах (например, в водорослях и микроорганизмах) синтезируются и разлагаются не произвольно, а по правилу «золотого сечения», подчиняясь определенному закону, описываемому знаменитым рядом чисел Фибоначчи (1, 1, 2, 3, 5, 8...), в котором каждый следующий член равен сумме двух предыдущих. Гармония природы непостижимым образом проявляется здесь в накоплении и расходовании в экосистемах энергии и вещества (в частности, фосфора), описываемых соотношением, которое приближенно дается классическим коэффициентом «золотого сечения» 1,618 (5/3, 8/5, 13/8 и т. д.), т. е. 62% упомянутых соединений должно связываться и аккумулироваться и только 38% — разрушаться или улетучиваться. Эти закономерности сказываются в дальнейшем и на накоплении гумуса, и на круговороте фосфора и азота, и на газообразных потоках, определяемых выбросами и «стоками» углекислого газа СО 2 , и на «дыхании» почвы (выделении СО 2 и усвоении кислорода О 2). На самом деле в природе наблюдаются колебания числовых значений этого соотношения в пределах 1,3-1,7. Но, как не раз отмечалось в трудах автора и других ученых, гораздо страшнее оказывается то, что главной причиной отклонений и даже нарушения этой закономерности стала антропогенная деятельность.
Некоторые специалисты уже обратили внимание на то, что нас могут подстерегать новые опасности, если это отношение стремится к единице, т. е. накопление и разложение идут с одинаковой интенсивностью, как это происходит, например, в цикле углерода, где за счет «вмешательства» мировой экономики океан и биосфера поглощают ныне лишь половину выбросов углерода (а надо бы 62%).
Но вернемся к фосфину и его производным, иными словами, к тем фосфорорганическим соединениям, в которых вместе с фосфором и углеродом встречаются разные элементы (азот, сера, кремний, молибден и т. д.) и их комплексы. В благоприятных для роста микроорганизмов условиях (в частности, в условиях болот и тундры при наблюдаемом потеплении) фосфорорганические соединения разлагаются с помощью фермента (катализатора) C-Р-лиазы. Ныне он обнаружен у 9 групп бактерий, которые питаются фосфором, добывая его при расщеплении фосфорорганических соединений. А вот грибы и дрожжи, на которые в экосистемах приходится 50-70% всей микрофлоры, не расщепляют эти соединения. Наоборот, простейшие, моллюски и грибы их синтезируют. Грибы могут расти даже при довольно высоких концентрациях фосфина, только мицелий у них желтеет.
Применение, свойства, опасности
Фосфин ядовит (опасная концентрация, способная привести к летальному исходу, — 0,05 мг/л), а в концентрации 2000 мл/м 3 (2 л/м 3 , или 2·10 -3) он вызывает мгновенную смерть. С ним приходится сталкиваться прежде всего в сельском хозяйстве при обеззараживании зернохранилищ и защите от клещей и других вредителей при транспортировке урожая, особенно зерновых культур. Раньше его активно применяли против крыс и мышей в амбарах. В Австралии к его помощи прибегают даже в борьбе с чрезмерно быстро размножающимися кроликами. Кроме того, ряд гербицидов и инсектицидов содержат фосфорорганические соединения на основе фосфина и его производных. И, наконец, в последнее время с ним все чаще приходится иметь дело в связи с широкомасштабным уничтожением химического оружия, предусматривающим обезвреживание отравляющих фосфорорганических соединений зарина и зомана — производных фосфина.
Чистый фосфин (без примесей) воспламеняется при температуре 150°С, сгорает с образованием токсичной фосфорной кислоты, но при наличии примесей дифосфина Р 2 Н 4 или газообразного фосфора Р 4 может и самопроизвольно воспламеняться на воздухе. Реакция фосфина с кислородом (как, впрочем, и окисление похожих на него метана — СН 4 и силана — SiH 4) относится к разветвленным цепным химическим реакциям, т. е. протекает все быстрее и может привести к взрыву. Окисление фосфина происходит при комнатной температуре, но при низкой температуре газ может быть устойчивым. Окисление фосфина можно ускорить, облучая его ультрафиолетом. Его самовоспламенение на воздухе возможно при концентрациях 1,7-1,9% (17-19 л/м 3), или 26-27 г/м 3 . Так что в болотных экосистемах нередко приходится сталкиваться не только с упомянутыми «блуждающими огнями», но и с самовозгоранием (кстати, и распространенные торфяные пожары имеют такую же природу).
Для фумигации (избавления хранилищ зерна и сельскохозяйственной продукции от клещей и иных вредителей) обычно используют фосфиды, в частности, соединения фосфора с металлами. Реагируя с влагой воздуха, фосфиды выделяют фосфин. Содержащие фосфиды таблетки и ленты раскладывают в хранилищах из расчета 9 г/т зерна или другой подлежащей долгому хранению продукции, добавляют их даже в яблоки. Считается, что при проветривании фосфин улетучивается, хотя по имеющимся в научной литературе данным в фуражном зерне поглощается до 13% ядовитого газа. Разве одно это обстоятельство не должно заставить относиться к такой «дезинфекции» с предельной осторожностью?!
Ныне для фумигации зерна при транспортировке и хранении разрешены к применению два соединения — метилбромин и метилфосфин, причем первое на порядок менее токсично (и эффективно), чем второе. Применяя последнее, молчаливо предполагают, что ядовитый фосфин после поглощения содержимым хранилища чудесным образом извлекается и улетучивается, отравив лишь клещей и других вредителей. Похоже, раньше было не принято задумываться над тем, насколько эта картина соответствует действительности. Между тем еще почти полвека назад было установлено, что метилфосфин (смесь двух газов — метана СН 4 и фосфина РН 3) чрезвычайно токсичен, почти как сам фосфин.
Метан и фосфин в биосфере
Не секрет, что выделяемый из болот метан считается одним из основных парниковых газов и остается предметом активных обсуждений и исследований в связи с проблемами глобального изменения климата. Увы, в России его концентрация в атмосфере определяется только на одной метеостанции (Териберка на Кольском полуострове). А ведь ее не мешало бы измерять и над сибирскими болотами!
Как известно, в земных глубинах законсервированы огромные запасы метана (7·10 11 -3·10 13 т), причем 4·10 11 т из них — в арктической зоне вечной мерзлоты. На суше метан содержится в органических соединениях болот, осадках и детритах, а в Мировом океане — в газогидратах, залегающих под дном, в условиях пониженных температур. В Докладе ООН по изменению климата эксперты сообщают, что в Сибири выделение метана из болот и вечной мерзлоты в последние годы стремительно растет. Максимальная эмиссия метана из тундровых почв достигается при 8-10°С, а при 5°С преобладает его окисление на СО 2 и воду. Образуется же он во всех почвенных горизонтах. В результате недавних исследований выяснилось, что, к примеру, наша южная кустарниковая тундра (окрестности Воркуты) служила стоком углерода лишь два года из последних пяти.
Это довольно опасная тенденция, особенно если принять во внимание, что на долю нашей страны приходится 2/3 всех болот на Земле. Наши площади заболоченных земель превышают площадь всех сельскохозяйственных угодий: по данным на 2003 года, 343 млн га болот (из них не поросших лесом — 130 млн га) и 221 млн га сельскохозяйственных угодий (из них 123 млн га пашни).
А вот как оценили выделение метана сотрудники МГУ в 2007 году по результатам измерений на болотах в Томской области. По их оценкам, среднее значение величины потока метана составляло около 10 мг/м 2 за час. В летний период за сутки может выделяться 2,4 кг/га, за сезон (6 месяцев) 432 кг/га. А со 130 млн га болот — почти 60 млн т. На окисление такого количества метана потребуется вдвое больше кислорода — 120 млн т.
Главным же «побочным» эффектом выделения метана следует признать тот факт, что в тундровых и болотных экосистемах при низких температурах метан не только представляет собой изрядный резерв углерода, способный заметно изменить его содержание в атмосфере, но и тесно связан с фосфорорганическими соединениями, которые неизменно присутствуют в растениях, микрофлоре болот и осадков (в основном за счет упомянутой связи С-Р). И его выделение из тех мест, где он прежде синтезировался, из-за интенсификации с ростом температуры биохимических процессов брожения происходит не в последнюю очередь за счет распада соединений на основе фосфина. Иными словами, эмиссия газов СН 4 и РН 3 происходит параллельно. Между тем пока экологи и климатологи следят лишь за изменением содержания в атмосфере СО 2 и СН 4 , а содержание РН 3 никем не учитывается. А зря!
Это упущение объясняется, в частности, тем, что лишь немногие специалисты знают о методах, позволяющих измерить содержание в атмосфере фосфора в газообразном состоянии. Ведь даже в научном мире до сих пор бытует мнение, что фосфор в природе существует преимущественно в форме фосфатов и после гидролиза связей Р-О-Р, Р-О-С и даже Р-С превращается в твердое вещество. Потоки фосфора в атмосферу в виде летучих соединений типа РН 3 считаются ничтожными и ими пренебрегают. Определение содержания фосфора, поступившего в атмосферу с фосфином, лишь привычными методами, используемыми для выявления фосфора в твердых соединениях, заметно искажает реальную картину круговорота фосфора в экосистемах. При этом игнорируется появление в атмосфере ядовитого и самовозгорающегося фосфина.
Фосфиновая угроза: простые оценки
Между тем простейшую количественную оценку выделения фосфина в экосистемах можно получить, изучая затопленные водой территории, имитирующие заливные луга или рисовые чеки. Как было установлено в проведенной еще в 1926 году в Московской сельскохозяйственной академии им. К. А. Тимирязева серии из шести опытов, выполнявшихся в строго контролируемых условиях, в газовую форму (фосфин) переходит 9,7 мг фосфора из 1 кг почвы за час. Не слишком сложный расчет дает 2,13 кг/га за сутки. Но ведь это почти столько же, сколько выделяется метана из болот! Стало быть, за сезон получаем 383 кг/га, а со всей площади безлесных болот (130 млн га) — около 50 млн т РН 3 . На его окисление до фосфорной кислоты по формуле
РН 3 + 2O 2 → Н 3 РO 4
потребуется, как нетрудно видеть, вдвое больше кислорода — почти 100 млн т (для метана эти значения составляли 60 и 120 млн т соответственно).
Косвенным подтверждением выделения фосфина из почв служат и исследования потоков фосфора на рисовых чеках — от посадки до уборки урожая потери фосфора в затопленных почвах в 3-8 раз превышают его содержание в зерне и соломе. Максимальный вынос Р 2 O 5 достигает 100 кг/га. Из почв органических соединений фосфора выводится в 4 раза больше, чем запасается в растениях. Общие потери фосфора из верхнего (20 см) слоя почв, по разным оценкам, составляют 960-2940 кг/га. Есть данные, свидетельствующие о том, что при выращивании риса на затопленных чеках в течение 32 лет из почвы теряется больше половины гумуса, а с ним, конечно же, выносятся азот и фосфор.

Это может происходить и за счет выделения их газообразных форм — аммиака (NH 3) и фосфина (РН 3). Давно известно, что по химическим свойствам они представляют собой химические структурные аналоги. Повторюсь, определение фосфора и азота только в минеральной форме, игнорирование газовых составляющих не отражает истинных процессов в экосистемах, особенно в анаэробных условиях. В частности, прямое подтверждение того, что в экосистемах болот вместе с метаном выделяется и фосфор, получено в недавних исследованиях.
Возвращаясь же к рассуждениям о возможной недооценке содержания фосфина в атмосфере, следует заметить, что вполне ощутимый вклад могут вносить не только болота Севера или тропиков, но и обширные рисовые плантации (прежде всего в Индии, Китае, Японии и странах Юго-Восточной Азии).
В научной литературе встречаются данные о том, что с осадками на землю выпадает до 3,5 кг/га фосфора. Иными словами, это примерно лишь 1% того фосфора, который, по имеющимся оценкам, выносится из болотных систем или затапливаемых почв фосфином в атмосферу (383 кг/га), остальные 99%, похоже, быстро окисляются, осаждаются или разлагаются (например, в результате гидролиза) в приземных слоях воздуха, литосфере и биосфере, обеспечивая перераспределение фосфора на поверхности земли.
Конечно же фосфин, как и метан, есть в атмосфере, но надо признать, что цикл фосфора изучен гораздо хуже, чем круговорот азота или углерода. Высокоактивные соединения фосфора в присутствии кислорода быстро превращаются в нейтральные комплексы, «безобидные» фосфаты. Кроме того, в экосистемах фосфора, как правило, немного, т. е. он присутствует в низких концентрациях. Поэтому, повторю, попытки учитывать фосфор только в форме фосфатов могут вести к заметному искажению его истинной роли в экосистемах. А к чему может привести недооценка этой роли, хорошо видно, например, по необдуманно осушенным ранее болотам, легко воспламеняющимся в засушливые годы за счет метана (СН 4), силана (SiH 4) и фосфина (РН 3).
По результатам измерений на упомянутой выше метеостанции Териберка было установлено, что в 1990 году в атмосферу с территории России было выброшено 48,8 млн т метана (напомним, наши оценки для всей площади безлесных болот составили около 60 млн т). За 1996-2003 гг. самая высокая концентрация была зафиксирована именно в 2003 году. Этот год был самым теплым для всей России, особенно же это относилось к лету и осени в зонах болот и тундры (Якутия, Западная Сибирь) — в среднем температура здесь оказалась выше многолетней почти на 6°С. В этих условиях одновременно наблюдалось и летнее снижение содержания верхового озона O 3 над Севером России на 5-10%. А ведь летом и здесь ускоряются процессы фотосинтеза и образования кислорода. Поэтому очевидно, что для окисления возросшего количества метана и фосфина в условиях теплого 2003 года здесь интенсивно расходовался озон.
От фосфина к кислороду: немного статистики и философии
Не секрет, что из-за богатейших биоресурсов Россию уже привыкли считать всемирным донором кислорода. По оценкам специалистов, над ее территорией ежегодно формируется 8130 млн т O 2 . Думается, мы не слишком погрешим против истины, предположив, что и процесс фотосинтеза, ответственный за формирование этой массы кислорода, подчиняется упомянутому «закону всемирной гармонии» — правилу «золотого сечения». Ведь на образование 1 т органики при фотосинтезе тратится 1,47 т углекислого газа, 0,6 т воды и 3,84 Гкал солнечной энергии и при этом выделяется 1,07 т кислорода. Соотношение между количеством поглощенного СO 2 и выделенного O 2 (1,47: 1,07) не так уж отличается от «золотого».
По некоторым опубликованным оценкам, потребление кислорода в России (дыхание, сжигание топлива и другие промышленные нужды) составляет 2784 млн т. Тогда его «производство» Россией превышает ее расход на 5346 млн т. Но в других расчетах, где учтено потребление кислорода микрофлорой (прежде всего почвы) на «дыхание», российский избыток выработки кислорода над его потреблением оказывается уже на порядок ниже — 560 млн т. Между тем, как считают некоторые исследователи, «дыхание» почвы регулируется своим правилом «золотого сечения», определяющим соотношение выделяемого микрофлорой углекислого газа и потребляемого кислорода. На целине значение этой величины близко к 1,58, а на пашне колеблется в пределах 1,3-1,75 — иными словами, кислород в процессе «дыхания» почвы расходуется «экономно» (42-37%), а углекислого газа выделяется больше (58-63%). Если исходить из среднего значения «золотого сечения» 1,52 для соотношения СO 2: O 2 , то при эмиссии СO 2 из почв России 10 409 млн т кислорода на «дыхание» российских почв потребляется еще 6848 млн т (оценки 2004 года по данным сотрудников Института фундаментальных проблем биологии РАН, в частности В. Н. Кудеярова).
Своеобразная «золотая пропорция» соблюдается и между стоком СO 2 и его эмиссией в масштабе России. Соотношение между стоком, составляющим 4450 млн т за год (в пересчете на углерод), и эмиссией (2800 млн т — в тех же единицах) оказывается равным 1,59, т е. удивительно близко к «золотому». Что ж, пока над Россией в целом нет избытка СO 2 , наши экосистемы поглощают больше, чем мы выбрасываем, наши леса нас спасают и покрывают «грехи» наши. Но в последние годы (прежде всего на Севере) все чаще отмечается, что экосистемы не справляются с «планом» по поглощению и отмеченное соотношение нарушается.
Впрочем, гораздо важнее, что, как следует из ряда оценок, на территории России общий расход кислорода за год на наши нужды (2784 млн т), дыхание почвы (6848 млн т) и окисление метана и фосфина (220 млн т) приближается к 10 млрд т, а это почти на 2 млрд т больше, чем его вырабатывают все наши леса. И этот печальный баланс представляется мне гораздо более серьезной проблемой, чем ожидаемая торговля квотами. Ради сохранения окружающей среды и биосферы планеты, ресурсов которой мы сегодня расходуем на 25% больше, чем они успевают восстанавливаться, нужно наконец осознать, что без ограничения потребления нам и нашим потомкам просто не выжить. И не в последнюю очередь это касается кислорода. В атмосфере его вроде бы немало (21%), но нельзя допускать, чтобы на Земле его потреблялось больше, чем вырабатывается.
Подводя итоги
Не секрет, что за последние 100 лет в результате бездумной деятельности человека и игнорирования им законов природы выбросы углекислого газа в атмосферу (и его содержание там), по разным оценкам, выросли на 25-35%. Одним из плохо просчитываемых последствий глобального потепления может стать резкая интенсификация биохимических процессов в природных зонах болот и вечной мерзлоты. При этом может резко возрасти выделение не только метана (это уже почти очевидно), но и мало изученных по влиянию на биосферу газов: аммиака, силана и фосфина, которым для окисления и нейтрализации потребуется немало кислорода. А ведь есть еще и не вполне проанализированные эффекты обратной связи (например, более интенсивное выделение метана ускорит дальнейший рост концентрации СO 2 в атмосфере, что, в свою очередь, может привести к резкому замедлению фотосинтеза). Как следует из недавних исследований, в 90-х годах прошлого века заметно ослабла компенсирующая роль фотосинтеза в бореальных лесах. А ведь прежде было твердо установлено, что деревья на всех широтах достоверно способствовали фотосинтезу и ассимиляции СO 2 . Опасная тенденция! И примеры подобных «метаморфоз» лесов множатся год от года.

В настоящее время мы почти ничего не знаем о выделении и окислении не раз упоминавшегося в этой статье силана (SiH 4). Между тем все болотные растения, злаки и микроорганизмы богаты органическим кремнием. В торфе верховых болот — 43% SiO 2 , переходных — 28%, низинных — 21%. Пока есть лишь отрывочные данные о том, что силан в соединении с фосфином образует недостаточно исследованные комплексы — силилфосфины. Процессы выделения силана, его окисления и соединения с другими элементами нуждаются в серьезном изучении.
И в заключение — выглядящий фантастическим сюжет, который должен заставить задуматься всех, кто еще не утратил эту способность. В приземном слое атмосферы в связи со стремительным ростом содержания углекислого и некоторых других «мертвых» газов в обозримом будущем может возникнуть нехватка кислорода не только из-за замедления фотосинтеза, роста потребления на окисление, сжигание и дыхание, но и из-за «экрана» ядовитых газов, мешающего притоку O 2 из более высоких слоев атмосферы.
Миллиарды лет основой всего живого на Земле был фотосинтез, исправно снабжавший планету кислородом. Увы, как справедливо отмечают некоторые исследователи, современная цивилизация впервые в истории, похоже, ухитрилась замедлить пополнение атмосферы кислородом, а природу довела до точки бифуркации. Выдержит ли она?
См., например: Елдышев Ю.Н. Виновник глобального потепления — метан? // «Экология и жизнь», 2007, № 11, с. 45; Изменение климата: факты и факторы // «Экология и жизнь», 2008, № 3, с. 44.
См., например, статью Кравченко И.К. в журнале «Микробиология», № 6, 2007.
Промышленная экспозиция происходит при использовании РН3 в производстве ацетилена или при использовании фосфина в качестве присадки при производстве силиконовых кристаллов. Фосфид алюминия, применяемый в качестве фумиганта зерна, и фосфид цинка, применяемый в качестве родентицида, при контакте с влагой выделяют газообразный фосфин, который может привести к смерти.
Этот газ с чесночным запахом вызывает развитие тяжелых желудочно-кишечных симптомов. В тяжелых случаях развиваются кома, судороги, гипотензия и отек легких. В отличие от газа арсина фосфин не вызывает гемолитическую анемию.
а) Клиника отравления газом фосфином . Газ фосфин вызывает желудочно-кишечные симптомы, нарушения деятельности респираторной, сердечно-сосудистой и центральной нервной систем, обусловленные метаболическими изменениями.
В число выраженных клинических проявлений острой экспозиции к фосфину входят головная боль, усталость, тошнота, рвота, кашель, одышка, парестезия, желтуха, атаксия, интенционный тремор, слабость и диплопия. В летальных случаях при аутопсии выявлялись центродолевой некроз печени, застойная сердечная недостаточность с отеком легких и фокальный некроз миокарда.
б) Лечение отравления газом фосфином :
- Меры, принимаемые до госпитализации в зоне заражения или Decon area . После чрезмерной экспозиции в одежде пострадавшего остаются небольшие количества фосфина, которых недостаточно, чтобы представлять опасность для медицинского персонала, находящегося вне зоны загрязнения.
1. Спасатели должны быть обеспечены полностью автономными респираторами, специальной защитной одеждой и перчатками.
2. Необходимо быстро оценить проходимость дыхательных путей, состояние дыхания и кровообращения, обеспечить стабильность позвоночника (при подозрении на травму), обеспечить проходимость воздушных путей и адекватное дыхание, подать дополнительный кислород.
3. Окатить пострадавшего водой из шланга и, если есть вероятность накопления газа в одежде (например, в случае длительной экспозиции в замкнутом помещении), одежду снять и упаковать в двуслойный мешок.
- Лечение в стационаре
:
1. Исследовать и обеспечить адекватное функционирование воздушных путей, дыхания и кровообращения.
2. В случае респираторного дистресса использовать кислородную маску.
3. Контролировать сердечный ритм; сделать с 12 отведениями. При тяжелых экспозициях исключить инфаркт миокарда.
4. Лабораторные тесты: гематокритное число, электролиты, азот мочевины крови и/или креатинин, ферменты печени, Са, Mg и газовый состав крови. Следует сделать запрос на другие лабораторные тесты.
5. Лечить отек легких. Симптомы могут не появляться в течение 72 ч.
6. Поражение печени может стать очевидным через 2- 3 сут.
Ближайший источник камня, содержащего фосфин , был указан на картах, и Давид отправил туда рабочую группу синих и зеленых всадников, которые должны были начать заготовку огненного камня.
Теперь им были ведомы все уловки врага, они научились оценивать особенности атак, узнали, как сберегать силы всадников и зверей, как предохраняться от паров фосфина и ударов Нитей.
Огненные струи фосфина , извергаемые драконами, образовывали в воздухе непрерывно меняющийся световой узор.
Всадники обнаружили залежи фосфина на плато где-то между рекой Малай и Садридом.
Пока дракон пристраивал свое громоздкое тело на столь неподходящей посадочной площадке, его широкие крылья гнали вдоль двора пахнущий фосфином воздух.
Потом отстирывал провонявшие фосфином штаны и рубашку и сушил их на солнце, развесив по кустам.
Когда Джексом вошел к себе, направляясь переменить провонявший фосфином летный костюм, ему попался на глаза набросок бухты, все еще разложенный на рабочем столе.
Джексом сунул Руту в пасть его порцию и, как всегда испытывая внутренний трепет, стал слушать, как мощные зубы дракона дробят насыщенный фосфином камень.
Степень окисления в PH3
Общие сведения о фосфине и степени окисления в PH3
Брутто-формула - PH3 (строение молекулы показано нарис. 1). Молярная масса фосфина равна 34,00 г/моль.
Значение слова фосфин
1. Строение молекулы фосфина с указанием валентного угла и длины химической связи.
При низких температурах образует твердый кларат 8PH3×46H2O. Плотность - 1,5294 г/л. Температура кипения - (-87,42oC), плавления - (-133,8oC).
В ОВР является сильным восстановителем, окисляется концентрированной серной и азотной кислотами, йодом, кислородом, пероксидом водорода, гипохлоритом натрия. Донорные свойства выражены значительно слабее, чем у аммиака.
PH3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фосфина, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Фосфин - это тривиальное название гидрида фосфора, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления фосфора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
Значит степень окисления фосфора в фосфине равна (-3):
Примеры решения задач

3. Молекулы. Химическая связь. Строение веществ
Химические частицы, образованные из двух или нескольких атомов, называются молекулами (реальными или условными формульными единицами многоатомных веществ). Атомы в молекулах химически связаны.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга. Каждая химическая связь в структурных формулах представляется валентной чертой, например:
H – H (связь между двумя атомами водорода);
H3N – Н+ (связь между атомом азота молекулы аммиака и катионом водорода);
(К+) – (I-) (связь между катионом калия и иодид-ионом).
Химическая связь образуется парой электронов ( ), которая в электронных формулах сложных частиц (молекул, сложных ионов) обычно заменяется валентной чертой, в отличие от собственных, неподеленных электронных пар атомов, например:

Химическая связь называется ковалентной, если она образована путем обобществления пары электронов обоими атомами.
В молекуле F2 оба атома фтора имеют одинаковую электроотрицательность, следовательно, обладание электронной парой для них одинаково. Такую химическую связь называют неполярной, так как у каждого атома фтора электронная плотность одинакова и в электронной формуле молекулы может быть условно разделена между ними поровну:
В молекуле хлороводорода НСl химическая связь уже полярная, так как электронная плотность на атоме хлора (элемента с большей электроотрицательностью) значительно выше, чем на атоме водорода:
Ковалентная связь, например Н – Н, может быть образована путем обобществления электронов двух нейтральных атомов:
H · + · H > H – H
H H
Такой механизм образования связи называется обменным или равноценным.
По другому механизму та же ковалентная связь H – H возникает при обобществлении электронной пары гидрид-иона H катионом водорода Н+:
H+ + (:H)- > H – H
H H
Катион Н+ в этом случае называют акцептором, а анион Н – донором электронной пары. Механизм образования ковалентной связи при этом будет донорно-акцепторным, или координационным.
Одинарные связи (Н – Н, F – F, Н – CI, Н – N) называются а-связями, они определяют геометрическую форму молекул.
Двойные и тройные связи () содержат одну?-составляющую и одну или две?-составляющие; ?-составляющая, являющаяся основной и условно образующаяся первой, всегда прочнее?-составляющих.
Физическими (реально измеряемыми) характеристиками химической связи являются ее энергия, длина и полярность.
Энергия химической связи (Е св) – это теплота, которая выделяется при образовании данной связи и затрачивается на ее разрыв. Для одних и тех же атомов одинарная связь всегда слабее , чем кратная (двойная, тройная).
Длина химической связи (l св) – межъядерное расстояние. Для одних и тех же атомов одинарная связь всегда длиннее , чем кратная.
Полярность связи измеряется электрическим дипольным моментом р – произведением реального электрического заряда (на атомах данной связи) на длину диполя (т. е.
Фосфор. Фосфин
длину связи). Чем больше дипольный момент, тем выше полярность связи. Реальные электрические заряды на атомах в ковалентной связи всегда меньше по значению, чем степени окисления элементов, но совпадают по знаку; например, для связи H+I-Cl-I реальные заряды равны Н+0’17-Сl-0’17 (двухполюсная частица, или диполь).
Полярность молекул определяется их составом и геометрической формой.
Неполярными (р = O) будут:
а) молекулы простых веществ, так как они содержат только неполярные ковалентные связи;
б) многоатомные молекулы сложных веществ, если их геометрическая форма симметрична.
Например, молекулы СО2, BF3 и СН4 имеют следующие направления равных (по длине) векторов связей:

При сложении векторов связей их сумма всегда обращается в нуль, и молекулы в целом неполярны, хотя и содержат полярные связи.
Полярными (р > O) будут:
а) двухатомные молекулы сложных веществ, так как они содержат только полярные связи;
б) многоатомные молекулы сложных веществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH3, Н2О, HNО3 и HCN.
Сложные ионы, например NH4+, SO42- и NO3-, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связь возникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К+ и I-. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельным случаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K2S, Li3N) и веществ класса солей (NaNО3, K2SО4, СаСО3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы (кристаллы, построенные из катионов и анионов).
Известен еще один вид связи, называемой металлической связью, в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку. Совокупность обобществленных валентных электронов (электронный газ) удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомные и молекулярные кристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I2 и диоксид углерода СO2 (сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н2O и смеси H2O + NH3:

Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н2O и NH3, но их нет в HCl, H2S и РН3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями

(например, HF и Н2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
Примеры заданий части А
1. Вещества только с ковалентными связями – это
1) SiH4, Сl2O, СаВr2
2) NF3, NH4Cl, P2O5
3) CH4, HNO3, Na(CH3O)
4) CCl2O, I2, N2O
2–4. Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
5. Кратные связи имеются в молекулах
6. Частицы, называемые радикалами, – это
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
8. Наиболее прочная и короткая связь – в молекуле
9. Вещества только с ионными связями – в наборе
10–13. Кристаллическая решетка вещества
1) металлическая
3) атомная
4) молекулярная
Соединения фосфора.
Р-3 . Фосфиды металлов являются ионно-ковалентными соединениями. Фосфиды s-металлов (кроме Be) и лантаноидов — ионные солеобразные соединения, они легко гидролизуются водой и кислотами: Mg3P2 + 6H2O = 3Mg(OH)2↓ + 2PH3 Na3P + 3HCl = 3NaCl + PH3. Фосфиды d-элементов – металлоподобные химически инертные соединения. Исключение составляют фосфиды металлов I и II групп, побочных подгрупп, которые также являются солеобразными, но с большой примесью ковалентности. Фосфор не дает устойчивых соединений с сурьмой, висмутом, свинцом и ртутью.
Соединение фосфора с водородом называют фосфидом водорода, хотя электроотрицательности этих элементов практически равны. Соединение имеет формулу РН3, называется фосфин . Это чрезвычайно ядовитый газ с неприятным чесночным запахом, tкип=-88°С. Водородные связи между молекулами фосфина в жидкости и между молекулами воды и фосфина при растворении отсутствуют, поэтому температура кипения невелика и в воде фосфин практически не растворяется. Молекула представляет собой пирамиду с атомом фосфора в вершине и углом 93,5° между связями Р-Н, что указывает на отсутствие гибридизации атомных орбиталей фосфора при образовании этого соединения. Связи образованы почти чистыми р-орбиталями. Неподеленная электронная пара фосфора остается на 3s-орбитали, поэтому фосфин является слабым основанием и слабым комплексообразователем вообще. Катион фосфония образуется только с самыми сильными кислотами в безводной среде (HJ, HClO4,HBF4), например PH3 + HJ = PH4J. Вода легко разлагает соли фосфония. Фосфин проявляет сильные восстановительные свойства: PH3 + 2O2 = H3PO4 (при 150°С эта реакция происходит со взрывом), PH3 + 6AgNO3 + 3H2O = 6Ag↓ + H2(PHO3) + 6AgNO3 PH3 + 3J2 + 3H2O = H2(PHO3) + 6HJ. Синтез фосфина из простых веществ не осуществить, так как связь Р-Н недостаточно прочная из-за своей длины и из-за незначительного вклада электростатической составляющей. Поэтому фосфин получают гидролизом фосфидов металлов или растворением фосфора в щелочи (реакции приведены выше).
Основными соединениями фосфора в его положительных степенях окисления являются оксиды, кислородсодержащие кислоты и галогениды. Целесообразно рассмотреть их по отдельности.
Оксиды фосфора – Р4О6 и Р4О10 – кислотные оксиды, имеют молекулярное строение, являются твердыми веществами (tпл(Р4О6)=23,8°С, молекулярная модификация Р4О10 возгоняется при 3590С, а полимерная модификация плавится при 580°С), оба растворяются в воде, давая гидроксиды, являющиеся кислотами, фосфористой и ортофосфорной, соответственно. Оксид фосфора (V) очень гигроскопичен, поглощает влагу из воздуха, поэтому используется в качестве осушителя, а также в качестве водоотнимающего средства: Р2О5 + HNO3 = HPO3 + N2O5, при этом образуется метафосфорная кислота или полифосфорные кислоты – (HPO3)3-4. Оксид фосфора (III), в котором фосфор находится в промежуточной степени окисления, способен к реакциям дальнейшего окисления и к реакциям диспропорционирования, например: P4O6 + 2O2 = P4O10 P4O6 + 6H2O (гор) = 3H3PO4 + PH3, при 210°С в атмосфере Н2 происходит реакция 5P4O6 = 2P4 + 3P4O10. Оксид фосфора (V) окислительными свойствами не обладает, а сам может быть получен при окислении фосфора в безводных условиях, например, при термическом разложении некоторых солей: 6P + 5KClO3 = 3P2O5 + 5KCl
Кислородные кислоты фосфора. Многообразие кислородных кислот фосфора вызвано следующими причинами: 1.Валентность у фосфора может быть III или V. 2. В случае валентности V возможно образование орто и метакислот, отличающихся количеством присоединенных молекул воды. 3. Во всех гидроксидах фосфор проявляет координационное число 4, такие гидроксиды для него более устойчивы, если атомов кислорода недостаточно, то образуется связь Р-Н ((НО)2РНО, а не Р(ОН)3 и т.д.). 4. Фосфорные кислоты склонны к образованию линейных или циклических полимеров. 5. В определенных условиях возможно образование связи Р-Р. 6. Как для всех гидроксидов при дальнейшем окислении образуются пероксокислоты. Приведем строение и свойства наиболее известных кислот фосфора.
H3PO4 – ортофосфорная кислота. Это трехосновная, средняя по диссоциации по первой ступени (Ка=7,52.10-3) и слабая по двум остальным ступеням кислота. В безводном состоянии образует прозрачные гигроскопичные кристаллы с tпл=42°С. В воде растворяется в любой концентрации. Ортофосфорная кислота получается при растворении оксида фосфора (V) в воде, при сжигании фосфина, при окислении любых форм фосфора в кислой среде, при гидролизе бинарных соединений фосфора(V): P4S10 + 16H2O = 4H3PO4 + 10H2S. В промышленности используется метод сжигания фосфора с последующим растворением оксида, а также вытеснение ортофосфорной кислоты из фосфата кальция концентрированной серной кислотой при нагревании: Ca3(PO4)2 + 3H2SO4 = 3CaSO4↓ + 2H3PO4. Этой кислоте соответствует три ряда солей – средние (фосфаты или ортофосфаты) и кислые (гидрофосфаты и дигидрофосфаты). Фосфаты и гидрофосфаты всех металлов, кроме натрия, калия, рубидия и цезия, нерастворимы в воде. Дигидрофосфаты растворимы. Растворимые фосфаты подвергаются сильному гидролизу по аниону, наибольшей константой гидролиза характеризуется фосфат-анион, наименьшей – дигидрофосфат. Гидролиз по аниону приводит к щелочной среде растворов солей. Кислые анионы одновременно с гидролизом участвуют в равновесии диссоциации, что приводит к кислой среде раствора, для дигидрофосфата в большей степени, для гидрофосфата в меньшей. В результате указанных процессов раствор дигидрофосфата натрия имеет слабокислую среду, раствор гидрофосфата – слабощелочную, а раствор фосфата – сильнощелочную среду. Фосфат аммония как соль, образованная слабыми кислотой и основанием, нацело разлагается водой. Ортофосфаты плавятся без разложения при очень высоких температурах. Гидрофосфаты дают при нагревании дифосфаты: 2K2HPO4 = K4P2O7 + H2O. Дигидрофосфаты при нагревании превращаются в полиметафосфаты: xKH2PO4 = (KPO3)x + H2O. Сильными окислительными свойствами фосфаты не обладают, но могут быть восстановлены углеродом при нагревании. В присутствии диоксида кремния эта реакция приводит к получению фосфора (уравнение реакции приводилось), в отсутствие SiO2 процесс идет следующим образом: Ca3(PO4)2 + 8C = Ca3P2 + 8CO. Нагревание фосфата аммония приводит к постепенной потере молекул аммиака с образованием в конце концов при температуре выше 300°С полиметафосфорной кислоты.
При дегидратации ортофосфорной кислоты образуются конденсированные фосфорные кислоты, в которых имеются один или несколько мостиковых атомов кислорода. При этом образуются цепочечные, циклические и смешанные структуры. Рассмотрим самые простые из них.
Дифосфорная (пирофосфорная) кислота – Н4Р2О7. Получается при нагревании ортофосфорной кислоты до 2000С. В безводном состоянии представляет собой бесцветные кристаллы с tпл=61°С, которые хорошо растворимы в воде с образованием гораздо более сильной кислоты, чем ортофосфорная. Особенно сильной эта кислота является по первым двум ступеням. Любая конденсированная кислота сильнее одиночной, так как при ее диссоциации получается более устойчивый анион. Растворы пирофосфорной кислоты неустойчивы, так как происходит постепенное присоединение молекулы воды с образованием двух молекул ортофосфорной кислоты. Более устойчивыми являются соли – пирофосфаты, которые, как уже говорилось, могут быть получены при нагревании гидрофосфатов.
Метафосфорные кислоты – (НРО3)х, где х=3,4,6. Циклические конденсированные кислоты, содержащие цикл из чередующихся атомов фосфора и кислорода. Получаются при растворении оксида фосфора (V) в ортофосфорной кислоте, а также при нагревании пирофосфорной кислоты до 300°С: 3H4P2O7 = 2(HPO3)3 + H2O. Все метафосфорные кислоты очень сильные, для триметафосфорной кислоты Ка2= 0,02. Все эти кислоты также в водном растворе постепенно превращаются в ортофосфорную кислоту. Их соли называются, соответственно, три-, тетра- и гексаметафосфатами.
Окислением оксида фосфора (V) можно получить пероксофосфорную кислоту : Р4О10 + 4Н2О2 +2Н2О = 4Н3РО5.
Фосфорноватая (гипофосфорная) кислота Н4Р2О6 имеет связь Р-Р. Структурную формулу можно представить как (ОН)2ОР-РО(ОН)2.
Свойства фосфина
Из формулы видно, что валентность фосфора равна 5, а степень окисления +4 – величина формальная, связанная с наличием связи между одинаковыми атомами. Это четырехосновная кислота, сила которой соответствует ортофосфорной. Получается по реакции: PbP2O6 + 2H2S = 2PbS↓ + H4P2O6 и выделяется из раствора в виде дигидрата с tпл=62°С. В кислом растворе диспропорционирует на ортофосфорную и фосфористую кислоты.
Фосфористая кислота Н3РО3 или Н2. Это двухосновная кислота средней силы, в безводном состоянии – твердое вещество с tпл=74°С. Получается при гидролизе галогенидов фосфора (III), а также при окислении белого фосфора хлором под водой: P4 + 6Cl2 + 12H2O = 4H2 + 12HCl. Как уже говорилось выше, соединение состава Р(ОН)3 менее устойчиво, поэтому происходит изомеризация с образованием связи Р-Н, которая в водном растворе уже не диссоциирует. Соли фосфористой кислоты носят название фосфиты, кислые соли – гидрофосфиты. Большинство фосфитов (кроме солей щелочных металлов) в воде нерастворимы. Как и все соединения фосфора (III), фосфористая кислота – сильный восстановитель, она окисляется до фосфорной кислоты галогенами, диоксидом азота и другими окислителями, а также восстанавливает малоактивные металлы из раствора их солей, например: HgCl2 + H2 + H2O = H3PO4 + 2HCl + Hg↓.При нагревании диспропорционирует: 4H2 = 3H3PO4 + PH3.
Фосфорноватистая (фосфиновая) кислота Н3РО2 или H. Это твердое вещество с tпл=26,5°С, водный раствор которого является достаточно сильной (Ка=7,9 .10-2) одноосновной кислотой. Фосфор в этом соединении также имеет пять связей, две из которых с атомами водорода. Диссоциации подвергается только связь Н-О. Формальная степень окисления фосфора в этом соединении +1. Фосфорноватистая кислота и ее соли – гипофосфиты являются сильными восстановителями. Катионы металлов, даже стоящих в ряду напряжения перед водородом, способны восстанавливаться до металла: NiCl2 + Na + 2H2O = H3PO4 + HCl + NaCl + H2+ Ni↓. При нагревании фосфористая кислота диспропорционирует: 3H = PH3 + 2H2. При повышении температуры фосфористая кислота, как было показано, также разлагается на фосфорную кислоту и фосфин. Гипофосфиты щелочных и щелочноземельных металлов получаются при взаимодействии фосфора и щелочи (смотри выше). Окисление фосфина мягким окислителем: PH3 + SO2 = H + S↓ (катализаторы – ртуть и следы воды).
Галогениды фосфора РХ3 и РХ5. Известны все галогениды фосфора кроме PJ5. В случае фосфора (III) это пирамидальные молекулы с атомом фосфора в вершине и с углами между связями Р-Х, равными 100°. Галогениды фосфора (V) представляют собой тригональные бипирамиды с sp3d гибридизацией атомных орбиталей фосфора. Оба фторида фосфора при обычных условиях – газы, PCl3 и PBr3 – жидкости, а трииодид, пентахлорид и пентабромид – твердые вещества. Последние два соединения представляют собой соли с комплексными ионами PCl5: +-, PBr5: +Br-. При нагревании оба соединения отщепляют молекулу галогена и превращаются в тригалогенид. Галогениды фосфора получаются прямым синтезом. Только PF3 – косвенным путем: PCl3 + AsF3 = PF3 + AsCl3. Все галогениды фосфора подвержены гидролизу, а тригалогениды способны также к окислению: 2PCl3 + O2 = 2POCl3 – хлорокись фосфора, может получаться и по другим реакциям: PCl3 + 2CrO3 = POCl3 + Cr2O3↓ + O2, 6PCl5 + P4O10 = 10POCl3.Тригалогениды присоединяют также серу: PCl3 + S = PSCl3. В неводных растворах возможны реакции: KF + PF5 = K HF(жидкий) + PF5 = H – гексафторофосфорная кислота, устойчива только в водном растворе, по силе сравнима с хлорной кислотой.
Предыдущая567891011121314151617181920Следующая
ПОСМОТРЕТЬ ЕЩЕ:
Фосфин. Оксиды фосфора и фосфорные кислоты: свойства, получение.
Слово фосфин
Медико-биологическое значение фосфора.
Фосфи́н (фосфористый водород, гидрид фосфора, по номенклатуре IUPAC - фосфан РН3) - бесцветный, очень ядовитый, довольно неустойчивый газ (при нормальных условиях) со специфическим запахом гнилой рыбы.
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
]Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:
Также его можно получить воздействием воды или кислот на фосфиды:
Хлористый водород при нагревании взаимодействует с белым фосфором:
Разложение йодида фосфония:
Разложение фосфоновой кистоты:
или её восстановление:
Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
Проявляет сильные восстановительные свойства:
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/м³.
Известны следующие оксиды фосфора:
Оксид фосфора(III) - бинарное неорганическое соединение, оксид фосфора с формулой P4O6, белые хлопья или кристаллы с неприятным запахом, реагируют с водой.
Получение
- Осторожной окисление белого фосфора закисью азота или углекислотой:
- Обратное диспропорционирование оксида фосфора(V) и белого фосфора:
[править]Физические свойства
Оксид фосфора(III) образует белые хлопья или кристаллы с неприятным запахом.
Хорошо растворяется в органических растворителях (бензол, сероуглерод).
Неустойчив на свету, вначале желтеет, а затем краснеет.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Карбоновые кислоты переводит в соответствующие ангидриды:
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P-О-P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Значение фосфора
- фосфор входит в состав нуклеиновых кислот, которые принимают участие в процессах роста, деления клеток, хранения и использования генетической информации
- фосфор содержится в составе костей скелета (около 85% от общего количества фосфора организма)
- фосфор необходим для нормальной структуры зубов и десен
- обеспечивает правильную работу сердца и почек
- фосфор участвует в процессах накопления и освобождения энергии в клетках
- участвует в передаче нервных импульсов
- помогает обмену жиров и крахмалов.
Неорганический элемент фосфор, Р, находится в организме человека в виде соединений фосфора - неорганических фосфатов и липидов или нуклеотидов.
Предыдущая10111213141516171819202122232425Следующая
Физические свойства
Фосфор P имеет несколько аллотропных модификаций: белый, красный, чёрный.
Получение фосфора P
Свободный фосфор P получают из природного фосфата кальция, накаливая его с песком (SiO2) и углём в электрической печи при высокой температуре:
Химические свойства фосфора — P
Белый фосфор более реакционноспособный, чем красный.
Осторожно - фосфин!
Он легко окисляется и самовоспламеняется на воздухе.
При окислении белый фосфор светится в темноте – происходит превращение химической энергии в световую.

Соединения фосфора P с металлами называются фосфиды . Они легко разлагаются водой с образованием газа фосфина (PH3 ).
Фосфин — PH3
4. При большом избытке хлора образуется пятихлористый фосфор:

Оксиды и кислоты фосфора
Фосфор образует с кислородом три оксида :
P2O3 — фосфористый ангидрид – оксид фосфора (Ш);
P2O5 — фосфорный ангидрид – оксид фосфора (V);
(P2O4 — четырёхокись фосфора).
P2O3 получают при медленном окислении фосфора (при недостатке кислорода):
При действии холодной воды образуется фосфористая кислота – H3PO3 .
P2O5 образуется при горении фосфора на воздухе (при избытке кислорода):
Кислоты
Фосфорный ангидрид P2O5 , в зависимости от температуры может присоединить различное количество воды, образуя кислоты различного состава:

Наибольшее значение имеет орто фосфорная кислота – H3PO4 .
Она может быть получена следующим образом:
1. Кипячением метафосфорной кислоты:
2. Окислением красного фосфора:
3. Действием серной кислоты на фосфат кальция:
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10, 11/2009
ЗАНЯТИЕ 30
10-й класс (первый год обучения)
Фосфор и его соединения
1. Положение в таблице Д.И.Менделеева, строение атома.
2. Краткая история открытия и происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения
7. Важнейшие соединения фосфора.
Фосфор находится в главной подгруппе V группы периодической системы Д.И.Менделеева. Его электронная формула 1s 2 2s 2 p 6 3s 2 p 3 , это р -элемент. Характерные степени окисления фосфора в соединениях –3, +3, +5; наиболее устойчивой является степень окисления +5. В соединениях фосфор может входить как в состав катионов, так и в состав анионов, например:

Фосфор получил свое название благодаря свойству белого фосфора светиться в темноте. Греческое слово переводится как «несущий свет». Этим названием фосфор обязан своему первооткрывателю – алхимику Бранду, который, завороженный свечением белого фосфора, пришел к выводу, что получил философский камень.
Фосфор может существовать в виде нескольких аллотропных модификаций, наиболее устойчивыми из которых являются белый, красный и черный фосфор.
Молекула белого фосфора (наиболее активного аллотропа) имеет молекулярную кристаллическую решетку, в узлах которой находятся четырехатомные молекулы Р 4 тетраэдрического строения.
Белый фосфор мягкий, как воск, плавится и кипит без разложения, обладает чесночным запахом. На воздухе белый фосфор быстро окисляется (светится зеленоватым цветом), возможно самовоспламенение мелкодисперсного белого фосфора. В воде нерастворим (хранят под слоем воды), но хорошо растворяется в органических растворителях. Ядовит (даже в малых дозах, ПДК = 0,03 мг/м 3). Обладает очень высокой химической активностью. При нагревании без доступа воздуха до 250–300 °С превращается в красный фосфор.
Красный фосфор – это неорганический полимер; макромолекулы Р n могут иметь как циклическое, так и ациклическое строение. По свойствам резко отличается от белого фосфора: не ядовит, не светится в темноте, не растворяется в сероуглероде и других органических растворителях, не обладает высокой химической активностью. При комнатной температуре медленно переходит в белый фосфор; при нагревании до 200 °С под давлением превращается в черный фосфор.
Черный фосфор по виду похож на графит. По структуре – это неорганический полимер, молекулы которого имеют слоистую структуру. Полупроводник. Не ядовит. Химическая активность значительно ниже, чем у белого фосфора. На воздухе устойчив. При нагревании переходит в красный фосфор.
Х и м и ч е с к и е с в о й с т в а
Наиболее активным в химическом отношении является белый фосфор (но на практике предпочитают работать с красным фосфором). Он может проявлять в реакциях свойства как окислителя, так и восстановителя, например:
4Р + 3О 2 2Р 2 О 3 ,
4Р + 5О 2 2Р 2 О 5 .
Металлы (+/–)*:
3Ca + 2P Ca 3 P 2 ,
3Na + P Na 3 P,
Cu + P реакция не идет.
Неметаллы (+):
![]()
2Р + 3I 2PI 3 ,
6P + 5N 2 2P 2 N 5 .

Основные оксиды (–).
Кислотные оксиды (–).
Щелочи (+):
Кислоты (не окислители) (–).
Кислоты-окислители (+):
3P (кр.) + 5HNO 3 (разб.) + 2H 2 O = 3H 3 PO 4 + 5NO,
P (кр.) + 5HNO 3 (конц.) H 3 PO 4 + 5NO 2 + H 2 O,
2P (кр.) + H 2 SO 4 (конц.) 2H 3 PO 4 + 5SO 2 + 2H 2 O.
Соли (–)**.
В п р и р о д е фосфор встречается в виде соединений (солей), важнейшими из которых являются фосфорит (Ca 3 (PO 4) 2), хлорапатит (Ca 3 (PO 4) 2 CaCl 2) и фторапатит (Ca 3 (PO 4) 2 CaF 2). Фосфат кальция содержится в костях всех позвоночных животных, обусловливая их прочность.
Фосфор п о л у ч а ю т в электропечах, сплавляя без доступа воздуха фосфат кальция, песок и уголь:
Сa 3 (PO 4) 2 + 3SiO 2 + 5C 2P + 5CO + 3CaSiO 3 .
К важнейшим соединениям фосфора относятся: фосфин, оксид фосфора(III), оксид фосфора(V), фосфорные кислоты.
Ф о с ф и н
Это водородное соединение фосфора, бесцветный газ с чесночно-рыбным запахом, очень ядовит. Плохо растворим в воде, но хорошо растворим в органических растворителях. Гораздо менее устойчив, чем аммиак, но является более сильным восстановителем. Практического значения не имеет.
Для п о л у ч е н и я фосфина обычно не используют реакцию прямого синтеза из простых веществ; наиболее распространенный способ получения фосфина – гидролиз фосфидов:
Сa 3 P 2 + 6HOH = 3Ca(OH) 2 + 2PH 3 .
Кроме того, фосфин можно получить реакцией диспропорционирования между фосфором и растворами щелочей:
4P + 3KOH + 3H 2 O PH 3 + KPO 2 H 2 ,
или из солей фосфония:
PH 4 I PH 3 + HI,
PH 4 I + NaOH PH 3 + NaI + H 2 O.
Химические свойства фосфина целесообразно рассматривать с двух сторон.
Кислотно-основные свойства. Фосфин образует с водой неустойчивый гидрат, проявляющий очень слабые основные свойства:
PH 3 + H 2 O PH 3 H 2 O (PH 4 OH),
PH 3 + HCl PH 4 Cl,
2PH 3 + H 2 SO 4 (PН 4) 2 SO 4 .
Окислительно-восстановительные свойства . Фосфин – сильный восстановитель:
2PH 3 + 4O 2 P 2 O 5 + 3H 2 O,
PH 3 + 8AgNO 3 + 4H 2 O = H 3 PO 4 + 8Ag + 8HNO 3 .
О к с и д ф о с ф о р а(III)
Оксид Р 2 О 3 (истинная формула – Р 4 О 6) – белое кристаллическое вещество, типичный кислотный оксид. При взаимодействии с водой на холоде образует фосфористую кислоту (средней силы):
P 2 O 3 + 3H 2 O = 2H 3 PO 3

Поскольку фосфористая кислота является двухосновной, при взаимодействии триоксида фосфора со щелочами образуется два типа солей – гидрофосфиты и дигидрофосфиты.
Например:
P 2 O 3 + 4NaOH = 2Na 2 HPO 3 + H 2 O,
P 2 O 3 + 2NaOH + H 2 O = 2NaH 2 PO 3 .
Диоксид фосфора Р 2 О 3 окисляется кислородом воздуха до пентаоксида:
P 2 O 3 + O 2 P 2 O 5 .
Триоксид фосфора и фосфористая кислота являются достаточно сильными восстановителями. Получают оксид фосфора(III) медленным окислением фосфора в недостатке кислорода:
4P + 3O 2 2P 2 O 3 .
О к с и д ф о с ф о р а(V) и ф о с ф о р н ы е к и с л о т ы
Пентаоксид фосфора Р 2 О 5 (истинная формула – Р 4 О 10) – белое гигроскопичное кристаллическое вещество. В твердом и газообразном состояниях молекула существует в виде димера, при высоких температурах мономеризуется. Типичный кислотный оксид. Очень хорошо растворяется в воде, образуя ряд фосфорных кислот:
метафосфорную :
P 2 O 5 + H 2 O = 2HPO 3

пирофосфорную (дифосфорную) :
P 2 O 5 + 2H 2 O = H 4 P 2 O 7

ортофосфорную (фосфорную) :
P 2 O 5 + 3H 2 O = 2H 3 PO 4

Пентаоксид фосфора проявляет все свойства, характерные для кислотных оксидов, например:
P 2 O 5 + 3H 2 O = 2H 3 PO 4 ,
P 2 O 5 + 3CaO 2Ca 3 (PO 4) 2 ;
может образовывать три типа солей:

Окислительные свойства для него не характерны, т.к. степень окисления +5 является для фосфора очень устойчивой. Получают пентаоксид фосфора при горении фосфора в достаточном количестве кислорода:
4P + 5O 2 2P 2 O 5 .
Ортофосфорная кислота Н 3 РО 4 – бесцветное кристаллическое вещество, очень хорошо растворимое в воде, гигроскопична. Это трехосновная кислота средней силы; не обладает выраженными окислительными свойствами. Проявляет все химические свойства, характерные для кислот, образует три типа солей (фосфаты, гидрофосфаты и дигидрофосфаты):
2H 3 PO 4 + 3Ca = Ca 3 (PO 4) 2 + 3H 2 ,
H 3 PO 4 + Cu ,
2H 3 PO 4 + 3CaO = Ca 3 (PO 4) 2 + 3H 2 O,

2H 3 PO 4 + K 2 CO 3 = 2KH 2 PO 4 + CO 2 + H 2 O.
В промышленности фосфорную кислоту п о л у ч а ю т экстракционным:
Ca 3 (PO 4) 2 + 3H 2 SO 4 = 2H 3 PO 4 + 3CaSO 4 ,
а также термическим методом:
Ca 3 (PO 4) 2 + 3SiO 2 + 5C 3СaSiO 3 + 2P + 5CO,
4P + 5O 2 2P 2 O 5 ,
P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
К лабораторным методам получения ортофосфорной кислоты относят действие разбавленной азотной кислоты на фосфор:
3Р (кр.) + 5HNO 3 (разб.) + 2Н 2 О = 3H 3 PO 4 + 5NO,
взаимодействие метафосфорной кислоты с водой при нагревании:
HPO 3 + H 2 O H 3 PO 4 .
В организме человека ортофосфорная кислота образуется при гидролизе аденозинотрифосфорной кислоты (АТФ):
АТФ АДФ + H 3 PO 4 .
Качественной реакцией на фосфат-ион является реакция с катионом серебра; образуется осадок желтого цвета, не растворимый в слабокислых средах:
3Ag + + = Ag 3 PO 4 ,
3AgNO 3 + K 3 PO 4 = Ag 3 PO 4 + 3KNO 3 .
Кроме вышеперечисленных фосфорных кислот (содержащих фосфор в степени окисления +5), для фосфора известно много других кислородсодержащих кислот. Приведем некоторые из важнейших представителей.
Фосфорноватистая (НРО 2 Н 2) – одноосновная кислота средней силы. Второе ее название – фосфиновая:

Соли этой кислоты называют гипофосфитами, или фосфитами, например KРО 2 Н 2 .
Фосфористая (Н 3 РО 3) – двухосновная кислота средней силы, немного слабее фосфорноватистой. Также имеет второе название – фосфоновая:

Ее соли называются фосфиты, или фосфонаты, например K 2 РО 3 Н.
Дифосфорная (пирофосфорная) (Н 4 Р 2 О 7) – четырехосновная кислота средней силы, чуть сильнее ортофосфорной:

Соли – дифосфаты, например K 4 P 2 O 7 .
Тест по теме «Фосфор и его соединения»
1. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций:
а) кислород; б) азот;
в) фосфор; г) сера.
2. При взаимодействии 42,6 г фосфорного ангидрида и 400 г 15%-го раствора гидроксида натрия образуется:
а) фосфат натрия;
б) гидрофосфат натрия;
в) смесь фосфата и гидрофосфата натрия;
г) смесь гидро- и дигидрофосфата натрия.
3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна:
а) 5; б) 3; в) 4; г) 8.
4. Число электронов на внешнем уровне атома фосфора:
а) 2; б) 3; в) 5; г) 15.
5. Фосфор, полученный из 33 г технического фосфата кальция, сожгли в кислороде. Образовавшийся оксид фосфора(V) прореагировал с 200 мл 10%-го раствора гидроксида натрия (плотность – 1,2 г/мл) с образованием средней соли. Масса примесей в техническом образце фосфата кальция (в г) составляет:
а) 3,5; б) 1,5; в) 2; г) 4,8.
6. Число -связей в молекуле пирофосфорной кислоты:
а) 2; б) 12; в) 14; г) 10.
7. Число атомов водорода, содержащихся в 4,48 л (н.у.) фосфина равно:
а) 1,2 10 23 ; б) 0,6 10 23 ;
в) 6,02 10 23 ; г) 3,6 10 23 .
8. При температуре 30 °С некая реакция протекает за 15 с, а при 0 °С – за 2 мин. Коэффициент Вант-Гоффа для данной реакции:
а) 2,4; б) 2; в) 1,8; г) 3.
9. Ортофосфорная кислота может реагировать со следующими веществами:
а) оксид меди(II); б)гидроксид калия;
в) азотная кислота; г) цинк.
10. Сумма коэффициентов в реакции между фосфором и бертолетовой солью равна:
а) 9; б) 6; в) 19; г) такая реакция невозможна.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | в | а | в | в | б | г | б | а, б,г | в |
Задачи и упражнения на фосфор и его соединения
Ц е п о ч к и п р е в р а щ е н и й:
1. Фосфор -> пентаоксид фосфора -> ортофосфорная кислота -> фосфат кальция ® фосфорная кислота.
2. Фосфат кальция -> фосфор -> фосфид кальция -> фосфин -> пентаоксид фосфора -> фосфорная кислота -> дигидрофосфат кальция.
3. Фосфат кальция -> А -> В -> С -> Д -> Е -> фосфат кальция. Все вещества содержат фосфор, в схеме три ОВР подряд.
4. Фосфор -> пентаоксид фосфора -> фосфат кальция -> фосфор -> фосфин -> фосфорная кислота -> дигидрофосфат кальция.
5. Фосфид кальция (+ р-р соляной кислоты) -> А (+ кислород) -> В (+ гидроксид натрия, недостаток) -> С (+ гидроксид натрия, избыток) -> Д (+ гидроксид кальция) -> Е.
| У р о в е н ь А |
1. При полном сгорании 6,8 г вещества получили 14,2 г пентаоксида фосфора и 5,4 г воды. К полученным продуктам реакции добавили 37 мл 32%-го раствора едкого натра (плотность 1,35 г/мл). Установите формулу исходного вещества и определите концентрацию полученного раствора.
Решение
Уравнение реакции:
![]()
(P 2 O 5) = 0,1 моль, (H 2 O) = 0,3 моль.
(P) = 0,2 моль, (H) = 0,6 моль.
m(P) = 6,2 г, m (H) = 0,6 г.
m = 6,8 г.
(P) : (Н) = 0,2: 0,6 = 1: 3.
Следовательно, формула исходного вещества – PH 3 , а уравнение реакции:

тогда фосфорной кислоты образуется:
(H 3 PO 4) = 2(P 2 O 5) = 0,2 моль.
Со щелочью фосфорная кислота может реагировать следующим образом:

Определим по условию задачи количество вещества NaOH:

(Н 3 PO 4) : (NaOН) = 0,2: 0,4 = 1: 2,
следовательно, идет реакция 2.
(Na 2 HPO 4) = (Н 3 PO 4) = 0,2 моль;
m (Na 2 HPO 4) = M (Na 2 HPO 4) (Na 2 HPO 4) = 142 0,2 = 28,4 г;
m (р-ра) = m (Р 2 О 5) + m (Н 2 О) + m (р-ра NaOH) =14,2 + 5,4 + 37 1,35 = 69,55 г.
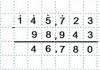
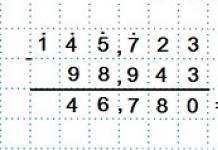
(Na 2 HPO 4) = m (Na 2 HPO 4)/m (р-ра) = 28,4/69,55 = 0,4083, или 40,83 %.
Ответ. PH 3 ; (Na 2 HPO 4) = 40,83 %.
2. При полном электролизе 1 кг раствора сульфата железа(II) на катоде выделилось 56 г металла. Какая масса фосфора может вступить в реакцию с веществом, выделившимся на аноде, и каков будет состав соли, если полученный продукт реакции растворить в 87,24 мл 28%-го раствора гидроксида натрия (плотность раствора 1,31 г/мл)?
Ответ. 12,4 г фосфора; гидрофосфат натрия.
3. 20 г смеси, состоящей из сульфата бария, фосфата кальция, карбоната кальция и фосфата натрия, растворили в воде. Масса нерастворившейся части составила 18 г. При действии на нее соляной кислоты выделилось 2,24 л газа (н.у.) и масса нерастворимого остатка составила 3 г. Определите состав исходной смеси солей по массе.
Ответ.
Na 3 PO 4 – 2 г; BaCO 3
– 3 г;
CaCO 3 – 10 г; Ca 3 (PO 4) 3 – 5 г.
4. Сколько кг фосфора может быть получено из 1 т фосфорита, содержащего 40 % примесей? Какой объем при н.у. займет фосфин, полученный из этого фосфора?
Ответ. 120 кг P; 86,7 м 3 PH 3 .
5. 40 г минерала, содержащего 77,5 % фосфата кальция, смешали с избытком песка и угля и нагрели без доступа воздуха в электрической печи. Полученное простое вещество растворили в 140 г 90%-й азотной кислоты. Определите массу гидроксида натрия, который потребуется для полной нейтрализации продукта окисления простого вещества.
Ответ. 24 г NaOH.
| У р о в е н ь Б |
1. Для полной нейтрализации раствора, полученного при гидролизе 1,23 г некоторого галогенида фосфора, потребовалось 35 мл 2М раствора гидроксида калия. Определите формулу галогенида.
Ответ. Трифторид фосфора.
2. Пробу безводного этанола, содержащего в качестве примеси 0,5 % оксида фосфора(V), сожгли в достаточном количестве кислорода. Образовавшиеся газы отделили, а полученный раствор нагрели до прекращения выделения газа, после чего к нему добавили равный по массе 0,5%-й раствор гидроксида калия. Определите массовые доли веществ в полученном растворе.
Ответ.
K 2 HPO 4 – 0,261 %;
KH 2 PO 4 – 0,204 %.
3. К 2 г смеси гидрофосфата и дигидрофосфата калия, в которой массовая доля фосфора равна 20 %, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли веществ в полученном растворе.
Ответ.
KH 2 PO 4 – 9,03 %;
K 2 HPO 4 (ост.) – 1,87 %.
4. При обработке водой смеси гидрида и фосфида щелочного металла с равными массовыми долями образовалась газовая смесь с плотностью по азоту 0,2926. Установите, какой металл входил в состав соединений.
Ответ. Натрий.
5. 50 г смеси фосфата кальция и карбонатов кальция и аммония прокалили, в результате получили 25,2 г твердого остатка, к которому добавили воду, а затем пропустили избыток углекислого газа. Масса нерастворившегося остатка составила 14 г. Определите массу карбоната аммония в исходной смеси.
Решение
При прокаливании смеси идут следующие процессы:
1) Ca 3 (PO 4) 2 ;
2) ![]()
3) (NH 4) 2 CO 3 2NH 3 + СO 2 + H 2 O.
В твердом остатке – Са 3 (PO 4) 2 и CaO.
После добавления воды:
4) Ca 3 (PO 4) 2 + H 2 O;
5) СаО + H 2 O = Ca(OH) 2 .
После пропускания углекислого газа:
6) Са(ОН) 2 + H 2 O + CO 2 = Ca(HСО 3) 2 .
Нерастворившийся остаток – Ca 3 (PO 4) 2 , следовательно, m (Ca 3 (PO 4) 2) = 14 г.
Находим массу CaO:
m (CaO) = 25,2 – 14 = 11,2 г.
(CaO) = 11,2/56 = 0,2 моль,
(CaCO 3) = (CaO) = 0,2 моль,
m (CaCO 3) = 0,2 100 = 20 г.
m (NH 4) 2 CO 3 = m (смеси) – m (Ca 3 (PO 4) 2) – m (CaCO 3) = 50 – 14 – 20 = 16 г.
Ответ . m (NH 4) 2 CO 3 = 16 г.
К а ч е с т в е н н ы е з а д а ч и
1. Твердое, белое, хорошо растворимое в воде соединение А представляет собой кислоту. При добавлении к водному раствору А оксида В образуется белое нерастворимое в воде соединение С. В результате прокаливания при высокой температуре вещества С в присутствии песка и угля образуется простое вещество, входящее в состав А. Идентифицируйте вещества, напишите уравнения реакций.
Ответ
. Вещества: А – H 2 PO 4 ,
В – CaO,
C – Ca 3 (PO 4) 2 .
2. Смесь двух твердых веществ красного цвета (А) и белого цвета (В) воспламеняется при слабом трении. В результате реакции образуются два твердых вещества белого цвета, одно из которых (С) растворяется в воде с образованием кислого раствора. Если к веществу С добавить оксид кальция, образуется белое нерастворимое в воде соединение. Идентифицируйте вещества, напишите уравнения реакций.
Ответ
. Вещества: А – P (кр.), В – KClO 3 ,
C – P 2 O 5 .
3. Нерастворимое в воде соединение А белого цвета в результате прокаливания при высокой температуре с углем и песком в отсутствии кислорода образует простое вещество В, существующее в нескольких аллотропных модификациях. При сгорании вещества В образуется соединение С, растворяющееся в воде с образованием кислоты Е, способной образовывать три типа солей. Идентифицируйте вещества, напишите уравнения реакций.
Ответ
. Вещества: А – Ca 3 (PO 4) 2 ,
В – P,
C – P 2 O 5 , Е – H 3 PO 4 .
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
** Интересной является окислительно-восстановительная реакция (ОВР), протекающая при зажигании спичек:
Продолжение следует
Формула фосфина ………………………………………………………….....РН 3
Молекулярная масса …………………………………………………………34,04
Цвет и вид.......................................................Бесцветный газ.
Температура плавления............................................ - 133,5°С.
Температура кипения.................................................... -87,7°С.
Давление при испарении...............40 мм рт. ст. при - 129,4°С.
Растворимость в воде........................26% от объема при 17°С.
Плотность..........................1,18 (0°С, 760 мм рт. ст.) (Воздух-1).
Температура вспышки.....................................................100°С.
Нижний предел взрываемости........... 1,79-1,89% от объема;
Появление запаха при.....................................................1,3 - 2,6 ррт.
При сравнительно высоких концентрациях фосфин взрывоопасен.
Нижний концентрационный предел воспламеняемости (НКПВ) – 1,79-1,89%
по объему или ………………………………..26,15-27,60 г/м 3 , или 17000-18900 мл/м 3 .
Скрытая теплота испарения фосфина равна …………………………………102,6 кал/г.
Растворимость в воде составляет 0,52 г/л при температуре 20 0 С и давлении 34,2 кгс/см 2 .
Фосфин
– высокотоксичный,бесцветный газ который тяжелее воздуха в 1,5 раза, поэтому при применении легко проникает во все щели и труднодоступные места в помещениях и эффективно уничтожает яйца, личинки, куколки и взрослых насекомых.
Плохо растворяется в воде, не реагирует с ней. Растворим в бензоле, диэтиловом эфире, сероуглероде. Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу.
Применение фосфина. При проведении фумигации фосфином используются неорганические препараты на основе фосфидов алюминия и магния. Объекты и технология применения препаратов на основе фосфида магния идентичны с препаратами на основе фосфида алюминия. Допуск людей и загрузку складов разрешают после полного проветривания и при содержании фосфина в воздухе рабочей зоны не выше ПДК (0,1 мг/ м³). Реализацию продукции осуществляют при остатке фосфина не выше МДУ (0,1 мг/кг для зерна, 0,01 мг/кг – для продуктов переработки зерна).
Газ Фосфин является сильным ядом для человека и других теплокровных животных. Острое отравление фосфином происходит при концентрации его в воздухе – 568 мг/м3. Газ фосфин обладает высокой токсичностью в отношении насекомых – вредителей хлебных запасов. При работе с ним желательно иметь представление о способе и механизме действия на вредные организмы . Предельно допустимая концентрация (ПДК) фосфина в воздухе рабочей зоны сотавляет 0,1 мг/м3. Однако запах газа начинает ощущаться при меньших концентрациях (около 0,03 мг/м3). Максимально допустимый уровень (МДУ) фосфина в зерне – 0,01 мг/кг, в зернопродуктах остатки фосфина не допускаются. Зерно и продукты его переработки могут быть использованы для пищевых целей только при условии, если остаточные количества фосфина в них не будут превышать МДУ.
Газ Фосфин слабо сорбируется зерном и зернопродуктами, поэтому легко дегазируется. В рекомендуемых для дезинсекции нормах расхода он не изменяет качества зерна и не ухудшает его семенных достоинств. Впервые он был применен в 1934 г. для фумигации зерновой продукции. В настоящее время, ввиду запрета на применение бромистого метила в целях фумигации, фосфин является основным фумигантом, предназначенным для борьбы с вредными насекомыми.