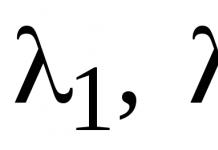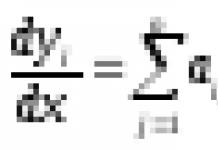Ферментативная кинетика изучает скорость реакций, катализируемых ферментами в зависимости от различных условий (концентрации, температуры, pH и др.) их взаимодействия с субстратом.
Однако ферменты - это белки, чувствительные к влиянию различных внешних воздействий. Поэтому при изучении скорости ферментативных реакций учитывают, главным образом, концентрации реагирующих веществ, а влияние температуры, pH среды, активаторов, ингибиторов и прочих факторов стараются свести к минимуму и создают стандартные условия. Во-первых, это оптимальное для данного фермента значение pH среды. Во-вторых, рекомендуется придерживаться температуры 25°С, в тех случаях, где это возможно. В-третьих, достигают полного насыщения фермента субстратом. Этот момент особенно важен, поскольку при низкой концентрации субстрата не все молекулы фермента участуют в реакции (рис. 6.5, а ), значит и результат будет далек от максимально возможного. Наибольшая мощность катализируемой реакции, при прочих равных условиях, достигается, если каждая молекула фермента участвует в превращении, т.е. при высокой концентрации фермент-субстратного комплекса (рис. 6.5, в). Если же концентрация субстрата не обеспечивает полного насыщения фермента (рис. 6.5, б ), то скорость протекающей реакции не достигает максимального значения.
Рис. 65.
а - при низкой концентрации субстрата; 6 - при недостаточной концентрации субстрата; в - при полном насыщении фермента субстратом
Скорость ферментативной реакции, измеренной при соблюдении перечисленных условий, и полном насыщении фермента субстратом называют максимальной скоростью ферментативной реакции (V).
Скорость ферментативной реакции, определяемая при неполном насыщении фермента субстратом, обозначается v.
Ферментативный катализ упрощенно можно описать схемой

где F - фермент; S - субстрат; FS - фермент-субстратный комплекс.
Каждая стадия этого процесса характеризуется определенной скоростью. Единицей измерения скорости ферментативной реакции служит количество молей субстрата, превращаемое в единицу времени (как и скорость обычной реакции).
Взаимодействие фермента с субстратом приводит к образованию фермент-субстратного комплекса, но этот процесс обратимый. Скорости прямой и обратной реакций зависят от концентраций реагирующих веществ и описываются соответствующими уравнениями:
В состоянии равновесия справедливо уравнение (6.3), поскольку скорости прямой и обратной реакции равны.
Подставив значения скорости прямой (6.1) и обратной (6.2) реакции в уравнение (6.3), получим равенство:
Состояние равновесия характеризуется соответствующей константой равновесия К р, равной отношению констант прямой и обратной реакций (6.5). Величина, обратная константе равновесия, называется субстратной константой K s , или константой диссоциации фермент-субстратного комплекса:

Из уравнения (6.6) ясно, что субстратная константа уменьшается при высокой концентрации фермент-субстратного комплекса, т.е. при большой его устойчивости. Следовательно, субстратная константа характеризует сродство фермента и субстрата и соотношение констант скоростей образования и диссоциации фермент-субстратного комплекса.
Явление насыщения фермента субстратом изучали Леонор Михаэлис и Мод Мептен. На основе математической обработки результатов ими было выведено уравнение (6.7), получившее их имена, из которого ясно, что при высокой концентрации субстрата и низком значении субстратной константы скорость ферментативной реакции стремится к максимальной. Однако это уравнение носит ограниченный характер, поскольку учитывает не все параметры:
Фермент-субстратный комплекс в процессе реакции может подвергаться превращениям в разных направлениях:
- диссоциировать на исходные вещества;
- превращаться в продукт, от которого отделяется фермент в неизменном виде.
Поэтому для описания суммарного действия ферментативного процесса введено понятие константы Михаэлиса К т, которая выражает взаимосвязь констант скоростей всех трех реакций ферментативного катализа (6.8). Если оба слагаемых разделить на константу скорости реакции образования фермент-субстратного комплекса, то получится выражение (6.9):

Из уравнения (6.9) вытекает важное следствие: константа Михаэлиса всегда больше субстратной константы на величину k 2 /k v
Численно К т равна такой концентрация субстрата, при которой скорость реакции составляет половину максимально возможной скорости и соответствует такому насыщению фермента субстратом, как на рис. 6.5, б. Поскольку на практике не всегда удается достичь полного насыщения фермента субстратом, то именно К т используется для сравнительной характеристики кинетических характеристик ферментов.
Скорость ферментативной реакции при неполном насыщении фермента субстратом (6.10) зависит от концентрации фермент-субстратного комплекса. Коэффициентом пропорциональности служит константа реакции освобождения фермента и продукта, поскольку при этом меняется концентрация фермент-субстратного комплекса:
После преобразований, с учетом представленных выше зависимостей, скорость ферментативной реакции при неполном насыщении фермента субстратом описывается уравнением (6.11), т.е. зависит от концентраций фермента, субстрата и их сродства K s:
Графическая зависимость скорости ферментативной реакции от концентрации субстрата не является линейной. Как очевидно из рис. 6.6, с увеличением концентрации субстрата наблюдается рост активности фермента. Однако при достижении максимального насыщения фермента субстратом скорость ферментативной реакции становится максимальной. Следовательно, фактором, ограничивающим скорость реакции, является образование фермент-субстратного комплекса.
Практика показала, что концентрации субстратов, как правило, выражаются значениями намного меньше единицы (10 6 -10 3 моль). Оперировать такими величинами в расчетах довольно сложно. Поэтому Г. Лайнуивер и Д. Берк предложили выражать графическую зависимость скорости ферментативной реакции не в прямых координатах, а в обратных. Они исходили из предположения, что для равных величин равны и обратные им значения:

Рис. 6.6.
После преобразования выражения (6.13) получается выражение, называемое уравнением Лайнуивера - Бэрка (6.14):
Графическая зависимость уравнения Лайнуивера- Берка носит линейный характер (рис. 6.7). Кинетические характеристики фермента определяются следующим образом:
- отрезок, отсекаемый на оси ординат, равен 1/V;
- отрезок, отсекаемый на оси абсцисс, равен -1 /К т.

Рис. 6.7.
Считается, что метод Лайнуивера - Берка позволяет более точно, чем в прямых координатах, определить максимальную скорость реакции. Из этого графика можно также извлечь ценную информацию, касающуюся ингибирования фермента.
Существуют и другие способы преобразования уравнения Михаэлиса- Ментен. Графические зависимости используют при изучении влияния различных внешних воздействий на ферментативный процесс.
Данный раздел энзимологии изучает влияние различных факторов на скорость ферментативной реакции. Учитывая общее уравнение ферментативного катализа обратимой реакции превращения одного субстрата в один продукт (1),
следует назвать главные факторы влияния на скорость ферментативной реакции: концентрация субстрата [S], концентрация фермента [E] и концентрация продукта реакции [P].
Взаимодействие некоторых ферментов с их субстратом можно описать гиперболической кривой зависимости скорости ферментативной реакции V от концентрации субстрата [S] (рис.19):

Рис.19.Зависимость скорости ферментативной реакции от концентрации субстрата.
На этой кривой можно выделить три участка, которые можно объяснить по положениям механизма взаимодействия фермента с субстратом: ОА – участок прямо пропорциональной зависимости V от [S], происходит постепенное заполнение активных центров фермента молекулами субстрата с образованием неустойчивого комплекса ES; участок АВ - криволинейная зависимость V от [S], полное насыщение активных центров фермента молекулами субстрата еще не достигнуто. Комплекс ES до достижения переходного состояния является нестабильным, вероятность обратной диссоциации до E и S еще велика; участок ВС - зависимость описывается уравнением нулевого порядка, участок параллелен оси [S], достигнуто полное насыщение активных ферментов молекулами субстрата, V=V max .
Характерная форма кривой описывается математически уравнением Бриггса-Холдейна:
V=V max ● [S]/ Km + [S] (2),
где Кm - константа Михаэлиса-Ментен, численно равная концентрации субстрата, при которой скорость ферментативной реакции равна половине V max .
Чем меньше K m фермента, тем выше сродство фермента к субстрату, тем быстрее достигается переходное состояние для субстрата, и он превращается в продукт реакции. Поиск значений Km для каждого из субстратов фермента с групповой специфичностью важен при определении биологической роли этого фермента в клетке.
Для большинства ферментов невозможно построить гиперболическую кривую (рис.19), В таком случае используется метод двойных обратных величин (Лайнуивера-Бэрка), т.е. строится графическая зависимость 1/[V] от 1/[S] (рис.20). Метод построения таких кривых в эксперименте очень удобен при изучении влияния различных типов ингибиторов на активность ферментов (см. по тексту дальше).

Рис.20. График зависимости 1/[V] от 1/[S] (метод Лайнуивера-Бэрка),
где y-отсекаемый участок - , а x – отсекаемый участок -  , тангенс угла α - .
, тангенс угла α - .
Зависимость скорости ферментативной реакции V от концентрации фермента [E].
Данная графическая зависимость (рис.21) рассматривается при оптимальных температуре и рН окружающей среды, при концентрациях субстрата, значительно превышающих концентрацию насыщения активных центров фермента.

Рис. 21. Влияние концентрации фермента на скорость ферментативной реакции.
Зависимость скорости ферментативной реакции от концентрации кофактора или кофермента. Для сложных ферментов, следует учитывать, что дефицит коферментных форм витаминов при гиповитаминозах, нарушение поступления в организм ионов металлов обязательно приводят к уменьшению концентрации соответствующих ферментов, необходимых для течения процессов обмена веществ. Поэтому следует сделать вывод о прямой зависимости активности фермента от концентрации кофактора или кофермента.
Влияние концентрации продуктов на скорость ферментативной реакции. Для обратимых реакций, протекающих в организме человека, необходимо учитывать, что продукты прямой реакции могут быть использованы ферментом в качестве субстратов обратной реакции. Поэтому направление течения и момент достижения V max являются зависимыми от соотношения концентраций исходных субстратов и продуктов реакции. Так, например, активность аланинаминотрасферазы, катализирующей превращение:
Аланин + Альфа-кетоглутарат ↔ Пируват + Глутамат
зависит в клетке от соотношения концентраций:
[аланин + альфа-кетоглутарат] / [пируват+глутамат].
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. ТЕОРИИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Ферменты, как и небелковые катализаторы, увеличивают скорость химической реакции по причине способности снижать энергию активации этой реакции. Энергия активации ферментативной реакции рассчитывается как разность между значением энергии в системе протекающей реакции достигшей переходного состояния и энергией, определяемой в начале реакции (см. графическую зависимость рис. 22).

Рис. 22. Графическая зависимость энергетического состояния химической реакции без фермента (1) и в присутствии фермента (2) от времени течения реакции.
Работы В. Генри и, в особенности, Л. Михаэлиса, М. Ментен по изучению механизма моносубстратных обратимых ферментативных реакций позволили постулировать, что фермент Е сначала обратимо и относительно быстро соединяется со своим субстратом S c образованием фермент-субстратного комплекса (ЕS):
E + S <=> ES (1)
Образование ЕS происходит за счет водородных связей, электростатических, гидрофобных взаимодействий, в некоторых случаях ковалентных, координационных связей между боковыми радикалами аминокислотных остатков активного центра и функциональными группами субстрата. У сложных ферментов функцию контакта с субстратом может выполнить и небелковая часть структуры.
Фермент-субстратный комплекс затем распадается во второй более медленной обратимой реакции с образованием продукта реакции Р и свободного фермента Е:
ES <=> EР <=>E + P (2)
В настоящее время, благодаря работам выше названных ученых, а также Кейлина Д., Чанса Б., Кошленда Д. (теория «индуцированного соответствия»), существуют теоретические положения о четырёх основных моментах в механизме действия фермента на субстрат, определяющих способность ферментов ускорять химические реакции:
1. Ориентация и сближение . Фермент способен связывать молекулу субстрата таким образом, что атакуемая ферментом связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. Вероятность того, что комплекс ES достигнет переходного состояния за счет ориентации и сближения, сильно увеличивается.
2. Напряжение и деформация : индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, облегчая тем самым достижение комплексом ES переходного состояния. Возникает так называемое индуцированное соответствие между молекулами E и S.
ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ КИНЕТИКА
изучает закономерности протекания во времени ферментативных р-ций, а также их механизм; раздел кинетики химической.
Каталитич. цикл конверсии в-ва S (субстрата) в продукт P под действием фермента E протекает с образованием промежут. соед. X i
:
где ki -
константы скорости отдельных элементарных стадий,
образования фермент-субстратного комплекса X 1 (ES, комплекс Михаэлиса).
При данной т-ре скорость р-ции зависит от концентраций фермента, субстрата и состава среды. Различают стационарную, предстационарную и релаксационную кинетику ферментативных р-ций.
Стационарная кинетика.
В стационарном состоянии по промежуточным соед. (dX i
/dt
= 0, i = 1, ..., n
) и при избытке субстрата , где [S] 0 и [E] 0 - начальные концентрации соотв. субстрата и фермента, кинетика процесса характеризуется постоянным, неизменным во времени уровнем концентраций промежут. соед., а выражение для скорости процесса v
0 , наз. начальной стационарной скоростью, имеет вид (ур-ние Михаэлиса- Ментен):
 (1)
(1)
где значения k кат и К м ->
ф-ции констант скорости элементарных стадий и заданы ур-нениями:

Величину k кат
наз.
эффективной каталитич. константой скорости процесса, параметр К м ->
константой Михаэлиса. Значение k кат
определяется величинами наиб. медленных стадий каталитич. р-ций и иногда наз. числом оборотов фермента (ферментной системы); k кат
характеризует число каталитич. циклов, совершаемых ферментной системой в единицу времени. Наиб. распространены , имеющие значение k кат. для специфич. субстратов в диапазоне 10 2 -10 3 с -1 . Типичные значения константы Михаэлиса лежат в интервале 10 -3 - 10 -4 M.
При больших концентрациях субстрата, когда т. е. скорость р-ции не зависит от концентрации субстрата и достигает постоянной величины, наз. макс. скоростью. Графически ур-ние Михаэлиса - Ментен представляет собой гиперболу. Его можно линеаризовать, используя метод двойных обратных величин (метод Лайнуи-вера - Берка), т. е. строя зависимость 1/vот 1/[S] 0 , или др. методы. Линейная форма ур-ния (1) имеет вид:
 (2)
(2)
Она позволяет определить графически значения К м
и v макс (рис. 1).

Рис. 1. График линейной трансформации ур-ния Михаэлиса - Ментен в двойных обратных величинах (по Лайнуиверу - Берку).
Величина К м >
численно равна концентрации субстрата, при к-рой скорость р-ции равна , поэтому К м
часто служит мерой сродства субстрата и фермента, однако это справедливо лишь, если
Величины К м >
и изменяются в зависимости от значений рН. Это связано со способностью участвующих в катализе групп молекулы фермента изменять свое состояние ионизации и, тем самым, свою каталитич. эффективность. В простейшем случае изменение рН приводит к протонированию или депротонированию, по крайней мере, двух ионизирующихся групп фермента, участвующих в катализе. Если при этом только одна форма фермент-субстратного комплекса (напр., ESH) из трех возможных (ES, ESH и ESH 2) способна превращаться в продукт р-ции, то зависимость скорости от рН описывается ф-лой:

где f =
1 + / и f "
= 1 +
+ K" b />
-т. наз. рН-ф-ции Михаэлиса, а К а, К b
и К" a , K" b ->
константы ионизации групп аи bсоотв. своб. фермента и фермент-субстратного комплекса. В координатах lg - рН эта зависимость представлена на рис. 2, причем тангенсы углов наклона касательных к восходящей, независимой от рН, и нисходящей ветвям кривой должны быть равны соответственно +1, 0 и -1. Из такого графика можно определить значения рК а
групп, участвующих в катализе.

Рис. 2. Зависимость каталитич. константы от рН в логарифмич. координатах.
Скорость ферментативной р-ции не всегда подчиняется ур-нию (1). Один из часто встречающихся случаев - участие в р-ции аллостерич. ферментов (см. Регуляторы ферментов),
для к-рых зависимость степени насыщения фермента от [S] 0 имеет негиперболич. характер (рис. 3). Это явление обусловлено кооперативностью связывания субстрата, т. е. когда связывание субстрата на одном из участков макромолекулы фермента увеличивает (положит. кооперативность) или уменьшает (отрицат. кооперативность) сродство к субстрату др. участка.

Рис. З Зависимость степени насыщения фермента субстратом от концентрации субстрата при положительной (I) и отрицательной (II) кооперативности, а также в ее отсутствии (III).
Предстационарная кинетика.
При быстром смешении р-ров фермента и субстрата в интервале времен 10 -6 -10 -1 с можно наблюдать переходные процессы, предшествующие образованию устойчивого стационарного состояния. В этом предстационарном режиме при использовании большого избытка субстрата система дифференц. ур-ний, описывающая кинетику процессов, линейна. Решение данного типа системы линейных дифференц. ур-ний дается суммой экспоненциальных членов. Так, для кинетич. схемы, представленной выше, кинетика накопления продукта имеет вид:

где A i ->
, b, а n ->
ф-ции элементарных констант скорости; -корни соответствующего характеристич. ур-ния.
Величина, обратная , наз. характеристич. временем процесса:
Для р-ции, протекающей с участием nпромежут. соед., можно получить nхарактеристич. времен.
Исследование кинетики ферментативной р-ции в предстационарном режиме позволяет получить представление о детальном механизме каталитич. цикла и определить константы скорости элементарных стадий процесса.
Экспериментально кинетику ферментативной р-ции в предстационарном режиме исследуют с помощью метода остановленной струи (см. Струевые кинетические методы),
позволяющего смешивать компоненты р-ции в течение 1 мс.
Релаксационная кинетика.
При быстром возмущающем воздействии на систему (изменение т-ры, давления, электрич. поля) время, к-рое необходимо системе для достижения нового равновесия или стационарного состояния, зависит от скорости процессов, определяющих каталитич. ферментативный цикл.
Система ур-ний, описывающая кинетику процесса, линейна, если смещение от положения равновесия невелико. Решение системы приводит к зависимостям концентраций компонентов разл. стадий процесса в виде суммы экспоненциальных членов, показатели экспонент к-рых имеют характер времен релаксаций. Результатом исследования является спектр времен релаксации, соответствующий числу промежут. соед., участвующих в процессе. Величины времен релаксаций зависят от констант скорости элементарных стадий процессов.
Релаксационные методы
кинетики позволяют определить константы скорости отдельных элементарных стадий трансформации интермедиатов. Методы изучения релаксационной кинетики имеют разл. разрешающую способность: поглощение ультразвука - 10 -6 -10 -10
с, температурный скачок - 1O -4 -10 -6 с, метод электрич. импульса - 10 -4 -10 -6 с, скачок давления - 10 -2 с. При исследовании кинетики ферментативных р-ций наиб, применение нашел метод температурного скачка.
Макрокинетика ферментативных процессов.
Развитие методов получения гетерогенных катализаторов путем иммобилизации ферментов на разл. носителях (см. Иммобилизованные ферменты
)обусловило необходимость анализа кинетики процессов с учетом массопереноса субстрата. Теоретически и экспериментально исследованы закономерности кинетики р-ций с учетом эффектов диффузионного слоя и для систем с внутридиффузионными затруднениями при распределении фермента внутри носителя.
В условиях, когда на кинетику процесса влияет диффузионный перенос субстрата, каталитич. эффективность системы уменьшается. Фактор эффективности равен отношению плотности потока продукта в условиях протекания ферментативной р-ции с диффузионно пониженной концентрацией субстрата к потоку, к-рый мог бы реализоваться в отсутствие диффузионных ограничений. В чисто диффузионной области, когда скорость процесса определяется массопереносом субстрата, фактор эффективности для систем с внешнедиффузи-онным торможением обратно пропорционален диффузионному модулю :

где
толщина диффузионного слоя, D - коэф. диффузии субстрата.
Для систем с внутридиффузионным торможением в р-циях первого порядка

где Ф т
- безразмерный модуль (модуль Тиле).
При анализе кинетич. закономерностей в ферментативных реакторах широкое теоретич. и эксперим. развитие получили "идеальные" модели реакторов, проточный (проточный реактор идеального перемешивания), проточный реактор с идеальным вытеснением, мембранный реактор.
Кинетика полиферментных процессов.
В организме (клетке) ферменты действуют не изолированно, а катализируют цепи трансформации молекул. Р-ции в полиферментных системах с кинетич. точки зрения можно рассматривать как последоват. процессы, специфич. особенностью к-рых является ферментами каждой из стадий:
где ,
соотв. макс, скорость процесса и константа Михаэлиса i
-й стадии р-ции соответственно.
Важная особенность процесса - возможность образования устойчивого стационарного состояния. Условием-его возникновения может служить неравенство > v 0 , где v 0 - скорость лимитирующей стадии, характеризуемой наименьшей константой скорости и тем самым определяющей скорость всего последоват. процесса. В стационарном состоянии концентрации метаболитов после лимитирующей стадии меньше константы Михаэлиса соответствующего фермента.
Специфич. группу полиферментных систем составляют системы, осуществляющие окислит.-восстановит. р-ции с участием белковых переносчиков электронов. Переносчики образуют специфич. структуры, комплексы с детерминированной последовательностью переноса электрона. Кинетич. описание такого рода систем рассматривает в качестве независимой переменной состояния цепей с разл. степенью заселенности электронами.
Применение.
Ф. р. к. широко используют в исследовательской практике для изучения механизмов действия ферментов и ферментных систем. Практически значимая область науки о ферментах - инженерная энзимология,
оперирует понятиями Ф. р. к. для оптимизации биотехнол. процессов.
Лит.:
Полторак О. M., Чухрай E. С, Физико-химические основы ферментативного катализа, M., 1971; Березин И. В., Мартинек К, Основы физической химии ферментативного катализа, M., 1977; Варфоломеев С. Д., Зайцев С. В., Кинетические методы в биохимических исследованиях, M.. 1982. С. Д. Варфоломеев.
Химическая энциклопедия. - М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ КИНЕТИКА" в других словарях:
Каталитич. р ция циклич. процесс, складывающийся из ряда элементарных р ций, скорости к рых описываются действующих масс законом. Этот закон имеет простую форму для идеальных газовых смесей, идеальных р ров и идеальных поверхностных слоев.… … Химическая энциклопедия
Кинетика химических реакций, учение о химических процессах о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической… … Большая советская энциклопедия
КИНЕТИКА ХИМИЧЕСКАЯ - (от греч. kinesis движение), отдел теоретической химии, посвященный изучению законов хим. реакций. Можно наметить несколько типов хим. взаимодействий и прежде всего отличать реакции, протекающие в гомогенной (однородной) среде, от реакций,… … Большая медицинская энциклопедия
- (биокатализ), ускорение биохим. р ций при участии белковых макромолекул, называемых ферментами (энзимами). Ф. к. разновидность катализа, хотя термин ферментация (брожение)известен с давних времен, когда еще не было понятия хим. катализа. Первое… … Химическая энциклопедия
- (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
- (от лат. fermentum закваска) (энзимы), белки, выполняющие роль катализаторов в живых организмах. Осн. ф ции Ф. ускорять превращение в в, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его … Химическая энциклопедия
- (от греч. pharmakon лекарство и kinetikos приводящий в движение), изучает кинетич. закономерности процессов, происходящих с лек. ср вом в организме. Осн. фармакокинетич. процессы: всасывание, распределение, метаболизм и экскреция (выведение).… … Химическая энциклопедия
Ферментативная кинетика изучает влияние различных факторов (концентрация S и E, рН, температура, давление, ингибиторы и активаторы) на скорость ферментативных реакций. Главной целью изучения кинетики ферментативных реакций является получение информации, позволяющей глубже понять механизм действия ферментов.
Кинетическая кривая позволяет определить начальную скорость реакции V 0 .
Кривая субстратного насыщения.
Зависимость скорости реакции от концентрации фермента.
Зависимость скорости реакции от температуры.
Зависимость скорости реакции от рН.
|
|
Оптимум рН действия большинства ферментов лежит в пределах физиологических значений 6,0-8,0. Пепсин активен при рН 1,5-2,0, что соответствует кислотности желудочного сока. Аргиназа, специфичный фермент печени, активен при 10,0. Влияние рН среды на скорость ферментативной реакции связывают с состоянием и степенью ионизации ионогенных групп в молекуле фермента и субстрата. Этот фактор определяет конформацию белка, состояние активного центра и субстрата, формирование фермент-субстратного комплекса, собственно процесс катализа. |
Математическое описание кривой субстратного насыщения, константа Михаэлиса .
|
|
Уравнение, описывающее кривую субстратного насыщения, было предложено Михаэлисом и Ментон и носит их имена (уравнение Михаэлиса-Ментен): V = (V MAX *[ S ])/(Km +[ S ]) , где Km – константа Михаэлиса. Легко рассчитать, что при V = V MAX /2 Km = [S], т.е. Km – это концентрация субстрата, при которой скорость реакции составляет ½ V MAX . С целью упрощения определения величины V MAX и Km уравнение Михаэлиса-Ментен можно пересчитать. 1/V = (Km+[S])/(V MAX *[S]), 1/V = Km/(V MAX *[S]) + 1/V MAX , |
|
|
1/ V = Km / V MAX *1/[ S ] + 1/ V MAX уравнение Лайнуивера-Берка. Уравнение, описывающее график Лайнуивера-Берка – это уравнение прямой линии (y = mx + c), где 1/V MAX – это отрезок, отсекаемый прямой на оси ординат; Km/V MAX - тангенс угла наклона прямой; пересечение прямой с осью абсцисс дает величину 1/Km. График Лайнуивера-Бэрка позволяет определить Km по относительно небольшому числу точек. Этот график также используют при оценке действия ингибиторов, о чем будет сказано ниже. Значение Km изменяются в широких пределах: от 10 -6 моль/л для очень активных ферментов, до 10 -2 – для малоактивных ферментов. |
Оценки Km имеют практическую ценность. При концентрациях субстрата в 100 раз превышающих Km, фермент будет работать практически с максимальной скоростью, поэтому максимальная скорость V MAX будет отражать количество присутствующего активного фермента. Это обстоятельство используют для оценки содержания фермента в препарате. Кроме того, Km является характеристикой фермента, что используется для диагностики энзимопатий.
Ингибирование активности ферментов.
Чрезвычайно характеристикой и важной особенностью ферментов является их инактивация под влиянием определенных ингибиторов.
Ингибиторы – это вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами.
Ингибирование ферментативной активности может быть необратимым или обратимым, конкурентным или неконкрентным.
Необратимое ингибирование – это стойкая инактивация фермента, возникающая в результате ковалентного связывания молекулы ингибитора в активном центре или в другом особом центре, изменяющим конформацию фермента. Диссоциация столь устойчивых комплексов с регенерацией свободного фермента практически исключена. Для преодоления последствий такого ингибирования организм должен синтезировать новые молекулы фермента.
Обратимое ингибирование – характеризуется равновесным комплексообразованием ингибитора с ферментом за счет нековалентных связей, вследствие чего такие комплексы способны к диссоциации с восстановлением активности фермента.
Классификация ингибиторов на конкурентные и неконкурентные основана на том, ослабляется (конкурентное ингибирование ) или не ослабляется (неконкурентное ингибирование ) их ингибирующие действие при повышении концентрации субстрата.
Конкурентные ингибиторы – это, как правило, соединения, структура которых сходна со структурой субстрата. Это позволяет им связываться в том же активном центре, что и субстраты, препятствуя взаимодействию фермента с субстратом уже на стадии связывания. После связывания ингибитор может быть превращен в некий продукт или остается в активном центре, пока не произойдет диссоциация.
Обратимое конкурентное ингибирование можно представить в виде схемы:
E↔ E-I → E + P 1
S (неакт)
Степень ингибирования фермента определяется соотношением концентраций субстрата и фермента.
Классическим примером подобного типа ингибирования является торможение активности сукцинатдегидрогеназы (СДГ) малатом, который вытесняет сукцинат из субстратного участка и препятствует его превращению в фумарат:

Ковалентное связывание ингибитора в активном центре приводит к инактивации фермента (необратимое ингибирование). Примером необратимого конкурентного ингибирования может служить инактивация триозофосфатизомеразы 3-хлорацетолфосфатом. Этот ингибитор является структурным аналогом субстрата – диоксиацетонфосфата и необратимо присоединяется к остатку глутаминовой кислоты в активном центре:
Некоторые ингибиторы действуют менее избирательно, взаимодействуя с определенной функциональной группой в составе активного центра разных ферментов. Так, связывание йодацетата или его амида с SH-группой аминокислоты цистеина, находящийся в активном центре фермента и принемающей участие в катализе, приводит к полной утрате активности фермента:
R-SH + JCH 2 COOH → HJ + R-S-CH 2 COOH
Поэтому эти ингибиторы инактивируют все ферменты, которые имеют SH-группы, участвующие в катализе.
Необратимое ингибирование гидролаз при действии нервно-паралитических газов (зарин, зоман) обусловлено их ковалентным связыванием с остатком серина в активном центре.
Метод конкурентного ингибирования нашел широкое применение в медицинской практике. Сульфаниламидные препараты – антагонисты п-аминобензойной кислоты, могут служить примером метаболизируемых конкурентных ингибиторов. Они связываются с дигидроптератсинтетазой – бактериальным ферментом, осуществляющим превращение п-аминобензоата в фолиевую кислоту, необходимую для роста бактерий. Бактерия погибает в результате того, что связавшийся сульфаниламид превращается в другое соединение и фолиевая кислота не образуется.
Неконкурентные ингибиторы обычно связываются с молекулой фермента в участке, отличном от места связывания субстрата, и субстрат непосредственно не конкурирует с ингибитором. Поскольку ингибитор и субстрат связываются с разными центрами возможно образование как комплекса E-I, так и комплекса S-E-I. Комплекс S-E-I тоже распадается с образованием продукта, однако с меньшей скоростью, чем E-S, поэтому реакция будет замедляться, но не остановится. Таким образом, могут протекать следующие параллельные реакции:
E↔ E-I ↔ S-E-I → E-I + P
Обратимое неконкурентное ингибирование встречается сравнительно редко.
Неконкурентные ингибиторы называют аллостерическими в отличие от конкурентных (изостерических ).
Обратимое ингибирование может быть количественно изучено на основе уравнения Михаэлиса-Ментен.
При конкурентном ингибировании V MAX остается постоянной, а Km возрастает.
|
|
|
При неконкурентном ингибировании снижается V MAX при неизменном Km.
|
|
|
Если продукт реакции ингибирует фермент, катализирующий его образование, такой способ ингибирования называется ретроингибированием или ингибированием по принципу обратной связи . Например, глюкоза тормозит глюкозо-6-фосфатазу, которая катализирует гидролиз глюкозо-6-фосфата.
Биологическое значение такого ингибирования – регуляция определенных метаболических путей (см. следующее занятие).
ПРАКТИЧЕСКАЯ ЧАСТЬ
Задание студентам
1. Изучить денатурацию белков под действием растворов минеральных и органических кислот и при нагревании.
2. Обнаружить кофермент НАД в дрожжах.
3. Определить амилазную активность в моче (сыворотке крови).
9. ЭТАЛОНЫ ОТВЕТОВ НА ЗАДАЧИ , тестовые вопросы, используемые при контроле знаний на занятии (можно в виде приложения)
10. ХАРАКТЕР И ОБЪЕМ ВОЗМОЖНОЙ УЧЕБНО-ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЫ ПО ТЕМЕ
(Указать конкретно характер и форму УИРС: подготовка реферативных выступлений, проведение самостоятельных исследований, имитационная игра, оформление истории болезни с использованием монографической литературы и др. формы)
Скорость ферментативной реакции
Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Скорость определяют по углу наклона касательной к кривой на начальной стадии реакции.
Рис. 2 Скорость ферментативной реакции.
Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата.
Факторы, влияющие на ферментативную активность
Действие Ф. зависит от ряда факторов: температуры, реакции среды (pH), концентрации фермента, концентрации субстрата, от присутствия специфических активаторов и неспецифических или специфических ингибиторов.
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента.

Рис. 3 Зависимость скорости ферментативной реакции от концентрации фермента.
Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
Температура
Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q 10: Q 10 = (скорость реакции при (х + 10)°C) / (скорость реакции при х °C)
В пределах 0-40°C Q 10 ферментативной реакции равен 2. Иными словами, при каждом повышении температуры на 10°C скорость ферментативной реакции удваивается.

Рис. 4 Влияние температуры на активность такого фермента, как амилаза слюны.
С повышением температуры движение молекул ускоряется, и у молекул реагирующих веществ больше шансов столкнуться друг с другом. Увеличивается, следовательно, и вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность, называется оптимальной. За пределами этого уровня скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию.

Рис. 5 Ход ферментативной реакции при разных температурах.
Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается.
Поскольку белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные (в виде белкового геля или раствора), инактивирование Ф. в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
Концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата.

Рис. 6 Зависимость скорости ферментативной реакции от концентрации субстрата.
Теоретическая максимальная скорость реакции V max никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не влечет за собой сколько-нибудь заметного изменения скорости реакции. Это следует объяснить тем, что при высоких концентрациях субстрата активные центры молекул Ф. в любой данный момент оказываются практически насыщенными. Таким образом, сколько бы ни было в наличии избыточного субстрата, он может соединиться с Ф. лишь после того, как образовавшийся ранее фермент-субстратный комплекс диссоциирует на продукт и свободный Ф. Поэтому при высоких концентрациях субстрата скорость ферментативной реакции лимитируется и концентрацией субстрата, и временем, которое требуется для диссоциации фермент-субстратного комплекса.
При постоянной температуре любой Ф. работает наиболее эффективно в узких пределах pH. Оптимальным считается то значение pH, при котором реакция протекает с максимальной скоростью.

Рис. 7 Зависимость активности фермента от pH.
При более высоких и более низких pH активность Ф. снижается. Сдвиг pH меняет заряд ионизированных кислотных и основных групп, от которого зависит специфичная форма молекул Ф. В результате изменяется форма молекул Ф., и в первую очередь форма его активного центра. При слишком резких сдвигах pH Ф. денатурирует. Свойственный данному Ф. оптимум pH не всегда совпадает с pH его непосредственного внутриклеточного окружения. Это позволяет предположить, что среда, в которой находится Ф., в какой-то мере регулирует его активность.