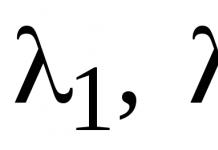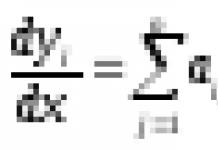При записи кинетического уравнения реакции для газообразных систем вместо концентрации (С) пишут давление (Р) реагентов, так как изменение давления в системе аналогично изменению концентрации. Увеличение давления в системе вызывает уменьшение объема системы во столько же раз, при этом концентрация реагентов в единице объема увеличивается так же. При уменьшении давления происходит увеличение объема системы, при этом концентрации в единице объема уменьшится соответственно.
Примеры и решения задач.
Пример 1.
Скорость какой реакции больше, если за единицу времени в единице объема образовалось в результате первой реакции 9г водяного пара, в результате второй реакции – 3,65г хлористого водорода?
Скорость реакции измеряется количеством молей вещества, которое образуется в единице объема за единицу времени. Молярная масса воды молярная масса хлористого водорода ![]() тогда скорость первой реакции,
тогда скорость первой реакции,
Моль/л×с,
а скорость второй реакции
будет  моль/л.
моль/л.
Скорость образования водяных паров больше, так как число молей образования водяного пара больше, чем число молей образования хлористого водорода.
Пример 2.
Реакция между веществами А и В выражается уравнением: А+2В®С. Начальная концентрация вещества А равна 0,3 моль/л, а вещества В–0,5 моль/л. Константа скорости равна 0,4. Определить скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшается на 0,1 моль/л.
Концентрация вещества А уменьшилась на 0,1 моль/л. Следовательно, исходя из уравнения реакции, концентрация вещества В уменьшилась на 0,2 моль/л, так как перед веществом В стоит коэффициент 2. Тогда концентрация вещества А через некоторое время станет равной 0,3-0,1=0,2 моль/л, а концентрация В – 0,5-0,2=0,3 моль/л.
Определяем скорость реакции:
Моль/л×с
Пример 3.
Как изменится скорость реакции: если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции:
![]() .
.
При увеличении концентрации NO в 3 раза скорость реакции будет:

Скорость реакции увеличится в 9 раз.
Пример 4.
Определите, как изменится скорость реакции, ![]() если увеличить давление в системе в 2 раза.
если увеличить давление в системе в 2 раза.
Увеличение давления в системе в 2 раза вызовет уменьшение объема системы в 2 раза, при этом концентрации реагирующих веществ возрастут в 2 раза.
Согласно закону действующих масс запишем начальную скорость реакции ![]() и при увеличении давления в 2 раза:
и при увеличении давления в 2 раза:
 , .
, .
Скорость реакции увеличится в 8 раз.
Пример 5.
Рассчитайте исходные концентрации веществ А и В в системе А+3В=2С, если равновесные концентрации веществ А равна 0,1 моль/л, веществ В равна 0,2 моль/л, вещества С–0,7 моль/л.
Находим концентрацию вещества А, израсходованную на реакцию, составляя пропорцию по уравнению реакции:
2 моль/л С получено из 1 моль/л А,
0,7 моль/л С ®х моль /л × А.
![]() моль/л А.
моль/л А.
Следовательно, исходная концентрация вещества А равна:
![]()
0,1 + 0,35 = 0,45 моль/л.
Находим концентрацию вещества В, израсходованную на реакцию.
Составляем пропорцию по уравнению реакции:
2 моль/л С получено из 3 моль/л В
0,7 моль/л С ® х моль/л В
х= моль/л А.
Тогда исходная концентрация вещества В равна:
![]()
![]() моль/л.
моль/л.
Пример 6.
При температуре 40 0 С образовалось 0,5 моль/л вещества А. Сколько моль/л А образуется, если повысить температуру до 80 0 С? Температурный коэффициент реакции равен 2.
По правилу Вант-Гоффа запишем выражение скорости реакции при 80 0 С:
![]() .
.
Подставив в уравнение данные задачи, получим:
При 80 0 С образуется 8 моль/л вещества А.
Пример 7.
Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Запишем уравнение Аррениуса для условия задачи:

где R – универсальная газовая постоянная, равная 8,32 Дж/к(К×моль).

откуда изменение константы скорости будет:
61. Скорость химической реакции
2NO(г) + O2(г) = 2NO2(г)
при концентрациях реагирующих веществ =0,3 моль/л и =0,15 моль/л составила 1,2·10-3 моль/(л·с). Найдите значение константы скорости реакции.
62. На сколько градусов следует повысить температуру системы, чтобы скорость протекания в ней реакции возросла в 30 раз (=2,5)?
63. Во сколько раз следует увеличить концентрацию оксида углерода в системе
2СО = СО2+ С,
чтобы скорость реакции увеличилась в 4 раза?
64. Во сколько раз следует увеличить давление, чтобы скорость реакции образования NО2по реакции
возросла в 1000 раз?
65. Реакция идет согласно уравнению
2NO(г) + Cl2(г) = 2NOCl(г).
Концентрации исходных веществ до начала реакции составляли: =0,4 моль/л; =0,3 моль/л. Во сколько раз изменится скорость реакции по сравнению с первоначальной в тот момент, когда успеет прореагировать половина оксида азота?
66. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40, если =3,2?
67. Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению
и определите, во сколько раз увеличится скорость этой реакции, если:
а) концентрация А уменьшится в 2 раза;
б) концентрация А увеличится в 2 раза;
в) концентрация В увеличится в 2 раза;
г) концентрация обоих веществ увеличится в 2 раза.
68. Во сколько раз следует увеличить концентрацию водорода в системе
N2 + 3H2= 2NН3,
чтобы скорость реакции возросла в 100 раз?
69. Вычислите температурный коэффициент скорости реакции, если константа скорости ее при 100 С составляет 0,0006, а при 150 С 0,072.
70. Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO + Cl2= 2NOCl.
Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в 2 раза;
б) концентрации хлора в 2 раза;
в) концентрации обоих веществ в 2 раза?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Примеры решения задач
Химическим равновесием называется такое состояние системы, при котором скорости прямой и обратной химических реакций равны, и концентрации реагирующих веществ не изменяются с течением времени.
Количественной характеристикой химического равновесия является константа равновесия. Константа равновесия при постоянной температуре равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов, и является величиной постоянной.
В общем случае для гомогенной реакции mA+ nB« pC+qD
константа равновесия равна:
Это уравнение выражаем законом действующих масс для обратимой реакции.
При изменении внешних условий происходит смещение химического равновесия, выражающееся в изменении равновесных концентраций исходных веществ и продуктов реакции. Направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Химическое равновесие можно сместить влиянием изменения концентрации реагирующих веществ, температуры, давления.
При увеличении концентрации исходных веществ равновесие сместится в соответствии с принципом Ле-Шателье в сторону продуктов реакции, а при увеличении концентраций продуктов – в сторону исходных веществ.
При изменении температуры (ее увеличении) равновесие смещается в сторону эндотермической реакции (D H > 0), идущей с поглощением тепла, т.е. увеличивается скорость прямой реакции, и равновесие смещается в сторону продуктов реакции. В случае экзотермической реакции (D H > 0), при увеличении температуры увеличится скорость обратной реакции, которая будет обеспечивать поглощение тепла, и равновесие сместится в сторону исходных веществ.
Если в реакции участвуют вещества в газообразном состоянии, то химическое равновесие можно сместить изменением давления. Увеличение давления равносильно увеличено концентрации реагирующих веществ. При увеличении давления равновесие смещается в сторону реакции с меньшим числом молей газообразных веществ, а при уменьшении давления – в сторону реакции с большим числом молей газообразных веществ.
Пример 1.
Рассчитайте исходные концентрации вещества А и В в гомогенной системе А+3В«2С, если равновесные концентрации А=0,1 моль/л, В=0,2 моль/л, С= 0,7 моль/л.
Известно, что исходная концентрация вещества равна сумме равновесной и концентрации, ушедшей на реакцию, т.е. прореагировавшей:
Чтобы найти надо знать, сколько вещества А прореагировало.
Рассчитываем , составляя пропорцию по уравнению реакций:
2моль/л С получено из 1 моль/л А
0,7 моль/л С ––––––––х моль/л А,
х= (0,7×1)/2= 0,35 моль/л
![]()
Рассчитываем исходную концентрацию вещества В:
![]()
Для нахождения составим пропорцию:
2 моль/л С получено из 3моль/л В
0,7 моль/л С –––––––––––––х моль/л В
х = (0,7×3)/2 = 1,05 моль/л
Тогда исходная концентрация В равна:
Пример 2 .
Рассчитайте равновесные концентрации веществ в системе А+В «С+Д при условии, что исходные концентрации веществ: А=1 моль/л, В= 5 моль/л. Константа равновесия равна 1.
Предположим, что к моменту равновесия вещества А прореагировало х молей. Исходя из уравнения реакции, равновесные концентрации будут:
![]() ;
; ![]()
так как по уравнению реакции вещества В ушло на реакции столько же, сколько прореагировало вещества А.
Подставляем значения равновесных концентраций в константу равновесия и находим х.

Тогда: ![]()
![]()
![]()
![]()
Пример 3.
В системе установилось равновесие: 2АВ+В 2 «2АВ; D H > 0.
В каком направлении сместится равновесие при уменьшении температуры?
Данная прямая реакция является эндотермической, т.е. идет с поглощением тепла, поэтому при уменьшении температуры в системе, равновесие в соответствии с принципом Ле-Шателье сместится влево, в сторону обратной реакции, которая является экзотермической.
Пример 4 .
Равновесие системы А + В « АВ установилось при следующих концентрациях веществ: С(А)=С(В)=C(АВ)=0,01моль/л. Рассчитайте константу равновесия и исходные концентрации веществ.72. Исходные концентрации оксида азота (II) и хлора в системе
2NO + Cl2 2NOCl
составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 оксида азота (II).
73. При некоторой температуре равновесные концентрации реагентов обратимой химической реакции
2А(г)+В(г) 2С(г)
составили [А]=0,04 моль/л, [В]=0,06 моль/л, [C]=0,02 моль/л. Вычислите константу равновесия и исходные концентрации веществ А и В.
74. При некоторой температуре равновесные концентрации в системе
составляли соответственно: = 0,04 моль/л, = 0,06 моль/л,
0,02 моль/л. Вычислите константу равновесия и исходные кон-
центрации оксида серы (IV) и кислорода.
75. При состоянии равновесия системы
концентрации участвующих веществ были: = 0,3 моль/л; = =0,9 моль/л; = 0,4 моль/л. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличится в 5 раз. В каком направлении сместится равновесие?
76. Вычислите константу равновесия обратимой реакции
2SO2(г) + O2(г) 2SO3(г),
если равновесная концентрация =0,04 моль/л, а исходные концен-трации веществ =1 моль/л, =0,8 моль/л.
77. Равновесие системы
CO + Cl2 COCl2,
установилось при следующих концентрациях реагирующих веществ: [СО] = =[Сl2] = = 0,001 моль/л. Определите константу равновесия и исходные концентрации окиси углерода и хлора.
78. Исходные концентрации оксида углерода (II) и паров воды равны и составляют 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2в системе
CO + H2O CO2+ H2,
если равновесная концентрация СО2оказалась равной 0,01 моль/л. Вычислите константу равновесия.
79. Определите равновесную концентрацию водорода в системе
если исходная концентрация HJ составляла 0,05 моль/л, а константа равновесия К=0,02.
80. Константа равновесия системы
СО + Н2О СО2+ Н2
при некоторой температуре равна 1. Вычислите процентный состав смеси в состоянии равновесия, если начальные концентрации СО и Н2О составляют по 1 моль/л.
Химические реакции протекают с различными скоростями: с малой скоростью - при образовании сталактитов и сталагмитов, со средней скоростью - при варке пищи, мгновенно - при взрыве. Очень быстро проходят реакции в водных растворах.

Определение скорости химической реакции, а также выяснение ее зависимости от условий проведения процесса - задача химической кинетики - науки о закономерностях протекания химических реакций во времени.
Если химические реакции происходят в однородной среде, например в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции называют гомогенными .
(v гомог) определяется как изменением количества вещества в единицу времени в единице объема:

где Δn - изменение числа молей одного вещества (чаще всего исходного, но может быть и продукта реакции); Δt - интервал времени (с, мин); V - объем газа или раствора (л).
Поскольку отношение количества вещества к объему представляет собой молярную концентрацию С, то

Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:

если объем системы не меняется.
Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью), или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными .
Определяется как изменение количества вещества в единицу времени на единице поверхности.

где S - площадь поверхности соприкосновения веществ (м 2 , см 2).
Изменение количества вещества, по которому определяют скорость реакции, - это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того, чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться, причем столкнуться эффективно: не разлететься, как мячики, в разные стороны, а так, чтобы в частицах разрушились или ослабли «старые связи» и смогли образоваться «новые», а для этого частицы должны обладать достаточной энергией.
Расчетные данные показывают, что, например, в газах столкновения молекул при атмосферно давлении исчисляются миллиардами за 1 секунду, то есть все реакции должны были бы идти мгновенно. Но это не так. Оказывается, что лишь очень небольшая доля молекул обладает необходимой энергией, приводящей к эффективному соударению.
Минимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение, называют энергией активации E a .
Таким образом, на пути всех частиц, вступающих в реакцию, имеется энергетический барьер, равный энергии активации E a . Когда он маленький, то находится много частиц, которые могут его преодолеть, и скорость реакции велика. В противном случае требуется «толчок». Когда вы подносите спичку, чтобы зажечь спиртовку, вы сообщаете дополнительную энергию E a , необходимую для эффективного соударения молекул спирта с молекулами кислорода (преодоление барьера).
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций .

Температура
При повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. X. Вант- Гофф сформулировал правило:
Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2-4 раза (эту величину называют температурным коэффициентом реакции).
При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля «активных» молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции. Математически эта зависимость выражается соотношением:

где v t 1 и v t 2 - скорости реакции соответственно при конечной t 2 и начальной t 1 температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 °С.
Однако для увеличения скорости реакции повышение температуры не всегда применимо, т. к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества и т. д.
Эндотермические и экзотермические реакции
Реакция метана с кислородом воздуха, как известно, сопровождается выделением большого количества тепла. Поэтому ее используют в быту для приготовления пищи, нагревания воды и отопления. Природный газ, поступающий в дома по трубам, на 98% состоит именно из метана. Реакция оксида кальция (СаО) с водой тоже сопровождается выделением большого количества тепла.
О чем могут говорить эти факты? При образовании новых химических связей в продуктах реакции выделяется больше энергии, чем требуется на разрыв химических связей в реагентах. Избыток энергии выделяется в виде тепла, а иногда и света.
СН 4 + 2О 2 = СО 2 + 2Н 2 О + Q (энергия (свет, тепло));
СаО + Н 2 О = Са(ОН) 2 + Q (энергия (тепло)).
Такие реакции должны протекать легко (как легко катится под гору камень).
Реакции, в которых энергия выделяется, называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского «экзо» – наружу).
Например, многие окислительно-восстановительные реакции являются экзотермическими. Одна из таких красивых реакций — внутримолекулярное окисление-восстановление, протекающее внутри одной и той же соли — дихромата аммония (NH 4) 2 Cr 2 O 7:
(NH 4) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4 H 2 O + Q (энергия).
Другое дело – обратные реакции. Они аналогичны закатыванию камня в гору. Получить метан из CO 2 и воды до сих пор не удается, а для получения негашеной извести СаО из гидроксида кальция Са(ОН) 2 требуются сильное нагревание. Такая реакция идет только при постоянном притоке энергии извне:
Са(ОН) 2 = СаО + Н 2 О — Q (энергия (тепло))
Это говорит о том, что разрыв химических связей в Ca(OH) 2 требует большей энергии, чем может выделиться при образовании новых химических связей в молекулах CaO и H 2 O.
Реакции, в которых энергия поглощается, называются ЭНДОТЕРМИЧЕСКИМИ (от «эндо» – внутрь).
Концентрация реагирующих веществ
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ.
Чтобы осуществилось химическое взаимодействие между частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла. На основе большого экспериментального материала в 1867 г. норвежцами К. Гульденбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Для реакции А + В = D этот закон выразится так:

Для реакции 2А + В = D этот закон выразится так:

Здесь С А, С В - концентрации веществ А и В (моль/л); k 1 и k 2 - коэффициенты пропорциональности, называемые константами скорости реакции.
Физический смысл константы скорости реакции нетрудно установить - она численно равна скорости реакции, в которой концентрации реагирующих веществ равны 1 моль/л или их произведение равно единице. В таком случае ясно, что константа скорости реакции зависит только от температуры и не зависит от концентрации веществ.
Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии , т. к. они реагируют на поверхности и их концентрации обычно являются постоянными.
Например, для реакции горения угля выражение скорости реакции должно быть записано так:


т. е. скорость реакции пропорциональна только концентрации кислорода.
Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентраций исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции.
Действие катализаторов
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами (от лат. katalysis - разрушение).
Катализатор действует как опытный проводник, направляющий группу туристов не через высокий перевал в горах (его преодоление требует много сил и времени и не всем доступно), а по известным ему обходным тропам, по которым можно преодолеть гору значительно легче и быстрее.

Правда, по обходному пути можно попасть не совсем туда, куда ведет главный перевал. Но иногда именно это и требуется! Именно так действуют катализаторы, которые называют селективными. Ясно, что нет необходимости сжигать аммиак и азот, зато оксид азота (II) находит использование в производстве азотной кислоты.
Катализаторы - это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными количественно и качественно.
Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (каталитические преобразователи, превращающие оксиды азота выхлопных газов автомобиля в безвредный азот).
Различают два вида катализа.
Гомогенный катализ , при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе).
Гетерогенный катализ , при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества.
Например, при производстве серной кислоты контактным способом используют твердый катализатор - оксид ванадия (V) V 2 O 5:

При производстве метанола используют твердый «цинкохромовый» катализатор (8ZnO Cr 2 O 3 х CrO 3):
Очень эффективно работают биологические катализаторы - ферменты. По химической природе это белки. Благодаря им в живых организмах при невысокой температуре с большой скоростью протекают сложные химические реакции.
Известны другие интересные вещества - ингибиторы (от лат. inhibere - задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате реакция резко замедляется и затем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы.
Например, с помощью ингибиторов стабилизируют растворы пероксида водорода.
Природа реагирующих веществ (их состав, строение)
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Если энергия активации мала (< 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в данных случаях ничтожно мала.
Если энергия активации велика (> 120 кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно.
Если энергии активации химических реакций имеют промежуточные значения (40120 кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Поверхность соприкосновения реагирующих веществ
Скорость реакций, идущих на поверхности веществ, т. е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела.
Увеличение скорости реакции объясняется в первую очередь увеличением поверхности соприкосновения исходных веществ , а также рядом других причин, например, нарушением структуры «правильной» кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.
В промышленности для проведения гетерогенных реакций используют «кипящий слой», чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью «кипящего слоя» проводят обжиг колчедана.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью .
Но что же такое скорость реакции ? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n 1 и n 2 – количество вещества (моль) в момент времени t 1 и t 2 соответственно в системе объемом V .
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n 2 — n 1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n 2 — n 1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С :
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Е а. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Е а и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V 2 и V 1 – скорость при температуре t 2 и t 1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы .
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Вспомним про энергию активации E a . Молекулы с энергией меньшей, чем энергия активации в отсутствие катализатора друг с другом взаимодействовать не могут. Катализаторы, изменяют путь, по которому протекает реакция подобно тому, как опытный проводник проложит маршрут экспедиции не напрямую через гору, а с помощью обходных троп, в результате чего даже те спутники, которые не имели достаточно энергии для восхождения на гору, смогут перебраться на другую ее сторону.
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
2Al + 6HCl → 2AlCl 3 + 3H 2
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит меду твердым веществом и жидкостью или газом перемешивание может ее ускорить.
Скорость химических реакций - это число элементарных актов химических превращений, приводящих к образованию продуктов реакции в единицу времени в единице объема или на единице поверхности.
Поскольку число элементарных актов не пересчитать, то скорость измеряют, определяя изменение концентраций реагирующих веществ или продуктов реакции в единицу времени:
, ![]()
В любой реакции реагенты расходуются, она замедляется. См. рис.3.9.1.

Рис. 3.9.1. Изменение скорости реакции во времени.
V– скорость реакции, C– концентрация А, В.
Поэтому можно говорить только о скорости в данный момент времени. Скорость зависит от концентрации реагирующих веществ.
От чего еще она зависит? От природы реагирующих веществ, температуры, степени измельчения реагентов для гетерогенных реакций (площади поверхности), катализатора и формы сосуда и т.д.
Рассмотрим зависимость vот концентрации. Предположим, имеем реакцию A+ B+ 2D= F+ L. Надо найти зависимость скорости от концентрации реагентов v= f(C A , C B , C D) = ?
Измерим скорость при каких либо концентрациях, а потом увеличим С А вдвое и еще раз измерим скорость. Пусть она возросла вдвое. Это значит, что vпропорциональна С А в первой степени. Увеличим С В вдвое. Предположим, что это не повлияло на скорость - вполне реальная ситуация. Если растворять NO 2 в воде для получения азотной кислоты, то очевидно, что скорость реакции не будет зависеть от количества воды. В таком случае можно сказать, что vзависит от С В в нулевой степени. Пусть теперь мы обнаружили, что от С D скорость зависит как С D 2 . Тогда общее уравнение скорости реакции запишется как v= kC A C B 0 C D 2 .
Это выражение называется кинетическим уравнением реакции; k– константа скорости реакции (численно равна скорости при концентрациях реагентов, равных единице). Показатели степеней при концентрациях в кинетическом уравнении называются порядками реакции по данному веществу, а их сумма – общим порядком реакции.
Порядки реакций устанавливаются экспериментально, а не по стехиометрическим коэффициентам. Существует совсем немного реакций, где порядок совпадает с суммой стехиометрических коэффициентов.
N 2 O 5 = 2NO 2 + 1/2O 2 v = kC(N 2 O 5) р-ия1 порядка
(H 2)+(J 2)=2(HJ) v=kC(H 2)C(J 2) р-ия2 порядка
но (Н 2) + (Br 2) = 2(HBr) v=kC(H 2)C(Br 2) 1/2
(Cl 2) + 2(NO) = 2(NOCl) v=kC(Cl 2)C(NO) 2 р-ия3 порядка.
Иными словами, порядок может быть и дробным. Почему, рассмотрим ниже.
Реакции обычно идут по стадиям, поскольку невозможно представить себе одновременное столкновение большого числа молекул.
Предположим, что некая реакция
идет в две стадии
A+ B= ABи AB+ B= C+ D,
тогда, если первая реакция идет медленно, а вторая быстро, то скорость определяется первой стадией (пока она не пройдет, не может идти вторая), т.е. накоплением частиц АВ. Тогда и v=kC A C B .
Скорость реакции определяется самой медленной стадией. Отсюда различия между порядком реакции и стехиометрическими коэффициентами. Например, реакция разложения перекиси водорода
2H 2 O 2 = H 2 O+ O 2
является реакцией первого порядка, т.к. она лимитируется первой стадией H 2 O 2 = H 2 O+ O, а вторая стадия О + О = О 2 идет очень быстро.
Может быть самой медленной не первая, а вторая или другая стадия и тогда мы получаем иногда дробный порядок, выражая концентрации интермедиатов через концентрации начальных веществ.
С ростом температуры увеличивается скорость движения частиц, а следовательно, частота их соударений. Поэтому скорость реакций увеличивается с температурой. Существует эмпирическая закономерность, выведенная Вант-Гоффом, что при увеличении температуры на 10 о скорость возрастает в 2-4 раза.
Реакции идут по стадиям. Маловероятно, что в реакции образования аммиака N 2 + 3H 2 = 2NH 3 одновременно столкнутся в одной точке пространства 4 молекулы, да еще нужного сорта.
Количество частиц, принимающих участие в элементарном акте химического превращения называется молекулярностью реакции.
Реакции могут быть моно- , би- и тримолекулярными.
Мономолекулярные – реакции разложения и внутримолекулярные перегруппировки.
Бимолекулярные – 2NO 2 = N 2 O 4
Тримолекулярные (редкие) - 2NO+ O 2 = 2NO 2 .
В этих примерах порядок и молекулярность совпадают, но часто они различны.
Имеются два критерия возможности самопроизвольного протекания химического процесса – изменение энтальпии DН, которое отражает определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, то есть, критерий процесса – уменьшение энтальпии (DН<0).
Если DН=0, то критерий самопроизвольного протекания процесса DS>0.
Как влияют величины энтальпийного и энтропийного фактора на протекание процесса.
1) Экзотермическая реакция , DН<0.
a) DS>0, тогда для любого Т DGбудет меньше нуля и процесс идет всегда, причем до конца.
б) DS<0, в этом случае все будет зависеть от соотношения абсолютных значений энтальпийного и энтропийного фактора,
DG<0 - реакция идет
DG>0 - реакция не идет
Экзотермические реакции, сопровождающиеся уменьшением энтропии, идут при низких температурах, увеличение Т способствует протеканию обратной реакции (Принцип Ле Шателье).
2) Эндотермическая реакция , DН>0.
а) DS>0, реакция возможна только если |TDS|>|DH|, тогда DG<0, т.е при высоких температурах, если же
б) DS<0, то DG>0 при любых температурах и процесс самопроизвольно идти не может.
Пример - реакция окисления глюкозы до CO 2 и H 2 O
6(O 2) ®6(CO 2) + 6H 2 O DН= - 2810 кДж
Энтропия при этом, очевидно, возрастает. Следовательно, обратный процесс принципиально не может идти самопроизвольно. Для его протекания требуется энергия извне (фотосинтез).
Следует отметить, что в вопросе о возможности протекания процесса термодинамический критерий – истина в последней инстанции. Если DG>0, никакие катализаторы не помогут провести процесс. При DG<0 процесс может быть заморожен.
- Геохимия природных и техногенных ландшафтов
- ДИДАКТИЧЕСКИЙ ПЛАН
- ЛИТЕРАТУРА
- Оценка загрязненности воды
- Биохимическое и химическое потребление кислорода
- Аналитическое определение БПК и ХПК
- Неорганические вещества в воде. Ионы, поступающие из удобрений и солей, используемых для снеготаяния и борьбы со льдом. Кислотные выбросы. Ионы тяжелых металлов. Основные химические реакции в гидросфере
- Методы очистки воды: физические, химические и биологические. Основные принципы и аппаратное оформление. Очистка питьевой воды: процессы водоподготовки и химические реакции, лежащие в их основе. Стандарты на воду
- Загрязнение почвы. Химические последствия кислотных загрязнений
- Роль металлов в живой природе
- Необходимость и токсичность ионов металлов
- Взаимосвязь между необходимостью и токсичностью металлов в экосистемах
- Потенциально опасные следы металлов в атмосфере, гидросфере и литосфере
- Глобальный перенос следовых количеств потенциально опасных металлов
- Микроэлементы. Поступление и усвоение металлов в организме
- Молекулярные основы токсичности металлов. Ряды токсичности
- Факторы окружающей среды, влияющие на токсичность
- Толерантность организмов к металлам. Канцерогенность ионов металлов. Пути воздействия металлов на организм
- Ионы тяжелых металлов в природных водах. Формы существования металлов в водных экосистемах, зависимость токсичности от формы. Вторичная токсичность вод
- Строение атмосферы
- Распределение температуры, давления и других параметров по высоте
- Причины образования характерных слоев в атмосфере (барометрическая формула, конвекция, космическое излучение). Значение слоев для человека
- Ионосфера
- Изменение химического состава по высоте (несоответствие барометрической формуле)
- Рассмотрение атмосферы как системы (открытая, замкнутая, изолированная). Термодинамический подход (N2O). Грозы
- Кинетический подход
- Основные химические реакции в атмосфере и тропосфере
- Элементы химической кинетики (порядок реакции, молекулярность, зависимость скорости от давления)
- Озоновый слой
- Разрушающее действие галогенов, фреонов и т.д.
- Характерный химический состав выбросов в атмосферу
- Химические превращения загрязнений
- Возможность самоочищения атмосферы
- Границы биосферы, состав и масса живого вещества
- Кларки и геохимические функции живого вещества, биогеохимические процессы как геологический фактор
- Органическое вещество, процессы синтеза и разложения
- Автотрофные и гетеротрофные организмы
- Сульфатредукция и метанообразование
- Возраст жизни и возраст фотосинтеза
Механизмы протекания химических превращений и их скорости изучает химическая кинетика. Химические процессы протекают во времени с различными скоростями. Какие-то происходят быстро, почти мгновенно, для протекания других требуется весьма продолжительное время.
Вконтакте
Скорость реакции - скорость с которой расходуются реагенты (их концентрация уменьшается) или образуются продукты реакции в единице объёма.
Факторы, способные влиять на скорость химической реакции
На то, насколько быстро будет происходить химическое взаимодействие, могут повлиять следующие факторы:
- концентрация веществ;
- природа реагентов;
- температура;
- присутствие катализатора;
- давление (для реакций в газовой среде).
Таким образом, изменяя определённые условия протекания химического процесса, можно повлиять на то, насколько быстро будет протекать процесс.
 В процессе химического взаимодействия частицы реагирующих веществ сталкиваются друг с другом. Количество таких совпадений пропорционально числу частиц веществ в объёме реагирующей смеси, а значит и пропорционально молярным концентрациям реагентов.
В процессе химического взаимодействия частицы реагирующих веществ сталкиваются друг с другом. Количество таких совпадений пропорционально числу частиц веществ в объёме реагирующей смеси, а значит и пропорционально молярным концентрациям реагентов.
Закон действующих масс описывает зависимость скорости реакции от молярных концентраций веществ, вступающих во взаимодействие.
Для элементарной реакции (А + В → …) данный закон выражается формулой:
υ = k ∙С A ∙С B,
где k - константа скорости; С A и С B - молярные концентрации реагентов, А и В.
Если одно из реагирующих веществ находится в твёрдом состоянии, то взаимодействие происходит на поверхности раздела фаз, в связи с этим концентрация твёрдого вещества не включается в уравнение кинетического закона действующих масс. Для понимания физического смысла константы скорости, необходимо принять С, А и С В равными 1. Тогда становится понятно, что константа скорости равна скорости реакции при концентрациях реагентов, равных единице.
Природа реагентов
Так как в процессе взаимодействия разрушаются химические связи реагирующих веществ и образуются новые связи продуктов реакции, то большую роль будет играть характер связей, участвующих в реакции соединений и строение молекул реагирующих веществ.
Площадь поверхности соприкосновения реагентов
Такая характеристика, как площадь поверхности соприкосновения твёрдых реагентов, на протекание реакции влияет, порой, довольно значительно. Измельчение твёрдого вещества позволяет увеличить площадь поверхности соприкосновения реагентов, а значит и ускорить протекание процесса. Площадь соприкосновения растворимых веществ легко увеличивается растворением вещества.
Температура реакции
 При увеличении температуры энергия сталкивающихся частиц возрастёт, очевидно, что с ростом температуры и сам химический процесс будет ускоряться. Наглядным примером того, как увеличение температуры влияет на процесс взаимодействия веществ, можно считать приведённые в таблице данные.
При увеличении температуры энергия сталкивающихся частиц возрастёт, очевидно, что с ростом температуры и сам химический процесс будет ускоряться. Наглядным примером того, как увеличение температуры влияет на процесс взаимодействия веществ, можно считать приведённые в таблице данные.
Таблица 1. Влияние изменения температуры на скорость образования воды (О 2 +2Н 2 →2Н 2 О)
Для количественного описания того, как температура может влиять на скорость взаимодействия веществ используют правило Вант-Гоффа. Правило Вант-Гоффа состоит в том, что при повышении температуры на 10 градусов, происходит ускорение в 2−4 раза.
Математическая формула, описывающая правило Вант-Гоффа, выглядит следующим образом:
Где γ — температурный коэффициент скорости химической реакции (γ = 2−4).
Но гораздо более точно описывает температурную зависимость константы скорости уравнение Аррениуса:
Где R - универсальная газовая постоянная, А - множитель, определяемый видом реакции, Е, А - энергия активации.
Энергией активации называют такую энергию, которую должна приобрести молекула, чтобы произошло химическое превращение. То есть она является неким энергетическим барьером, который необходимо будет преодолеть сталкивающимся в реакционном объёме молекулам для перераспределения связей.
Энергия активации не зависит от внешних факторов, а зависит от природы вещества. Значение энергии активации до 40 - 50 кДж/моль позволяет веществам реагировать друг с другом довольно активно. Если же энергия активации превышает 120 кДж/моль , то вещества (при обычных температурах) будут реагировать очень медленно. Изменение температуры приводит к изменению количества активных молекул, то есть молекул, достигших энергии большей, чем энергия активации, а значит способных к химическим превращениям.
Действие катализатора
 Катализатором называют вещество, способное ускорять процесс, но не входящее в состав его продуктов. Катализ (ускорение протекания химического превращения) разделяют на · гомогенный, · гетерогенный. Если реагенты и катализатор находятся в одинаковых агрегатных состояниях, то катализ называют гомогенным, если в различных, то гетерогенным. Механизмы действия катализаторов разнообразны и достаточно сложны. Кроме того, стоит отметить, что для катализаторов характерна избирательность действия. То есть один и тот же катализатор, ускоряя одну реакцию, может никак не изменять скорость другой.
Катализатором называют вещество, способное ускорять процесс, но не входящее в состав его продуктов. Катализ (ускорение протекания химического превращения) разделяют на · гомогенный, · гетерогенный. Если реагенты и катализатор находятся в одинаковых агрегатных состояниях, то катализ называют гомогенным, если в различных, то гетерогенным. Механизмы действия катализаторов разнообразны и достаточно сложны. Кроме того, стоит отметить, что для катализаторов характерна избирательность действия. То есть один и тот же катализатор, ускоряя одну реакцию, может никак не изменять скорость другой.
Давление
Если в превращении участвуют газообразные вещества, то на скорость протекания процесса будет влиять изменение давления в системе. Это происходит потому , что для газообразных реагентов изменение давления приводит к изменению концентрации.
Экспериментальное определение скорости химической реакции
Определить быстроту протекания химического превращения экспериментально можно, получив данные о том, как в единицу времени меняется концентрация веществ, вступающих в реакцию, или продуктов. Методы получения таких данных делят на
- химические,
- физико-химические.
 Химические методы достаточно просты, доступны и точны. С их помощью скорость определяют, непосредственно замеряя концентрацию или количество вещества реагентов или продуктов. В случае медленной реакции, для контроля за тем, как расходуется реагент отбирают пробы. После чего определяют содержание в пробе реагента. Осуществляя отбор проб через равные промежутки времени, можно получить данные об изменении количества вещества в процессе взаимодействия. Чаще всего используют такие виды анализа, как титриметрия и гравиметрия.
Химические методы достаточно просты, доступны и точны. С их помощью скорость определяют, непосредственно замеряя концентрацию или количество вещества реагентов или продуктов. В случае медленной реакции, для контроля за тем, как расходуется реагент отбирают пробы. После чего определяют содержание в пробе реагента. Осуществляя отбор проб через равные промежутки времени, можно получить данные об изменении количества вещества в процессе взаимодействия. Чаще всего используют такие виды анализа, как титриметрия и гравиметрия.
Если реакция протекает быстро, то чтобы отобрать пробу, её приходится останавливать. Это можно сделать с помощью охлаждения, резкого удаления катализатора , также можно произвести разбавление либо перевести один из реагентов в не реакционноспособное состояние.
Методы физико-химического анализа в современной экспериментальной кинетике используются чаще, чем химические. С их помощью можно наблюдать изменение концентраций веществ в реальном времени. При этом реакцию нет необходимости останавливать и отбирать пробы.
Физико-химические методы основываются на измерении физического свойства, зависящего от количественного содержания в системе определённого соединения и изменяющегося со временем. Например, если в реакции участвуют газы, то таким свойством может быть давление. Также измеряют электропроводность, показатель преломления, спектры поглощения веществ.