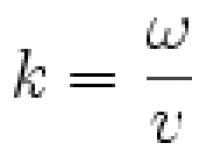... моль /л, = 0,28 моль /л, = 0,44 моль /л. Найти мольные доли компонентов в 5 %-ном (по массе ) водном... получения хлорида аммония (NH4Cl) массой 10,7 г. Сколько моль углерода в 4 г сероуглерода (CS2)? Пользуясь справочными...
Учебное пособие содержит краткое изложение основных теоретических положений, задачи по всем разделам курса общей физики, ответы и предложения, которыми можно воспользоваться при решении задач. Ббк 22. 3
Сборник задачИ 1% аргона, найти массу 1 моль воздуха. Найти объем смеси, состоящей из азота массой 2,8 кг и кислорода массой 3,2 кг... и нейтронов содержится в ядрах изотопов углерода : 1) 16°С; 2) "^С; 3) "|С; 4) 5) !64С; 6) 1|С? 183 Во сколько...
1. моль. Количество вещества эквивалента (эквивалент) и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Закон эквивалентов
ДокументКг/моль . Относительная молекулярная масса Mr – это молярная масса вещества, отнесенная к молярной массы атома углерода ... Cн и молярную массу эквивалента (mэ) растворенного вещества, титр легко найти по формуле...
1. В кристаллогидрате сульфата марганца (II) массовая доля марганца равна 0,268. Определить количество вещества воды, приходящееся на 1 моль кристаллогидрата. Написать формулу соли. 2
ДокументВоды, приходящееся на 1 моль кристаллогидрата. Написать формулу соли... г органического вещества (М= 93 г/моль ) образовалось 8, 8 г оксида углерода (IV) , 2,1 г воды и... Найти массу уксусной кислоты в исходной смеси. 7. Имеется смесь железа, углерода ...
Задача 3.1.1 Сколько молей сульфида железа (II) содержится в 8,8 г FeS?
Решение: Определяем молярную массу (М) сульфида железа (II).
М(FeS) = 56+32=88 г/моль
Рассчитаем, сколько молей содержится в 8,8 г FeS
Задача 3.1.2 Сколько молекул содержится в 54 г воды? Чему равна масса одной молекулы воды?
Решение: Определяем молярную массу воды.
М(Н 2 О) = 18 г/моль
Следовательно, в 54 г воды содержится 54/18 = 3 моль Н 2 О. Один моль любого вещества содержит 6,02 10 23 молекул. Тогда в 3 молях (54г Н 2 О) содержится 6,02 10 23 3 = 18,06 10 23 молекул.
Определим массу одной молекулы воды.


Задача 3.1.3 Сколько молей и молекул содержится в 1 м 3 любого газа при нормальных условиях?
Решение: 1 моль любого газа при нормальных условиях занимает объем 22,4 л. Следовательно, в 1м 3 (=1000л) будет содержаться 44,6 молей газа:

1 моль любого газа содержит 6,02 10 23 молекул. Из этого следует, что в 1 м 3 любого газа при нормальных условиях содержится
6,02 10 23 44,6 = 2,68 10 25 молекул.
Задача 3.1.4 Выразите в молях: а) 6,02 10 23 молекул С 2 Н 2 ;
б) 1,80 10 24 атомов азота; в) 3,01 10 23 молекул NH 3 . Какова молярная масса указанных веществ?
Решение: Моль – это количество вещества, в котором содержится число частиц любого определенного вида, равное постоянной Авогадро. Отсюда:
а)

б)

в)

Масса моля вещества выражается в г/моль . Молярная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в а.е.м.
Следовательно, молярные массы данных веществ равны:
а) М(С 2 Н 2) = 26 г/моль; б) М(N) = 14 г/моль;
в) М(NH 3) = 17 г/моль;
Задача 3.1.5 Определить молярную массу газа, если при нормальных условиях0,824г его занимают объем0,260л.
Решение: При нормальных условиях 1 моль любого газа занимает объем 22,4 л. Вычислив массу 22,4 л данного газа, мы узнаем его молярную массу.
0,824 г газа занимают объем 0,260 л
Х г газа занимают объем 22,4 л

Следовательно, молярная масса газа равна 71 г/моль.
3.2 Эквивалент. Фактор эквивалентности. Молярная масса эквивалентов.
Задача 3.2.1 Вычислите эквивалент, фактор эквивалентности и молярную массу эквивалентов Н 3 РО 4 при реакциях обмена, в результате которых образуются кислые и нормальные соли.
Решение Запишем уравнения реакций взаимодействия фосфорной кислоты со щелочью:
Н 2 РО 4 + NaOH = NaH 2 PO 4 + H 2 O; (1)
Н 2 РО 4 Н 2 РО 4 + 2NaOH = Na 2 HPO 4 + 2H 2 O; (2)
Н 2 РО 4 + 3NaOH = Na 3 PO 4 + 3H 2 O; (3)
Т.к. фосфорная кислота трехосновная кислота, она образует две кислые соли: NaH 2 PO 4 - дигидрофосфат натрия и Na 2 HPO 4 - гидрофосфат натрия и одну среднюю соль Na 3 PO 4 - фосфат натрия.
В реакции (1) фосфорная кислота обменивает на металл один атом водорода, т.е. ведет себя как одноосновная кислота, поэтому
f э (Н 3 РО 4) в реакции (1) равен 1;
Э(Н 3 РО 4) = Н 3 РО 4 ; М (1 Н 3 РО 4) = 98 г/моль.
В реакции (2) фосфорная кислота обменивает на металл три атома f э (Н 3 РО 4)водорода, т.е. ведет себя как двухосновная кислота, поэтомуf э (Н 3 РО 4)в реакции (2) равен1/2;
Э(Н 3 РО 4) = 1/2Н 3 РО 4 ; М (1/2 Н 3 РО 4) = 49 г/моль.
В реакции (3) фосфорная кислота ведет себя как трехосновная кислота, поэтому f э (Н 3 РО 4) в данной реакции равен 1/3;
Э(Н 3 РО 4) = 1/3Н 3 РО 4 ; М (1/3 Н 3 РО 4) = 32,67 г/моль.
Задача 3.2.2 Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ сКОН и определите их эквивалентные и молярные массы эквивалентов.
Решение: Запишем уравнения происходящих реакций:
КН 2 РО 4 + 2КОН = К 3 РО 4 + 2 Н 2 О
Bi(OH) 2 NO 3 + KOH = Bi(OH) 3 + KNO 3
Дигидрофосфат калия при взаимодействии с КОНобменивает на металл два атома водорода, т.е. f э солиКН 2 РО 4 = 1/2;
Э(КН 2 РО 4) = 1/2 КН 2 РО 4 ;
М(1/2 КН 2 РО 4) = 1/2 (39 + 2 + 31 +64) = 68г/моль
Нитрат дигидроксовисмута (III) при реакции сКОНобменивает одну группуNO 3 - на ионОН - ,т.е. в молекуле основной соли перестраивается одна связь, следовательно:
Э(Bi(OH) 2 NO 3) = Bi(OH) 2 NO 3 ;
М(1 Bi(OH) 2 NO 3) = 305 г/моль
Класс: 8
Цель: Познакомить учащихся с понятиями «количество вещества», «молярная масса» дать представление о постоянной Авогадро. Показать взаимосвязь количества вещества, числа частиц и постоянной Авогадро, а также взаимосвязь молярной массы, массы и количества вещества. Научить производить расчёты.
Тип урока: урок изучения и первичного закрепления новых знаний.
Ход урока
I. Организационный момент
II. Проверка д/з по теме: «Типы химических реакций»
III. Изучение нового материала
1. Количество вещества – моль
Вещества вступают в реакцию в строго определённых соотношениях. Например, чтобы получить вещество вода нужно взять столько водорода и кислорода, чтобы на каждые две молекулы водорода приходилась одна молекула кислорода:
2Н 2 + O 2 = 2Н 2 О
Чтобы получить вещество сульфид железа, нужно взять столько железа и серы, чтобы на каждый атом железа приходился один атом серы.
Чтобы получить вещество оксид фосфора, нужно взять столько молекул фосфора и кислорода, чтобы на четыре молекулы фосфора приходилось пять молекул кислорода.
Определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооружённым глазом. Для определения числа структурных единиц (атомов, молекул) в химии применяют особую величину – количество вещества (v – ню) . Единицей количества вещества является моль .
- Моль – это количество вещества, которое содержит столько структурных частиц (атомов, молекул), сколько атомов содержится в 12 г углерода.
Экспериментально установлено, что 12 г углерода содержит 6·10 23 атомов. Значит один моль любого вещества, независимо от его агрегатного состояния содержит одинаковое число частиц – 6· 10 23 .
- 1 моль кислорода (O 2) содержит 6·10 23 молекул.
- 1 моль водорода (Н 2) содержит 6·10 23 молекул.
- 1 моль воды (Н 2 O) содержит 6·10 23 молекул.
- 1 моль железа (Fe) содержит 6·10 23 молекул.
Задание: Используя полученную информацию, ответьте на вопросы:
а) сколько атомов кислорода содержится в 1 моле кислорода?
– 6·10 23 ·2 = 12· 10 23 атомов.
б) сколько атомов водорода и кислорода содержится в 1 моле воды (Н 2 O)?
– 6·10 23 ·2 = 12· 10 23 атомов водорода и 6·10 23 атомов кислорода.
Число 6·10 23 названо постоянной Авогадро в честь итальянского учёного 19 века и обозначается NА. Единицы измерения атомы/моль или молекулы/моль.
2. Решение задач на нахождение количества вещества
Часто нужно знать, сколько частиц вещества содержится в определённом количестве вещества. Или же найти количество вещества по известному числу молекул. Эти расчёты можно сделать по формуле:
где N – число молекул, NА – постоянная Авогадро, v – количество вещества. Из этой формулы можно выразить количество вещества.
| v = N / NА |
Задача 1. Сколько атомов содержится в 2 молях серы?
N = 2·6·10 23 = 12·10 23 атомов.
Задача 2. Сколько атомов содержится в 0,5 молях железа?
N = 0,5·6·10 23 = 3·10 23 атомов.
Задача 3. Сколько молекул содержится в 5 молях углекислого газа?
N = 5·6·10 23 = 30·10 23 молекул.
Задача 4. Какое количество вещества составляет 12·10 23 молекул этого вещества?
v = 12·10 23 / 6·10 23 = 2 моль.
Задача 5. Какое количество вещества составляет 0,6·10 23 молекул этого вещества?
v = 0,6·10 23 / 6·10 23 = 0,1 моль.
Задача 6. Какое количество вещества составляет 3·10 23 молекул этого вещества?
v = 3·10 23 / 6·10 23 = 0,5 моль.
3. Молярная масса
Для химических реакций нужно учитывать количество вещества в молях.
В: Но как на практике отмерить 2, или 2,5 моль вещества? В каких единицах лучше всего измерять массу веществ?
Для удобства в химии используют молярную массу.
Молярная масса – это масса одного моля вещества.
Обозначается – М. Измеряется в г/моль.
Молярная масса равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса – величина постоянная. Численное значение молярной массы соответствует значению относительной атомной или относительной молекулярной массы.
В: Как можно найти значения относительной атомной или относительной молекулярной массы?
Мr (S) = 32; M (S) = 32 г/моль – что соответствует 1 молю серы
Мr (Н 2 О) = 18; М (Н 2 О) = 18 г/моль – что соответствует 1 молю воды.
4. Решение задач на нахождение массы вещества
Задача 7. Определить массу 0,5 моль железа.
Задача 8. Определить массу 0,25 моль меди
Задача 9. Определить массу 2 моль углекислого газа (СO 2)
Задача 10. Сколько молей оксида меди – CuО составляют 160 г оксида меди?
v = 160 / 80 = 8 моль
Задача 11. Сколько молей воды соответствуют 30 г воды
v = 30/18 = 1,66 моль
Задача 12. Сколько молей магния соответствует его 40 граммам?
v = 40 /24 = 1,66 моль
IV. Закрепление
Фронтальный опрос:
- Что такое количество вещества?
- Чему равен 1 моль любого вещества?
- Что такое молярная масса?
- Отличается ли понятия «моль молекул» и «моль атомов»?
- Объясните на примере молекулы аммиака NН3.
- Зачем необходимо знать формулы при решении задач?
Задачи:
- Сколько молекул содержится в 180 граммах воды?
- Сколько молекул составляет 80 г углекислого газа?
V. Домашнее задание
Изучить текст параграфа, составить две задачи: на нахождение количества вещества; на нахождение массы вещества.
Литература:
- Гара Н.Н. Химия. Уроки в 8 классе: пособие для учителя. _ М.: Просвещение, 2009.
- Рудзитес Г.Е., Фельдман Ф.Г. Химия. 8 класс.: Учебник для общеобразовательных учебных учреждений – М.: Просвещение, 2009.
16. Моль. Молярная масса. Молярная масса эквивалента. Эквивалент.
17. Закон Авогадро: Следствия из закона Авогадро. Плотность одного газа по другому
18. Уравнение Клапейрона-Менделеева для идеальных газов.
19. Закон сохранения массы и энергии.
20. Закон постоянства состава: дальтониды, бертолиды.
21. Закон эквивалентов (три формы).
Практические задачи/задания
6. Сколько молекул содержится в 62 г кислорода при н.у.?
7. Определить молярную массу эквивалента металла, если при сгорании 432 его грамм образуется 464 грамм оксида.
8. Оксид марганца содержит 22,56 % кислорода. Вычислите молярную массу эквивалента марганца в оксиде и составьте формулу.
9. Какой объем занимают 16 г кислорода при 20 ◦С, давлении 250 мм. рт. ст. (760 мм. рт.ст.= 1 атм = 101,3 кПа)?
10. При н.у 300 мл газа имеют массу 0,857 г. Определите молярную массу газа, его плотность по воздуху.
Часть 4. Теоретическая неорганическая химия. Строение атома, химические связи
22. Размеры, заряды и массы атомов и нуклонов. Атомная орбиталь Число электронов, протонов и нейтронов в электронейтральном атоме. Масса атома (его массовое число).
23. Современные представления о строении атома в соответствии с принципом наименьшей энергии, правило Клечковского, принципом Паули и правилом Гунда. Правило Клечковского. Принцип Паули.
24. Правило Гунда. Уравнение Луи Де Бройля, h- постоянная Планка. Уравнение Планка Перио-дический закон Д.И. Менделеева Свойства элементов и их соединений в периодической зависимости от заряда атомных ядер элементов. Изобары. Изотоны. Изотопы.
25. Сродство к электрону Еср. Энергия ионизации атомов Еион Химическая связь. Причина обра-зования хим. Связи. Энергия связи и длина связи. Ковалентная (или объединённая) химическая связь. Насыщаемость. Направленность связи. Пространственная конфигурация молекул при различном типе гибридизации, валентный угол.
26. Ионная связь. Ее свойства. Металлическая связь. Межмолекулярное взаимодействие: ион-дипольное; диполь-дипольное (ориентационное); индукционное; дисперсионное. Ван дер Ваальсовы силы. Водородная связь
27. Гидрофильно-гидрофобное взаимодействие. Агрегатное состояние Твёрдые вещества кристаллические и аморфные. Анизотропность. Изотропность. Жидкое состояние. Жидко-кристаллическое состояние. Газ, пар. Плазма.
Практические задачи/задания
11. Указать тип химической связи, тип гибридизации центрального атома, валентный угол и форму у молекул и ионов: ВСl 3 , СН 4 , РО 4 3- , РF 5 , [ PСl 4 ] + , NO 2 - , АsO 4, NH 5, SH 6.
12. Сравните значения валентных углов молекул и объясните характер их изменения в ряду СН 4 - 109,5 0 ; H 3 N - I07,3 0 ; Н 2 О – 104,5 0 .
13. Какой атом завершается электронной формулой 4s 2 4p 4 ?
Сколько электронов, протонов, нейтронов в наиболее растпространенном изотопе электронейтральном атоме с такой электронной формулой?
Часть 5. Способы выражения концентраций растворов. Определение рН растворов
28. Признаки химической реакции при растворении вещества.
29. Основные способы выражения концентраций растворов: массовая доля W, молярная концентрация С, молярная концентрация эквивалента Сэ, моляльная концентрация b, титр Т.
30. Водоро́дный показа́тель, pH. Сильные кислоты, сильные основания.
31. Степень диссоциации для сильных и слабых электролитов.
32. Расчет рН для кислот. Расчет рН для оснований (гидроксидов). Буферные растворы.
33. Гидролиз солей. рН среды при различных случаях гидролиза.
Практические задачи/задания
14. Составьте ионные и молекулярные уравнения гидролиза соли MnCl 2 . Укажите реакцию среды.
15. Вычислите рН 0,02 М раствора Н 2 CO 3 (константу диссоциации взять в справочнике).
16. Сколько мл 30%-ного раствора МgCO 3 (плотность взять в справочнике) нужно для приготовления 500 мл раствора с Сэ = 0,1 моль/л?
17. Произведение растворимости раствора МgCO 3 взять в справочнике. Вычислите концентрацию ионов Мg в насыщенном растворе соли.
18. Какова массовая доля NaСl в растворе с Сэ = 0,1 моль/л (плотность в справочнике)?