Аминокислотами называются органические карбоновые кислоты, у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу. В зависимости от положения группы -NН 2 различают α, β, γ и т. д. L-аминокислоты. К настоящему времени в различных объектах живого мира найдено до 200 различных аминокислот. В организме человека содержится около 60 различных аминокислот и их производных, но не все они входят в состав белков.
Аминокислоты делятся на две группы:
- протеиногенные (входящие в состав белков)
Среди них выделяют главные (их всего 20) и редкие. Редкие белковые аминокислоты (например, гидроксипролин, гидроксилизин, аминолимонная кислота и др.) на самом деле являются производными тех же 20 аминокислот.
Остальные аминокислоты не участвуют в построении белков; они находятся в клетке либо в свободном виде (как продукты обмена), либо входят в состав других небелковых соединений. Например, аминокислоты орнитин и цитруллин являются промежуточными продуктами в образовании протеиногенной аминокислоты аргинина и участвуют в цикле синтеза мочевины; γ-амино-масляная кислота тоже находится в свободном виде и играет роль медиатора в передаче нервных импульсов; β-аланин входит в состав витамина - пантотеновой кислоты.
- непротеиногенные (не участвующие в образовании белков)
Непротеиногенные аминокислоты в отличие от протеиногенных более разнообразны, особенно те, которые содержатся в грибах, высших растениях. Протеиногенные аминокислоты участвуют в построении множества разных белков независимо от вида организма, а непротеиногенные аминокислоты могут быть даже токсичны для организма другого вида, т. е. ведут себя как обычные чужеродные вещества. Например, канаванин, дьенколевая кислота и β-циано-аланин, выделенные из растений, ядовиты для человека.
Строение и классификация протеиногенных аминокислот
Радикал R в простейшем случае представлен атомом водорода (глицин), а может иметь и сложное строение. Поэтому α-аминокислоты отличаются друг от друга прежде всего строением бокового радикала, а следовательно, и физико-химическими свойствами, присущими этим радикалам. Приняты три классификации аминокислот:
Приведенная физиологическая классификация аминокислот не универсальна в отличие от первых двух классификаций и до некоторой степени условна, поскольку действительна только для организмов данного вида. Однако абсолютная незаменимость восьми аминокислот универсальна для всех видов организмов (в табл. 2 приведены данные для некоторых представителей позвоночных и насекомых [показать] ).
| Таблица 2. Незаменимые (+), заменимые (-) и полузаменимые (±) аминокислоты для некоторых позвоночных и насекомых (по Любке и др., 1975) | |||||||
| Аминокислоты | Человек | Крыса | Мышь | Курица | Лосось | Москит | Пчела |
| Глицин | - | - | - | + | - | + | - |
| Алании | - | - | - | - | - | - | - |
| Валин | + | + | + | + | + | + | + |
| Лейцин | + | + | + | + | + | + | + |
| Изолейцин | + | + | + | + | + | + | + |
| Цистеин | - | - | - | - | - | - | - |
| Метионин | + | + | + | + | + | + | + |
| Серин | - | - | - | - | - | - | - |
| Треонин | + | + | + | + | + | + | + |
| Аспарагиновая кислота | - | - | - | - | - | - | - |
| Глутаминовая кислота | - | - | - | - | - | - | - |
| Лизин | + | + | + | + | + | + | + |
| Аргинин | ± | ± | + | + | + | + | + |
| Фенилаланин | + | + | + | + | + | + | + |
| Тирозин | ± | ± | + | + | - | - | - |
| Гистидин | ± | + | + | + | + | + | + |
| Триптофан | + | + | + | + | + | + | + |
| Пролин | - | - | - | - | - | - | - |
Для крыс и мышей незаменимых аминокислот уже девять (к восьми известным добавляется гистидин). Нормальный рост и развитие курицы возможны только при наличии одиннадцати незаменимых аминокислот (добавляются гистидин, аргинин, тирозин), т. е. полузаменимые для человека аминокислоты абсолютно незаменимы для курицы. Для москитов глицин является абсолютно незаменимой, а тирозин, наоборот, заменимой аминокислотой.
Значит, для разных видов организмов возможны существенные отклонения в потребности в отдельных аминокислотах, что определяется особенностями их обмена.
Сложившийся для каждого вида организма состав незаменимых аминокислот, или так называемая ауксотрофность организма в отношении аминокислот, отражает скорее всего стремление его к минимальным энергетическим затратам на синтез аминокислот. Действительно, выгоднее получать готовый продукт, чем производить его самому. Поэтому организмы, потребляющие незаменимые аминокислоты, тратят примерно на 20% энергии меньше, чем те, которые синтезируют все аминокислоты. С другой стороны, в ходе эволюции не сохранилось таких форм жизни, которые бы полностью зависели от поступления всех аминокислот извне. Им трудно было бы приспосабливаться к изменениям внешней среды, учитывая, что аминокислоты являются материалом для синтеза такого вещества, как белок, без которого жизнь невозможна.
Физико-химические свойства аминокислот
Кислотно-основные свойства аминокислот . По химическим свойствам аминокислоты - амфотерные электролиты, т. е. сочетают свойства и кислот, и оснований.

Кислотные группы аминокислот: карбоксильная (-СООН -> -СОО - + Н +), протонированная α-аминогруппа (-NH + 3 -> -NН 2 + Н +).
Основные группы аминокислот: диссоциированная карбоксильная (-СОО - + Н + -> -СООН) и α-аминогруппа (-NН 2 + Н + -> NН + 3).
Для каждой аминокислоты имеется как минимум две константы кислотной диссоциации рК а - одна для группы -СООН, а вторая для α-аминогруппы.
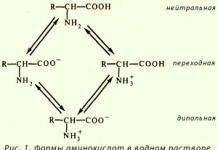
В водном растворе возможно существование трех форм аминокислот (рис. 1.)
Доказано, что в водных растворах аминокислоты находятся в виде диполя; или цвиттер-иона.
Влияние рН среды на ионизацию аминокислот . Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН<7) все аминокислоты несут положительный заряд (существуют в виде катиона), так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:

В кислой среде аминокислоты в электрическом поле движутся к катоду.
В щелочной среде (рН>7), где имеется избыток ионов ОН - , аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NН + 3 -группа:
В этом случае аминокислоты перемещаются в электрическом поле к аноду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в котором заряд аминокислоты равен нулю, называется изоэлектрическим. Значение рН, при котором наступает такое состояние и аминокислота не перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рН I . Изоэлектрическая точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5,5 для фенилаланина до 6,3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3,2, для аспарагиновой 2,8). Изоэлектрическая точка для цистеина и цистина равна 5,0, что указывает на слабые кислотные свойства этих аминокислот. У основных аминокислот - гистидина и особенно лизина и аргинина - изоэлектрическая точка значительно выше 7.
В клетках и межклеточной жидкости организма человека и животных рН среды близка к нейтральной, поэтому основные аминокислоты (лизин, аргинин) несут суммарный положительный заряд (катионы), кислые аминокислоты (аспарагиновая и глутаминовая) имеют отрицательный заряд (анионы), а остальные существуют в виде диполя. Кислые и основные аминокислоты больше гидратированы, чем все остальные аминокислоты.
Стереоизомерия аминокислот
Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода (С*) и обладают оптической активностью, причем большая часть их относится к левовращающим. Они существуют в виде пространственных изомеров, или стереоизомеров. По расположению заместителей вокруг асимметрического атома углерода стерео-изомеры относят к L- или D-ряду.
L- и D-изомеры относятся друг к другу как предмет и его зеркальное изображение, поэтому их называют также зеркальными изомерами или энантиомерами. Аминокислоты треонин и изолейцин имеют по два асимметрических атома углерода, поэтому у них по четыре стереоизомера. Например, у треонина, помимо L- и D-треонина, имеется еще два, которые называют диастереомерами или аллоформами: L-аллотреонин и D-аллотреонин.
Все аминокислоты, входящие в состав белков, относятся к L-ряду. Считалось, что D-аминокислоты не встречаются в живой природе. Однако были найдены полипептиды в виде полимеров D-глутаминовой кислоты в капсулах спороносных бактерий (палочке сибирской язвы, картофельной и сенной палочке); D-глутаминовая кислота и D-аланин входят в состав мукопептидов клеточной стенки некоторых бактерий. D-Аминокислоты обнаружены также в антибиотиках, продуцируемых микроорганизмами (см. табл. 3).
Возможно, D-аминокислоты оказались более пригодными для защитных функций организмов (именно этой цели служат и капсула бактерий, и антибиотики), в то время как L-аминокислоты нужны организму для построения белков.
Распространение отдельных аминокислот в разных белках
К настоящему времени расшифрован аминокислотный состав многих белков микробного, растительного и животного происхождения. Наиболее часто в белках находят аланин, глицин, лейцин, серии. Однако каждый белок имеет свой аминокислотный состав. Например, протамины (простые белки, находящиеся в молоках рыб) содержат до 85% аргинина, но в них отсутствуют циклические, кислые и серусодержащие аминокислоты, треонин и лизин. Фиброин - белок натурального шелка, содержит до 50% глицина; в состав коллагена - белка сухожилий - входят редкие аминокислоты (гидроксилизин, гидроксипролин), которые отсутствуют в остальных белках.
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его функцией. Последовательность расположения аминокислот в белке обусловлена генетическим кодом.
| Страница 2 | всего страниц: 7 |
ЛИПИДЫ
Липиды – нерастворимые в воде маслянистые или жирные вещества, которые могут быть экстрагированы из клеток неполярными растворителями. Это гетерогенная группа соединений, непосредственно или опосредовано связанных с жирными кислотами.
Биологические функции липидов:
1) источник энергии, который может длительно запасаться;
2) участие в образовании клеточных мембран;
3) источник жирорастворимых витаминов, сигнальных молекул и незамени-мых жирных кислот;
4) теплоизоляция;
5) неполярные липиды служат электроизоляторами, обеспечивая быстрое распространение волн деполяризации вдоль миелинизированных нервных волокон;
6) участие в образовании липопротеидов.
Жирные кислоты – структурные компоненты большинства липидов. Это длинноцепочечные органические кислоты, содержащие от 4 до 24 углеродных атомов, они содержат одну карбоксильную группу и длинный неполярный углеводородный «хвост». В клетках не встречаются в свободном состоянии, а только в ковалентно связанной форме. В состав природных жиров входят обычно жирные кислоты с четным числом атомов углерода, поскольку они синтезируются из двууглеродных единиц, образующих неразветвленную цепь углеродных атомов. Многие жирные кислоты имеют одну или несколько двойных связей – ненасыщенные жирные кислоты.
Наиболее важные жирные кислоты (после формулы приведено число атомов углерода, название, температура плавления):
12, лауриновая, 44,2 о С
14, миристиновая, 53,9 о С
16, пальмитиновая, 63,1 о С
18, стеариновая, 69,6 о С
18, олеиновая, 13,5 о С
18, линолевая, -5 о С
18, линоленовая, -11 о С
20, арахидоновая, -49,5 о С
Общие свойства жирных кислот;
Почти все содержат четное число атомов углерода,
Насыщенные кислоты у животных и у растений встречаются в два раза чаще, чем ненасыщенные,
Насыщенные жирные кислоты не имеют жесткой линейной структуры, они обладают большой гибкостью и могут принимать разнообразные конформации,
В большинстве жирных кислот имеющаяся двойная связь расположена между 9-м и 10-м атомами углерода (Δ 9),
Дополнительные двойные связи обычно расположены между Δ 9 -двойной связью и метильным концом цепи,
Две двойные связи в жирных кислотах не бывают сопряженными, между ними всегда находится метиленовая группа,
Двойные связи практически всех природных жирных кислот находятся в цис -конформации, что приводит к сильному изгибу алифатической цепи и более жесткому строению,
При температуре тела насыщенные жирные кислоты находятся в твердом воскообразном состоянии, а ненасыщенные жирные кислоты представляют собой жидкости,
Натриевые и калиевые мыла жирных кислот способны эмульгировать нерастворимые в воде масла и жиры, кальциевые и магниевые мыла жирных кислот растворяются очень плохо и не эмульгируют жиров.
В мембранных липидах бактерий встречаются необычные жирные кислоты и спирты. Многие из бактериальных штаммов, содержащих эти липиды (термофилы, ацидофилы и галлофилы), адаптированы к экстре-мальным условиям.
изоразветвленные
антеизоразветвленные
циклопропансодержащие
ω-циклогексилсодержащие
изопранильные
циклопентанфитанильные
Состав бактериальных липидов отличается большим разнообразием и спектр жирных кислот разных видов приобрел значение таксономического критерия для идентификации организмов.
У животных важными производными арахидоновой кислоты являются гистогормоны простагландины, тромбоксаны и лейкотриены, объединенные в группу эйкозаноидов и обладающие чрезвычайно широкой биологической активностью.
простагландин Н 2
Классификация липидов:
1. Триацилглицериды (жиры) – это эфиры спирта глицерола и трех молекул жирных кислот. Они составляют основной компонент жировых депо растительных и животных клеток. В мембранах не содержатся. Простые триацилглицериды содержат остатки одинаковых жирных кислот во всех трех положениях (тристеарин, трипальмитин, триолеин). Смешанные содержат разные жирные кислоты. По удельному весу легче воды, хорошо растворимы в хлороформе, бензоле, эфире. Гидролизуются при кипячении с кислотами или основаниями, либо под действием липазы. В клетках в обычных условиях самоокисление ненасыщенных жиров полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты. В специализированных клетках соединительной ткани животных адипоцитах огромное количество триацилглицеридов может запасаться в виде жировых капель, заполняющих почти весь объем клетки. В форме гликогена организм может запасти энергию не более чем на сутки. Триацилглицериды могут запасать энергию на месяцы, так как они могут храниться в очень больших количествах в практически чистом, негидратированном виде и в расчете на единицу веса в них запасается в два раза больше энергии, чем в углеводах. Кроме того, триацилглицериды под кожей образуют теплоизоляционный слой, защищающий организм от действия очень низких температур.
нейтральный жир
Для характеристики свойств жира используют следующие константы:
Кислотное число – количество мг КОН, необходимое для нейтрализации
свободных жирных кислот, содержащихся в 1 г жира;
Число омыления – количество мг КОН, необходимое для гидролиза
нейтральных липидов и нейтрализации всех жирных кислот,
Йодное число – количество граммов йода, связываемое с 100 г жира,
характеризует степень ненасыщенности данного жира.
2. Воска – это сложные эфиры, образуемые длинноцепочечными жирными кислотами и длинноцепочечными спиртами. У позвоночных животных секретируемые кожными железами воска выполняют функцию защитного покрытия, которое смазывает и смягчает кожу, а также предохраняет ее от воды. Восковым слоем покрыты волосы, шерсть, мех, перья животных, а также листья многих растений. Воска вырабатываются и ис-пользуются в очень больших количествах морскими организмами, особенно планктоном, у которого они служат основной формой накопления высококалорийного клеточного топлива.
спермацет, получают из головного мозга кашалотов
пчелиный воск
3. Фосфоглицеролипиды – служат главными структурными компонентами мембран и никогда не запасаются в больших количествах. Обязательно содержат в своем составе многоатомный спирт глицерин, фосфорную кислоту и остатки жирных кислот.
Фосфоглицеролипиды по химическому строению можно еще разделить на несколько типов:
1) фосфолипиды – состоят из глицерина, двух остатков жирных кислот по 1-му и 2-му положению глицерина и остатка фосфорной кислоты, с которой связан остаток еще одного спирта (этаноламин, холин, серин, инозитол). Как правило, жирная кислота в 1-м положении насыщенная, а во 2-м – ненасыщенная.
фосфатидная кислота – исходное вещество для синтеза других фосфолипидов, в тканях содержится в незначительных количествах
фосфатидилэтаноламин (кефалин)
фосфатидилхолин (лецитин), его практически нет в бактериях
фосфатидилсерин
фосфатидилинозитол – предшественник двух важных вторичных мессенджеров (посредников) диацилглицерина и инозитол-1,4,5-трифосфата
2) плазмалогены – фосфоглицеролипиды, у которых одна из углеводо-родных цепей представляет собой простой виниловый эфир. Плазмалогены не встречаются в растениях. Этаноламиновые плазмалогены широко представлены в миелине и в саркоплазматическом ретикулуме сердца.
этаноламинплазмалоген
3) лизофосфолипиды – образуются из фосфолипидов при ферментатив-ном отщеплении одного из ацильных остатков. В змеином яде содержится фосфолипаза А 2 , которая образует лизофосфатиды, обладающие гемолитическим действием;
4) кардиолипины – фосфолипиды внутренних мембран бактерий и мито-хондрий, образуются при взаимодействии с глицерином двух остатков фосфатидной кислоты:
кардиолипин
4. Фосфосфинголипиды – функции глицерина в них выполняет сфингозин – аминоспирт с длинной алифатической цепью. Не содержат глицерина. В большом количестве присутствуют в мембранах клеток нервной ткани и мозге. В мембранах растительных и бактериальных клеток фосфосфинголипиды встречаются редко. Производные сфингозина, ацилированного по аминогруппе остатками жирных кислот, называются церамидами. Важнейший представитель этой группы – сфингомиелин (церамид-1-фосфохолин). Он присутствует в большинстве мембран животных клеток, особенно много его в миелиновых оболочках нервных клеток определенного типа.
сфингомиелин
сфингозин
5. Гликоглицеролипиды – липиды, у которых в положении 3 глицерола находится углевод, присоединенный с помощью гликозидной связи, фосфатной группы не содержат. Гликоглицеролипиды широко представлены в мембранах хлоропластов, а также в сине-зеленых водорослях и бактериях. Моногалактозилдиацилглицерол – наиболее распространенный в природе полярный липид, поскольку на его долю приходится половина всех липидов тилакоидной мембраны хлоропластов:
моногалактозилдиацилглицерол
6. Гликосфинголипиды – построены из сфингозина, остатка жирной кислоты и олигосахарида. Содержатся во всех тканях, главным образом в наружном липидном слое плазматических мембран. В них отсутствует фосфатная группа и они не несут электрического заряда. Гликосфинголипиды можно разделить еще на два типа:
1) цереброзиды – более простые представители этой группы. Галактоцереброзиды содержатся главным образом в мембранах клеток мозга, тогда как глюкоцереброзиды присутствуют в мембранах других клеток. Цереброзиды, содержащие два, три или четыре остатка сахаров, локализуются в основном в наружном слое клеточных мембран.
галактоцереброзид
2) ганглиозиды – наиболее сложные гликосфинголипиды. Их очень крупные полярные головы образованы несколькими остатками сахаров. Для них характерно наличие в крайнем положении одного или нескольких остатков N-ацетилнейраминовой (сиаловой) кислоты, несущей при рН 7 отрицательный заряд. В сером веществе головного мозга ганглиозиды составляют около 6% мембранных липидов. Ганглиозиды – важные компоненты расположенных на поверхности клеточных мембран специфических рецепторных участков. Так они находятся в тех специфических участках нервных окончаний, где происходит связывание молекул нейромедиатора в процессе химической передачи импульса от одной нервной клетки к другой.
7. Изопреноиды – производные изопрена (активная форма – 5-изопенте-нилдифосфат), выполняющие самые разнообразные функции.
изопрен 5-изопентенилдифосфат
Способность синтезировать специфические изопреноиды свойственна лишь некоторым видам животных и растений.
1) каучук – синтезируют несколько видов растений, в первую очередь гевея бразильская:
фрагмент каучука
2) жирорастворимые витамины А, D, Е, К (из-за структурного и функ-ционального сродства со стероидными гормонами витамин D сейчас относят к гормонам):
витамин А
витамин Е
витамин К
3) гормоны роста животных – ретиноевая кислота у позвоночных и неоте-нины у насекомых:
ретиноевая кислота
неотенин
Ретиноевая кислота является гормональным производным витамина А, стимулирует рост и дифференциацию клеток, неотенины – гормоны насекомых, стимулируют рост личинок и тормозят линьку, являются антагонистами экдизону;
4) растительные гормоны – абсцизовая кислота, является стрессовым фитогормоном, запускающим системный иммунный ответ растений, проявляющийся в устойчивости к самым различным патогенам:
абсцизовая кислота
5) терпены – многочисленные душистые вещества и эфирные масла растений, обладающие бактерицидным и фунгицидным действием; соединения из двух изопреновых звеньев называются монотерпенами, из трех – сесквитерпенами, из шести – тритерпенами:
камфора тимол
6) стероиды – сложные жирорастворимые вещества, молекулы которых содержат в своей основе циклопентанпергидрофенантрен (по своей сути – тритерпен). Основной стерол в тканях животных – спирт холестерин (холестерол). Холестерин и его эфиры с длинноцепочечными жирными кислотами – важные компоненты липопротеинов плазмы, а также наружной клеточной мембраны. Из-за того, что четыре конденсированных кольца создают жесткую структуру, присутствие холестерина в мембра-нах регулирует текучесть мембран при экстремальных температурах. В растениях и микроорганизмах содержатся родственные соединения – эргостерин, стигмастерин и β-ситостерин.
холестерин
эргостерин
стигмастерин
β-ситостерин
Из холестерина в организме образуются желчные кислоты. Они обеспечивают растворимость холестерина в желчи и способствуют перевариванию липидов в кишечнике.
холевая кислота
Из холестерина образуются также стероидные гормоны – липофильные сигнальные молекулы, регулирующие обмен веществ, рост и репродук-цию. В организме человека основными являются шесть стероидных гормонов:
кортизол альдостерон
тестостерон эстрадиол
прогестерон кальцитриол
Кальцитриол – витамин D, обладающий гормональной активностью, он отличается от гормонов позвоночных, однако также построен на основе холестерина. Кольцо В раскрывается за счет светозависимой реакции.
Производным холестерина является гормон линьки насекомых, пауков и ракообразных – экдизон. Стероидные гормоны, выполняющие сигнальную функцию, встречаются также в растениях.
7) липидные якоря, удерживающие молекулы белков или других соединений на мембране:
убихинон
Как мы видим, липиды не являются полимерами в буквальном смысле этого слова, однако как в метаболическом, так и в структурном отношении они близки к присутствующей в бактериях полиоксимасляной кислоте – важному запасному веществу. Этот сильно восстановленный полимер состоит исключительно из звеньев D-β-оксимасляной кислоты, соединенных сложноэфирной связью. Каждая цепь содержит около 1500 остатков. Структура представляет собой компактную правую спираль, около 90 таких цепей уложено с образованием тонкого слоя в бактериальных клетках.
поли-D-β-оксимасляная кислота
Аминокислотами называются карбоновые кислоты, содержащие аминогруппу и карбоксильную группу. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или α-аминокислотами, хотя существуют такие аминокислоты как β-аланин, таурин, γ-аминомасляная кислота. Обобщенная формула α-аминокислоты выглядит так:
У α-аминокислот при 2 атоме углерода имеются четыре разных заместителя, то есть все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) атом углерода и существуют в виде двух энантиомеров – L- и D-аминокислот. Природные аминокислоты относятся к L-ряду. D-аминокислоты встречаются в бактериях и пептидных антибиотиках.
Все аминокислоты в водных растворах могут существовать в виде биполярных ионов, причем их суммарный заряд зависит от рН среды. Величина рН, при которой суммарный заряд равен нулю, называется изоэлектрической точкой. В изоэлектрической точке аминокислота является цвиттер-ионом, то есть аминная группа у нее протонирована, а карбоксиль-ная – диссоциирована. В нейтральной области рН большинство аминокислот являются цвиттер-ионами:
Аминокислоты не поглощают свет в видимой области спектра, ароматические аминокислоты поглощают свет в УФ области спектра: триптофан и тирозин при 280 нм, фенилаланин – при 260 нм.
Для аминокислот характерны некоторые химические реакции, имеющие большое значение для лабораторной практики: цветная нингидриновая проба на α-аминогруппу, реакции, характерные для сульфгидрильных, фенольных и других групп радикалов аминокислот, ацелирование и образование оснований Шиффа по аминогруппам, этерификация по карбоксильным группам.
Биологическая роль аминокислот:
1) являются структурными элементами пептидов и белков, так называемые протеиногенные аминокислоты. В состав белков входят 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в про-цессе трансляции, некоторые из них могут быть фосфорилированы, ацилированы или гидроксилированы;
2) могут быть структурными элементами других природных соединений – коферментов, желчных кислот, антибиотиков;
3) являются сигнальными молекулами. Некоторые из аминокислот являются нейромедиаторами или предшественниками нейромедиаторов, гормонов и гистогормонов;
4) являются важнейшими метаболитами, например, некоторые аминокислоты являются предшественниками алкалоидов растений, или служат донорами азота, или являются жизненно важными компонентами питания.
Классификация протеиногенных аминокислот основана на строении и на полярности боковых цепей:
1. Алифатические аминокислоты:
глицин, гли , G, Gly
аланин, ала , А, Ala
валин, вал , V, Val*
Лейцин, лей , L, Leu*
изолейцин, иле, I, Ile*
Эти аминокислоты не содержат в боковой цепи гетероатомов, циклических группировок и характеризуется отчетливо выраженной низкой полярностью.
цистеин, цис , C, Cys
метионин, мет , M, Met*
3. Ароматические аминокислоты:
фенилаланин, фен , F, Phe*
тирозин, тир , Y, Tyr
триптофан, три , W, Trp*
гистидин, гис , H, His
Ароматические аминокислоты содержат мезомерные резонансно стабилизированные циклы. В этой группе только аминокислота фенилаланин проявляет низкую полярность, тирозин и триптофан характеризуются заметной, а гистидин – даже высокой полярностью. Гистидин может быть отнесен также к основным аминокислотам.
4. Нейтральные аминокислоты:
серин, сер , S, Ser
треонин, тре , T, Thr*
аспарагин, асн, N, Asn
глутамин, глн, Q, Gln
Нейтральные аминокислоты содержат гидроксильные или карбоксамидные группы. Хотя амидные группы неионогенны, молекулы аспарагина и глута-мина высоко полярны.
5. Кислые аминокислоты:
аспарагиновая кислота (аспартат), асп , D, Asp
глутаминовая кислота (глутамат), глу, E, Glu
Карбоксильные группы боковых цепей кислых аминокислот полностью ионизированы во всем диапазоне физиологических значений рН.
6. Основные аминокислоты:
лизин, лиз, K, Lys*
аргинин, арг , R, Arg
Боковые цепи основных аминокислот полностью протонированы в нейтраль-ной области рН. Сильно основной и очень полярной аминокислотой является аргинин, содержащий гуанидиновую группировку.
7. Иминокислота:
пролин, про , P, Pro
Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой. Атом азота в кольце является слабым основанией и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи, что очень существенно для структуры коллагена.
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Это незаменимые аминокислоты отмечены звездочками.
Как было указано выше, протеиногенные аминокислоты являются предшественниками некоторых ценных биологически активных молекул.
Два биогенных амина β-аланин и цистеамин входят в состав кофермента А (коферменты – производные водорастворимых витаминов, образующие активный центр сложных ферментов). β-Аланин образуется путем декарбоксилирования аспарагиновой кислоты, а цистеамин путем декарбоксилирования цистеина:
β-аланин цистеамин
Остаток глутаминовой кислоты входит в состав другого кофермента – тетрагидрофолиевой кислоты, производного витамина В с.
Другими биологически ценными молекулами являются конъюгаты желчных кислот с аминокислотой глицином. Эти конъюгаты являются более сильными кислотами, чем базовые, образуются в печени и присутствуют в желчи в виде солей.
гликохолевая кислота
Протеиногенные аминокислоты являются предшественниками некоторых антибиотиков – биологически активных веществ, синтезируемых микроорганизмами и подавляющих размножение бактерий, вирусов и клеток. Наиболее известными из них являются пенициллины и цефалоспорины, составляющие группу β-лактамных антибиотиков и продуцирумые плесенью рода Penicillium . Для них характерно наличие в структуре реакционноспособного β-лактамного кольца, с помощью которого они ингибируют синтез клеточных стенок грамотрицательных микроорганизмов.
общая формула пенициллинов
Из аминокислот путем декарбоксилирования получаются биогенные амины – нейромедиаторы, гормоны и гистогормоны.
Аминокислоты глицин и глутамат сами по себе являются нейромедиаторами в центральной нервной системе.
Производными аминокислот также являются алкалоиды – природные азотсодержащие соединения основного характера, образующиеся в расте-ниях. Данные соединения являются исключительно активными физиологическими соединениями, широко используемыми в медицине. Примерами алкалоидов могут служить производное фенилаланина папаверин, изохинолиновый алкалоид мака снотворного (спазмолитик), и производное триптофана физостигмин, индольный алкалоид из калабар-ских бобов (антихолинэстеразный препарат):
папаверин физостигмин
Аминокислоты являются чрезвычайно популярными объектами биотехнологии. Существует множество вариантов химического синтеза аминокислот, однако в результате получаются рацематы аминокислот. Так как для пищевой промышленности и медицины пригодны только L-изомеры аминокислот, рацемические смеси необходимо разделять на энантиомеры, что представляет серьезную проблему. Поэтому более популярен биотехнологический подход: ферментативный синтез с помощью иммобилизированных ферментов и микробиологический синтез с помощью целых микробных клеток. В обоих последних случаях получаются чистые L-изомеры.
Аминокислоты используются как пищевые добавки и компоненты кормов. Глутаминовая кислота усиливает вкус мяса, валин и лейцин улучшают вкус хлебобулочных изделий, глицин и цистеин используются в качестве антиоксидантов при консервировании. D-триптофан может быть заменителем сахара, так как во много раз его слаще. Лизин добавляют в корм сельскохозяйственным животным, так как большинство растительных белков содержит малое количество незаменимой аминокислоты лизина.
Аминокислоты широко используются в медицинской практике. Это такие аминокислоты как метионин, гистидин, глутаминовая и аспарагиновая кислоты, глицин, цистеин, валин.
В последнее десятилетие аминокислоты начали добавлять в космети-ческие средства по уходу за кожей и волосами.
Химически модифицированные аминокислоты также широко используются в промышленности в качестве поверхностно-активных веществ в синтезе полимеров, при производстве моющих средств, эмульгаторов, добавок к топливу.
Современно протеиновое питание невозможно представить без рассмотрения роли отдельных аминокислот. Даже при общем положительном протеиновом балансе организм животного может испытывать недостаток протеина. Это связано с тем, что усвоение отдельных аминокислот взаимосвязано в друг другом, недостаток или избыток одной аминокислоты может приводить к недостатку другой.
Часть аминокислот не синтезируется в организме человека и животных. Они получили название незаменимых. Таких аминокислот всего десять. Четыре из них являются критическими (лимитирующими)- они чаще всего ограничивают рост и развитие животных.
В рационах для птицы главными лимитирующими аминокислотами являются метионин и цистин, в рационах для свиней – лизин. Организм должен получать достаточное количество главной лимитирующей кислоты с кормом для того, чтобы и другие аминокислоты могли эффективно использоваться для синтеза белка.
Этот принцип иллюстрирован «бочкой Либиха», где уровень заполнения бочки представляет собой уровень синтеза протеина в организме животного. Самая короткая доска в бочке «ограничивает» возможность удержания в ней жидкости. Если же эта доска будет удлинена, то и объем удерживаемой в бочке жидкости увеличится до уровня второй лимитирующей доски.
Самый важный фактор, определяющий продуктивность животных, - это сбалансированность содержащихся в нем аминокислот в соответствии с физиологическими потребностями. Многочисленными исследованиями было доказано, что у свиней, в зависимости от породы и пола, потребность в аминокислотах отличается количественно. А вот отношение незаменимых аминокислот для синтеза 1 г протеина является одинаковым. Такое соотношение незаменимых аминокислот к лизину, как основной лимитирующей аминокислоте, и называется «идеальным протеином» или «идеальным профилем аминокислот». (
Лизин
входит в состав практически всех белков животного, растительного и микробного происхождения, однако протеины злаковых культур бедны лизином.
- Лизин регулирует воспроизводительную функцию, при его недостатке нарушается образование спермиев и яйцеклеток.
- Необходим для роста молодняка, образования тканевых белков. Лизин принимает участие в синтезе нуклеопротеидов, хромопротеидов (гемоглобин), тем самым регулирует пигментацию шерсти животных. Регулирует количество продуктов распада белка в тканях и органах.
- Способствует всасыванию кальция
- Участвует в функциональной деятельности нервной и эндокринной систем, регулирует обмен белков и углеводов, однако реагируя с углеводами, лизин переходит в недоступную для усвоения форму.
- Лизин является исходным веществом при образовании карнитина, играющего важную роль в жировом обмене.
Метионин и цистин серосодержащие аминокислоты. При этом метионин может трансформироваться в цистин, поэтому эти аминокислоты нормируются вместе, а при недостатке в рацион вводятся метиониновые добавки. Обе эти аминокислоты участвуют в образовании производных кожи - волоса, пера; вместе с витамином Е регулируют удаление избытков жира из печени, необходимы для роста и размножения клеток, эритроцитов. При недостатке метионина цистин неактивен. Однако значительного избытка метионина в рационе не следует допускать.
Метионин
способствует отложению жира в мышцах, необходим для образования новых органических соединений холина (витамина В4), креатина, адреналина, ниацина (витамина В5) и др.
Дефицит метионина в рационах приводит к снижению уровня плазменных белков (альбуминов), вызывает анемию (снижается уровень гемоглобина крови), при одновременном недостатке витамина Е и селена способствует развитию мышечной дистрофии. Недостаточное количество метионина в рационе вызывает отставание в росте молодняка, потерю аппетита, снижение продуктивности, увеличение затрат корма, жировое перерождение печени, нарушение функций почек, анемию и истощение.
Избыток метионина ухудшает использование азота, вызывает дегенеративные изменения в печени, почках, поджелудочной железе, увеличивает потребность в аргинине, глицине. При большом избытке метионина наблюдается дисбаланс (нарушается равновесие аминокислот, в основе которого лежат резкие отклонения от оптимального соотношения незаменимых аминокислот в рационе), который сопровождается нарушением обмена веществ и торможением скорости роста у молодняка.
Цистин - серосодержащая аминокислота, взаимозаменяемая с метионином, участвует в окислительно-восстановительных процессах, обмене белков, углеводов и желчных кислот, способствует образованию веществ, обезвреживающих яды кишечника, активизирует инсулин, вместе с триптофаном цистин участвует в синтезе в печени желчных кислот, необходимых для всасывания продуктов переваривания жиров из кишечника, используется для синтеза глютатиона. Цистин обладает способностью поглощать ультрафиолетовые лучи. При недостатке цистина отмечается цирроз печени, задержка оперяемости и роста пера у молодняка, ломкость и выпадение (выщипывание) перьев у взрослой птицы, снижение сопротивляемости к инфекционным заболеваниям.
Триптофан
определяет физиологическую активность ферментов пищеварительного тракта, окислительных ферментов в клетках и ряда гормонов, участвует в обновлении белков плазмы крови, обуславливает нормальное функционирование эндокринного и кроветворного аппаратов, половой системы, синтез гамма - глобулинов, гемоглобина, никотиновой кислоты, глазного пурпура и др. При недостатке в рационе триптофана замедляется рост молодняка, снижается яйценоскость несушек, повышаются затраты корма на продукцию, атрофируются эндокринные и половые железы, возникает слепота, развивается анемия (снижается количество эритроцитов и уровень гемоглобина в крови), понижается резистентность и иммунные свойства организма, оплодотворённость и выводимость яиц. У свиней, получавших рацион, бедный триптофаном, снижается потребление корма, появляется извращенный аппетит, огрубение щетины и истощение, отмечается ожирение печени. Дефицит этой аминокислоты приводит также к стерильности, повышенной возбудимости, конвульсиям, образованию катаракты, отрицательному балансу азота и потере живой массы. Триптофан, являясь предшественником (провитамином) никотиновой кислоты, предупреждает развитие пеллагры.
Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Названию белки, наиболее принятому в отечественной литературе, соответствует термин протеины (от греч. proteios - первый). К настоящему времени достигнуты большие успехи в установлении соотношения структуры и функций белков, механизма их участия в важнейших процессах жизнедеятельности организма и в понимании молекулярных основ патогенеза многих болезней.
В зависимости от молекулярной массы различают пептиды и белки. Пептиды имеют меньшую молекулярную массу, чем белки. Для пептидов более свойственна регуляторная функция (гормоны, ингибиторы и активаторы ферментов, переносчики ионов через мембраны, антибиотики, токсины и др.).
12.1. α -Аминокислоты
12.1.1. Классификация
Пептиды и белки построены из остатков α-аминокислот. Общее число встречающихся в природе аминокислот превышает 100, но некоторые из них обнаружены лишь в определенном сообществе орга- низмов, 20 наиболее важных α-аминокислот постоянно встречаются во всех белках (схема 12.1).
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Схема 12.1. Важнейшие α-аминокислоты*

* Сокращенные обозначения применяются только для записи аминокислотных остатков в молекулах пептидов и белков. ** Незаменимые аминокислоты.
Названия α-аминокислот могут быть построены по заместительной номенклатуре, но чаще используются их тривиальные названия.

Тривиальные названия α-аминокислот обычно связаны с источниками выделения. Серин входит в состав фиброина шелка (от лат. serieus - шелковистый); тирозин впервые выделен из сыра (от греч. tyros - сыр); глутамин - из злаковой клейковины (от нем. Gluten - клей); аспарагиновая кислота - из ростков спаржи (от лат. asparagus - спаржа).
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми (см. схему 12.1).
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
α-Аминокислоты классифицируют несколькими способами в зависимости от признака, положенного в основу их деления на группы.
Одним из классификационных признаков служит химическая природа радикала R. По этому признаку аминокислоты делятся на алифатические, ароматические и гетероциклические (см. схему 12.1).
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
Нейтральные аминокислоты - по одной группе NH 2 и СООН;
Основные аминокислоты - две группы NH 2 и одна группа
СООН;
Кислые аминокислоты - одна группа NH 2 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
Гидроксильная - серин, треонин;
Карбоксильная - аспарагиновая и глутаминовая кислоты;
Тиольная - цистеин;
Амидная - аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН 2-.

Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.

К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового

В химии α-аминокислот большое внимание уделяется строению и свойствам «боковых» радикалов R, которые играют важную роль в формировании структуры белков и выполнении ими биологических функций. Большое значение имеют такие характеристики, как полярность «боковых» радикалов, наличие в радикалах функциональных групп и способность этих функциональных групп к ионизации.
В зависимости от бокового радикала выделяют аминокислоты с неполярными (гидрофобными) радикалами и аминокислоты c поляр- ными (гидрофильными) радикалами.
К первой группе относятся аминокислоты с алифатическими боковыми радикалами - аланин, валин, лейцин, изолейцин, метионин - и ароматическими боковыми радикалами - фенилаланин, триптофан.
Ко второй группе принадлежат аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к иони- зации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине - неионогенная (имеет спиртовую природу).

Полярные аминокислоты с ионогенными группами в радикалах в определенных условиях могут находиться в ионном (анионном или катионном) состоянии.

12.1.2. Стереоизомерия
Основной тип построения α-аминокислот, т. е. связь одного и того же атома углерода с двумя разными функциональными группами, радикалом и атомом водорода, уже сам по себе предопределяет хираль- ность α-атома углерода. Исключение составляет простейшая аминокислота глицин H 2 NCH 2 COOH, не имеющая центра хиральности.
Конфигурация α-аминокислот определяется по конфигурационному стандарту - глицериновому альдегиду. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно группе ОН в l-глицериновом альдегиде) соответствует l-конфи- гурации, справа - d-конфигурации хирального атома углерода. По R, S-системе α-атом углерода у всех α-аминокислот l-ряда имеет S-, а у d-ряда - R-конфигурацию (исключение составляет цистеин, см. 7.1.2).
Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные α-аминокислоты принадлежат к l-ряду.

Аминокислоты изолейцин, треонин и 4-гидроксипролин содержат в молекуле по два центра хиральности.

Такие аминокислоты могут существовать в виде четырех стереоизомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Для построения белков животных организмов используется только один из энантиомеров.
Стереоизомерия изолейцина аналогична рассмотренной ранее стереоизомерии треонина (см. 7.1.3). Из четырех стереоизомеров в состав белков входит l-изолейцин с S-конфигурацией обоих асимметрических атомов углерода С-α и С-β. В названиях другой пары энантиомеров, являющихся диастереомерами по отношению к лейцину, используется приставка алло-.

Расщепление рацематов. Источником получения α-аминокислот l-ряда служат белки, которые подвергают для этого гидролитическому расщеплению. В связи с большой потребностью в отдельных энантиомерах (для синтеза белков, лекарственных веществ и т. п.) разработаны химические методы расщепления синтетических рацемических аминокислот. Предпочтителен ферментативный способ расщепления с использованием ферментов. В настоящее время для разделения рацемических смесей используют хроматографию на хиральных сорбентах.
12.1.3. Кислотно-основные свойства
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH 2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Полностью протонированная аминокислота (катионная форма) с позиций теории Брёнстеда является двухосновной кислотой,
Отдавая один протон, такая двухосновная кислота превращается в слабую одноосновную кислоту - диполярный ион с одной кислотной группой NH 3 + . Депротонирование диполярного иона приводит к получению анионной формы аминокислоты - карбоксилат-иона, являющегося основанием Брёнстеда. Значения характеризую-
щие кислотные свойства карбоксильной группы аминокислот, обычно лежат в интервале от 1 до 3; значения рK а2 характеризующие кислотность аммониевой группы, - от 9 до 10 (табл. 12.1).
Таблица 12.1. Кислотно-основные свойства важнейших α-аминокислот

Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH 2 . Например, у аланина изоэлектрическая точка находится при рН 6,0.

Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рК а, как это видно на примере аспарагиновой кислоты (р/ 3,0).

У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).

В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α -аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
12.1.4. Аналитически важные реакции α -аминокислот
α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные как для карбоксильной, так и для аминогруппы. Некоторые химические свойства аминокислот обусловлены функциональными группами в радикале. В настоящем разделе рассматриваются реакции, имеющие практическое значение для идентификации и анализа аминокислот.
Этерификация. При взаимодействии аминокислот со спиртами в присутствии кислотного катализатора (например, газообразный хлороводород) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком.

Сложные эфиры аминокислот не имеют диполярного строения, поэтому, в отличие от исходных кислот, они растворяются в органических растворителях и обладают летучестью. Так, глицин - крис- таллическое вещество с высокой температурой плавления (292 ?С), а его метиловый эфир - жидкость с температурой кипения 130 ?С. Анализ эфиров аминокислот можно проводить с помощью газожидкостной хроматографии.
Реакция с формальдегидом. Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена).
Амфотерность аминокислот не позволяет проводить непосредственно титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые аминоспирты (см. 5.3) - N-гидроксиметильные производные, свободную карбоксильную группу которых затем титруют щелочью.
Качественные реакции. Особенность химии аминокислот и белков заключается в использовании многочисленных качественных (цветных) реакций, составлявших ранее основу химического анализа. В настоящее время, когда исследования проводятся с помощью физико-химических методов, многие качественные реакции продолжают применять для обнаружения α-аминокислот, например, в хроматографическом анализе.
Хелатообразование. С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди(11) в мягких условиях получаются хорошо кристаллизующиеся хелатные
соли меди(11) синего цвета (один из неспецифических способов обнаружения α-аминокислот).

Нингидринная реакция. Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550-570 нм).

Дезаминирование. В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты (см. 4.3). При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван-Слайка).
Ксантопротеиновая реакция. Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

Существует также ряд частных реакций, позволяющих обнаруживать отдельные аминокислоты.
Триптофан обнаруживают при помощи реакции с п-(диметиламино)бензальдегидом в среде серной кислоты по появляющемуся красно-фиолетовому окрашиванию (реакция Эрлиха). Эта реакция используется для количественного анализа триптофана в продуктах расщепления белков.
Цистеин обнаруживают с помощью нескольких качественных реакций, основанных на реакционной способности содержащейся в нем меркаптогруппы. Например, при нагревании раствора белка с ацетатом свинца (СНзСОО)2РЬ в щелочной среде образуется черный осадок сульфида свинца PbS, что указывает на присутствие в белках цистеина.
12.1.5. Биологически важные химические реакции
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции - получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.

α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу NH 3 +), в связи с чем способны к декарбоксилированию.
Элиминирование свойственно аминокислотам, у которых в боковом радикале в β-положении к карбоксильной группе содержится электроноакцепторная функциональная группа, например гидроксильная или тиольная. Их отщепление приводит к промежуточным реакционноспособным α-енаминокислотам, легко переходящим в таутомерные иминокислоты (аналогия с кето-енольной таутомерией). α-Иминокислоты в результате гидратации по связи C=N и последующего отщепления молекулы аммиака превращаются в α-оксокислоты.

Такой тип превращений имеет название элиминирование-гидратация. Примером служит получение пировиноградной кислоты из серина.
Альдольное расщепление происходит в случае α-аминокислот, у которых в β-положении содержится гидроксильная группа. Например, серин расщепляется с образованием глицина и формальдегида (последний не выделяется в свободном виде, а сразу связывается с коферментом).
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+ (см. 14.3). α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.

В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Окисление тиольных групп лежит в основе взаимопревращений цистеиновых и цистиновых остатков, обеспечивающих ряд окислительно-восстановительных процессов в клетке. Цистеин, как и все тиолы (см. 4.1.2), легко окисляется с образованием дисульфида - цистина. Дисульфидная связь в цистине легко восстанавливается с образованием цистеина.

Благодаря способности тиольной группы к легкому окислению цистеин выполняет защитную функцию при воздействии на орга- низм веществ с высокой окислительной способностью. Кроме того, он был первым лекарственным средством, проявившим противолучевое действие. Цистеин используется в фармацевтической практике в качестве стабилизатора лекарственных препаратов.
Превращение цистеина в цистин приводит к образованию дисульфидных связей, например, в восстановленном глутатионе
(см. 12.2.3).
12.2. Первичная структура пептидов и белков
Условно считают, что пептиды содержат в молекуле до 100 (что соответствует молекулярной массе до 10 тыс.), а белки - более 100 аминокислотных остатков (молекулярная масса от 10 тыс. до нескольких миллионов).
В свою очередь, в группе пептидов принято различать олигопептиды (низкомолекулярные пептиды), содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, в состав цепи которых входит до 100 аминокислотных остатков. Макромолекулы с числом аминокислотных остатков, приближающимся или немного превышающим 100, не разграничивают по понятиям полипептиды и белки, эти термины часто используют как синонимы.
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями (схема 12.2).
Конструкция полиамидной цепи одинакова для всего многообразия пептидов и белков. Эта цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп -СО-NH- и фрагментов -CH(R)-.
Один конец цепи, на котором находится аминокислота со свободной группой NH 2, называют N-концом, другой - С-концом,
Схема 12.2. Принцип построения пептидной цепи

на котором находится аминокислота со свободной группой СООН. Пептидные и белковые цепи записывают с N-конца.
12.2.1. Строение пептидной группы
В пептидной (амидной) группе -СО-NH- атом углерода находится в состоянии sp2-гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с π-электронами двойной связи С=О. С позиций электронного строения пептидная группа представляет собой трехцентровую p,π-сопряженную систему (см. 2.3.1), электронная плотность в которой смещена в сторону более электроотрицательного атома кислорода. Атомы С, Ои N, образующие сопряженную систему, находятся в одной плоскости. Распределение электронной плотности в амидной группе можно представить с по- мощью граничных структур (I) и (II) или смещения электронной плотности в результате +M- и - M-эффектов групп NH и C=O соответственно (III).

В результате сопряжения происходит некоторое выравнивание длин связей. Двойная связь С=О удлиняется до 0,124 нм против обычной длины 0,121 нм, а связь С-N становится короче - 0,132 нм по сравнению с 0,147 нм в обычном случае (рис. 12.1). Плоская сопряженная система в пептидной группе служит причиной затруднения вращения вокруг связи С-N (барьер вращения составляет 63-84 кДж/моль). Таким образом, электронное строение предопре- деляет достаточно жесткую плоскую структуру пептидной группы.
Как видно из рис. 12.1, α-атомы углерода аминокислотных остатков располагаются в плоскости пептидной группы по разные стороны от связи С-N, т. е. в более выгодном тpанс-положении: боковые радикалы R аминокислотных остатков в этом случае будут наиболее удалены друг от друга в пространстве.
Полипептидная цепь имеет удивительно однотипное строение и может быть представлена в виде ряда расположенных под углом друг

Рис. 12.1. Плоскостное расположение пептидной группы -CO-NH- и α-атомов углерода аминокислотных остатков
к другу плоскостей пептидных групп, соединенных между собой через α-атомы углерода связями Сα-N и Сα-Сsp 2 (рис. 12.2). Вращение вокруг этих одинарных связей весьма ограничено вследствие затруднений в пространственном размещении боковых радикалов аминокислотных остатков. Таким образом, электронное и пространственное строение пептидной группы во многом предопределяет структуру полипептидной цепи в целом.

Рис. 12.2. Взаимное положение плоскостей пептидных групп в полипептидной цепи
12.2.2. Состав и аминокислотная последовательность
При единообразно построенной полиамидной цепи специфичность пептидов и белков определяется двумя важнейшими характе- ристиками - аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептидов и белков - это природа и количественное соотношение входящих в них α-аминокислот.
Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизатов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов.
Амидные связи способны гидролизоваться как в кислой, так и щелочной среде (см. 8.3.3). Пептиды и белки гидролизуются с образованием либо более коротких цепей - это так называемый частичный гидролиз, либо смеси аминокислот (в ионной форме) - полный гидролиз. Обычно гидролиз осуществляют в кислой среде, так как в условиях щелочного гидролиза многие аминокислоты неустойчивы. Следует отметить, что гидролизу подвергаются также амидные группы аспарагина и глутамина.

Первичная структура пептидов и белков - это аминокислотная последовательность, т. е. порядок чередования α-аминокислотных остатков.
Первичную структуру определяют путем последовательного отщепления аминокислот с какого-либо конца цепи и их идентификации.
12.2.3. Строение и номенклатура пептидов
Названия пептидов строят путем последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением суффикса -ил, кроме последней С-концевой аминокислоты, для которой сохраняется ее полное название. Другими словами, названия
аминокислот, вступивших в образование пептидной связи за счет «своей» группы СООН, оканчиваются в названии пептида на -ил: аланил, валил и т. п. (для остатков аспарагиновой и глутаминовой кислот используют названия «аспартил» и «глутамил» соответствен- но). Названия и символы аминокислот означают их принадлежность к l -ряду, если не указано иное (d или dl ).

Иногда в сокращенной записи символами Н (как часть аминогруппы) и ОН (как часть карбоксильной группы) уточняется незамещенность функциональных групп концевых аминокислот. Этим способом удобно изображать функциональные производные пептидов; например, амид приведенного выше пептида по С-концевой аминокислоте записывается Н-Asn-Gly-Phe-NH2.
Пептиды содержатся во всех организмах. В отличие от белков они имеют более разнородный аминокислотный состав, в частнос- ти, довольно часто включают аминокислоты d -ряда. В структурном отношении они также более разнообразны: содержат циклические фрагменты, разветвленные цепи и т. д.
Один из наиболее распространенных представителей трипептидов - глутатион - содержится в организме всех животных, в растениях и бактериях.

Цистеин в составе глутатиона обусловливает возможность существования глутатиона как в восстановленной, так и окисленной форме.

Глутатион участвует в ряде окислительно-восстановительных процессов. Он выполняет функцию протектора белков, т. е. вещества, предохраняющего белки со свободными тиольными группами SH от окисления с образованием дисульфидных связей -S-S-. Это касается тех белков, для которых такой процесс нежелателен. Глутатион в этих случаях принимает на себя действие окислителя и таким образом «защищает» белок. При окислении глутатиона происходит межмолекулярное сшивание двух трипептидных фрагментов за счет дисульфидной связи. Процесс обратим.
12.3. Вторичная структура полипептидов и белков
Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны и более высокие уровни организа- ции, которые называют вторичной, третичной и четвертичной струк- турами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная - трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структура связана с упорядоченным расположением макромолекулярной цепи в пространстве. Третичная и четвертичная структура белков рассматривается в курсе биохимии.
Расчетным путем было показано, что для полипептидной цепи одной из наиболее выгодных конформаций является расположение в пространстве в виде правозакрученной спирали, названной α-спиралью (рис. 12.3, а).
Пространственное расположение α-спирализованной полипептидной цепи можно представить, вообразив, что она обвивает некий

Рис. 12.3. α-Спиральная конформация полипептидной цепи
цилиндр (см. рис. 12.3, б). На один виток спирали в среднем приходится 3,6 аминокислотного остатка, шаг спирали составляет 0,54 нм, диаметр - 0,5 нм. Плоскости двух соседних пептидных групп располагаются при этом под углом 108?, а боковые радикалы аминокислот находятся на наружной стороне спирали, т. е. направлены как бы от поверхности цилиндра.
Основную роль в закреплении такой конформации цепи играют водородные связи, которые в α-спирали образуются между кар- бонильным атомом кислорода каждого первого и атомом водорода NН-группы каждого пятого аминокислотного остатка.

Водородные связи направлены почти параллельно оси α-спирали. Они удерживают цепь в закрученном состоянии.
Обычно белковые цепи спирализованы не полностью, а лишь частично. В таких белках, как миоглобин и гемоглобин, содержатся довольно длинные α-спиральные участки, например цепь миоглобина
спирализована на 75%. Во многих других белках доля спиральных участков в цепи может быть небольшой.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей (рис. 12.4). Во многих белках одновременно содержатся α-спиральные и β-складчатые структуры.

Рис. 12.4. Вторичная структура полипептидной цепи в виде складчатого листа (β-структура)
Лекция №1
ТЕМА: «Аминокислоты».
План лекции:
1. Характеристика аминокислот
2. Пептиды.
Характеристика аминокислот.
Аминокислоты – органические соединения, производные углеводородов, в молекулы которых входят карбоксильные и аминогруппы.
Белки состоят из остатков аминокислот, соединённых пептидными связями. Для анализа аминокислотного состава проводят гидролиз белка с последующим выделением аминокислот. Рассмотрим основные закономерности, характерные для аминокислот белков.
В настоящее время установлено, что в состав белков входят постоянно часто встречающийся набор аминокислот. Их 18. Кроме указанных, обнаружены ещё 2 амида аминокислот – аспарагин и глутамин. Все они получили название мажорных (часто встречающихся) аминокислот. Часто их образно называют «волшебными» аминокислотами. Кроме мажорных аминокислот, встречаются и редкие, те, которые не часто встречаются в составе природных белков. Их называют минорными.
Практически все аминокислоты белков относятся к α – аминокислотам (аминогруппа расположена у первого после карбоксильной группы атома углерода). Исходя из сказанного, для большинства аминокислот справедлива общая формула:
NH 2 -CH-COOH
Где R – радикалы, имеющие различное строение.
Рассмотрим формулы белковых аминокислот, табл. 2.

Все α - аминокислоты, кроме аминоуксусной (глицина), имеют асимметрический α - углеродный атом и существуют в виде двух энантиомеров. За редким исключением, природные аминокислоты относятся к L - ряду. Лишь в составе клеточных стенок бактерий и в антибиотиках обнаружены аминокислоты D генетического ряда. Значение угла вращения составляет 20-30 0 градусов. Вращение может быть вправо (7 аминокислот) и влево (10 аминокислот).
H― *―NH 2 H 2 N―*―H
D - кофигурация L-кофигурация
(природные аминокислоты)
В зависимости от преобладания амино- или карбоксильных групп, аминокислоты делят на 3 подкласса:
Кислые аминокислоты. Преобладают карбоксильные (кислотные) группы над аминогруппами (основными), например, аспарагиновая, глутаминовая кислоты.
Нейтральные аминокислоты Количество групп равны. Глицин, аланин, и т. д.
Основные аминокислоты. Преобладают основные (аминогруппы) над карбоксильными (кислотными), например, лизин.
По физическим и ряду химических свойств аминокислоты резко отличаются от соответствующих кислот и оснований. Они лучше растворяются в воде, чем в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие температуры плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале pH) находятся в цвиттер-ионной форме (т.е. как внутренние соли). Взаимное влияние групп особенно ярко проявляется у α - аминокислот, где обе группы находятся в непосредственной близости.
H 2 N - CH 2 COOH ↔ H 3 N + - CH 2 COO -
цвиттер-ион
Цвиттер - ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 5010 -30 Кл м), а также полосой поглощения в ИК- спектре твердой аминокислоты или её раствора.
Аминокислоты способны вступать в реакции поликонденсации, приводящие к образованию полипептидов разной длины, которые и составляет первичную структуру белковой молекулы.
H 2 N–CH(R 1)-COOH + H 2 N– CH(R 2) – COOH → H 2 N – CH(R 1) – CO-NH – CH(R 2) – COOH
Дипептид
Связь С – N – называется пептидной связью.
Помимо рассмотренных выше 20 наиболее распространенных аминокислот из гидролизатов некоторых специализированных белков выделены некоторые другие аминокислоты. Все они являются, как правило, производными обычных аминокислот, т.е. модифицированными аминокислотами.
4-оксипролин , встречается в фибриллярном белке коллагене и некоторых растительных белках; 5-оксилизин найден в гидролизатах коллагена, десмози н и изодесмозин выделены из гидролизатов фибриллярного белка эластина. Похоже, что эти аминокислоты содержаться только в этом белке. Структура их необычна: 4-е молекулы лизина, соединенные своими R-группами, образуют замещенное пиридиновое кольцо. Возможно, что благодаря именно такой структуре эти аминокислоты могут образовывать 4-е радиально расходящиеся пептидные цепи. Результатом есть то, что эластин, в отличие от других фибриллярных белков, способен деформироваться (растягиваться) в двух взаимно перпендикулярных направлениях. И т.д.
Из перечисленных белковых аминокислот живые организмы синтезируют огромное количество разнообразнейших белковых соединений. Многие растения и бактерии могут синтезировать все необходимые им аминокислоты из простых неорганических соединений. В теле человека и животных примерно половина аминокислот также синтезируется Другая часть аминокислот может поступить в организм человека только с пищевыми белками.
- незаменимые аминокислоты - не синтезируются в организме человека, а поступают только с пищей. К незаменимым аминокислотам относят 8 аминокислот: валин, фенилаланин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин .
- заменимые аминокислоты - могут синтезироваться в организме человека из других составляющих. К заменимым аминокислотам относят 12 аминокислот.
Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет. Белки, в которых содержатся незаменимые аминокислоты, должны составлять в питании взрослых людей около 16-20% (20-30г при суточной норме белка 80-100г). В питании детей доля белка повышается до 30% - для школьников, и до 40% - для дошкольников. Это связано с тем, что детский организм постоянно растет и, поэтому, нуждается в большом количестве аминокислот как пластического материала для построения белков мышц, сосудов, нервной системы, кожи и всех других тканей и органов.
В наши дни быстрого питания и всеобщего увлечения фаст-фудом в рационе очень часто преобладают продукты с высоким содержанием легкоусваиваемых углеводов и жиров, а доля белковых продуктов заметно снижается. При недостатке в рационе каких - либо аминокислот или при голодании в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» - аминокислоты идут на поддержание нормальной работы наиболее важных органов - сердца и мозга. Организм человека может испытывать нехватку как незаменимых, так и заменимых аминокислот. Дефицит аминокислот, особенно незаменимых, приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям. Первыми «вестниками» нехватки аминокислот могут быть снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия. Такие проявления могут возникнуть у лиц, с целью снижения веса соблюдающих низкокалорийную несбалансированную диету с резким ограничением белковых продуктов.
Чаще других с проявлениями нехватки аминокислот, особенно незаменимых, сталкиваются вегетарианцы, намеренно избегающие включения в свой рацион полноценного животного белка.
Избыток аминокислот встречается в наши дни достаточно редко, но может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к развитию аневризмы аорты, заболеваниям суставов, ранней седине, тяжелым анемиям). В нормальных условиях функционирования организма, когда присутствует достаточное количество витаминов (В 6 , В 12 , фолиевая кислота) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот быстро превращается в полезные компоненты и не успевает «нанести ущерб» организму. При несбалансированной диете возникает дефицит витаминов и микроэлементов, и избыток аминокислот может нарушить работу систем и органов. Такой вариант возможен при длительном соблюдении белковых или низкоуглеводных диет, а также при неконтролируемом приеме спортсменами протеиново-энергетических продуктов (аминокислотно-витаминные коктейли) для увеличения веса и развития мышц.
Среди химических методов наиболее распространен метод аминокислотного скора (scor - счет, подсчет). Он основан на сравнении аминокислотного состава белка оцениваемого продукта с аминокислотным составом стандартного (идеального) белка. После количественного определения химическим путем содержания каждой из незаменимых аминокислот в исследуемом белке определяют аминокислотный скор (АС) для каждой из них по формуле
АС = (m ак . иссл / m ак . идеальн ) 100
m ак. иссл - содержание незаменимой аминокислоты (в мг) в 1 г исследуемого белка.
m ак. идеальн - содержание незаменимой аминокислоты (в мг) в 1 г стандартного (идеального) белка.
Аминокислотный образец ФАО/ВОЗ
Одновременно с определением аминокислотного скора выявляют лимитирующую для данного белка незаменимую аминокислоту , то есть ту, для которой скор является наименьшим.
Пептиды.
Две аминокислоты могут ковалентно соединяться посредством пептидной связи с образованием дипептида.
Три аминокислоты могут соединяться посредством двух пептидных связей с образованием трипептида. Несколько аминокислот образуют олигопептиды, большое число аминокислот - полипептиды. Пептиды содержат только одну -аминогруппу и одну -карбоксильную группу. Эти группы могут быть ионизованы при определенных значениях рН. Подобно аминокислотам они имеют характеристические кривые титрования и изоэлектрические точки, при которых они не двигаются в электрическом поле.
Подобно другим органическим соединениям пептиды участвуют в химических реакциях, которые определяются наличием функциональных групп: свободной аминогруппой, свободной карбоксигруппой и R-группами. Пептидные связи подвержены гидролизу сильной кислотой (например, 6М НС1) или сильным основанием с образованием аминокислот. Гидролиз пептидных связей - это необходимый этап в определении аминокислотного состава белков. Пептидные связи могут быть разрушены действием ферментов протеаз .
Многие пептиды, встречающиеся в природе, имеют биологическую активность при очень низких концентрациях.
Пептиды - потенциально активные фармацевтические препараты, есть три способа их получения:
1) выделение из органов и тканей;
2) генетическая инженерия;
3) прямой химический синтез.
В последнем случае высокие требования предъявляются к выходу продуктов на всех промежуточных стадиях.