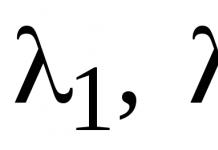Еще в 16 веке был известен минерал вольфрамит, который в переводе с немецкого (Wolf Rahm ) означает «волчьи сливки». Такое название минерал получил в связи со своими особенностями. Дело в том, что вольфрам, который сопровождал оловянные руды, во время выплавки олова превращал его просто в пену шлаков, поэтому и говорили: «пожирает олово, как волк овцу». Спустя время, именно от вольфрамита и было унаследовано 74 химическим элементом периодической системы название вольфрам.
Характеристики вольфрама
Вольфрам является переходным металлом светло-серого цвета. Имеет внешнее сходство со сталью. В связи с обладанием достаточно уникальными свойствами, данный элемент является очень ценным и редким материалом, чистый вид которого в природе отсутствует. Вольфрам обладает:
- достаточно высокой плотностью, которая приравнивается к 19,3 г/см 3 ;
- высокой температурой плавления, составляющей 3422 0 С;
- достаточным электросопротивлением - 5,5 мкОм*см;
- нормальным показателем коэффициента параметра линейного расширения, равняющегося 4,32;
- наивысшей среди всех металлов температурой кипения, равняющейся 5555 0 С;
- низкой скоростью испарения, даже не смотря на температуры, превышающие 200 0 С;
- относительно низкой электропроводностью. Однако, это не мешает вольфраму оставаться хорошим проводником.
| Характеристика | Значение |
|---|---|
| Свойства атома | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
| Электронная конфигурация | 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 ВW ← W6+ 0,68 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25 г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F) |
| Температура кипения | 5828 K (5555 °C, 10031 °F) |
| Уд. теплота плавления |
285,3 кДж/кг 52,31 кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,160 Å |
| Температура Дебая | 310 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 162,8 Вт/(м·К) |
| Номер CAS | 7440-33-7 |
Все это делает вольфрам очень прочным металлом, который не поддается механическим повреждениям. Но наличие таких уникальных свойств не исключает присутствие недостатков, которые также есть у вольфрама. К ним относятся:
- высокая ломкость при воздействии на него очень низких температур;
- высокая плотность, что затрудняет процесс его обработки;
- низкая сопротивляемость кислотам при низких температурах.
Получение вольфрама
Вольфрам, наряду с молибденом, рубидием и рядом других веществ, входит в группу редких металлов, которые характеризуются очень малым распространением в природе. В связи с этим, его нельзя добыть традиционным способом, как многие полезные ископаемые. Таким образом, промышленное получение вольфрама состоит из следующих этапов:
- добычи руды, в составе которой содержится определенная доля вольфрама;
- организации надлежащих условий, в которых можно выделить металл от перерабатываемой массы;
- концентрации вещества в виде раствора или осадка;
- очистки получившегося в результате предыдущего этапа химического соединения;
- выделении чистого вольфрама.
Таким образом, чистое вещество из добытой руды, содержащей вольфрам, можно выделить несколькими способами.
- В результате обогащения вольфрамовой руды гравитацией, флотацией, магнитной или электрической сепарацией. В процессе этого образуется вольфрамовый концентрат, на 55-65% состоящий из ангидрида (трехокиси) вольфрама WO 3 . В концентратах данного металла ведется контроль за содержанием примесей, в качестве которых могут выступать фосфор, сера, мышьяк, олово, медь, сурьма и висмут.
- Как известно, трехокись вольфрама WO 3 является основным материалом для выделения металлического вольфрама или карбида вольфрама. Получение WO 3-- происходит в результате разложения концентратов, выщелачивания сплава или спека и др. В таком случае, на выходе образуется материал на 99,9% состоящий из WO 3 .
- Из ангидрида вольфрама WO 3 . Именно путем восстановления данного вещества водородом или углеродом получают вольфрамовый порошок. Применения второго компонента для восстановительной реакции применяют реже. Это связано с насыщением в процессе реакции WO 3 карбидами, в результате чего металл теряет свою прочность и его становится тяжелее обработать. Вольфрамовый порошок получают особыми способами, благодаря которым становится возможным проводить контроль его химического состава, размеров и формы зерен, а также гранулометрического состава. Так, фракцию частиц порошка можно увеличить путем быстрого нарастания температуры или низкой скоростью подачи водорода.
- Производство компактного вольфрама, который имеет вид штабиков или слитков и представляет собой заготовку для дальнейшего изготовления полуфабрикатов - проволоки, прутков, ленты и др.
Последний способ, в свою очередь, включает в себя два возможных варианта. Один из них связан с методами порошковой металлургии, а другой - с плавкой в электрических дуговых печах с расходуемым электродом.
Метод порошковой металлургии
В силу того, что благодаря данному способу можно равномернее распределить присадки, наделяющие вольфрам особыми его свойствами, он более популярен.
Он включает несколько этапов:
- Металлический порошок прессуется в штабики;
- Заготовки подвергаются спеканию при низких температурах (так называемое, предварительное спекание);
- Сваривание заготовок;
- Получение полуфабрикатов путем обработки заготовок. Реализация данного этапа осуществляется ковкой или механической обработкой (шлифовка, полировка). Стоит отметить, что механическая обработка вольфрама становится возможной только под воздействием высоких температур, в противном случае, его обработать невозможно.
При этом, порошок должен быть хорошо очищен с максимально допустимым процентным содержанием примесей до 0,05%.
Данный метод позволяет получить вольфрамовые штабики, имеющие квадратное сечение от 8х8 до 40х40 мм и длину в 280-650 мм. Стоит отметить, что в условиях комнатных температур они достаточно прочны, однако имеют повышенную хрупкость.
Плавка
Данный способ применяется, если необходимо получить вольфрамовые заготовки достаточно крупных габаритов - от 200 кг до 3000 кг. Такие заготовки, как правило, необходимы для проката, вытяжки труб, изготовления изделий путем литья. Для плавки необходимо создание специальных условий - вакуум или разреженная атмосфера водорода. На выходе образуются слитки вольфрама, обладающие крупнокристаллической структурой, а также высокой хрупкостью в связи с наличием большого количества примесей. Содержание примесей можно снизить за счет предварительной плавки вольфрама в электронно-лучевой печи. Однако, структура при этом остается неизменной. В связи с чем, для уменьшения размера зерна происходит дальнейшая плавка слитков, но уже в электрической дуговой печи. При этом, в процессе плавки к слиткам добавляются легирующие вещества, наделяющие вольфрам особыми свойствами.
Чтобы получить вольфрамовые слитки, имеющие мелкозернистую структуру, используют дуговую гарниссажную плавку с разливкой металла в изложницу.
Способ получения металла определяет наличие в нем присадок и примесей. Таким образом, сегодня производится несколько марок вольфрама.
Марки вольфрама
- ВЧ - чистый вольфрам, в котором отсутствуют какие-либо присадки;
- ВА - металл, имеющий в своем составе алюминиевую и кремнещелоную присадку, которые наделяют его дополнительными свойствами;
- ВМ - металл, имеющий в своем составе ториевую и кремнещелочную присадку;
- ВТ - вольфрам, в составе которого содержится оксид тория в качестве присадки, что существенно повышает эмиссионные свойства металла;
- ВИ - металл, содержащий оксид иттрия;
- ВЛ - вольфрам с окисью лантана, что также повышает эмиссионные свойства;
- ВР - сплав рения и вольфрама;
- ВРН - какие-либо присадки в металле отсутствуют, однако могут присутствовать примеси в больших объемах;
- МВ - сплав вольфрама с молибденом, что существенно повышает прочность после отжига, сохраняя при этом пластичность.
Где применяется вольфрам?
Благодаря своим уникальным свойствам, 74 химический элемент стал незаменимым во многих промышленных отраслях.
- Основное применение вольфрама - в качестве основы для производства тугоплавких материалов в металлургии.
- С обязательным участием вольфрама производятся нити накаливания, являющиеся главным элементом приборов освещения, кинескопов, а также иных вакуумных труб.
- Также данный металл лежит в основе производства тяжелых сплавов, используемых в качестве противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий.
- Вольфрам является электродами при аргонно-дуговой сварке;
- Его сплавы отличаются высокой устойчивостью к воздействиям различных температур, кислой среде, а также твердостью и устойчивостью к истиранию, в связи с чем применяются при производстве хирургических инструментов, брони танков, торпедных и снарядных оболочек, деталей самолетов и двигателей, а также контейнеров для хранения ядерных отходов;
- Вакуумные печи сопротивления, температура в которых достигает предельно высоких величин, оборудованы нагревательными элементами, произведенными также из вольфрама;
- Использование вольфрама популярно для обеспечения защиты от ионизирующего излучения.
- Соединения вольфрама используются в качестве легирующих элементов, высокотемпературных смазок, катализаторов, пигментов, а также для преобразования тепловой энергии в электрическую (дителлурид вольфрама).
Введение
Значение редких элементов в науке и технике увеличивается с каждым годом, причем все больше стирается граница между редкими и нередкими элементами. Современному химику-аналитику все чаще и чаще приходится иметь дело с определениями вольфрама, молибдена, ванадия, титана, циркония и других редких элементов.
Анализ смеси всех элементов представляет собой исключительно редкий случай.
Многие комбинации редких и нередких элементов, встречающиеся в минералах, настолько сложны, что для выполнения анализа требуется большой опыт и знания в области химии редких элементов.
Для разделения элементов на группы или для выделения какого-либо одного элемента используются не только реакции осаждения, но также и другие способы, как, например: экстрагирование соединений органическими растворителями, дистилляция летучих соединений, электролиз и т.п.
Ввиду трудности разделения и определения некоторых редких элементов химическими методами эти определения производят физическими методами (спектральным, люминесцентным и др.).
При обнаружении весьма малых количеств рассеянных редких элементов применяют химические способы обогащения, основанные на соосаждении определяемого элемента с другим специально подобранным элементом - «носителем». Элементы-носители подбираются таким образом, чтобы не мешать дальнейшему ходу анализа.
Одним из наиболее важных редких элементов является вольфрам. В данной работе мы хотим рассмотреть некоторые вопросы, связанные с качественным обнаружением вольфрама.
История открытия вольфрама
Слово «вольфрам» существовало задолго до открытия этого металла. Ещё немецкий врач и металлург Георгиус Агрикола (1494-1555) называл вольфрамом некоторые металлы. Слово «вольфрам» имело много оттенков значения; оно, в частности, означало и «волчью слюну» и «волчью пену», т.е. пену у пасти разъяренного волка. Металлурги XIV-XVI веков заметили, что при выплавке олова примесь какого-то минерала вызывает значительные потери металла, переводя его «в пену» - в шлак. Вредной примесью был минерал вольфрамит (Mn, Fe)WO4, похожий внешне на оловянную руду - касситерит (SnO2). Средневековые металлурги называли вольфрамит «вольфрамом» и говорили, что «он похищает и пожирает олово, как волк овцу».
Впервые вольфрам получили испанские химики братья де Элуяр в 1783г. Ещё раньше - в 1781г. - шведский химик Шееле выделил триоксид вольфрама WO3 из минерала составом CaWO4, в последствии получившего название «шеелит». Поэтому вольфрам долгое время называли шеелием.
В Англии, Франции и США вольфрам именуют иначе - тунгстен, что означает в переводе со шведского «тяжелый камень». В России в XIX веке вольфрам называли «волчец».
Положение в периодической системе химических элементов
Вольфрам - элемент VI группы периодической системы химических элементов, его порядковый номер 74, атомная масса 183,85.
Природный вольфрам состоит из смеси стабильных изотопов с массами:
Для вольфрама также известны радиоактивные изотопы с массами от 174 до 188.
Физико-химические свойства вольфрама и его применение
вольфрам химический качественный обнаружение
Чистый металлический вольфрам - металл серебристо-белого цвета, по внешнему виду похож на сталь, кристаллическая решетка объемноцентрированная кубическая; в порошкообразном состоянии - темно-серого цвета.
Физические константы вольфрама:
Температура плавления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3380-3430oC
Температура кипения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .5900oC
Плотность (при 20 oC) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19,3 г/см3
Удельная теплоемкость (при 20 oC) . . . . . . . . . . . . . . . . . .0,032 кал/г* oC
Теплота плавления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .44 кал/г
Теплота испарения. . . . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . . .1,83 кал/г
Упругость паров вольфрама указана в Таблице 1 (см. Приложение).
Вольфрам имеет самую высокую температуру плавления и самое низкое давление пара среди металлов. Вольфрамовая проволока имеет самый высокий предел прочности при растяжении и предел текучести до 420кГ/мм2.
Сегодня вольфрам находит широкое применение в науке и технике. Его используют для легирования стали, как основу сверхтвердых сплавов, как компонент жаропрочных сплавов для авиационной и ракетной техники, для изготовления катодов электровакуумных приборов и нитей ламп накаливания. Вольфрамовые сплавы обладают высокой жаропрочностью (при 16500С предел прочности ув 175-253 МПа), однако хрупки и выше 6000С интенсивно окисляются на воздухе (без защитного покрытия могут использоваться только в вакууме и восстановительной или нейтральной атмосфере). Хорошо поглощают ионизирующее излечение. Применяются для изготовления нагревательных элементов, тепловых экранов, контейнеров для хранения радиоактивных препаратов, термоэмиттеров, электродов термопар, используемых для измерения температур до 25000С (сплавы с рением).
Химические свойства
Вольфрам - один из наиболее коррозийноустойчивых металлов. При обычной температуре устойчив к действию воды и воздуха, при температуре 400-500 oC заметно окисляется, при более высокой температуре окисляется интенсивно, образуя триоксид вольфрама желтого цвета. С водородом не взаимодействует даже при очень высоких температурах, с азотом взаимодействует при температуре свыше 2000 oC, образуя нитрид WN2. Твердый углерод при 1100-1200 oC реагирует с вольфрамом, образуя карбиды WC и W2C. На холоду серная, соляная, азотная, фтороводородная кислоты и царская водка на вольфрам не действуют. При температуре 100 oC вольфрам не взаимодействует с фтороводородной кислотой, слабо взаимодействует с соляной и серной кислотами, быстрее взаимодействует с азотной кислотой и царской водкой. Быстро растворяется в смеси фтороводородной и азотной кислот. Растворы щелочей на холоду не действуют на вольфрам; расплавленные щелочи при доступе воздуха или в присутствии окислителей (таких как: нитраты, хлораты, диоксид свинца) интенсивно растворяют вольфрам, образуя соли.
Распределение электронов в атоме вольфрама: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d4 6s2. Потенциалы ионизации вольфрама: I1=7.98эВ; I2=17.7эВ. Радиус атома rme=1,40Ao.
Ионные радиусы:
В соединениях вольфрам проявляет степени окисления +2, +3, +4, +5, +6. В высших степенях окисления вольфрам обладает кислотными свойствами, в низших - основными. Соединения со степенью окисления +2, +3 неустойчивы. Двухвалентный вольфрам известен лишь в виде галогенидов. Из соединений вольфрама(IV) выделены в твердом виде устойчивые комплексные цианиды. Наибольшее практическое значение в анализе имеют соединения вольфрама(V) и (VI).
Поведение вольфрама в растворах сложно, особенно в кислых, из-за отсутствия простых соединений. Существенное значение в аналитической химии вольфрама имеет его большая склонность к комплексообразованию. Вследствие того, что в комплексных соединениях индивидуальные свойства отдельных элементов проявляются ярче, чем в простых, комплексообразование вольфрама широко используют в определении в присутствии близких по свойствам элементов.
Соединения вольфрама(II) и (III) являются сильными восстановителями, окислительная способность соединений вольфрама(V) проявляется слабо.
Термодинамические данные для вольфрама и его соединений указаны в Таблице 2 (см. Приложение)
До 40-х годов XX века аналитическая химия вольфрама развивалась попутно с аналитической химией молибдена, причем для первого были характерны гравиметрические методы определения. В последние годы успешно исследовалась химия координационных соединений вольфрама, некоторые из которых успешно используются в аналитической химии для определения вольфрама физическими и физико-химическими методами.
Близость свойств вольфрама и молибдена объясняет трудность их разделения и определения при взаимном присутствии. Однако различие в распределении валентных электронов, явление лантаноидного сжатия, испытываемое электронной оболочкой вольфрама, приводят к различию некоторых химических свойств этих элементов. Например, склонность водных растворов вольфрама(VI) к полимеризации и к гидролизу в присутствии минеральных кислот сильнее, чем у молибдена(VI). Вольфрам труднее восстанавливается до определенных низших степеней окисления, стабилизация которых, в отличии от молибдена, сложна и не всегда успешна.
Качественное обнаружение вольфрама
Химия вольфрама чрезвычайно сложна. Обладая переменной степенью окисления, этот элемент образует большое число соединений. Здесь будут рассмотрены свойства только тех соединений вольфрама, которые он образует при растворении его сплавов в кислотах. Так как для растворения этих сплавов используется концентрированная азотная кислота в смеси с 2н. серной кислотой или царская водка, вольфрам переходит в свою высшую степень окисления +6. Поэтому мы остановимся на свойствах соединений вольфрама(VI).
Частные реакции иона WO42-:
1. Кислоты. При действии на растворы вольфраматов концентрированными минеральными кислотами, например соляной, выпадает белый осадок вольфрамовой кислоты:
WO42-+2H++H2O = WO3*2 H2O.
При кипячении WO3*2 H2O превращается в WO3* H2O желтого цвета. Вольфрамовая кислота нерастворима в концентрированных кислотах (отличие от MoO3* H2O). Реакция ее образования применяется для отделения WO42- от других ионов.
2. Сероводород H2S в кислом растворе не осаждает WO42-.
3. Сульфид аммония (NH4)2S образует с вольфраматами растворимые в воде тиосоли, например:
WO42- + 8NH4+ +4S2-+ 4 H2O = WS42- + 8NH4OH.
При подкислении тиосоль разлагается с образованием светло-бурого осадка WS3.
4. Восстановление WO42-. На раствор вольфрамата, подкисленный соляной или серной кислотой, действуют металлическим цинком. Образовавшийся сначала осадок вольфрамовой кислоты при этом синеет вследствие образования продуктов переменного состава, содержащих соединения вольфрама(VI) и (V):
Zn + 2WO42-+6Н+ = W2O5+Zn2++3H2O.
То же соединение получается при замене цинка раствором хлорида олова(II).
При сероводородном методе анализа вольфрам относят к подгруппе мышьяка; однако он не образует сульфида при действии сероводорода в кислой среде, а образует его лишь при действии сульфидов аммония и щелочных металлов или сероводорода в щелочной среде; растворяется в избытке сульфида с образованием тиосоли:
Na2WO4 + 4 (NH4)2S + 4 H2O = Na2WS4 + 8 NH4OH.
При подкислении растворов тиосолей выпадает светло-бурый сульфид вольфрама:
Na2WS4 + 2 HCl = 2 NaCl + H2S + WS3,
растворяющийся в избытке соляной кислоты. Но ион WO42- осаждается при действии соляной кислоты в виде малорастворимой вольфрамовой кислоты вместе с группой серебра (Ag+, Hg22+,Tl(I),Pb2+) и, таким образом, отделяется от большинства катионов.
В бессероводородной схеме анализа вольфрам также предложено выделять в форме вольфрамовой кислоты действием соляной кислоты; вместе с ним осаждаются в форме хлоридов ионы: Ag+,Hg22+,Tl (I),Pb2+. Систематический ход анализа катионов в присутствии вольфрама указан в Таблице 3 (см. Приложение).
Качественный анализ вольфрама очень слабо разработан. В основном используют осаждение малорастворимой вольфрамовой кислоты при действии на вольфраматы минеральных кислот; вместе с вольфрамовой в этих условиях осаждается кремниевая кислота. От последней вольфрам отделяют обработкой осадка аммиаком, а затем обнаруживают в фильтрате. Из неорганических реагентов чаще всего используют роданиды щелочных металлов и аммония в присутствии восстановителей титана(III) и олова(II), из органических - толуол-3,4-дитиол. Вероятно, для обнаружения можно использовать реагенты, рекомендованные для фотометрического определения вольфрама: они чувствительны и достаточно надежны, особенно после отделения вольфрама, например, кислым гидролизом. Реагенты, рекомендованные для гравиметрического определения вольфрама, мало пригодны для его обнаружения, так как образуют нехарактерные осадки с вольфрамом.
Коренман предложил обнаруживать вольфрам при помощи хлорида аммония: бесцветные кристаллы вольфрамата аммония имеют форму ромбов и палочек. Чувствительность 0,15мкг вольфрама в капле раствора, предельное разбавление 1:4*104. Обнаружению не мешают хлориды, сульфаты, стократные количества молибдатов и тридцатикратные - ванадатов.
Роданидный метод позволяет обнаружить капельным методом 0,05-1% триоксида вольфрама WO3 в рудах и?10-4% вольфрама в горных породах.
Капельное обнаружение вольфрама в рудах. Обнаружению 0,05-1% триоксида вольфрама не мешают по 10% молибдена и ванадия; 5% хрома; по 2% мышьяка и сурьмы, однако ванадий и хром рекомендуется отделять.
Около 5мг образца, растертого до пудры, сплавляют с? 20мг гидроксида натрия, к расплаву прибавляют около 3мг пероксида натрия и вновь сплавляют. Желтая окраска плава указывает на присутствие хрома. К плаву прибавляют несколько капель воды, нагревают, переносят в фарфоровый тигель и подкисляют соляной кислотой. Раствор выпаривают на водяной бане почти досуха, остаток смачивают соляной кислотой, разбавляют водой, отфильтровывают. Осадок на фильтре обрабатывают горячим раствором аммиака (1:1), промывают горячей водой, фильтрат и промывные воды объединяют и прибавляют одну каплю раствора реагента (30г роданида калия в 100 мл воды), выпаривают до небольшого объема, вводят 1-2 капли концентрированной соляной кислоты, 1 каплю 10% раствора хлорида олова(II) и 1 каплю 0,5% раствора хлорида титана(III) в соляной кислоте (1:1). В присутствии вольфрама появляется желтое окрашивание.
Обнаружение вольфрама в рудах и горных породах. Обнаружению?1 10-4% вольфрама мешают молибден, селен, теллур, большие количества железа, ванадия, хрома, диоксида кремния. Сульфидные образцы обжигают и дополнительно измельчают после обжига.
0,5г тонкоизмельченного вещества обрабатывают 30 минут в пробирке или микростаканчике 2 мл соляной кислоты при нагревании на водяной бане. Если присутствует мышьяк, его удаляют действием гидразина в присутствии бромида калия, упаривая жидкость после введения реагентов до половины первоначального объема. Остаток растворяют в двух объемах воды, фильтруют раствор через ватный тампон и промывают 1-2мл воды. Фильтрат и промывные воды упаривают досуха, растворяют в 1-2 каплях воды, вводят по каплям 25% раствор гидроксида калия до полного осаждения гидроксида железа, вводят 3 капли насыщенного раствора роданида аммония, перемешивают, прибавляют 40% раствор хлорида олова(II) до исчезновения красного окрашивания. В присутствии вольфрама появляется желтовато-зеленое окрашивание.
Для повышения чувствительности обнаружения вольфрама до 0,01 мкг рекомендовано выполнять реакцию на зернах анионита. Обнаружению не мешают 100-1000 мкг La, Ce(IV), Zr, Th, Mn, Fe, Ni, Zn, Cd, Al, Ga, In, Ge, Sn (IV), Pb, Sb (III), Bi, F-, Br-,I-, NO3-,SO32-, SO42-, HPO42-, B4O72-,HCOO-, C2O42-, цитрата и тартрата. Мешают Pd, Pt, Ag, Au, Hg, As, Se, Te.
В присутствии молибдена раствор подкисляют серной кислотой до концентрации 1-2М, дважды экстрагируют молибден смесью равных объемов ацетилацетона и хлороформа, водный слой фильтруют, упаривают до небольшого объема, вводят азотную кислоту для разрушения органических веществ и прибавляют гидроксид натрия до концентрации 0,01М. Раствор помещают на белую кафельную пластинку, прибавляют несколько зерен анионита дауэкс-1-х-1 или 1-х-2, через несколько минут вводят по 1 капле 10% раствора хлорида олова(II) в концентрированной соляной кислоте и 3% раствора роданида аммония. В присутствии вольфрама зерно окрашивается в зеленоватый цвет. Зерно рекомендуется рассматривать под микроскопом при освещении флуоресцентной лампы.
Капельное обнаружение вольфрама в стали. Кульберг предлагает реакцию, основанную на способности пероксовольфрамовой кислоты, образующейся при действии перекиси водорода на вольфрамовую кислоту, окрашивать уксуснокислый раствор бензидина в оранжево-красно-коричневй цвет. Получающееся соединение устойчиво к действию пероксида водорода.
На зачищенную поверхность стали помещают каплю кислотной смеси (1 часть 30% серной кислоты и 1 часть концентрированной азотной кислоты). Через 2-3 минуты прибавляют большой избыток пероксида натрия, перемешивают и по каплям вводят 10% раствор аммиака до прекращения кипения. Часть осадка захватывают кусочком фильтровальной бумаги, помещают на него 2-3 капли свежеприготовленного 1% раствора бензидина в ледяной уксусной кислоте. В присутствии вольфрама возникает оранжево-красно-коричневое окрашивание.
В сталях вольфрам можно обнаруживать дитиолом; не мешают молибден, цирконий, медь и другие компоненты стали.
Навеску стали 0,5-0,6г растворяют в 10 мл 6М соляной кислоты. Часть раствора нагревают с хлоридом олова(II) для восстановления молибдена(VI) до молибдена(III) и прибавляют метанольный раствор дитиола. В присутствии вольфрама возникает голубовато-зеленое окрашивание.
При использовании родамина С чувствительность обнаружения вольфрама составляет 0,001-0,0005мг в 1 капле раствора. Рекомендуется выделить вольфрамовую кислоту H2WO4, затем растворить ее в гидроксиде натрия и обнаружить вольфрам в слабокислой среде. Обнаружению без отделения вольфрама мешают многие ионы, в том числе анионы I-, Br-, SCN-, Cr2O72-, S2O82-, MnO4-, ClO4-, S2O32-.
Родамин С рекомендовано применять для обнаружения вольфрама на бумажных хроматограммах; для этого их опрыскивают 0,025% раствором родамина С в 1М серной кислоте и 20% раствором бромида калия. Присутствие вольфрама можно идентифицировать по окраске или люминесценции пятна.
Под действием катодных или ультрафиолетовых лучей шеелит интенсивно люминесцирует голубым светом.
Имеющий светло-серый цвет. В периодической системе Менделеева ему принадлежит 74 порядковый номер. Химический элемент является тугоплавким. В своем составе он содержит 5 стабильных изотопов.
Химические свойства вольфрама
Химическая стойкость вольфрама на воздухе и в воде достаточно высока. При нагревании подвержен окислению. Чем больше температура, тем выше скорость окисления химического элемента. При температуре, превышающей 1000°С, вольфрам начинает испаряться. При комнатной температуре , соляная, серная, плавиковая и азотная кислоты не могут оказывать на вольфрам никакого действия. Смесь азотной и плавиковой кислот растворяют вольфрам. Ни в жидком, ни в твердом состоянии вольфрам не смешивается с золотом, серебром, натрием, литием. Также не происходит взаимодействия с цинком, магнием, кальцием, ртутью. Вольфрам растворим в тантале и ниобии, а с хромом и молибденом может образовывать растворы как в твердом, так и в жидком состоянии.
Применение вольфрама
Применяют вольфрам в современной промышленности как в чистом виде, так и в сплавах. Вольфрам относится к износоустойчивым металлам. Часто сплавы, имеющих в составе вольфрам, применяют для изготовления лопастей турбин и клапанов авиадвигателей. Также этот химический элемент нашел свое применение для изготовления различных деталей в рентгенотехнике и радиоэлектронике. Вольфрам используют для нитей электроламп.
Химические соединения вольфрама в последнее время нашли свое практическое применение. Гетерополикислота фосфорно-вольфрамовая используется при производстве ярких красок и лаков, устойчивых на свету. Для изготовления светящихся красок и изготовлении лазеров применяются вольфраматы редкоземельных элементов, щелочноземельных металлов и кадмия.
Сегодня традиционные обручальные кольца из золота стали заменять изделиями из других металлов. Популярность приобрели кольца обручальные из карбида вольфрама. Такие изделия отличаются высокой прочностью. Зеркальная полировка кольца со временем не тускнеет. Изделие сохранит свое первоначальное состояние на весь срок использования.
Вольфрам используют в виде легирующей добавки для стали. Это придает стали прочность и твердость при высокой температуре. Таким образом, инструменты, изготовленные из вольфрамовой стали, обладают способностью выдерживать весьма интенсивные процессы металлообработки.
Вольфрам - это химический элемент периодической системы Менделеева, который принадлежит к VI группе. В природе вольфрам встречается в виде смеси из пяти изотопов. В своем обычном виде и при обычных условиях он представляет собой твердый металл серебристо-серого цвета. Он также является самым тугоплавким из всех металлов.
Основные свойства вольфрама
Вольфрам - это металл, обладающий замечательными физическими и химическими свойствами. Практически во всех отраслях современного производства применяется вольфрам. Формула его обычно выражается в виде обозначения оксида металла - WO 3 . Вольфрам считается самым тугоплавким из металлов. Предполагается, что лишь сиборгий может быть еще более тугоплавок. Но точно пока этого утверждать нельзя, так как сиборгий имеет очень малое время существования.
Этот металл имеет особые физические и химические свойства. Вольфрам имеет плотность 19300 кг/м 3 , температура плавления его составляет 3410 °С. По этому параметру он занимает второе место после углерода - графита или алмаза. В природе вольфрам встречается в виде пяти стабильных изотопов. Их массовые числа находятся в интервале от 180 до 186. Вольфрам обладает 6-й валентностью, а в соединениях она может составлять 0, 2, 3, 4 и 5. Металл также имеет достаточно высокий уровень теплопроводности. Для вольфрама этот показатель составляет 163 Вт/(м*град). По этому свойству он превышает даже такие соединения, как сплавы алюминия. Масса вольфрама обусловлена его плотностью, которая равна 19кг/м 3 . Степень окисления вольфрама колеблется от +2 до +6. В высших степенях своего окисления металл имеет кислотные свойства, а в низших - основные.
При этом сплавы низших соединений вольфрама считаются неустойчивыми. Самыми стойкими являются соединения со степенью +6. Они проявляют и наиболее характерные для металла химические свойства. Вольфрам имеет свойство легко образовывать комплексы. Но металлический вольфрам обычно является очень стойким. Он начинает взаимодействовать с кислородом лишь при температуре +400 °С. Кристаллическая решетка вольфрама относится к типу кубических объемноцентрированных.
Взаимодействие с другими химическими веществами
Если вольфрам смешать с сухим фтором, то можно получить соединение под названием "гексафторид", который плавится уже при температуре 2,5 °С, а закипает при 19,5 °С. Похожее вещество получают при соединении вольфрама с хлором. Но для такой реакции необходима достаточно высокая температура - порядка 600 °С. Однако вещество легко противостоит разрушительному действию воды и практически не подвергается изменениям на холоде. Вольфрам - металл, который без кислорода не производит реакции растворения в щелочах. Однако он легко растворяется в смеси HNO 3 и HF. Самые главные из химических соединений вольфрама - это его трехокись WO 3 , Н 2 WO 4 - вольфрамовая кислота, а также ее производные - соли вольфраматы.

Можно рассмотреть некоторые химические свойства вольфрама с уравнениями реакций. Например, формула WO 3 + 3H 2 = W+3H 2 O. В ней металл вольфрам восстанавливается из оксида, проявляется его свойство взаимодействия с водородом. Это уравнение отражает процесс получения вольфрама из его триоксида. Следующей формулой обозначается такое свойство, как практическая нерастворимость вольфрама в кислотах: W + 2HNO3 + 6HF = WF6 + 2NO + 4H2O. Одним из наиболее примечательных веществ, содержащих вольфрам, считается карбонил. Из него получают плотные и ультратонкие покрытия из чистого вольфрама.
История открытия
Вольфрам - металл, получивший свое название из латинского языка. В переводе это слово означает «волчья пена». Такое необычное название появилось из-за поведения металла. Сопровождая добытую оловянную руду, вольфрам мешал выделению олова. Из-за него в процессе выплавки образовывались только шлаки. Об этом металле говорили, что он «поедает олово, как волк ест овцу». Для многих интересно, кто открыл химический элемент вольфрам?
Это научное открытие было сделано одновременно в двух местах разными учеными, независимо друг от друга. В 1781 году химик из Швеции Шееле получил так называемый «тяжелый камень», проводя опыты с азотной кислотой и шеелитом. В 1783 году братья-химики из Испании по фамилии Элюар также сообщил об открытии нового элемента. Точнее, ими был открыт оксид вольфрама, растворявшийся в аммиаке.
Сплавы с другими металлами
В настоящее время различают однофазные и многофазные вольфрамовые сплавы. Они содержат один или несколько посторонних элементов. Самое известное соединение - это сплав вольфрама и молибдена. Добавление молибдена придает вольфраму прочность при его растяжении. Также к категории однофазных сплавов принадлежат соединения вольфрама с титаном, гафнием, цирконием. Самую большую пластичность вольфраму придает рений. Однако практически применять такой сплав - довольно трудоемкий процесс, так как рений очень тяжело добыть.

Так как вольфрам является одним из самых тугоплавких материалов, то получать вольфрамовые сплавы - непростая задача. Когда этот металл только начинает закипать, другие уже переходят в жидкость или состояние газа. Но современные ученые умеют получать сплавы при помощи процесса электролиза. Сплавы, содержащие вольфрам, никель и кобальт, используются для нанесения защитного слоя на непрочные материалы.
В современной металлургической промышленности также получают сплавы, используя вольфрамовый порошок. Для его создания необходимы особенные условия, включая создание вакуумной обстановки. Из-за некоторых особенностей взаимодействия вольфрама с другими элементами металлурги предпочитают создавать сплавы не двухфазной характеристики, а с применением 3, 4 и более составляющих. Эти сплавы особенно прочны, но при четком соблюдении формул. При малейших отклонениях процентных составляющих сплав может получиться хрупким и непригодным к использованию.
Вольфрам - элемент, применяющийся в технике
Из этого металла изготавливают нити накаливания обыкновенных лампочек. А также трубки для рентгеновских аппаратов, составляющие вакуумных печей, которые должны использоваться при крайне высоких температурах. Сталь, в состав которой входит вольфрам, имеет очень высокий уровень прочности. Такие сплавы используются для изготовления инструментов в самых различных областях: для бурения скважин, в медицине, машиностроении.

Главное преимущество соединения стали и вольфрама - износоустойчивость, маловероятность повреждений. Самый известный в строительстве вольфрамовый сплав носит название «победит». Также этот элемент широко используется в химической промышленности. С его добавлением создают краски, пигменты. Особенно широкое применение в этой сфере получил оксид вольфрама 6. Его применяют для изготовления карбидов и галогенидов вольфрама. Другое название этого вещества - триоксид вольфрама. 6 используется как желтый пигмент в красках для керамики и изделий из стекла.
Что такое тяжелые сплавы?
Все сплавы на основе вольфрама, которые обладают высоким показателем плотности, называют тяжелыми. Их получают только при помощи методов порошковой металлургии. Вольфрам всегда является основой тяжелых сплавов, где его содержание может составлять до 98 %. Кроме этого металла, в тяжелые сплавы добавляется никель, медь и железо. Однако в них могут входить и хром, серебро, кобальт, молибден. Самую большую популярность получили сплавы ВМЖ (вольфрам - никель - железо) и ВНМ (вольфрам - никель - медь). Высокий уровень плотности таких сплавов позволяет им поглощать опасное гамма-излучение. Из них изготавливают маховики колес, электрические контакты, роторы для гироскопов.
Карбид вольфрама
Около половины всего вольфрама применяется для изготовления прочных металлов, особенно вольфрамового карбида, который имеет температуру плавления 2770 С. Карбид вольфрама представляет собой химическое соединение, в котором содержится равное количество атомов углерода и вольфрама. Этот сплав имеет особые химические свойства. Вольфрам придает ему такую прочность, что по этому показателю он превосходит сталь в два раза.

Карбид вольфрама широко используется в промышленности. Из него изготавливают режущие предметы, которые должны быть очень устойчивы к высоким температурам и истиранию. Также из этого элемента изготавливают:
- Детали самолетов, двигатели автомобилей.
- Детали для космических кораблей.
- Медицинские хирургические инструменты, которые применяются в сфере полостной хирургии. Такие инструменты дороже обычной медицинской стали, однако они более производительны.
- Ювелирные изделия, особенно обручальные кольца. Такая популярность вольфрама связана с его прочностью, которая для венчающихся символизирует прочность взаимоотношений, а также внешним видом. Характеристики вольфрама в отполированном виде таковы, что он в течение очень длительного времени сохраняет зеркальный, блестящий вид.
- Шарики для шариковых ручек класса люкс.
Победит - сплав вольфрама
Приблизительно во второй половине 1920-х годов во многих странах начали выпускаться сплавы для режущих инструментов, которые получали из карбидов вольфрама и металлического кобальта. В Германии такой сплав назывался видиа, в Штатах - карбола. В Советском Союзе такой сплав получил название «победит». Эти сплавы оказались прекрасными для обработки чугунной продукции. Победит является металлокерамическим сплавом с чрезвычайно высоким уровнем прочности. Он изготавливается в виде пластинок различных форм и размеров.

Процесс изготовления победита сводится к следующему: берется порошок карбида вольфрама, мелкий порошок никеля или кобальта, и все перемешивается и прессуется в специальных формах. Спрессованные таким образом пластины подвергаются дальнейшей температурной обработке. Это дает очень твердый сплав. Эти пластины используются не только для резки чугуна, но и для изготовления бурильных инструментов. Пластинки из победита напаиваются на бурильное оборудование при помощи меди.
Распространенность вольфрама в природе
Этот металл очень мало распространен в окружающей среде. После всех элементов он занимает 57-е место и содержится в виде кларка вольфрама. Также металл образует минералы - шеелит и вольфрамит. Вольфрам мигрирует в подземные воды либо в виде собственного иона, либо в виде всевозможных соединений. Но его наибольшая концентрация в подземных водах ничтожно мала. Она составляет сотые доли мг/л и практически не меняет их химические свойства. Вольфрам также может попадать в природные водоемы из стоков заводов и фабрик.
Влияние на человеческий организм
Вольфрам практически не поступает в организм с водой или пищей. Может существовать опасность вдыхания вольфрамовых частиц вместе с воздухом на производстве. Однако, несмотря на принадлежность к категории тяжелых металлов, вольфрам не токсичен. Отравления вольфрамом случаются лишь у тех, кто связан с вольфрамовым производством. При этом степень влияния металла на организм бывает разной. Например, вольфрамовый порошок, карбид вольфрама и такое вещество, как ангидрит вольфрамовой кислоты, могут вызывать поражение легких. Его главные симптомы - общее недомогание, лихорадка. Более сильные симптомы возникают при отравлении сплавами вольфрама. Это происходит при вдыхании пыли сплавов и приводит к бронхитам, пневмосклерозу.
Металлический вольфрам, попадая внутрь человеческого организма, не всасывается в кишечнике и постепенно выводится. Большую опасность могут представлять вольфрамовые соединения, относящиеся к растворимым. Они откладываются в селезенке, костях и коже. При длительном воздействии вольфрамовых соединений могут возникать такие симптомы, как ломкость ногтей, шелушение кожи, различного рода дерматиты.
Запасы вольфрама в различных странах
Самые большие ресурсы вольфрама находятся в России, Канаде и Китае. По прогнозам ученых, на отечественных территориях располагается около 943 тысяч тонн этого металла. Если верить этим оценкам, то подавляющая часть запасов расположена в Южной Сибири и на Дальнем Востоке. Очень незначительной является доля разведанных ресурсов - она составляет всего лишь порядка 7 %.

По количеству разведанных залежей вольфрама Россия уступает лишь Китаю. Большая их часть расположена в районах Кабардино-Балкарии и Бурятии. Но в этих месторождениях добывается не чистый вольфрам, а его руды, содержащие также молибден, золото, висмут, теллур, скандий и другие вещества. Две трети получаемых объемов вольфрама из разведанных источников заключены в труднообогатимых рудах, где главным вольфрамосодержащим минералом является шеелит. На долю легкообогатимых руд приходится всего лишь треть всей добычи. Характеристики вольфрама, добываемого на территории России, ниже, чем за рубежом. Руды содержат большой процент триоксида вольфрама. В России очень мало россыпных месторождений металла. Вольфрамовые пески также являются низкокачественными, с большим количеством оксидов.
Вольфрам в экономике
Глобальное производство вольфрама начало свой рост примерно с 2009 года, когда стала восстанавливаться азиатская промышленность. Крупнейшим производителем вольфрама остается Китай. Например, в 2013 году на долю производства этой страны приходился 81 % от мирового предложения. Около 12 % спроса на вольфрам связано с производством осветительных приборов. По прогнозам экспертов, использование вольфрама в этой сфере будет сокращаться на фоне применения светодиодных и люминесцентных ламп как в бытовых условиях, так и на производстве.
Считается, что будет расти спрос на вольфрам в сфере производства электронной техники. Высокая износостойкость вольфрама и его способность выдерживать электричество делают этот металл наиболее подходящим для производства регуляторов напряжения. Однако по объему этот спрос пока остается довольно незначительным, и считается, что к 2018 году он вырастет лишь на 2 %. Однако согласно прогнозам ученых, в ближайшее время должен произойти рост спроса на цементированный карбид. Это связано с ростом автомобильного производства в США, Китае, Европе, а также увеличением горнодобывающей промышленности. Считается, что к 2018 году спрос на вольфрам увеличится на 3,6 %.
История открытия вольфрама
Слово «вольфрам» существовало задолго до открытия этого металла. Ещё немецкий врач и металлург Георгиус Агрикола (1494-1555) называл вольфрамом некоторые металлы. Слово «вольфрам» имело много оттенков значения; оно, в частности, означало и «волчью слюну» и «волчью пену», т.е. пену у пасти разъяренного волка. Металлурги XIV-XVI веков заметили, что при выплавке олова примесь какого-то минерала вызывает значительные потери металла, переводя его «в пену» - в шлак. Вредной примесью был минерал вольфрамит (Mn, Fe)WO4, похожий внешне на оловянную руду - касситерит (SnO2). Средневековые металлурги называли вольфрамит «вольфрамом» и говорили, что «он похищает и пожирает олово, как волк овцу».
Впервые вольфрам получили испанские химики братья де Элуяр в 1783г. Ещё раньше - в 1781г. - шведский химик Шееле выделил триоксид вольфрама WO3 из минерала составом CaWO4, в последствии получившего название «шеелит». Поэтому вольфрам долгое время называли шеелием.
В Англии, Франции и США вольфрам именуют иначе - тунгстен, что означает в переводе со шведского «тяжелый камень». В России в XIX веке вольфрам называли «волчец».
Азот и его соединения
Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения ("удушливый воздух") и в отличие от CO2не поглощаемый раствором щелочи. Вскоре французский химик А.Л...
Аурум и его соединения
Золото (англ. Gold, франц. Оr, нем. Gold) - один из семи металлов древности. Обычно считают, что золото было первым металлом, с которым познакомился человек еще в эпоху каменного века благодаря его распространению в самородном состоянии...
Капельный анализ
Капельный метод анализа начал использоваться довольно давно. Трудно установить, кто первый использовал капельные реакции для аналитических целей. По-видимому, наиболее ранний пример был опубликован Ф...
Магнийорганические соединения
К магнийорганическим относят химические соединения, в которых атом углерода непосредственно связан с атомом магния. Они представляют отдельный очень важный класс соединений магния...
Меланоидины как результат реакции Майяра
Химия богата именными реакциями, их более тысячи. Но большинство из них мало о чем скажут человеку, далекому от химии, они для тех, кто понимает. Однако в этом богатом перечне есть одна реакция...
Никель и его соединения
Уже с 17 в. рудокопам Саксонии (Германия) была известна руда, которая по внешнему виду напоминала медные руды, но меди при выплавке не давала. Ее называли купферникель (нем. Kupfer - медь, а Nickel - имя гнома...
Цинк является тем элементом, который человек знает и использует с древних времен. Наиболее распространенным минералом является карбонат цинка, или каламин. Как любой карбонат, каламин при нагревании, точнее прокаливании...
Получение фосфорнокислого цинка
В 1817 нем. химик Ф. Штромейер, при ревизии одной из аптек, обнаружил, что имевшийся там карбонат цинка содержит примесь неизвестного металла, который осаждается в виде жёлтого сульфида сероводородом из кислого раствора...
Получение фосфорнокислого цинка
Самородная ртуть была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась киноварь (природная HgS) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н.э.)...
Практическое применение и свойства неодима
В средние века алхимики выделили группу веществ, почти не растворяющихся в воде и кислотах (из растворов кислот не выделялось пузырьков газа), не изменявшихся при нагревании, не плавившихся и обладающих щелочным характером...
Применение хлорофилла
Возможность экстракции зеленых пигментов листьев спиртом была известна уже французскому ученому Ж. Сенебье в 1782-1800 гг. В 1817 г. французские химики П. Пельтье и Ж. Кванту назвали зеленый спиртовой раствор смеси растительных пигментов хлорофиллом...
Радон, его влияние на человека
После открытия радия, когда ученые с большим увлечением познавали тайны радиоактивности, было установлено, что твердые вещества, находившиеся в близком соседстве с солями радия, становились радиоактивными...
Фармацевтический анализ производных изохинолина (папаверина гидрохлорид)
Папаверин был открыт студентом-химиком Генрихом Мерком в 1848 г. Новое вещество немец выделил из опия -- млечного сока снотворного мака (лат. Papaver Somniferum). По химической структуре средство было причислено к классу алкалоидов. В 1910 г. А...
Фармацевтический анализ производных фурана (фурагин)
Первые сведения о синтетическом получении фурановых веществ появились ещё в начале XIX века, то есть на заре органической химии как самостоятельной науки. Однако только со второй половины XIX столетия...
Химия элементов: молибден
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен. Этот свинцово-серый с металлическим блеском минерал (другое название - молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом...