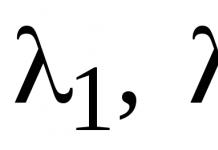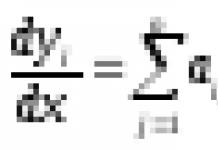(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление спиртов
При горении спиртов образуются двуокись углерода и вода: При действии обычных окислителей - хромовой смеси, пермангата калия окислению подвергается в первую очередь атом углерода, при котором находится гидроксильная группа. Первичные спирты дают при окислении альдегиды, которые легко переходят...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление этилового спирта до уксусной кислоты.
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий родов Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные. Уксуснокислые бактерии указанных родов различаются между собой по...(ОСНОВЫ МИКРОБИОЛОГИИ)
Каталитическое дегидрирование спиртов
Превращение спиртов в альдегиды и кетоны можно осуществить также дегидрированием - пропусканием паров спирта над нагретым катализатором - медью или серебром при 300 °С: Взаимодействие спиртов с магнийорганическими соединениями (реактивами Гриньяра) приводит к образованию предельных углеводородов: Эта...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Спирт и спиртосодержащая продукция
К подакцизным товарам относится только этиловый спирт (спирт-сырец и ректифицированный), независимо от вида сырья, из которого он произведен (пищевого или непищевого). Технический спирт (это не этиловый) не является акцизным товаром, его получают из древесины или нефтепродуктов. Для производства акцизного...(Налогообложение коммерческой деятельности)
(ОРГАНИЧЕСКАЯ ХИМИЯ)
Отщепление воды от спиртов (дегидратация):
В качестве катализаторов дегидратации используются кислые реагенты: серная и фосфорная кислоты, окись алюминия и т.п. Порядок отщепления чаще всего определяется правилом Зайцева (1875 г.): при образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизи- рованного атома углерода...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление спиртов
Спирты окисляются легче, чем углеводороды, причем в первую очередь окислению подвергается углерод, при котором находится гидроксильная группа. Наиболее подходящим окислителем в лабораторных условиях является хромовая смесь. В промышленности - кислород воздуха в присутствии катализаторов. Первичные ...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление этилового спирта до уксусной кислоты.
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий родов Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные. Уксуснокислые бактерии указанных родов различаются между собой по...(ОСНОВЫ МИКРОБИОЛОГИИ)
Каталитическое дегидрирование парафинов
Важным промышленным способом является также каталитическое дегидрирование парафинов над окисью хрома: Большинство лабораторных способов получения олефинов основано на реакциях отщепления (элиминирования) различных реагентов: воды, галогенов или галогеноводородов от соответствующих производных предельных...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Общепринятый механизм дегидратации спиртов следующий (для простоты в качестве примера взят этиловый спирт):
Спирт присоединяет ион водорода стадия (1) с образованием протонированного спирта, который диссоциирует стадия (2), давая молекулу воды и ион карбония; затем ион карбония стадия (3) теряет ион водорода и образуется алкен.
Таким образом, двойная связь образуется в две стадии: потеря гидроксильной группы в виде [стадия (2)] и потеря водорода (стадия (3)). В этом отличие этой реакции от реакции дегидрогалогенирования, где отщепление водорода и галогена происходит одновременно.
Первая стадия представляет кислотно-основное равновесие по Бренстеду - Лоури (разд. 1.19). При растворений серной кислоты в воде, например, происходит следующая реакция:

Ион водорода перешел от очень слабого основания к более сильному основанию с образованием иона оксония основные свойства обоих соединений обусловлены, конечно, неподеленной парой электронов, которая может связывать ион водорода. Спирт также содержит атом кислорода с неподеленной парой электронов и его основность сравнима с основностью воды. Первую стадию предложенного механизма можно наиболее вероятно представить следующим образом:

Ион водорода перешел от бисульфат-иона к более сильному основанию (этиловому спирту) с образованием замещенного иона оксония протонированного спирта.
Аналогично стадия (3) является не выталкиванием свободного иона водорода, а его переходом к наиболее сильному из имеющихся оснований, а именно к

Для удобства этот процесс часто изображают как присоединение или отщепление иона водорода но следует понимать, что во всех случаях на самом деле происходит перенос протона от одного основания к другому.
Все три реакции приведены как равновесные, поскольку каждая стадия обратима; как будет показано ниже, обратной реакцией является образование спиртов из алкенов (разд. 6.10). Равновесие (1) сдвинуто очень сильно вправо; известно, что серная кислота почти полностью ионизована в спиртовом растворе. Поскольку концентрация имеющихся в каждый момент карбониевых ионов очень мала, равновесие (2) сдвинуто сильно влево. В какой-то момент один из этих немногих карбониевых ионов реагирует по уравнению (3) с образованием алкена. При дегидратации, летучий алкен обычно отгоняется из реакционной смеси, и, таким образом, равновесие (3) сдвигается вправо. В результате вся реакция доходит до конца.
Карбониевый ион образуется в результате диссоциации протонированного спирта; при этом заряженная частица отделяется от
нейтральной частицы Очевидно, этот процесс требует значительно меньше энергии, чем образование карбониевого иона из самого спирта, поскольку в этом случае необходимо оторвать положительную частицу от отрицательной. В первом случае слабое основание (вода) отщепляется от иона карбония (кислоты Льюиса) значительно легче, чем очень сильное основание, гидроксил-ион, т. е. вода является лучшей уходящей группой, чем гидроксил-ион. Показано, что гидроксил-ион почти никогда не отщепляется от спирта; реакции расщепления связи в спирте почти во всех случаях требуют кислого катализатора, роль которого, как и в настоящем случае, заключается в протонировании спирта.

Наконец, следует понимать, что диссоциация протонированного спирта становится возможной только благодаря сольватации карбониевого иона (ср. разд. 5.14). Энергия для разрыва связи углерод - кислород берется за счет образования большого числа ион-дипольных связей между ионом карбония и полярным растворителем.
Карбониевый ион может вступать в различные реакции; какая из них происходит, зависит от экспериментальных условий. Все реакции карбониевых ионов завершаются одинаково: они приобретают пару электронов для заполнения октета у положительно заряженного атома углерода. В данном случае ион водорода отщепляется от атома углерода, соседнего с положительно заряженным обедненном электронами атомом углерода; пара электронов, прежде осуществлявшая связь с этим водородом, теперь может образовать -связь

Этот механизм объясняет кислотный катализ при дегидратации. Объясняет ли этот механизм также и тот факт, что легкость дегидратации спиртов уменьшается в ряду третичный вторичный первичный? Прежде чем ответить на этот вопрос, необходимо выяснить, как изменяется устойчивость карбониевых ионов.
Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. осуществляется на медном или серебряном катализаторе при температуре 200 - 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al 2 O 3 , SnO 2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.

2. может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 - 450 °С.


3. так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).

4. Дегидрирование метанола . Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 - 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.
Специальность: химическая технология
Кафедра: неорганической химии и химической технологии
УТВЕРЖДАЮ
Заведующий кафедрой
_____________________) (Подпись, Фамилия, инициалы)
"___"____________20 г.
КУРСОВАЯ РАБОТА
По дисциплине: Промышленный катализ
_______________________________
На тему: Каталитическое дегидрирование
________________________
Обозначение работы КР – 02068108 – 240100 - 2015
Студент Фазылова Л. А.
Логин 435
Руководитель _______________ Кузнецова И.В.
Воронеж– 2015 г.
Введение
Производство катализаторов для процессов дегидрирования алкилароматических углеводородов.
Каталитическое дегидрирование алканов
Оборудование для каталитического дегидрирования алканов
Регенерация катализаторов.
Список использованных литературных источников
Введение
Дегидри́рование - реакция отщепления водорода от молекулы органического соединения; является обратимой, обратная реакция - гидрирование. Смещению равновесия в сторону дегидрирования способствует повышение температуры и понижение давления, в том числе разбавление реакционной смеси. Катализаторами реакции гидрирование - дегидрирование являются металлы 8Б и 1Б подгрупп (никель, платина, палладий, медь, серебро) и полупроводниковые оксиды (Fe 2 O 3 , Cr 2 O 3 , ZnO, MoO 3).
Процессы дегидрирования широко используются в промышленном органическом синтезе:
1) дегидрированием спиртов получают: формальдегид, ацетон, метилэтилкетон, циклогексанон.
2) дегидрированием алкилароматических соединений получают: стирол, α-метилстирол, винилтолуол, дивинилбензол.
3) дегидрированием парафинов получают: олефины (пропилен, бутилен и изобутилен, изопентен, высшие олефины) и диены (бутадиен и изопрен)
Каталитическое дегидрирование спиртов
Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
Дегидрирование этанола осуществляется на медном или серебряном катализаторе при температуре 200 - 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al 2 O 3 , SnO 2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.

Дегидрирование метанола . Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 - 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.

2. Производство катализаторов для процессов дегидрирования спиртов
Известен катализатор для дегидрирования спиртов, содержащий окислы, 5 цинка и железа. Новейшим является катализатор для дегидрирования спиртов, представляющий собой окисел иттрия или редкоземельного 10 элемента, выбранного из группы, включащей неодим,праэеодим, иттербий..
Недостатком известных катализаторов является их недостаточно высокая активность и селективность.
Целью науки является повышение активности и селективности катализатора для дегидрирования спиртов. Указанная цель достигается тем,что катализатор на основе окислов иттрия или редкоземельного элемента, выбранного из группы, включающей неодим, празеодим, иттербий, дополнительно содержит технеций.
Введение в катализатор технеция позволяет повысить активность катали-затора, что выражается в увеличении степени превращения спирта в 2-5 раз и снижении температуры начала реакции о дегидрирования на 80-120 0 С. При этом катализатор приобретает чисто дегидрирующие свойства, что позволяет повысить селективность. В реакции дегидрирования спирта, например изопропилового в ацетон до 100%.
Такой катализатор получают пропитыванием раствором соли технеция предварительно сформованных частиц катализатора. Объем раствора превышает в 1,4 ─ 1,6 раза насыпной объем катализатора. Количество технеция в катализаторе определяется по удельной радиоактивности. Влажный катализатор сушат. Сухой продукт нагревают в течение 1 ч в токе водорода сначала при 280-300 0 С (для превращения пертехнетата в двуокись технеция), затем при 600-700 0 С в течение 11 ч (для восстановления двуокиси технеция до металла) .
Пример. Катализатор готовят путем пропитывания окиси иттрия раствором пертехнетата аммония, объем которого превышает в 1,5 раза объем окиси иттрия. Пропитанные частицы катализатора высушивают при 70-80 0 С в течение 2 ч. Затем проводят восстановление в токе водорода в течение 1 ч при 280 0 С при температуре 600 С.
Исследование каталитической активности проводят на примере разложения иэопропилового спирта в установке проточного типа. Вес катализатора
0,5 г при объеме 1 см. Размер частиц катализатора 1, 5 - 2 мм. Удельная поверхность 48,5 м /г. Скорость подачи спирта составляет 0,071 мл/мин.
Разложение изоаропилового спирта на предложенном катализаторе происхо- дит только в направлении дегидрирования с образованием ацетона и водорода, никаких других продуктов не обнаружено. На окиси иттрия без добавки технеция разложение изопропилового спирта идет в двух направ-лениях: дегидрование и дегидрация. Повышение активности катализатора тем больше, чем выше количество вводимого технеция. Катализаторы, содержащие 0,03 - 0,05% технеция, являются селективньми, ведущими процесс только в одном направлении в сторону дегидрирования.
3. Дегидрирование алкилароматических соединений
Дегидрирование алкилароматических соединений является важным промышленным процессом синтеза стирола и его гомологов. Катализаторами процесса в большинстве случаев являются промотированные оксидами калия, кальция, хрома, церия, магния, цинка оксиды железа. Их отличи-тельной особенностью является способность к саморегенерации под воздействием водяного пара. Так же известны фосфатные, меднохромовые и даже катализаторы на основе смеси оксида железа и меди.
Процессы дегидрирования алкилароматических соединений протекают при атмосферном давлении и при температуре 550 - 620 °С в мольном соотношении сырья к водяному пару 1:20. Пар необходим не только для снижения парциального давления этилбензола, но и для поддержания саморегенерации железооксидных катализаторов.
Дегидрирование этилбензола – вторая стадия процесса получения стирола из бензола. На первой стадии проводят алкилирование бензола хлорэтаном (реакция Фриделя-Крафтса) на алюмохромовом катализаторе, а на второй полученный этилбензол дегидрируется до стирола. Процесс характеризуется высоким значением энергии активации 152 кДж/моль, ввиду чего скорость реакции сильно зависит от температуры. Именно поэтому реакцию проводят при высоких температурах.

Параллельно в процессе дегидрирования этилбензола протекают побочные реакции – коксообразование, скелетная изомеризация и крекинг. Крекинг и изомеризация снижают селективность процесса, а коксообразование оказывает влияние на дезактивацию катализатора. Для того, чтобы катализатор работал дольше, необходимо периодически проводить окислительную регенерацию, в основе которой лежит реакция газификации, «выжигающая» большую часть кокса с поверхности катализатора.