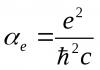(ОРГАНИЧЕСКАЯ ХИМИЯ)
Отщепление воды от спиртов (дегидратация):
В качестве катализаторов дегидратации используются кислые реагенты: серная и фосфорная кислоты, окись алюминия и т.п. Порядок отщепления чаще всего определяется правилом Зайцева (1875 г.): при образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизи- рованного атома углерода...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление спиртов
Спирты окисляются легче, чем углеводороды, причем в первую очередь окислению подвергается углерод, при котором находится гидроксильная группа. Наиболее подходящим окислителем в лабораторных условиях является хромовая смесь. В промышленности - кислород воздуха в присутствии катализаторов. Первичные ...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Окисление этилового спирта до уксусной кислоты.
Этиловый спирт окисляется до уксусной кислоты под влиянием уксуснокислых бактерий родов Gluconobacter и Acetobacter. Это грамотрицательные хемоорганогетеротрофные, не образующие спор, палочковидные организмы, подвижные или неподвижные. Уксуснокислые бактерии указанных родов различаются между собой по...(ОСНОВЫ МИКРОБИОЛОГИИ)
Каталитическое дегидрирование парафинов
Важным промышленным способом является также каталитическое дегидрирование парафинов над окисью хрома: Большинство лабораторных способов получения олефинов основано на реакциях отщепления (элиминирования) различных реагентов: воды, галогенов или галогеноводородов от соответствующих производных предельных...(ОРГАНИЧЕСКАЯ ХИМИЯ)
Принципиальной проблемой, которая возникает при окислении спиртов до альдегидов, является то, что альдегиды очень легко подвергаются дальнейшему окислению по сравнению с исходными спиртами. По сути альдегиды являются активными органическими восстановителями. Так, при окислении первичных спиртов бихроматом натрия в серной кислоте (смесь Бекмана), альдегид, который образуется, необходимо защитить от дальнейшего окисления до карбоновой кислоты. Можно, например, удалять альдегид из реакционной смеси. И это широко применяется, так как температура кипения альдегида как правило ниже, чем температура кипения исходного спирта. Таким путем могут быть получены, в первую очередь, низкокипящие альдегиды, например, уксусный, пропионовый, изомасляный:
Рисунок 1.
Лучшие результаты можно получить, если вместо серной кислоты использовать ледяную уксусную кислоту.
Для получения высококипящих альдегидов из соответствующих первичных спиртов в качестве окислителя используют трет-бутиловый эфир хроматной кислоты:
Рисунок 2.
При окислении трет-бутилхроматом ненасыщенных спиртов (в апротонных неполярных растворителях) кратные связи не занимаются, и ненасыщенные альдегиды образуются с высокими выходами.
Достаточно селективным является метод окисления, в котором используют диоксид марганца в органическом растворителе, пентан или хлористый метилен. Например, алил- и бензил- спирты таким образом можно окислять в соответствующие альдегиды. Выходные спирты мало растворимые в неполярных растворителях, а альдегиды, которые образуются в результате окисления, значительно лучше растворимые в пентан или хлористый метилен. Поэтому карбонильные соединения переходят в слой растворителя и таким образом можно предотвратить контакт с окислителем и дальнейшем окислению:
Рисунок 3.
Проводить окисление вторичных спиртов в кетоны значительно проще, чем первичных спиртов в альдегиды. Выходы здесь выше, так как, во-первых, реакционная способность вторичных спиртов выше, чем первичных, а, во-вторых, кетоны, которые образуются значительно более стойки к действию окислителей чем альдегиды.
Окислители для окисления спиртов
Для окисления спиртов в качестве окислителей наиболее широкое применение нашли реагенты на основе переходных металлов - производные шестивалентного хрома, четырех и семи валентного марганца.
Для селективного окисления первичных спиртов до альдегидов в настоящее время лучшими реагентами считается комплекс $CrO_3$ с пиридином - $CrO_{3^.} 2C_5H_5N$ (реагент Саррета-Коллинза), также широко применяется реагент Кори - хлорхромат пиридиния $CrO_3Cl^-C_5H_5N^+H$ в хлористом метилене. Комплекс $CrO_{3^.} 2C_5H_5N$ красного цвета получается при медленном взаимодействии $CrO_{3^.}$ с пиридином при 10-15 $^\circ$С. Оранжевый хлорхромат пиридиния получают при добавлении пиридина к раствору оксида хрома (IV) в 20%-й соляной кислоте. Оба этих реагента растворимы в $CH_2Cl_2$ или $CHCl_3$:
Рисунок 4.
Эти реагенты обеспечивают очень высокие выходы альдегидов, однако хлорхромат пиридиния имеет важное преимущество в том отношении, что этот реагент не затрагивает двойную или тройную связи в исходных спиртах и поэтому особенно эффективен для получения ненасыщенных альдегидов.
Для получения $α¸β$-ненасыщенных альдегидов окислением замещенных аллильных спиртов универсальным окислителем является оксид марганца (IV) $MnO_2$
Примеры реакций спиртов с этими окислителями приведены ниже:
Каталитическое дегидрирование спиртов
Собственно говоря, окисление спиртов до карбонильных соединений сводится к отщеплению водорода от молекулы исходного спирта. Такое отщепление можно осуществить не только с помощью рассмотренных ранее методов окисления, а и используя каталитическое дегидрирование. Каталитическое дегидрирование - процесс отщепления водорода от спиртов в присутствии катализатора (медь, серебро, оксид цинка, смесь оксидов хрома и меди) как с участием кислорода, так и без него. Реакция дегидрирования в присутствии кислорода называется реакцией окислительного дегидрирования.
В качестве катализаторов чаще всего используют тонкодисперсные медь и серебро, а также оксид цинка. Каталитическое дегидрирование спиртов особенно удобно использовать для синтеза альдегидов, которые очень легко окисляются до кислот.
Вышеупомянутые катализаторы наносят в высокодисперсном состоянии на инертные носители, с развитой поверхностью, например, асбест, пемза. Равновесие реакции каталитического дегидрирования устанавливается при температуре 300-400 $^\circ$С. Чтобы предотвратить дальнейшее преобразование продуктов дегидрирования, реакционные газы необходимо быстро охлаждать. Дегидрирования очень эндотермических реакцией ($\triangle H$ = 70-86 кДж / моль). Водород, образующийся можно сжигать, если добавлять в реакционную смесь воздуха, тогда суммарная реакция будет сильно экзотермической ($\triangle H$ = -(160-180) кДж / моль). Такой процесс называется окислительное дегидрирование или аутотермичное дегидрирования. Хотя дегидрирование используется главным образом в промышленности, этот метод можно применять также и в лаборатории для препаративного синтеза.
Дегидрирование насыщения спиртов алифатического ряда происходит с хорошими выходами:
Рисунок 9.
В случае высококипящих спиртов реакцию проводят при пониженном давлении. Ненасыщенные спирты в условиях дегидрирования превращаются в соответствующие насыщенные карбонильные соединения. Гидрирование кратной $C = C$ связи происходит водородом, который образуется в процессе реакции. Чтобы предотвратить эту побочную реакцию и иметь возможность получать каталитическим дегидрированием ненасыщенные карбонильные соединения, процесс проводят в вакууме при 5-20 мм рт. ст. в присутствии паров воды. Такой метод позволяет получать целый ряд ненасыщенных карбонильных соединений:
Рисунок 10.
Применение дегидрирования спиртов
Дегидрирования спиртов является важным промышленным методом синтеза альдегидов и кетонов, например формальдегида, ацетальдегида, ацетона. Эти продуты в больших объемах добывают как дегидрированием, так и окислительным дегидрированием на медном или серебряном катализаторе.
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Примеры спиртов:
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами .
Примеры фенолов:
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы

очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al 2 O 3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
CH 3 OK + Н 2 О = СН 3 ОН + KOH
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al 2 O 3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH 3 -O-CH 3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН 3 -ОН + 3O 2 = 2CO 2 + 4H 2 O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al 2 O 3 ); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Бо льшая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Бо льшая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара- положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов.
Общепринятый механизм дегидратации спиртов следующий (для простоты в качестве примера взят этиловый спирт):
Спирт присоединяет ион водорода стадия (1) с образованием протонированного спирта, который диссоциирует стадия (2), давая молекулу воды и ион карбония; затем ион карбония стадия (3) теряет ион водорода и образуется алкен.
Таким образом, двойная связь образуется в две стадии: потеря гидроксильной группы в виде [стадия (2)] и потеря водорода (стадия (3)). В этом отличие этой реакции от реакции дегидрогалогенирования, где отщепление водорода и галогена происходит одновременно.
Первая стадия представляет кислотно-основное равновесие по Бренстеду - Лоури (разд. 1.19). При растворений серной кислоты в воде, например, происходит следующая реакция:

Ион водорода перешел от очень слабого основания к более сильному основанию с образованием иона оксония основные свойства обоих соединений обусловлены, конечно, неподеленной парой электронов, которая может связывать ион водорода. Спирт также содержит атом кислорода с неподеленной парой электронов и его основность сравнима с основностью воды. Первую стадию предложенного механизма можно наиболее вероятно представить следующим образом:

Ион водорода перешел от бисульфат-иона к более сильному основанию (этиловому спирту) с образованием замещенного иона оксония протонированного спирта.
Аналогично стадия (3) является не выталкиванием свободного иона водорода, а его переходом к наиболее сильному из имеющихся оснований, а именно к

Для удобства этот процесс часто изображают как присоединение или отщепление иона водорода но следует понимать, что во всех случаях на самом деле происходит перенос протона от одного основания к другому.
Все три реакции приведены как равновесные, поскольку каждая стадия обратима; как будет показано ниже, обратной реакцией является образование спиртов из алкенов (разд. 6.10). Равновесие (1) сдвинуто очень сильно вправо; известно, что серная кислота почти полностью ионизована в спиртовом растворе. Поскольку концентрация имеющихся в каждый момент карбониевых ионов очень мала, равновесие (2) сдвинуто сильно влево. В какой-то момент один из этих немногих карбониевых ионов реагирует по уравнению (3) с образованием алкена. При дегидратации, летучий алкен обычно отгоняется из реакционной смеси, и, таким образом, равновесие (3) сдвигается вправо. В результате вся реакция доходит до конца.
Карбониевый ион образуется в результате диссоциации протонированного спирта; при этом заряженная частица отделяется от
нейтральной частицы Очевидно, этот процесс требует значительно меньше энергии, чем образование карбониевого иона из самого спирта, поскольку в этом случае необходимо оторвать положительную частицу от отрицательной. В первом случае слабое основание (вода) отщепляется от иона карбония (кислоты Льюиса) значительно легче, чем очень сильное основание, гидроксил-ион, т. е. вода является лучшей уходящей группой, чем гидроксил-ион. Показано, что гидроксил-ион почти никогда не отщепляется от спирта; реакции расщепления связи в спирте почти во всех случаях требуют кислого катализатора, роль которого, как и в настоящем случае, заключается в протонировании спирта.

Наконец, следует понимать, что диссоциация протонированного спирта становится возможной только благодаря сольватации карбониевого иона (ср. разд. 5.14). Энергия для разрыва связи углерод - кислород берется за счет образования большого числа ион-дипольных связей между ионом карбония и полярным растворителем.
Карбониевый ион может вступать в различные реакции; какая из них происходит, зависит от экспериментальных условий. Все реакции карбониевых ионов завершаются одинаково: они приобретают пару электронов для заполнения октета у положительно заряженного атома углерода. В данном случае ион водорода отщепляется от атома углерода, соседнего с положительно заряженным обедненном электронами атомом углерода; пара электронов, прежде осуществлявшая связь с этим водородом, теперь может образовать -связь

Этот механизм объясняет кислотный катализ при дегидратации. Объясняет ли этот механизм также и тот факт, что легкость дегидратации спиртов уменьшается в ряду третичный вторичный первичный? Прежде чем ответить на этот вопрос, необходимо выяснить, как изменяется устойчивость карбониевых ионов.
Реакции дегидрирования спиртов необходимы для получения альдегидов и кетонов. Кетоны получаются из вторичных спиртов, а альдегиды из первичных спиртов. Катализаторами в процессах служат медь, серебро, хромиты меди, оксид цинка и т.д. Стоит отметить, что по сравнению с медными катализаторами оксид цинка является более стойким и не теряет активность в ходе процесса, однако может провоцировать реакцию дегидратации. В общем виде реакции дегидрирования спиртов могут быть представлены следующим образом:
В промышленности дегидрированием спиртов получают такие соединения, как ацетальдегид, ацетон, метилэтилкетон и циклогексанон. Процессы протекают в токе водяного пара. Наиболее распространенными процессами являются:
1. осуществляется на медном или серебряном катализаторе при температуре 200 - 400 °С и атмосферном давлении. Катализатор представляет собой какой-либо носитель Al 2 O 3 , SnO 2 или углеродное волокно, на который нанесены компоненты серебра или меди. Данная реакция является одной из составляющих процесса Вакера, который является промышленным методом получения уксусного альдегида из этанола путем его дегидрирования или окисления кислородом.

2. может протекать по-разному, в зависимости от структурной формулы его исходного вещества. 2-пропанол, который является вторичным спиртом дегидрируется до ацетона, а 1-пропанол, будучи первичным спиртом, дегидрируется до пропаналя при атмосферном давлении и температуре процесса 250 - 450 °С.


3. так же зависит от структуры исходного соединения, которая влияет на конечный продукт (альдегид или кетон).

4. Дегидрирование метанола . Данный процесс не является до конца изученным, но большинство исследователей выделяет его как перспективный процесс синтеза формальдегида, не содержащего воды. Предлагаются разные параметры процесса: температура 600 - 900 °С, активный компонент катализатора цинк или медь, носитель оксид кремния, возможность инициирования реакции перекисью водорода и т.д. На данный момент большую часть формальдегида в мире получают окислением метанола.