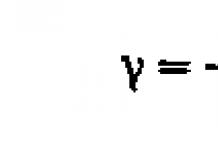ОПРЕДЕЛЕНИЕ
Глицерин - это бесцветная, вязкая, сиропообразная жидкость, сладкая на вкус. Не ядовит. Глицерин не имеет запаха.
Его температуры плавления и кипения равны 18 o С и 290 o С соответственно. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. Абсолютно чистый безводный глицерин затвердевает при +18 o С, но получить его в твердом виде чрезвычайно сложно. Строение молекулы глицерина представлено на рис. 1.
Рис. 1. Строение молекулы глицерина.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов - жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции.
Получение глицерина
Старейший способ производства глицерина - гидролиз жиров и масел:

В настоящее время глицерин получают синтетическим путем из пропилена, образующегося при крекинге нефти. При этом используют разные пути превращения пропилена в глицерин. Наиболее перспективный способ - окисление пропилена кислородом воздуха в присутствии катализатора и при высокой температуре (kat = Cu, t 0 = 370). Процесс идет в несколько стадий.
Химические свойства глицерина
Глицерин является представителем трехатомных спиртов, для которых, как для гидроксилсодержащих соединений характерны те же реакции, что и для одноатомных спиртов.
Глицерин реагирует с активными металлами (калием, натрием и др.), замещающими водород во всех гидроксильных группах, вступают в реакции с галогеноводородами (HCl, HBr и др.), в реакции дегидратации, образуя различные эфиры.
Глицерин имеет и специфические свойства, отличающие его от одноатомных спиртов: он вступает в реакцию, не только со щелочными металлами, но и с некоторыми основаниями, в том числе нерастворимыми, например с гидроксидом меди (II):

Результатом реакции глицерина с гидроксидом меди (II) является глицерат меди (сложное комплексное соединение ярко-синего цвета). Эта реакция - качественная реакция на многоатомные спирты.
Важнейшей в практическом отношении является реакция нитрования глицерина, в результате которой образуется тринитроглицерин C 3 H 5 (ONO 2) 3:

Применение глицерина
Глицерин является компонентом многих пищевых продуктов, кремов и косметических средств.
Примеры решения задач
ПРИМЕР 1
В пробирку помещают 2 капли раствора сернокислой меди, 2 капли раствора едкого натра и перемешивают - образуется голубой студенистый осадок гидроксида меди (II). В пробирку добавляют 1 каплю глицерина и взбалтывают содержимое. Осадок растворяется и появляется темно-синее окрашивание вследствие образования глицерата меди.
Химизм процесса:
Глицерат меди
Глицерин – трехатомный спирт. Кислотность его больше, чем одноатомных спиртов: увеличение числа гидроксильных групп усиливает кислотный характер.
Глицерин легко образует глицераты с гидроокисями тяжелых металлов. Однако, способность его образовывать металлические производные (глицераты) с многовалентными металлами объясняется не столько его повышенной кислотностью, сколько тем, что при этом образуются внутрикомплексные соединения, обладающие особой устойчивостью. Соединения такого рода называют хелатными (от греческого “хела” – клешня).
Реакция с гидроксидом меди является качественной реакцией на многоатомные спирты и позволяет отличить их от одноатомных.
Окисление этилового спирта окисью меди
В сухую пробирку помещают 2 капли этилового спирта. Держа спираль из медной проволоки пинцетом, нагревают ее в пламени спиртовки до появления черного налета окиси меди. Еще горячую спираль опускают в пробирку с этиловым спиртом. Черная поверхность спирали немедленно становится золотистой вследствие восстановления окиси меди. При этом ощущается характерный запах уксусного альдегида (запах яблок).
Образование уксусного альдегида можно обнаружить с помощью цветной реакции с фуксинсернистой кислоты. Для этого в пробирку помещают 3 капли раствора фуксинсернистой кислоты и пипеткой вносят 1 каплю полученного раствора. Появляется розово-фиолетовая окраска. Написать уравнение реакции окисления спирта.
Окисление спиртов хромовой смесью
В сухую пробирку помещают 2 капли этилового спирта, добавляют 1 каплю раствора серной кислоты и 2 капли раствора двухромовокислого калия. Оранжевый раствор нагревают над пламенем спиртовки до начала изменения окраски на синевато-зеленую. Одновременно ощущается характерный запах уксусного альдегида.
Аналогичную реакцию провести, используя изоамиловый спирт или другой спирт, имеющийся в распоряжении, отметив запах образующегося альдегида.
Объяснить химизм процесса химизм процесса, написав уравнения соответствующих реакций.
Окисление этилового спирта раствором перманганата калия
В сухую пробирку помещают 2 капли этилового спирта, 2 капли раствора марганцевокислого калия и 3 капли раствора серной кислоты. Осторожно нагревают содержимое пробирки над пламенем горелки, Розовый раствор обесцвечивается. Ощущается характерный запах уксусного альдегида, который можно обнаружить также по цветной реакции с фуксинсернистой кислотой.
Химизм процесса: (написать уравнение реакции).
Спирты окисляются легче, чем соответствующие предельные углеводороды, что объясняется влиянием имеющейся в их молекуле гидроксигруппы. Первичные спирты превращаются при окислении в альдегиды в мягких условиях, в кислоты – в более жестких условиях. Вторичные спирты дают при окислении кетоны.
При проведении опыта используемМикролабораторию для химического эксперимента
Цель опыта: изучить качественную реакцию на глицерин.
Оборудование: пробирки (2 шт.).
Реактивы: раствор гидроксида натрия NaOH, раствор сульфата меди(II) CuSO4, глицерин C3H5(OH)3.
1. В две пробирки вносим по 20-25 капель сульфата меди(II).
2. Добавляем к нему избыток гидроксида натрия.

3. Образуется осадок гидроксида меди(II) голубого цвета.

4. В одну пробирку по каплям добавляем глицерин.

5. Встряхиваем пробирку до исчезновения осадка и образования темно-синего раствора глицерата меди(II).

6. Сравниваем окраску раствора с окраской гидроксида меди(II) в контрольной пробирке.

Вывод:
Качественной реакцией на глицерин является его взаимодействие с гидроксидом меди (II).
Спирт, мало похожий на спирт.
Нитроглицерин получают, нитруя, обрабатывая смесью концентрированных кислот (азотной и серной, последняя нужна для связывания образующейся воды) простейшего и самого известного из трехатомных спиртов - глицерина С3Н5 (ОН) 3. Производство взрывчатых веществ и порохов - один из основных потребителей глицерина, хотя, конечно, далеко не единственный.
В наши дни довольно много глицерина идет на производство полимерных материалов. Глифталевые смолы - продукты реакции глицерина с фталевой кислотой, будучи растворены в спирте, превращаются в хороший, хотя и несколько хрупкий, электроизоляционный лак. Нужен глицерин и для производства намного более популярных эпоксидных смол. Из глицерина получают эпихлоргидрин - вещество, незаменимое при синтезе знаменитой «эпоксидки». Но не из-за этих смол и тем более не из-за нитроглицерина глицерин считается жизненно важным для нас веществом.
Его продают в аптеках. Но в медицинской практике чистый глицерин используют весьма ограниченно. Он хорошо смягчает кожу. В этом качестве - мягчителя кожи - мы в основном его и используем дома, в быту. В той же роли выступает он и на предприятиях обувной и кожевенной промышленности. Иногда вводят глицерин в состав медицинских свечей (при соответствующей дозировке он действует как слабительное). Этим, собственно, и ограничиваются лекарственные функции глицерина. Значительно шире применяют в медицинской практике производные глицерина, в первую очередь нитроглицерин и глицерофосфаты.
Глицерофосфат , который продают в аптеке, содержит в действительности два глицерофосфата. В состав этого лекарства, которое взрослым назначают при общем переутомлении и истощении нервной системы, а детям при рахите, входят 10% глицерофосфата кальция, 2% глицерофосфата натрия и 88% обыкновенного сахара.
Из глицерина синтетическим путем получают незаменимую аминокислоту метионин. В медицинской практике метионин используют при заболеваниях печени и атеросклерозе.
Производные глицерина всегда есть в организмах высших животных и человека. Это жиры - сложные эфиры глицерина и органических кислот (пальмитиновой, стеариновой и олеиновой)- самые энергоемкие (хотя и не всегда полезные) вещества организма. Подсчитано, что энергетическая ценность жиров в два с лишним раза больше, чем углеводов. Не случайно организм откладывает про запас именно это, самое калорийное «горючее». А кроме того, жировая прослойка служит и теплоизоляцией: теплопроводность жиров крайне низка. У растений жиры заключены главным образом в семенах. В этом - одно из проявлений извечной мудрости природы: тем самым она позаботилась об энергообеспечении следующих поколений…

Впервые на нашей планете глицерин был получен в 1779 г. Карл Вильгельм Шееле (1742-1786) кипятил оливковое масло со свинцовым глетом (окисью свинца) и получил сладковатую сиропообразную жидкость. Он назвал ее сладким маслом или сладким началом жиров. Определить точно состав и строение этого «начала» Шееле, конечно, не мог: органическая химия только— только начинала развиваться. Состав глицерина выяснил в 1823 г. французский химик Мишель Эжен Шеврель, занимавшийся исследованием жиров животного происхождения. А тот факт, что глицерин представляет собой трехатомный спирт, первым установил известнейший французский химик Шарль Адольф Вюрц. Он же, кстати, первым синтезировал в 1857 г. простейший двухатомный спирт этиленгликоль.
Синтетический глицерин из нефти (точнее, из пропилена) впервые получен в 1938 г.
Глицерин отчасти сходен с самым, пожалуй, популярным из спиртов - винным, или этиловым. Как и винный спирт : он горит голубым неярким пламенем. Как и винный спирт, он активно поглощает влагу из воздуха. Как и при образовании спиртоводных растворов, при смешении глицерина и воды суммарный объем оказывается меньше, чем объем исходных компонентов. Как и этиловый спирт, глицерин нужен для производства порохов. Но если в этом производстве роль C2H5OH, в общем-то, подсобная, то глицерин - незаменимое сырье для получения нитроглицерина. А значит, и баллиститного пороха, и динамита тоже. Наконец, как и винный спирт, глицерин входит в состав алкогольных напитков.
Правда, вопреки распространенному мнению, в составе ликеров глицерина нет. Ликеры загущают сахарным сиропом. А вот в натуральных винах глицерин присутствует обязательно. Подобные вина подают в дорогих заведениях, подобных http://www.tatarcha.net/ и кто бы мог подумать, что когда-то из них хотели получать столь дешевый ныне глицерин.
Глицерин образуется при гидролизе жиров, когда при высоком давлении (25 105 паскалей) и температуре немного выше 200 °С вода разрушает жиры. Но лишь немногим известно, что тот же самый глицерин - нормальный продукт сбраживания сахаров. Около трех процентов сахара, содержащегося в винограде, в конечном счете превращается в глицерин. В вине, правда, глицерина намного меньше: в процессе созревания вина он частично превращается в другие органические вещества, но доли процента глицерина есть во всех натуральных винах, а в некоторые вина его вводили и вводят преднамеренно, например при приготовлении хорошего портвейна по классической технологии.
В конце прошлого века, когда спрос на глицерин вырос во всех промышленно развитых странах, химики вполне серьезно обсуждали возможности извлечения глицерина из отходов винокурен, конкретно - из барды. В наши дни потребность в глицерине еще больше: но из барды его все-таки не извлекают. Сейчас глицерин получают в основном синтетическим путем - из пропилена, хотя не утратил значения и классический способ производства глицерина - гидролизом жиров.
Если чистый глицерин охлаждать очень медленно, он затвердевает при температуре около 18 °С. Но эту своеобразную жидкость куда проще переохладить, чем превратить в кристаллы. Он может оставаться жидким и при температуре ниже 0°С. Подобным же образом ведут себя его водные растворы. Например, раствор, в котором на две весовых части глицерина приходится одна часть воды, замерзает при минус 46,5 °С.
К тому же, глицерин - жидкость умеренно вязкая, почти не токсичная, хорошо растворяющая многие органические и неорганические вещества. Из-за этого комплекса свойств глицерин недавно нашел весьма неожиданное применение.
Здесь позволим себе небольшое лирическое отступление.
У Маяковского в заключительной части поэмы «Про это» есть такие строки:
Вот он,
большелобый
тихий химик,
перед опытом наморщил лоб.
Книга - «Вся земля» -
выискивает имя.
Век двадцатый.
Воскресить кого б?
Прервем цитату, обратимся к печальной прозе.
В 1967 г. умер от лейкоза известный американский психолог профессор Джеймс Бедфорд. Согласно воле покойного, сразу же по наступлении клинической смерти его тело было заморожено
. Бедфорд надеялся, что сверхнизкие температуры остановят процесс распада клеток и сохранят их неизменными до тех пор, пока наука найдет средства борьбы с пока еще неизлечимой болезнью. Тогда тело разморозят и попытаются вернуть ученого к жизни…
Вряд ли эти надежды можно считать обоснованными. Крупнейший специалист в области реанимации академик АМН В. А. Неговский писал, что, охладив тело до температуры ниже + 10 °С, можно продлить еще обратимое состояние клинической смерти до 40-60 минут. Использование же минусовых температур при замораживании живых тканей и клеток приводит к их гибели.
Тем не менее надежды на воскрешение в будущем привлекают многих. Эти надежды питает вера во всемогущество науки будущего. В какой-то степени эту веру подкрепляют некоторые свойства глицерина и приготовленных на его основе кровезаменителей.
Качественная реакция на глицерин
В США процедуре замораживания в надежде на оживление и излечение в будущем подверглось более тысячи человек. В городке Фармингдейл в 1971 г. начала функционировать «клиника для мертвецов». Сразу же после смерти из тела пациента этой клиники выпускают всю кровь и заполняют вены специальным глицериновым раствором. После этого тело обертывают в станиоль и помещают в сосуд с сухим льдом (- 79 °С), а затем в специальную герметичную капсулу с жидким азотом. «Если своевременно менять азот, тело никогда не разложится»,- заявил руководитель клиники К. Гендерсон.

Но ведь этого же мало! Не затем соглашались люди на посмертное замораживание, чтобы хорошо сохранились их трупы.
Глицерин действительно затрудняет образование кристаллов льда, разрушающих кровеносные сосуды и клетки. Однажды уже удалось оживить сердце эмбриона цыпленка, охлажденного в глицерине почти до абсолютного нуля. Но сделать что-либо подобное с целым организмом пока еще даже не пытались. Вывести человека из состояния клинической смерти спустя годы после ее наступления - тоже. Поэтому еще раз процитируем Владимира Александровича Неговского:
«Я знаю, - говорил он, - лишь один подобный случай со счастливым концом - это случай со спящей красавицей. От столетнего сна ее пробудил поцелуй. Это тоже способ реанимации, да к тому же еще и приятный».
Но глицерин - добавим от себя - здесь не при чем.
Трехатомные спирты (глицерин).
Трехатомиые спирты содержат три гидроксильные группы при разных углеродных атомах.
Общая формула СnН2n — 1(ОН)3.
Первый и основной представитель трехатомных спиртов - глицерин (пропантриол-1,2,3) HОСН2-СHOH-СН2ОН.
Номенклатура. Для названия трехатомных спиртов по систематической номенклатуре необходимо добавить к названию соответствующего алкана суффикс -триол.
Изомерия трехатомных спиртов, как и двухатомных, определяется строением углеродной цепи и положением в ней трех гидроксильных групп.
Получение. 1. Глицерин можно получать гидролизом (омылением) растительных или животных жиров (в присутствии щелочей или кислот):
H2C-O-C//-C17H35 H2C-OH
HC-O-C//-C17H35 + 3H2O ® HC-OH + 3C17H35COOH
H2C-O-C//-C17H35 H2C-OH
триглицерид (жир) глицерин стеариновая
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот - мыла (поэтому этот процесс называется омылением).
2. Синтез из пропилена (промышленный способ):
| Cl2, 450-500 oC | H2O (гидролиз)
CH ----® CH ----®
пропилен хлористый
CH2OH HOCl (гипо- CH2OH CH2OH
| хлорирование) | H2O (гидролиз) |
®CH ----® CHOH ----® CHOH
|| -HCl | -HCl |
аллиловый монохлор- глицерин
спирт гидрин
глицерина
Химические свойства. По химическим свойствам глицерин во многом напоминает этиленгликоль. Он может реагировать одной, двумя или тремя гидроксильными группами.
1. Образование глицератпов.
Глицерин, вступая в реакции со щелочными металлами, а также с гидроксидами тяжелых металлов, образует глицераты:
H2С-OH H2C-Oæ /O- CH2
2 HC-OH + Cu(OH)2 ® HC-O/ãO- CH + 2H2O
H2C-OH H2C-OH HO-CH2
глицерат меди
2. Образование сложных эфиров. С органическими и минеральными кислотами глицерин образует сложные эфиры:
H2C-OH HO-NO2 H2C-O-NO2
HC-OH + HO-NO2 -® HC-O-NO2 + 3H2O
H2C-OH HO-NO2 H2C-O-NO2
глицерин азотная тринитрат
кислота глицерина
(нитроглицерин)
H2C-OH HO-OC-CH3 H2C-O-COCH3
HC-OH + HO-OC-CH3 -® HC-O-COCH3 + 3H2O
H2C-OH HO-OC-CH3 H2C-O-COCH3
глицерин уксусная триацетат
кислота глицерина
3. Замена гидроксильных групп на галогены. При взаимодействии глицерина с галогеноводородами (НС1, НВr) образуются моно- и дихлор- или бромгидрины:
H2C-OH ® HC-OH ® HC-Cl ù CH2\
| HCl | | HCl | | | KOH | O
HC-OH --| H2C-OH -- | H2C-OH|---® CH/
| -H2O | -H2O | | -KCl, -H2O |
H2C-OH ® H2C-OH ® H2C-Cl û CH2Cl
монохлор- дихлор- эпихлор-
гидрины гидрины гидрин
4. Окисление. При окислении глицерина образуются различные продукты, состав которых зависит от природы окислителя. Начальными продуктами окисления являются: глицериновый альдегид HOCH2-CHOH-CHO, дигидроксиацетон НОСН2-СО-CН2ОН и конечный продукт (без разрыва углеродной цепи) - щавелевая кислота НООС-СООН.
Отдельные представители. Глицерин (пропантриол-1,2,3) НОСН2-СНОН-СН2OН — вязкая гигроскопическая нетоксичная жидкость (т. кип. 290 °С с разл.), сладкая на вкус. Смешивается с водой во всех соотношениях. Используют для производства взрывчатых веществ, антифризов и полиэфирных полимеров. Находит применение в пищевой (для изготовления кондитерских изделий, ликеров и т.д.), текстильной, кожевенной и химической промышленности, в парфюмерии.
Предыдущая891011121314151617181920212223Следующая
Главная / Глицерин
Глицерин
Стандарт качества
ГОСТ 6824-96
Формула
Описание
Вязкая жидкость без цвета и запаха, сладкая на вкус. Из-за своего сладкого привкуса вещество и получило своё название (лат.> glycos [гликос] — сладкий). Смешивается с водой в любых соотношениях. Не ядовит. Температура плавления глицерина - 8°С, температура кипения - 245°С. Плотность глицерина - 1.26 г/см3.
Химические свойства глицерина типичны для многоатомных спиртов. Из органических соединений хорошо растворяется в спирте, но не растворим в жирах, аренах, эфире и хлороформе. Сам глицерин хорошо растворяет моно- и дисахариды, а также неорганические соли и щелочи. Отсюда — широкий спектр применения глицерина. В 1938 был разработан метод синтеза глицерина из пропилена. Этим путем производят значительную часть глицерина.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин используется как пищевая добавка Е422 в производстве кондитерских изделий для улучшения консистенции, для предотвращения проседания шоколада, увеличения объема хлеба.
Добавление глицерина уменьшает время зачерствения хлебных изделий, делает макароны менее клейкими, уменьшает налипание крахмала при выпечке.
Глицерин применяется при изготовлении экстрактов кофе, чая, имбиря и других растительных веществ, которые мелко измельчают и обрабатывают водным раствором глицерина, нагревают и испаряют воду. Получается экстракт, в котором содержится около 30% глицерина. Глицерин широко используется при производстве безалкогольных напитков. Экстракт, приготовленный на основе глицерина, в разбавленном состоянии придает напиткам «мягкость».
Из-за своей высокой гигроскопичности глицерин используют при заготовке табака (чтобы сохранить листья влажными и устранить неприятный вкус).
В медицине и в производстве фармацевтических препаратов глицерин используют для растворения лекарств, повышения вязкости жидких препаратов, предохранения от изменений при ферментации жидкостей, от высыхания мазей, паст и кремов. Используя глицерин вместо воды можно приготовить высококонцентрированные медицинские растворы. Так же он хорошо растворяет йод, бром, фенол, тимол, хлорид ртути и алкалоиды. Глицерин обладает антисептическими свойствами.
Глицерин усиливает моющую способность большинства сортов туалетного мыла, в которых он используется, придает коже белизну и смягчает её.
В сельском хозяйстве глицерин применяется для обработки семян, что способствует их хорошему прорастанию, деревьев и кустарников, что защищает кору от непогоды.
Глицерин в текстильной промышленности применяется в ткачестве, прядении, крашении, что придает тканям мягкость и эластичность. Его используют для получения анилиновых красок, растворителей для красок, при производстве синтетического шелка и шерсти.
В бумажной промышленности глицерин применяют в производстве папиросной бумаги, пергамента, кальки, бумажных салфеток и жаронепроницаемой бумаги.
В кожевенной промышленности используют глицериновые растворы в процессе жировки кож, добавляя его к водным растворам хлорида бария. Глицерин входит в состав восковых эмульсий для дубления кожи.
Глицерин широко применяется в производстве прозрачных упаковочных материалов.
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ГЛИЦЕРИН
Благодаря своей пластичности, свойству удерживать влагу и стойко переносить холод, глицерин используется в качестве пластификатора при производстве целлофана. Глицерин является составной частью при получении пластмасс и смол. Полиглицерины используют для покрытия бумажных мешков, в которых хранится масло. Бумажный упаковочный материал становится огнестойким, если его под давлением пропитать водным раствором глицерина, буры, фосфата аммония, желатина.
В лакокрасочной промышленности глицерин является составляющим компонентом полировочных составов, особенно лаков, применяемых для окончательной отделки.
В радиотехнике глицерин широко используют в производстве электролитических конденсаторов, алкидных смол, которые применяются как изоляционный материал, при обработке алюминия и его сплавов.
Лечебные свойства и показания к применению глицерина
Глицерин в 10-30% смеси с водой, этиловым спиртом, ланолином, вазелином обладает способностью смягчать ткани и применяется обычно как смягчающее средство для кожи и слизистых оболочек.
Глицерин используется как основа для мазей и как растворитель для ряда лекарственных веществ (буры, танина, ихтиола и др.).
На основе глицерина готовятся и другие безжирные средства для ухода за кожей — кремы (кремы-глицероляты), желе (безжирные мази) и другие лекарственные формы и косметические препараты, например, 3-5% глицерина добавляется в лосьоны для смягчения кожи).
В смеси с нашатырным спиртом и спиртом (нашатырного спирта — 20,0, глицерина — 40,0, спирта этилового 70% — 40,0) глицерин применяется как средство для смягчения кожи рук (для обтирания рук при сухой коже).
Упаковка
От 1 и 2.5 литровых полиэтиленовых бутылок для исследовательских и лабораторных применений, 25 и 190 литровых пластиковых бочек, до1000 литровых контейнеров.
Транспортировка
Транспортируют в алюминиевых или стальных железнодорожных цистернах и бочках.
Хранение
Хранят глицерин в герметичных емкостях из алюминия или нержавеющей стали под азотной подушкой
в проветриваемом сухом помещении при невысокой температуре.
Срок годности глицерина — 5 лет со дня изготовления.
Технические характеристики
— Молярная масса - 92,1 г/моль
— Плотность - 1,261 г/см3
— Термические свойства
— Температура плавления - 18 °C
— Температура кипения - 290 °C
— Оптический показатель преломления - 1,4729
номер CAS - 56-81-5
— SMILES - OCC(O)CO
| Показатели | Глицерин | |||
| Ц-98 | ПК-94 | Т-94 | Т-88 | |
| Относительная плотность при 20 °С 1 по отношению к воде этой же температуры, не менее | 1,2584 | 1,2481 | 1,2481 | 1,2322 |
| Плотность при 20 °С, г/ см3, не менее | 1,255 | 1,244 | 1,244 | — |
| Реакция глицерина, 0,1 моль/ дм3 раствора НС1 или КОН, см3, не более | 1,5 | 1,5 | 1,5 | 1,5 |
| Массовая доля чистого глицерина, %, не менее | 98 | 94 | 94 | 88 |
| Массовая доля золы, %, не более | 0,14 | 0,01 | 0,02 | 0,25 |
| Коэффициент омыления (сложные эфиры), мг КОН на 1 г глицерина, не более | 0,7 | 0,7 | 2,0 | — |
| Хлориды | Следы | Отсутствие | Следы | — |
| Сернокислые соединения (сульфиты) | « | « | « | — |
| Углеводы, акролеин и другие восстанавливающие вещества, железо, мышьяк | Отсутствие | |||
| Содержание свинца, мг/ кг, не более | — | 5,0 | — | — |
Отгрузка от 1 кг! Доставка по РФ! Работаем только с Юридическими лицами (в т.ч. ИП) и только по безналичному расчёту!
Глицерин или согласно международной номенклатуре пропантриол -1,2,3 - сложное вещество, которое относится к многоатомным спиртам, а точнее является трехатомным спиртом, т.к. имеет 3 гидроксильные группы - ОН. Химические свойства глицерина схожи с таковыми у однако выражены сильнее из-за того, что гидроксильных групп больше и они оказывают влияние друг на друга.
Глицерин, как и спирты с одной гидроксильной группой, хорошо растворяется в воде. Это, можно сказать, тоже качественная реакция на глицерин, так как он растворяется в воде в практически любом соотношении. Это свойство используют при производстве антифризов - жидкостей, которые не замерзают и охлаждают моторы машин и самолетов.
Также глицерин взаимодействует с перманганатом калия. Это качественная реакция на глицерин, которую еще называют вулканом Шееле. Для ее проведения необходимо к порошку перманганата калия, который насыпан в виде горки с углублением в фарфоровой чаше, добавить 1-2 капли безводного глицерина. Через минуту смесь самопроизвольно воспламеняется В процессе реакции выделяется большое количество тепла, а также разлетаются горячие частички продуктов реакции и водяного пара. Данная реакция является окислительно-восстановительной.

Глицерин обладает гигроскопичностью, т.е. способен удерживать влагу. Именно на этом свойстве основана следующая качественная реакция на глицерин. Она проводится в вытяжном шкафу. Для ее проведения в чистую, сухую пробирку насыпать примерно 1 см3 кристаллического гидросульфата калия (KHSO4). Добавляем 1-2 капли глицерина, нагревая затем до появления резкого запаха. Гидросульфат калия действует здесь как водопоглащающее вещество, которое начинает себя проявлять при нагревании. Глицерин, теряя воду, преобразуется в непредельное соединение - акролеин, которое имеет резкий неприятный запах. С3Н5(ОН)3 — H2C=CH-CHO + 2 H2O.
Реакция глицерина с гидроксидом меди является качественной и служит для определения не только глицерина, но и других Для того чтобы провести ее, изначально необходимо приготовить свежий раствор гидроксида меди (ІІ). Для этого к добавляем и получаем гидроксид меди (ІІ), который образует осадок голубого цвета. В эту пробирку с осадком добавляем несколько капель глицерина и замечаем, что осадок исчез, а раствор преобрел синюю окраску.

Образовавшейся комплекс называется алкоголят или глицерат меди. Качественная реакция на глицерин с гидроксидом меди (ІІ) применяется, если глицерин находится в чистом виде или в водном раствре. Для проведения таких реакций, в которых глицерин находится с примесями, необходимо проводить предварительную очистку его от них.
Качественные реакции на глицерин помогают обнаружить его в любой среде. Это активно используется для определения глицерина в продуктах питания, косметике, парфюмерии, медицинских препаратах и антифризах.