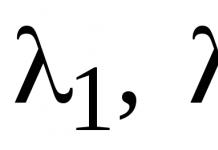Общая схема реакции:
Нуклеофил отдает субстрату свою пару электронов, за счет которой образуется новая связь, а галоген уходит со своей парой электронов в виде галогенид-аниона. При этом происходит алкилирование нуклеофила.
Для нуклеофильного замещения у атома углерода в состоянии sp 3 -гибридизации установлено два основных механизма: бимолекулярное нуклеофильное замещение (S N 2 ) и мономолекуляное нуклеофильное замещение (S N 1 ).
Бимолекулярное нуклеофильное замещение.
Бимолекулярное нуклеофильное замещение - это синхронный процесс, который протекает в одну стадию. Разрыв старой и образование новой связи происходят одновременно. Нуклеофил атакует субстрат со стороны, противоположной уходящей группе (с тыла), и постепенно вытесняет ее из молекулы:
Y: + R-Hal ® ® Y-R + Hal -
переходное
состояние
S N 2-реакции имеют следующие основные признаки.
- Кинетический признак
Скорость реакции зависит от концентрации и субстрата, и нуклеофила. Реакция имеет второй общий порядок (первый по субстрату и первый по нуклеофилу) и описывается кинетическим уравнением:
- v=k[Y]
- Стереохимический признак
Если нуклеофильное замещение происходит у асимметрического атома углерода, то имеет место обращение конфигурации, так как в переходном состоянии три нереагирующие группы и центральный атом углерода находятся в одной плоскости, а входящая и уходящая группы расположены на одной прямой, перпендикулярной этой плоскости. В результате структура выворачивается, как зонтик:
Мономолекуляное нуклеофильное замещение.
Мономолекулярное нуклеофильное замещение протекает в две стадии:
На первой стадии под действием растворителя происходит гетеролитический разрыв связи в субстрате, в результате чего образуется карбокатион. Процесс протекает медленно и определяет скорость реакции в целом. На второй стадии карбокатион быстро реагирует с нуклеофилом, давая продукт замещения.
Энергетическая диаграмма процесса имеет вид:
S N 1-реакции имеют следующие основные признаки.
- Кинетический признак
Скорость реакции зависит только от концентрации субстрата, поскольку нуклеофил не участвует в лимитирующей стадии процесса. Реакция имеет первый порядок и описывается кинетическим уравнением:
v=k
- Cтереохимический признак
Если нуклеофильное замещение происходит у асимметрического атома углерода, то, как правило, образуется рацемическая смесь, так как атака нуклеофилом плоского карбокатиона с обоих сторон равновероятна:
Факторы, влияющие на ход нуклеофильного замещения
Легкость протекания реакции и ее механизм зависят от многих факторов, среди которых можно выделить следующие:
- строение углеводородного радикала субстрата;
- природа уходящей группы;
- сила нуклеофила;
- природа растворителя.
Влияние строения углеводородного радикала.
Реакционная способность первичных, вторичных и третичных алкилгалогенидов в реакциях нуклеофильного замещения различна, причем порядок реакционной способности зависит от механизма реакции.
Скорость реакций, протекающих по механизму S N 1, зависит от стабильности карбокатиона, образующегося на первой стадии реакции. Таким образом, реакционная способность алкилгалогенидов в реакциях S N 1 возрастает в ряду:
который соответствует ряду стабильности карбокатионов:
Успех реакции S N 2 определяется эффективностью атаки нуклеофила на положительно заряженный реакционный центр субстрата. Поэтому электронодонорные радикалы R, понижая положительный заряд на реакционном центре, замедляет нуклеофильную атаку. В то же время увеличению объема R затрудняет подход нуклеофила к реакционному центру. Совместное действие индуктивного и объемного эффектов определяет ряд реакционных способностей субстратов в реакциях нуклеофильного замещения:
Высокой реакционной способностью независимо от механизма реакции обладают аллил- и бензилгалогениды. В процессе S N 1 они дают карбокатионы, стабилизированные засчет сопряжения:
Бензил-катион
Легкость, с которой аллил- и бензилгалогениды вступают в S N 2-реакции объясняют участием кратных связей в стабилизации переходного состояния.
Влияние природы уходящей группы.
Реакционная способность алкилгалоненидов зависит от прочности связи углерод - галоген, которая уменьшается в ряду:
C-F > C-Cl > C-Br > C-I.
Не менее важно, чтобы уходящая группа была термодинамически стабильна. (Она должна быть более устойчива, чем атакующий субстрат нуклеофил). Хорошими (относительно устойчивыми) уходящими группами являются слабые основания. Галогенид-анионы - хорошие уходящие группы. Их относительная стабильность возрастает по мере уменьшения их основности в ряду:
F - < Cl - < Br - < I -
Параллельно увеличивается и реакционная способность алкилгалогенидов независимо от того, по какому из двух механизмов протекает реакция:
RF < RCl < RBr < RI
Влияние природы нуклеофила.
Нулеофильность - это способность частицы взаимодействовать с атомом углерода, несущим целый или частичный положительный заряд. Нуклеофильность является кинетической характеристикой и определяется константами скоростей соответствующих реакций.
Нуклеофилы, как и основания, могут быть сильными и слабыми. Единой шкалы нуклеофильности не существует, так как относительная сила нуклеофила может изменяться в зависимости от природы субстрата и растворителя. Однако можно выделить следующие основные закономерности.
1) Отрицательно заряженные нуклеофилы сильнее, чем нейтральные молекулы (сопряженные им кислоты):
OH - > H 2 O; RO - > ROH; NH 2 - > NH 3
2) Для элементов одного периода с ростом электроотрицательности атома нуклеофильность уменьшается:
NH 2 - > OH - > F -
R 3 C - > RNH 2 - > RO - > F -
3) Электронодонорные заместители увеличивают, электроноакцепторные - уменьшают нуклеофильность. Например, для кислородсодержащих нуклеофилов установлен следующий ряд реакционной способности:
RO - > OH - > ArO - > RCOO -
В рассмотренных примерах порядок нуклеофильности реагентов совпадает с порядком их основности и объясняется теми же причинами. Однако сила нуклеофила определяется не только его основностью, но иполяризуемостью .
4) Для элементов одной подгруппы с возрастанием заряда ядра нуклеофильность увеличивается, несмотря на уменьшение основности:
RS --
I - - - -
Рост нуклеофильности связан с увеличением поляризуемости атомов и ионов по мере увеличения их радиуса. Чем выше поляризуемость нуклеофила, тем легче деформируется его электронное облако и тем в большей степени он способен передать электронную плотность на субстрат.
Такой порядок нуклеофильности может быть объяснен также с позиций принципа ЖМКО. Основность по Бренстеду проявляется во взаимодействии с жесткой кислотой Н + , в то время как нуклеофильность проявляется во взаимодействии с более мягким кислотным центром - атомом углерода, для которого предпочтительным будет взаимодействие с мягкими основаниями Льюиса - RS - и I - .
Кроме того, относительная сила нуклеофилов зависит от природы растворителя. Чем меньше размер аниона, тем лучше он сольватируется полярными протонными растворителями (т.е. растворителями, способными образовывать с анионом водородные связи), что снижает его реакционную способность. При замене растворителя порядок реакционной способности нуклеофилов может меняться на противоположный.
В соответствии с механизмами S N 2 и S N 1 природа нуклеофила оказывает влияние на ход S N 2-реакции, так как нуклеофил участвует в лимитирующей (и единственной) стадии процесса, и не влияет на скорость реакций, протекающих по механизму S N 1, лимитирующая стадия которых протекает без участия нуклеофила.
Влияние природы растворителя
Растворитель влияет на скорость и механизм реакций нуклеофильного замещения.
Протеканию реакции по механизму S N 1 способствуют сильноионизирующие растворители. К ним относятся полярные протонные растворители (вода, спирты, карбоновые кислоты), так как они хорошо сольватируют ионные интермедиаты: отрицательно заряженную уходящую группу - за счет водородных связей, карбокатион - за счет свободных пар электронов.
Влияние растворителя на S N 2-реакции проявляется в меньшей степени и зависит от распределения зарядов в исходном и переходном состояниях. Как правило, их скорость уменьшается с ростом полярности растворителя и увеличивается при переходе от протонных растворителей к апротонным (диметилформамид, диметилсульфоксид, ацетонитрил). В апротонных растворителях, которые не способны к образованию водородных связей, нуклеофил (а это, как правило, анион) в меньшей степени сольватирован и, следовательно, обладает большей силой, что важно для S N 2-реакции.
Таким образом, протеканию реакций по механизму S N 2 способствуют:
- субстрат с углеводородным радикалом малого объема (первичным);
- апротонный растворитель;
- сильный нуклеофил.
Реализации механизма S N 1 способствуют:
- субстрат с углеводородным радикалом разветвленного строения (третичным);
- полярный протонный растворитель;
- слабый нуклеофил.
По легкости замещения галогена независимо от механизма реакции галогенпроизводные располагаются в следующий ряд:
аллил- и бензилгалогениды > алкилгалогениды > винил- и арилгалогениды
Галогенпроизводные, содержащие связь (винил- и арилгалогениды), обладают очень низкой реакционной способностью. Реакция протекает по иному механизму. Малую подвижность галогена в винил- и арилгалогенидах объясняют увеличением прочности связи C-Hal за счет сопряжения пары электронов галогена с электронами p -связей:
Примеры реакций нуклеофильного замещения
Реакции нуклеофильного замещения галогена широко используются в органическом синтезе. С их помощью можно заменять галоген на другие функциональные группы или углеводородные радикалы и получать из галогенпроизводных любые классы органических соединений.
Примеры синтетического использования галогенпроизводных алифатических углеводородов приведены в таблице.
Таблица 7. S N -реакции галогенпроизводных
| Субстрат | + | нуклефил | ® | продукт + уходящая группа |
| Получение спиртов | ||||
| R-Hal | + | OH - (H 2 O) | ® | R-OH + Hal - (HHal) |
| CH 3 Br | + | NaOH | CH 3 OH + NaBr | |
| (CH 3) 3 CCl | + | H 2 O | ® | (CH 3) 3 COH + HCl |
| CH 2 =CH-CH 2 Cl | + | H 2 O | ® | CH 2 =CHCH 2 OH+HCl |
| Получение простых эфиров | ||||
| R-Hal | + | R / O - | ® | R-OR / + Hal - |
| СH 3 I | + | CH 3 CH 2 O - Na + | ® | CH 3 OCH 2 CH 3 + NaI |
| Получение сложных эфиров | ||||
| R-Hal | + | R / COO - | ® | R / COOR + Hal - |
| CH 3 CH 2 I | + | CH 3 COO - Na + | ® | CH 3 COOCH 2 CH 3 + NaI |
| Получение тиолов | ||||
| R-Hal | + | SH - | ® | R-SH + Hal - |
| CH 3 СH 2 Br | + | NaHS | ® | CH 3 СH 2 SH + NaBr |
| Получение сульфидов | ||||
| R-Hal | + | R / S - | ® | R-SR / + Hal - |
| CH 3 СH 2 Br | CH 3 СH 2 S - Na + | ® | (CH 3 СH 2) 2 S + NaBr | |
| Получение аминов и аммониевых солей | ||||
| R-Hal | + | NH 2 - | ® | RNH 2 + Hal - |
| R-Hal | + | R / 3 N | ® | R R / 3 N + Hal - |
| Получение нитрилов | ||||
| R-Hal | + | Сє N - | ® | R- Сє N + Hal - (S N 2) |
| CH 3 СH 2 Br | + | NaCN | ® | CH 3 СH 2 CN + NaBr |
| Получение нитросоединений | ||||
| R-Hal | NO 2 - | ® | R-NO 2 + Hal - (S N 2) | |
| CH 3 CH 2 I | AgNO 2 | ® | CH 3 CH 2 NO 2 + AgI | |
| Получение галогенпроизводных | ||||
| R-Hal | + | I - | ® | R-I + Hal - (S N 2) |
| CH 3 Cl | + | NaI | ® | СH 3 I + NaCl |
Винил- и арилгалогениды инертны по отношению к нуклеофильным реагентам. Замещения галогена в галогенбензолах возможно только в очень жестких условиях, например:
Введение электроноакцепторных заместителей в орто - и пара -положения к галогену активизируют галогенарены в S N -реакциях:
Аналогично 2,4-динитрофторбензол взаимодействует с аминогруппами аминокислот и пептидов, что используется для установления их аминокислотного состава:
Номенклатура:
1) заместительная (систематическая),
2) радикало-функциональная.
Для низших и наиболее распространённых представителей приемлемыми являются и тривиальные названия, например, фтороформ, хлороформ, бромоформ, йодоформ, фторотан.
Строение и свойства

В зависимости от природы галогена от фтора к йоду полярность связи C–Hal уменьшается (так как уменьшается электроотрицательность галогена), но возрастает её поляризуемость и увеличивается длина (так как увеличивается радиус атома галогена), а прочность связи при этом уменьшается.
Так как поляризуемость связи C–I наибольшая, то при растворении йодоалканов в полярных растворителях эта связь легко поляризуется вплоть до гетеролитического разрыва, то есть до гетеролитической диссоциации йодоалкана: R–I ® R + + I - . При этом химические свойства соединений сильно зависят от их поляризуемости.


Реакции нуклеофильного замещения
Нуклеофильные частицы:
HО - , RO - , - NH 2 , F - , Cl - , Br - , I - , CN - , H - , - CH 2 -R
H 2 O, ROH, NH 3 , RNH 2 , RR ¢NH, H 2 S, RSH
Механизм бимолекулярного нуклеофильного замещения

Механизм мономолекулярного замещения
где II - тесная ионная пара
III - рыхлая ионная пара
IV и V - диссоциированные ионы
Факторы, влияющие на механизм и скорость нуклеофильного замещения
1. Влияние структуры субстрата .
бромметан бромэтан 2-бромпропан
Скорость S N 2-реакции:
 ,
,
Поэтому высокая скорость реакций нуклеофильного замещения может быть характерна и для первичных, и для третичных алкилгалогенидов .
В первом случае - за счёт лёгкости взаимодействия по S N 2-механизму (свободный доступ реакционного центра, нет стерических препятствий),
во втором - по S N 1-механизму (лёгкость диссоциации субстратов, стабильность образующегося карбокатиона).
Вторичные алкилгалогениды в большинстве случаев должны реагировать по смешанному механизму, причём скорость реакций у них будет относительно небольшой, так как есть препятствия для протекания и мономолекулярного, и бимолекулярного замещения.
2. Влияние природы нуклеофила.
3. Влияние растворителей и катализаторов.
4. Влияние природы уходящей группы.
Примеры реакций нуклеофильного замещения
1) Гидролиз галогеналканов - это превращение их в спирты по схеме:
R-Х + H 2 O ® R-OH + HХ
Механизм реакции: S N 1или S N 2 - определяется, в основном, структурой субстрата, а также другими факторами. Например, щелочной гидролиз бромэтана (S N 2-механизм):
Кислотный гидролиз 2-бром-2-метилпропана (S N 1-механизм):

2) Алкоголиз галогеналканов - это взаимодействие галогеналканов с алкоголятами металлов (реакция Вильямсона ), приводящее к образованию простых эфиров:
R-Hal + R ¢-O - Na + ® R-O-R ¢ + NaHal
Нуклеофильная частица - алкоголят-анион R ¢-O - .
При этом при синтезе смешанных эфиров (с разными R и R ¢) необходимо осуществить правильный выбор галогеналкана и алкоголята (RHal и R ¢-O - или R ¢Hal и R-O - - в зависимости от структуры углеводородных радикалов) для того, чтобы реакция протекала с наибольшей скоростью, а возможность образования алкена (протекание конкурирующей реакции отщепления) была бы сведена к минимуму .
3) Аммонолиз галогеналканов - это взаимодействие галогеналканов с аммиаком, приводящее к получению аминов (или их солей) - алкилирование аминов по Гофману
R-Х + NН 3 ®[R-NН 3 ] + Х - R-NН 2 + NН 4 Х
4) Замена одного атома галогена на другой :
R-Br + I - ® R-I + Br -
Кислая среда и протонные растворители способствуют замещению атома фтора,
а высокополярные апротонные растворители, наоборот, атома йода, так как нуклеофильность галогенид-ионов уменьшается в ряду I - >Br - >Cl - >F -
5) Взаимодействие с цианидами - это взаимодействие галогеналканов с солями синильной кислоты, приводящее к образованию органических цианидов (нитрилов) или изоцианидов. Цианид-ион является амбидентным нуклеофилом, то есть, способен проявлять свои нуклеофильные свойства, как за счёт атома углерода, так и за счёт атома азота:
- : C ºN ®: C=N : -
Механизм S N 1 - приводит к образованию изоцианидов (изонитрилов):
R + + : C=N : - ® R-N=С :
Механизм S N 2:
При этом образуются цианиды (нитрилы).
6) Взаимодействие с нитритами.
Нитрит-анион также является амбидентным нуклеофилом.
Поэтому его взаимодействие с галогеналканами может привести либо к нитросоединениям, либо к эфирам азотистой кислоты.
Общая схема реакции:
R - НаI + :N - → R - N + :НаI -
Нуклеофил отдает субстрату свою пару электронов, за счет которой образуется новая связь, а галоген уходит со своей парой электронов в виде галогенид-аниона. При этом происходит алкилирование нуклеофила.
Для нуклеофильного замещения у атома углерода в состоянии sp 3 -гибридизации установлено два основных механизма: бимолекулярное нуклеофильное замещение (S N 2 ) и мономолекуляное нуклеофильное замещение (S N 1 ).
Бимолекулярное нуклеофильное замещение – это синхронный процесс, который протекает в одну стадию. Разрыв старой и образование новой связи происходят одновременно. Нуклеофил атакует субстрат со стороны, противоположной уходящей группе (с тыла), и постепенно вытесняет ее из молекулы:
N: + R-Hal → → N-R + Hal -
переходное
состояние
S N 2-реакции имеют следующие основные признаки:
- Кинетический
Скорость реакции зависит от концентрации и субстрата, и нуклеофила. Реакция имеет второй общий порядок (первый по субстрату и первый по нуклеофилу) и описывается кинетическим уравнением:
2. Стереохимический
Если нуклеофильное замещение происходит у асимметрического атома углерода, то имеет место обращение конфигурации, так как в переходном состоянии три нереагирующие группы и центральный атом углерода находятся в одной плоскости, а входящая и уходящая группы расположены на одной прямой, перпендикулярной этой плоскости. В результате структура выворачивается, как зонтик.
Мономолекулярное нуклеофильное замещение протекает в две стадии.
На первой стадии под действием растворителя происходит гетеролитический разрыв связи в субстрате, в результате чего образуется карбокатион. Процесс протекает медленно и определяет скорость реакции в целом. На второй стадии карбокатион быстро реагирует с нуклеофилом, давая продукт замещения.
S N 1-реакции имеют следующие основные признаки.
1. Кинетический
Скорость реакции зависит только от концентрации субстрата, поскольку нуклеофил не участвует в лимитирующей стадии процесса. Реакция имеет первый порядок и описывается кинетическим уравнением:
2. Cтереохимический признак
Если нуклеофильное замещение происходит у асимметрического атома углерода, то, как правило, образуется рацемическая смесь, так как атака нуклеофилом плоского карбокатиона с обоих сторон равновероятна.
Факторы, влияющие на ход нуклеофильного замещения
Легкость протекания реакции и ее механизм зависят от многих факторов, среди которых можно выделить следующие:
- строение углеводородного радикала субстрата;
- природа уходящей группы;
- сила нуклеофила;
- природа растворителя.
Влияние строения углеводородного радикала.
Реакционная способность первичных, вторичных и третичных алкилгалогенидов в реакциях нуклеофильного замещения различна, причем порядок реакционной способности зависит от механизма реакции.
Скорость реакций, протекающих по механизму S N 1, зависит от стабильности карбокатиона, образующегося на первой стадии реакции. Таким образом, реакционная способность алкилгалогенидов в реакциях S N 1 возрастает в ряду: перв <вторич< третич
который соответствует ряду стабильности карбокатионов.
Успех реакции S N 2 определяется эффективностью атаки нуклеофила на положительно заряженный реакционный центр субстрата. Поэтому электронодонорные радикалы R, понижая положительный заряд на реакционном центре, замедляют нуклеофильную атаку. Увеличение объема R затрудняет подход нуклеофила к реакционному центру. Совместное действие индуктивного и объемного эффектов определяет ряд реакционных особностей субстратов в реакциях нуклеофильного замещения: перв >вторич> третич.
Высокой реакционной способностью, независимо от механизма реакции, обладают аллил- и бензилгалогениды. В процессе S N 1 они образуют карбокатионы, стабилизированные засчет р, π-сопряжения:
Легкость, с которой аллил- и бензилгалогениды вступают в S N 2-реакции, объясняют участием кратных связей в стабилизации переходного состояния.
Влияние природы уходящей группы.
Реакционная способность алкилгалоненидов зависит от прочности связи углерод – галоген, которая уменьшается в ряду:
C-F > C-Cl > C-Br > C-I.
Не менее важно, чтобы уходящая группа была термодинамически стабильна. (Она должна быть более устойчива, чем атакующий субстрат нуклеофил). Хорошими (относительно устойчивыми) уходящими группами являются слабые основания. Галогенид-анионы – хорошие уходящие группы. Относительная стабильность возрастает по мере уменьшения их основности в ряду:
F - < Cl - < Br - < I -
Параллельно увеличивается и реакционная способность алкилгалогенидов:
RF < RCl < RBr < RI
Влияние природы нуклеофила.
Нулеофильность – это способность частицы взаимодействовать с атомом углерода, несущим целый или частичный положительный заряд. Нуклеофильность является кинетической характеристикой и определяется константами скоростей соответствующих реакций.
Нуклеофилы, как и основания, могут быть сильными и слабыми. Единой шкалы нуклеофильности не существует, так как относительная сила нуклеофила может изменяться в зависимости от природы субстрата и растворителя. Однако можно выделить следующие основные закономерности:
1) отрицательно заряженные нуклеофилы сильнее, чем нейтральные молекулы (сопряженные им кислоты):
OH - > H 2 O; RO - > ROH; NH 2 - > NH 3
2) для элементов одного периода с ростом электроотрицательности атома нуклеофильность уменьшается:
NH 2 - > OH - > F -
R 3 C - > RNH 2 - > RO - > F -
3) электронодонорные заместители увеличивают, электроноакцепторные – уменьшают нуклеофильность. Например, для кислородсодержащих нуклеофилов установлен следующий ряд реакционной способности:
RO - > OH - > ArO - > RCOO -
В рассмотренных примерах порядок нуклеофильности реагентов совпадает с порядком их основности и объясняется теми же причинами. Однако сила нуклеофила определяется не только его основностью, но и поляризуемостью .
4) Для элементов одной подгруппы с возрастанием заряда ядра нуклеофильность увеличивается, несмотря на уменьшение основности:
I- > Вr- > Cl- > F-
Рост нуклеофильности связан с увеличением поляризуемости атомов и ионов по мере увеличения их радиуса. Чем выше поляризуемость нуклеофила, тем легче деформируется его электронное облако и тем в большей степени он способен передать электронную плотность субстрату.
Такой порядок нуклеофильности может быть объяснен также с позиций принципа ЖМКО. Основность по Бренстеду проявляется во взаимодействии с жесткой кислотой Н+, в то время как нуклеофильность проявляется во взаимодействии с более мягким кислотным центром – атомом углерода, для которого предпочтительным будет взаимодействие с мягкими основаниями Льюиса – RS- и I-.
Относительная сила нуклеофилов зависит от природы растворителя. Чем меньше размер аниона, тем лучше он сольватируется полярными протонными растворителями (т.е. растворителями, способными образовывать с анионом водородные связи), что снижает его реакционную способность. При замене растворителя порядок реакционной способности нуклеофилов может меняться на противоположный.
В соответствии с механизмами S N 2 и S N 1 природа нуклеофила оказывает влияние на ход S N 2-реакции, так как нуклеофил участвует в лимитирующей (и единственной) стадии процесса, и не влияет на скорость реакций, протекающих по механизму S N 1, лимитирующая стадия которых протекает без участия нуклеофила.
Влияние природы растворителя
Растворитель влияет на скорость и механизм реакций нуклеофильного замещения.
Протеканию реакции по механизму S N 1 способствуют сильноионизирующие растворители. К ним относятся полярные протонные растворители (вода, спирты, карбоновые кислоты), так как они хорошо сольватируют ионные интермедиаты: отрицательно заряженную уходящую группу – за счет водородных связей, карбокатион – за счет свободных пар электронов.
Влияние растворителя на SN2-реакции проявляется в меньшей степени и зависит от распределения зарядов в исходном и переходном состояниях. Как правило, их скорость уменьшается с ростом полярности растворителя и увеличивается при переходе от протонных растворителей к апротонным (диметилформамид, диметилсульфоксид, ацетонитрил). В апротонных растворителях, которые не способны к образованию водородных связей, нуклеофил (а это, как правило, анион) в меньшей степени сольватирован и, следовательно, обладает большей силой, что важно для S N 2-реакции.
Таким образом, протеканию реакций по механизму S N 2 способствуют:
- субстрат с углеводородным радикалом малого объема (первичным);
- апротонный растворитель;
- сильный нуклеофил.
Реализации механизма S N 1 способствуют:
- субстрат с углеводородным радикалом разветвленного строения (третичным);
- полярный протонный растворитель;
- слабый нуклеофил.
По легкости замещения галогена независимо от механизма реакции галогенпроизводные располагаются в следующий ряд:
аллил- и бензилгалогениды > алкилгалогениды > винил- и арилгалогениды
Галогенпроизводные, содержащие связь (винил- и арилгалогениды), обладают очень низкой реакционной способностью. Реакция протекает по иному механизму. Малую подвижность галогена в винил- и арилгалогенидах объясняют увеличением прочности связи C-Hal за счет сопряжения пары электронов галогена с электронами π -связей:
Реакции нуклеофильного замещения галогена широко используются в органическом синтезе. С их помощью можно заменять галоген на другие функциональные группы или углеводородные радикалы и получать из галогенпроизводных любые классы органических соединений.
Примеры синтетического использования галогенпроизводных алифатических углеводородов приведены в таблице.
Таблица. S N -реакции галогенпроизводных
| Субстрат | + | нуклефил | → | продукт + уходящая группа |
| Получение спиртов | ||||
| R-Hal | + | OH - (H 2 O) | → | R-OH + Hal - (HHal) |
| CH 3 Br | + | NaOH | CH 3 OH + NaBr | |
| (CH 3) 3 CCl | + | H 2 O | → | (CH 3) 3 COH + HCl |
| CH 2 =CH-CH 2 Cl | + | H 2 O | → | CH 2 =CHCH 2 OH+HCl |
| Получение простых эфиров | ||||
| R-Hal | + | R / O - | → | R-OR / + Hal - |
| СH 3 I | + | CH 3 CH 2 O - Na + | → | CH 3 OCH 2 CH 3 + NaI |
| Получение сложных эфиров | ||||
| R-Hal | + | R / COO - | → | R / COOR + Hal - |
| CH 3 CH 2 I | + | CH 3 COO - Na + | → | CH 3 COOCH 2 CH 3 + NaI |
| Получение тиолов | ||||
| R-Hal | + | SH - | → | R-SH + Hal - |
| CH 3 СH 2 Br | + | NaHS | → | CH 3 СH 2 SH + NaBr |
| Получение сульфидов | ||||
| R-Hal | + | R / S - | → | R-SR / + Hal - |
| CH 3 СH 2 Br | CH 3 СH 2 S - Na + | → | (CH 3 СH 2) 2 S + NaBr | |
| Получение аминов и аммониевых солей | ||||
| R-Hal | + | NH 2 - | → | RNH 2 + Hal - |
| R-Hal | + | R / 3 N | → | R R / 3 N + Hal - |
| Получение нитрилов | ||||
| R-Hal | + | С N - | → | R- С N + Hal - (S N 2) |
| CH 3 СH 2 Br | + | NaCN | → | CH 3 СH 2 CN + NaBr |
| Получение нитросоединений | ||||
| R-Hal | NO 2 - | → | R-NO 2 + Hal - (S N 2) | |
| CH 3 CH 2 I | AgNO 2 | → | CH 3 CH 2 NO 2 + AgI | |
| Получение галогенпроизводных | ||||
| R-Hal | + | I - | → | R-I + Hal - (S N 2) |
| CH 3 Cl | + | NaI | → | СH 3 I + NaCl |
Винил- и арилгалогениды инертны по отношению к нуклеофильным реагентам. Замещение галогена в галогенбензолах возможно только в очень жестких условиях.
Введение электроноакцепторных заместителей в орто - и пара -положения к галогену активизируют галогенарены в S N -реакциях.
Реакции элиминирования
В процессе отщепления (дегидрогалогенирования) от молекулы галогеноводорода отщепляется HHal и образуется алкен.
Отщепление протекает под действием сильных оснований – концентрированных растворов гидроксидов щелочных металлов в спирте, алкоголятов или амидов щелочных металлов. Основания отщепляют протон в ß -положении, одновременно из молекулы уходит галоген в виде галогенид-аниона.
Если возможно образование двух разных продуктов отщепления, то преимущественно образуется наиболее замещенный у двойной связи алкен, который является термодинамически более стабильным (правило Зайцева) :
Реакции элиминирования могут протекать, по мономолекулярному (Е1) или бимолекулярному (Е2) механизмам.
Е1-реакции протекают параллельно с реакциями S N 1 и включают две стадии. Сначала образуется карбокатион, от которого затем отщепляется под действием основания протон.
Реакции Е2 протекают параллельно с реакциями S N 2 и включают одну стадию, в ходе которой одновременно происходит разрыв старых и образование новых связей.
Механизм отщепления (Е1 или Е2) определяется теми же факторами, что и соответствующие процессы нуклеофильного замещения (SN1 и SN2).
Конкуренция реакций нуклеофильного замещения и элиминирования
Процессы отщепления и нуклеофильного замещения всегда протекают параллельно, так как все нуклеофилы одновременно являются и основаниями.
Соотношение продуктов отщепления и замещения зависит от природы реагентов и условий проведения реакции. Подбирая условия реакции и реагент, можно добиться преимущественного протекания реакции в нужном направлении.
Факторы, способствующие протеканию отщепления:
1) Высокая основность реагента.
Сильные основания будут атаковать в первую очередь атом водорода в ß -положении, а не углерод. Так, под действием алкоголят-анионов, которые являются сильными основаниями, протекает в основном отщепление, в то время как менее основные тиолят-анионы реагируют по атому углерода и дают продукты замещения:
CH 3 -CHI-CH 3 + C 2 H 5 O - Na + → CH 3 -CH=CH 2 + C 2 H 5 OH + NaI
CH 3 -CHI-CH 3 + C 2 H 5 S - Na + → (CH 3) 2 CH-S-C 2 H 5 +NaI
Протеканию отщепления способствует не только высокая основность, но и большой объем реагента, что затрудняет его атаку по атому углерода. Поэтому третичные алкоголят-анионы дают, основном, продукты отщепления.
2) Малополярные растворители.
Один и тот же реагент – гидроксид калия, в водном растворе реагирует как нуклеофил с образованием продуктов замещения, а в менее полярном растворителе – спирте дает в основном продукты отщепления.
3) Высокая температура.
Реакции отщепления имеют большую энергию активации, чем реакции замещения, и поэтому их скорость возрастает в большей степени при увеличении температуры.
4) Протеканию отщепления способствует большой объем углеводородного радикала субстрата, что затрудняет атаку реагента по атому углерода. Склонность галогенпроизводных к реакциям отщепления возрастает в ряду:
первичные < вторичные < третичные
Взаимодействие оснований с третичные алкилгалогениды приводит в основном к отщеплению.
Лекция № 11
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны содержат карбонильную группу С=О. Общая формула:
Методы получения.


Химические свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов органических соединений. Их химические свойства определяются присутствием карбонильной группы. Вследствие большого различия в электроотрицательностях углерода и кислорода и высокой поляризуемости π -связи связь С=О обладает значительной полярностью (µ С=О =2,5-2,8 D). Атом углерода карбонильной группы несет эффективный положительный заряд и является объектом для атаки нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции нуклеофильного присоединения A N . Кроме того, карбонильная группа оказывает влияние на реакционную способность связи С-Н в α -положении, повышая ее кислотность.
Таким образом, молекулы альдегидов и кетонов содержат два основных реакционных центра – связь С=О и связь С-Н в α -положении:

2.1. Реакции нуклеофильного присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи. Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и дает продукт присоединения:

Активность карбонильных соединений в A N –реакциях зависит от величины эффективного положительного заряда на карбонильном атоме углерода и объема заместителей у карбонильной группы. Электронодонорные и объемистые заместители затрудняют реакцию, электроноакцепторные заместители повышают реакционную способность карбонильного соединения. Поэтому альдегиды в A N –реакциях активнее, чем кетоны:
Активность карбонильных соединений повышается в присутствии кислотных катализаторов, которые увеличивают положительный заряд на карбонильном атоме углерода:

Альдегиды и кетоны присоединяют воду, спирты, тиолы, синильную кислоту, гидросульфит натрия, соединения типа NH 2 X. Все реакции присоединения идут быстро, в мягких условиях, однако образующиеся продукты, как правило, термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание продуктов присоединения в равновесной смеси может быть низким.
Присоединение воды.
Альдегиды и кетоны присоединяют воду с образованием гидратов. Реакция протекает обратимо. Образующиеся гидраты термодинамически не стабильны. Равновесие смещено в сторону продуктов присоединения только в случае активных карбонильных соединений.

Продукт гидратации трихлоруксусного альдегида хлоральгидрат – устойчивое кристаллическое соединение, которое используется в медицине как успокаивающее и снотворное средство.
Присоединение спиртов и тиолов.
Альдегиды присоединяют спирты с образованием полуацеталей . При избытке спирта и в присутствии кислотного катализатора реакция идет дальше – до образования ацеталей

Реакция образования полуацеталя протекает как нуклеофильное присоединение и ускоряется в присутствии кислот или оснований.

Процесс образования ацеталя идет как нуклеофильное замещение ОН группы в полуацетале и возможен только в условиях кислотного катализа, когда группа ОН превращается в хорошую уходящую группу (H 2 O).

Образование ацеталей – обратимый процесс. В кислой среде полуацетали и ацетали легко гидролизуются. В щелочной среде гидролиз не идет. Реакции образования и гидролиза ацеталей играют важную роль в химии углеводов.
Кетоны в аналогичных условиях кеталей не дают.
Тиолы как более сильные нуклеофилы, чем спирты, образуют продукты присоединения и с альдегидами, и с кетонами.
Присоединение синильной кислоты
Синильная кислота присоединяется к карбонильным соединением в условиях основного катализа с образованием циангидринов.

Реакция имеет препаративное значение и используется в синтезе α-гидрокси- и α -аминокислот (см. лек. № 14). Плоды некоторых растений (например, горький миндаль) содержат циангидрины. Выделяющаяся при их расщеплении синильная кислота оказывает отравляющее действие.
Присоединение бисульфита натрия.
Альдегиды и метилкетоны присоединяют бисульфит натрия NaHSO 3 c образованием бисульфитных производных.

Бисульфитные производные карбонильных соединений – кристаллические вещества, не растворимые в избытке раствора бисульфита натрия. Реакция используется для выделения карбонильных соединений из смесей. Карбонильное соединение может быть легко регенерировано обработкой бисульфитного производного кислотой или щелочью:
Взаимодействие с соединениями общей формулы NH 2 X.
Реакции протекают по общей схеме как процесс присоединения-отщепления. Образующийся на первой стадии продукт присоединения не устойчив и легко отщепляет воду:

По приведенной схеме с карбонильными соединениями реагируют аммиак, первичные амины, гидразин, замещенные гидразины, гидроксиламин:

Образующиеся производные представляют собой кристаллические вещества, которые используют для выделения и идентификации карбонильных соединений.
2.2. Реакции по α -углеродному атому.
Кето-енольная таутомерия.
Водород в α -положении к карбонильной группе обладает кислотными свойствами, так как образующийся при его отщеплении анион стабилизируется за счет резонанса:

Результатом протонной подвижности атома водорода в α -положении является способность карбонильных соединений к образованию енольных форм за счет миграции протона из α -положения к атому кислорода карбонильной группы:

Кетон и енол являются таутомерами . Таутомеры – это изомеры, способные быстро и обратимо превращаться друг в друга за счет миграции какой-либо группы (в данном случае – протона). Равновесие между кетоном и енолом называют кето-енольной таутомерией.
Большинство карбонильных соединений существуют преимущественно в кетонной форме. Содержание енольной формы возрастает с увеличением кислотности карбонильного соединения, а также в случае дополнительной стабилизации енольной формы за счет водородной связи или за счет сопряжения.
Таблица 8. Содержание енольных форм и кислотность карбонильных соединений
Например, в 1,3-дикарбонильных соединениях подвижность протонов метиленовой группы резко увеличивается за счет электроноакцепторного влияния двух карбонильных групп. Кроме того, енольная форма стабилизируется за счет наличия в ней системы сопряженных α -связей и внутримолекулярной водородной связи:

Енолизация и образование енолят-анионов являются первыми стадиями реакций карбонильных соединений, протекающих по α -углеродному атому. Важнейшими из них являются галогенирование и альдольно-кротоновая конденсация .
Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl 2 , Br 2 , I 2) с образованием α –галогенпроизводных:

Реакция катализируется кислотами или основаниями. Скорость реакции не зависит от концентрации и природы галогена. Процесс протекает через образование енольной формы (медленная стадия), которая затем реагирует с галогеном (быстрая стадия). Таким образом, галоген не участвует в скорость-определяющей стадии процесса.

Если карбонильное соединение содержит несколько α -водородных атомов, то замещение каждого последующего происходит быстрее, чем предыдущего, вследствие увеличения их кислотности под действием электроноакцепторного влияния галогена. В щелочной среде ацетальдегид и метилкетоны дают тригалогенпроизводные, которые затем расщеплятся под действием избытка щелочи с образованием тригалогенметанов (галоформная реакция) :
Реакции конденсации
В присутствии каталитических количеств кислот или щелочей карбонильные соединения, содержащие α -водородные атомы, претерпевают конденсацию с образованием α-гидроксикарбонильных соединений.

В образовании связи С-С участвуют карбонильный атом углерода одной молекулы (карбонильной компоненты ) и α -углеродный атом другой молекулы (метиленовой компоненты ). Эта реакция носит название альдольной конденсации (по названию продукта конденсации ацетальдегида – альдоля).
При нагревании реакционной смеси продукт легко дегидратируется с образованием α,ß -непредельного карбонильного соединения:

Такой тип конденсации носит название кротоновой (по названию продукта конденсации ацетальдегида – кротонового альдегида).
В качестве метиленовой компоненты в реакциях конденсации могут выступать не только карбонильные соединения, но и другие С-Н-кислоты. Реакции конденсации имеют препаративное значение, так как позволяют наращивать цепь углеродных атомов. По типу альдольной конденсации и ретроальдольного распада (обратный процесс) протекают многие биохимические процессы: гликолиз, синтез лимонной кислоты в цикле Кребса, синтез нейраминовой кислоты.
Прежде чем рассмотреть каждый из классов производных кислот в отдельности, полезно дать общую картину их поведения, в рамках которой будет легче рассмотреть довольно многочисленные индивидуальные особенности.
Каждое производное почти всегда получают - непосредственно или косвенным путем - из соответствующей карбоновой кислоты, и его можно превратить вновь в карбоновую кислоту простым гидролизом. Большую роль в химии производных кислот играют превращения их друг в друга и в исходную кислоту. Кроме того, каждый класс имеет свои характерные реакции.
Производные карбоновых кислот, как и сами кислоты, содержат карбонильную группу Эта группа сохраняется в продуктах большинства реакций этих соединений и не претерпевает при этом видимых изменений. Однако само присутствие этой группы в молекуле определяет характерную реакционную способность этих соединений, и этот факт является ключевым для понимания их химии.
Ацильные соединения (карбоновые кислоты и их производные) обычно претерпевают реакции нуклеофильного замещения, в которых группы или замещаются на другие основные группы. Замещение протекает гораздо легче, чем замещение при насыщенном атоме углерода; в действительности многие из этих реакций вообще не происходят в отсутствие карбонильной группы, как, например, замещение на

Для объяснения свойств ацильных соединений необходимо вновь обратиться к строению карбонильной группы. Мы уже встречались с этой группой
при изучении альдегидов и кетонов (разд. 19.1 и 19.9) и знаем, каких реакций можно в общем для нее ожидать.
Углерод карбонильной группы связан с тремя другими атомами -связями; поскольку эти связи используют -орбитали (разд. 2.23), они лежат в плоскости под углом 120° (2,094 рад) друг к другу. Остающаяся -орбиталь атома углерода перекрывается с -орбиталью атома кислорода с образованием -связи; углерод и кислород, таким образом, соединены двойной связью. Часть молекулы, непосредственно примыкающая к атому углерода карбонильной группы, плоская; кислород, углерод карбонильной группы и два связанных с ним атома лежат в одной плоскости

Как электронные, так и пространственные факторы делают карбонильную группу особенно доступной для нуклеофильной атаки по углероду карбонильной группы. Эти факторы следующие: а) тенденция кислорода к получению электронов, даже если при этом на кислороде появляется отрицательный заряд; б) относительная незатрудненность переходного состояния при превращении тригонального реагента в тетраэдрический интер-медиат. Те же факторы делают ацильные соединения доступными для нуклеофильной атаки.
Однако ацильные соединения отличаются от альдегидов и кетонов природой второй стадии реакции. Тетраэдрический интермедиат, получающийся из альдегида или кетона, присоединяет протон, и образуется продукт присоединения. Тетраэдрический интермедиат, образующийся из ацильного соединения, элиминирует группу что приводит снова к тригональному соединению, и результатом реакции является замещение.

Можно понять, почему эти два класса соединений ведут себя различным образом. Легкость, с которой элиминируется группа зависит от ее основности: чем слабее основание, тем легче уходит эта группа. Для хлорангидридов, ангидридов кислот, сложных эфиров и амидов группой являются соответственно следующие: очень слабое основание умеренно слабое основание и сильные основания и Но для того чтобы произошло замещение у альдегидов или кетонов, элиминируемой группой должен быть гидрид-ион или алкил-ион которые, как мы знаем, являются самыми сильными основаниями (отметьте очень низкую кислотность и В результате в реакциях с альдегидами и кетонами вместо элиминирования всегда происходит присоединение.
(см. скан)
(см. скан)
Итак, нуклеофильное замещение в ацильной группе происходит в две стадии с промежуточным образованием тетраэдрического интермедиата. Обычно общая скорость определяется скоростью обеих стадий, но первая стадия более важна.
Скорость первой стадии (образование тетраэдрического интермедиата) определяется теми же факторами, что и реакция присоединения к альдегидам и кетонам (разд. 19.9): ей благоприятствует эффект оттягивания электронов, стабилизующий образующийся отрицательный заряд; ей препятствует наличие объемистых групп, создающих пространственные препятствия в переходном состоянии. Легкость второй стадии зависит от основности уходящей группы
Гомолитические (радикальные) реакции
Например, галогенирование алканов (реакция цепная)
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия) ;
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия);
СH 2 Cl 2 + Cl 2 hν → CHCl 3 + HCl (3 стадия);
CHCl 3 + Cl 2 hν → CCl 4 + HCl (4 стадия).
Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
CH 3 - CH 2 - CH - CH 3 + Cl 2 hν → смесь галогеналканов.
1; 4 – первичные; 3 – вторичный; 2 – третичный.
Гетеролитические (ионные)
Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
б) H 2 O → H + + OH -
Образовавшиеся ионы вступают в дальнейшие превращения, например:
CH 3 + + OH - → CH 3 OH
электрофил нуклеофил
Ионные реакции делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Примеры частиц – электрофилов:H 3 O + , H + , HCl, HNO 3 , NO 2 + , AlCl 3 и др
Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH - , Cl - , S 2- , NH 3 , H 2 O, R-OH, CH 3 O - и др
Нуклеофильные реакции – это реакции органических веществ с нуклеофилами, т.е. анионами или молекулами, которые предоставляют электронную пару на образование новой связи:
СH 3 Br (субстрат) + NaOH (реагент-нуклеофил) → CH 3 OH + NaBr
Электрофильные реакции – реакции органических соединений с электрофильными реагентами, т.е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи
C 6 H 6 (субстрат) + HO: - NO 2 + (реагент –электрофил) → C 6 H 5 – NO 2 + H –OH
Примеры нуклеофильных реакций
Нуклеофильное замещение:
Не для всех реакций можно чётко определить механизм, по которому они протекают, так как чистый S N 1 или S N 2 являются всего лишь идеальными (предельными) модельными случаями. Следует помнить, что один и тот же субстрат может реагировать с одним и тем же нуклеофилом, в зависимости от условий реакции и растворителя, как по механизму S N 1 , так и S N 2 .
Например, скорость гидролиза 2-бромпропана описывается с учётом смешанного механизма его протекания :
CH 3 −CHBr−CH 3 + HO − → CH 3 −CHOH−CH 3 + Br −
4.Алканы-органич. соединения,молекулы которых состоят из углерода и водорада,относят к углеводородам.Если молекула углеводородов содержат только простые сигма-связи,а их состав отвечает общей формуле C n H 2 n +2 ,то их относят к предельным,или парафинам.Атомы углерода в алканах наход. в состоянии sp 3 -гибридизации и четырехвалентны.Алканы образуют ряд гомологов,в котором каждый последующий член отличается от предыдущего на гомологич. Разность –CH2-группу.
Изомерия:1)изомерия углеродного скелета;
2)изомерия положения заместителя в углеродной цепи
Номенклатура:по номенкл. ИЮПАК названия предельных углеводородов характ-ся суффиксом –ан-.Парвые четыре углеводорода носят тривиальные названия,а начиная с пятого –в их основе лежит название латинского числительного в соответствии с числом ат.углерода в молекуле.Названия углеводороднх радикалов строят путем замены суффикса –ан на –ил.
Общие способы получения:
1.Реакция Вюрца(взимод-е галогенуглеводородов с щелочными Ме-Li,Na,K)
CH3Br+2Na +Br-CH32NaBr+CH3-CH3
CH3-Cl+2Na+Cl-CH3CH3-CH3+2NaCl
2.Гидрирование непред.углеводородов
CH2=CH2-этилен
CH2=CH2+H2 Pt,t CH3-CH3-этан
Физические св-ва:
1.от С1-С4-газы(б.з)
2.от С5-С22-жидкости(спец.з)
3.>С22-твердые в-ва(б.з)
Хорошо изучены до С100.Темп.кипеня или плавления их в гомологическом ряду монотонно возрастают с каждой новой –CH2-группой(яркий пример перехода кол-ва в качество).
Химические св-ва:
1.Р-ции замеш-я ат.Н:
А)прямое галогенирование(F2.Cl2.Br2)
Cl2+CH4 hv HCL+CH3Cl+CH2Cl2+CHCl3+CCl4
Фторирование(со взрывом)
Хлорирование(на свету)
Механизм хлорирования(цепной,радикальный)
Cl2 hv 2Cl .
Cl . +CH4HCl+CH3
CH3+Cl . CH3Cl-обрыв цепи
CH3 . +Cl2Cl . +CH3ClHCl+CH2Cl . и тд -рост цепи
Бромирование(нагревание,получ-е света)
Б)нитрование(-No2 гр.)-р-ция Коновалава
CH3-CH3+NO3 140C H2O+CH3-CH2NO2 нитроэтан
В)Сульфохлорирование(SO3,Cl2)
CH3-CH3+SO3+CL2 hv HCl+CH3-CH2-SO3Cl сульфахлорэтан
Г)Кретинг
CH3-CH2-CH2-CH3 Pt,t CH2=CH2+CH3-CH3
Использование в сельском хоз-ве:распр.применение отработанных масел в качестве гербицидов для уничтожения двудольных сорняков в посевах злаков и кукурузы.Большое практическое значение приобрели нефтеотходы в связи с открытием возможности примен-я их в кач-ве органич. Субстратов при выращивании некоторых штаммов дрожжевых культур для получ-я сухих белково-витаминных концентратов(БВК).
Sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28", что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Примеры соединений, для которых характерна sp 3 -гибридизация: NH 3 , POCl 3 , SO 2 F 2 , SOBr 2 , NH 4+ , H 3 O + . Также, sp 3 -гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы) и других органческих соединениях: CH 4 , C 5 H 12 , C 6 H 14 , C 8 H 18 и др. Общая формула алканов: C n H 2n+2 . Общая формула циклоалканов: C n H 2n . В предельных углеводородах все химические связи одинарные, поэтому между гибридными орбиталями этих соединений возможно только σ-перекрывание.
sp 3 - Гибридизация характерна для атомов углерода в насыщенных углеводородах (алканах) – в частности, в метане

Рис.2 Схема электронного строения молекулы метана
6.Алкены-органич.соединения,молекулы которых состоят из ат.углерода и водорода и помимо простых сигма-св. содерж. Еще и двойную пи-св.Их состав отвечает общей формуле CnH2n.что означает налич. В их сост. Молек. Дефицита 2 ат. Водорода в сравнении с алканами.
Этилен CH2=CH2
Электронная природа двойной связи: С точки зрения электронных представлений двойная связь осуществляется двумя парами электронов, принадлежавших двум связываемым углеродным атомам. Одна пара электроновобразует при этом обычную ковалентную σ-связь, вторая же пара электронов образует связь иного характера, так называемую π-связь. Особая конфигурация электронных облаков π-связи обусловливает фиксирование направлений остальных четырех ковалентных σ-связей при таких двух углеродных атомах. Эти связи оказываются лежащими в одной плоскости и располагаются под углами 120° друг относительно друга и относительно направления σ-связи между атомами углерода, связанными двойной связью.Двойная связь энергетически не является вдвое более прочной по сравнению с простой связью. Соответствующие энергии связей для С-С и С=С составляют 79,3 и 140,5 ккал/моль.
Изомерия:
1.углеродный скелет
CH2=CH-CH2-CH2-CH3 пентен-1
CH2=C(CH3)-CH2-CH3 2-метилбутен-1
2.полож-е заместителя
CH2=CH-CH(CH3)-CH3 3-метилбутен-1
3.полож-е дв.связи в углеводородной цепи
CH3-CH=CH-CH2-CH3 пентен-2
4.геометрическая(цис-,транс-)
Номенклатура:
Пользуются ИЮПАК-номенкл.Отличительной особенностью является необходимость выбирать в случае алкенов в качестве главной углерод-углеродную цепь,включающую в себя дв.св.,а характер. Алканам суффиксы –вн а алкенах заменять на –ен.Например:
Способы получения:
1.Крекинг алканов.Заключается в термическом разложении алканов с более длинной цепью углер.атомов до смеси алканов и ненасыщ.углеводородов с короткой цепью и водорода при 500-700 С и высоком давл.:
2.Дегидратация спиртов.Протекает в присутствии катализатора –оксида алюминия и водоотнимающих средств при обязат.дополнит.нагревании и в согласии со схемой(по правилу А.Зайцева:отщепление воды от спиртов происходит с участием гидроксильной группы за счет ат.водорода соседнего и наименее гидрогенизированного ат.углерода) :
3.Дегалогенирование дигалогенпроизводных углеводородов протекает в присутствии активных двухвалентный металлов(Mg,Zn) при нагревании,по схеме:
4.Восстановление алкинов(насыщение трйной связи активным водородом)в зависимости от типа использованного катализатора приводит к образованию цис- или транс-алкенов по схеме):
5.Дегидрогалогенирование моногалогенуглеводородов спиртовой щелочью протекает при темп. Кипения спирта
Sp2-гибридизаця
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Атомы углерода в sp 2 -гибридном состоянии образуют такие аллотропные формы как графит, графен, фуллерены и другие наноструктуры.
sp 2 -Гибридизация характерна для атомов С, N, O и др. с двойной связью (sp 2 -атомы выделены красным цветом):H 2 C
=C
H 2 (анимация, 21,3 Кб), H 2 C
=C
HR, R 2 C
=N
R,
R-N
=N-
R, R 2 C
=O
, R-N
=O
, а также для катионов типа R 3 C + и свободных радикалов R 3 C
.
Электронная модель молекулы этилена.

Цис-,транс-изомерия на примере бутена -2.
Цис-бутен2, транс-бутен2
Геометрическая, или цис-транс-изомерия - эт вид пространственной изомерии, зависящей от различного расположения атомов по отношению к плоскости двойной связи. Дис-изомером называется такой изомер, у которого одинаковые атомы (или атомные группы) расположены по одну сторону плоскости двойной связи.
8.Алкины-органич.соединения,молекулы которых сост. Их атомов углерода и водорода и помимо простых сигма-связей содержат еще и не менее двух двойных пи-всязей;присутствует одна тройна связь.Их состав отвечает общей фотрмуле CnH2n-2,что означает означает наличие в сравнении с алканами дефицита сразу 4-ёх ат.водорода в молекуле.
Ацетилен C2H2();пропин()
Природа тройной связи:
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях . Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.


На представленной выше диаграмме приведены молекулярные орбитали этилена и ацетилена.
Изомерия:
1.углеродного скелета
2.положение заместителя
3.Положение тройной связи(этот вид изомерии для этого вида цепи невозможен,тк. Не зватает длины угл.цепи)
Номенклатура:ИЮПАК.При этом окончание-ин,характеризующие наличие тройной связи:
Способы получения:
1.Дегидрирование алкенов
CH2=CH2 этилен Kt,t H2+HC=CH аустилен
2.Двойной дегидрогемогенорование дигалогенуглеводородов(-2НХ)
3.Карбидный метод(только для ацитилена)
А)>60% в химич.пром-ти
Б)>30%в технике >3000С
Химические св-ва:
1.Реакции замещения атомов Н при ат. С с тройной св.
А)замещ=е на металл(Na,k,Cu)
Б)замещ-е на галоген(Cl,Br)
2.Реакции с участием пи-св.
А)присоед-я
Присоед-я с водой (р.Кучерова)
3.Р-ии полимеризации
А)димеризация
Вопрос 9.Sp-гибридизация.электронная модель мол ацетилена.качественная реакция на ацетилен. sp-гибридизация (характерна для алкинов).Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов Простейший член и родоначальник гомологич ряда у/в-ацетилен С2Н2. Атомы С в ацетилене объединены тремя общими парами электронов, т.е.связаны тройной С===С связью. Строение мол ацетилена: н-с===с-н. исходя из SP-гибридного состояния атС у тройной связи,строение молекулы ацетилена можно представить как результат перекрывания 2-х гибридных (s и р х) орбиталей от каждого соседнего атС. При этом гибридные sp-орбитали расположены на одной прямой,образуя угол в 180. (см в уч и тет сроение мол ацетилена) наличие двух П-связей и sp-гибридных орбиталей приводит к резкому увеличению электронной плотности между ат Н. (см рис в тет) как следствие оч слабая связь С-Н.
Методы получения: дегидрирование алкенов
Карбидный метод(для ацетилена)
1.Реакция замещения атН при ат С трйной св.: а) замщение на Ме(Сu, Нg)
(р-ия алкиннов Сu-качественная р-ия на эти алкины)
Замещение на галоген(хлор,бром)
Вопрос 10. Хим св-ва алкенов и алкинов.
Алкены.1.Р-ии присоединения: а) галогенов
Это р-ия явл качественной ре-ей на двойную связь
Б) галогенводородов
Правило Марковникова: любая электрофильная частица присоед-ся к молекуле несимметричного алкена по месту разрыва п-связи к более гидрогенизованному ат С,а процесс протекает через стадию образования наиболее стабильного карбкатиона.
Г)окислительное гидроксилирование(р-ия Вагнера)
Эту р-ию часто используют для обнаружения двойной связи (качествен р-ия)
2. полимеризация-р-ия объединения большого числа одинаковых или разных молекул в одну новую большую молекулу.
3.замещение атН
Алкины 1. Р-ия замещения ат Н при атС тройной связи: а) замещение на Ме(К, Nа,Сu)
Б)замещение на галоген
Р-ия с учетом П-связи а)р-ия присоединения
Б)присоединени с НОН (р-ия Кучерова)
3.р-ия полимеризации:а) димеризация I
Б)димеризация II
Значение их: из индивидуальных ненасыщенных у/в следует отметить биогенное значение этилена СН2=СН2. Процессы созревания плодов и ягод сопровождается обязательным образованием этилена в их кожуре.отмечена способность этилена стимулировать процессы корнеобразования и вызывать листопад у некот растений.этилен приводит к заметному ускорению сроков их созревания. Подобным свойством обладает и простейший алкин- ацетилен.
Вопрос11. Циклоалканы- это циклические предельные углевоороды. СnH2n-общ формула. (строение их см в тет)
Теория напряжения циклов Байера- предполагает,что атомы С в циклоалканах образуют плоский замкнутый цикл,в кот валентные углы простой С-С-связи отличаются от тетраэдрического,наименее напреженного валентного угла в молекуле метана. При этом чем сильнее валентный угол в циклоалканах отличается от тетраэдрического,тем сильнее напряжены их молекулярные циклические скелеты. По Байеру величина напряжения должна уменьшаться от циклопропана до циклопентана,а затем вновь возрастать в циклогексане. Конформа́ция молекулы-пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей. Кольца в циклоалканах (за исключением циклопропана) - неплоские. Так, циклобутан имеет слегка вспученную форму - один из углеродных атомов располагается выше или ниже плоскости, в которой находятся три остальных атома, циклопентан - конформацию конверта или твист-конформацию, циклогексан может существовать в двух конформациях кресла, при переходе между которыми (через конформацию ванны) все аксиальные заместители становятся экваториальными и наоборот. Для циклов больших размеров число конформаций возрастает, поэтому такие соединения существуют в виде нескольких взаимопревращающихся конформеров. Так, для циклогептана возможны 4 устойчивые конформаций: искаженное кресло (твист-кресло), кресло, ванна, искаженная ванна (твист-ванна), для циклооктана - 11 конформаций.
Хим св-ва: (лекция и учеб.)
Вопрос12 Арены- это углеводородные производные бензола,включая сам бензол(С6H6).впервые бензол был открыт Фарадеем.
Простейшие представители (одноядерные арены):

Многоядерные арены: нафталин С 10 Н 8 , антрацен С 14 Н 10 и др.

Понятие об ароматичности: термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл.Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе. К ароматическим соед-иям относятся бензо и в-ва,напоминающие его по своему химич поведению.
Правило Хюккеля, согласно кот ароматическим будет всякое органич соед-ие,удовлетворяющее след уловиям:1.наличие замкнутого и опланарного(плоского) цикла.2.беспрерывность сопряжения Р-электронов всех П-связей.3.число Р-эл.,участвующих в сопряжении,должно соответствовать формуле:4n+2(n-целое число).
Методы получения: 1. Дегидрирование соответствующих циклоалканов-успешно пртекает над Pt-катализатором при t ок.300С.
2.ароматизация алканов
3.тримеризация алкинов
Теория электрофильного замещения:электрофильными явл.в-ва с дефицитом электронов,а также кислоты. Реакции электрофильного замещения-реакции замещения, в которых атаку осуществляет электрофил-частица, заряженная положительно или имеющая дефицит электронов.
1.р-ии замещения ат.Н бензольного кольца.
А)галогенирование
Б)алкилирование (р-ия Фриделя-Крафтса)
2.р-ии присоед-ия по бензольному кольцу
А)гидрирование.
Б)хлорирование
3.окисление алкильных производных бензола.
Вопрос13. Алкадиены . Диены-орг.соед-ия,молекулы кот сост.из ат. С и Н и помимо простых б-связей содержат еще и две двойные П-св. Их общ.формула СnH2n-2.
Классификация диенов основана на взаиморасположении 2-х двойных С=С связей в их молекулах. По этому признаку их дел.на след группы:1.кумулированные –диены с соседним расположением двух П-связей,кот имеют общ формулу:R-CH=C=CH2. Прочтейший представитель- аллен СН2=С=СН2,поэтому их еще наз.алленами. 2.сопряженные-диены с чередующимся расположением связей и общ формулой:R-CH=CH-CH=CH2. 3. Изолированные-диены с расстоянием между П-св.,превышающим одну простую б-св.,с общ. формулой:R-CH=CH-(CH2)n-CH=CH2, где n=1,2 и более.
ИЮПАК-номенкл.:выбор главной цепи углеродных атомов и нумерацию атомов проводят так,чтобы положения двойных связей обозначались наименьшими числами,а для указания кол-ва двойных связей исп-ют суфф.-диен. Например:

Простейший член сопряженных диенов-бутадиен: СН2=СН-СН=СН2. Четыре ат.С в бутадиене объединены общими парами электронов,кот образуют две,чередующиеся с простой б-св,двойных П-св. Это общая отличительная особенность строения всего класса сопряженных диенов. Углеводороды с сопряженными двойными связями получают:1)дегидрированием алканов, содержащихся в природном газе и газах нефтепереработки, при пропускании их над нагретым катализатором
CH 3 –CH 2 –CH 2 –CH 3 –– ~600°С; Cr 2 O 3, Al 2 O 3- CH 2 =CH–CH=CH 2 + 2H 2
2)дегидрированием и дегидратацией этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод акад. С.В.Лебедева
2CH 3 CH 2 OH –– ~450° С;ZnO,Al2O3 CH 2 =CH–CH=CH 2 + 2H 2 O + H 2 ,
он впервые на базе бутадиена получил бутадиеновый каучук.
Взаимодействие двух или нескольких соседних p- связей с образованием единого p- электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения.
Рассмотрим реакции галогенирования и гидрогалогенирования сопряженных диенов. 
Дивинил и изопрен вступают в полимеризацию и сополимеризацию (т.е. совместную полимеризацию) с другими непредельными соединениями, образуя каучуки. Каучуки – это эластичные высокомолекулярные материалы (эластомеры), из которых методом вулканизации (нагреванием с серой) получают резину.Реакции полимеризации. Диеновые углеводороды обладают исключительно важной особенностью: они легко вступают в реакции полимеризации с образованием каучукоподобных высокомолекулярных продуктов. Реакции полимеризации протекают с присоединением молекул друг с другом в 1,4- или 1,2-положении, а также с одновременным присоединением в 1,4-и 1,2-положения.
Бутадиен - газ (tкип -4,5°С), изопрен - жидкость, кипящая при 34°С, диметилбутадиен - жидкость, кипящая при 70°C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений
Вопрос14 .реакции полимеризации диеновых у/в.
Р-ия полимеризации-ведет к образованию полимеров из молекул мономеров в рез-те разрыва главных валентностей слабых П-связей и последовательного связывания образовавшихся радикалов друг с другом. Полимеризация диеновых углеводородов.Получение синтетического каучука-основная область применения диеновых углеводородов (главным образом бутадиена и изопрена). Натуральный каучук-полимер изопрена:n=1000-3000
Синтетический каучук в промышленном масштабе впервые по способу С. В. Лебедева: Было установлено,что многократное присоед-ие мономерного бутадиена-1,3 может происходить в положении 1,4- и 1,2- с образованием полимерной цепи,сод-ей двойные связи. В присутсвии металлического натрия.
Каучук имеет громадное значение в народном хозяйстве.
Реакции полимеризации. Диеновые углеводороды обладают исключительно важной особенностью: они легко вступают в реакции полимеризации с образованием каучукоподобных высокомолекулярных продуктов. Реакции полимеризации протекают с присоединением молекул друг с другом в 1,4- или 1,2-положении, а также с одновременным присоединением в 1,4-и 1,2-положения. Вот как выглядит фрагмент формулы продукта полимеризации дивинила (бутадиена-1,3), если присоединение молекул друг к другу идет в положение 1,4.
Аналог изопрена-хлоропрен- легко полимеризуется в полихлоропрен строения:
n (Н 2 С=СCl-СН=СН 2) → (-Н 2 С-СCl=СН-СН 2 -) 2n
Вопрос15.Галогенуглеводороды –орг.соед-ия,образующиеся при замене одного или нес кат.Н в молекуле углеводорода на галоген. если,например,в молекуле пропана,циклогексана,бензола всего один ат.Н заменить на галоген,то мы получим новый и след класс орг.соед-ий- галогенуглеводороды,например: СН3СН2СН2Сl-хлорпропан хлорбензол
Классификация: 1 . По кол-ву ат.Н в молекуле у/в,замещенных на галоген,классиф-ют на моно-,ди-,три-, тетрагалогенпроизводные.. СН3СН2Вr-бромистый этил(моно) СН2С12-хлористый метилен(ди) СНС13хлороформ(три) СС14-четыреххлористый углерод(тетра) существуют также полигалогеуг-ды. 2. В зависимости от хар-ра ат.С,с кот связаны атомы галогена,различают первичные R-CH2-Hal, вторичные R 2 СН-На1 и третичные R 3 С-На1 галогенпроиз-ые. 3. В зависимости от взаимного расположения атомов галогена разделяют на геминальные(когда оба ат галогена наход-ся у одного и того же ат С)- R-СНС1 2 и вицинальные(ат галогена наход у соседних ат С)-R-СН(С1)-СН2С1 4. В зависимости от типа и хар-ра строения скелета орг молекулы:алифатические(насыщенные и ненасыщ),циклоалифотические и ароматические. В основе названия галогенуглеводорода по номенклатуре IUPAC лежит название самой длинной неразветвленной цепи. Атомы углерода нумеруют таким образом, чтобы меньший номер получил заместитель, который в названии пишется первым, а сами заместители перечисляются в алфавитном порядке. Цепи углеродных атомов в галогенпроизводных алкенов и алкинов нумеруют с того конца, к которому ближе расположена кратная связь. СНС13-трихлорметан, СН 2 (С1)-СН 2 (С1)-1,2-дихлорэтан Для некоторых простейших галогенпроизводных углеводородов сохраняются названия, в основе которых лежит название углеводородного остатка СH 3 Cl – метилхлорид, СH 3 J – метилиодид, С 2 Н 5 Вr – этилбромид.
Индуктивный эффект (I-эффект) - это передача электронного влияния заместителей по цепи σ-связей. Этот эффект передаётся по цепи σ-связей с постепенным затуханием и, как правило, через три - четыре связи он уже не проявляется. Направление индуктивного эффекта заместителя качественно оценивают, сравнивая с со связью С-Н, полагая её неполярной, а индуктивный эффект водорода равным нулю. Электроотягивающие заместители снижают элекроную плотность в системе σ-связей, и их называют электроноакцепторными. Элекроноподающие заместители повышают электроннную плотность в цепи σ-связей по сравнению с атомом водорода, т. е. проявляют +I эффект и являются элекронодонорными. К ним относятся атомы с низкой электроотрицательностью (например, металлы), а также отрицательно заряженные атомы или группы, обладающие избытком электронной плотности, которую они стремятся перераспределить на соседние связи. Этот эффект влияет на реакционноспособность орг молекул,определяя и ск-ть р-ии,и направление атаки реагента.


Способы получения:1.промышленного фотохимич-го галогенирования(хлорир-ия или бромирования)алкенов под действием УФ-излучения СН4+С12НС1+СН3С1-хлорметан. 2.присоед-ие галогенов и галогенводородов по кратной связи а)СН2=СН-СН3(пропен)+Вr2CН2(Вr)-CH(Br)-CH3-1,2-дибромпропан б) СН2=СН2(этен)+НС1CH3CH2C1-хлорэтан
Хим св-ва:1.р-ия гидролиза: R-Hal+MeOH (H 2 O) R-OH+MeHal Нуклеофильное замещение галогена, как установлено, идет по двум механизмам SN2 – замещение нуклеофильное второго порядка(бимолекулярное) и SN1 – замещение нуклеофильное первого порядка(мономолекулярное). Порядок реакции соответствует числу реагентов, от концентрации которых зависит скорость реакции.1) SN2 – замещение наиболее характерно для первичных алкил-галогенидов. Замещение происходит через интермедиат (активированный комплекс) в одну стадию.
2) SN1 – механизм типичный для третичных алкилгалогенидов и галогенидов аллильного типа, в которых диссоциация связи C−Hal на первой стадии приводит к стабильным карбокатионам.
Р-ии отщепления галогенводорода,нуклеофильное замещение в иных реакциях(см. уч с129
Вопрос16 .Сравнительная хар-ка хим св-в алиф-их и аромат-их галогенуглеводородов
Вопрос17. Спирты и фенолы
*
Спирты-такие гидроксильный соед-ия,у кот ОН-гр.никогда не соединена с ат.С бензольного кольца. СnH 2 n +1 OH-общ формула. Классификация:
Многоатомные (2 и более он-гр.)и одноатомные(одна ОН-гр) дел-ся на первич,вторич,третич.
Изомерия: все виды изом углеродного скелета, изом положения он-гр.в углеродной цепи(пентанол-2,пентанол-3). Номенклатура июпак: прибавление к названию родонач-го у/в суфф.-ол. Если в спирте есть более старшие ф-ии,то ОН-гр обознач префиксом(окси) нумерация проводится ближе к тому концу,где расположена он-гр.
Способы получения: 1.гидратация алкенов(т.е.+воды) под действием t и Н3РО4: СН2=СН2(этилен)+НОН СН3-СН2ОН-этанол. 2.гидролиз моногалогенуглеводородов СН3-СН2Вr+ +H2O НВr+СН3-СН2ОН(этанол). 3. окисление алканов (-вода) CH3-CH2-CH3+O2 CH3-CH-CH3-пропанол-2
Хим св-ва:1.р-ии замещения атН в ОН-гр
2.замещение ОН-гр
3.дегидратация
4.окисление
*
Фенолы-гидроксильные соед-ия,у кот ОН-гр.всегда соединена с ат.С бензольного кольца.
Номенклатура:
Методы получения:1. Процесс «Дау»
2.Р-я Сергеева
Хи.св-ва: 1.р-и замещ ОН-гр нет
2.р-и замещ ат. Н в ОН-гр
3.Р-и замещ атН бенз кольца
Вопрос 18. Многоатомные спирты и фенолы.
*Многоатомные спирты-это содержащие 2 и более функц-ых ОН-гр в сос-ве мол-лы. В зависимости от кол-ва ОН-гр разделяют на двух-,трех-,четырехатомные.Двухатомные спирты(гликоли) нестабильны,в момент образ-я теряют мол-лы воды и превращ-ся в альдегиды,кетоны и к-ты.
Хим.св-ва.
Реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов:
Гликоли со спиртами обра-т продукты моно-(спиртоэфиры) и дизамещения(простые эфиры):
Физич.св-ва:
бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо - в органических растворителях; имеют высокие температуры кипения. Например, tкип этиленгликоля 198°С, плотность= 1,11 г/см 3 ; tкип глицерина = 290°С, плот=1,26г/см 3 .
Качественная реакция.
*Фенолы гидроксильные соед-ия,у кот ОН-гр.всегда соединена с ат.С бензольного кольца.
По кол-ву ОН-гр.все фенолы подразд-ся на одно-,двух-, трехатомные.
Хим.св-ва
1.р-и замещ ОН-гр нет
2.р-и замещ ат. Н в ОН-гр
3.Р-и замещ атН бенз-го кольца.
а)взаимод. Со щелочами
б)р-ии замещ. Ат Н бенз-го кольца
Физич.св-ва:
Большинство фенолов - бесцветные твердые вещества. Фенол плавится при t°=41°C. Присутствие воды в феноле понижает его температуру плавления. Смесь фенола с водой при ком-натной t° - жидкост, обладает характерным запахом. При нагревании до 70°С растворяется полностью.Фенол - антисептик, его водный раствор используется для дезинфекции и называется карболовой кислотой.
Качественная реакция:
В водных р-рах одноат. фенолы взаимод-ют с хлоридом железа (III) с образ-ем комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления синильной кислоты. 6C 6 H 5 OH + FeCl 3 = H 3 + 3HCl
Вопрос 19. Кач. р-ции на многоатомные спирты и первич.аминогруппу
Качественная реакция на многоат. спирты:
Замещ-е атН в гликолях на ионы тяж.металлов приводик к образ-ю ярко окрашенных в синий цвет внутрикомплексных хелатного типа соед. Свежеосажденный гидроксид меди с гликолями дает:
Качественная реакция на первичную аминогруппу:
Алкилирование- При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Вопрос 20. Р-ии присоед-я по карбоскильной гр: присоед Н, NaHSO 3 ,HCN,CH 3 MgCl
Вопрос 21.Р-и замещ.карбон-го О 2 у альдегидов и кетонов: взаимод.с PCl 5, NH 3 , NH 2 NH 2 , NH 2 OH.
Альдегиды-карбонил-е соед., содер-ие альдегид-ю гр.
Кетоны-органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Вопрос 22.Монокарбоновые кислоты. Изомерия, номенклатура, способы получения. Строение карбоксильной группы, хим.св-ва.
Монокарбоновые кислоты-одноосновные карбоновые кислоты содержат одну карбоксильную группу, связанную с углеводородным радикалом (предельным, непредельным, ароматическим).
Способы получения:
1.Окисление соответствующих альдегидов.
2.Гидролиз гимениальных тригалогенуглеводородов.
3.Гидролиз нитрилов.
Строение карбоксильной группы:

Хим.св-ва: 1.Р-ии замещ. Ат Н ОН-гр. Взаимод-е со щелочами.(р-я нейтрализации).
2.Р-ии замещ. ОН-гр. а)Образов-е сложных эфиров:
б)образ-е ангидридов:
в)образ-е галогенангидридов:
3.Потеря ОН-гр
4.Р-я по радикалу R
Вопрос 23.Как зависит кислотность карбоновых кислот от величины и хар-ра радикала. Как влияет присутствие акцепторных заместителей и их положение в мол-ле? Ответ обоснуйте.
Вопрос 24. Функциональные производные карбоновых кислот: соли, слож.эфиры,ангидриды и галогенангидриды, амиды, нитрилы. Получение и св-ва.
Карбоновые к-ты проявляют высокую реакционную способность. Они вступают в р-ии с различными вещ-ми и образуют разнообразные соед-ия, среди кот. большое знач. имеют функц-ые производные, т.е. соединения, полученные в рез-те р-ий по карбоксильной группе.
1. Образование солей
. а) при взаимодействии с металлами: 2RCOOH + Mg ® (RCOO)2Mg + H2
б) в реакциях с гидроксидами металлов: 2RCOOH + NaOH ® RCOONa + H2O
2. Образование сложных эфиров
R"–COOR": (р-я этерификации)Сложные эфиры низших карб. к-т и простейших одноат. спиртов - летучие бесцвет. жидк.с характерным фруктовым запахом. Слож. эфиры высших карб. к-т - бесцвет. Тв. вещ-ва, темп.плав. зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
3.Образование ангидридов.
Уксусный ангидрид представляет собой бесцветную прозрачную подвижную жидкость с резким запахом.
Уксусный ангидрид часто применяется в реакциях ацилирования.
4.Образование галогенангидридов.
Галогенангидриды являются высокореакционноспособными веществами и широко используются в органическом синтезе для введения ацильной группы (реакция ацилирования).
5. Образование амидов.
Амид муравьиной к-ты - жидкость, амиды всех др. к-т - белые кристалл-ие вещ-ва. Низшие амиды хорошо растворимы в воде. Водные р-ры амидов дают нейтральную р-ию на лакмус.
Важнейшее св-во амидов - способ-ть их к гидролизу в присутствии кислот и щелочей
6.Образование нитрилов
(дегидратацией амидов)
25. Дикарбоновые кис-ты - орган. Соединения, содерж в своем сос-ве молекул две карбоксильные группы. Формула:HOOC-R-COOH. Способы получения. При окислении этиленгликоля образуется щавеливая к-та HO-CH 2 CH 2 -OH
Гидролиз динитрилов:N=C-CH 2 CH 2 -C=NNH 2 OC-CH 2 CH 2 -CONH 2 HOOC-CH 2 CH 2 -COOH
Окисление циклических кетонов при помощи конц азотной к-ты
Химические св-ваHOOC –R- COOH + CH 3 OHHOOC – R- C-O-CH 3 + H 2 O
HOOC-R-C-OCH 3 + CH 3 OH CH 3 –O-C-R-C-O-CH 3
Нагревание щавелевой и малоновой к-т с выделением CO 2 и образованием монокарбоновых к-т
HOOC-COOH HCOOK + CO 2 HOOC-CH 2 -COOH CH 3 - COOH +CO 2
Малоновая к-та и ее диэтиловый эфир.
Терефталевая к-та –твердое кристаллическое, высокоплавкое, белого цвета в-во; получается окислением n-ксилола
Непредельные к-ты содержат в своем сос-ве одну или несколько кратных связей. Для них харак-ны все известные р-ии по карбоксильной группе и все р-ии, присущие соедин. Этиленового ряда. Акриловая к-та- 1-й член гомол ряда непредк-т, получается окислением акролеина
В промышленности из окиси этилена и синильной к-ты
Взаимное влияние П –связей и в а – положении орган радикала и П - связи С=О группы карбоксила приводит к поляризации первой, что вызывает ориентацию присоедгалогенуглеводородов против правила Марковникова:
Акрилонитрил-продукт многотоннажногохим синтеза; поучают дегидратацией оксинитрила либо каталитприсоедин синильной к-ты к ацетилену при 80 С
Фумаровая и малеиновая к-ты- изомерные соедин-я, получаемые дегидротацией яблочной к-ты
Геометрические изомеры образуют и длинноцепочечные высшие жирные к-ты. Например, жидкая и маслянистая олеиновая к-та в процессе медленного нагревания в присуткаталитич количеств NO 2 изомеризуется с образ уже твердого в обычных условиях транс- изомера – элаидиновой к-ты строения:
26. Важнейшие функц группы в орг химии.
Спирты- это производные углеводородов, содерж в молекуле одну или несколько гидроксил групп-ОН у насыщенных атомов углерода.Кислородосодерж орган соединения. По строению делятся на предельные (алканолы) СН 3 ОН метанол, ароматические –фенилметанол, непредельные: алкенолы СН 2 =СН-СН 2 ОН пропен-2-ол-1, алкинолы НС С-СН 2 ОН Пропин-2-ол-1качеств р-я на одноатомные первичные спирты - оксид меди (прокаленная медная проволока). Спирты при этом окисляются до альдегидов, на проволоке образуется слой восстановленной меди.
Сн3 - СН2 - ОН + СuO =CH3 - COH + Cu + H2Oна многоатомные
 Простейшая качественная реакция на спирты - окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
Простейшая качественная реакция на спирты - окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
CH 3 -CH 2 -OH + CuO -t-> CH 3 -CHO + Cu + H 2 OСпирты идентифицируются пробой Лукаса - конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида:
CH 3 -CHOH-CH 3 + HCl -ZnCl 2 -> CH 3 -CHCl-CH 3 ↓ + H2O
Первичные спирты в реакцию не вступают.Еще одним известным методом является иодоформная проба:
CH 3 -CH 2 -OH + 4I 2 + 6NaOH --> CHI 3 ↓ + 5NaI + HCOONa + 5H 2 OКачественные реакции на многоатомные спирты.
Наиболее известная качественная реакция на многоатомные спирты - взаимодействие их с гидроксидом меди (II). Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. К примеру, при приливании глицерина образуется глицерат меди (II): Карбонильные соединения(оксосоединения)-
это производные УВ, содерж в молекуле карбонил группу С=О
Карбонильные соединения(оксосоединения)-
это производные УВ, содерж в молекуле карбонил группу С=О
Оксосоед делятся на альдегиды и кетоны. Альдегиды-это орган соед-я, молекулы которых содержат альдегидную группу, связанную с УВ радикалом С=О Р-я с аммиачны раствором оксида серебра(1) и щелочным раствором сульфата меди (2) явл-ся качественными р-ями.
CH 3 -CHO + 2OH -t->CH 3 -COOH + 2Ag↓ + 4NH 3 + H 2 Oреакцией серебряного зеркала
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
HCOOH + 2OH -t-> CO 2 + 2H 2 O + 4NH 3 + 2Ag↓
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH) 2 . Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO 4 + 2NaOH --> Na 2 SO 4 + Cu(OH) 2 ↓
CH 3 -CHO + 2Cu(OH) 2 -t-> CH 3 -COOH + Cu 2 O↓ + 2H 2 O
Выпадает оксид меди (I) Cu 2 O - осадок красного цвета.Еще один метод определения альдегидов - реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера:
CH 3 -CHO + K 2 + 3KOH --> CH 3 -COOK + Hg↓ + 4KI + 2H 2 Карбоновые кислоты
- это производные УВ, содержфункцион карбоксил группу СООН. Формула: В зависимости от строения углеводородного радикала карбоновые к-ты делятся на предельные R=алкил, непредельные- производные непредельных УВ, ароматические. Азотосодержащие органические соединения. Амины- это производные аммиака(NH 3), в молекуле которого один, два или три атома водорода замещены УВ радикалами. Аминокислоты-это произодные УВ, содерж аминогруппы(-NH 2) и карбокс группы Качественные реакции на амины.
На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO 2 . Для начала нужно ее приготовить, а затем добавить амин:
NaNO 2 + HCl -->NaCl + HNO 2 Первичные дают азот N 2:CH 3 -NH 2 + HNO 2 -->CH 3 -OH + N 2 + H 2 OВторичные - алкилнитрозоамины - вещества с резким запахом (на примере диметилнитрозоамина):
CH 3 -NH-CH 3 + HNO 2 --> CH 3 -N(NO)-CH 3 + H 2 OТретичные амины в мягких условиях с HNO 2 не реагируют.Анилин образует осадок при добавлении бромной воды:
C 6 H 5 NH 2 + 3Br 2 --> C6H 2 NH 2 (Br) 3 ↓ + 3HBr
Оксикислоты
Оксикислотами называются органические карбоновые кислоты,
групп. Число карбоксильных групп определяет основностьоксикислоты. По
числу гидроксилов, включая и входящие в состав карбоксильных групп,
определяют атомность оксикислот.
Простейшие оксикислоты обычно называют поих природным
источником.
Например:
Молочная кислота – одноосновная, двухатомная кислота;
была открыта Шeeле в прокисшем молоке, откуда и получила свое название.
HOOC-CH2-CН COOH
OH -яблочная, двухосновная, трехосновная
(содержится в яблоках).
HOOC-CH-CН COOH
НO OH -винная кислота, двухосновная, четырехатомная
(была выделена из «винного камня» - отхода, получаемого при изготовлении
и выдержке виноградных вин).
НOOC-CH2-C СН2СOOH
Лимонная кислота, трехосновная,
четырехатомная, была выделена из листьев лимона.
Очень часто оксикислоты получают названия как оксипроизводные
соответствующих карбоновых кислот. В зависимости от положения
оксигруппы по отношению к карбоксильной различают α-, β-, γ- и т.д.
оксикислоты (гидрокси – по ИЮПАК).
Способы получения
1. Гидролизгалогензамещенныхкислот.
Это удобный способ синтеза α-оксикислот, из-за доступности α-
галогензамещенных кислот.
2. Получениеизальдегидов, кетонов (циангидринный синтез, получение α-
оксикислот).
3. Восстановлениеоксокислот.
4. Изаминокислот.
5. Изнепредельныхкислот.
6. Окислениеоксиальдегидов (альдоли) и гликолей.
Например, окисью серебра в аммиачном растворе, получают оксикислоты
с различным строением в зависимости от положения соответствующих групп
в исходном соединении:
7. Окислениекислот с третичныматомомуглерода, находящимсяв α-
положении к карбоксилу.
8. Гидролизлактонов.
циклогексанон-капролактон 6-гидроксигексановая кислота
Многие из оксикислот получают специфическими методами или же
извлекают из растительных и животных продуктов.