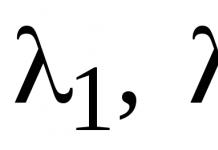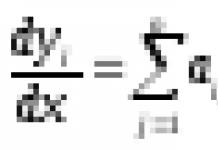Общий вид реакций электрофильного замещения:
R − X + Y + → R − Y + X + {\displaystyle {\mathsf {R\!\!-\!\!X+Y^{+}}}\rightarrow {\mathsf {R\!\!-\!\!Y+X^{+}}}} (катионный электрофил)
R − X + Y − Z → R − Y + X − Z {\displaystyle {\mathsf {R\!\!-\!\!X+Y\!\!-\!\!Z}}\rightarrow {\mathsf {R\!\!-\!\!Y+X\!\!-\!\!Z}}} (нейтральный электрофил)
Выделяют реакции ароматического (широко распространены) и алифатического (мало распространены) электрофильного замещения. Характерность реакций электрофильного замещения именно для ароматических систем объясняется высокой электронной плотностью ароматического кольца, способного притягивать положительно заряженные частицы.
Реакции ароматического электрофильного замещения играют крайне важную роль в органическом синтезе и широко используются как в лабораторной практике, так и промышленности.
Энциклопедичный YouTube
1 / 5
✪ Электрофильное Ароматическое Замещение
✪ Механизм электрофильного ароматического замещения
✪ Алкены. Механизм реакции электрофильного присоединения.
✪ Механизмы химических реакций. Ч.2. Классификация механизмов. Электрофильные и нуклеофильные реакции.
✪ Классификация реакций: нуклеофилы, электрофилы, радикалы
Субтитры
Мы с вами уже говорили о бензольном кольце. Так, я плохо его нарисовал, давайте я его перерисую. Итак, мы уже обсуждали, что стабильность бензола связана с его ароматичностью. Вот эти электроны на этих π-орбиталях, формирующие двойные связи, принадлежат не только этим связям. Они находятся в постоянном движении. Этот может пойти сюда. Этот - сюда. А этот - вот сюда. Электроны не просто перемещаются туда-сюда. Они «циркулируют» по всему кольцу. Таким образом, ароматическая молекула оказывается более стабильной. Мы уже видели примеры ароматических соединений или, правильнее сказать, мы видели примеры бензольного кольца с введенными заместителями, галоген заместителями или же OH-группой. В этом видеоуроке мне хотелось бы подробнее рассмотреть, как можно присоединить заместитель к бензольному кольцу. Сегодня мы будем изучать электрофильное ароматическое замещение. Давайте запишем. Электрофильное ароматическое замещение. Вы можете справедливо заметить: «Сэл, ты сказал, что ты добавляешь заместители». Но в действительности у бензола уже есть шесть атомов водорода. Здесь один водород, два водорода, три водорода, четыре водорода, пять водородов и, наконец, шесть водородов. Они всегда есть у бензола. И, даже не рисуя их, мы их подразумеваем. Когда мы добавляем хлор или же бром, или же OH-группу, то мы замещаем их на один из атомов водорода. Потому это называется «замещением». А «ароматическое», потому что мы имеем дело с бензольным кольцом. Итак, мы будем рассматривать ароматическую молекулу и мы увидим, что чтобы замещение прошло, нам понадобится очень сильный электрофил. Давайте попробуем представить, как это произойдет. Но прежде позвольте я скопирую и вставлю рисунок, чтобы его не перерисовывать. Давайте скопируем его. Допустим, у нас есть действительно сильный электрофил. В следующем видеоуроке мы рассмотрим несколько конкретных примеров, чтобы вы понимали, что такое сильный электрофил. Но, думаю, слово «электрофил» уже само по себе наводит на мысль, что это что-то, что любит электроны. Электрофил хочет заполучить электроны очень, очень и очень сильно. И обычно у электрофила положительный заряд. Итак, он требует электроны. Давайте немного проясним этот момент. Не будем писать, что электрофилу нужны электроны. Потому что, когда мы говорим об электрофилах или нуклеофилах, то мы имеем в виду их реакционную способность. Запишем это по-другому: принимает электроны. Действительно очень, очень и очень хорошо принимает электроны. Что же произойдет? Как мы уже сказали, бензол это стабильная молекула. Вот эти электроны, эти π-электроны постоянно циркулируют. Что же произойдет, если такая молекула столкнется определенным образом с молекулой электрофила? Давайте обозначим вот этот электрон здесь. Как видно из рисунка, он находится у этого атома углерода. Я думаю, это понятно, что углерод находится здесь. Хотя толком я его и не нарисовал. Но если этот, хорошо принимающий электроны электрофил, столкнется определенным образом с бензолом, то этот электрон перейдет к электрофилу. Итак, таким образом… Давайте я просто скопирую и вставлю первоначальную молекулу. Итак, что же теперь изменилось? Вот этой связи у нас больше нет. Этот углерод теперь связан с электрофилом. Проясним это. Этот электрон раньше был тут. Этот электрон по-прежнему принадлежит этому углероду, а другой электрон переходит к электрофилу, который с удовольствием забирает его себе. Итак, теперь этот электрон принадлежит электрофилу. Электрофил, таким образом, получил электрон. До этого он был положительно заряжен, а теперь нейтрально. Повторюсь, что конкретные примеры мы рассмотрим в следующих видеоуроках. Вернемся к замещению. Эту связь мы теперь наблюдаем вот тут. Этот атом углерода вот тут потерял электрон. И поскольку он потерял электрон, на нем появится положительный заряд. На самом деле проделать такое с резонансно-стабилизированной молекулой не просто. Поэтому, как я уже неоднократно говорил, участвовать в реакции должен действительно сильный электрофил. Стоит отметить, что получившийся карбокатион относительно стабилен. И, несмотря на то, что это всего лишь вторичный карбокатион, он оказывается стабильным благодаря резонансу. Этот электрон может перейти к карбокатиону. Если это произойдет, мы получим вот что. Давайте перерисуем кольцо. Нарисуем резонансные структуры как можно быстрее. Здесь у нас водород. Здесь электрофил. Вообще-то, это больше не электрофил, просто обозначаем этот заместитель буквой «E». Здесь водород. Здесь двойная связь. Давайте нарисуем ее немного аккуратнее. Здесь у нас водород. Здесь водород, здесь водород и вот тут. И я сказал, что эта структура стабилизирована. Электрон отсюда может перепрыгнуть сюда. Если этот электрон перейдет вот сюда, то двойная связь теперь окажется здесь. Еще раз. Электрон перейдет сюда и двойная связь теперь тут. Этот атом углерода отдал свой электрон и теперь он положительно заряжен. Вот почему такая структура оказывается резонансно-стабилизированной. Электрон может вернуть нас к предыдущей структуре, а может сам перескочить вот сюда. Давайте я опять перерисую все это. Нарисуем сразу все атомы водорода. Вот здесь у нас заместитель и атом водорода. Еще водород здесь, еще здесь, здесь и здесь. Обычно столько внимания водородам не уделяют, но поскольку один из этих атомов будет отщепляться в процессе механизма, в данном случае я предпочитаю их обозначить, чтобы не забыть, что атомы водорода здесь есть. Вернемся к резонансной стабилизации. Если это электрон перейдет сюда, тогда эта двойная связь окажется здесь. Этот атом углерода потерял электрон и теперь несет положительный заряд. Вот эту двойную связь, которая была здесь сверху, рисуем там же, где она и была. Мы можем переходить от одной структуры к другой. Электроны постоянно перемещаются по кольцу. Безусловно, мы говорим не о такой сильной стабилизации, если бы эта молекула была полностью ароматической. Электроны перемещались по π-орбиталям снова и снова, тем самым стабилизируя структуру. Но этот карбокатион все равно относительно стабилен благодаря «циркуляции» электронов по кольцу. Мы также можем считать, что этот положительный заряд «размазывается» между этим углеродом, этим углеродом и вот этим углеродом. Тем не менее, стабильности этому соединению не хватает. Молекула вновь хочет стать ароматической, вернуть себе стабильное состояние. И для того, чтобы вернуться в стабильное состояние, карбокатиону нужно каким-то образом получить электрон. Способ, с помощью которого карбокатион может заполучить электрон, заключается в том, чтобы основание из окружающей среды отщепило этот протон, протон атома углерода, который также связан с электрофилом. Итак, это основание отщепляет протон. Мы говорим только про ядро водорода, так как электрон водорода остается здесь. Давайте нарисуем это другим цветом. Точнее, это электрон, который был у водорода, теперь он переходит к атому углерода вот сюда. Такое пересечение линий выглядит немного запутанно. Электрон может перейти к этому углероду. Что же мы тогда получим? А получим мы вот что. Итак, если это произойдет… Давайте нарисуем желтым наше шестичленное кольцо. Теперь нарисуем все водороды. Какой бы цвет выбрать? Давайте нарисуем их вот таким зеленым. Итак, рисуем все атомы водорода. Теперь давайте не будем спешить. Вот этот водород, точнее только его ядро, отщепило основание. Таким образом, атом водорода перешел к основанию. Вот этот электрон был передан атому водорода. Итак, один электрон перешел к этому водороду, а второй электрон по-прежнему принадлежит основанию. Мы получили сопряженную основанию кислоту, другими словами, основание, которое получило протон. А этот атом углерода теперь соединен только с заместителем, который был раньше нашим электрофилом. Давайте для простоты нарисуем это одним цветом. То, что раньше было электрофилом находится вот здесь, а эта связь соответствует этой связи. Осталось немного. Будем придерживаться одних и тех же цветов. Эта двойная связь соответствует этой двойной связи. У нас есть эта двойная связь. Эта двойная связь, которую мы теперь рисуем здесь. И затем этот электрон вернется к верхнему атому углерода. Давайте расставим все по полочкам. Эта связь и этот электрон возвращаются к этому верхнему углероду. Давайте нарисуем связь и электрон, которые вернулись на свои места. Этот верхний углерод перестает быть положительно заряженным. И мы опять получаем резонансно-стабилизированную структуру. Я забыл упомянуть про заряды. Могло случиться так, что это основание было отрицательно заряжено. Хотя совсем не обязательно. Но, если у этого основания был отрицательный заряд, то после того, как оно отдаст свой электрон водороду, отрицательный заряд пропадет. В этом есть своя логика, потому что сначала у нас были как положительные, так и отрицательные заряды, а после того, как все прореагировало заряды пропали. Суммарный заряд равен нулю. Вернемся к вопросу электрофильного ароматического замещения. Мы заместили один из этих водородов. Мы заместили этот водород вот здесь с помощью электрофила. То, что раньше было электрофилом, после того, как получило электрон, теперь является просто заместителем, присоединенным к бензольному кольцу. И, пройдя весь этот сложный путь, мы, наконец, пришли к новой ароматической молекуле с E-заместителем. В следующем видеоуроке мы рассмотрим конкретные примеры электрофилов и оснований. Subtitles by the Amara.org community
Реакции ароматического электрофильного замещения
Для ароматических систем фактически существует один механизм электрофильного замещения - S E Ar . Механизм S E 1 (по аналогии с механизмом S N 1 ) - встречается крайне редко, а S E 2 (соответствующий по аналогии S N 2 ) - не встречается вовсе .
Реакции S E Ar
Механизм реакции S E Ar или реакции ароматического электрофильного замещения (англ. Electrophilic aromatic substitution ) является самым распространенным и наиболее важным среди реакций замещения ароматических соединений и состоит из двух стадий. На первом этапе происходит присоединение электрофила, на втором - отщепление электрофуга:
| Скорость реакции = k** |
В качестве атакующей частицы обычно выступают относительно слабые электрофилы, поэтому в большинстве случаев реакция S E Ar протекает под действием катализатора - кислоты Льюиса. Чаще других используются AlCl 3 , FeCl 3 , FeBr 3 , ZnCl 2 .
В этом случае механизм реакции выглядит следующим образом (на примере хлорирования бензола , катализатор FeCl 3) :
1.На первом этапе катализатор взаимодействует с атакующей частицей с образованием активного электрофильного агента:
C l − C l + F e C l 3 ⇄ C l − C l + ⋅ ⋅ ⋅ F e C l 3 − ⇄ C l + F e C l 4 − {\displaystyle {\mathsf {Cl\!\!-\!\!Cl+FeCl_{3}}}\rightleftarrows {\mathsf {Cl\!\!-\!\!Cl^{+}}}\!\cdot \cdot \cdot {\mathsf {FeCl_{3}^{-}}}\rightleftarrows {\mathsf {Cl^{+}FeCl_{4}^{-}}}}
2. На втором этапе, собственно, и реализуется механизм S E Ar :
H N O 3 + 2 H 2 S O 4 → N O 2 + + H 3 O + + 2 H S O 4 − {\displaystyle {\mathsf {HNO_{3}+2H_{2}SO_{4}}}\rightarrow {\mathsf {NO_{2}^{+}+H_{3}O^{+}+2HSO_{4}^{-}}}}
| Скорость реакции = k** |
X 2 + F e X 3 → X + + F e X 4 − {\displaystyle {\mathsf {X_{2}+FeX_{3}}}\rightarrow {\mathsf {X^{+}+FeX_{4}^{-}}}}
В замещенных бензолах возможна так называемая ипсо -атака, то есть замещение имеющегося заместителя на другой:
Реакции алифатического электрофильного замещения
Реакции S E 1
Механизм реакции S E 1 или реакции мономолекулярного электрофильного замещения (
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делокализация шести p-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной p-электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения.
Рассмотрим механизм электрофильного замещения на примере нитрования бензола.
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
нитробензол
Реакции замещения в кольцо протекают только через образование положительно заряженных промежуточных частиц.
p-комплекс  s-комплекс
s-комплекс

Замещаемой частицей является протон.
По такому механизму протекают реакции алкилирования, галогенирования, сульфирования, нитрования ароматических соединений и другие, различаясь лишь способом образования активной частицы реакции – электрофила Е +
а) сульфирование:
HO–SO 3 H + H–SO 4 H à HSO 3 + + HSO 4 –
б) галогенирование
Cl 2 + AlCl 3 à Cl + + AlCl 4 –
в) алкилирование:
CH 3 –CH 2 –Cl + AlCl 3 à CH 3 –CH 2 + + AlCl 4 –
г) ацилирование
СН 3 СOCl + AlCl 3 à СН 3 С + =O + AlCl 4 –
В незамещенном кольце бензола все 6 положений равноценны для вхождения замещающей группы. Сложнее обстоит дело, если в реацию вступают гомологи или производные бензола. В этом случае вновь входящая группа вступает в определенное место в кольце. Это место зависит от уже имеющегося (или имеющихся) в кольце заместителя. Например, если в кольце имеется электронодонорная группировка типа: алкил–, –ОН, –ОСН 3 , –NH 2 , –NHR, NR 2 , –NH–COR, –Х (галоген) (заместители первого рода ), то замещающая группа вступает в орто- или пара- положения относительно имеющейся группы:

Если в кольце уже имеется электроноакцепторная группировка типа: –NO 2 , –NO, –SO 3 H, –CX 3 , –COOH, –COH, –COR, –CN (заместители второго рода ), то вновь вступающая группа становится в мета- положение к ним:

Таблица 2
Сводная таблица заместителей и их электронных эффектов
| Заместитель или группа атомов | Ориентация | Эффекты |
| СН 3 > CH 3 –CH 2 > (CH 3) 2 CH | о-, п- ориентация, (галогены–дезактивирующие) | + I, +M |
| (CH 3) 3 C | + I, M=0 | |
| Атом, присоединенный к p–системе, имеет неподеленную пару электронов: X– (галоген), –O – , –OH, –OR, –NH 2 , –NHR, –NR 2 , –SH, –SR, | – I, + M | |
| присоединенный к p–системе атом в свою очередь связан с более электроотрицательным атомом: –N=O,–NO 2 , –SO 3 H, –COOH, –COH, –C(O)–R, –COOR, –CN, –CX 3 , –C=N=S, | м-ориентация, с дезактивированием | – I, –M |
| sp 2 -гибридизованный углерод: –СН=СН–, –С 6 Н 5 (фенил) | о-, п- ориентация | I=0,+M |
| Атом, не имеющий р–орбиталей, но с полным положительным зарядом –NH 3 + , –NR 3 + , | м- ориентация, с дезактивированием | –I, M=0 |
Если в кольце имеется два заместителя разного рода , направляющие замещение несогласованно , то место вступления новой группы определяется по заместителю первого рода , например.
Наиболее характерны для ароматических углеводородов реакции замещения . При этом в результате реакций не происходит разрушения ароматического секстета электронов. Известны также многочисленные примеры реакций радикального галогенирования и окисления боковых цепей алкилбензолов. Процессы, в которых разрушается стабильная ароматическая система, мало характерны.
IV.1 Электрофильное ароматическое замещение (seAr)
А . Механизм S E Ar (Substitution Electrophilic in Arenes)
Электрофильное замещение в ароматическом ядре является одной из наиболее хорошо изученных и широко распространенных органических реакций. Чаще всего, конечным результатом электрофильного замещения является замещение атома водорода в ароматическом ядре на другой атом или группу атомов:
Реакции электрофильного замещения в ароматическом ядре (как и реакции электрофильногоприсоединения к С=С связи) начинаются с образования -комплекса - электрофильный агент координируется с молекулой бензола за счет -электронной системы последнего:

В бензольном ядре -система, будучи устойчивой (энергия стабилизации; см. раздел II), не нарушается столь легко, как в алкенах. Поэтому соответствующий -комплекс может быть не только зафиксирован с помощью физико-химических методов, но и выделен .(прим.24)
Как правило, стадия образования -комплекса протекает быстро и не лимитирует скорости всего процесса.
Далее ароматическая система нарушается, и возникает ковалентная связь электрофила с атомом углерода бензольного ядра. При этом -комплекс превращается в карбокатион (карбениевый ион), в котором положительный заряд делокализован в диеновой системе, а атакованный электрофилом атом углерода переходит из sp 2 - в sp 3 -гибридное состояние. Такой катион называется -комплексом . Как правило, стадия образования -комплекса является скорость определяющей . Делокализация положительного заряда в -комплексе осуществляется не равномерно между пятью атомами углерода, а за счет 2,4,6-положений бензольного кольца (ср. с аллильным катионом, где положительный заряд распределен между 1,3-положениями):

При электрофильном присоединении к алкенам также сначала образуется -комплекс, переходящий затем в -комплекс, однако дальнейшая судьба -комплекса в случае электрофильных реакций алкенов и аренов различна. -Комплекс, образующийся из алкенов, стабилизируется за счет транс -присоединения нуклеофила; -комплекс, формирующийся из ароматической системы, стабилизируется с регенерацией ароматического секстета -электронов:(прим.25)

Ниже приведен энергетический профиль такой реакции (прим.27) (Е а - энергия активации соответствующей стадии):

Еще раз подчеркнем, что реакции S Е Ar, по результату представляющие собой замещение , на самом деле по механизму являются реакциями присоединения с последующим отщеплением .
Б. Ориентация присоединения в монозамещенных бензолах
При рассмотрении реакций электрофильного замещения в монозамещенных бензолах возникает две проблемы: 1. Новый заместитель может вступать в орто -, мета - илипара -положения, а также замещать уже имеющийся заместитель (последнее, так называемое ипсо-замещение , менее распространено - см. раздел IV.1.Д (нитрование). 2. Скорость замещения может быть больше или меньше скорости замещения в бензоле.
Влияние имеющегося в бензольном кольце заместителя можно объяснить исходя из его электронных эффектов. По этому признаку заместители можно разделить на 3 основных группы:
1. Заместители, ускоряющие реакцию по сравнению с незамещенным бензолом (активирующие ) и направляющие замещение в орто ,- пара - положения.
2. Заместители, замедляющие реакцию (дезактивирующие ) и направляющие замещение в орто,-пара- положения .
3. Заместители, замедляющие реакцию (дезактивирующие ) и направляющие замещение в мета - положения .
Заместители, отмеченные в п.п. 1,2 (орто-,пара-ориентанты ) называются заместителями I-го рода ; отмеченные в п.3 (мета-ориентанты ) - заместителями II-го рода . Ниже приведено отнесение обычно встречающихся заместителей в соотвествие с их электронными эффектами.
Очевидно, что электрофильное замещение будет происходить тем быстрее, чем более электронодонорным является заместитель в ядре , и тем медленнее, чем более электроноакцепторным является заместитель в ядре .
Для объяснения ориентации замещения рассмотрим строение -комплексов при атаке в орто -, мета - и пара -положения монозамещенного бензола (как уже отмечалось, образование -комплексов обычно является скоростьопределяющей стадией электрофильного замещения; cледовательно, легкость их образования должна определять легкость протекания замещения в данное положение):

Если группа Z - донор электронов (неважно, индуктивный или мезомерный), то при орто - или пара -атаке она может принимать непосредственное участие в делокализации положительного заряда в -комплексе (структуры III, IV, VI, VII). Если же Z - акцептор электронов, то указанные структуры будут энергетически невыгодными (из-за наличия частичного положительного заряда на атоме углерода, связанном с электроноакцепторным заместителем) и в этом случае оказывается предпочтительной мета-атака, при которой не возникает таких структур.
Приведенное выше объяснение дано на основании так называемого динамического эффекта , т.е. распределения электронной плотности в реагирующей молекуле. Ориентацию электрофильного замещения в монозамещенных бензолах можно объяснить и с позиции статических электронных эффектов - распределения электронной плотности в нереагирующей молекуле. При рассмотрении смещения электронной плотности по кратным связям можно заметить, что при наличии электронодонорного заместителя более всего повышена электронная плотность в орто - и пара - положениях, а при наличии электроноакцепторного заместителя эти положения наиболее обеднены электронами:

Особый случай представляют собой галогены - будучи заместителями в бензольном ядре, они дезактивируют его в реакциях электрофильного замещения, однако являютсяорто -, пара -ориентантами. Дезактивация (снижение скорости реакции с электрофилами) связана с тем, что, в отличие других группировок с неподеленными электронными парами (таких как -OH, -NH 2 и т.п.), обладающих положительным мезомерным (+М) и отрицательным индуктивным эффектом (-I), для галогенов характерно преобладание индуктивного эффекта над мезомерным (+М< -I).(прим.30)

В то же время, атомы галогенов являются орто,пара -ориентантами, поскольку способны за счет положительного мезомерного эффекта участвовать в делокализации положительного заряда в -комплексе, образующемся при орто - или пара - атаке (структуры IV, VII в приведенной выше схеме), и тем самым снижают энергию его образования.
Если в бензольном ядре имеется не один, а два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация ) или не совпадать (несогласованная ориентация ). В первом случае можно рассчитывать на преимущественное образование каких-то определенных изомеров, а во втором будут получаться сложные смеси.(прим.31)
Ниже приведены некоторые примеры согласованной ориентации двух заместителей; место преимущественного вступления третьего заместителя показано стрелкой.

Спрос на бензол определяется развитием потребляющих его отраслей. Основные области применения бензола - производство этилбензола, кумола и циклогексана и анилина.
Реакции электрофильного замещения протекают труднее, чем у бензола, что обусловлено сильным электроноакцепторным действием нитрогруппы. Замещение происходит в мета-положение, так как нитрогруппа – ориентант П рода (S E 2 аром).
Поэтому реакции электрофильного замещения осуществляются только с сильными реагентами (нитрование, сульфирование, галогенирование) в более жестких условиях:

Реакции нуклеофильного замещения
В реакциях нуклеофильного замещения (S N 2 аром) нитрогруппа направляет нуклеофил в орто- и пара-положения.
Например, сплавление нитробензола с КОН при 100 0 С приводит к получению орто- и пара-нитрофенолов:

Более предпочтительной является атака в орто-положение, поскольку отрицательный индуктивный эффект нитрогруппы, действуя на малом расстоянии, создает большую нехватку электронов в орто-, чем в пара-положении.
Присутствие двух и особенно трех нитрогрупп в мета-положении по отношению друг к другу еще более способствует реакциям с нуклеофильными реагентами.
Так, например, при взаимодействии мета-динитробензола со щелочью или с амидом натрия происходит замещение одного из атомов водорода, находящихся в орто- или пара-положениях, на группу OH, или наNH 2 :

2,4-динитрофенол

2,6-динитроанилин
Симметричный тринитробензол реагирует со щелочью с образованием пикриновой кислоты:

2,4,6-тринитрофенол
пикриновая кислота
Влияние нитрогруппы на реакционную способность
других групп в бензольном кольце
Нуклеофильное замещение нитрогруппы
Если нитрогруппы находятся в орто- и пара-положениях по отношению друг к другу, то они активируют друг друга и возможно нуклеофильное замещение нитрогруппы с уходом нитрит-иона:


Нуклеофильное замещение галогенов и других групп
Нитрогруппа активирует нуклеофильное замещение не только атома водорода, но и других групп, находящихся в бензольном кольце в орто- и пара-положениях относительно нитрогруппы.
Легко замещаются на нуклеофилы атомы галогенов, -ОН, -OR, –NR 2 и другие группы.
Роль нитрогруппы заключается не только в создании положительного заряда на атоме углерода, связанном с замещаемой группой, но и в стабилизации отрицательного ϭ-комплекса, т.к. нитрогруппа способствует делокализаии отрицательного заряда.
Например, галоген в орто- и пара-нитрохлорбензолах под влиянием нитрогруппы легко замещается на нуклеофильные частицы:


:Nu: -- = ОН -- , NH 2 -- , I -- , -- OCH 3
Присутствие двух и особенно трех нитрогрупп ускоряет нуклеофильное замещение, причем наиболее ярко это выражено в тех случаях, когда нитрогруппы находятся в орто- или пара-положении относительно замещаемой группы:

2,4-динитрохлорбензол
Наиболее легко атом галогена замещается в 2,4,6-тринитрохлорбензоле (пикрилхлорид):

2,4,6-тринитрохлорбензол
(пикрилхлорид)
Реакции, связанные с подвижностью атомов водорода
алкильных радикалов
Благодаря сильно выраженному электроноакцепторному характеру нитрогруппа оказывает значительное влияние на подвижность атомов водорода алкильных радикалов, нахоящихся в орто- и пара-положениях по отношению к ней.
а) реакции конденсации с альдегидами
В пара-нитротолуоле атомы водорода метильной группы под влиянием нитрогруппы приобретают высокую подвижность и вследствие этого пара-нитротолуол вступает в реакции конденсации с альдегидами в качестве метиленового компонента:

б) образование нитроновых кислот
Атомы водорода у α-углеродного атома благодаря ϭ,π-сопряжению обладают высокой подвижностью и могут мигрировать к кислороду нитрогруппы с образованием таутомерной нитроновой кислоты.
Образование нитроновых кислот у ароматических нитросоединений с нитрогруппой в кольце связано с преобразованием бензольного кольца в хиноидную структуру:
Например, орто-нитротолуол проявляет фотохромизм: образуется нитроновая кислота ярко-синего цвета (хиноидные структуры часто интенсивно окрашены:

орто-нитротолуол нитроновая кислота
Введение
Реакции электрофильного замещения - реакции замещения, в которых атаку осуществляет электрофил (частица, имеющая дефицит электронов), а при образовании новой связи частица отщепляется без своей электронной пары (реакции SЕ-типа).
Общий вид реакции
Электрофильные агенты
Электрофильные агенты условно могут быть разделены на 3 группы:
.Сильные электрофилы:
.NO2+(Ион нитрония); комплексы Cl2 или Br2 с различными кислотами Льюиса (FeCl3, AlBr3, AlCl3, SbCl5 и т.д.); H2OCl + , H2OBr + , RSO2+ , HSO3+ , H2S2O7 .
.Электрофилы средней силы:
Комплексы алкилгалогенидов или ацилгалогенидов с кислотами Льюиса (RCl. AlCl3,. AlCl3 и др.); комплексы спиртов с сильными кислотами Льюиса и Бренстеда (ROH. BF3, ROH. H3PO4, ROH. HF). .Слабые электрофилы:
Катионы диазония, иминия CH2=N+ H2, нитрозония NO+(нитрозоил-катион); оксид углерода (IV) СО2. Сильные электрофилы взаимодействуют с соединениями ряда бензола, содержащими как электронодонорные, так и практически любые электроноакцепторные заместители. Электрофилы второй группы реагируют с бензолом и его производными, содержащими электронодонорные (активирующие) заместители или атомы галогенов, но обычно не реагируют с производными бензола, содержащими сильные дезактивирующие электроноакцепторные заместители (NO2, SO3H, COR,CN и др.). Наконец, слабые электрофилы взаимодействуют только с производными бензола, содержащими очень сильные электронодонорные заместители (+М)-типа (OH, OR, NH2, NR2, O- и др.).
Типы механизмов
Можно представить два возможных механизма замещения протона в ароматической молекуле на электрофильный реагент. .Отщепление протона может происходить одновременно с образованием новой связи с электрофильным реагентом Е, и рекакция в этом случае будет идти в одну стадию:
Для синхронного процесса изменение заряда на субстрате в процессе реакции должно быть сравнительно невелико. Кроме того, так как связь С-Н разрывается на скоростьопределяющей стадии реакции, можно ожидать, что при синхронном механизме реакция должна сопровождаться значительным кинетическим изотопным эффектом водорода. Первоначально происходит присоединение электрофильного агента к π-системе ароматического ядра, образуется мало-стабильный интермеднат. Далее происходит отщепление протона от образовавшегося катиона под действием основания, в качестве которого может выступать молекула растворителя:
Реакции, идущие по этому механизму, должны характеризоваться высокой чувствительностью скорости к электронным эффектам заместителей, так как промежуточный интермедиат является катионом. Кроме того, если скоростьопределяющей стадией является первая, в которой не происходит нарушения связи С-Н, реакция не должна сопровождаться значительным кинетическим изотопным эффектом. При взаимодействии ароматических соединений с электрофильными реагентами может происходить образование двух типов комплексов, которые могут быть интермедиатами в реакциях электрофильного замещения. Если электрофильный агент не разрушает существенным образом электронную π-систему ароматического ядра, образуются π-комплексы.
Существование π-комплексов подтверждается данными УФ-спектроскопии, изменениями в растворимости, давлении пара, температурах замерзания. Образование π-комплексов доказано, например, для взаимодействия ароматических углеводородов с хлороводородом или ионом Ag+:
Так как электронное строение ароматического кольца меняется незначительно (можно провести аналогию между этими комплексами и комплексами с переносом заряда), при образовании π-комплексов не происходит существенных изменений в спектрах, не наблюдается увеличения электрической проводимости. Влияние электронных эффектов заместителей в ароматическом кольце на стабильность π-комплексов сравнительно невелико, так как перенос заряда в π-комплексах мал.
При растворении ароматических углеводородов в жидком фтороводороде происходит протонирование молекулы ароматического углеводорода с образованием аренониевого иона, и получаются комплексы другого типа - δ-комплексы.
Устойчивость δ-комплексов (аренониевых ионов), в отличие от устойчивости -комплексов, очень сильно зависит от числа и природы заместителей в бензольном кольце. .
Образованию δ-комплексов способствует стабилизация противоиона за счет взаимодействия с фторидом бора(Ш) или другими кислотами Льюиса:
В присутствии кислот Льюиса δ-комплексы образуются и с хлороводородом.
Промежуточный δ-комплекс имеет несколько резонансных структур и весьма напоминает «супераллил-катион» тем, что положительный заряд в нем распределяется по трем из пяти доступных р-орбиталей. Эта система включает два одинаковых орто-углеродных атома по отношению к sp3-гибридизоваиному атому углерода и один пара-углеродный атом по отношению к этому же атому. Два эквивалентных мета-положения кольца не несут формального заряда, но они, несомненно, имеют слегка электроположительный характер из-за соседних положительно заряженных атомов углерода:
При образовании δ-комплексов происходит резкое увеличение электрической проводимости раствора.
Основным путем превращения аренониевых ионов в растворе является отрыв протона с регенерацией ароматической системы. Поскольку при образовании аренонневого иона в ароматическом кольце локализуется целый положительный заряд, влияние электронных эффектов заместителей на относительную стабильность δ-комплексов должно быть значительно больше, чем в случае π-комплексов.
Таким образом, можно ожидать, что реакция электрофильного замещения будет происходить через стадию образования сначала π-комплекса, а затем δ-комплекса.
Изомерные δ-комплексы
В переходном состоянии, предшествующем образованию δ-комплекса, между молекулой монозамещенного бензола С6Н5Х и положительно заряженным электрофилом Е+ заряд поделен между атакующим электрофилом и бензольным кольцом. Если переходное состояние «раннее» (похожее на реагенты), то заряд в бензольном кольце невелик и в основном локализован на электрофиле, а если переходное состояние «позднее» (похожее на аренониевый ион), то заряд в основном локализован на атомах углерода бензольного кольца. Для реакций монозамещенных бензолов могут существовать четыре комплекса: орто-, мета-, пара- и ипсо- :
орто-мета-пара-ипсо-
В соответствии с этим могут быть четыре разных переходных состояния, энергия которых зависит от степени взаимодействия заместителя Х с положительным зарядом кольца. В «позднем» переходном состоянии полярный эффект заместителя Х должен быть выражен сильнее, чем в «раннем» переходном состоянии, но качественно влияние одного и того же заместителя должно быть одинаковым. Из орто-, мета- и пара-комплексов образуются продукты замещения водорода (путем отщепления протона), но из ипсо-комплекса может образоваться продукт замещения группы Х путем отщепления катиона Х+. ипсо-Замещение характерно для металлоорганических соединений; как правило, в них металл замещается легче протона:
Классификация заместителей
В настоящее время заместители делят на три группы с учетом их активирующего или дезактивирующего влияния, а также ориентации замещения в бензольном кольце. 1.Активирующие орто-пара-ориентирующие группы. К ним относятся: NH2, NHR, NR2, NHAc, OH, OR, OAc, Alk и др.
2.Дезактивирующие орто-пара-ориентирующие группы. Это галогены F, Cl, Br и I.
Эти две группы (1 и 2) заместителей называют ориентантами I-го рода. 3.Дезактивирующие мета-ориентирующие группы. Эту группу составляют NO2, NO, SO3H, SO2R, SOR, C(O)R, COOH, COOR, CN, NR3+ ,CCl3 и др. Это ориентанты II-го рода.
Естественно, что существуют и группировки атомов промежуточного характера, обусловливающие смешанную ориентацию. К ним, например, относятся: CH2NO, CH2COCH3, CH2F, CHCl2, CH2NO2, CH2CH2NO2, CH2CH2NR3+, CH2PR3+, CH2SR2+ и др.
Примеры влияния ориентантов:
Основные реакции электрофильного ароматического замещения
Нитрование. Одной из наиболее широко исследованных реакций замещения в ароматических системах является нитрование. Различные арены нитруются в самых разнообразных условиях. Наиболее часто в качестве нитрующего агента используют азотную кислоту в смеси с серной кислотой или азотную кислоту в органических растворителях: уксусной кислоте, нитрометане и т.д. Незамещенный бензол обычно нитруют смесью концентрированных азотной и серной кислот при 45-50оС. Этот реагент называется нитрующей смесью.
Установлено, что в электрофильном нитровании, независимо от природы нитрующего агента, активным электрофилом является ион нитрония NO2+ . В избытке концентрированной серной кислоты происходит количественное превращение азотной кислоты в гидросульфат нитрония:
При разбавлении серной кислоты водой концентрация иона NO2+ уменьшается и вместе с этим резко падает и скорость нитрования. Однако очень реакционноспособные арены нитруются даже в таких условиях, когда обнаружить ион NO2+ в растворе какими-либо физическими методами невозможно. Имеются доказательства, что даже в отсутствие серной кислоты нитрование осуществляется ионом нитрония.
В таких условиях реакции очень активных аренов имеют нулевой кинетический порядок по ароматическому субстрату (медленная стадия - образование NO2+ без участия ArH). В этих же условиях для менее реакционноспособных аренов кинетический порядок по ArH первый, т.е. лимитирующей скорость стадией становится уже собственно процесс замещения. Подобный эффект наблюдался, например, при нитровании толуола водным раствором азотной и серной кислот. При низкой концентрации H2SO4 порядок по толуолу был нулевым, а при более высокой - первым. При использовании в качестве реагента нитрующей смеси (HNO3 + H2SO4) концентрация ионов нитрония в растворе всегда достаточно высока и при избытке реагента постоянна, поэтому нитрование можно рассматривать как двухстадийный процесс.
Медленной стадией этого двухстадийного процесса является образование -комплекса. Это доказывается отсутствием кинетического изотопного эффекта водорода при нитровании аренов и дейтероаренов. Однако введение очень объемистых групп с обеих сторон замещающегося водорода может сильно уменьшить скорость стадии k2 и привести к появлению изотопного эффекта. Галогенирование (например, бромирование) бензола действием самого галогена протекает только в присутствии катализаторов, таких как ZnCl2, FeBr3, А1Вr3 и т. д. Катализаторами являются обычно кислоты Льюиса. Они вызывают некоторую поляризацию молекулы галогена, усиливая тем самым ее электрофильный характер, после чего такая поляризованная молекула атакует π-электроны ароматического кольца участком, несущим положительный заряд:
После расщепления связи бром - бром образуется δ-комплекс с бензолом, от которого возникающий отрицательно заряженный комплекс -BrFeBr3 отрывает протон, давая бром-бензол.
В качестве галогенирующих средств могут применяться также водные растворы НО-Hal, разумеется, в присутствии сильных кислот. Имеются надежные доказательства того, что, например при хлорировании, хлорирующим агентом является ион Сl+, образующийся в результате реакции:
Механизм дальнейшего взаимодействия ионов Cl+ с бензолом не отличается от механизма нитрования ионами NO2+. Сходство этих двух процессов подтверждается тем, что кислота НОCl сама по себе, так же как и НNO3 очень слабо взаимодействует с бензолом; как в том, так и в другом случае для высвобождения ионов Cl+ и NO2+ путем протонирвоания «молекул-носителей» требуются сильные кислоты:
Дальнейшие доказательства в пользу того, что замещающими агентами являются галоген-катионы или комплексы, содержащие поляризованный галоген, были получены при изучении реакций между межгалогенидными и ароматическими соединениями. Так, например, действие BrCl приводит только к бромированию, a ICl-только к иодированию, т. е. в молекулу ароматического соединения всегда вводится менее электроотрицательный галоген, который в исходной молекуле межгалогенидного соединения несет на себе частичный положительный заряд, например:
δ+δ-→Cl
Сульфирование. До сих пор нет единого мнения относительно истинной природы электрофильного агента сульфирования. Данные кинетических измерений не дают однозначного ответа на этот вопрос, поскольку в водной и безводной серной кислоте содержится большое число потенциальных электрофильных агентов, относительная концентрация которых зависит от отношения H2O/SO3. При концентрации серной кислоты ниже 80% устанавливаются главным образом следующие равновесия:
При более высокой концентрации серной кислоты в интервале 85-98% состояние серной кислоты в основном описывается уравнениями:
В 100%-ной серной кислоте и в олеуме помимо H2S2O7 существуют и другие полисерные кислоты - H2S3O10; H2S4O13 и т.д. Все это крайне затрудняет интерпретацию данных по кинетике сульфирования. В водной серной кислоте при концентрации ниже 80% скорость сульфирования линейно коррелирует с активностью иона H3SO4+ . При концентрации серной кислоты выше 85% наблюдается линейная корреляция с активностью H2S2O7. Эти две частицы, по-видимому, и есть два главных реальных электрофильных агента сульфирования ароматических соединений в водной серной кислоте. Их можно рассматривать как молекулу SO3, координированную соответственно с ионом H3O+ или серной кислотой. При переходе от 85%-ной к 100%-ной серной кислоте концентрация иона H3O+ резко уменьшается, а концентрация H2SO4 увеличивается. В 91%-ной кислоте = , но так как H2S2O7 (SO3 . H2SO4) более сильный электрофильный агент, чем H3SO4+ (H3O+ . SO3), он доминирует как электрофил не только в 91%-ной, но даже и в 85%-ной серной кислоте. Таким образом, механизм сульфирования может быть представлен, по-видимому, следующим образом:
Кинетический изотопный эффект kH/kD при концентрации серной кислоты ниже 95% пренебрежимо мал. Но при сульфировании 98-100%-ной H2SO4 или олеумом наблюдается кинетический изотопный эффект kH/kD в диапазоне 1.15-1.7, т.е. определяющей скорость стадией становится уже стадия (2). При концентрации серной кислоты ниже 95% протон от -комплекса отщепляется гидросульфат-ионом HSO4- , а при более высокой концентрации серной кислоты роль очень слабого основания играет сама H2SO4. Поэтому скорость стадии (2) резко уменьшается, и наблюдается кинетический изотопный эффект.
В олеуме скорость сульфирования резко возрастает. Электрофильным агентом в этом случае, по-видимому, является не связанный в комплекс SO3. Медленной является стадия (2).
Алкилирование по Фриделю-Крафтсу. Реакция Ш.Фриделя-Дж.Крафтса (1877 г.) представляет собой удобный метод прямого введения алкильной группы в ароматическое кольцо. Алкилирование ароматических соединений осуществляется под действием алкилгалогенидов, только в присутствии в качестве катализатора подходящей кислоты Льюиса: AlBr3, AlCl3, GaBr3, GaCl3, BF3, SbF5, SbCl5, FeCl3, SnCl4, ZnCl2 и др.
Наиболее активными катализаторами являются безводные сублимированные бромиды алюминия и галлия, пятифтористая сурьма, хлориды алюминия и галлия, менее активны галогениды железа (III), SbCl5, к малоактивным катализаторам относятся SnCl4 и ZnCl2. В целом активность кислот Льюиса, как катализаторов алкилирования бензола, уменьшается в ряду AlBr3> GaBr3> AlCl3> GaCl3> FeCl3> SbCl5> TiCl4> BF3> BCl3> SnCl4> SbCl3. Самым распространенным катализатором этой реакции является предварительно сублимированный хлористый алюминий. Например, механизм реакции бензилирования хлористым бензилом в нитробензоле в присутствии безводного AlCl3 в качестве катализатора следующей схемой: где В: =AlCl4- ; H2O или другое основание. Скорость реакции лимитируется второй стадией. Точное строение интермедиата (RCl .AlCl3) неизвестно. В принципе, можно представить целый ряд структур от молекулярного комплекса до диссоциированных карбокатионов.
Участие свободных карбокатионов как алкилирующих агентов маловероятно. Если бы алкилирующими агентами были свободные карбокатионы, то медленной стадией была бы стадия их образования (k1), а реакция с аренами была бы быстрой и третьего порядка не должно было наблюдаться. Крайне маловероятно, что алкилирующим агентом является молекулярный комплекс. При низких температурах иногда удается выделить комплексы алкилгалогенидов с кислотами Льюиса. Для них характерен медленный обмен галогенов по схеме:
Скорость обмена возрастает в ряду перв.R< втор.R<трет.R, что можно объяснить и ион-парным строением, и структурой координационного аддукта. Многие исследователи, работающие в данной области, полагают, что строение комплексов RX. MXn постепенно изменяется от структуры координационного аддукта в случае R=СН3 до структуры ионной пары в случае R=t-Bu, однако экспериментально это пока не подтверждено. Способность атома галогена в RX к комплексообразованию с AlCl3 или другой жесткой кислотой Льюиса резко уменьшается от фтора к иоду, вследствие этого активность алкилгалогенидов в качестве алкилирующих агентов в реакции Фриделя-Крафтса также уменьшается в ряду RF> RCl> RBr> RI. По этой причине алкилиодиды не применяют в качестве алкилирующего агента. Различие в активности алкилфторидов и алкилбромидов настолько велико, что позволяет селективно замещать фтор в присутствии брома в одной и той же молекуле.
Ацилирование по Фриделю-Крафтсу Введение ацильной группы в ароматическое кольцо с помощью ацилирующего агента и кислоты Льюиса называют ацилированием по Фриделю-Крафтсу. Ацилирующими агентами обычно являются галогенангидриды и ангидриды кислот в присутствии галогенидов алюминия, трифторида бора или пентафторида сурьмы в качестве кислот Льюиса. Ацилгалогениды и ангидриды кислот образуют с кислотой Льюиса донорно-акцепторные комплексы состава 1:1 и 1:2. Спектральными методами было установлено, что хлорид алюминия, трифторид бора и пентафторид сурьмы координируются по карбонильному атому кислорода, так как он более основен чем соседний атом хлора. Электрофильным агентом в реакции ацилирования ароматических соединений является либо этот донорно-акцепторный комплекс, либо катион ацилия, образующийся при его диссоциации.
Можно полагать, что медленной стадией реакции является атака одного из трех электрофилов (RCO+ , RCOCl . AlCl3, RCOCl . Al2Cl6) на арен, приводящая к -комплексу. Эффективность этих ацилирующих частиц зависит от природы субстрата, ацилгалогенида и растворителя, а также от количества взятого катализатора.
При ацилировании аренов ацилгалогенидами, катализируемом хлоридом или бромидом алюминия в полярных апротонных растворителях (нитробензоле, нитрометане и др.), ацилирующим агентом является катион ацилия, тогда как в малополярной среде (хлористом метилене, дихлорэтане или тетрахлорэтане) в реакции принимает участие донорно-акцепторный комплекс. Природа ацилгалогенида также оказывает влияние на образование и стабильность солей ацилия. Механизм реакции ацилирования аренов по Фриделю-Крафтсу под действием донорно-акцепторного комплекса
описывается следующей схемой:
Ароматический кетон представляет собой более сильное основание Льюиса, чем ацилгалогенид и образует стабильный комплекс с AlCl3 или другой кислотой Льюиса. Поэтому для ацилирования ароматических соединений ацилгалогенидами требуется несколько больше эквимолярного количества катализатора, а при ацилировании ангидридами кислот два моля катализатора (т.к. они содержат два карбонильных атома кислорода). Кетон выделяют, разлагая его комплекс с AlCl3 водой или соляной кислотой. Ацилирование по Фриделю-Крафтсу полностью лишено тех недостатков, которые присущи реакции алкилирования. При ацилировании вводится только одна ацильная группа, поскольку ароматические кетоны не вступают в дальнейшую реакцию (так же, как и другие арены, содержащие сильные электроноакцепторные группы: NO2, CN, COOR). Еще одним преимуществом этой реакции по сравнению с алкилированием является отсутствие перегруппировок в ацилирующем агенте. Кроме того, для ацилирования не характерны реакции диспропорционирования продуктов реакции.
Список используемой литературы замещение ароматический молекула реакция 1.Курц А Л., Ливанцов М.В., Ливанцова Л.И. Электрофильное замещение в ароматическом ряду:Методическая разработка для студентов III курса.-Москва, 1997.
2.Днепровский А.С. и др. Теоретические основы органической химии/А.С. Днепровский, Т.И. Темникова: Учебник для вузов.- 2-е изд., перераб.- Л.:Химия, 1961.- 560с.
3.Терней А. Современная органическая химия.Том1:Учебник.-Мир, 1981.-680с.
.Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия: Учебник - М.: МГУ,1999. - 560с.
.Сайкс П. Механизмы реакций в органической химии. Пер. с англ. под ред. Проф. ВаршавскогоЯ. М. Изд. 3-е, М., «Химия»,1977. - 320с.