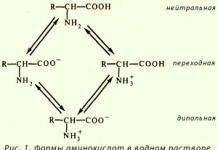
Химические реакции представляют собой процессы, сопровождающиеся изменением распределения электронов внешних орбиталей атомов реагирующих веществ. Движущей силой химических реакций является стремление к образованию новых соединений, обладающих меньшей свободной энергией, и, следовательно, более стабильных.
Вещества, вступающие в химическую реакцию, называют исходными веществами (соединениями) или реагентами. Один из реагентов принято называть субстратом. Это, как правило, то вещество, в котором у атома углерода происходит разрыв старой и образование новой связи. Действующее на субстрат соединение называют атакующим реагентом или реакционной частицей.
Например, при хлорировании алканов:
СН 3 – СН 3 + С1 2 ® СН 3 – СН 2 C1 + НС1
этан хлор хлорэтан хлороводород
этан является субстратом, а хлор – реагентом.
В ходе химического превращения обычно изменяется не вся молекула, а только её часть – реакционный центр.
Реакционный центр – это атом или группа атомов, непосредственно участвующие в данной химической реакции.
Так, при взаимодействии органического основания - метиламина с соляной кислотой метиламин является субстратом, соляная кислота - реагентом. Реакционный центр - атом азота аминогруппы. Именно неподелённая электронная пара азота непосредственно подвергается атаке протона и присоединяет его.
СН 3 – N Н 2 + H + C1 – ® СН 3 – N Н 3 + C1 –
метиламин хлороводород хлорид метиламмония
Соединения, образующиеся в ходе химического взаимодействия, называют продуктами реакции.
Большинство органических реакций включает несколько последовательных (элементарных) стадий. Детальное описание совокупности и последовательности протекания этих стадий называется механизмом. Механизм реакции – это часто гипотеза, предлагаемая на данном уровне развития науки для объяснения экспериментальных данных. Он может уточняться и даже меняться с появлением новых экспериментальных фактов и углублением теоретических представлений.
Установление механизма органических реакций – довольно сложная задача. Для ее решения необходимо на современном уровне знаний иметь полное представление о промежуточных стадиях и промежуточных веществах (интермедиатах), природе взаимодействия реагирующих частиц, характере разрыва и образования связей, изменении энергии химической системы на всем пути ее перехода из исходного состояния в конечное. Механизм должен согласовываться (быть адекватным) со стереохимией и кинетикой процесса.
Общая скорость сложной химической реакции определяется (лимитируется) скоростью ее наиболее медленной стадии, а скорость составляющих элементарных реакций – их энергией активации Е а. Энергия активации – минимальное дополнительное по сравнению со средним количество энергии, необходимое для осуществления эффективного столкновения молекул, приводящего к взаимодействию. Ее можно определить также как энергию, необходимую для достижения системой переходного состояния,иначе называемого активированным комплексом, превращение которого в продукты реакции происходит уже самопроизвольно. Чем меньше величина энергии активации реакции, тем выше ее скорость. (Эта ситуация более подробно была рассмотрена в первой части пособия).
В случае многоступенчатых процессов некоторые стадии включают образование интермедиатов – нестабильных промежуточных частиц. В качестве интермедиатов часто выступают органические ионы или радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности распределения (делокализации) заряда или появления у данной частицы неспаренного электрона.
Для снижения величины энергии активации и, соответственно, увеличения скорости химической реакции используют катализаторы. Катализатор – химическое вещество, ускоряющее реакцию, но не входящее в состав конечных продуктов реакции. Теоретически количество катализатора, в отличие от других реагентов, после реакции не изменяется. Принцип действия катализатора заключается в уменьшении энергии активации реакции. Катализатор реагирует с исходным веществом с образованием интермедиата, имеющего меньшую энергию активации. Получившееся промежуточное соединение подвергается действию реагента, а затем расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется. Катализатор не влияет на положение равновесия между исходными и конечными продуктами, но уменьшает время достижения положения равновесия.
Вещества, которые снижают скорость реакции, называют ингибиторами.
Изучение механизмов химических реакций помогает решать следующие задачи:
– систематизировать экспериментальные данные (знание механизма реакции позволяет обнаружить сходство и различия между реакциями);
– оптимизировать условия синтеза (знание механизма реакции позволяет определить лучшие условия для получения требуемого продукта с наилучшим выходом при наименьших затратах);
– прогнозировать реакционную способность (установив механизм реакции для одного из гомологов, можно уверенно предположить направление реакции для других членов гомологического ряда);
– позволяет проводить математическое моделирование процессов;
– доставляет интеллектуальное удовлетворение исследователю.
1. Объясните разницу между понятиями «субстрат» и «атакующий реагент».
2. Дайте определение энергии активации реакции.
3. Как влияет введение катализатора на энергию активации реакции?
4. В присутствии кислорода скорость хлорирования метана замедляется. Кислород в этом случае можно назвать катализатором или ингибитором реакции?
5. Какие частицы могут выступать в качестве интермедиатов?
В этой непростой для понимания статье рассматривается психика с позиций системного подхода. Большое внимание уделяется эмоциональной сфере. В частности, описана системная энергетическая концепция эмоций.
Поддерживающие статьи:
В наиболее общем виде психика может быть представлена как открытая функциональная система, состоящая из трех элементов:
- процессы формирования психического образа: внимание, ощущение, восприятие, эмоции, мышление, память
- причины, побуждающие психическую активность: потребности, мотивы
- целенаправленная психическая активность: деятельность
Суть функционирования такой системы в упрощенном виде состоит в том, что удовлетворение определенных потребностей становится мотивом-целью, который активизирует процессы формирования психического образа, а психический образ, в свою очередь, активизирует деятельность, направленную на удовлетворение потребности и мотива-цели, вызвавших эту деятельность. Необходимо отметить, что поскольку все эти элементы связаны в систему с обратной связью, где не действуют привычные причинно-следственные отношения, то, строго говоря, неважно, с какого из элементов начинать рассмотрение такой системы. Однако по сложившейся бытовой и научной традиции, для облегчения понимания функционирования такой системы принято начинать с анализа побудительных причин – потребностей, целей и мотивов, затем переходить к рассмотрению формирования психического образа и, наконец – к рассмотрению деятельности, которая, с одной стороны, является следствием психической активности, а с другой – направлена на прекращение этой активности.
Применяя общую схему системы управления к психике, можно наполнить ее конкретным психологическим содержанием:
- цели управления состоят в удовлетворении потребностей и мотивов, изучение которых, относится к предмету психологии (традиционный предмет психоанализа);
- средства – это психический образ, изучение которого также относится к предмету психологии (традиционный предмет гештальтпсихологии);
- результат – это деятельность, направленная на достижение цели, изучение которой несомненно относится к предмету психологии (традиционный предмет бихевиоризма и, к слову, отечественной теории деятельности).
Таким образом, предмет изучения психологии – это самоуправление целенаправленной жизнедеятельностью организма.
Дать определение любому научному понятию – значит объяснить его с помощью других, уже известных понятий, указать на его место в ряду других, уже известных явлений, выделив при этом специфические, присущие только этому понятию особенности. Применим это правило для определения предмета психологии.
Психика присуща живым организмам и отсутствует у неживых объектов – физических тел. По поводу того, чем же отличается живая материя от неживой, написано много научных работ, которые сходятся в том, что живые организмы способны к целенаправленной жизнедеятельности. Неодушевленные, неживые объекты такой способностью не обладают. В настоящее время никто не спорит с тем положением, что активная целенаправленная жизнедеятельность возможна только в том случае, если имеется возможность самоуправления этой жизнедеятельностью.
Ключевым в таком определении предмета психологии является понятие «управление».
Вряд ли кто-то станет спорить, что мир бесконечен и непознаваем до конца и что возможна некая непознаваемая сущность, если хотите, Бог или Природа, которая оказывает влияние, а может быть и управляет душой живого организма, в то время как душа, допускающая ее познание, управляет самим организмом. Душа – «псюхе», психика – управляет человеком как целостным объектом, не выделяя его отдельных органов или составляющих частей. Различные науки, изучающие человека, определяя свой предмет изучения, выделяют различные аспекты жизнедеятельности организма, причем аспект управления активной целенаправленной жизнедеятельностью организма стал предметом изучения науки, в название которой вошло слово «душа» – науки психологии. В монографиях, посвященных теоретическим проблемам управления в технике, в кибернетике, в психологии и т.д. механизм управления давно уже понимается как система с обратной связью, включающая в свою структуру три основные компонента, связанные как прямой, так и обратной связью.
Отметим, что данная модель ни в коем случае не претендует на то, чтобы продемонстрировать всю сложность и многогранность механизма управления. В этой модели подчеркивается системный характер функционирования управления, предполагающий прямые и обратные связи отдельных элементов.
В отечественной психологии также неоднократно делались попытки представить структуру и функционирование психики как систему с обратной связью. Это и рефлекторное кольцо, и системный подход Н. А. Бернштейна к анализу движений, и акцептор действия П. К. Анохина и другие более или менее известные попытки объяснить функционирование психики, используя системные принципы. Рассматривая психику как функциональную систему, эти авторы, безусловно, стремились к целостному пониманию психики , когда все элементы психики логически связаны друг с другом.
Наиболее четко идея целостности психики и системной взаимосвязи отдельных компонентов психики – мотива, образа и действия, нашла свое отражение в работах М.Г. Ярошевского, использовавшего системный подход для категориального анализа «... развития психологического познания как деятельности». Он убедительно показал, что слабость и односторонность популярных психологических теорий – психоанализа, гештальтпсихологии и бихевиоризма состоит как раз в том, что эти теории не используют всестороннего, целостного, системного подхода к изучению психики и, в конечном счете, ограничены в понимании предмета психологии. Так, психоанализ, гештальтпсихология и бихевиоризма анализируют соответственно потребности и мотивы, психический образ и деятельность, но не рассматривают психику в целом, во всей полноте ее свойств.
Необходимо отметить, что системная концепция психики шире, чем любая традиционная психологическая теория, в том числе и теория деятельности, и в то же время не противоречит ни одной из них. Именно в ней реализуется целостный подход к психике.
Итак, в соответствии с системной концепцией психики:
– психика – открытая система самоуправления целенаправленной жизнедеятельностью, присущая живому организму;
– психика, понимаемая как система самоуправления целенаправленной жизнедеятельностью организма, имеет свою внутреннюю, присущую ей логику и может рассматриваться как с точки зрения функционирования отдельных элементов системы и их взаимосвязи, так и с точки зрения функционирования системы в целом.
В свете системного подхода психика – это многоуровневая, самоорганизующаяся, динамическая и открытая система, которая отличается рядом специфических свойств и характеристик.
1. Активный и избирательный характер отражения явлений действительности, их отношений и взаимосвязей, позволяющий субъекту не только ориентироваться в окружающем мире, но и познавать его. Данное системное свойство проявляется в двух фундаментальных характеристиках:
а) чувствительность – общая способность к ощущению;
б) нехарактерная для физических объектов ннтенциоиальность, то есть направленность на внеположное другое, которая на высших уровнях развития психики становится произвольной.
2. «Опережающий» характер психического отражения, который так же проявляется в двух основных способностях:
а) антиципация или способность к предвидению, не только констатирующий, но и опережающий / прогностический характер информационных процессов;
б)способность к построению временной перспективы, планированию и организации деятельности во времени.
3. Способность к преобразованию энергии внешних воздействий в целостную информацию о мире (картину мира), которая на высших уровнях развития психики может быть осознана, проанализирована и осмыслена.
4. Активный и целенаправленный характер приспособления (адаптации) к окружающему миру.
5. Обусловленность процессов развития и самоорганизации факторами социокультурного окружения. Данное системное свойство выражается в опосредованности высших психических функций опытом социального взаимодействия и знаковыми системами.
6. На высших уровнях развития тенденция к таким сложным формам организации и саморегуляции как сознание, самосознание, личность, предполагающая:
а) активное отражение не только внешнего мира (рефлекторная деятельность), но также собственных внутренних состояний и процессов (рефлексия);
б) самодетерминацию т.е. активное целеполагание и самоопределение.
7. Аксиологический (ценностный) и смыслообразующий характер высших форм организации психики:
а) регуляция психической активности посредством значений, смыслов и ценностных ориентации;
б) способность к реализации базовых ценностей культуры и к творческому смыслообразованию.
Психические явления
Психика проявляется в психических явлениях.
Все психические явления делятся на три группы:
- психические процессы
- психические состояния
- психические свойства личности.
Психические процессы – это динамическое отражение действительности в различных формах психических явлений. Они подразделяются на познавательные (к ним относятся ощущения и восприятия, представления и память, мышление и воображение), эмоциональные (активные и пассивные переживания), волевые (решение, исполнение, волевое усилие и т.д.).
Психическое состояние – определившийся в данное время относительно устойчивый уровень психической деятельности, который проявляется в повышенной или пониженной активности личности.
Каждый человек ежедневно испытывает различные психические состояния. При каком-то одном умственная или физическая работа протекает легко и продуктивно, а при другом – трудно и неэффективно.
Наиболее изучены:
- общее психическое состояние, например внимание, проявляющееся на уровне активной сосредоточенности или рассеянности;
- эмоциональные состояния, или настроения (жизнерадостное, восторженное, грустное, печальное, гневное, раздражительное настроение, состояние депрессии, воодушевления, творческое состояние и т. п.).
Высшими и устойчивыми регуляторами психической деятельности являются свойства личности.
Под психическими свойствами следует понимать устойчивые образования, обеспечивающие определенный качественно-количественный уровень деятельности и поведения, типичный для того или иного человека. Они синтезируются и создают сложные структурные образования личности, к которым необходимо отнести:
1) жизненную позицию (систему потребностей, интересов, убеждений, идеалов, определяющую избирательность и уровень активности человека);
2) темперамент (систему природных свойств личности (подвижность, уравновешенность поведения и тонус активности), характеризующую динамическую сторону поведения);
3) способности (систему интеллектуально-волевых и эмоциональных свойств, определяющую творческие возможности личности);
4) характер как систему отношений и способов поведения.
К психическим свойствам личности относятся:
- темперамент;
- направленность;
- способности;
- характер.
Психические процессы, состояния и свойства человека являются едиными проявлениями его психики. Поэтому одно и то же проявление психики может быть рассмотрено в различных отношениях. Например, аффект как психическое свойство представляет собой общую характеристику эмоциональных, познавательных и поведенческих аспектов психики субъекта в определенный, относительно ограниченный отрезок времени; как психический процесс он характеризуется стадиальностью развития эмоций; он может рассматриваться и как проявление психических свойств индивида – вспыльчивости, несдержанности, гневливости.
В.А. Ганзен, считает категории процесс и состояние противоположными, разграничивая их по признаку динамичности. Актуальное психическое состояние, по мнению автора, характеризуется совокупностью значений параметров одновременно протекающих процессов и является для них фоном.
Между двумя категориями существуют сложные диалектические взаимосвязи: психические процессы в определенных условиях могут рассматриваться как состояния. Однако процессы преимущественно выполняют функцию отражения, а состояния – функцию регулирования.
По мнению А. О. Прохорова, автономность категорий процессы и состояния заключается во временном аспекте, а также в обусловливании процессов психическими состояниями, которые задают диапазон их изменений, особенности развертывания и способа организации.
Рассмотрим некоторые характеристики психического состояния:
психические процессы: 1 – ощущения, 2 – четкость восприятий, 3 – особенности представлений, 4 - память, 5 – мышление, 6 – воображение, 7 – речь, 8 – эмоциональные процессы, 9 – волевые процессы, 10 – внимание;
физиологические реакции: 11 – температурные ощущения, 12 – состояние мышечного тонуса, 13 – координация движений, 14 - двигательная активность, 15 – сердечнососудистая система, 16 - проявления со стороны органов дыхания, 17 – состояние потоотделения, 18 – ощущения со стороны желудочно-кишечного тракта, 19 – состояние слизистой оболочки полости рта, 20 – окраска кожных покровов;
шкала переживаний: 21 – тоскливость – весёлость, 22 – грустность – оптимистичность, 23 – печаль - задорность, 24 - пассивность – активность, 25 – сонливость – бодрость, 26 – вялость – бойкость, 27 – интенциональность переживаний, 28 – напряжённость – раскрепощённость, 29 - тяжесть – лёгкость, 30 - скованность – раскованность;
поведение: 31 – пассивность – активность, 32 – непоследовательность – последовательность, 33 - импульсивность - размеренность, 34 - необдуманность – продуманность, 35 - неуправляемость – управляемость, 36 – неадекватность - адекватность, 37 – расслабленность – напряжённость, 38 – неустойчивость – устойчивость, 39 – неуверенность – уверенность, 40 – закрытость – открытость.
Психические процессы непосредственно связаны с психическими состояниями и свойствами. Эту связь можно проиллюстрировать следующей таблицей.
Таблица. Формы проявления психики человека
Процессы |
Состояния |
Свойства |
|
Когнитивные: |
устойчивый интерес, творческий подъем, апатия, угнетенность и др. |
Рассудительность – беспечность |
|
Эмоциональные |
скука, печаль, радость, конфликтные эмоциональные состояния – стресс, аффект, фрустрация |
эмоциональная устойчивость/ эмоциональная неустойчивость |
|
мобилизационная готовность, инициативность, целеустремленность, решительность, настойчивость, сосредоточенность, решимость, сдержанность |
смелость – робость |
||
Мотивации |
желания, стремления, интересы, влечения, страсти, сомнение, неуверенность, растерянность, замешательство, страх (боязнь), надежда, когнитивный диссонанс («познавательное несоответствие») |
Связанные с экстернальностью: безропотность, кротость, покорность-послушность, безоговорочное подчинение чужим требованиям, приказам, уступчивость, покладистость, податливость на уговоры, реактивность. Связанные с интернальностью: инициативность, упрямство. Связанные с принятием решений: догматичность, капризность, своенравность, самодурство, эгоистичность, нерешительность, легкомыслие, безрассудность – не сдерживаемое доводами рассудка принятие решения (отсюда – безрассудные поступки как свойство личности), безответственность, делячество, импульсивность, корыстолюбие, самоуверенность, самонадеянность, своеволие, своенравие, дальновидность, благоразумие, обстоятельность, самостоятельность, рисковость |
|
Также различают интегральные психические свойства и образования, такие, например, как принципиальность или самоотверженность личности и др. Принято выделять социально-психологических свойств личности (социальный интеллект, социальная компетентность, стиль лидерства и др. Объективные личностные особенности: отчужденность – отзывчивость; сознательность – безответственность; доверчивость – подозрительность; дипломатичность – прямолинейность; радикализм – консерватизм и др..
В современной психологии сложилось разделение психических процессов на три основные подсистемы:
- когнитивную
- регулятивную
- коммуникативную.
Когнитивная подсистема включает процессы, обеспечивающие познание внешней среды, ориентировку в ней (познавательные процессы: ощущение, восприятие, представление, внимание, воображение, память, мышление); вторая – процессы, направленные на построение, организацию и регуляцию деятельности и поведения (волевые, эмоциональные, мотивационные процессы); третья – процессы, обеспечивающие коммуникацию, взаимодействие между людьми.
Если классифицировать психические процессы по степени их интегрированности, то можно выделить три уровня:
- когнитивные, эмоциональные, волевые и мотивационные процессы
- регулятивные (интегральные) процессы
- рефлексивные процессы
Рефлексивность выступает как мета-способность, входящая в когнитивную подструктуру психики, выполняя регулятивную функцию для всей системы, а рефлексивные процессы – как «процессы третьего порядка» (считая процессами первого порядка когнитивные, эмоциональные, волевые, мотивационные, а второго порядка – синтетические и регулятивные, к которым относятся целеобразование, планирование, прогнозирование, принятие решения, самоконтроль, и др.). Рефлексия представляет собой наивысший по степени интегрированности процесс; она одновременно является способом и механизмом выхода системы психики за собственные пределы, что детерминирует пластичность и адаптивность личности.
В данном подходе рефлексия является синтетической психической реальностью, которая является одновременно процессом, свойством и состоянием. Рефлексия – это одновременно и свойство, уникально присущее лишь человеку, и состояние осознания чего-либо, и процесс репрезентации психике своего собственного содержания.
Как специфическая для человека способность рефлексия – это принципиально присущая ему возможность восприятия не только внешнего, но и внутреннего мира. Это способность к самоотражению своей психики, что является основой свойства и феномена сознания. Кроме того, это как бы процесс «мышления о мышлении», когда предметом, объектом мышления становится оно само. Как состояние рефлексия характеризуется погруженностью человека в свои мысли и чувства, его отстраненностью от окружающих событий и явлений.
Функциональная система
Теория функциональных систем, предложенная П.К.Анохиным, изменяет традиционное «органное» мышление и открывает картину целостных интегративных функций организма, т.е. постулирует функциональный подход к физиологическим явлениям.
Возникнув на основе теории условных рефлексов И.П.Павлова, теория функциональных систем явилась ее творческим развитием. Вместе с тем в процессе развития самой теории функциональных систем она вышла за рамки классической рефлекторной теории и оформилась в самостоятельный принцип организации физиологических функций. Функциональные системы имеют отличную от рефлекторной дуги циклическую динамическую организацию, вся деятельность составляющих компонентов которой направлена на обеспечение различных приспособительных результатов, полезных для организма и для его взаимодействия с окружающей средой и себе подобными.
Функциональная система – это такое сочетание (согласованная деятельность) нервных процессов и органов тела человека, которое позволяет ему как эффективно выполнять определенные задуманные действия, так и исправлять их результаты (если они неверны), тем самым адаптируясь в окружающей среде.
Наиболее детально механизм управления действиями и деятельностью рассмотрен в схеме П. К. Анохина, которая целиком приложима и к произвольному управлению.
Любая функциональная система, согласно представлениям П.К.Анохина, имеет принципиально однотипную организацию и включает следующие общие, притом универсальные для разных функциональных систем периферические и центральные узловые механизмы:

Рис. Организация функциональной системы по П.К. Анохину
Функциональная система включает следующие элементы: 1) управляющее устройство – нервный центр; 2) выходные каналы, посредством которых осуществляется связь с рабочими органами (эффекторы) – нервная и гормональная регуляция; 3) исполнительные органы – эффекторы, обеспечивающие в ходе физиологической деятельности поддержание регулируемого процесса показателя на некотором оптимальном уровне (полезный результат деятельности функциональной системы); 4) рецепторные системы, воспринимающие информацию о параметрах отклонения регулируемого процесса показателя от оптимального уровня; 5) канал обратной связи (входные каналы) с передачей информации от рецепторов к нервному центру.
Схема управления действиями человека, по П. К. Анохину, включает в себя пять блоков:
А – блок афферентного синтеза;
Б – блок принятия решения;
В – блок составления программы действия или деятельности в целом;
Г – блок исполнения и получения результата;
Д – блок обратной связи, поставляющей информацию о результатах совершенного действия.

Рис. Схема функциональной системы по П.К. Анохину.
ОА – обстановочная афферентация, ПА – пусковая афферентация
Рассмотрим, как функционируют эти блоки и каков их вклад в произвольное управление действиями.
Афферентный синтез (от лат. afferens (afferentis) – приносящий) – в теории функциональной системы (П. К. Анохин) синтез материала, запечатленного в памяти, мотивации, информации о среде и пускового стимула с целью принятия решения. Память трактуется при этом как совокупность взаимосвязанных функциональных систем различного уровня иерархии, сформированных в процессе эволюции и в индивидуальном жизненном опыте, а мотивация – как конкретизация одной из потребностей организма. При афферентном синтезе благодаря мотивации актуализируются все системы, деятельность которых когда-либо приводила к удовлетворению данной потребности. Информация о среде помогает достигнуть требуемых в данной обстановке результатов. Окончательное решение осуществляется в тот момент, когда какое-либо событие – пусковой стимул – дает перевес одной из систем, уже выбранных под действием мотивации и обстановки. В связи с тем, что иерархическая организация систем в памяти отражает эволюционную и индивидуальную историю приспособительных соотношений организма со средой, существует и соответствующая иерархия афферентного синтеза. Подобно любому системному процессу афферентный синтез имеет место не в какой-либо отдельной структуре мозга, а представляет собой процесс взаимодействия нейронов самой различной (центральной и периферической, афферентной и эфферентной) морфологической принадлежности в объеме всего мозга и организма.
Афферентный синтез, по теории П. К. Анохина, осуществляется при взаимодействии четырех факторов: 1) пусковой афферентации; 2) обстановочной афферентации; 3) памяти и 4) мотивации.
Афферентация (от лат. afferentis – «приносящий») – постоянный поток нервных импульсов, поступающих в центральную нервную систему от органов чувств, воспринимающих информацию как от раздражителей внешних (экстерорецепция), так и от внутренних органов (интерорецепция). Находится в прямой зависимости от силы раздражителей и насыщенности ими среды, а также от состояния – активности или пассивности – индивида.
Обстановочная афферентация – сумма афферентных возбуждений, возникающих в конкретных условиях и сигнализирующих об обстановке, в которой находится организм. Обстановочная афферентация действует на организм, в котором имеется тот или иной уровень мотивационного возбуждения (мотивация).
Под пусковой афферентацией понимается толчок, т.е. стимул, который, вскрывая имеющуюся в центральной нервной системе структуру возбуждения, приводит к появлению вовне какой-либо деятельности организма. Успех ответного действия есть синтетическое целое обстановочной и пусковой афферентации и что удельный вес той и другой может меняться в зависимости от складывающихся условий жизни организма. Эксперименты показали, что этот постоянный органический синтез двух видов афферентации осуществляется при некотором участии лобных отделов коры больших полушарий. Включением обратной афферентации действие обстановки, в которой находится данное животное или человек, возрастает еще больше.
Обратная афферентация является аналогом обратных связей в кибернетике и имеет большое значение для физиологии и медицины. В любом физиологическом процессе или в поведенческом акте, который направлен на получение какого-то приспособительного эффекта, обратная афферентация информирует о результатах совершенного действия, давая возможность организму в целом оценить степень успеха выполненного действия.
Обратные афферентации, возникающие при каком-либо двигательном акте, разделяют на две совершенно различные категории: а) направляющую движение и б) результативную афферентацию. В то время как первая афферентация представлена только проприоцептивными импульсациями от мышц, осуществляющих движение, вторая афферентация всегда комплексная и охватывает все афферентные признаки, касающиеся самого результата предпринятого движения. Обе афферентации всегда имеют организующее влияние на формирование последующих действий организма. В самом деле, последующие двигательные акты организма будут находиться в прямой зависимости от того, в какой степени обратная афферентация о результатах действия соответствует исходному стимулу.
Пусковой сигнал воспринимается с помощью органов чувств в виде ощущений, посылающих соответствующие раздражителю сигналы по проводникам, идущим в нервные центры, – афферентным (чувствительным) нервам. В центральной нервной системе эти сигналы обрабатываются, в результате чего ощущения синтезируются и возникает восприятие объектов и ситуаций. «Опознание» пусковой информации происходит с помощью долговременной и кратковременной памяти, т.е. следов от предшествующей активности человека в аналогичных ситуациях.
Переработка в центральной нервной системе пусковой информации имеет прежде всего задачу определить значимость для человека данного сигнала. Это особенно важно в тех случаях, когда поступает одновременно несколько сигналов и человек должен выбрать, на какой из них следует реагировать сейчас, на какой – потом, на какой вообще не нужно реагировать. Однако прежде чем принять окончательное решение, человек должен сопоставить пусковую афферентацию с обстановочной (фоновой) афферентацией, сообщающей о состоянии самого человека, о внешней ситуации. Если ситуация мешает получению обычной, стандартной реакции на данный стимул, в программу действия по достижению цели вносятся поправки.
Опознание пускового сигнала (в роли которого может выступать и потребность) приводит к появлению «модели потребного будущего», по выражению Н.А. Бернштейна, т.е. модели того, что должно произойти при реагировании на этот стимул.
Мотивационное возбуждение, возникающее на основе потребности, заключает в своей архитектонике свойства тех раздражителей, которые приводят к удовлетворению данной потребности: воздействуя на корковые клетки, оно создает особую химическую «настроенность». Такая настроенность клеток определяет их реакцию, благодаря чему осуществляется активная фильтрация сенсорной информации. Таким образом, потребностное возбуждение определяет активное использование и подбор специальных раздражителей из внешнего мира, сигнализирующих об объектах, способных удовлетворить исходную потребность организма. Это опережающее отражение результата деятельности формируется на основе афферентного синтеза.
Деятельность человека разнообразна как по смыслу и действиям, так и по тем условиям, в которых она протекает. Разные цели, задачи и условия деятельности предъявляют и разные требования к человеку и его функциональным системам. Поэтому функциональные системы каждый раз при изменении программы и условий деятельности частично или полностью реорганизуются, т.е. могут состоять из разного количества блоков, выполняющих свои специфические функции (в каждой функциональной системе участвуют разные психические процессы, двигательные и волевые качества и т.д.). Это значит, что архитектоника (строение) функциональных систем, формирующихся для получения полезных результатов (решения задачи), различна. Несмотря на это, все функциональные системы, независимо от уровня их организации и количества составляющих их компонентов, имеют принципиально одинаковую функциональную архитектуру и принципы функционирования, под которыми понимаются законы упорядочения деятельности субсистем с целью получения полезного результата.
Очевидно, эти представления П. К. Анохина целесообразно дополнить представлениями А. А. Ухтомского о доминанте. Согласно этим представлениям, доминанта как временно господствующий очаг возбуждения (а потребностное возбуждение можно назвать таковым) понижает пороги к адекватным раздражителям (соответствующим доминанте) и повышает пороги к тем раздражителям, которые не имеют к ней отношения. Следовательно, доминанта способствует избирательному восприятию стимулов, раздражителей, сигнализирующих о предмете удовлетворения потребности.
Доминирующая мотивация формируется на основе ведущей потребности, при участии мотивационных центров гипоталамуса. На стадии афферентного синтеза доминирующая мотивация активирует память.
Встраиваясь в процесс произвольного управления, описанные выше непроизвольные, не зависящие от воли человека механизмы получения и переработки информации помогают принятию обоснованного решения, как бы высвечивая, как лучи прожектора, те объекты и их свойства, которые необходимы для удовлетворения потребности.
Таким образом, «афферентный синтез» приводит к получению человеком «информации к размышлению», т.е. сведений, необходимых для принятия обоснованного решения: какой должна быть цель, каковы внешние и внутренние условия для ее достижения.
Принятие решения связано с уверенностью или неуверенностью человека. Эта характеристика выражается в убежденности или, наоборот, в сомнении человека в правильности принятого решения. Уверенность побуждает человека к действию по реализации программы, сомнение заставляет осуществить всестороннюю проверку принятого решения. В результате выполнение действия задерживается.
Степень уверенности определяется рядом внешних и внутренних факторов. К числу первых относится информация: чем меньшими сведениями обладает человек и чем больше имеется кажущихся равнозначными вариантов, тем (при прочих равных условиях) он в большей степени чувствует неуверенность. Способствуют неуверенности такие факторы, как неожиданная ситуация, новая обстановка, отсутствие опыта. Внутренние (психологические) факторы, вызывающие неуверенность, – это тревожность, нерешительность как личностные характеристики.
У некоторых людей (импульсивных, страстных, с повышенной самооценкой) уверенность перерастает в самоуверенность, что приводит к прогнозированию без достаточно тщательного учета всех обстоятельств и собственных возможностей. Такие личности, по наблюдению С.Л. Рубинштейна, как бы преднамеренно отдают себя во власть обстоятельств, будучи уверенными, что надлежащий момент принесет им и надлежащее решение. Поэтому считается, что некоторая степень сомнения и боязни даже ценна, так как этим гарантируется известная граница безопасности.
Но, как писал Н. А. Бернштейн, афферентные сигналы часто содержат лишь информацию о том, «что есть», но не о том, «что надо делать». В связи с этим необходим следующий этап управления: определение того, как, с помощью каких наличных ресурсов и средств можно достичь цели, «потребного будущего». Это связано с программированием действий.
Программирование действий. Программирование двигательных действий должно, во-первых, предусматривать параметры движений (пространственные, скоростные, темповые, величину необходимого усилия) и, во-вторых, ход движений в деталях. Первая функция коррелирует с задающим механизмом, вторая – обеспечивающая «кинетическую мелодию» – с программирующим механизмом (Л. В. Чхаидзе ). И принятие решения, и программирование связаны со способностью человека «заглядывать вперед», т.е. экстраполировать будущее.
Частным видом экстраполяции является антиципация, или упреждающее реагирование на какие-то сигналы, движущиеся объекты.
Предвидение во многих случаях не может быть абсолютным, а носит вероятностный характер: даже при безусловно- и условно-рефлекторном реагировании статистический аппарат мозга вычисляет наиболее вероятный вариант действия, позволяющий достигать цели, или вариант ответа на сигнал.
Способность сопоставлять поступающую информацию о наличной ситуации с хранящейся в памяти информацией о прошлом опыте и строить на основании всех этих данных гипотезы о предстоящих событиях, приписывая им ту или иную вероятность, названа вероятностным прогнозированием.
Различают объективную и субъективную вероятность. Первая характеризует, например, частоту возникновения той или иной ситуации. Вторая – это ожидаемая частота события. Субъективная вероятность может не соответствовать объективной. При отсутствии информации, когда, например, человек приступает к выполнению незнакомой задачи, он исходит из осознанного или неосознанного допущения, что события равновероятны; в действительности же, например, какое-то одно событие может случаться чаще других. Это приводит к тому, что сначала человек допускает при прогнозировании много ошибок. Приобретая опыт, он начинает приближать субъективную вероятностную оценку событий к объективно существующей вероятности, в результате чего его поведение становится адекватным ситуации.
Память, участвующая в программировании, должна хранить сведения не только о минувших событиях, но и о вероятности их наступления, и о связях между наступлением разных событий. Известную роль в вероятностном прогнозировании играют эмоции, которые, могут восполнять недостаток информации и, окрашивая ситуацию в тот или иной эмоциональный фон (приятный или неприятный), повышать или понижать субъективную вероятность ответной реакции.
Программирование действий и деятельности осуществляется в трех возможных вариантах: при наличии полной информации, при наличии частичной информации и при полном отсутствии информации. Эти варианты соответствуют вероятности от единицы до нуля. При вероятности, равной единице, предусматривается жесткая программа деятельности; поиск как таковой отсутствует. Например, спринтер знает, что при выстреле стартера нужно начать бег. При абсолютном отсутствии информации вероятностное программирование бесполезно, поэтому при полной неопределенности поиск осуществляется методом «проб и ошибок», т.е. сводится к случайному (слепому) получению полезного результата (это соответствует внешнему поиску объекта удовлетворения потребности. К последнему варианту достижения цели ученые относятся по-разному. Одни считают его универсальным биологическим методом адаптации, другие считают частным случаем и его обусловленность видят только в отсутствии информации. Очевидно, к оценке этого способа надо подходить дифференцированно, как это делал У. Эшби: если видеть в нем просто попытку достижения цели, то это действительно «второсортный» способ; если же рассматривать его как вариант получения информации, необходимой для достижения цели, то этот способ может играть большую роль в приобретении опыта.
При промежуточном варианте (когда человек обладает неполной информацией), который встречается наиболее часто, прогнозирование затруднено и осуществляется различными способами:
1. Человек предпочитает действовать по «жесткой» программе.
2. Он выбирает несколько вариантов и действует то по одному, то по другому варианту.
3. Он не имеет заранее обдуманного решения и действует в зависимости от ситуации, что требует высокого развития тактического мышления.
По окончании программирования следуют сигнал к реализации программы и выполнение самой программы (действие или деятельность). Этому этапу на рисунке соответствует блок Г.
Однако на этом процесс управления не заканчивается. Человек должен знать, как поэтапно и в целом осуществляется программа и в случае отклонения от нее вносить исправления, возвращающие систему в запрограммированное русло. Контроль за действиями осуществляется с помощью обратной связи и акцептора результата действия (аппарата сличения).
Итак, достижение приспособительного результата осуществляется с помощью специфических механизмов, из которых наиболее важными являются:
1. афферентный синтез всей поступающей в нервную систему информации;
2. принятие решения с одновременным формированием аппарата прогнозирования результата в виде афферентной модели акцептора результатов действия;
3. собственно действие;
4. сличение на основе обратной связи афферентной модели акцептора результатов действия и параметров выполненного действия;
5. коррекция поведения в случае рассогласования реальных и идеальных (смоделированных нервной системой) параметров действия.
Функциональная система по П.К.Анохину – кибернетическая схема управления организмом, нацеленная на достижение полезных для организма результатов. Функциональная система характеризует следующие свойства схемы управления поведением:
- целенаправленность, связанную с необходимостью удовлетворения потребностей животного;
- мотивацию, задающую предпосылки (например, обусловленные потребностями) для формирования цели;
- доминанту, обеспечивающую мобилизацию ресурсов животного на достижение приоритетной цели, в том числе мобилизацию интеллектуальных ресурсов (концентрацию внимания);
- распознавание ситуации;
- «планирование» действий;
- принятие решения;
- прогноз результата действия;
- выполнение самого целенаправленного действия;
- оценку результата действия;
- сопоставление прогноза и результата;
- поиск нужного решения и корректировку базы знаний (в случае рассогласования прогноза и результата) – обучение.

Рис. Кибернетическая схема функциональной системы (в духе П.К. Анохина)
Распознавание, планирование, принятие решения основываются на использовании базы знаний, которая пополняется при обучении.
Важное понятие функциональной системы – мотивация. Роль мотивации – формирование цели и поддержка целенаправленных форм поведения. Мотивация может рассматриваться как активная движущая сила, которая стимулирует нахождение такого решения, которое адекватно потребностям животного в рассматриваемой ситуации. Мотивация тесно связана с понятием доминанты, которое ввел А.А. Ухтомский. Доминанта мобилизует ресурсы человека на достижение заданной цели. В частности, мобилизуются нервные ресурсы, так что внимание животного концентрируется на приоритетной цели.
Состав функциональной системы не определяется пространственной близостью структур или их анатомической принадлежностью. В нее могут включаться как близко, так и отдаленно расположенные системы организма. Она может вовлекать отдельные части любых цельных в анатомическом отношении систем и даже детали отдельных целых органов. При этом отдельная нервная клетка, мышца, часть какого-либо органа, весь орган в целом могут участвовать своей активностью в достижении полезного приспособительного результата, только будучи включены в соответствующую функциональную систему. Фактором, определяющим избирательность этих соединений, является биологическая и физиологическая архитектура самой функциональной системы, а критерием эффективности этих объединений является конечный приспособительный результат. Функциональная система характеризуется:
1. степенью пластичности, т.е. способностью менять составляющие их компоненты. Например, функциональная система, обеспечивающая дыхание, состоит преимущественно из врожденных структур и поэтому обладает малой пластичностью: в акте дыхания, как правило, участвуют одни и те же центральные и периферические компоненты. В то же время функциональная система, обеспечивающая движение тела, пластична и может достаточно легко перестраивать компонентные взаимосвязи (до чего-то можно дойти, добежать, допрыгать, доползти);
2. индивидуальными и меняющимися требованиями к афферентации. Именно количество и качество афферентных импульсов характеризует степень сложности, произвольности или автоматизированности функциональной системы;
3. способностью к саморегуляции, которая присуща ей как целому. При возможном дефекте функциональной системы происходит быстрая перестройка составляющих ее компонентов так, чтобы необходимый результат, пусть даже менее эффективно (как по времени, так и по энергетическим затратам), но все же был бы достигнут.
Начальную стадию поведенческого акта любой степени сложности, а следовательно, и начало работы функциональной системы составляет афферентный синтез. Важность афферентного синтеза состоит в том, что эта стадия определяет все последующее поведение организма. Задача этой стадии – собрать необходимую информацию о различных параметрах внешней среды. Благодаря афферентному синтезу из множества внешних и внутренних раздражителей организм отбирает главные и создает цель поведения. Поскольку на выбор такой информации оказывает влияние как цель поведения, как и предыдущий опыт жизнедеятельности, то афферентный синтез всегда индивидуален. На этой стадии происходит взаимодействие трех компонентов: мотивационного возбуждения, обстановочной афферентации (т.е. информации о внешней среде) и извлекаемых из памяти следов прошлого опыта. В результате обработки и синтеза этих компонентов принимается решение о том, «что делать» и происходит переход к формированию программы действий, которая обеспечивает выбор и последующую реализацию одного действия из множества потенциально возможных. Команда, представленная комплексом эфферентных возбуждений, направляется к периферическим исполнительным органам и воплощается в соответствующее действие.
Необходимой частью функциональной системы является акцептор результатов действия – центральный аппарат оценки результатов и параметров еще не совершившегося действия. Таким образом, еще до осуществления какого-либо поведенческого акта у живого организма уже имеется представление о нем, своеобразная модель или образ ожидаемого результата.
В процессе реального действия от акцептора идут эфферентные сигналы к нервным и моторным структурам, обеспечивающим достижение необходимой цели. Об успешности или неуспешности поведенческого акта сигнализирует поступающая в мозг афферентная импульсация от всех рецепторов, которые регистрируют последовательные этапы выполнения конкретного действия (обратная афферентация). Оценка поведенческого акта как в целом, так и в деталях невозможна без такой точной информации о результатах каждого из действий. Этот механизм является абсолютно необходимым для успешной реализации каждого поведенческого акта. Более того, любой организм немедленно бы погиб, если бы подобного механизма не существовало.
Структура процесса мышления. Мышление представляет собой процесс познавательной деятельности, при котором субъект оперирует различными видами обобщений, включая образы, понятия и категории.
Появление речи в процессе эволюции принципиально изменило функции мозга. Мир внутренних переживаний, намерений приобрел качественно новый аппарат кодирования информации с помощью абстрактных символов. Это не только обусловило возможность передачи информации от человека к человеку, но и сделало качественно иным процесс мышления. Мы лучше осознаем, понимаем мысль, когда облачаем ее в языковую форму. Вне языка мы переживаем неясные побуждения, которые могут быть выражены лишь в жестах и мимике, Слово выступает не только как средство выражения мысли: оно перестраивает мышление и интеллектуальные функции человека, так как сама мысль совершается и формируется с помощью слова.
Суть мышления – в выполнении некоторых когнитивных операций с образами во внутренней картине мира. Эти операции позволяют строить и достраивать меняющуюся модель мира. Благодаря слову картина мира становится более совершенной, дифференцированной, с одной стороны, и более обобщенной – с другой. Присоединяясь к непосредственному образу предмета, слово выделяет его существенные элементарные или комплексные признаки, которые непосредственно недоступны субъекту. Слово переводит субъективный смысл образа в систему значений, что делает его более понятным как самому субъекту, так и его партнеру.
С позиции теории функциональных систем П.К. Анохина основные этапы мыслительного процесса могут быть сопоставлены с этапами структуры поведенческого акта. Направленность процесса мышления определяется доминирующей мотивацией субъекта. Афферентный синтез выбирает зону поиска решения проблемы. Поступающая информация анализируется и сопоставляется со знаниями, извлекаемыми из памяти, содержание которых существенно определяется доминирующей мотивацией. Этапу принятия решения соответствует выбор наиболее вероятной гипотезы для ее последующей проверки и доказательств. В акцепторе результатов действия в соответствии с принятой гипотезой формируются некоторые представления о том, что прежде всего следует подтвердить, доказать или опровергнуть. Эфферентный синтез содержит замыслы доказательств и проверок. Выполнение конкретного доказательства, которое подтверждает справедливость выдвинутого предположения, эквивалентно этапу осуществления реального действия. В случае неудачи активируется ориентировочно-исследовательская деятельность субъекта. Она приводит к изменению содержания акцептора результатов, а также эфферентного синтеза. Возникают новые замыслы, идеи и, возможно, привлекаются иные способы доказательств.
У человека различают два основных вида мышления; наглядно-образное и словесно-логическое. Последнее функционирует на базе языковых средств и представляет собой наиболее поздний период филогенетического и онтогенетического развития мышления.
Эмоции. Функциональная система по П.К.Анохину не учитывает эмоциональные процессы. Однако когнитивные (познавательные) и оценочные операции влияют на эмоции и реализуются в мозге, который уже эмоционален и не является аффективно-нейтральным. Чисто когнитивной детерминанты эмоций вообще не существует. Эмоция на значимый стимул – это единство аффективно-когнитивных процессов.

Рис. Схема формирования поступка
Эмоции – внутренний регулятор деятельности. Однако функцию регуляции поведения эмоции выполняют не прямо, а через мотивы, причем нередко мотивы собственного поведения остаются для человека неосознанными. Эта особенность эмоциональных явлений – их тесная связь со сферой бессознательного – также составляет важнейшую специфику эмоций, существенно отличающую ее от познавательных процессов, которые в большей степени осуществляются под контролем сознания.
В теоретическом осмыслении эмоций, как известно, имеются две крайние позиции. С одной стороны, это биологизаторские представления об эмоциях как адаптационном (и только) механизме приспособления психики к среде, с другой – это интеллектуалистические представления об эмоциях как результате дефицита информации. К числу первых относится, например, концепция П.К. Анохина, не видевшего разницы между эмоциями животных и человека ни в качественном, отношении, ни с точки зрения выполняемых ими функций. Примером второй точки зрения является информационная теория П.В. Симонова, сводящая все многообразие эмоций к дефициту информации. И та и другая концепции не могут претендовать на целостную характеристику эмоций как психических явлений, хотя они и отражают определенные аспекты эмоциональной сферы. Прежде всего, эти концепции не учитывают сложный неоднородный состав эмоциональных явлений, составляющих «эмоциональную сферу» человека. В «эмоциональную сферу» человека входят, по-видимому, различные типы эмоциональных явлений, такие, как «эмоциональный тон ощущений», эмоциональная реакция (или эмоциональный процесс), эмоциональные состояния, эмоционально-личностные качества. Каждый из этих типов эмоциональных явлений характеризуется своими закономерностями формирования, функционирования и распада, что нельзя не учитывать при построении общепсихологической концепции эмоций. Общепсихологическая концепция эмоций должна учитывать и центральный для человеческой психики фактор – фактор социального опыта, культурно-исторической детерминации всех человеческих психических явлений, включая и эмоции. Социальная детерминация определяет прежде всего тот предмет (объект), на который направлено эмоциональное явление, т.е. эмоциональную оценку его восприятия. Социальная детерминация (через вид психической деятельности) объясняет возникновение той или иной эмоции. Культурно-историческая детерминация определяет также и формы выражения эмоций, процессы их саморегуляции. Общепсихологическая теория эмоций должна имманентно включать в себя и эти аспекты эмоциональных явлений. Наконец, общепсихологическая концепция эмоций должна включать и представления о механизмах реализации эмоций, т.е. о тех психофизиологических закономерностях, которые обеспечивают их осуществление.
П.К. Анохин разработал биологическую теорию эмоций, в которой подчеркивает адаптивный характер эмоциональных реакций, их регуляторную функцию в обеспечении поведения и адаптации организма к меняющимся условиям окружающей среды. Анохин выделяет два основных стадии в жизнедеятельности любого организма: стадия появления потребности и формирования мотивации и стадия удовлетворения потребности. Каждая из этих стадий обязательно сопровождается эмоциями: первая – в основном негативными, вторая – в основном позитивными.
Эмоции являются ведущим компонентом информационной оценки мозгом внутренних потребностей и действия внешних факторов. Если проблему эмоций рассматривать с биологической точки зрения, то надо будет признать, что эмоциональные ощущения закрепились как своеобразный инструмент, удерживающий жизненный процесс в его оптимальных границах и предупреждающий разрушительный характер недостатка или избытка каких-либо факторов жизни данного организма. Эмоциональный уровень психической деятельности генетически детерминирован и не требует специального обучения.
Отрицательные эмоции возникают и усиливаются всегда в тех случаях, когда возникает рассогласование в деятельности функциональной системы: при возникновении метаболических потребностей и их неудовлетвоернии, при действии на организм повреждающих факторов, когда информация о достигнутых результатах не соответствует запрограммированным в акцепторе.
Положительные эмоции формируются во всех случаях достижения субъектом требуемых результатов. На основе неоднократного удовлетворения однотипной потребности формируется предвидение положительной эмоции при удовлетворении данной потребности за счет ее включения в акцептор результата действия.
Получается, что эмоциональные реакции являются одной из важнейших составляющих процесса научения.
Итак, в соответствии с биологической теорией эмоций П.К. Анохина, ведущие эмоции с отрицательным знаком сигнализируют организму об отклонениях в его внутренней среде (голод, жажда), что активирует соответствующую программу действий. Завершение целенаправленных действий сопровождается положительным эмоциональным фоном, что закрепляется в памяти животного как «получение награды». Объясняя свою позицию, Анохин приводит пример, когда хищник в течение многих дней, целенаправленно преследует свою добычу, что сопровождается как негативными переживаниями (чувство голода), так и позитивными (процесс насыщения). Таким образом: «ведущие эмоции участвуют в формировании функциональной системы, определяя вектор, то есть направленность поведения, постановку цели, формирование акцептора результата действия. Ситуативные эмоции, возникающие при оценке отдельных этапов действия, позволяют корректировать поведение и достигать поставленной цели».
Таким образом, основную информационную нагрузку в биологической теории несет её знак, который маркирует программу поведения и придает последней определенную направленность.
За основу рассмотрения психики как единой целостной функциональной системы в философии и психологии берется понимание психики как отражения действительности и регуляции на этой основе поведения и деятельности. Из такого понимания природы и назначения психики естественно вытекал вопрос, что именно должно быть отражено в психике, что должно быть в ней представлено, чтобы поведение было адекватным внешним и внутренним условиям, а деятельность – успешной. Система основных психических процессов, необходимых для успешного поведения в среде и для успешной деятельности, выстраивается следующим образом:
1. Должна быть отражена наличная предметная действительность, существующая в данном пространстве в данный момент времени.
2. Должны быть представлены события, могущие иметь место в будущем и имеющие место в пространстве за пределами его непосредственной данности.
1 и 2 – это познавательные процессы, которые образуют когнитивную подсистему психики , включающую ощущения и восприятие, опережающее отражение действительности в форме разного рода анципаций и экстраполяций, воображение, мышление.
3. Должны быть отражены нужды собственного организма и личности. Это – потребностно-мотивационная подсистема психики.
4. Должно быть в прямой непосредственной чувственной форме отражено значение для организма и личности (положительное или отрицательное) тех или иных внешних факторов, собственных внутренних состояний, а также результатов взаимодействия организма и личности со средой – природной и социальной. Это – эмоции и чувства, образующие эмоциональную подсистему психики .
5. Обязательно нужно иметь сведения о том, как отражена действительность в психике других людей: что они ощущают и воспринимают в данный момент, что они знают и понимают, о чем думают, что и как предвидят, что чувствуют, каковы их потребности и т.п. Без учета сведений о содержании психики других людей (теоретически – всех, но в конкретных актах поведения и деятельности, конечно, только некоторых в зависимости от обстоятельств) никакое адекватное внешним условиям поведение и никакая успешная деятельность просто невозможны. Вместе с тем каждый человек, если он хочет, чтобы поведение и деятельность других людей были как-то согласованы с его собственным видением мира, собственными чувствами и потребностями, должен передавать им данные содержания своей психики. Эти двусторонние процессы обмена содержаниями и состояниями собственной психики людей осуществляются коммуникативной подсистемой психики , включающей невербальную и вербально-знаковую коммуникацию.
6. Конечно, нужно учитывать весь прошлый успешный опыт отражения и регуляции поведения и деятельности. Это – подсистема памяти .
7. Однако процессы отражения – это только одна сторона дела, поскольку жизненная задача психики – осуществлять адекватные внешней среде и внутренним состояниям субъекта поведение и деятельность. Значит, необходим синтез, интеграция всех сведений, поступающих из шести названных выше подсистем психики. Это осуществляется центральной, интеграционно-волевой подсистемой , где происходит синтез всех сведений, поступающих от других подсистем, идут процессы принятия решений, происходит выработка целей, планов и программ поведения.
8. Любая психическая деятельность требует необходимого активационно-энергетического обеспечения работы всех других подсистем, включая интеграционно-волевую. Это обеспечение осуществляется активационно-энергетической подсистемой психики. При этом чем с более трудными задачами и ситуациями сталкивается человек, чем больше требований предъявляется к целостной функциональной системе его психики и к ее отдельным подсистемам, тем в большей степени (не обязательно линейно и, конечно, до определенного индивидуально обусловленного предела) включается ее активационно-энергетическая подсистема.
Интеграционно-волевая и активационно-энергетическая подсистемы появляются в эволюции позднее после более или менее относительной дифференциации остальных подсистем, когда возникает необходимость в согласовании и интеграции их функций в организации адаптивных актов (или циклов) поведения. В мозге современного человека высшим интегративным центром являются лобные доли коры полушарий, так называемая префронтальная кора. Ее анатомо-функциональные связи говорят о том, что к ней поступают импульсации со стороны всех подсистем развитой функциональной системы психики:
1) проекционных и ассоциативных областей коры (когнитивная и антиципационная подсистемы);
2) гипоталамуса и связанных с ним структур (потребностно-мотивационная подсистема);
3) лимбической системы (эмоциональная подсистема);
4) гиппокампа и относящихся к нему структур (подсистема памяти);
5) речевых областей коры (подсистема речевой коммуникации);
6) ретикулярной формации ствола мозга и других активирующих неспецифических структур (энергетико-активационная подструктура).
Функциональные блоки
мозга
Психические процессы человека являются сложными функциональными системами, и они не локализованы в узких, ограниченных участках мозга, а осуществляются при участии сложных комплексов совместно работающих мозговых аппаратов, каждый из которых вносит свой вклад в организацию этой функциональной системы. Вот почему становится необходимым выяснить, из каких основных функциональных единиц состоит мозг человека, как построена и какую роль играет каждая из них в осуществлении сложных форм психической деятельности.
Можно выделить три основных функциональных блока, или три основных аппарата мозга, участие которых необходимо для осуществления любого вида психической деятельности. С некоторым приближением к истине их можно обозначить как:
1) блок, обеспечивающий регуляцию тонуса и бодрствования;
2) блок получения, переработки и хранения информации, поступающей из внешнего мира;
3) блок программирования, регуляции и контроля психической деятельности.
Каждый из этих основных блоков имеет иерархическое строение и состоит по крайней мере из надстроенных друг над другом корковых зон трех типов: первичных (или проекционных), куда поступают импульсы с периферии или откуда направляются импульсы на периферию, вторичных (или проекционно-ассоциативных), где происходит переработка получаемой информации или подготовка соответствующих программ, и, наконец, третичных (или зон перекрытия), которые являются наиболее поздно развивающимися аппаратами больших полушарий и которые у человека обеспечивают наиболее сложные формы психической деятельности, требующие совместного участия многих зон мозговой коры.
1. Блок регуляции тонуса и бодрствования. Для того чтобы обеспечивалось полноценное протекание психических процессов, человек должен находиться в состоянии бодрствования. Известно, что только в оптимальных условиях бодрствования человек может принимать и перерабатывать информацию, вызывать в памяти нужные избирательные системы связей, программировать свою деятельность и осуществлять контроль за протеканием своих психических процессов, корригируя ошибки и сохраняя направленность своей деятельности.
Хорошо известно, что в состоянии сна четкая регуляция психических процессов невозможна, всплывающие воспоминания и ассоциации приобретают неорганизованный характер, и направленное избирательное (селективное) выполнение психической деятельности становится невозможным.
О том, что для осуществления организованной, целенаправленной деятельности необходимо поддерживать оптимальный тонус коры, говорил еще И.П.Павлов, гипотетически утверждавший, что если бы мы могли видеть, как распространяется возбуждение по коре бодрствующего животного (или человека), мы наблюдали бы «светлое пятно», перемещающееся по коре мозга по мере перехода от одной деятельности к другой и олицетворяющее пункт оптимального возбуждения.
Развитие электрофизиологической техники позволило увидеть это «пятно» оптимального возбуждения: с помощью специального прибора – «топоскопа» М.Н.Ливанова (1962), дающего возможность одновременно регистрировать электрическую активность в 50-100 пунктах коры головного мозга, – можно наблюдать, как в коре мозга бодрствующего животного действительно возникает «пятно» оптимального возбуждения, как оно передвигается при переходе животного из одного состояния в другое и как в патологическом состоянии постепенно теряет свою подвижность, становится инертным или совсем угасает.
И. П. Павлов не только указал на необходимость оптимального состояния мозговой коры для осуществления организованной деятельности, но и открыл основные нейродинамические законы возникновения такого оптимального состояния. Как было показано многочисленными исследованиями павловской школы, процессы возбуждения и торможения, протекающие в бодрствующей коре, подчиняются закону силы, характеризуются определенной концентрированностью, уравновешенностью и подвижностью.
Эти основные законы нейродинамики неприложимы к состояниям сна или утомления. Это является результатом того, что в так называемых «тормозных», или «фазовых», состояниях тонус коры снижается и, как следствие, нарушается закон силы: слабые раздражители уравниваются с сильными по интенсивности вызываемых ими ответов («уравнительная фаза») или даже превосходят их, вызывая более интенсивные реакции, чем те, которые вызываются сильными раздражителями («парадоксальная фаза»), в отдельных случаях реакции сохраняются только в ответ на слабые стимулы, в то время как сильные раздражители вообще перестают вызывать какие-либо ответы («ультрапарадоксальная фаза»). Кроме того, по мере снижения тонуса коры нарушается нормальное соотношение возбудительных и тормозных процессов и та подвижность, которая необходима для протекания нормальной психической деятельности. Все это указывает на то, какое решающее значение имеет наличие оптимального тонуса коры для организованного протекания психической деятельности.
Возникает однако вопрос: какие аппараты мозга обеспечивают поддержание оптимального тонуса коры, о котором мы только что говорили? Какие участки мозга регулируют и изменяют тонус коры, сохраняя его на нужное время и повышая его, когда в этом возникает необходимость?
Одним из наиболее важных в этом плане открытий было установление того факта, что аппараты, обеспечивающие и регулирующие тонус коры, могут находиться не в самой коре, а в лежащих ниже стволовых и подкорковых отделах мозга и что эти аппараты находятся в двойных отношениях с корой, тонизируя ее и в то же время испытывая ее регулирующее влияние.
В 1949 г. два выдающихся исследователя – Мэгун и Моруцци – обнаружили, что в стволовых отделах головного мозга находится особое нервное образование, которое как по своему морфологическому строению, так и по своим функциональным свойствам приспособлено к тому, чтобы осуществлять роль механизма, регулирующего состояния мозговой коры, т.е. способно изменять ее тонус и обеспечивать ее бодрствование.
Это образование построено по типу нервной сети, в которую вкраплены тела нервных клеток, соединяющиеся друг с другом короткими отростками. По сети этого образования, названного ретикулярной формацией , возбуждение распространяется не отдельными, изолированными импульсами, не по закону «все или ничего», а градуально, постепенно меняя свой уровень и, таким образом, модулируя состояние всего нервного аппарата.
2. Блок приема, переработки и хранения информации. Этот блок расположен в конвекситальных (наружных) отделах новой коры (неокортекса) и занимает ее задние отделы, включая в свой состав аппараты зрительной (затылочной), слуховой (височной) и общечувствительной (теменной) областей. По своему гистологическому строению он состоит из нейронов подкорки и мозговой коры. Эти нейроны в отличие от аппаратов первого блока работают не по принципу градуальных изменений, а по закону «все или ничего», принимая отдельные импульсы и передавая их на другие группы нейронов.
Аппараты этого (как и следующего) блока имеют иерархическое строение, распадаясь на первичные (проекционные) зоны, которые принимают информацию и дробят ее на мельчайшие составные части, вторичные (проекционно-ассоциативные) зоны, которые обеспечивают кодирование (синтез) этих составных частей и превращают соматотопическую проекцию в функциональную организацию, и третичные зоны (или зоны перекрытия), обеспечивающие совместную работу различных анализаторов и выработку надмодальных (символических) схем, лежащих в основе комплексных форм познавательной деятельности.
По своим функциональным особенностям аппараты этого блока приспособлены к приему экстероцептивных раздражений, приходящих в головной мозг от периферических рецепторов, к дроблению их на огромное число компонентов (иначе говоря, к анализу их на мельчайшие составляющие детали) и к комбинированию их в нужные динамические функциональные структуры (иначе говоря, к синтезу их в целые функциональные системы).
Таким образом, этот функциональный блок головного мозга обладает высокой модальной специфичностью: входящие в его состав части приспособлены к тому, чтобы принимать зрительную, слуховую, вестибулярную или общечувствительную информацию. В системы этого блока включаются и центральные аппараты вкусовой и обонятельной рецепции, но у человека они настолько оттесняются центральными представительствами высших экстероцептивных, дистантных анализаторов, что занимают в коре головного мозга незначительное место.
3. Блок программирования, регуляции и контроля сложных форм деятельности. Прием, переработка и хранение внешней информации составляют только одну сторону психической жизни человека. Ее другую сторону составляет организация активной сознательной психической деятельности. С этой задачей и связан третий из основных функциональных блоков мозга – блок программирования, регуляции и контроля за протекающей деятельностью.
Человек не только пассивно реагирует на поступающие сигналы. Он формирует планы и программы своих действий, следит за их выполнением и регулирует свое поведение, приводя его в соответствие с этими планами и программами; наконец, он контролирует свою сознательную деятельность, сличая эффект своих действий с исходными намерениями и корригируя допущенные им ошибки.
Все это происходит при активном участии эмоций. Эмоция – особая форма психического отражения, которая в форме непосредственного переживания отражает не объективные явления, а субъективное к ним отношение. Особенность эмоций состоит в том, что они отражают значимость объектов и ситуаций, действующих на субъект, обусловленную отношением их объективных свойств к потребностям субъекта. Эмоции выполняют функции связи между действительностью и потребностями. Можно утверждать, что эмоции возникают в результате воздействия определенного раздражителя, а их появление есть не что иное, как проявление механизмов адаптации человека и регуляции его поведения.
Процессы регуляции и контроля сознательной деятельности требуют совсем иных мозговых аппаратов, чем аппараты первого и второго блоков. Если даже в простых рефлекторных актах наряду с афферентной стороной существует эффекторная сторона и аппараты обратной связи служат контрольным сервомеханизмом, то тем более необходимы такие специальные контролирующие нервные образования в сложных психических актах. Этим задачам и служат аппараты третьего блока головного мозга. Аппараты третьего функционального блока расположены в передних отделах больших полушарий, спереди от передней центральной извилины.
Взаимодействие трех основных функциональных блоков мозга. Было бы неправильным думать, что каждый из этих блоков может самостоятельно осуществлять ту или иную форму деятельности, считая, например, что второй функциональный блок полностью осуществляет функцию восприятия и мышления, а третий – функцию движения и построения действий.
Приняв положение о системном строении сложных психологических процессов, мы должны встать на иную точку зрения. Каждая форма сознательной деятельности всегда является сложной функциональной системой и осуществляется, опираясь на совместную работу всех трех блоков мозга, каждый из которых вносит свой вклад в осуществление психического процесса в целом. Факты, которые хорошо установлены современной психологией, делают это положение бесспорным.
Уже давно прошло то время, когда психологи рассматривали психические функции как изолированные «способности», каждая из которых может быть локализована в определенном участке мозга. Отвергнута и другая концепция, согласно которой психические процессы представлялись по модели рефлекторной дуги, первая часть которой имела чисто афферентный характер и выполняла функции ощущения и восприятия, в то время как вторая – эффекторная – часть целиком осуществляла движения и действия.
Современные представления о строении психических процессов исходят из модели рефлекторного кольца или сложной саморегулирующейся системы, каждое звено которой включает как афферентные, так и эфферентные компоненты и которая в целом носит характер сложной и активной психической деятельности.
Рассмотрим это на двух примерах: восприятия и движения, или действия. Сделаем это лишь в самых общих чертах.
Известно, что ощущение включает в себя двигательные компоненты, и современная психология рассматривает ощущение, и тем более восприятие, как рефлекторный акт, содержащий как афферентные, так и эфферентные звенья; чтобы убедиться в сложном активном характере ощущений, достаточно напомнить, что даже у животных они включают в свой состав процесс отбора биологически значимых признаков, а у человека – и активное кодирующее влияние языка. Еще более отчетливо активный характер процессов выступает в сложном предметном восприятии. Хорошо известно, что предметное восприятие носит не только полирецепторный характер, опираясь на совместную работу целой группы анализаторов, но всегда включает в свой состав активные двигательные компоненты. Решающую роль движений глаз в зрительном восприятии отмечал еще И.М.Сеченов (1874–1878), однако доказано это было лишь в последнее время. В целом ряде психофизиологических исследований было показано, что неподвижный глаз практически не может воспринимать изображение, состоящее из многих компонентов, и что сложное предметное восприятие предполагает активные, поисковые движения глаз, выделяющие нужные признаки, и лишь постепенно, по мере развития принимает свернутый характер.
Все эти факты убеждают нас в том, что восприятие осуществляется при совместном участии всех тех функциональных блоков мозга, из которых первый обеспечивает нужный тонус коры, второй осуществляет анализ и синтез поступающей информации, а третий обеспечивает направленные поисковые движения, создавая тем самым активный характер воспринимающей деятельности.
Именно такое сложное строение восприятия объясняет, почему его нарушения могут возникать при поражении различных, далеко расположенных друг от друга, мозговых аппаратов. Аналогичное можно сказать и о построении произвольного движения и действия.
Участие эфферентных механизмов в построении движения самоочевидно; однако еще Н.А. Бернштейн (1947) показал, что движение не может управляться одними эфферентными импульсами и что для его организованного протекания необходимы постоянные афферентные процессы, сигнализирующие о состоянии сочленений и мышц, положении сегментов движущегося аппарата и тех пространственных координатах, в которых движение протекает.
Таким образом, произвольное движение, и тем более предметное действие, опирается на совместную работу самых различных отделов мозга, и если аппараты первого блока обеспечивают нужный тонус мышц, без которого никакое координированное движение не было бы возможным, то аппараты второго блока дают возможность осуществить те афферентные синтезы, в системе которых протекает движение, а аппараты третьего блока обеспечивают подчинение движения и действия соответствующим намерениям, создают программы выполнения двигательных актов и обеспечивают ту регуляцию и контроль протекания движений, благодаря которым сохраняется его организованный, осмысленный характер.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО «Поморский государственный университет им. М.В. Ломоносова»
КОРЯЖЕМСКИЙ ФИЛИАЛ
ХИМИКО-ГЕОГРАФИЧЕСКИЙ ФАКУЛЬТЕТ
кафедра химии
МЕТОДИЧЕСКИЕ ПОДХОДЫ К ФОРМИРОВАНИЮ ЗНАНИЙ О ХИМИЧЕСКИХ РЕАКЦИЯХ
курсовая работа
Защищена с отметкой _______________
Научный руководитель _____________
Коряжма
Введение
Глава 1.Структура понятия «химическая реакция» и этапы его
формирования
1.1 Понятие «химическая реакция» как система
1.2 Этапы формирования понятия «химическая реакция»
Глава 2.Основные методы, применяемые в разделах о химической
2.1 Введение понятия «химическая реакция»
2.2Формирование знаний отипах химических реакций
2.3Формирование знаний о реакциях ионного обмена
2.4Формирование знаний о химической кинетике
Заключение
Список литературы
Приложение
Введение
Тема данной курсовой работы «Методические подходы к формированию знаний о химической реакциях». Методический подход иначе метод есть способ достижения цели, определенным образом упорядоченная деятельность. Основная цель, которую должен достичь учитель химии при изучении данного понятия: сформировать целую систему знаний о химических реакциях, состоящую из отдельных подсистем, блоков знаний. Учащиеся должны не только освоить теоретический материал этой темы, но и уметь применять полученные знания на практике, понимать те химические процессы, которые заложены в основу химических производств (производство серной кислоты, минеральных удобрений и т.д.) и химические явления, постоянно происходящие в природе (изменение минерального состава горных пород, образование озона в атмосфере), понимать важность применения наиболее безопасных методов получения новых альтернативных строительных материалов для экологии.
Данная тема актуальна, так как необходимо разрабатывать наиболее эффективные методические подходы к формированию знаний о химических реакциях, удовлетворяющих поставленной цели.
Объектом исследования работы является теоретическая система знаний о химической реакции, а предметом – те методические подходы, которые способствуют эффективному пониманию и усвоению знаний о химической реакции.
Цель работы состоит, прежде всего, в рассмотрении системообразующего понятия «химическая реакция», изучении и анализе подходов, использующихся при формировании основных блоков знаний о химической реакции.
Здесь важно изучить основные подсистемы, интегрируемые общим понятием «химическая реакция», показать связи между ними, рассмотреть свойства данной системы, раскрыть этапы формирования данного понятия по мере накопления теоретического материала учащимися, описать методы (их содержание), используемые на современном уровне обучения химии (общелогические, общепедагогические, специфические), показать их применение в совокупности при изучении разделов о химической реакции.
Глава 1. Структура понятия «химическая реакция» и этапы его формирования
1.1 Понятие «химическая реакция» как система содержания учебного предмета
Система понятий о химической реакции – это весьма сложная, многоплановая, многокомпонентная система. Этим осложнено обобщение знаний, выделение инварианта данной системы понятий. В развитом и структурно оформленном виде общее понятие о химической реакции представляет собой теоретическую систему сущностных знаний о ней . Научно-теоретическими основами ее формирования служат теории строения веществ и химических процессов, периодический закон и закон сохранения массы и энергии. Понятие «химическая реакция» тесно связано с понятием «вещество». Это является отражением диалектической связи вида материи с формой ее движения. В ходе химических реакций осуществляется превращение веществ. Химическими реакциями называют явления, при которых изменяются состав, структура и свойства химических соединений – одни вещества превращаются в другие.
Ведущей идеей преемственного формирования и генерализации знаний о химической реакции в школе должен стать триединый структурно-энергетико-кинетический подход, поскольку с этих позиций можно дать разностороннюю характеристику реакции .
Основанием для развертывания всей совокупности знаний о химической реакции в виде теоретической системы служит генетически исходное отношение между реагентами и продуктами реакции. Генетически исходное отношение, лежащее в центре данной системы знания отражает общая модель химической реакции:
РЕАГЕНТЫ→ ПРОДУКТЫ РЕАКЦИИ
где ПАК-переходный активный комплекс.
Существенными признаками и сторонами общего понятия химическая реакция являются следующие блоки знаний:
блок знаний об условиях и признаках протекания реакций;
блок знаний об энергетике химических реакций;
блок знаний о кинетике химических реакций;
блок знаний о химическом равновесии;
блок знаний о закономерностях протекания реакций.
Основополагающими понятиями этой системы являются «реакционная способность», «переходное состояние», «скорость реакции», «механизм реакции». Именно эти понятия находятся в центре современной теоретической химии как узловые. Поэтому ведущим в анализе и формировании данной системы является кинетический подход.
Сущность химической реакции заключается в образовании ПАК по схеме:
исходное состояние – переходное состояние – конечное состояние реакционной системы. Как пишет В.И.Кузнецов: “Переходное состояние системы – это сущность химических превращений, сущность любого химического процесса”. При химических реакциях происходит разрыв связей в исходных веществах и образование других (как правило, более прочных и энергетически выгодных) в продуктах реакции.
Элементарной субстанцией химической реакции являются атомы (ионы, радикалы) элементов. Сохраняемость атомов и их фундаментальных свойств, в том числе их масс, зарядов и др., служит основанием для количественных описаний химических реакций, для установления количественных отношений, отражаемых уравнениями реакций. Это объясняет подчинение их закону сохранения массы и энергии. Происходящая в ходе превращения веществ перестройка электронных структур участвующих в реакции атомов, молекул и др. частиц сопровождается образованием и превращением химической энергии в другие ее виды. Энергетический признак – один из важнейших признаков химической реакции.
Все эти сущностные знания, отражающие признаки, стороны, связи и отношения химической реакции, составляют теоретическое ядро системы понятий о химической реакции. Эта система может быть представлена следующей схемой :
|
Знания о веществе |
2. Условия возникновен ия и протекания реакций и их признаки |
3. Механизм реакции |
4. Скорость реакции |
химическое производство |
|||
|
Модель реакции |
5. Химическое равновесие |
||||||
|
Реагенты продукты начальное конечное состояние состояние конечное состояние |
|||||||
|
1. Реакцион ная способность веществ и энергетика процессов |
6. Химические закономер нои и управление химическими реакциями |
||||||
|
классификация химических реакции |
|||||||
|
Электронноди- намические |
Электронно- статические |
||||||
|
7. Уравнения реакций |
|||||||
Рис.1. Система знаний о химической реакции в школьном курсе химии.
1. Блок знаний об условиях и признаках протекания реакций включает в себя преимущественно эмпирические понятия, образованные на основе эксперимента и наблюдений. Признаки реакций выявляются на основе экспериментальных данных. Сравнение опытов дает возможность выявить общие для всех реакций признаки – образование новых веществ и энергетические изменения, сопровождающие эти изменения.
2. Блок знаний об энергетике химических реакций позволяет ответить на вопрос почему протекают химические реакции, возможно или невозможно их осуществление, каковы движущие силы реакций. В школьном курсе химии знания энергетики представлены такими элементами термохимии как тепловой эффект реакции, термохимические уравнения; в старших классах вводятся понятия энтропии и энергии Гиббса. Кроме того, к ним можно отнести и понятие энергии активации.
3. Блок знаний о кинетике химических реакций отвечает на вопрос, как протекают химические реакции, раскрывает течение реакции во времени, их механизм. Эта проблема – центральная в современной химии, поэтому при рассмотрении реакций кинетический подход является ведущим, в том числе и в школе.
Важнейшими понятиями данного блока являются: «реакционная способность», «скорость реакции», «энергия активации», «активированный переходный комплекс», «механизм реакций», «катализ и его виды» и другие. Кроме того, в этот блок входят такие закономерности, как правило Вант-Гоффа, закон действия масс (без учета стхиометрических коэффициентов или для реакций, где эти коэффициенты равны 1). Наиболее общим является понятие «реакционная способность». Оно раскрывает связь свойств реагентов с разного рода факторами, в том числе и кинетическими.
Понятие скорости химической реакции характеризует протекание реакции во времени, отражая при этом характер изменений свойств реагентов и их концентраций. Оно определяется изменением концентрации реагирующих веществ в единицу времени. Скорость реакции – центральное понятие в системе знаний о реакции школьного курса химии. Его главное назначение – качественное и количественное описание протекания реакций во времени.
Понятие «механизм реакции» является наиболее абстрактным и сложным для усвоения. Поэтому вначале дают его простейшую формулировку: механизм реакции – это последовательность элементарных химических актов. Данное понятие раскрывает протекание химического процесса, как во времени, так и в пространстве (число частиц, последовательность соударения, строение ПАК). В совокупности понятия «скорость реакции», «реакционная способность» и «механизм реакции» составляют ядро кинетических знаний. Фактором, связывающим их, является понятие «промежуточного активированного комплекса», которое отражает единство устойчивости и изменчивости химических соединений, механизм многих реакций. Активированный комплекс характеризуется как неустойчивое промежуточное соединение, обладающее большим запасом энергии, и как промежуточное состояние реакции. Это понятие тесно связано с понятием «энергия активации» – той оптимальной энергией, которой должны обладать реагирующие частицы (молекулы, ионы и др.), чтобы при столкновении они могли вступить в химическую реакцию.
4. Блок знаний о химическом равновесии.
Важнейшими понятиями блока являются: «прямая и обратная реакция», «химическое равновесие», «факторы и закономерности смещения химического равновесия». Теоретической основой раскрытия этого материала служат основные положения кинетики и термодинамики, принцип Ле-Шателье и другие. Интегративное понятие этого блока – химическое равновесие. Традиционно знания о химическом равновесии включаются в систему понятий о кинетике, и рассматривается как равенство скоростей прямой и обратной реакций. Рассмотрение химического равновесия с этой позиции является односторонним. Возможен и термодинамический подход к рассмотрению данного вопроса. Здесь химическое равновесие рассматривается как уравновешивание энтальпийного и энтропийного факторов, как равенство двух противоположных тенденций – к порядку и беспорядку, имеющее место в замкнутой системе при постоянной температуре и неизменных количествах вещества реагентов.
5. Блок знаний о закономерностях протекания реакций раскрывает повторяющиеся связи и отношения объектов и явлений химии. К таковым закономерностям относятся:
закономерные отношения масс реагентов и продуктов реакции, отношения объемов реагирующих веществ (для газообразных);
протекание реакций в сторону уменьшения свободной энергии системы (∆G
зависимость реакционной способности веществ (связей, атомов, ионов) от электроотрицательности и степени окисления входящих в их состав атомов элементов;
зависимость протекания реакции от природы реагентов;
зависимость скорости реакции от различных факторов (концентрации реагентов, их состояния и размера частиц, температуры, давления и пр.);
зависимость смещения химического равновесия от кинетических факторов (изменение температуры и давления, концентрации реагирующих веществ).
Важным аккумулятором химических закономерностей является периодическая система Д. И. Менделеева, многие закономерности обобщает электрохимический ряд напряжений металлов.
Этой теоретической системе знаний присущи функции описания, объяснения и предсказания . Такого уровня развития эта система достигает на определенных этапах обучения в результате теоретического обобщения и применения знаний. Проходя в своем развитии через последовательно сменяющиеся теории, обогащаясь новыми знаниями и умениями, она приобретает структуру и функции теоретических систем знаний.
ключает в себя приемущественно эмпирические понятия, образованные на о
1.2 Этапы формирования понятия «химическая реакция»
В силу того, что понятие химическая реакция является достаточно сложным и многогранным, сформировать полное представление обо всех его сторонах, раскрыть всю его философскую сущность невозможно за короткий промежуток времени. Более того, данное понятие формируется на протяжении всего курса обучения химии.
Понятие «химическая реакция» формируется поэтапно .
Первый этап (8 класс). На первоначальных этапах изучения химии используется индуктивный подход. В основе изучения, как источник химического познания лежит химический эксперимент. В результате наблюдения за экспериментом учащиеся осознают образования новых веществ в ходе протекания химической реакции. Но в экспериментальном изучении реакций не уделяется внимания ее сущности, акцент делается на внешние проявления (изменение окраски раствора, выделение газа, выпадение осадка).
Понятие о химической реакции начинает формироваться с самых первых уроков. Сначала дают понятие о явлениях, происходящих в природе, повседневной жизни, быту, разграничивая явления на физические и химические. А затем сообщают учащимся о тождественности понятий «химическое явление» и «химическая реакция». На уровне атомно-молекулярного учения разъясняют, как можно по внешним признакам обнаружить протекание химической реакции.
Классификация химических реакций дается на уровне сравнения числа исходных и полученных веществ. При этом учащиеся используют такие мыслительные приемы как сравнение, анализ, синтез, обобщение. Все эти сведения включены в раздел «Первоначальные химические понятия». Далее все стороны системы понятий о химической реакции должны расширяться и дополняться новыми данными, т. е начинается этап накопления. Закономерности протекания химической реакции разбираются на простейших примерах: так влияние температуры рассматривается на реакции образования сульфида железа, реакции окисления рассматриваются как процесс соединения вещества с кислородом, понятие о реакциях обмена на примере взаимодействия кислот с оксидами и т.д.
На втором этапе (8 класс) понятие о химической реакции получает дальнейшее развитие. Начинают формироваться энергетические представления о химических реакциях. Рассматривается понятие об экзо- и эндотермических реакциях, вводится новое понятие о тепловом эффекте химической реакции, термохимических уравнениях и их составлении. При изучении энергетических эффектов появляется возможность показать не только качественную, но и количественную сторону химической реакции. Количественные отношения веществ, вступивших в реакцию, трактуются как молярные отношения реагирующих веществ.
На третьем этапе (8 класс) формирования понятие «химическая реакция» претерпевает качественные изменения в теме «Химическая связь. Строение вещества». В данной теме химическая реакция начинает трактоваться как разрушение одних связей и образование других. Рассматривается это на примере окислительно-восстановительных реакций. Механизм этих реакций объясняют с точки зрения перехода электронов, поднимаясь тем самым на более высокий теоретический уровень.
На основе нового понятия «степень окисления» анализируют известные учащимся реакции разных типов, доказывая тем самым, что среди реакций любого типа можно найти окислительно-восстановительные.
В теме «Подгруппа кислорода» вводится новое понятие аллотропия и соответствующие ей новый тип реакций - аллотропные превращения.
Четвертый этап (9 класс). В разделе «Закономерности химической реакции» вводится понятие о скорости химической реакции и о влияющих на нее факторах (температура, концентрация, поверхность соприкосновения). Здесь же рассматривается вопрос об обратимости химической реакции и о химическом равновесии. Необходимо подчеркнуть динамический характер химического равновесия, факторы, вызывающие смещение химического равновесия. Таким образом, учащиеся знакомятся еще с одним типом химической реакции - обратимыми.
Этап пятый. На данном этапе происходит знакомство учащихся с такой важной темой как «Теория электролитической диссоциации». Она помимо мировоззренческого значения (иллюстрация единства и борьбы противоположностей – моляризации и диссоциации) вносит много нового в объяснение механизма реакций. На базе понятия об обратимых реакциях можно объяснить сущность процесса диссоциации, а также гидролиза солей, рассматриваемого в ионной форме, чтобы не вводить понятия о гидроксосолях.
Этап шестой (9 – 10 классы). Дальнейшие развитие понятия о химической реакции осуществляется в курсе органической химии. Дополняются понятия о классификации химических реакций, вводятся новые типы реакций, например реакции изомеризации, полимеризации, этерификации и др. В органике вводится качественно новый материал и в понятие о механизмах реакций. Так, например, рассматривается свободнорадикальный механизм на примере реакций замещения (галогенирование алканов), присоединения (полимеризация), отщепления (крекинг). Расширяется понятие об ионном механизме химической реакции: приводятся примеры присоединения неорганических соединений к алкенам, реакций замещения при гидролизе галогеналканов.
Дополняется также система понятий о закономерностях протекания химических реакций. При развитии понятия «скорость химической реакции» отмечается влияние энергии связи и ее типа. Знания о катализе и катализаторах дополняются в органике знаниями о ферментах.
Этап седьмой (11 класс). На завершающем этапе обучения подводятся итоги, обобщаются знания о химических реакциях. В конце обучения учащиеся должны суметь охарактеризовать предложенную им в качестве примера химическую реакцию в свете компонентов ее содержания.
Глава 2. Основные методы, применяемые в разделах о химической реакции
2.1 Введение понятия «химическая реакция»
В самом определении химии дан предмет изучения – химические явления, сопровождаемые превращением веществ. Учащиеся не должны просто заучить данное определение, они в первую очередь должны осознать предмет и в процессе обучения на него должен постоянно делаться акцент. При формировании знания о химических явлениях важно учитывать такой принцип диалектики как переход от абстрактного знания к конкретному . Фундаментом такого обучения будет исходное понятие науки, т.е абстракция. Опираться на понятие – значит выводить из всеобщего его конкретные, частные формы.
Совместно с учителем учащиеся совершают квазиисследовательскую предметную деятельность и открывают для себя предмет познания химии – химическое явление. Процесс познания строится на анализе, рефлексии и прогнозировании доступных экспериментов, лишь часть из которых выполняет учитель, а большинство – сами учащиеся.
Так, с помощью учителя они анализируют то, что происходит в окружающем мире, и обнаруживают протекание различных явлений. Некоторые из них учащиеся воспроизводят экспериментально. Результаты опытов свидетельствуют об изменениях веществ – это признак любого явления. Взяв в качестве основания классификации характер изменения веществ, явления можно подразделить на две группы. К первой относятся явления, при которых происходит лишь переход веществ из одного состояния в другое, а ко второй – превращение одних веществ в другие. Первую группу явлений называют физическими (их школьники изучают в курсе физики), вторую – химическими (с ними учащиеся сталкиваются впервые).
Для более четкого дифференцирования рассмотренных, а также других, предложенных самими учащимися явлений (пока по основным внешним признакам) школьники моделируют их в графической или знаковой форме (по выбору). Последующий анализ моделей и осмысление обобщенных явлений по схеме «было-стало» показывает учащимся, что при физических явлениях что было, то и осталось, т.е вещества не изменили свою природу, а только перешли в другое состояние, тогда как при химических явлениях было нечто одно, а стало нечто другое.
Осуществление учащимися описанных выше действий позволяет им выделить всеобщий признак химических явлений (в сравнении с физическими) – превращение веществ – и тем самым открыть для себя предмет химии. На базе этого же всеобщего признака формулируется пока абстрактное (т.е одностороннее) определение понятия «химическое явление» на уровне представления: химическое явление (химическая реакция) – это процесс превращения одних веществ в другие.
Таким образом, учитель с самого начала обучения химии вводит учащихся в ситуацию открытия нового для них свойства реальной действительности – превращения веществ, характеризуемого не познанным пока абстрактным понятием «химическое явление (химическая реакция)».
Чтобы мотивировать учащихся на дальнейшее изучение химии учитель, обсуждая вопросы химических явлений, предлагает подумать: важны ли химические явления в природе, в промышленном производстве, в жизни человека? Зачем нужно их изучать? После их обсуждения, учащиеся приступают к исследованию предмета химии – превращению веществ. Учащиеся легко могут дифференцировать знакомые им явления на физические и химические, но если им продемонстрировать, например процесс растворения сахара и взаимодействие растворов соляной кислоты и щелочи, то последний процесс они вряд ли смогут однозначно отнести к химическим явлениям (нет видимых признаков реакции). Таким образом, учитель подводит учащихся к мысли, что только внешних признаков недостаточно для того, чтобы назвать явление химическим.
В связи с этим учитель ставит учебную задачу: выявить внутренние признаки превращения одних веществ в другие.
Начинается новый этап квазиисследования учащихся, направленный на логическое абстрагирование, расчленение предмета исследования на составляющие. На этом этапе учащиеся исследуют внутреннюю структуру понятия химическая реакция.
Для этого учитель предлагает изучить вещества, участвующие в превращениях. Совместно с учащимися учитель формулирует гипотезу: возможно сущность реакции заключается в изучении веществ, участвующих в ней. Для решения этой задачи необходимо применять абстрагирование, то есть мысленное извлечение моделей химических явлений, экспериментально исследовать реальные вещества. Научиться составлять новые модели веществ. Эти действия позволяют перевести мыследействие учащихся на абстрактный уровень представления о веществах, тем самым, конкретизируя понятие «химическое явление».
Наиболее целесообразным способом изучения вещества являются наблюдаемые признаки, если же их нет, необходимо каким-то образом подействовать на вещество. Учащиеся уже знают, что вещества состоят из атомов, связанных в молекулы. В одних веществах связи более прочные, в других менее прочные. Вновь выдвигается гипотеза: если вещества состоят из микрочастиц, то превращения, возможно, заключатся в изменениях между молекулами и связями. С изменением гипотезы формулируется новая учебная задача: выяснить, что происходит с микрочастицами и связями между ними при химическом превращении веществ.
Таким образом, мыследействие учащихся переводится на микроуровень организации материи.
В соответствии с принципами активности и объективности мыследействия учащихся должны быть основаны на результатах экспериментов.
Учащимся демонстрируют простейший опыт: нагревание воды, ее последующее испарение и конденсация. При нагревании происходит разрыв связей между молекулами воды, так как при сообщении им энергии увеличивается их подвижность. При конденсации пара вновь происходит образование связей между молекулами воды. Школьники делают заключение, что в процессе разрыва и образования связей между молекулами изменений не произошло, значит это явление физическое.
Таким образом, изучив явления между веществами не изученными остаются только атомы.
Вновь выдвигается гипотеза: возможно, сущность превращений веществ заключается в изменениях, происходящих с атомами и связями между ними. И опять же изменяется учебная задача – выяснить, что происходит с атомами различных видов и со связями между ними при превращениях одних веществ в другие, и как это можно установить. Учитель демонстрирует электролиз воды, в ходе которого образуются кислород и водород. Моделируя данный процесс, учащиеся видят: разложение сопровождается разрывом связей в молекуле воды, а затем образованием связей между двумя атомами кислорода и четырьмя атомами водорода.ях одних веществ в другие, и как это можно устан
Таким образом, учащиеся осознают, что химические явления происходят на уровне рассмотрения атомов и связей между ними.
После моделирования других химических процессов и выделении их всеобщих признаков учащиеся делают заключение: сущность химического явления (реакции) заключается в разрыве связей в исходных веществах и образовании новых связей между атомами тех же видов в продуктах реакции. Теперь они могут сформулировать определение химического явления на уровне абстрактной сущности: химическое явление – это процесс разрыва связей между частицами исходных веществ и образование новых связей в продуктах реакции между теми же частицами, но в ином сочетании. Данное определение является для учащихся абстрактным уже потому, что учащиеся не могут ответить на вопрос, почему одни связи рвутся, а другие образуются. Для ответа на этот вопрос учащимся нужно сначала изучить атомы, а затем связи между ними.
После изучения атомов учащиеся могут сконструировать химические соединения сначала на микро-, а затем на макроуровне организации вещества, и только потом, зная прочность связей в веществах, осмысливать и предсказывать процессы их разрыва и образования.
По мере изучения каждого уровня организации вещества, связываемого с химическими явлениями, все более конкретизируется понятие «химическая реакция».
Способ постановки гипотез и поиск ответов на них, осмысление происходящих явлений составляет этап вхождения школьников в ориентированно-мотивационный процесс, имеющий значение для перевода учащегося с позиции объекта воздействия на позицию субъекта, который сам сотрудничает с другими учащимися и учителями. Учащиеся, вышедшие на этот этап осознанно могут ответить на вопросы: что изучает химия? Для чего ее нужно изучать? Каков путь ее познания?
При поиске ответа на первый вопрос учащиеся открывают предмет химии; отвечая на второй, актуализируют внутренние мотивы и потребности ее изучения; обсуждая третий, осмысливают план изучения химии (на абстрактном уровне) в соответствии с принципом восхождения от абстрактного к конкретному.
Как итог можно сказать, что если учащиеся будут постигать диалектически выстроенное содержание учебного материала, открывая для себя принципы и законы диалектики и использовать их как средство ориентации в мире и познании окружающей действительности, то можно, вероятно, констатировать факт формирования личности с развитым диалектическим способом мышления.
2.2 Формирование знаний о типах химических реакций
Изучение атомно-молекулярного учения и первоначальных химических понятий, а также некоторое накопление фактов позволяет более осмысленно подойти к классификации реакций.
Первое ознакомление с классификацией веществ показывает, что в ее основу положен их состав и свойства: вещества делятся на простые и сложные (по составу), а простые вещества на металлы и неметаллы (по свойствам).
Таким образом, всякая классификация явлений, предметов, веществ связана с выбором каких то существенных признаков, которые можно положить в основу деления предметов или явлений на группы .
Можно ли классифицировать химические реакции? Что положить в основу их классификации?
Сущность всякой химической реакции состоит в изменении состава молекул веществ, взятых для реакции. Поэтому характер этих изменений и нужно положить основу классификации химических реакций. После разъяснения поставленной перед учащимися проблемы можно предложить назвать известные им реакции и написать на доске уравнения этих реакций.
|
H 2 O= H 2 + O 2 |
В одних случаях из молекул одного вещества получается 2 молекулы других веществ – это реакции разложения, в других, наоборот, из молекул двух веществ образуется одна молекула нового вещества – это реакции соединения. Учитель совместно с учащимися, анализируя данные выводы, выясняет, всегда ли из молекул одного сложного вещества образуются молекулы простого вещества. Для ответа на данный вопрос учитель проводит реакцию разложения, например малахита или перманганата калия.
Таким образом, учащиеся осознают, что в ходе разложения сложных веществ могут образоваться как сложные, так и простые вещества (либо их смесь). В заключении учащиеся зарисовывают схему данного опыта, делают необходимые пометки к чертежу и записывают уравнения реакции.
Далее при формировании у учащихся понятия о типах реакций, учитель вновь выдвигает проблему: могут ли во время протекания химической реакции происходить какие-либо другие перегруппировки атомов кроме тех, которые происходят при химических реакциях присоединения и разложения?
Для ответа на этот вопрос учитель демонстрирует ученикам опыт между раствором CuCl 2 и железом (железным гвоздем). В ходе процесса железный гвоздь покрывается налетом меди. Учитель задает вопрос: можно ли данную реакцию отнести к реакциям соединения или разложения? Для ответа на этот вопрос учитель записывает на доске уравнение реакции (связывая тем самым модель процесса с реальным, только что проведенным опытом) и поясняет, что ни к тому, ни к другому типу данную реакцию отнести нельзя, поскольку в ходе процесса из молекул двух веществ образуется также две молекулы новых веществ. А значит, есть основание выделить еще один тип реакции. Это третий тип химической реакции, который называется замещением (вытеснением). Необходимо подчеркнуть, что в реакцию замещения вступает одно простое и одно сложное вещество.
В завершении урока учащиеся выполняют ряд упражнений по данной теме, приобретая и закрепляя тем самым навыки работы с новым материалом. Кроме того, по данной теме учащимся задается задание на дом.
Как видно из вышеперечисленного, в ходе урока учитель при объяснении данного материала использует методы беседы, рассказа, объяснения. Благодаря наводящим вопросам, учащиеся включаются в мыслительный процесс. Здесь рационально использовать наглядность, в качестве которой ведущую роль отводят химическому эксперименту. Важно провести связь типов реакций с процессами, происходящими в жизни (например, процесс выделения меди на железном гвозде свидетельствует о его разрушении, данный процесс разрушения металла присутствует повсеместно).
После знакомства с реакциями обмена учитель вновь предлагает обсудить две реакции. Таковыми могут быть, например, следующие:
Mg + H 2 SO 4 = MgSO 4 + H 2 и MgO + H 2 SO 4 = MgSO 4 + H 2 O.
В чем заключаются сходства и различия данных реакций? Обсуждая вместе с учителем данные модели процессов, учащиеся должны прийти к следующим выводам :
сходство проявляется в том, что количество исходных веществ и продуктов реакции одинаково; одним из продуктов в обоих случаях является соль MgSO 4;
различие: исходными веществами одной из реакции являются сложные вещества, в другой – простое и сложное;
реакции относятся к разным типам.
Получив эти ответы, или наводящими вопросами подведя учащихся к ним, учитель предлагает рассмотреть еще две реакции:
FeO + H 2 SO 4 = FeSO 4 + H 2 O и FeCl 2 + H 2 SO 4 = FeSO 4 + 2HCl.
Опять в ходе обсуждения учащиеся приходят к следующим выводам:
участвующие в реакциях вещества относятся к разным классам неорганических соединений (FeO – основной оксид и кислота, FeCl 2 – соль и кислота);
при данных реакциях сложные вещества обмениваются составными частями (атомами или группами атомов);
реакции относятся к одному типу.
Реакции между сложными химическими веществами, в результате которых происходит обмен между атомами или группами атомов, называются реакциями обмена.
Как о частном случае реакций обмена учителю необходимо рассказать учащимся о реакциях нейтрализации . После ознакомления и записи следующих правил, свидетельствующих о возможности протекания реакции:
в ходе реакции образуется вода;
выпадает осадок;
выделяется газ;
учащиеся излагают характерные признаки реакций обмена:
CuSO 4 + NaOH, HCl + K 2 CO 3 , NaOH + HCl.
Изучение проводится следующим образом:
запись уравнений реакции,
работа с таблицей растворимости,
вывод о возможности протекания реакции,
экспериментальная проверка.
Проведя экспериментальную проверку, учащиеся отмечают отсутствие видимых признаков последней реакции. Учитель поясняет, что данная реакция является реакцией нейтрализации, а реакции такого типа необходимо проводить в присутствии индикаторов, по изменению окраски которых и нужно судить, что реакция прошла.
Таким образом, учащиеся получают на основе атомно-молекулярного учения первое представление о классификации реакций. В дальнейшем, сформированное на этом уровне представление о классификации претерпевает ряд качественных и количественных изменений и дополнений. Так наблюдается усиление изучения количественной стороны процессов (изучается закон сохранения массы, закон Авогадро и следствия из него и др.). В количественном описании химических реакций, в прогностику возможностей их протекания вносит вклад изучение элементов термохимии: тепловой эффект, термохимические уравнения. Их познание опирается на первоначальные энергетические представления.
Обобщая знания об энергетических зависимостях, раскрывающихся на основе экспериментов, надо выделить важнейшую из них – взаимосвязь между образованием новых веществ и энергетическим эффектом реакции, так как энергетические изменения, по мнению Д.И.Менделеева представляют собой внутреннее содержание химических реакций. Важно подвести учащихся к выводу, дополняющему прежние: процесс образования новых веществ связан с энергетическими изменениями. Их важной характеристикой является тепловой эффект реакции.
Эти знания – основа классификации по энергетическому признаку, деления реакций на экзо- и эндотермические реакции.
На основе электронной теории строения вещества изучается один из наиболее сложных и информационно емких видов реакций – окислительно-восстановительные. Здесь важнейшими понятиями будут следующие:
степень окисления;
процессы окисления/ восстановления;
окислитель и восстановитель;
собственно окислительно-восстановительная реакция.
Сформированное понятие об окислительно-восстановительной реакции необходимо вести в общую систему знаний о химическом процессе. Необходимость оперирования учащимися понятием «окислительно-восстановительная реакция» требует формирования у них умений использовать химический язык. Обобщенным умением учащихся при изучении окислительно-восстановительных реакций будет умение составлять уравнения конкретных реакций.
При изучении различных классов неорганических соединений и систематизации химических элементов знания об окислительно-восстановительных реакциях дополняются, углубляются и совершенствуются (происходит ознакомление с конкретными окислителями и восстановителями). Качественно новым этапом в изучении окислительно-восстановительных реакций будет теория электролитов, в которой учитель знакомит учащихся с новым видом окислителей и восстановителей – ионами, выявляет и раскрывает закономерности протекания таких реакций в водных растворах. При изучении азота и фосфора знания учащихся пополняются новыми конкретными примерами окисления и восстановления. Анализируется реакции азотной кислоты с металлами, совершенствуются навыки составления уравнений. Далее изучается электролиз, коррозия металлов как разновидность окислительно-восстановительных процессов.
По окончании обучения учащихся общая классификация химических реакций должна выглядеть следующим образом:
Рис 2. Классификация химических реакций.
2.3 Формирование знаний о реакциях ионного обмена
Изучение теории электролитической диссоциации позволяет углубить и расширить знания о реакции, дифференцировать особенности протекания обменных и окислительно-восстановительных реакций. Учащиеся приобретают умения составлять ионные и ионно-электронные уравнения реакций, распознавать реакции обмена электролитов. Особое внимание уделяется на проблемное изучение этих реакций, механизмов и закономерностей их протекания. В центре изучения реакций электролитов – обменные реакции.
Реакции ионного обмена являются еще боле абстрактными по сравнению с привычными молекулярными. Вследствие этого путь их познания должен быть следующим: краткое ионное уравнение, полное ионное уравнение – уравнение в молекулярной форме – опыт.
Рассмотрим, например, методы формирования знаний о реакциях ионного обмена в свете теории о кислотно- основных взаимодействиях .
Большинство реакций ионного обмена в водных растворах могут быть рассмотрены в свете представлений о кислотно-основных взаимодействиях.
С позиции протолитической теории кислоты представляют собой частицы (ионы, молекулы), способные отдавать протон (доноры протонов), а основания – частицы, способные присоединять протон (акцепторы протонов). Например, уксусная кислота СН 3 СООН в водном растворе отдает протоны основанию, роль которого выполняет молекула воды. При этом образуются ионы гидрозония Н 3 О + и новое основание СН 3 СОО - . В такой системе слабой кислоте соответствует сильное основание СН 3 СОО - . Они называются соответственно сопряженными кислотой и основанием. В сопряженной системе сильной кислоте соответствует слабое основание, и наоборот, слабой кислоте – сильное основание. В таких системах различные ионы всегда конкурируют между собой в связывании протона, например в системе:
NO 2 - + HSO 4 - =HNO 2 + SO 4 2- .
Конкурируют ионы NO 2 - и SO 4 2- . Нитрит ионы сильнее связывают протоны, так как HNO 2 более слабая кислота, чем HSO 4 - .
Для обучения школьников умению анализировать ход реакций необходимо применять наиболее понятные им эмпирические правила:
Реакции обмена в водных растворах протекают в направлении образования слабого электролита, нерастворимого или малорастворимого вещества, газообразного продукта.
Сильные кислоты вытесняют слабые из растворов из растворов солей. Более тяжелые и менее летучие кислоты вытесняют из растворов солей менее тяжелые и более летучие. Равновесие в этих случаях смещено в сторону образования боле слабой или более летучей кислоты.
Сильные основания вытесняют из растворов солей более слабые основания.
Сильные электролиты в разбавленных растворах имеют практически одинаковую степень диссоциации и диссоциируют необратимо. Средние и слабые отличаются степенью диссоциации и диссоциируют обратимо.
Реакции ионного обмена в водных средах, по сути, обратимы. Необходимое условие необратимости – удаление хотя бы одного из продуктов реакции. В случае, когда в состав исходных веществ и продуктов реакции входят слабые электролиты, реакции обмена всегда обратимы и можно говорить лишь о смещении равновесия в сторону более слабого электролита.
Для эффективности закрепления правил при анализе ионных уравнений можно предложить учащимся использовать таблицы содержащие ряды кислот, расположенных в порядке убывания значений констант диссоциации (см. приложение). Сильные кислоты показаны как электролиты примерно одинаковой силы. Данная таблица применяется вместе с выполнением соответствующих упражнений.
Можно условно принять, что равновесие реакций, в которых исходная и образующаяся кислоты отличаются по константам ионизации хотя бы на один порядок, практически смещено в сторону более слабого электролита. При решении задач можно также использовать вытеснительную таблицу кислот (см. приложение), в которой формулы кислот в строке и столбце расположены в порядке убывания константы диссоциации. Направление стрелки на пересечении строки и столбца указывает на вытесняемую кислоту или на смещение равновесия в сторону соответствующей кислоты. Двойные стрелки указывают на установление равновесия при приблизительно равных концентрациях кислот. Предлагаемая таблица может быть также частью комплекта справочных материалов на контрольных работах и экзаменах.
2.4 Формирование знаний о кинетике химических реакций
Вопросы кинетики химических процессов и химическое равновесие являются самыми сложными не только для учеников, но и для учителей. При изучении этого материла достаточно выгодной и перспективной является методика, основанная на собственной познавательной активности учащихся . По данной методике учитель не объясняет новый материал, а организует познавательную деятельность учащихся, которые наблюдают опты, ведут расчеты, моделируют, находят ответы на вопросы, поставленные учителем, осмысливают результаты собственной деятельности. Правильно организованная познавательная деятельность приводит школьников к определенным выводам, самостоятельному созиданию знаний.
Весь учебный материал разбит на 6 уроков:
Скорость химической реакции.
зависимость скорости химической реакции от внешних факторов.
Влияние температуры на скорость химической реакции.
5-6. Химическое равновесие и его смещение.
Итак, рассмотрим подробнее каждый этап формирования знаний по данной теме.
Урок 1. Скорость химической реакции
Обсуждение нового материала начинается с демонстрации следующего эксперимента: взаимодействие соляной кислоты с магнием и железом. Учащиеся видят, что эти две реакции протекают по разному: с железом реакция идет гораздо медленнее, чем с магнием. Таким образом, учитель подводит учащихся к выводу, что химические реакции могут быть охарактеризованы определенными скоростями.
Прежде чем учащиеся придут к пониманию скорости химической реакции, необходимо обсудить общее «понятие скорость». Для этого учащимся задают вопросы:
Что собой представляет механическое движение? (Это длина пути, проделанного физическим телом за единицу времени).
Что изменяется во времени при прокручивании кинопленки? (Изменяется число прокрученных кадров).
Каждый раз учитель подчеркивает, что скорость какого-либо процесса – это изменение какой-либо величины за единицу времени.
Теперь нужно найти величину, которая изменяется во времени с течением химической реакции. Учитель напоминает, что химическая реакция осуществляется при столкновении частиц. Понятно, что чем чаще происходят эти столкновения, тем скорость реакции будет выше. Исходя из этого, учащимся предлагается сформулировать определение скорости химической реакции. Выслушивая предположения, учитель подводит учеников к более точному определению: скорость химической реакции – это число столкновений или число элементарных актов реакции в единицу времени. Но число столкновений подсчитать невозможно, поэтому необходимо найти другую величину, которая также изменяется во времени при протекании химической реакции. Исходные вещества превращаются в продукты реакции, а значит, изменяется количество вещества.
Изменение любой величины находят как разность между начальным и конечным значениями и обозначают греческой буквой Δ (дельта). Так как начальное количество исходного вещества больше конечного, то:
Δ n = n 1 – n 2 .
Чтобы измерить скорости реакции надо вычислить, как изменяется количество вещества за единицу времени:
Если реакция происходит в растворе или газовой среде, то при сравнении скоростей различных реакций нужно учитывать не просто количество вещества, а количество вещества в единице объема, то есть молярную концентрацию, которую вычисляют по формуле:
С =
 и измеряют в моль/л.
и измеряют в моль/л.
Итак, скорость реакции в растворе – это изменение концентрации вещества в единицу времени:
∆С = С 1 – С 2 ; W =
Снова начинается обсуждение
вопроса об измерении скорости по
изменению концентрации продуктов
реакции и выведение формулы скорости
для такого случая. При выведении данной
формулы оказывается, что она идентична
предыдущей. Затем учащиеся выводят из
формулы единицы измерения скорости
химической реакции: [W]
=

Учитель делает общий вывод: скорость реакции – это изменение количества или концентрации исходных веществ или продуктов реакции в единицу времени.
Далее учитель обучает учащихся вычислению скорости в опыте: к 10 мл. 0,1М раствора соляной кислоты добавляют такой же объем 0,1М раствора тиосульфата натрия. Отсчитываем по метроному или секундомеру время от начала сливания растворов до окончания реакции (помутнения), скорость получается равной около 7с. Определить скорость можно по концентрации одного из исходных веществ, причем конечную реакцию следует считать равной 0. Тогда получим:
W = .
.
Затем обсуждается вопрос: сохраняется ли скорость реакции неизменной в течение всего химического процесса или изменяется? Чтобы учащиеся пришли к правильному выводу, учитель задает наводящие вопросы:
Изменяется ли количество исходных веществ в ходе реакции?
Как изменяется число столкновений частиц при уменьшении концентрации?
Школьники делают вывод, что скорость химической реакции со временем уменьшается. Для подтверждения этого факта учащимся предлагают следующее задание: для реакции, протекающей в соответствии с уравнением
C 4 H 9 OH + HCl = C 4 H 9 Cl + HOH
Экспериментально определена концентрация одного из веществ в разные промежутки времени.
Как изменится скорость этой реакции со временем?
Учащиеся высчитывают скорость химической реакции в первом промежутке времени, затем во втором и так далее:
W 1
=
 =
0,0023 моль/л с W
2 =
=
0,0023 моль/л с W
2 = =
0,0019 моль/л с
=
0,0019 моль/л с
W 3
= =
0,0014 моль/л с W
4 ==
0,0009моль/л с
=
0,0014 моль/л с W
4 ==
0,0009моль/л с
 Рис
3. Зависимость скорости реакции от
времени.
Рис
3. Зависимость скорости реакции от
времени.
По рассчитанным значениям скорости строят график зависимости скорости реакции от времени. Использование столь малых величин вызывает затруднение у учащихся, поэтому скорость для удобства построения умножают на 10 3 .
Важно обратить внимание учащихся на то, что скорости являются усредненными, а для более точных расчетов необходимо сокращение временного интервала. Точки в связи с этим ставятся в середине отрезков времени.
Анализируя график. Учитель еще раз формулирует главный вывод урока: с течением времени скорость химической реакции уменьшается.
Урок 2. Зависимость скорости химической реакции от внешних факторов
В начале урока идет проверка домашнего задания подобного тому, что решали на предыдущем уроке. Параллельно этому обсуждается, почему с течением времени скорость химической реакции уменьшается (уменьшается количество исходных веществ, а если реакция идет в растворе, то их концентрации). Уменьшение количества исходных веществ ведет к тому, что частицы реже сталкиваются друг с другом, поэтому и уменьшается скорость химической реакции. Получается, что скорость химической реакции зависит от концентрации исходных веществ.
Данный вывод необходимо подтвердить экспериментально: рассмотрим реакцию взаимодействия растворов тиосульфата натрия разных концентраций и соляной кислоты (0,1М). Заранее приготовленный раствор 0,1М тиосульфата натрия разбавляем: в первом стакане 2,5 мл. раствора Na 2 S 2 O 3 + 5 мл. воды; во втором 5 мл. раствора Na 2 S 2 O 3 + 2,5 мл. воды; в третий наливаем 7,5 мл. неразбавленного раствора Na 2 S 2 O 3 .
При проведении опыта один из учеников ассистирует учителю. Метроном запускают одновременно с приливанием в каждый стаканчик 2,5 мл. соляной кислоты. Момент сливания растворов считают нулевым, далее отсчитывают время от начала реакции до помутнения. Ассистент записывает на доске время протекания реакции в каждом стаканчике.
1-й стакан – 23с.
2-й стакан – 15с.
3-й стакан – 7с.
По изменению концентрации соляной кислоты вычисляем скорости реакции и чертим график:
W 1 = 0,043моль/л с W 2 = 0,067моль/л с W 4 = 0,143моль/л с
 Рис.
4. Зависимость скорости реакции от
концентрации.
Рис.
4. Зависимость скорости реакции от
концентрации.
Вычерчивание графика отнимает время, но зато дает незаменимые навыки научного исследования, а значит, развивает мышление учащихся.Таким образом, учащиеся, анализируя график, делают вывод, что скорость химической реакции зависит от концентрации
реагирующих веществ. После этого учитель задает вопрос: будет ли влиять на скорость реакции газообразных и твердых веществ концентрация? Концентрация газа пропорциональна давлению, поэтому изменение давления (а значит и концентрации) изменяет скорость реакции. Твердые вещества под эту зависимость не попадают, так как давление на них существенного влияния не оказывает (за исключением очень больших). Таким образом, учащиеся начинают осознавать, что скоростью химических процессов можно управлять. Учитель должен сделать акцент на то, что это особенно важно для химических производств (наиболее рентабельны те производства, в основе которых лежат реакции протекающие наиболее быстро). В то же время некоторые реакции нежелательны и их скорость необходимо замедлить (например, процессы коррозии металлов). Поэтому так важно знать от чего зависит скорость химической реакции.
Далее обсуждается, как влияет природа вещества (его состав, вид, прочность связей) на скорость химической реакции. Учащимся предлагается рассмотреть пример: взаимодействие кислорода и водорода происходит моментально, а взаимодействие азота и водорода очень медленно. Учитель приводит следующие данные: для разрушения связей в молекулах азота требуется энергия 942 кДж/моль, а в молекулах кислорода – 494 кДж/моль. Теперь учащимся понятно, что более прочные молекулы азота труднее вступают в реакцию и скорость такой реакции очень мала. То есть, учащиеся подводятся к выводу, что скорость химической реакции зависит от природы реагирующих веществ.
Затем обсуждается влияние агрегатного состояния вещества на скорость реакции. Учащиеся самостоятельно проводят реакцию взаимодействия PbNO 3 и KJ в кристаллическом виде и в растворе и делают вывод, что скорость химической реакции зависит от агрегатного состояния вещества. Следует добавить, что реакции между газообразными веществами идут еще быстрее и часто сопровождаются взрывом. Столкновения между частицами газов и в растворе происходят во всем объеме, а реакции с участием твердых веществ только на поверхности.
Тогда как же можно увеличить скорость химических реакций с участием твердых веществ? Учитель наводит учащихся на мысль, что необходимо увеличить поверхность соприкосновения, т.е раздробить вещество. Влияние этого фактора учащиеся исследуют на примере взаимодействия куска мрамора с соляной кислотой и мраморной крошки с соляной кислотой. Вновь формулируется вывод: скорость реакции зависит от степени измельчения твердого вещества.
Урок 3. Влияние температуры на скорость реакции
Обсуждение нового материала начинается с демонстрации взаимодействия 0,1М растворов тиосульфата натрия и соляной кислоты. При комнатной температуре и при температуре на 10˚С выше комнатной. Для этого растворы нагревают на водяной бане при постоянном помешивании. Опыт показывает, что при комнатной температуре помутнение раствора появляется через 11с., а при повышенной – через 5с. Учащиеся самостоятельно рассчитывают скорости обоих процессов:
W 1
= =
0,009моль/л с W
2 =
=
0,009моль/л с W
2 = =
0,02моль/л с
=
0,02моль/л с
Таким образом, скорость реакции прямо пропорциональна температуре. Далее учащиеся совместно с учителем вычисляют, во сколько раз возросла скорость реакции при повышении температуры на 10˚С
γ =
 .
.
Число γ – это температурный коэффициент скорости данной реакции. Температурный коэффициент показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10˚С.
Для закрепления понятия о температурном коэффициенте скорости реакции учащиеся решают ряд заданий по возрастанию сложности. Примером задачи более сложного уровня может быть следующая: температурный коэффициент скорости реакции равен 3, во сколько раз возрастает скорость реакции при повышении температуры от 20 до 50˚С? Для решения этой задачи можно дать готовую формулу, но тогда учащиеся не уловят сущности. Поэтому лучше вывести формулу логическим путем. Предположим, что первоначальная скорость химической реакции равна 1моль/лּ с, т.е при температуре 30˚С скорость реакции равна:
Теперь вычислим скорость реакции при 40˚С
(W 3) и при 50˚С (W 4):
W 3 = W 2 γ = 9 моль/л с
W 4 = W 3 γ = 27 моль/л с
По этим данным видно, что можно вывести формулу для вычисления скорости реакции при повышении температуры на несколько десятков градусов. Из расчетов видно, что температурный коэффициент должен быть возведен в степень равную разности между начальной и конечной температуры деленную на 10:
 ,
т.е
,
т.е
 раз.
раз.
Эта формула является математическим выражением правила Вант-Гоффа. Можно рассказать учащимся, что известный нидерландский ученый Я. Вант-Гофф пришел к выводу, что скорость большинства реакций при повышении температуры на каждые 10˚С повышается в 2-4 раза на основе экспериментальных исследований.
W 2 = W 1 γ = 3 моль/л с
Теперь необходимо разобраться, почему температура влияет на скорость реакции. Учитель подводит учащихся к мысли о том, что энергия, сообщаемая веществу при нагревании, расходуется на разрушение химических связей исходных веществ.
Демонстрируя следующий рисунок, учитель показывает, как изменяется электронная плотность химических связей при взаимодействии йода с водородом:
Рис. 5 Схема образования ПАК на примере взаимодействия йода и водорода.
Когда молекулы сталкиваются, образуется общее для 4-х атомов электронное облако. Оно неустойчиво: электронная плотность из области между атомами исходных веществ как бы перетекает в область между атомами йода и водорода.
Такое промежуточное соединение образованное двумя молекулами называется промежуточным активированным комплексом (ПАК). Он существует короткое время и распадается на две молекулы (в данном случае HJ). Для образования ПАК необходима энергия, которая бы разрушала химические связи внутри столкнувшихся молекул. Эту энергию называют энергией активации.
Энергия активации – эта энергия, необходимая частицам в количестве 1 моль для образования активированного комплекса.
Г рафически
этот процесс выглядит следующим образом:
рафически
этот процесс выглядит следующим образом:
Таким образом, энергия активации – это энергетический барьер, который должны преодолеть исходные вещества, чтобы превратиться в продукты реакции: чем меньше энергия активации, тем выше скорость химической реакции.
Подводя итог урока, учитель формулирует вывод: при нагревании скорость химической реакции возрастает, потому что увеличивается число молекул способных преодолеть энергетический барьер.
Урок 4. Катализ
Понятие «катализ» формируется также на основе эксперимента. Учащимся показывают склянку с пероксидом водорода. Они видят, что никаких признаков течения реакции нет. Но учащимся известно, что со временем пероксид водорода разлагается. Тогда учитель спрашивает: как можно ускорить процесс разложения. Скорее всего, последуют ответы об увеличении температуры до той, при которой разложение будет заметно. Учитель демонстрирует опыт нагревания пероксида водорода. При поднесении тлеющей лучинки, учащиеся видят, что она тухнет (значит выделяющегося кислорода явно недостаточно для поддержания горения). То есть нагревание мало увеличивает скорость химической реакции. Затем в склянку с пероксидом водорода учитель вносит диоксид марганца MnO 2 . Даже без тлеющей лучинки учащиеся наблюдают мгновенное выделение газа. Затем вместо MnO 2 учитель вносит оксид кобальта (II) CoO (реакция идет еще более бурно), а после проводит тот же опыт с CuO (в данном случае реакция идет очень медленно).
Учитель сообщает, что вещества, способные увеличивать скорость химической реакции называются катализаторами.
На опыте школьники убедились, что не каждое вещество может быть катализатором и ускорять химический процесс. Отсюда вывод – действие катализаторов избирательно.
Затем учитель обращает внимание учащихся на такой факт, что вещества, которые ускоряли ход реакции, сами не расходовались. Если их отфильтровать и высушить, то окажется, что масса их не изменилась . Для объяснения этого факта учитель схематично показывает процесс каталитической реакции:
1 стадия. А + К = АК
2 стадия. АК + В = АВ + К.
Таким образом, вещество К остается количественно без изменения.
Теперь необходимо разобраться в причине увеличения катализаторами скорости химической реакции. Увеличение скорости реакции под действием катализатора объясняется тем, что каждая из двух стадий с катализатором имеет меньший энергетический барьер по сравнению с непосредственной реакцией взаимодействия исходных веществ.
Урок 5-6. Химическое равновесие и его смещение
Урок начинается с актуализации знаний полученных на прошлых уроках, в частности об энергетическом барьере и образовании ПАК.
Переходя к новой теме, учитель выясняет, во что превращается ПАК: в продукты реакции или исходные вещества. Школьники приходят к выводу, что на самом деле возможны оба процесса.
Учащимся демонстрируют схему:

Рис. 7.Обратимость реакции.
Превращение исходных веществ в продукты реакции называют прямой реакцией, а продуктов в исходные вещества – обратной. Учитель сообщает учащимся, что взятое в качестве примера взаимодействие йода с водородом – обратимый процесс, и на самом деле большинство реакций обратимы.
Далее учащимся сообщается, что со временем скорость прямой реакции уменьшается, а скорость обратной реакции сначала равна 0, а затем возрастает. Для более наглядной иллюстрации сказанного учитель демонстрирует учащимся график, который они переносят в тетрадь.
Анализируя график, ученики приходят к выводу, что в какой то момент времени скорость прямой и обратной реакции выравниваются. Этот факт свидетельствует о наступлении равновесия. Учащимся задается вопрос: прекращаются ли при наступлении химического равновесия обе реакции?.
Если реакции прекращаются, то при изменении условий влияющих на скорость прямой или обратной реакции ничего не произойдет.
Чтобы проверить этот факт, учащимся демонстрируют следующий опыт: две пробирки, закрытые пробками и соединенные стеклянной трубкой, заполнены диоксидом азота. NO 2 при охлаждении димеризуется, а при нагревании происходит обратная реакция:
NO 2 (бурый) N 2 O 4 (бесцветный)
Одну пробирку опускаем в горячую воду, другую в стакан с кусочками льда. При охлаждении усиливается димеризация, и окраска смеси становится менее интенсивной. При нагревании происходит разложение N 2 O 4 и окраска смеси усиливается. Изменение окраски газа при изменении условий свидетельствует о том, что реакции продолжают протекать. Если вынуть пробирки из стакана, то через некоторое время окраска в них выровняется. Наступает равновесие. Учащимся вновь задается вопрос: идут ли при этом реакции, и почему не наблюдается видимых изменений (реакции идут, т.к их скорости можно изменить, видимых изменений нет, потому что наступило равновесие).
Таким образом, учащиеся осознают, что равновесие можно изменять (смещать) меняя условия протекания процесса.
После этого приступают к изучению принципа Ле-Шателье. В качестве эпиграфа к изучению учитель приводит слова французского ученого: «Изменение любого фактора, могущего влиять на состояние химического равновесия системы вызывает в ней реакцию, стремящуюся противодействовать произведенному изменению». То есть, изменяя какую-либо характеристику системы, равновесие смещается так, чтобы уменьшить это изменение.
Учитель предлагает подумать, какие факторы влияют на смещение равновесия. В ответах учащихся выделяют концентрацию, температуру и давление. Причем влияние температуры они уже наблюдали в опыте с оксидом азота. Изучение влияния концентрации проводят в опыте взаимодействия роданида калия с хлоридом железа (III):
KCNS + FeCl 3 = Fe(CNS) 3 + KCl
Увеличивая концентрацию исходных веществ, окраска раствора становится более интенсивной, а при добавлении к прореагировавшему раствору KCl окраска становится менее насыщенной. Таким образом, учащиеся видят, что увеличение концентрации исходных веществ ведет к большему образованию продуктов реакции (увеличение скорости прямой реакции), а значит к смещению равновесия вправо и наоборот.
Влияние следующего фактора – давления учащиеся уже изучают не опытным путем, а при помощи моделирования процесса реакции. Учащиеся уже знают, что давление в первую очередь влияет на реакции между газами. Учитель формулирует общий принцип Ле-Шателье: если на систему, находящуюся в равновесии, подействовать, изменяя концентрацию, давление, температуру, то равновесие сместится в направлении той реакции, которая уменьшит это воздействие.
Влияние давления обычно рассматривают на примере реакции синтеза аммиака:
N 2 + 3H 2 = 2NH 3 .
Учащимся напоминают о зависимости давления от температуры. Так как зависимость прямо пропорциональна, то увеличение давления, а значит и объема исходных газовых компонентов смещает равновесие в сторону образования аммиака (в сторону уменьшения объема). Также обсуждается вопрос смещения равновесия в условиях понижения давления. Схематически оба вывода можно записать так:
N 2 + 3H 2 = 2NH 3 .
Уменьшение р.
Увеличение р. .
Учитель формулирует вывод: повышение давления вызывает смещение равновесия в сторону той реакции, которая приводит к образованию меньшего количества газов, следовательно, к понижению давления. Понижение давления вызывает смещение равновесия в сторону той реакции, которая приводит к образованию большего количества газов, следовательно, к повышению давления.
Затем учащиеся выполняют ряд упражнений по этим правилам.
Влияние температуры еще раз предлагается рассмотреть на примере следующей реакции:
CaCO 3 (тв) = CaO (тв) + CO 2(г) – Q.
Самостоятельно анализируя данное уравнение, учащиеся осознают, что если прямая реакция эндотермична, то обратная ей экзотермична. Учащиеся могут испытывать трудности с выполнением этих реакций, поэтому учитель может задавать наводящие вопросы: как изменяется температура системы, если тепло поглощается (понижается), и как она изменяется при выделении тепла (повышается). Придя к таким выводам, учащиеся уже сами формулируют вывод: равновесие при повышении температуры смещается в сторону эндотермической (прямой), а при понижении – в сторону экзотермической (в данном случае обратной).
Полнота предлагаемого материала в данном методе соответствует образовательным стандартам. Данный метод позволяет активизировать мышление учащихся.
Заключение
В заключении хотелось бы еще раз отметить те методы и приемы, которые используются при формировании основных разделов понятия химическая реакция.
Главная роль при изучении каждой составляющей понятия «химическая реакция» отводится химическому эксперименту. Он наиболее наглядно отражает внешние признаки и явления, происходящие при взаимодействии, а также отражает влияние внешних факторов воздействия на реагирующие вещества. Он решает многообразные задачи воспитания (трудового, культурологического, этического, мировоззренческого, экологического); развития (памяти, мышления, воображения, творческой самостоятельности); обучения. В процессе обучения он служит источником познания , выполняет функцию метода (познания химических объектов, проверки учебных гипотез, решения учебных проблем), а также функцию средства обучения (доказательности истинности суждений, иллюстрации, применения знаний и умений), средства воспитания и развития учащихся. При изучении многих тем химический эксперимент применяется параллельно с моделированием: написание химических формул веществ, составление из них моделей процессов, вычерчивание графических иллюстраций процессов. Моделирование позволяет более полно отразить те изменения, которые происходят в ходе химических реакций. Использовать моделирование, в частности составляя уравнения химических реакций, нужно так, чтобы максимально избежать формализма знаний учащихся : составляя формулы веществ, моделируя процессы, происходящие с ними они четко должны понимать, что за химическими формулами стоят конкретные вещества (в реакцию вступает не формула, а вещество). В этой связи и толкование уравнений реакций должно быть грамотным. Например, в реакции: 2H 2 + O 2 = 2H 2 O формулировка процесса должна быть следующей: 2моль водорода реагируют с 1молем кислорода и образуется 2моль воды (а не два аш-два плюс о-два равно два аш-два-о).
Применение различных схем-конспектов облегчает учащимся запоминание объемного материала. Например, использование схемы «Скорость химической реакции и ее зависимость от различных факторов» (см. приложение) помогает усвоению, запоминанию и воспроизведению накопленных знаний по данной теме. Такие схемы могут состоять из нескольких блоков и составляться поэтапно по мере изучении, каждого блока.
При изучении различных классов простых и сложных соединений учитель может использовать коллекции минералов . Так, например, при изучении темы «Сера и ее соединения» необходимо ознакомить учащихся с самим минералом для изучения его физических свойств, что позволяет также преодолеть формализм знаний. Кроме того, с этой же целью провести экскурсию для учащихся, в ходе которой они могут наблюдать образование пленки серы на лужах, камнях, траве после дождя вблизи сероводородных источников. На примере серосодержащих минералов (сульфатов, сульфидов) можно дополнить знания учащихся об окислительно-восстановительных процессах происходящих в природе.
Особое внимание отводится методам позволяющим активизировать самостоятельную деятельность учащихся. Известно, что время начала изучения химии в школе (8 класс) соответствует подростковому периоду развития личности учеников (11-12 – 14-15 лет). В этом возрасте для подростка наиболее привлекательными становятся формы проведения занятий, позволяющие проявить самостоятельность и инициативу. Он легче осваивает способы действия, когда учитель лишь помогает ему . Примеры занятий активно использующих данный принцип более подробно рассмотрены в параграфах «Введение понятия о химической реакции», «Формирование знаний о кинетике химических реакций».
Итак, в рассмотренных методических подходах применяются следующие методы:
общелогические: абстрагирование, индуктивный подход выведения понятий, обобщение, конкретизация и другие.
общепедагогические: рассказ, рассуждение, беседа и другие.
специфические: химический эксперимент, наблюдение и объяснение химических объектов.
Данные методы применяются в совокупности, так как часто применение какой-либо одной группы методов не приводит к эффективным положительным результатам. Интеграция этих методов в определенном сочетании приводит к появлению метода обучения химии.
Интерес к учебному предмету во многом зависит от того, в какой именно форме учитель подаст изучаемый материал, насколько увлекательно и доходчиво объяснит его. Именно эти качества и необходимо учитывать при выборе методов обучения, ведь только правильно выбранный метод позволит активизировать интерес к учению, усилит мотивацию учения.
Список литературы
Кузнецова Л. М., Дронова Н. Ю., Евстигнеева Т. А. К методике изучения химической кинетики и химического равновесия // Химия в школе. – 2001. – № 9. – с.7.
Кузнецова Н. Е. Методика преподавания химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. – М.: Просвещение, 1984. –415 с., ил.
Кузнецова Н. Е. Формирование систем понятий при обучении химии. – М.: Просвещение, 1989. – 144 с.
Мухина В. С. Возрастная психология: феноменология развития, детство, отрочество: Учебник для студ. вузов. – 9-е изд., стереотип. –М.: Издательский центр «Академия», 2004. – 456 с.
Пак М. С. Основы дидактики химии: учебное пособие. – СПб.: Изд-во РГПУ им. А. И. Герцена, 2004. –307 с.
Стабалдина С. Т. Принципы и законы диалектики в обучении химии // Химия в школе. – 2003. – № 7. – с.16.
Трофимова И. В. Реакции ионного обмена в водных растворах // Химия в школе. – 2005. – № 10. – с.10-16.
Турлакова Е. В. Использование схем-конспектов при изучении закономерностей химических реакций. // Химия в школе. – 1997. – № 1. – с.6.
Химия. 8 класс: Поурочные планы (по учебнику Л. С. Гузея и др.). I полугодие / Авт. – сост. С. Ю. Дибленко. – Волгоград: Учитель, 2004. – 144 с.
Химия. 8 класс: Поурочные планы (по учебнику Л. С. Гузея и др.). II полугодие / Авт. – сост. С. Ю. Дибленко. – Волгоград: Учитель, 2004. – 168 с.
Химия. 9 класс: Поурочные планы (по учебнику Л. С. Гузея и др.). I полугодие / Авт. – сост. С. Ю. Дибленко, Е. А. Смирнова, С. М. Колмыкова. – Волгоград: Учитель, 2005. – 169 с.
Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. и др. Преподавание химии в 7-8 классах: Метод. пособие для учителей. – М.: Просвещение, 1969. – 318 с.
Чернобельская Г. М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. – М.: .: Гуманит. изд. центр ВЛАДОС, 2000. – 336 с.
Шелинский Г. И. Насущные вопросы формирования важнейших химических понятий химии на начальном этапе обучения // Химия в школе. – 2001. – № 5. – с.17.
Шилов В. И. Использование минералов при формировании химических понятий // Химия в школе. – 2006. – №3. – с.32.
Приложение
|
Ряды кислот |
Порядок константы диссоциации |
|
1. НСЮ 4 , HI, HBr, HCI, НМп 0 4 , H 2 S0 4 , H 2 Se0 4, H 2 Cr 2 0 7 , HN0 3 |
|
|
2. Н 4 Р 2 0 7 2 Сг0 4 = НЮ 3 = НВг0 3 ≈ H 2 S 2 0 3 |
10 -1 |
|
3. НСг 2 О 7 - = НСЮ 2 = HSe 0 4 - ≈ H 2 S 0 3 = Н S О - 4 ≈ HS 2 0 3 4 = Н 3 Р0 3 |
10 -2 |
|
4. Н 2 Те = H 2 Se 0 3 = Н 2 Те0 3 H 3 As 0 4 3 Р0 4 = Н 3 Р 2 О 4 |
10 -3 |
|
5. H 2 Se 2 В 4 0 7 HF = Н N 0 2 |
10 -4 |
|
6. СН 3 СООН |
10 -5 |
|
7. Н 2 Р0 3 = H 2 As0 4 4 = Н 2 С0 3 |
10 -6 |
|
8. НТеОз 6 Те0 6 = НСЮ = H 2 S = HS 0 3 = Н 2 Р0 4 |
10 -8 |
|
9. НВЮ = HSe0 3 - |
10 -9 |
|
10. H 2 Si0 3 = H 4 Si0 4 3 As0 3 = H 3 B0 3 + |
10 -10 |
|
11. HSe" = НЮ 4 |
10 -11 |
|
12. H 3 Si0 4 Н 2 0 2 = HAs О 2- |
10 -12 |
|
13. HS - = НАЮ 2 = НТе - ≈ HPO 4 2- |
10 -13 |
|
14 H 2 SiO 4 2- |
10 -14 |
|
15. Н 2 О |
10 -16 |
|
HClO 4 |
HMnO 4 |
H 2 SO 4 |
HNO 3 |
H 2 CrO 4 |
H 2 SO 3 |
HSO 4 - |
H 3 PO 4 |
HNO 2 |
HCrO 4 |
H 2 CO 3 |
H 2 S |
HSO 3 |
H 2 PO 4 |
H 2 SiO 3 |
NH 4 + |
HCO 3 - |
HS - |
HPO 4 2- |
|||||
|
HClO 4 |
|||||||||||||||||||||||
|
HM 4 |
|||||||||||||||||||||||
|
H 2 SO 4 |
|||||||||||||||||||||||
|
HNO 3 |
|||||||||||||||||||||||
|
H 2 C 4 |
|||||||||||||||||||||||
|
H 2 O 3 |
|||||||||||||||||||||||
|
HSO 4 - |
|||||||||||||||||||||||
|
H 3 PO 4 |
|||||||||||||||||||||||
|
HNO 2 |
|||||||||||||||||||||||
|
HCr - |
|||||||||||||||||||||||
|
H 2 CO 3 |
|||||||||||||||||||||||
|
H 2 S |
|||||||||||||||||||||||
|
HSO 3 - |
|||||||||||||||||||||||
|
H 2 PO 4 - |
|||||||||||||||||||||||
|
H 2 SiO 3 |
|||||||||||||||||||||||
|
NH 4 + |
|||||||||||||||||||||||
|
HCO 3 - |
|||||||||||||||||||||||
|
HS - |
|||||||||||||||||||||||
|
HPO 4 2- |
подходы
к формированию
и закреплению у детей... объем знаний
ученик получает... быстрота, точность глазодвигательных реакций
, способность к... химических
веществ на вкусовые рецепторы обусловливает формирование
...Формирование конкурентных преимуществ промышленных предприятий на примере ОАО РудгормашКурсовая работа >> МенеджментИсследованы методические подходы к формированию и... реакции на собственные стратегические действия; - оценивать их компетенции и способности по формированию ... знания , необходимые для формирования ... транспортный, строительный, химический и нефтехимический и... Разработка текущего годового плана действующего химического производства предприятияКурсовая работа >> МенеджментИ управления в химической промышленности и природопользовании Кафедра... 48 7.1. Методические подходы к формированию отпускных цен... и закрепление полученных знаний в ходе изучения... промышленном органическом синтезе в реакциях : ● дегидратации (получении... Химические , физические факторы окружающей среды, меры предупреждения вредного влияния на организмКонтрольная работа >> ЭкологияСлуховых, обонятельных реакций , ухудшение... нефтехимическая и химическая промышленность выделяют в... остаются совершенствование методических подходов к изучению... человека. Знание перечисленных выше... 1) главным фактором формирования естественных и искусственных... |
ТЕМА 6. ПСИХОФИЗИОЛОГИЯ ВНИМАНИЯ
- 6.1. Ориентировочная реакция
- 6.2. Нейрофизиологические механизмы внимания
- 6.3. Методы изучения и диагностики внимания
В психологии внимание определяется как процесс и состояние настройки субъекта на восприятие приоритетной информации и выполнение поставленных задач.
Направленность и сосредоточенность психической деятельности при внимании обеспечивает более эффективное восприятие информации. В общем плане выделяют два основных вида внимания: непроизвольное и произвольное (избирательное, селективное). Оба вида внимания имеют разные функции, по-разному формируются в онтогенезе, и в их основе лежат различные физиологические механизмы.
Ориентировочная реакция (ОР) впервые была описана И.П. Павловым как двигательная реакция животного на новый, внезапно появляющийся раздражитель. Она включала поворот головы и глаз в сторону раздражителя и обязательно сопровождалась торможением текущей условно-рефлекторной деятельности. Другая особенность ОР заключалась в угашении всех ее поведенческих проявлений при повторении стимула. Угасшая ОР, легко восстанавливалась при малейшем изменении обстановки (см. Хрестомат. 6.2).
Физиологические показатели ОР.
Использование полиграфической регистрации показало, что ОР вызывает не только поведенческие проявления, но и целый спектр вегетативных изменений. Отражением этих генерализованных
изменений являются различные компоненты ОР: двигательный (мышечный), сердечный, дыхательный, кожно-гальванический, сосудистый, зрачковый, сенсорный и электроэнцефалографический (см. тему 2). Как правило, при предъявлении нового стимула повышается мышечный тонус
, изменяется частота дыхания, пульса, возрастает электрическая активность кожи, расширяются зрачки, снижаются сенсорные пороги. В электроэнцефалограмме в начале ориентировочной реакции возникает генерализованная активация, которая проявляется в блокаде (подавлении) альфа-ритма
и смене его высокочастотной активностью. Одновременно с этим возникает возможность объединения и синхронной работы нервных клеток не по принципу их пространственной близости, а по функциональному принципу. Благодаря всем этим изменениям возникает особое состояние мобилизационной готовности организма.
Чаще других в экспериментах, направленных на изучение ОР, используют показатели кожно-гальванической реакции (КГР
). Она обладает особой чувствительностью к новизне стимула, модальна неспецифична, т.е. не зависит от того, какой именно стимул вызывает ОР. Кроме того, КГР быстро угасает, даже если ОР вызвана болевым раздражителем. Однако КГР тесно связана с эмоциональной сферой, поэтому использование КГР при изучении ОР требует четкого разделения собственно ориентировочного и эмоционального компонентов реагирования на новый стимул.
Нервная модель стимула.
Механизм возникновения и угашения ОР получил толкование в концепции нервной модели стимула, предложенной Е.Н. Соколовым. Согласно этой концепции, в результате повторения стимула в нервной системе формируется "модель", определенная конфигурация следа, в которой фиксируются все параметры стимула. Ориентировочная реакция
возникает в тех случаях, когда обнаруживается рассогласование между действующим стимулом и сформированным следом, т.е. "нервной моделью". Если действующий стимул и нервный след, оставленный предшествующим раздражителем, идентичны, то ОР не возникает. Если же они не совпадают, то ориентировочная реакция возникает и оказывается до известной степени тем сильнее, чем больше различаются предшествующий и новый раздражители. Поскольку ОР возникает в результате рассогласования афферентного раздражения с "нервной моделью" ожидаемого стимула, очевидно, что ОР будет длиться до тех пор, пока существует эта разница.
В соответствии с этой концепцией ОР должна фиксироваться при любом сколько-нибудь ощутимом расхождении между двумя последовательно предъявляемыми стимулами. Имеются, однако, многочисленные факты, которые свидетельствуют о том, что ОР далеко не всегда обязательно возникает при изменении параметров стимула.
Значимость стимула.
Ориентировочный рефлекс связан с адаптацией организма к меняющимся условиям среды, поэтому для него справедлив "закон силы". Иначе говоря, чем больше изменяется стимул (например, его интенсивность или степень новизны), тем значительнее ответная реакция. Однако не меньшую, а нередко и большую реакцию могут вызвать ничтожные изменения ситуации, если они прямо адресованы к основным потребностям человека.
Кажется, что более значимый и, следовательно, в чем-то уже знакомый человеку стимул должен при прочих равных условиях вызывать меньшую ОР, чем абсолютно новый. Факты, однако, говорят о другом. Значимость стимула нередко имеет решающее значение для возникновения ОР. Высоко значимый стимул может вызвать мощную ориентировочную реакцию, имея небольшую физическую интенсивность.
- По некоторым представлениям, факторы, провоцирующие ОР, можно упорядочить, выделив 4 уровня, или регистра:
- стимульный регистр;
- регистр новизны;
- регистр интенсивности;
- регистр значимости.
Первый уровень оценки проходят практически все стимулы, второй и третий регистры работают параллельно. Пройдя любой из этих двух регистров, стимул поступает в последний и там оценивается его значимость. Только после этого завершающего акта оценивания развивается весь комплекс ориентировочной реакции.
Таким образом, ОР возникает не на любой новый стимул, а только на такой, который предварительно оценивается как биологически значимый. Иначе мы переживали бы ОР ежесекундно, так как новые раздражители действуют на нас постоянно. Оценивая ОР, следовательно, надо учитывать не формальное количество информации, содержащейся в стимуле, а количество семантической, значимой информации.
Существенно и другое: восприятие значимого стимула нередко сопровождается формированием ответной адекватной
реакции. Присутствие моторных компонентов свидетельствует о том, что ОР предоставляет собой единство воспринимающих и исполнительных механизмов. Таким образом, ОР, традиционно рассматриваемая как реакция на новый раздражитель, представляет частный случай ориентировочной деятельности, которая понимается как организация новых видов деятельности, формирование активности в изменившихся условиях среды (см. Хрестомат. 6.1).
МЕХАНИЗМ РЕАКЦИИ
. Понятие
используется в основные в двух смыслах. Для сложных реакций, состоящих из
несколько стадий, МЕХАНИЗМ РЕАКЦИИр.-это совокупность стадий, в результате которых исходные вещества
превращаются в продукты. Для простой реакции (элементарной реакции, элементарной
стадии), которая не может быть разложена на более простые химический акты, выяснение
МЕХАНИЗМ РЕАКЦИИр. означает идентифицирование физических процессов, составляющих сущность химический превращения.
Для одной частицы (молекула в основном или возбужденном состоянии, ион, радикал,
диффузионная пара, синглетная или триплет-ная радикальная пара, комплекс) или
двух (редко трех) частиц (молекул, ионов, радикалов, ион-радикалов и т.п.),
находящихся в определенных квантовых состояниях, изменения в положениях
атомных ядер и состояниях электронов составляют суть их превращений в другие
частицы с присущими этим частицам квантовыми состояниями. В рассматриваемые
физических процессы часто включают в явном виде акты передачи энергии от частицы к
частице. Для элементарных реакций в растворе МЕХАНИЗМ РЕАКЦИИр. включает изменения
в ближней сольватной оболочке превращающихся частиц.
Гипотетич. представления
относительно МЕХАНИЗМ РЕАКЦИИр. формируются на основе имеющихся эксперим. фактов и результатов
теоретич. анализа. Новые данные могут привести к изменению или уточнению предложенного
МЕХАНИЗМ РЕАКЦИИр., все более приближая его к истинному.
Сложные реакции.
Стехиометрич.
уравение, как правило, не отражает истинного МЕХАНИЗМ РЕАКЦИИр. Так, газофазная термически активируемая
неразветвленная цепная реакция Н 2 + Вr 2
2НВr состоит из следующей простых стадий: термодинамически инициирование Вr 2
; продолжения цепи
+ Н 2 НВr
+ ;
+ + Вr 2 НВr
+ ; +
НВr Н 2
+; обрыв
цепи +
+ Вr 2 .
Скорость процесса описывается сложным уравением, включающим константы скорости
всех простых стадий и концентрации веществ Вr 2 , Н 2 и НВr.
Другой пример -нуклеоф. замещение при атоме С, соответствующее стехиометрич.
уравению RX + Y - RY+X - ,
которое в зависимости от природы реагентов и растворителя может идти по двум различные
механизмам S N 2 и S N 1 (см.
Нуклеофильные реакции).
Характеризуя механизм сложной
реакции, часто указывают на его главную отличит. особенность: ионный МЕХАНИЗМ РЕАКЦИИр., когда
наиболее характерно участие в отдельных стадиях ионов; радикальный МЕХАНИЗМ РЕАКЦИИр., радикально-цепной,
нуклеоф. или электемпературоф. замещение и т.п. Иногда МЕХАНИЗМ РЕАКЦИИр. называют по имени исследователя,
его предложившего и доказавшего, например МЕХАНИЗМ РЕАКЦИИр. Налбандяна - Воеводского для взаимодействие
Н 2 с О 2 , МЕХАНИЗМ РЕАКЦИИр. Бендера для замещения при карбонильном атоме
С и т. п.
Установление механизма
сложной реакции начинается с изучения изменения во времени концентраций исходных
веществ и, если возможно, промежуточные веществ, определения порядков реакции по отдельным
реагентам при широком диапазоне вариации условий (температура, начальные парциальные
и суммарные давления для газофазных реакций; исходные и суммарные концентрации
реагентов, природа растворителя для реакций в растворах). На основе полученных данных
предлагают одну или несколько возможных схем реакции и составляют системы дифференц.
уравений. При решении этих систем с помощью ЭВМ различают прямую и обратную задачи.
В прямой задаче константы скорости и константы равновесия отд. простых стадий,
полученные экспериментально или оцененные независимым путем, задают ЭВМ, которая
численно или графически представляет результаты решения системы уравений в виде
кинетическая кривых сложной реакции. Затем эти кривые сопоставляют с эксперим. данными.
В обратной задаче, существенно более сложной, ЭВМ на основе схемы реакции
и всего объема кинетическая сведений "выдает" константы скорости отдельных
стадий. Чем сложнее кинетическая закономерности (смена порядка реакций, запределивание
кинетическая кривых, появление на них изломов и др. особенностей), тем больше возможностей,
сопоставляя эксперим. данные и результаты расчетов, дискриминировать ту или
иную схему в поисках истинного МЕХАНИЗМ РЕАКЦИИр.
Важную роль в установлении
МЕХАНИЗМ РЕАКЦИИр. играет исследование природы продуктов и промежуточные веществ методами УФ, ИК и
гамма-резонансной спектроскопии, ЭПР, ЯМР, масс-спектемпературометрии, химический поляризации
ядер, электрохимический методами и т.п. Разрабатываются способы получения и накопления
высокоактивных промежуточные продуктов: ионов, радикалов, возбужденных частиц с
целью непосредственного изучения их реакционное способности. Для получения констант
скорости тех стадий сложной реакции, в которых участвуют высокоактивные частицы,
информативно моделирование этих стадий в специальных ("чистых")
условиях, например путем проведения реакций при низких температурах (до 100-70 К), в ионном
источнике масс-спектрометра высокого давления, в ячейке спектрометра ион-циклотронного
резонанса и т.п. При изучении гетерогенно-каталитических реакций важно независимое
исследование адсорбции всех участвующих в реакции веществ на поверхности катализатора,
изучение спектров адсорбир. частиц в оптический и радиочастотном диапазонах, а также
установление их природы физических и физических-химический методами (рентгеновская и УФ фотоэлектронная
спектроскопия, оже-спектроскопия, спектроскопия энергетич. потерь электронов
и др.).
Элементарные реакции.
Для установления МЕХАНИЗМ РЕАКЦИИ р. привлекают как теоретич. методы (см. Квантовая
химия, Динамика элементарного акта), так и многочисленные эксперим. методы.
Для газофазных реакций это - молекулярных пучков метод, масс-спектрометрия
высокого давления, масс-спектро-метрия с химический ионизацией, ионная фотодиссоциация,
ион-циклотронный резонанс, метод послесвечения в потоке, лазерная спектроскопия-селективное
возбуждение отдельных связей или атомных групп молекулы, в том числе лазерно-индуцированная
флуоресценция, внутрирезонаторная лазерная спектроскопия, активная спектроскопия
когерентного рассеяния. Для изучения МЕХАНИЗМ РЕАКЦИИр. в конденсир. средах используют методы:
ЭПР, ЯМР, ядерный квадрупольный резонанс, химический поляризацию ядер, гамма-резонансную
спектроскопию, рентгенo- и фотоэлектронную спектроскопию, реакции с изотопными
индикаторами (мечеными атомами) и оптически активными соединение, проведение
реакций при низких температурах и высоких давлениях, спектроскопию (УФ, ИК и комбинационного
рассеяния), хемилюминесцентные методы, полярографию, кинетическая методы исследования
быстрых и сверхбыстрых реакций (импульсный фотолиз, методы непрерывной и остановленной
струи, температурного скачка, скачка давления и др.). Пользуясь этими методами,
зная природу и строение исходных и конечных частиц, можно с определенной степенью
достоверности установить структуру переходного состояния (см. Активированного
комплекса теория), выяснить, как деформируется исходная молекула или как
сближаются исходные частицы, если их несколько (изменение межатомных расстояний,
углов между связями), как меняется поляризуемость химических связей, образуются ли
ионные, свободнорадикальные, триплетные или др. активные формы, изменяются ли
в ходе реакции электронные состояния молекул, атомов, ионов.
Например, квантовохимический расчеты
свидетельствуют о том, что в ходе бимолекулярной реакции между HNCO и СН 3 ОН
по мере уменьшения расстояния с 30 до 10 нм между атомом С группы -NCO и атомом
О спирта изменяются заряды q N и q O на атомах
N и О группы -N=C=O и заселенности связей P N=C и P C=0 .
Более резкий темп изменения заряда на N (Dq N = 0,47) по сравнению
с изменением заряда на О (Dq O = 0,18), а также уменьшения
заселенности N=С-связи (DP N=C = 0,58) по сравнению со связью
С=О (DР C =O = = 0,35) позволяет сделать вывод о
преимущественном присоединении гидроксила СН 3 ОН по связи N=C с образованием
уретановой группы -NHC(O)OCH 3 .
В простых случаях методы
квантовой химии позволяют рассчитывать поверхность потенциальной энергии
(ППЭ), по которой идет реакция. В более сложных случаях возможно установление
только одного из профилей ППЭ, отображающего вид координаты реакции. Современные
расчетные и эксперим. методы позволяют установить более сложное протекание элементарных
реакций, чем это представлялось ранее. Например, реакции типа
, где X - F или I, могут идти с участием разных электронных состояний частиц:

При изучении элементарных
реакций даже простейших частиц методом мол. пучков выявляется наличие несколько каналов
протекания реакции со своими энтальпиями DH 0 и сечениями:

Установлено, что реакция
Не + + О 2 Не
+ О + О + идет одновременно по шести каналам с образованием атома
О и иона О + в разных электронных состояниях. Те же результаты были
получены методом ион-циклотронного резонанса:

Исследуя картину интенсивности
углового рассеяния продуктов в мол. пучках, можно получить прямую микроско-пич.
информацию о деталях мол. взаимодействия. Например, реакция К +I 2 протекает
по м е х а н и з м у с р ы в а, когда каждый налетающий на молекулу I 2
атом К подхватывает один атом I, двигаясь в прямом направлении, не оказывая
при этом сильного воздействия на второй атом I. В предельном случае такого МЕХАНИЗМ РЕАКЦИИр.
атом I выступает в роли "наблюдателя", т. к. его импульс после акта
реакции остается таким же, как и до него (М.р. типа "наблюдатель-срыв").
Однако поведение продукта KI в реакции К + СН 3 I существенно
отличается от описанного для реакции К + I 2: реакция К+СН 3 I
осуществляется при столь тесном сближении частиц-партнеров, что продукт KI должен
"рикошетировать", как если бы сталкивались твердые шары (м е х а
н и з м р и к о ш е т и р о в а н и я). Сближение на летающего
атома К с молекулой СН 3 I наиболее эффективно при конфигурации
К...I-СН 3 , т.е. со стороны йодного конца молекулы ("ориентационный
эффект молекулы-мишени"). Для реакции между атомом щелочного металла М и
молекулой галогена Х 2 постулируется так называемой гарпунный механизм, при
котором от атома М к молекуле Х 2 происходит перескок электрона с образованием
частиц М + и Х - 2 , которые, ускоренно двигаясь
друг к другу, взаимодействие с образованием колебательно-возбужденного продукта М + Х - .
Нередко бимолекулярная реакция идет в две "микроскопич." стадии с
предварит. образованием промежуточные комплекса:
![]()
продукты. Например, реакции Cs
+ SF 6 , Cs + + RbCl идут через образование долгоживущего комплекса
сталкивающихся частиц. Это служит указанием на сущест вование
на ППЭ вдоль реакционное пути глубокой "ямы". Особенно характерно образование
долгоживущих промежуточные комплексов для реакций в растворе. Например, реакция формамида с
гидроксид-ионом идет с образованием промежуточные тетраэд-рич. комплекса:

В газовой фазе стадия 1
не имеет энергетич. барьера, стадия 2 обладает таким барьером; в воде обе стадии
имеют примерно одинаковые энергетич. барьеры. В этом случае следует говорить
о двух элементарных реакциях. Превращение тетраэдрич. комплекса в продукты идет
как "концертная реакция", в ходе которой одновременно (в один акт) образуется
связь N-Н и разрываются связи О-Н и С-N.
При детальном анализе МЕХАНИЗМ РЕАКЦИИр.
иногда возникает необходимость в явном виде рассматривать акты переноса энергии
между молекулами или с одних энергетич. уровней молекулы на другие. Особенно
ярко это проявляется в газофазных реакциях. Например, мономолекулярная реакция АВ А
+ В может осуществиться только в том случае, если молекула АВ будет обладать
внутр. энергией большей, чем энергия активации реакции. Такие активные молекулы
АВ* образуются в результате неупругих столкновений АВ с окружающими молекулами
X (термодинамически активация), а также при облучении светом или при электронном ударе.
Элементарная термодинамически реакция наряду с собственно химический превращением (константа
скорости k*) должна включать акты активации и дезактивации (константы
скорости k а и k д):

Вследствие увеличения концентрации
X с ростом давления данная реакция имеет второй порядок при малых давлениях и
первый порядок при больших давлениях (см. Мономолекулярные реакции). Строго
говоря, каждая из приведенных выше реакций должна описываться системой кинетическая
уравений, отвечающих микроскопич. актам с участием частиц с различные заселенностью
энергетич. уровней.
Передача энергии с колебательных
на электронные уровни молекулы является важной стадией, например, при взаимодействии
в основном электронном состоянии 2 Р 3/2 с колебательно-возбужденной
молекулой НСl (колебательное квантовое число u=1):
Канал (а)протекания
реакции приводит к резонансному электронно-колебательное обмену энергией, канал (б)-к
чисто колебательное дезактивации молекулы. В некоторых случаях МЕХАНИЗМ РЕАКЦИИр. включает в явном
виде отвод энергии от образовавшейся в реакции частицы. Так, рекомбинация атомов
и радикалов, например
RR, может осуществляться только как три-молекулярная реакция с участием
третьей частицы X, отводящей энергию, т. к. иначе выделившаяся при реакции энергия
приведет к диссоциации образовавшейся молекулы RR (
++ XRR
+ X*). Скорость такой реакции пропорциональна квадрату концентрации радикалов
и общему давлению. В случае рекомбинации многоатомных радикалов энергия реакции
распределяется по многие степеням свободы и образующаяся молекула приобретает стабильность,
а избыточную энергию отдает при последующей столкновениях с другими молекулами. Импульсная
ИК лазерная фотохимия позволяет экспериментально решать многие тонкие вопросы передачи
энергии между молекулами и между разными степенями свободы внутри молекулы.
Химическая энциклопедия. Том 3 >>