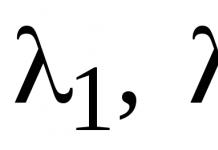Для того чтобы выявить наличие воспалительного процесса или заболевания применяют лабораторное исследование урины, а именно Ph мочи: норма определяет отсутствие патологий в организме, а отклонение указывает на их наличие.
О каком виде исследования идет речь, и какие нормы считаются допустимыми для здорового человека, узнаем далее.
Что значит Ph мочи?
Выделительная система в человеческом организме предназначена не только для выведения вредных и ненужных веществ, но и определяет кислотное равновесие .
Показатель под названием Ph означает общее число ионов в растворе, то есть в образце урины, собранной для анализа.
Проведение исследования показывает физические свойства в составе урины, а также оценивает баланс по кислоте и щелочи в ней. Постоянно высокая кислота вредит тканям организма. В этом случае, если не принимать усилий, тогда важные для жизни процессы будут приостановлены.
Какая норма?
Водородный показатель, то есть Ph, характеризует концентрацию по ионам водорода в организме людей. На уровень концентрации Ph влияют кислота, а также щелочь.
Норма уровня Ph в составе мочи зависит от того, в каком физиологическом состоянии находится человек, чем он питается, а также возраста и пола. Немаловажным фактором считается время, в которое собирается моча.
Основными нормами, установленными для определения Ph, являются следующие показатели :
- Для человека старше 18 лет нормой считается Ph от 5 0 и до 7;
- в среднем моча взрослых женщин и мужчин, собранная в утренние часы, находится в пределах 6,0-6,4 Ph;
- в вечернее время она немного повышается и может достигать от 6,4-7,0;
- для детей грудничкового возраста, получающих грудное вскармливание, норма определена в 6,9-8;
- при искусственном типе кормления ребенок грудничкового возраста должен иметь Ph в пределах от 5,4 до 6,9.
Причины отклонения от нормальных показателей
Если Ph мочи превышает отметку в 7, тогда она считается щелочной, а если держится на уровне 5 или ниже, тогда кислой.
Причин для повышения или понижения уровня Ph в моче много, однако, нужно рассмотреть основные из них, чтобы понять какое отклонение может менять показатели и как этого избежать.
Если кислотность мочи повышена , тогда это объяснить рядом причин, приводящим к этому явлению:
- При долгом голодании и недостатке пищи, содержащей углеводы, наблюдается повышение кислотности. Организм человека в таком случае запускает процесс по расщеплению и жиров, находящихся в запасах тела. Этот процесс осуществляется для восполнения необходимой энергии.
- Постоянные перегрузки человеческого организма и изнурительные занятия физическими упражнениями ведут к тому, что из тела уходить жидкость, а кислотность при этом повышается.
- В ситуациях, когда приходится пребывать в душном помещении, жарких странах или цехах с повышенной температурой.
- Избыточный уровень при диабете.
- Длительная интоксикация организма, в том числе алкогольными напитками.
- Воспалительные процессы в области почечной системы, в том числе и , а также цистит.
- Септическое состояние в организме человека.
Все вышеперечисленные причины повышенной кислотности лишь основные, но существуют еще и иные факторы, которые может установить только лечащий врач, основываясь на результатах исследований.
Пониженная кислотность часто наблюдается при наличии одной или нескольких причин этого явления. К ним относят:
- нарушение в работе , а также щитовидной железы;
- при приеме в пищу избыточного количества белка животного происхождения;
- избыточное употребление щелочной минеральной воды;
- высокий уровень желудочной кислотности;
- наличие ;
- активное размножение инфекции в области мочевыделительной системе.
В период беременности у женщины происходят перемены в обменных процессах организма, что влияет и на состояние Ph, поэтому в этот период нормальной считается кислотность в диапазоне 5,3-6,5 . Низкий уровень кислотности часто наблюдается в период рвоты и поноса.
Норма Ph мочи у ребенка может меняться в зависимости от вида вскармливания и времени суток, в которые проводится сбор урины. Поэтому окончательный диагноз может быть поставлен только детским врачом, на основе иных анализов и других исследований.
Определение кислотности мочи в домашних условиях
 Определить кислотность мочи можно не только в условиях лаборатории, но и дома. Вариант проведения анализа дома подходит тем пациентам, которые должны самостоятельно отслеживать уровень Ph, из-за наличия сахарного диабета или уратурии.
Определить кислотность мочи можно не только в условиях лаборатории, но и дома. Вариант проведения анализа дома подходит тем пациентам, которые должны самостоятельно отслеживать уровень Ph, из-за наличия сахарного диабета или уратурии.
Часто применяют такие виды исследования как:
- Лакмусовая бумага.
- Метод Магаршака.
- Тест-полоски, применяемые как в большинстве лабораторий, так и в домашних условиях, при проведении самостоятельных проверок на уровень Ph. Их можно приобрести в аптеках и применять по мере необходимости.
Она пропитана специальным реагентом, который вступает с жидкостью в реакцию, а затем меняет краску. Суть метода сводится к тому, что необходимо опустить сразу два вида полоски синюю и красную в урину и проверить, как меняется оттенок.
Если две полоски остались в том же состоянии, тогда реакция считается нейтральной. Если обе полоски сменили цветовую окраску, тогда принято считать, что в урине есть и щелочная и кислотная реакции.
Если красный цвет сменился синим, тогда присутствует щелочная реакция. При смене синего цвета на красный принято считать реакцию кислотной.
Суть этого способа определения уровня Ph сводится к тому, что берут два раствора красного и синего цвета, который постепенно добавляют в исследуемый материал.
Далее проверяют окраску: если урина стала ярко фиолетового цвета, тогда кислотность примерно 6, при окрашивании в серый оттенок нужно считать кислотность 7,2. Светло-фиолетовая моча указывает на уровень 6,6. Зеленая моча – это признак кислотности в 7,8.
Плюсом подобного исследования является простота, поскольку с определением кислотности в урине подобным способом может справиться любой человек. Полоску опускают в свежую порцию мочи, а затем смотрят результат по специальной шкале с обозначенной цветовой гаммой.
Способы для снижения и повышения уровня кислотности
Существуют медикаментозные способы, чтобы понизить или повысить уровень кислотности, а также рекомендации по введению в питание определенных продуктов, способствующих нормализации рн .
Врачи выписывают пациенту растворы, вводимые внутривенно. Они произведены на основе бикарбоната калия, а также средства, продающиеся в аптеке для успешной нормализации кислотности.
Для того чтобы существенно снизить высокий показатель по кислотности урины, рекомендуется употреблять продукты с низким уровнем белка . Должны употребляться те продукты, которые имеют нейтральную щелочную нагрузку.
Также нужно употреблять в пищу продукты с нулевым кислотообразованием. К ним относят:
- огурцы;
- мороженное;
- растительное масло;
Допускается введение в пищу продуктов, имеющих отрицательное кислотообразование . Это фрукты, грибы, свежая зелень, фруктовые соки, а также белое вино.
Дело в том, что разделение пищи по кислотности достаточно условное. Каждый организм человека индивидуален и переваривает пищу по-разному. Однако нужно постепенно корректировать меню, в соответствии с рекомендациями лечащего врача.

Важно помнить о нормализации водного баланса , поскольку люди, ведущие здоровый образ жизни, как правило, реже страдают от повышенной кислотности мочи. Вода не только нормализует состояние кислотности в теле человека, но и наладит работу почечной системы.
Для того чтобы наоборот повысить кислотность необходимо немного сократить количество употребляемой воды, поскольку она существенно повышает уровень кислотности в организме.
Определяющий уровень Ph важен, поскольку может дать информативную картину многих внутренних заболеваний. Поэтому врачи рекомендуют сдавать анализ в лабораторных условиях и следить за уровнем кислотности дома, пользуясь тест-полосками.
Важно изучить основные методы повышения и понижения кислотности и применять их для корректировки этого показателя.
Как пользоваться лакмусовой бумагой для определения кислотности, узнайте из видео:
Как утверждают многие специалисты, очень высокая кислотность организма нарушает нормальное функционирование систем органов, и они становятся беззащитными перед разнообразными бактериями и вирусами.
Показатель рН - это число атомов водорода в определённом растворе. Если он равен 7, то это нейтральная среда, если от 0 до 6,9, то это кислая среда, от 7,1 до 14 - щелочная. Как известно, человеческое тело на 80% состоит из водного раствора. Организм постоянно старается уравновесить соотношение кислоты и щелочи в этом растворе.
Если кислотно-щелочной баланс нарушается, то это может вызвать серьёзные нарушения в организме. При употреблении в пищу продуктов, богатых на кислоту, и недостаточном количестве воды возникает закисление всего организма. К таким продуктам относятся газированные напитки, крупы, продукты, содержащие сахар, заменители , хлебобулочные изделия, мясные продукты и мясо.
Нобелевский лауреат Отто Варбург получил свою премию за открытие, что в среде, богатой на кислород, раковые клетки не размножаются, а позже было ещё доказано, что в такой среде малоактивны вирусы, бактерии и грибки. Чем выше уровень pH, имеющий щелочную реакцию, тем выше концентрация молекул кислорода (калоризатор). В кислой среде происходит повышение концентрации CO2 и образование молочной кислоты, что создает предпосылки для роста раковых клеток.

Проверить свой кислотно-щелочной баланс достаточно просто с помощью специального теста - тест-полосок лакмусовой бумаги, которые можно купить в аптеке. Самый оптимальный рН-баланс равен 6,4-6,5. Определять свой кислотно-щелочной баланс лучше всего за час до еды, или через два часа после.
Что касается рН слюны, то его значение указывает на активную работу ферментов пищевого тракта, в особенности - печени и желудка. Нормальная кислотность смешанной слюны равна 6,8-7,4 pH. Измеряют её обычно в полдень натощак или через два часа после еды. Пониженная кислотность ротовой полости нередко приводит к кариесу, болезням десен, неприятному запаху изо рта.

В медицине существует такой термин, как «ацидоз» - это повышенная кислотность. К такому состоянию часто приводит употребление большого количества и осложнения сахарного диабета. При повышенной кислотности могут наблюдаться проблемы с сердцем и кровеносными сосудами. Человек может достаточно быстро набирать вес. Очень часто в таких случаях встречаются заболевания почек, мочевого пузыря и снижение иммунитета.
Повышение уровня щелочи в организме называется алкалоз. В этом случае также наблюдается плохое усвоение минеральных веществ. Причиной такого состояния в организме может быть длительное употребление лекарственных веществ, содержащих большое количество щелочи. Алкалоз встречается достаточно редко, но тоже могут вызвать серьёзные и негативные перемены в нашем организме. К ним относятся заболевания кожных покровов и печени, неприятный и ярко выраженный запах изо рта и другие.

Для поддержки оптимального кислотно-щелочного баланса организма (30 мл на 1 кг тела). Что касается еды, то продуктов, богатых на щелочь, должно быть в несколько раз больше, чем продуктов кислотного характера.
Растительная пища, как овощи и фрукты, способствует образованию щелочной реакции, а злаки, мясо, обработанная пища в виде колбас, полуфабрикатов, хлебобулочных изделий - кислой. Чтобы поддерживать оптимальный кислотно-щелочной баланс, необходимо, чтобы в рационе преобладала растительная пища.
Врачи утверждают, что в наших же с вами интересах поддерживать правильный уровень кислоты и щелочи в организме. Только при оптимальном рН-балансе наш организм хорошо усваивает полезные вещества.
В нашем организме есть естественные механизмы, которые налаживают кислотно-щелочной баланс. Это буферные системы крови, дыхательная система и система выделения. Когда эти процессы нарушаются, то наш организм выделяет кислоты в желудочно-кишечный тракт, в почки и лёгкие, а также нашу кожу. Также он способен нейтрализовать кислоты минеральными веществами и накапливать кислоты в мышечной ткани (calorizator). Если вы ощущаете усталость, то это может значить, что гемоглобина крови нейтрализует кислоту. Если наблюдаются головокружения, головные боли, судороги и бессонница, то это может сигнализировать о том, что в нервных окончаниях, мышечной ткани и костях используется .

Вот сколько проблем со здоровьем может возникнуть из-за нарушения кислотно-щелочного баланса. Не пускайте дело на самотёк, возьмите во внимание то, что профилактика - это залог крепкого здоровья. Следите регулярно за рН организма во избежание многих заболеваний.
Водородный показатель – рН – это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
pН = – lg
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni – сила водорода, или pondus hydrogenii – вес водорода.
Несколько меньшее распространение получила обратная pH величина – показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH:
рОН = – lg
В чистой воде при 25°C концентрации ионов водорода () и гидроксид-ионов () одинаковы и составляют 10 -7 моль/л, это напрямую следует из константы автопротолиза воды К w , которую иначе называют ионным произведением воды:
К w = · =10 –14 [моль 2 /л 2 ] (при 25°C)
рН + рОН = 14
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания – наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда > говорят, что раствор является кислым, а при > – щелочным.
Определение рН
Для определения значения pH растворов широко используют несколько способов.
1) Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы – органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах – либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы (см. Таблица 1, занятие 2).
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
2) Аналитический объёмный метод – кислотно-основное титрование – также даёт точные результаты определения общей кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титранта точно хватает, чтобы полностью завершить реакцию, – фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред (Табл. 2).
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем.
3) Использование специального прибора – pH-метра – позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов, отличается удобством и высокой точностью, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
С помощью рН-метра измеряют концентрацию ионов водорода (pH) в растворах, питьевой воде, пищевой продукции и сырье, объектах окружающей среды и производственных систем непрерывного контроля технологических процессов, в т. ч. в агрессивных средах.
рН-метр незаменим для аппаратного мониторинга pH растворов разделения урана и плутония, когда требования к корректности показаний аппаратуры без её калибровки чрезвычайно высоки.
Прибор может использоваться в лабораториях стационарных и передвижных, в том числе полевых, а также клинико-диагностических, судебно-медицинских, научно-исследовательских, производственных, в том числе мясо-молочной и хлебопекарной промышленности.
Последнее время pH-метры также широко используются в аквариумных хозяйствах, контроля качества воды в бытовых условиях, земледелия (особенно в гидропонике), а также – для контроля диагностики состояния здоровья.
Таблица 2. Значения рН для некоторых биологических систем и других растворов
Из книги: Randy Holmes-Farley: Рифовая алхимия
Величина pH в рифовом аквариуме серьёзным образом влияет на жизнеспособность и состояние организмов, считающих этот аквариум своим домом. К сожалению, есть много факторов, которые выводят pH за пределы диапазона, оптимального для многих совместно содержащихся в морских аквариумах организмов. К примеру, слишком низкое значение pH затрудняет формирование скелета из карбоната кальция у кальцинируемых организмов. При достаточно низком pH эти скелеты, фактически, начинают растворяться. По этой причине аквариумисты должны следить за данным параметром. Подобное наблюдение, очень часто, является первым шагом на пути к решению различных вопросов, связанных с рН. Многие рифовые аквариумисты относят низкое значение pH к числу самых досадных проблем, связанных с поддержанием подходящих условий в аквариуме. В настоящей статье будут подробно рассмотрены причины, которые могут привести к низким значениям pH во многих аквариумах, и описаны лучшие способы его повышения. Проблемы, связанные с высоким значением pH были вкратце рассмотрены в моей предыдущей статье .
Что такое pH?
Данная глава должна помочь аквариумистам понять, что означает термин “pH”. Те, кто хочет только решить проблему низкого pH, может сразу перейти к выделенному жирным шрифтом тексту в конце данного раздела.
Есть множество различных определений понятия pH применительно к морской воде. В системе, используемой большинством аквариумистов (система Национального Бюро Стандартов - NBS) pH определяется согласно уравнению 1:
1. pH = -log a H
где a H
это «активность» ионов водорода (H +
, также называемых протонами) в растворе. Активность – это способ, которым химики измеряют “свободные” концентрации, и pH является мерой числа ионов водорода в растворе. Ионы водорода в морской воде частью находится в свободном состоянии (в действительности они не свободны, а присоединяются к молекулам воды, образуя комплексы - например, H 3
O +
), а частью составляют комплексы с другими ионами (поэтому химики используют термин "активность" вместо концентрации). В частности, ионы H +
в обычной морской воде присутствуют в виде свободных ионов H +
(около 73% от общего количества), в виде пар ионов H +
/SO4
--
(около 25% от общего содержания H +
), и виде пар ионов H +
/F -
(небольшая доля от общего числа H +
). Вопросы активности также влияют на калибровочные буферные растворы, и это одна из причин, по которой к морской воде применяют различные шкалы измерения pH и калибровочные буферные растворы. Нас, аквариумистов, однако, все эти прочие стандарты мало касаются: в среде аквариумистики принято иметь дело исключительно со стандартной системой NBS (Национального Бюро Стандартов США).
Для понимания основных проблем, связанных со значением pH в морских аквариумах, можно представить, что значение pH непосредственно связано с концентрацией H + :
2. pH = -g H log
где g H – константа (коэффициент активности), которую, в большинстве случаев, можно игнорировать (g H = 1 в чистой пресной воде и ~0.72 в морской воде). По сути, аквариумистам достаточно понимать, что pH является мерой числа ионов водорода в растворе, и что шкала pH логарифмическая. Это означает, что при pH 6 имеется в 10 раз больше ионов H + , чем при pH 7, и что при pH 6 имеется в 100 раз больше ионов H+, чем при pH 8. Следовательно, небольшое изменение величины pH может быть связано с существенным изменением концентрации ионов H + в воде.
Зачем контролировать pH?
Есть несколько причин, по которым аквариумисты хотели бы контролировать pH в морских аквариумах. Одна из них в том, что водные организмы активно растут только в определённом диапазоне pH. Естественно, этот диапазон различен для разных организмов, и понятие «оптимального» диапазона может быть не совсем корректным для аквариума, в котором содержится много различных видов. Даже натуральная морская вода (pH = 8.0-8.3) не будет оптимальной для всех существ, живущих в ней. Тем не менее, более восьмидесяти лет назад было установлено, что сильное расхождение pH от показателя, свойственного натуральной морской воде (например, ниже значения pH 7.3), является источником стресса для рыб 1 . Теперь мы обладаем дополнительной информацией об оптимальных диапазонах величины pH для многих организмов, но, к сожалению, эти данные недостаточны для того, чтобы аквариумисты могли найти оптимальное значение pH для большинства организмов, которые их интересуют. 2-6 Кроме того, вдияние pH может быть косвенным. Например, известно, что токсичность меди и никеля для некоторых организмов, присутствующих в наших аквариумах (таких как мизиды и разноногие ракообразные) зависит от величины pH 7 . Как следствие, диапазоны pH, которые будут приемлемы для одного аквариума, могут отличаться от величин, приемлемых для другого, даже если в этих аквариумах будут жить одиаковые организмы.
Тем не менее, имеются фундаментальные процессы, происходящие во многих морских организмах, на которые серьёзно влияют изменения pH. Одним из них является кальцификация (отвердение). Известно, что кальцификация в кораллах зависит от значения pH, и она падает по мере падения pH. 8-9 Используя такие факторы в совокупности с опытом, накопленным многочисленными любителями, мы можем разработать некоторые основные положения относительно приемлемого диапазона и предельно допустимых значений pH для рифовых аквариумов.
Каков приемлемый диапазон значений pH для рифового аквариума?
Приемлемый диапазон значений pH для рифовых аквариумов – это скорее мнение, а не конкретно определённый факт, и естественно, он будет варьироваться в зависимости от того, кто высказывает это мнение. И этот диапазон может довольно сильно отличаться от «оптимального» диапазона. При этом, по сравнению с приемлемым диапазоном, гораздо трудее обосновать, что же является «оптимальным диапазоном». Я предлагаю считать подходящим значение pH натуральной морской воды, равное примерно 8.2, но рифовый аквариум может жить в более широком диапазоне значений pH. Я считаю, что диапазон значений pH от 7.8 до 8.5 является приемлемым для рифовых аквариумов, с некоторыми допущениями, а именно:
- Буферность (KH) должна составлять, как минимум, 2.5 мэкв/л, и предпочтительно выше, особенно ближе к нижнему пределу диапазона pH. Данное положение частично основывается на том факте, что многие рифовые аквариумы довольно эффективно содержатся в диапазоне pH 7.8-8.0. При этом большая часть лучших из этих аквариумов содержит кальциевый реактор, который, хотя и имеет тенденцию к снижению pH, при этом поддерживает достаточно высокий уровень KH (3 мэкв/л и выше). В этом случае, любые проблемы, связанные с кальцинированием при низких значениях pH , могут быть компенсированы повышением щёлочности. Низкое значение pH в первую очередь поражает кальцифицируемые организмы, затрудняя получение достаточного количества карбоната для образования скелетов. Увеличение буферности сглаживает это затруднение по причинам, которые будут подробно рассмотрены далее в данной статье.
- Уровень кальция должен составлять, как минимум, 400 ppm. При понижении pH кальцификация становится затруднительной; она также становится затруднительной, поскольку снижается уровень содержания кальция . Крайне нежелательно одновременно иметь предельно допустимые низкие значения pH, щёлочности и содержания кальция. Таким образом, если pH будет в области низких значений, и будет нелегко изменить его значение (как например, в аквариуме с кальциевым реактором CaCO3/CO2), следует, по крайней мере, обеспечить приемлемое содержание кальция (~400-450 ppm). Более того, одна из проблем, возникающих при высоких значениях pH (свыше 8.2), является абиотическое осаждение карбоната кальция, приводящее к падению содержания кальция и щёлочности и к засорению нагревателей и импеллеров насосов. Если величина pH в аквариуме составляет 8.4 или выше (что часто имеет место в аквариумах, при применении известковой воды Ca(OH) 2 - кальквассера), следует обратить должное внимание поддержанию надлежащего уровеня содержания кальция и буферности. Это означает, что эти уровни не должны быть ни слишком низкими, вызывающими биологическую кальцификацию, ни слишком высокими, вызывающими избыточное абиотическое осаждение на оборудовании.
Углекислый газ и pH
Величина pH в аквариуме с морской водой тесно связана с количеством растворенной в воде двуокиси углерода. Она также связана и с буферностью. Действительно, если вода будет полностью аэрированной (т.е. в полном равновесии с обычным воздухом), то величина pH точно определяется щёлочностью карбоната. Чем выше щёлочность, тем выше pH. Рисунок 1 показывает соотношение для морской воды, в состоянии равновесия с обычным воздухом (350 ppm двуокиси углерода), и воды, находящейся в состоянии равновесия с воздухом, содержащим избыточное количество двуокиси углерода, который может присутствовать в доме (1000 ppm). Очевидно, что при любой буферности, при повышении содержания двуокиси углерода величина pH понизится. Именно избыток двуокиси углерода и бывает причиной низкого pH в рифовых аквариумах.

Рисунок 1. Соотношение между буферностью и pH в морской воде, находящейся в равновесии с воздухом, содержащим обычное и повышенное количество двуокиси углерода.
Зелёная точка соответствует естественной морской воде в равновесии с обычным воздухом, а кривые отражают результат, который был бы получен при повышенной или пониженной буферности.
Упрощенно данное соотношение можно понимать следующим образом: Двуокись углерода присутствует в воздухе в виде CO 2
. При растворении в воде он превращается в угольную кислоту H 2
CO 3
:
3. CO 2 + H 2 O -> H 2 CO 3
Количество H 2 CO 3 в воде (когда она хорошо аэрирована) не зависит от pH, а только от содержания углекислого газа в воздухе (и, в некоторой степени, от других факторов, таких, как температура и солёность). В системах, не уравновешенных воздухом, к которым можно отнести многие рифовые аквариумы, эти аквариумы можно рассматривать «как если бы» они находились в равновесии с неким количеством CO 2 в воздухе, которое эффективно определяется количеством H 2 CO 3 в воде. Следовательно, если в аквариуме (или в воздухе, с которым он уравновешен) имеется «избыток CO 2 », это означает, что в аквариуме присутствует избыток H 2 CO 3 , что, в свою очередь, означает что величина pH должна упасть, как это показано ниже.
Морская вода содержит смесь угольной кислоты, бикарбоната и карбоната, которые всегда находятся в равновесии:
4. H 2 CO 3 -> H + + HCO 3 - -> 2H + + CO 3 --
Уравнение 4 показывает, что если в аквариуме имеется избыток H 2 CO 3 , часть его диссоциирует (разбивается на части), превращаясь в ионы H + , HCO 3 - и CO 3 -- . В результате избытка H + , величина pH будет ниже, чем, если бы в нём было меньше CO 2 /H 2 CO 3 . При большом избытке CO 2 в морской воде величина pH может упасть до очень низких значений (pH 4-6). Уравновешивание воды в моём аквариуме с двуокисью углерода при давлении в 1 атмосферу привело к снижению pH до 5.0, хотя маловероятно, что такое низкое значение было бы достигнуто в рифовом аквариуме, поскольку находящиеся в нём грунт и остовы кораллов будут играть роль буфера при растворении. В моём аквариуме вода, уравновешенная двуокисью углерода при давлении в 1 атмосферу, в присутствии избытка твёрдого арагонита (кристаллическая форма карбоната кальция, т.е. в той же форме, что и в остовах кораллов), привела к величине pH, равной 5.8.
Если буферность составляет 3 мэкв/л (8.4 dKH), а pH - 7.93, это означает, что в аквариуме имеется избыток CO 2 (в противном случае значение pH должно было быть чуть выше 8.3).
Рисунки 2-5 графически показывают некоторые способы повышения pH в аквариумах. К способам увеличения pH относятся:
- Насыщение воды «обычным воздухом», вытесняя избыток двуокиси углерода приведет к смещению характеристик аквариума по зелёной линии (Рисунок 3), в результате чего значение pH поднимется чуть выше pH 8.3. Такой же результат имел бы место, если бы для избытока двуокиси углерода был поглощен в результате роста макро водорослей. Однако редко случается, чтобы такое явление могло привести к смещению характеристики вдоль зелёной линии, до значения выше pH 8.3.
- Увеличение буферности: даже если в аквариуме продолжает сохраняться избыток CO 2 , увеличение буферности приведет к увеличению pH вдоль зелёной линии (Рисунок 4) до значения 8.1 при буферности 4.5 мэкв/л (12.6 dKH).
- Применение известковой воды (kalkwasser) для снижения избыточного содержания CO 2 до нормального уровня, а также для увеличения буферности (до 4 мэкв/л), может привести к смещению кривой вдоль зелёной линии (Рисунок 5), что приведёт к увеличению pH свыше 8.4 и буферности до 4 мэкв/л (11.2 dKH).

Рисунок 2. Те же кривые, что и на Рисунке 1. Красные линии показывают величину pH,
которая получается при буферности 3 мэкв/л (8.4 dKH). Ясно видно, что величина pH значительно выше
при обычных уровнях содержания двуокиси углерода, чем при его повышенном содержании.

Рисунок 3. Те же кривые, иллюстрирующие влияние аэрации на pH,
при избыточном начальном содержании двуокиси углерода

Рисунок 4. Те же кривые, иллюстрирующие влияние увеличения буферности на pH,
при сохранении высокого содержание двуокиси углерода

Рисунок 5. Те же кривые, иллюстрирующие влияние известковой воды (kalkwasser) на pH путём сокращения избытка двуокиси углерода (гидроокись вступает в реакцию с двуокисью углерода, образуя
бикарбонат и карбонат), одновременно с увеличением буферности.
Почему значение pH изменяется в дневное и в ночное время?
Суточные изменения pH в рифовых аквариумах возникают из-за биологических процессов фотосинтеза и дыхания. Фотоситнез – это процесс, при котором организмы преобразуют двуокись углерода и воду в углеводы и кислород:
5. 6CO 2 + 6H 2 O + свет -> C 6 H 12 O 6 (углеводы) + 6O 2
Таким образом, в дневное время суток происходит потребление двуокиси углерода. В результате этого потребления многие аквариумы испытывают нехватку CO 2 в дневное время, и pH растет.
Кроме этого, организмы, обитающие в аквариуме также осуществляют процесс дыхания, во время которого углеводы преобразуются обратно в энергию, которая будет использоваться для других целей. По сути, этот процесс противоположен фотосинтезу:
6. C 6 H 12 O 6 (углеводы) + 6O 2 -> 6CO 2 + 6H 2 O + энергия
Данный процесс происходит в рифовом аквариуме постоянно, и он приводит к понижению pH в связи с образованием двуокиси углерода.
В результате совокупного действия этих процессов в большинстве рифовых аквариумов в дневное время pH возрастает, а в ночное время падает. Для типичного аквариума это изменение pH варьирует в диапазоне от менее, чем 0.1, до более чем 0.5. Как уже обсуждалось в других частях данной статьи, активная аэрация аквариумной воды для вытеснения избыточной двуокиси углерода или привлечения двуокиси углерода при её дефиците полностью нивелирует суточные колебания pН. На практике, однако, трудно достичь полной компенсации, величина pH различна в дневное и ночное время.
Помимо аэрации, на изменение pH влияет присутствие буферных растворов. Высокая карбонатная буферность приводит к меньшим колебаниям в pH, поскольку сочетание карбоната с бикарбонатом создаёт буфер, смягчая изменения pH. Борная кислота и ее соли также образуют буфер, смягчающий изменения pH. Емкость обех этих буферных систем выше при высоких значениях pH (8.5), чем при низких (7.8). Таким образом, аквариумисты, у которых значение pH в аквариуме низкое, могут столкнуться по этой причине с бОльшими колебаниями в значениях pH. Я детально обсуждал буферные эффекты и проблемы суточных колебаний pH в предыдущей статье .
Решение проблем с pH
Ниже приводятся конкретные советы по решению проблем с низким pH. Эти советы могут также помочь при поправке уровней pH ближе к природным значениям, даже если эти уровни уже находятся в пределах «приемлемого диапазона», как было описано выше, но всё ещё не столь высоки, как хотелось бы. Тем не менее, прежде чем приступить к реализации стратегии по изменению pH, ознакомьтесь с некоторыми общими положениями:
Убедитесь что у вас действительно есть проблема с уровнем pH. Зачастую, в результате некорректно произведенных измерений, вам может казаться, что есть проблема. Эта ситуация наиболее типична для случаев, когда аквариумист пользуется набором тестов (капельным тестом или тест-полосками) для измерения pH, а не пользуется электронным pH-метром. Тем не менее, ошибки возможны при любых измерениях, и будет досадно, если вы сделаете аквариуму хуже только из-за того, что pH-метр был неправильно откалиброван. Поэтому, прежде чеи начать коррективные меры, убедитесь, что значения pH были измерены правильно. Ниже приводятся ссылки на две статьи, которые стоит прочитать для того, чтобы быть уверенными, что измерение pH производится верно:
- Калибровка pH-метра при помощи буры из хозяйственного магазина .
Прежде чем приступить к поиску решения, попытайтесь определить причину, по которой возникла проблема. Например, если низкое значение pH вызвано избытком углекислого газа в воздухе помещения, усиление аэрации этим же воздухом вряд ли поможет в решении этой проблемы. Гораздо лучшим решением будет если вы адресуете саму суть проблемы.
Причины низкого pH
Как уже описывалось выше, когда значение pH опускается ниже 7.8, возникают проблемы. Это значит, что в течение дня нижнее значение pH опускается ниже 7.8. Конечно, если нижнее значение pH опустится до 7.9, все равно, будет нужно поднять значение pH, но уже не так срочно. Как правило, есть несколько причин, которые могут приводить к низкому значению pH, и по каждому случаю нужны различные действия. Нет универсального способа, позволяющего предохранить аквариум от всех этих проблем одновременно!
Первым шагом в решении проблемы низкого pH является выяснение причины его возникновения. Возможные причины могут быть следующие:
- В аквариуме используется кальциевый реактор (реактор карбоната кальция с двуокисью углерода: CaCO 3 /CO 2 ).
- Аквариум имеет низкую буферность.
- В связи с недостаточной аэрацией в аквариуме имеется больше CO 2 , чем в окружающем воздухе. Не заблуждайтесь, думая, что аквариум будет в достаточной степени насыщен кислородом, поскольку вода в нём очень турбулентна. ГОРАЗДО труднее привести содержание двуокиси углерода к равновесию, чем просто обеспечить достаточное количество кислорода. Если бы двуокись углерода находилась в идеальном равновесии, НЕ было бы разницы между величинами pH в дневное и в ночное время. Поскольку в большинстве аквариумов ночью значение pH ниже, это говорит об их неполной насыщенности воздухом.
- В аквариуме имеется избыток CO 2 , поскольку воздух в помещении содержит избыток CO 2 .
- Аквариум находится в процессе запуска, и в нем содержится избыток кислоты, образующейся в результате азотного цикла и разложения органических веществ до CO 2 .
Тест аэрацией
Некоторые из перечисленных выше вариантов требуют определённых усилий для диагностики. Проблемы 3 и 4 являются довольно распространёнными, и есть простой способ их выявления. Наберите стакан воды из аквариума и измерьте pH. Затем интенсивно аэрируйте эту воду в течение часа, используя наружный воздух. Значение pH возрастет, если pH был слишком низким для имеющегося значения буферности, в соответствии с Рисунком 3 (если pH вырастет, вероятно, одно из измерений - pH или буферность – было ошибочным). В этом случае повторите эксперимент с новым стаканом воды, используя для аэрации воздух из помещения. Если pH снова вырастет, значит pH в аквариуме также будет расти в результате аэрации, потому что вода в аквариуме содержит избыточную дозу двуокиси углерода. Если pH в стакане не вырастет (или будет расти очень медленно), это означает, что воздух в помещении содержит избыток CO 2 , и увеличение насыщенности этим воздухом не решит проблему низкого pH (при этом, проблема может быть решена, если для насыщения использовать свежий воздух).
Решение проблем с низким значением pH
Некоторые решения пригодны только при определённых причинах, и о них подробно говорится ниже. Тем не менее, есть и общие решения, которые часто бывают эффективными. К таким решениям относится применение добавок для повышения pH. Их применяют в случаях, когда требуется повышение буферности. В этомо случае лучше всего использовать известковую воду (kalkwasser), после чего можно использовать двухкомпонентные добавки для повышения pH. Преимущество этих методов в том, что они увеличивают pH без нарушения баланса с кальцием.
Использование одних только буферных растворов не всегда является хорошим методом, поскольку они лишь немного увеличивают значение pH, в то время, как буферность растет существенно. К сожалению, этикетки на многих имеющихся на рынке буферных растворах пишутся так, чтобы убедить аквариумистов, что pH будет в порядке, если они просто добавят некоторое количество этого раствора. В большинстве же случаев улучшение pH происходит только на один день, при этом щёлочность увеличивается сверх желаемых пределов.
Два других полезных метода заключаются в выращивании макро водорослей, которые в процессе роста поглощают некоторое количество CO 2 из воды (зачастую водоросли освещаются в противофазе с основным аквариумом - свет в емкости в макроводорослями включается ночью, когда свет в основном аквариуме выключен, чтобы минимизировать уменьшение pH), и насыщении воды свежим воздухом, забираемым снаружи помещения.
Низкое значение pH, вызванное кальциевым реакторомОбщей причиной низкого значения pH в рифовом аквариуме является использование кальциевого реактора. Эти реакторы применяют двуокись углерода, имеющую кислую реакцию, для растворения карбоната кальция, в результате чего в аквариум, хоть и временно, поступает значительное количество кислоты. В идеале двуокись углерода должна выветриваться из реактора, после того, как часть ее была израсходована на растворение CaCO 3 . Но в реальности данный процесс проходит не полностью, и аквариумы, в которых применяется кальциевый реактор, обычно действуют при значениях pH, близких к нижнему краю допустимого диапазона.
Предлагаемые решения предполагают, что реактор был должным образом отрегулирован. Плохо настроенный реактор может привести к понижению pH ниже обычного значения, поэтому первым шагом должно быть поведение соответствующей настройки. Вопрос настройки кальциевого реактора выходит за рамки данной статьи, отметим только, что значения pH и буферность вытекающей из реактора воды не должны быть слишком низкими.
Для минимизации проблемы низкого pH, возникающей в результате использования кальциевых реакторов, предлагалось много разных подходов, с различной степенью успеха. Одним из таких подходов является использование двухкамерного реактора, в котором вытекающая вода проходит через вторую камеру с CaCO 3 до того, как будет сброшена в аквариум. Растворение дополнительного CaCO 3 приводит к увеличению pH, а также вызывает повышение уровней содержания кальция и буферности в растворе. Такой подход выглядит успешным для повышении pH вытекающей из реактора воды, но не на всем пути до аквариума, и проблема низкого pH полностью не исчезает.
Другим подходом является аэрация воды на выходе из кальциевого реактора, до того, как она попадёт в аквариум. Целью этого метода является выдувание избытка CO 2 до того, как вода попадет в аквариум. Этот подход хорош в теории, но не на практике, поскольку до попадания в аквариум на дегазацию отводится недостаточно времени. Другой проблемой при этом подходе является тот факт, что в случае успешного повышения pH раствор может оказаться пересыщен CaCO 3 , что может привести ко вторичному осаждению CaCO 3 в реакторе, тем самым загрязняя его и снижая эффективность.
И, наконец, последний подход, возможно, самый успешный, заключается в комбинировании кальциевого реактора с другой системой повышения буферности, повышающей также значение pH. Самым удачным, наверное, является использование известковой воды (гидроксида кальция). В этом случае известковая вода применяется не столько для увеличения растворенного кальция или повышения буферности, а для того, чтобы поглотить избыток CO 2 , и, тем самым, поднять pH. Необходимое для этого количество известковой воды не так велико, как в случае ее использования в качестве основного источника для поддержания высоких уровней кальция и буферности. Добавление известковой воды может проводиться по таймеру, в ночные часы или рано утром, когда низкие значения pH наболее вероятны. Добавка известковой воды может проводиться исходя из показаний контроллера pH, т.е. она может добавляться только, когда значение pH упадет ниже определенного значения (например, ниже pH 7.8).
Низкое значение pH, вызванное высоким уровне м содержания углекислого газа в помещении
Высокие уровни содержания углекислого газа в помещении также могут привести к понижению pH в аквариумах. Дыхание людей и домашних животных, использование систем отопления, сжигающих природный газ (например, печи и плитки) при ненадлежащей вентиляции, и применение кальциевых реакторов могут привести к высоким уровням содержания углекислого газа в помещении. Уровень содержания углекислого газа в помещении легко может превысить его содержание в наружном воздухе вдвое, а такой избыток может привести к значительному понижению pH в аквариуме. Данная проблема особенно насущна в новых, более герметично закрываемых помещениях. Эта проблема вряд ли будет иметь место в старых домах, где ветер может «гулять» через оконные рамы.
Многие аквариумисты обнаружили, что открытое окно рядом с аквариумом может значительно повысить pH за один или два дня. К сожалению, аквариумисты, живущие в холодном климате, не могут комфортно открывать окна зимой. Некоторые из них выяснили, что в такой ситуации полезно провести трубку снаружи к месту забора воздуха флотатора, в котором свежий наружный воздух быстро смешивается с аквариумной водой. Имейте в виду, что если аквариумист проживает в зоне, где периодически распрыскиваются инсектициды для борьбы с комарами (например, в пригородных районах на юге), на забор воздуха необходимо устанавливать фильтр с активированным углем, чтобы предотвратить попадание ядохимикатов в аквариум.
Наконец, хорошим решением для многих случаев будет использование известковой воды (гидроксида кальция). Известковая вода может быть особенно эффективна, поскольку в данной ситуации маловероятно, чтобы pH в аквариуме поднялся до нежелательно высокого уровня - опасности, которая может сопровождать применение известковой воды в качестве основного источника кальция и буферности. Несмотря на то, что гидроксид кальция является самой распространённой и общепризнанной добавкой для обеспечения необходимой буферности в аквариуме, одновременно с повышением pH, можно воспользоваться и другими добавками для повышения pH. Например, в данной ситуации добавки на основе карбоната будут очень полезны, а на основе бикарбоната – нет. Если рассмотреть коммерческие продукты, B-ionic компании ESV будет лучше, чем более новая версия (Bicarbonate B-ionic) того же производителя. Стиральная сода (карбонат натрия) или прокаленная пищевая сода будут лучше, чем обычная пищевая сода (бикарбонат натрия).
Низкий pH, вызванный низкой буферностью
Низкая буферность также может привести к низкому уровню pH. Например, если понижение буферности по мере кальцификации ничем не компенсируется, это может привести к падению pH. Такое падение возможно при всех методах компенсации буферности, но больше всего будет наблюдаться при применении тех систем, которые сами не увеличивают значение pH (например, кальциевый реактор или использование бикарбонатов). В этом случае очевидное решение состоит в увеличении буферности каким-либо образом, в соответствии с Рисунком 4.
Резкое падение pH
Все описанные выше случаи относятся к хронически низким значениям pH. Ни один из рассмотренных вариантов не касается случаев резкого или временного сдвига pH. Однако, в некоторых ситуациях такое может произойти, и будет полезно знать, как поступать в подобных случаях. Большинство аквариумистов вряд ли будут делать, то, что сделал я: например, бросать в самп кусочек сухого льда только для того, чтобы посмотреть, что произойдёт. Сделав это, я увидел, что pH стал резко падать. Подобным образом легко можно убедиться в том, что значение pH равное 5 может убить всё живое в аквариуме (в моём случае этого не произошло, но я бы не рекомендовал вам пытаться повторить этот эксперимент ради развлечения).
С большей степенью вероятности, могут возникнуть проблемы с выбросом большого количества углекислого газа в результате сбоя в системе подачи углекислого газа в реактор. В большинстве этих случаев я бы посоветовал ничего не предпринимать до тех пор, пока с помощью сильной аэрации не будет удалён избыток CO 2 . Возможно, стоит открыть окно, чтобы участвующий в газообмене воздух сам по себе не содержал избытка CO 2 . Примерно за сутки состояние аквариума должно вернуться к норме. Если аквариумист решит добавить какое-либо средство для увеличения pH, он рискует поднять его значение до слишком высокого уровня через сутки, после того, как из аквариума был выведен избыток CO 2 .
Если причиной падения pH является минеральная кислота (например, соляная), карбонатная буферность (а также общая буферность) обвалится. В эьтом случае я бы советовал измерить буферность, и воспользоваться добавками для повышения карбонатной буферности (не на основе бора), для того, чтобы поднять буферность, вернув её к нормальному уровню (в диапазоне 2.5- 4 мэкв/л или 7-11 dKH). Конечным результатом этих действий должно быть увеличение pH. С помощью некоторых щелочных добавок (известковая вода или обычный B-ionic) значение pH можно увосстановить быстро, а при применении других (как, например, пищевая сода) увеличение pH будет происходить медленно, поскольку аквариуму потребуется время на выведение образующегося CO 2 .
Если причиной падения pH является уксус или другая органическая кислота, я бы посоветовал такие же меры, что и для соляной кислоты, о чём говорилось выше. Надо только иметь в виду, что с течением времени (от нескольких часов до суток) ацетат, образовавшийся из уксуса (уксусной кислоты) будет окислен до CO 2 и OH-. Результатом этого будет возможное увеличении значения pH и щёлочности. Поэтому, этом случае лучше ограничить или воздержаться от иных действий, приводящих к увеличению буферности. Если для стабилизации образовавшейся кислоты будет применяться большое количество добавок для повышения буферности, величина pH и /или буфрность впоследствии могут вырости до более высоких значений, чем хотелось бы.
Заключение
pH является важным показателем морского аквариума, хорошо знакомым большинству аквариумистов. Он оказывает серьёзное влияние на здоровье и самочувствие жителей наших систем, и мы обязаны сделать всё возможное для того, чтобы этот показатель лежал в допустимых пределах. В данной статье приводятся советы по решению часто встречающихся проблем, связанных с низким значением pH в аквариумах, позволяя аквариумистам диагностировать и решать проблемы низкого pH, которые могут возникнуть в аквариумах.
Счастливого «рифования»!
Если у вас появятся вопросы по данной статье, пожалуйста, посетите мой авторский форум на ReefCentral.
1. Hydrogen-ion concentration of sea water in its biological relations. Atkins, W. R. G. J. Marine Biol. Assoc. (1922), 12 717-71.
2. Water quality requirements for first-feeding in marine fish larvae. II. pH, oxygen, and carbon dioxide. Brownell, Charles L. Dep. Zool., Univ. Cape Town, Rondebosch, S. Afr. J. Exp. Mar. Biol. Ecol. (1980), 44(2-3), 285-8.
3. Chondrus crispus (Gigartinaceae, Rhodophyta) tank cultivation: optimizing carbon input by a fixed pH and use of a salt water well. Braud, Jean-Paul; Amat, Mireille A. Sanofi Bio-Industries, Polder du Dain, Bouin, Fr. Hydrobiologia (1996), 326/327 335-340.
4. Physiological ecology of Gelidiella acerosa. Rao, P. Sreenivasa; Mehta, V. B. Dep. Biosci., Saurashtra Univ., Rajkot, India. J. Phycol. (1973), 9(3), 333-
5. Studies on marine biological filters. Model filters. Wickins, J. F. Fish. Exp. Stn., Minist. Agric. Fish. Food, Conwy/Gwynedd, UK. Water Res. (1983), 17(12), 1769-80.
6. Physiological characteristics of Mycosphaerella ascophylli, a fungal endophyte of the marine brown alga Ascophyllum nodosum. Fries, Nils. Inst. Physiol. Bot., Univ. Uppsala, Uppsala, Swed. Physiol. Plant. (1979), 45(1), 117-21.
7. pH dependent toxicity of five metals to three marine organisms. Ho, Kay T.; Kuhn, Anne; Pelletier, Marguerite C.; Hendricks, Tracey L.; Helmstetter, Andrea. National Health and Ecological Effects Research Laboratory, U.S. Environmental Protection Agency, Narragansett, RI, USA. Environmental Toxicology (1999), 14(2), 235-240.
8. Effects of lowered pH and elevated nitrate on coral calcification. Marubini, F.; Atkinson, M. J. Biosphere 2 Center, Columbia Univ., Oracle, AZ, USA. Mar. Ecol.: Prog. Ser. (1999), 188 117-121.
9. Effect of calcium carbonate saturation state on the calcification rate of an experimental coral reef. Langdon, Chris; Takahashi, Taro; Sweeney, Colm; Chipman, Dave; Goddard, John; Marubini, Francesca; Aceves, Heather; Barnett, Heidi; Atkinson, Marlin J. Lamont-Doherty Earth Observatory of Columbia University, Palisades, NY, USA. Global Biogeochem. Cycles (2000), 14(2), 639-654.
Самая большая проблема, с которой когда-либо сталкивается аквариумист — поддержание постоянного уровня рН. Многие любители не могут понять, почему необходимо поддерживать постоянный уровень рН в аквариуме и какие факторы влияют на уровень рН в аквариуме.
Почему значение рН важно для вашего аквариума?
Поддержание постоянного рН может сильно повлиять на воду в вашем аквариуме. Например, если ваш рН падает ниже 6, бактерии, которые удерживают аммиак и (токсичные соединение для рыбы) начинает отмирать.
Если вы не поддерживаете постоянный уровень рН, то уровень аммиака в вашем аквариуме будет колебаться. Общий аммиак представляет собой комбинацию ионов аммония (NH4 +) и аммиака (NH3). Значение рН используемой воды является одним из основных факторов в относительных концентраций этих двух соединений. Больше аммиака (более токсичный из двух соединений) будет присутствовать в щелочной воде, в то время как больше ионов аммония (менее токсичный из двух соединений) будет присутствовать в кислой воде. В любом случае, после завершения цикла, аммиака не должно оставаться в вашем аквариуме.
Какое pH должно быть в аквариуме?
При рассмотрении вопроса о рН, вы должны знать, какой уровень рН вам нужно будет поддерживать в аквариуме. Например, дискусы любят жить на уровне рН 7,0. Если брать в целом, то это оптимальный уровень рН. Практически вся рыба развивается на постоянном уровне, где-то между 6,6 и 7,4. Для разведения, уровень должен быть рН 6-6,5. Но для примера, лучше стабильное рН 6,6, чем значение рН, которое колеблется между 6,6 и 7,0, даже для той рыбы, которой предпочтительней 7.0.
Каким должен быть уровень pH в аквариуме?
Как проверить рН водопроводной воды?
Многие аквариумисты сразу же тестируют воду из крана на рН. Тем не менее, это не совсем точные показания. Для правильного измерения рН водопроводной воды, нужно налить воду из крана в емкость и поместить туда распылитель, чтобы ее перемешать в течение 24 часов. После этого можно делать измерения. Было бы неплохо, провести второй замер через 48 часов, чтобы увидеть, если есть какие-либо дополнительные изменения. Эти значения, измеренные после 24-48 часов являются точным показателем рН водопроводной воды. Распылитель устанавливается водопроводную воду для того, чтоб ее перемешать и вызывать газообмен на поверхности воды. Этот обмен уменьшает количество углекислого газа в вашей воде и приводит к тому, рН расти. Это рН будет фактически тем, который Вы будете измерять в вашем аквариуме.
Совет: В начале от калибруйте Ваш pH — метр
Многие новички в аквариумистике часто допускают ошибку – покупают тест на pH и сразу делают замер. Если Вы купили контроллер или электронный pH метр – не спешите, откалибруйте его перед использованием. Если калибровочные порошки или растворы не идут в комплектации, необходимо их купить. Запомните, первым шагом является исследование тестового набора, который вы используете, чтобы убедиться, является ли он точным, или нет.
Большинство капельных тестов имеют свою собственную жизнь (обычно 6 месяцев). Если ваш тестовый набор старше срока годности, он может предоставлять неточные результаты.
Как поднять pH в аквариуме?
Есть определенные шаги, которые можно сделать, чтобы поднять уровень рН в аквариуме:
- Подмены. Если вы не меняете воду вашего аквариума, рН в вашем аквариуме будет снижаться. Наиболее эффективный метод, чтобы поднять его обратно до уровня водопроводной воды — делать регулярные подмены. Сифонка грунта также поможет противостоять тенденции рН снижаться с течением времени.
- Камни — Добавьте камни или коряги в аквариуме для повышения рН. Дробленые кораллы используется в качестве подложки в аквариумах со многими африканскими цихлидами (африканские цихлиды предпочитают высокий рН). Известняк и окаменелые кораллы также способствуют поднятию pH.
- Аэрация — Повышение концентрации кислорода в вашей воде будет служить снижению концентрации CO2, понижающим pH. Чем меньше двуокиси углерода – тем выше рН. Таким образом, вы можете увеличить аэрацию в аквариуме для повышения рН.
- Пищевая сода — Добавление соды также повысить рН, но если добавить соду один раз и просто забыть об этом, то результата не будет. Вы должны добавлять соду в вашем аквариуме постоянно. Также нужно быть осторожным, чтобы не добавить слишком много за один раз, т.к. это вызовет всплеск pH и может убить вашу рыбу. Уровень pH должен изменяться постепенно, при чем в любую сторону. Общее правило, 1 растворенная чайная ложка соды на 20 литров воды. Результаты измерять прибором или тестами
Как понизить pH в аквариуме?
Самый простой способ для понижения pH в аквариуме – увеличить концентрацию СO2. Делать это можно разными способами:
- Баллон с углекислым газом. Точная регулировка, простота использования.
- Брага. Дрожжи + сахар + трубка в аквариум. Сложно контролировать подачу и процесс перезапуска.
- Химические (гуглить “Аппарат Киппа”) и электохимические способы(сложны и опасны)